西藏灵菇在制备调节II型糖尿病患者肠道菌群制剂中的应用的制作方法
本发明涉及西藏灵菇在调节肠道菌群中的应用。
背景技术:
西藏灵菇菌粒(tibetankefirgrain)是由多种益生菌经过长期相互作用形成的复杂菌相共生体,将菌粒接种于牛奶后会不断长大形状类似盛开的雪莲花,因此西藏灵菇菌粒又称“西藏雪莲”。19世纪,欧洲医学院教授发现了可反复制备酸奶的西藏灵菇菌粒,菌粒发酵牛奶后的发酵乳被称为西藏灵菇,后由西藏地区传入内地。西藏灵菇与开菲尔类似,但起源不同,其功能也有很大差异。西藏灵菇包括多种益生菌,及乳酸、胞外多糖等多种益生物质。
饮食变化以及久坐不动的生活习惯是近年来糖尿病发病率迅速增长的罪魁祸首,糖尿病已成为第三大威胁人类生命的慢性疾病,预计到2030年中国糖尿病患者将激增4000多万,中国将成为世界糖尿病大国。我国糖尿病患者中ii型糖尿病患者比例达到93.7%,“三多一少”、不同程度的胰岛素抵抗和持续高血糖是ii型糖尿病的主要特征。
糖尿病是一种以患者血糖水平升高为特征的代谢性疾病。它通常是由于胰腺无法生成足量的胰岛素,或是人体细胞对胰岛素不响应所致。糖尿病患者多伴随着恶心、呕吐、腹泻、便秘等肠道失调症状。然而一些对肠道有调节作用的药物会给机体带来损伤,亟需寻求一种对肠道菌群有调节作用而又对机体没有伤害的手段。
技术实现要素:
本发明是要解决现有对肠道有调节作用的药物会给机体带来损伤的问题,提供西藏灵菇在制备调节ii型糖尿病患者肠道菌群制剂中的应用。
西藏灵菇在制备调节ii型糖尿病患者肠道菌群制剂中的应用。
所述西藏灵菇用于降低ii型糖尿病患者肠道厚壁菌门丰度;所述西藏灵菇的培养温度为21℃、25℃或29℃。
所述西藏灵菇用于提高ii型糖尿病动物肠道拟杆菌门丰度;所述西藏灵菇的培养温度为21℃。
所述西藏灵菇用于提高ii型糖尿病动物肠道alistipes丰度;所述西藏灵菇的培养温度为21℃。
所述西藏灵菇用于降低ii型糖尿病动物肠道blautia的丰度;所述西藏灵菇的培养温度为21℃、25℃或29℃。
所述西藏灵菇用于降低ii型糖尿病动物肠道拟杆菌属的丰度;所述西藏灵菇的培养温度为21℃、25℃或29℃。
所述西藏灵菇用于提高ii型糖尿病动物肠道乳酸杆菌属的丰度;所述西藏灵菇的培养温度为21℃、25℃或29℃。
所述西藏灵菇用于提高ii型糖尿病动物肠道菌群的多样性;所述西藏灵菇的培养温度为21℃、25℃或29℃。
本发明的有益效果:
小鼠肠道菌群在门分类水平上主要由厚壁菌门和拟杆菌门组成;在属分类水平上主要由alistipes、blautia、bacteroides和lactobacillus几个属组成。在门分类学水平上ii型糖尿病状态使得厚壁菌门丰度升高拟杆菌门丰度降低;在属分类学水平上糖尿病使得alistipes和lactobacillus丰度降低,使得blautia和bacteroides丰度升高。本发明经过实验验证饲喂西藏灵菇使得ii型糖尿病小鼠肠道菌群中发生变化的菌丰度向正常水平恢复。高通量测序结果表明ii型糖尿病状态使得小鼠肠道菌群多样性降低,饲喂西藏灵菇使得小鼠肠道菌群多样性向正常水平恢复。
进一步的,饲喂西藏灵菇后使得ii型糖尿病小鼠体重减轻、饮食和饮水增加的现象得到一定程度的缓解,西藏灵菇对ii型糖尿病小鼠空腹血糖、胰岛素抵抗症状、小肠内壁绒毛形态、代谢内毒素血症、小鼠全身和肾脏氧化损伤有一定的改善作用。
另外,饲喂西藏灵菇可以提高乙酸、丙酸、丁酸、戊酸、软脂酸、硬脂酸、油酸和亚油酸的含量,能在一定程度上降低ii型糖尿病小鼠降低葡萄糖和果糖的含量,提高半乳糖的含量。
西藏灵菇用于调节ii型糖尿病动物肠道菌群,调节效果显著,对机体没有任何伤害。
附图说明
图1为建模前两组小鼠的eric-pcr指纹图谱;
图2为建模成功后两组小鼠的eric-pcr指纹图谱;
图3为小鼠肠道菌群eric-pcr指纹图谱;
图4为西藏灵菇对肠道菌群门水平的影响;
图5为西藏灵菇对肠道菌群门水平的影响;
图6为西藏灵菇对小鼠体重的影响;
图7为西藏灵菇对小鼠饮食量的影响;
图8为西藏灵菇对小鼠饮水量的影响;
图9为西藏灵菇对空腹血糖的影响;
图10为西藏灵菇对胰岛素的影响;
图11为西藏灵菇对胰岛素抵抗指数的影响;
图12为西藏灵菇对小鼠k-mda的影响;
图13为西藏灵菇对小鼠s-mda的影响;
图14为西藏灵菇对小鼠代谢内毒素血症的影响;
图15为ct小鼠小肠绒毛形态扫描电镜(×100);
图16t2d小鼠小肠绒毛形态扫描电镜(×100);
图17为milk小鼠小肠绒毛形态扫描电镜(×100);
图18为tb21小鼠小肠绒毛形态扫描电镜(×100);
图19为tb25小鼠小肠绒毛形态扫描电镜(×100);
图20为tb29小鼠小肠绒毛形态扫描电镜(×100);
图21为小鼠肠道中乙酸含量变化情况;
图22为小鼠肠道中丙酸含量变化情况;
图23为小鼠肠道中丁酸含量变化情况;
图24为小鼠肠道中戊酸含量变化情况;
图25为小鼠肠道中软脂酸含量变化情况;
图26为小鼠肠道中硬脂酸含量变化情况;
图27为小鼠肠道中油酸含量变化情况;
图28为小鼠肠道中亚油酸含量变化情况;
图29为小鼠肠道中葡萄糖含量变化情况;
图30为小鼠肠道中果糖含量变化情况;
图31为小鼠肠道中半乳糖含量变化情况。
具体实施方式
本发明技术方案不局限于以下所列举具体实施方式,还包括各具体实施方式间的任意组合。
具体实施方式一:本实施方式西藏灵菇在制备调节ii型糖尿病患者肠道菌群制剂中的应用。
具体实施方式二:本实施方式与具体实施方式一不同的是:所述西藏灵菇用于降低ii型糖尿病患者肠道厚壁菌门丰度;所述西藏灵菇的培养温度为21℃、25℃或29℃。其它与具体实施方式一相同。
具体实施方式三:本实施方式与具体实施方式一不同的是:所述西藏灵菇用于提高ii型糖尿病患者肠道拟杆菌门丰度;所述西藏灵菇的培养温度为21℃。其它与具体实施方式一相同。
具体实施方式四:本实施方式与具体实施方式一不同的是:所述西藏灵菇用于提高ii型糖尿病患者肠道alistipes丰度;所述西藏灵菇的培养温度为21℃。其它与具体实施方式一相同。
具体实施方式五:本实施方式与具体实施方式一不同的是:所述西藏灵菇用于降低ii型糖尿病患者肠道blautia的丰度;所述西藏灵菇的培养温度为21℃、25℃或29℃。其它与具体实施方式一相同。
具体实施方式六:本实施方式与具体实施方式一不同的是:所述西藏灵菇用于降低ii型糖尿病患者肠道拟杆菌属的丰度;所述西藏灵菇的培养温度为21℃、25℃或29℃。其它与具体实施方式一相同。
具体实施方式七:本实施方式与具体实施方式一不同的是:所述西藏灵菇用于提高ii型糖尿病患者肠道乳酸杆菌属的丰度;所述西藏灵菇的培养温度为21℃、25℃或29℃。其它与具体实施方式一相同。
具体实施方式八:本实施方式与具体实施方式一不同的是:所述西藏灵菇用于提高ii型糖尿病患者肠道菌群的多样性;所述西藏灵菇的培养温度为21℃、25℃或29℃。其它与具体实施方式一相同。
具体实施方式九:本实施方式西藏灵菇在改善ii型糖尿病患者生化指标中的应用。
具体实施方式十:本实施方式与具体实施方式九不同的是:所述西藏灵菇用于缓解ii型糖尿病患者体重减轻;所述西藏灵菇的培养温度为21℃。其它与具体实施方式九相同。
具体实施方式十一:本实施方式与具体实施方式九不同的是:所述西藏灵菇用于改善ii型糖尿病患者饮食饮水;所述西藏灵菇的培养温度为29℃。其它与具体实施方式九相同。
具体实施方式十二:本实施方式与具体实施方式九不同的是:所述西藏灵菇用于降低ii型糖尿病患者空腹血糖;所述西藏灵菇的培养温度为21℃。其它与具体实施方式九相同。
具体实施方式十三:本实施方式与具体实施方式九不同的是:所述西藏灵菇用于降低ii型糖尿病患者胰岛素抵抗指数;所述西藏灵菇的培养温度为21℃、25℃或29℃。其它与具体实施方式九相同。
具体实施方式十四:本实施方式与具体实施方式九不同的是:所述西藏灵菇用于降低ii型糖尿病患者肾脏氧化损伤程度;所述西藏灵菇的培养温度为21℃、25℃或29℃。其它与具体实施方式九相同。
具体实施方式十五:本实施方式与具体实施方式九不同的是:所述西藏灵菇用于降低ii型糖尿病患者全身氧化损伤程度;所述西藏灵菇的培养温度为21℃、25℃或29℃。其它与具体实施方式九相同。
具体实施方式十六:本实施方式与具体实施方式九不同的是:所述西藏灵菇用于降低ii型糖尿病患者代谢内毒素血症;所述西藏灵菇的培养温度为21℃、25℃或29℃。其它与具体实施方式九相同。
具体实施方式十七:本实施方式与具体实施方式九不同的是:所述西藏灵菇用于改善ii型糖尿病患者小肠绒毛形态;所述西藏灵菇的培养温度为21℃、25℃或29℃。其它与具体实施方式九相同。
具体实施方式十八:本实施方式西藏灵菇在改变ii型糖尿病患者肠道代谢物中的应用。
具体实施方式十九:本实施方式与具体实施方式十八不同的是:所述西藏灵菇用于提高ii型糖尿病患者肠道中乙酸、丙酸和戊酸含量;所述西藏灵菇的培养温度为21℃或29℃。其它与具体实施方式十八相同。
具体实施方式二十:本实施方式与具体实施方式十八不同的是:所述西藏灵菇用于提高ii型糖尿病患者肠道中软脂酸和硬脂酸含量;所述西藏灵菇的培养温度为21℃、25℃或29℃。其它与具体实施方式十八相同。
具体实施方式二十一:本实施方式与具体实施方式十八不同的是:所述西藏灵菇用于提高ii型糖尿病患者肠道中油酸和亚油酸含量;所述西藏灵菇的培养温度为21℃或29℃。其它与具体实施方式十八相同。
具体实施方式二十二:本实施方式与具体实施方式十八不同的是:所述西藏灵菇用于降低ii型糖尿病患者肠道中葡萄糖和果糖的含量;所述西藏灵菇的培养温度为21℃或25℃。其它与具体实施方式十八相同。
具体实施方式二十三:本实施方式与具体实施方式十八不同的是:所述西藏灵菇用于提高ii型糖尿病患者肠道中半乳糖的含量;所述西藏灵菇的培养温度为21℃或29℃。其它与具体实施方式十八相同。
以下实验用于说明本发明,但不用来限制本发明的范围。若未特别指明,实验均按照常规实验条件,或按照制造厂商说明书建议的条件进行。
(一)将西藏灵菇菌粒在不同条件下进行培养
(1)取一定量的西藏灵菇菌粒按10%的接种量接种在完达山纯牛奶中,发酵,将菌粒取出进行传代。
(2)按每份3.0000g称取15份上述活化好的西藏灵菇菌粒做为出发菌株,将他们分别放在15个250ml锥形瓶中,并标注21℃,25℃,29℃,33℃,37℃,且每个温度做三个重复。
(3)将经过上述处理的菌分别置于21℃、25℃、29℃、33℃、37℃下进行发酵,ph达到4后终止发酵,将菌粒放在无菌的滤网上用蒸馏水反复缓慢冲洗直到滤出液中没有乳白色的发酵奶液为止。将经上述处理的菌粒放在滤纸充分吸干水分后称量菌粒湿重记录数据。
(4)发酵ph每达到4时进行一次菌粒湿重测定持续21天,操作步骤与(3)相同。
(二)动物分组与实验
实验小鼠饲养于教育部农业微生物工程中心动物培养室。实验室设施条件及动物日常管理工作依照《中华人民共和国卫生部实验动物环境及设施标准》实施,环境温度为20±2℃,环境相对湿度为45%~65%,自动控制12小时昼夜更替。构建ii型糖尿病小鼠模型,造模成功后的小鼠,随机分为5组,每组12只,分别为糖尿病阳性对照组(t2d)、糖尿病+21℃西藏灵菇(tb21)、糖尿病+25℃西藏灵菇(tb25)、糖尿病+29℃西藏灵菇(tb29)、糖尿病+纯牛奶(milk)和正常阴性对照组(ct)。
各组小鼠按照20ml/kg·d的剂量进行灌胃饲喂:ct组和t2d组小鼠灌胃灭菌的蒸馏水;tb21、tb25和tb29组小鼠分别灌胃21℃、25℃和29℃条件下制备的西藏灵菇;milk组灌胃纯牛奶,连续灌胃8周。
实验一:西藏灵菇对ii型糖尿病小鼠肠道菌群的影响
(一)饮食饮水的测量
每隔24h对各组小鼠的饮食饮水进行测量并记录,连续7天。
(二)粪便样品采集、前处理及粪便微生物总dna的提取
各组小鼠每周固定时间放入代谢笼中采集新鲜粪便,取0.2g粪便样品于标号为1的2ml离心管中,加入1ml灭菌磷酸钠缓冲液(pbs0.1m,ph7.0)悬浮,然后分别用灭菌牙签充分破碎粪便样品。使样本均匀浑浊无较大固体颗粒,破碎后充分漩涡振荡,3000r离心5min后取上清于新的2ml的标为2的离心管中,再向1号离心管中加入800ulpbs,3000r离心5min后取上清到2号离心管中,将2号离心管在12000r下离心5min弃上清,重复上述步骤一次,将两次收集到的沉淀用于提取粪便微生物总dna。
(三)eric-pcr扩增
提取粪便样品肠道菌群总dna,进行eric-pcr扩增。将扩增后的产物进行琼脂糖凝胶电泳。
(四)肠道菌群高通量测序
分别采集每组新鲜粪便样品进行dna提取,检测dna浓度及纯度,确保送样dna质量达到高通量测序要求,放入冻存管经液氮速冻后放入干冰中,样品委托上海生工生物工程公司通过miseqillumina测序平台对肠道菌群16srdna的v3-v4区进行分类测序工作,对各组小鼠肠道菌群的多样性和丰度进行不同生物分类学水平的分析。
(五)数据处理与分析
利用quantityonev4.6.2软件(bio-rad,hercules,ca)将琼脂糖凝胶上的条带数字化并转换为矩阵,利用spss17.0jx聚类分析。
(六)结果与分析
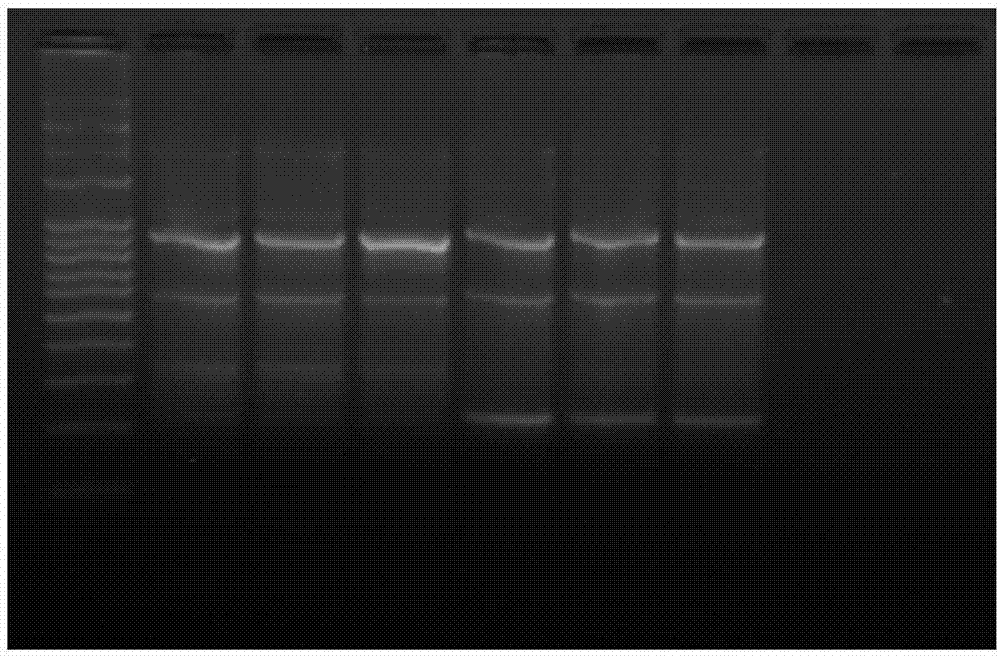
1、肠道菌群eric-pcr指纹图谱分析
以抽提的dna为模版进行eric-pcr扩增,图谱中所显示的条带代表着小鼠肠道菌群的模式,条带位置、明暗变化及数量变化都代表着小鼠粪便样品中肠道菌群的变化。
图1是正常组小鼠和预建模组小鼠肠道菌群eric-pcr指纹图谱,其中从左至右前3个泳道为正常组小鼠,后3个泳道为预建模组小鼠。从图中可以看出两组小鼠条带没有明显差异。200-300bp、600bp和900bp处得条带是两组小鼠间的共有条带,说明正常组小鼠和预建模组小鼠肠道菌群模式在建模前没有差异。
图2是正常组小鼠和ii型糖尿病模型组小鼠的eric-pcr指纹图谱,其中从左至右前3个泳道为正常组小鼠,后3个泳道为模型组小鼠。从图中可以看出两组小鼠条带出现明显差异。300bp、500bp处的条带只出现在正常组小鼠图谱中;而200bp处的条带虽然正常组和模型组小鼠的图谱中都有但模型组小鼠中该条带亮度较亮;说明正常组小鼠和模型组小鼠肠道菌群在建模后出现显著差异。
饲喂西藏灵菇第八周后各组小鼠肠道菌群模式见图3,图3是ct、tb21、tb25、tb29、t2d和milk组小鼠在饲喂西藏灵菇第八周的肠道菌群的eric-pcr指纹图谱,从图中可以看出各组小鼠条带之间出现明显差异。300bp和900bp处条带是各组小鼠肠道内的共有条带;400bp处的条带只出现在ct、tb21和tb25组小鼠的图谱中;而100bp处的条带只出现在milk组小鼠中。ct组和t2d组小鼠肠道菌群图谱模式出现差异;饲喂西藏灵菇后的tb21、tb25和tb29组小鼠肠道菌群图谱条带模式与ct组较为相似,由此可见西藏灵菇饲喂糖尿病小鼠后使得小鼠的肠道菌群图谱模式与正常组相似。
2、肠道菌群结构及丰度分析
eric-pcr技术只能对不同碱基数的片段进行区分由此可能会低估小鼠肠道菌群的多样性。高通量测序技术不仅可以准确的描述肠道菌群的多样性同时也能对肠道菌群的丰度进行定量。
门水平:西藏灵菇对ii型糖尿病小鼠肠道菌群门水平的影响见图4,图4中
ct组厚壁菌门丰度是29.05%,t2d组厚壁菌门丰度是48.18%,ii型糖尿病状态使得厚壁菌门丰度升高;饲喂西藏灵菇后的tb21、tb25和tb29组小鼠肠道中厚壁菌门丰度分别是29.63%、44.08%和26.21%,饲喂西藏灵菇使得ii糖尿病小鼠肠道菌群厚壁菌门丰度向正常水平恢复;饲喂纯牛奶milk组厚壁菌门丰度是41.44%。21℃西藏灵菇对厚壁菌门丰度向正常水平恢复作用较为显著。
ct组拟杆菌门丰度是43.96%,t2d组拟杆菌门丰度是36.76%,与ct组相比ii糖尿病状态使得拟杆菌门丰度降低;饲喂西藏灵菇后的tb21、tb25和tb29组中拟杆菌门的丰度分别是37.01%、30.33%和32.42%;饲喂纯牛奶后milk组中拟杆菌门的丰度是31.92%。由此可见只有21℃的西藏灵菇使得ii糖尿病小鼠肠道中拟杆菌门丰度向正常水平恢复。
属水平:西藏灵菇对ii糖尿病小鼠肠道菌群属水平的影响见图5,
ct组alistipes的丰度是19.33%,t2d组alistipes的丰度是10.72%,与ct组相比ii型糖尿病状态使得该属丰度降低;饲喂西藏灵菇后的tb21、tb25和tb29组小鼠中该属的丰度分别是12.59%、10.49%和8.5%;饲喂纯牛奶的milk组该属的丰度是10.78%。由此可见只有21℃的西藏灵菇使得ii型糖尿病小鼠肠道中alistipes丰度向正常水平恢复。
ct组中blautia丰度是11.83%,t2d组中blautia丰度是24.22%,与ct组相比ii型糖尿病状态使得小鼠肠道中该属丰度升高;饲喂西藏灵菇后的tb21、tb25和tb29组中该属的丰度分别是8.82%、15.37%和6.51%,饲喂西藏灵菇使得该属丰度降低;饲喂纯牛奶的milk组该属丰度是21.18%。由此可见西藏灵菇的饲喂能降低ii型糖尿病小鼠肠道中blautia的丰度。
ct组中拟杆菌属丰度是4.79%,t2d组中拟杆菌属丰度是8.29%,与ct组相比ii型糖尿病状态使得该属丰度升高;饲喂西藏灵菇后的tb21、tb25和tb29组中该属丰度分别是6.85%、2.09%和7.43%;饲喂西藏灵菇使得ii型糖尿病小鼠中该属丰度向正常水平恢复;饲喂纯牛奶后milk组该属丰度是5.1%。由此可见饲喂西藏灵菇能降低ii型糖尿病小鼠肠道中拟杆菌属的丰度。
ct组中乳酸杆菌属丰度是2.83%,t2d组中该属丰度是0.94%,与ct组相比ii型糖尿病状态使得该属丰度降低;饲喂西藏灵菇后的tb21、tb25和tb29组中该属的丰度分别是1.47%、1.52%和3.83%,饲喂西藏灵菇使得该属丰度向正常水平恢复;饲喂纯牛奶后milk组该属的丰度是0.8%,饲喂纯牛奶降低该属的丰度。由此可知29℃的西藏灵菇对乳酸杆菌属的丰度向正常水平恢复的作用较为显著。
3、西藏灵菇对小鼠肠道菌群多样性的影响
西藏灵菇对各组小鼠肠道菌群多样性的影响见表1。各组样品的序列数均超过35000,覆盖度均达到89%,这表明小鼠在绝大多数的肠道菌群均已被测序到。与ct组相比t2d组小鼠肠道菌群多样性降低,ii型糖尿病状态使得小鼠肠道菌群多样性降低;饲喂西藏灵菇后的tb21、tb25和tb29组多样性向正常水平恢复;饲喂纯牛奶后的milk组多样性降低。
表1肠道菌群alpha指数
综上所述,西藏灵菇能够在一定程度使糖尿病小鼠的肠道菌群向正常水平恢复。高通量测序结果表明小鼠肠道菌群在门分类水平上主要由厚壁菌门和拟杆菌门组成;在属分类水平上主要由alistipes、blautia、bacteroides和lactobacillus几个属组成。在门分类学水平上ii型糖尿病状态使得厚壁菌门丰度升高拟杆菌门丰度降低;在属分类学水平上糖尿病使得alistipes和lactobacillus丰度降低,使得blautia和bacteroides丰度升高。饲喂西藏灵菇使得ii型糖尿病小鼠肠道菌群中发生变化的菌丰度向正常水平恢复。高通量测序结果表明ii型糖尿病状态使得小鼠肠道菌群多样性降低,饲喂西藏灵菇使得小鼠肠道菌群多样性向正常水平恢复。
实验二:西藏灵菇对ii型糖尿病小鼠生化指标的影响
(一)小鼠体重测量及精神状态观察
各组小鼠每周测量体重,对小鼠精神状态进行观察,并记录
(二)饮食饮水的测量
每隔24h对各组小鼠饮食饮水进行测量连续7天,并作记录。
(三)血液样本采集及处理
1、样本采集
停止饲喂西藏灵菇当天对各组小鼠进行眼球取血。
2、样本处理
血清收集:室温下血液自然凝固20min,3000r/min离心20min收集上清。
血浆收集:选择医用肝素钠作为抗凝剂,取20ul小鼠血液加入180μl肝素钠生理盐水溶液充分混合20min后,3000r/min离心20min左右仔细收集上清。
3、测定血糖及血清胰岛素
4、胰岛素抵抗指数
根据
5、测定血浆脂多糖、血清丙二醛及肾脏mda
(四)小肠绒毛扫描电镜
取各组小鼠小肠1cm,利用超声波将其肠壁内容物清洗干净。对小鼠小肠进行电镜前处理,用导电胶带黏在扫描电镜样品台上进行扫描。
(五)数据处理与分析
利用orgin7.5对生化数据进行标准差分析;spss17.0软件对生化数据进行单因素方差分析(one-wayanova)。
(六)结果与分析
1、西藏灵菇对ii型糖尿病小鼠体重的影响
ct组、tb21、tb25、tb29、t2d组和milk组小鼠饲喂西藏灵菇后的第一周到第八周体重变化率分别是2.96%,1.85%、0.74%、1.07%,-0.13%,-0.15%。
西藏灵菇对小鼠体重的影响如图6,■表示ct,●表示tb21,▲表示tb25,×表示tb29,+表示t2d,
ii型糖尿病小鼠确实存在体重减轻的现象,饲喂西藏灵菇后使得ii型糖尿病小鼠体重减轻现象得到一定程度的缓解,21℃西藏灵菇对糖尿病小鼠体重减轻现象的缓解作用最明显;饲喂纯牛奶反而恶化这一现象。
2、西藏灵菇饲喂对ii型糖尿病小鼠食物和水摄入量的影响
西藏灵菇对ii型糖尿病小鼠饮食的影响见图7,西藏灵菇对ii型糖尿病小鼠饮水量的影响见图8。与ct组相比,t2d组小鼠饮食和饮水量均显著增加(α﹤0.05),饮食量增加87.48%饮水量约增加5.47倍。与t2d组小鼠相比,饲喂西藏灵菇后的tb21、tb25和tb29组小鼠饮食和饮水量均显著降低,饮食量分别降低44.32%、13.88%和20.56%,饮水量分别降低65.27%、26.11%和52.46%;饲喂纯牛奶后的milk组小鼠饮食和饮水量显著增加,饮食量增加0.12%,饮水量增加1.41%。
西藏灵菇对ii型糖尿病小鼠食物和水摄入显著增加的现象有一定的改善作用,其中29℃的西藏灵菇对ii型糖尿病小鼠饮食饮水的改善作用大;饲喂纯牛奶反而恶化ii型糖尿病小鼠多饮多食的现象。
3、西藏灵菇对ii型糖尿病小鼠空腹血糖、血清胰岛素和胰岛素抵抗指数的影响
西藏灵菇对各组小鼠空腹血糖、血清胰岛素(insulin,ins)含量和胰岛素抵抗指数(insulinresistanceindex,homa-ir)的影响见图9-图11。
与ct组相比,t2d组小鼠空腹血糖显著升高2.26倍。与t2d组小鼠相比,饲喂西藏灵菇后的tb21、tb25和tb29组小鼠空腹血糖显著降低(α﹤0.05),分别降低42.83%、21.84%和23.93%;饲喂纯牛奶的milk组小鼠空腹血糖升高了7.96%。
西藏灵菇对糖尿病小鼠血糖降低有一定的改善作用,其中21℃西藏灵菇对ii型糖尿病小鼠空腹血糖的降低作用较明显;饲喂纯牛奶反而导致血糖升高。
西藏灵菇对各组糖尿病小鼠血清胰岛素含量没有显著作用。
与ct组相比t2d组小鼠的胰岛素抵抗指数显著升高2.24倍。与t2d组小鼠相比,饲喂西藏灵菇后的tb21、tb25和tb29组小鼠的胰岛素抵抗指数显著降低(α﹤0.05),分别降低43.61%、21.44%和26.13%;而饲喂纯牛奶的milk组小鼠胰岛素抵抗指数显著升高了6.83%。
西藏灵菇能在一定程度上缓解ii型糖尿病小鼠胰岛素抵抗症状,其中21℃西藏灵菇对胰岛素抵抗症状的改善作用最明显;饲喂纯牛奶反而恶化这一症状。
4、西藏灵菇对ii型糖尿病小鼠肾脏和全身氧化损伤程度的影响
丙二醛(maloondialdehyde,mda)是一个判定氧化损伤的常用指标,经常被用来判定机体或组织的氧化损伤程度。西藏灵菇对ii型糖尿病小鼠肾脏及全身氧化损伤的影响见图12和图13。
ii型糖尿病状态对小鼠肾脏造成了较为明显的氧化损伤。与ct组相比t2d组小鼠肾脏氧化损伤程度升高了1.28倍。与t2d组小鼠相比,饲喂西藏灵菇后的tb21、tb25和tb29组小鼠肾脏氧化损伤程度分别降低了46.91%、23.74%和36.03%;饲喂纯牛奶后milk组小鼠肾脏氧化损伤程度升高了0.91%。
西藏灵菇能在一定程度上降低ii型糖尿病小鼠肾脏氧化损伤程度,饲喂纯牛奶使得小鼠肾脏氧化损伤程度增加。
ii型糖尿病状态对小鼠全身造成了较为明显的氧化损伤。与ct组相比t2d组小鼠全身氧化损伤程度升高了62.94%。与t2d组小鼠相比,饲喂西藏灵菇后的tb21、tb25和tb29组小鼠全身氧化损伤程度显著降低(α﹤0.05),分别降低了47.29%、31.24%和66.76%;饲喂纯牛奶后milk组小鼠全身氧化损伤程度升高了28.83%。
西藏灵菇能在一定程度上缓解ii型糖尿病小鼠,21℃西藏灵菇对ii型糖尿病小鼠全身氧化损伤程度的改善作用最明显;饲喂纯牛奶反而恶化这一症状。
5、西藏灵菇对ii型糖尿病小鼠代谢内毒素血症的影响
研究发现饲喂高脂膳食的大鼠血浆中脂多糖的含量会升高2-3倍达到一个阈值,此时大鼠出现的现象被称为代谢内毒素血症。脂多糖(lipoopolysaccharide,lps)是革兰氏阴性菌细胞壁的成分之一,ii型糖尿病小鼠体内血浆脂多糖含量代表着代谢内毒素血症。西藏灵菇对各组小鼠血浆脂多糖含量影响见图14。
ii型糖尿病状态使得小鼠代谢内毒素血症升高。与ct组相比t2d组小鼠代谢内毒素血症升高了26.08%;与t2d组小鼠相比,饲喂西藏灵菇后的tb21、tb25和tb29组小鼠代谢内毒素血症显著性降低(α﹤0.05),分别降低了16.53%、7.61%和12.87%;饲喂纯牛奶后的milk组小鼠代谢内毒素血症增加了5.51%。
西藏灵菇能在一定程度上降低ii型糖尿病小鼠的代谢内毒素血症,21℃西藏灵菇对ii型糖尿病小鼠代谢内毒素血症的降低作用最显著;饲喂纯牛奶反而恶化了这一症状。
6、西藏灵菇对ii型糖尿病相小鼠小肠绒毛形态的影响
西藏灵菇对ii型糖尿病小鼠小肠绒毛形态的影响见图15-图20。ii型糖尿病状态使得小鼠小肠绒毛排列不规则并出现萎缩现象。正常组小鼠回肠绒毛排列整齐、规则、形状和大小一致,未见萎缩、塌陷和坏死(如图15);ii型糖尿病组小鼠回肠绒毛排列不规则、绒毛间的差异较大、伴随萎缩、塌陷的现象(如图16);饲喂纯牛奶的milk组小鼠回肠绒毛呈极度不规则排列、并出现严重的萎缩现象(如图17);饲喂西藏灵菇的tb21、tb25和tb29组小鼠回肠绒毛排列整、规则、形状和大小较为均一、塌陷和萎缩症状得到一定程度的缓解(如图18、图19和图20)。
西藏灵菇能在一定程度上改善ii型糖尿病小鼠小肠绒毛形态,其中21℃西藏灵菇对ii型糖尿病小鼠小肠绒毛形态的改善作用最显著;饲喂纯牛奶反而恶化了这一现象。
综上所述,与ct组小鼠相比t2d组小鼠出现了体重减轻、饮食饮水增多的现象;同时血糖显著升高并出现较为明显的胰岛素抵抗症状;ii型糖尿病小鼠全身和肾脏氧化损伤程度也较为明显;ii型糖尿病小鼠出现肠代谢内毒素血症的同时小鼠小肠绒毛排列不规则并出现较为严重的萎缩现象。
饲喂西藏灵菇后使得ii型糖尿病小鼠体重减轻、饮食和饮水增加的现象得到一定程度的缓解,其中21℃西藏灵菇对ii型糖尿病小鼠体重减轻现象的缓解作用最明显,29℃西藏灵菇对ii型糖尿病小鼠饮食饮水的改善作用较明显;饲喂纯牛奶反而恶化了这一现象。
西藏灵菇对ii型糖尿病小鼠空腹血糖和胰岛素抵抗症状有一定的改善作用,其中21℃西藏灵菇对ii型糖尿病小鼠的空腹血糖和胰岛素抵抗症状的改善作用较为显著;饲喂纯牛奶反而造成了空腹血糖升高和胰岛素抵抗症状的恶化。
西藏灵菇对ii型糖尿病小鼠全身和肾脏氧化损伤有一定的改善作用其中对全身氧化损伤的改善作用较显著,饲喂纯牛奶反而使得小鼠氧化损伤程度增加。
西藏灵菇使ii型糖尿病小鼠的代谢内毒素血症显著降低,21℃西藏灵菇对ii型糖尿病小鼠代谢内毒素血症的改善作用最显著;饲喂纯牛奶反反而恶化了代谢内毒素血症。
西藏灵菇对ii型糖尿病小鼠小肠内壁绒毛形态有改善作用,饲喂纯牛奶造成了ii型糖尿病小鼠小肠内壁绒毛形态更为严重的塌陷和萎缩。
实验三、西藏灵菇对糖尿病小鼠肠道代谢物的影响
(一)粪便样品前处理
取-80℃保存的粪便200mg于2ml离心管中加入超纯水1000μl粪便,匀浆5min,13000r/min离心10min。取400μl上清液于另一2ml离心管中,作为第一步提取液弃去剩余的上清液。在粪便沉淀物中再加入1000μl甲醇,匀浆5min,13000r/min离心10min。取400μl上清液作为第二步提取液与第一步提取液混合,振荡30s。
(二)样品衍生化
取400μl上述混合液于2ml离心管中,加入1mg/ml十七酸甲醇溶液200μl(内标),真空冷冻干燥。干燥后加入甲氧胺盐酸盐吡啶溶液200μl密封后振荡30s,放置于30℃的摇床中反应90min。反应结束后于离心管中加入80μlbsfta(含1%tmcs)密封后,振荡30s,放置于70℃摇床中反应60min。反应结束后振荡10s。10000r/min离心10min取上清于样品瓶中,加入600μl乙腈,室温下放置1h后,进样分析。
(三)gc-ms运行条件
色谱条件:气相色谱柱型号为db-5m(19091s433:30m×0.25mm×0.25μm)色谱柱长度30cm;进样口温度270℃,流速为1ml/min,载气为99.999%的高纯氦气;采用不分流进样;进样量为1μl。色谱柱程序升温条件见表2。
表2gc升温程序
质谱条件为:质谱离子源电压为70ev,离子阱温度220℃、传输线温度280℃,电子倍增器电压为100mv,数据采集扫描模式为全扫描,采集范围是50~550m/z,溶剂延迟时间为5min。
(四)数据处理
小鼠肠道代谢物的定性分析,采用将样本中的组成成分与nist08标准数据库进行对比。定量分析,以内标物十七酸的量通过峰面积的壁纸来确定其他物质的含量。数据统计学分析均采用spss17.0软件进行,绘图采用origin7.5进行。
(五)结果与分析
1、ii型糖尿病小鼠肠道代谢物物质鉴定
取各组小鼠的粪便样本gc-ms分析的总离子流图,总离子流图通过计算机与nist08数据库进行对比,人工图谱解析、筛选,最终确定小鼠肠道代谢物的组成。
对各组小鼠粪便样本中物质经分析确定,主要为氨基酸类、短链脂肪酸类、糖类、糖酸类和长链脂肪酸类等化合物。其中氨基酸类主要有丙氨酸、亮氨酸、缬氨酸、丝氨酸、甘氨酸、苏氨酸、天门冬氨酸、脯氨酸等;短链脂肪酸类主要有乙酸、丙酸、丁酸等;糖类物质主要有葡萄糖、果糖、甘露糖、核糖、阿拉伯糖、来苏糖、半乳糖、塔罗糖等;糖酸类主要有葡萄糖酸、葡萄糖醛酸、半乳糖酸等;长链脂肪酸类主要有软脂酸、硬脂酸等。
2、ii型糖尿病小鼠肠道代谢物的变化
(1)脂肪酸类物质
①短链脂肪酸类物质
将gc-ms分析所得数据经加入十七酸作为内标物相对定量后,绘制了各组小鼠肠道代谢物短链脂肪酸变化图。
乙酸含量变化见图21,肠道代谢物中各组小鼠乙酸含量各组间略有差异,但构不成统计学上的显著水平(α﹤0.05)。与ct组相比t2d组乙酸含量降低;与t2d组相比饲喂21℃和29℃西藏灵菇小鼠乙酸含量升高尤其是tb29组乙酸含量基本恢复到与ct组相同的含量,饲喂25℃西藏灵菇的小鼠乙酸含量没有变化;饲喂纯牛奶的milk组小鼠肠道中乙酸含量降低。
丙酸含量变化见图22,肠道代谢物中各组小鼠丙酸含量有显著差异(α﹤0.05)。与ct组相比t2d组丙酸含量显著降低;与t2d组相比饲喂21℃和29℃西藏灵菇的小鼠丙酸含量升高尤其是tb29组丙酸含量显著升高,饲喂25℃西藏灵菇小鼠丙酸含量没有变化;饲喂纯牛奶的milk组小鼠肠道中丙酸含量降低。
丁酸含量变化见图23,可以看出,肠道代谢物中各组小鼠丁酸含量有显著差异(α﹤0.05)。与ct组相比t2d组小鼠肠道内丁酸含量显著降低;与t2d组相比饲喂三种不同温度下制备的西藏灵菇后的小鼠丁酸含量升高;饲喂纯牛奶的milk组小鼠肠道中丁酸含量降低。
戊酸含量变化见图24可以看出,肠道代谢物中各组小鼠戊酸含量有显著差异(α﹤0.05)。与ct组相比t2d组小鼠肠道内戊酸含量显著降低;与t2d组相比饲喂21℃和29℃西藏灵菇的小鼠戊酸含量升高尤其是tb21组丙酸含量升高明显,饲喂25℃西藏灵菇的小鼠戊酸含量基本没有变化;饲喂纯牛奶的milk组小鼠肠道戊酸含量降低。
t2d组小鼠肠道内的乙酸、丙酸、丁酸和戊酸含量低于ct组小鼠。饲喂21℃和29℃的西藏灵菇后的小鼠肠道内的乙酸、丙酸和戊酸含量升高而饲喂25℃的西藏灵菇对这几种物质含量基本没有影响;饲喂三种温度下制备的西藏灵菇后小鼠肠道内的丁酸含量均升高。
②长链脂肪酸类物质
肠道代谢物中的长链脂肪酸包括软脂酸、硬脂酸、油酸和亚油酸等中长链不饱和与饱和脂肪酸等。各组小鼠肠道代谢物长链脂肪酸含量变化见图5-2。
软脂酸和硬脂酸含量变化见图25和26,肠道代谢物中各组小鼠长链脂肪酸的含量有显著差异(α﹤0.05)。与ct组相比t2d组软脂酸和硬脂酸含量显著降低;与t2d组相比饲喂三种不同温度下制备的西藏灵菇小鼠软脂酸和硬脂酸含量升高尤其是tb21组含量升高明显;饲喂纯牛奶milk组小鼠软脂酸含量变化不明显。
油酸酸和亚油酸含量变化见图27和28,肠道代谢物中各组小鼠油酸和亚油酸含量有显著差异(α﹤0.05)。与ct组相比t2d组油酸和亚油酸含量显著降低;与t2d组相比饲喂21℃和29℃西藏灵菇的小鼠油酸和亚油酸含量升高尤其是tb21组含量升高明显,饲喂25℃西藏灵菇的小鼠油酸和亚油酸含量基本没有变化;饲喂纯牛奶milk组小鼠油酸含量变化不明显亚油酸含量有所升高。
t2d组小鼠软脂酸、硬脂酸、油酸和亚油酸代谢物的含量均显著低于ct组小鼠。饲喂三种不同温度下制备的西藏灵菇的tb21、tb25和tb29组软脂酸和硬脂酸含量升高;饲喂21℃和29℃西藏灵菇后的tb21和tb29组油酸和亚油酸含量升高而饲喂25℃的西藏灵菇对这两种物质含量基本没有影响。
综上,饲喂西藏灵菇可以提高乙酸、丙酸、丁酸、戊酸、软脂酸、硬脂酸、油酸和亚油酸的含量。
(2)糖类物质
本实验发现在小鼠肠道代谢物中含有大量的糖类物质,主要有葡萄糖、果糖、半乳糖、松二糖、核糖、木糖、麦芽糖、甘露糖、塔罗糖等26种糖类物质。
葡萄糖、果糖和半乳糖的含量变化见图29至图31。
t2d组小鼠葡萄糖代谢物含量低于ct组小鼠。饲喂三种不同温度下制备的西藏灵菇小鼠葡萄糖含量均低于t2d组。
各组小鼠果糖含量略有差异,但统计学上差异不显著水平(α﹤0.05),与ct组相比t2d组果糖含量升高;与t2d组相比饲喂21℃和25℃西藏灵菇小鼠果糖含量降低,饲喂29℃西藏灵菇小鼠葡萄糖含量高于t2d组;饲喂纯牛奶milk组小鼠肠道中果糖含量低于t2d组。
t2d组小鼠半乳糖代谢物含量低于ct组小鼠。半乳糖含量各组间有显著差异(α﹤0.05)。与ct组相比t2d组半乳糖糖含量显著降低;与t2d组相比饲喂21℃和29℃西藏灵菇小鼠半乳糖含量升高,饲喂25℃西藏灵菇的小鼠半乳糖含量没有变化;饲喂纯牛奶milk组小鼠半乳糖含量低于t2d组。
综上,饲喂西藏灵菇能在一定程度上降低ii型糖尿病小鼠葡萄糖和果糖的含量,提高半乳糖的含量。
- 还没有人留言评论。精彩留言会获得点赞!