一种美洲大蠊提取物、制备方法及其在免疫调节中的应用与流程
本发明涉及一种美洲大蠊提取物及其新应用,具体涉及一种美洲大蠊的水提醇沉提取物及其在免疫调节中的应用。
背景技术:
美洲大蠊(periplanetaamericanalinn.)俗称蟑螂,为昆虫纲有翅亚纲蜚蠊目蜚蠊科大蠊属昆虫。美洲大蠊入药始载于《神农本草经》,其中把它列为中品,谓“味:咸、寒;治:血瘀症坚寒热、破积聚、喉咽闭、内寒无子”(孙星衍等,《神农本草经》,商务印书馆,1955:90)。“蟑螂”为其俗名首见于《本草纲目拾遗》,也称其为石姜、滑虫;各地方有其不同的称法,如:偷油婆、茶婆子、灶蚂子等。蜚蠊科(blattidae)是一个庞大的昆虫家族,在地球上已生存了3.2亿年,与恐龙属同一时代出现的生物;无疑它是世界上生命力最强、最古老、至今繁衍最成功的昆虫类群之一。蟑螂作为害虫是城市卫生防疫部门和海关检疫部门重点防治对象之一。然而,在科技日新月异的今天,面对上千种针对它的各种杀灭剂,这一昆虫群体依然十分活跃,这表明其体内具有某些特殊的物质和其特有的作用机制,此引起了国内外一些学者的关注。
目前国内已批准上市的美洲大蠊制剂主要有“康复新”、“心脉隆注射液”、“肝龙注射液”等,主要用于治疗胃溃疡、宫颈糜烂、溃疡性结肠炎、慢性充血性心力衰竭、慢性乙型肝炎等。在对美洲大蠊的后续研究中发现:用醇水混合溶剂提取美洲大蠊虫体具有体外抗单纯疱疹病毒的功效(中国发明专利zl200810060885.9);用滤孔小于5000道尔顿(即<5kda)的超滤膜进行分离,能得到新的抗单纯疱疹病毒和广谱抗菌活性部位(中国发明专利zl201210137422.4,中国发明专利zl201210137410.1)。
技术实现要素:
本发明的一个目的在于提供一种美洲大蠊提取物的制备方法,及由该方法制备得到的美洲大蠊提取物。
本发明的另外一个目的在于提供上述美洲大蠊提取物在免疫调节中的应用。
本发明的再一个目的是提供一种含有上述美洲大蠊提取物的免疫调节剂。
本发明的技术方案如下:
一种美洲大蠊提取物的制备方法,包括以下步骤:
(1)将美洲大蠊干料与水混合浸泡,将浸泡后得到的混合物在75~95℃下回流提取,收集提取液,将所述提取液过滤浓缩至65℃下相对密度为1.10~1.20,得到美洲大蠊水提物;
(2)将所述步骤(1)得到的美洲大蠊水提物与乙醇混合,调节含醇量至60%~85%,搅拌静置后,过滤,将得到的滤液浓缩至65℃下的相对密度为1.05~1.10;弃去上层油脂,将下层溶液过滤,得到的滤液减压浓缩至干,得到美洲大蠊提取物。
进一步优选的,所述美洲大蠊干料为粉末状。
更进一步优选的,所述美洲大蠊干料与水的质量比为1:8~12。
进一步优选的,所述回流提取的次数为1~4次,每次提取的时间为1~5小时。
进一步优选的,所述上层油脂经冷藏后除去。
本发明还包括上述方法制备得到的美洲大蠊提取物。
本发明还提供了美洲大蠊提取物在制备具有调节免疫作用的食品或药品中的应用,所述美洲大蠊提取物为美洲大蠊经水提醇沉后的产物。进一步的,所述美洲大蠊提取物由上述方法制备得到。
本发明还提供了一种免疫调节剂,所述免疫调节剂包括上述有效量的美洲大蠊提取物和可食用辅料。
优选的,所述美洲大蠊提取物占所述免疫调节剂的质量百分含量为0.01~99.9%。
与现有技术相比,本发明具有以下优点:
本发明的美洲大蠊提取物通过对美洲大蠊先用水进行浸泡、回流提取,将提取液浓缩得到美洲大蠊水提物;再将美洲大蠊水提物醇沉,弃去油脂后,将溶液过滤浓缩,得到美洲大蠊提取物。本发明的方法制备得到的美洲大蠊提取物产品收率、生物活性都得到了较大的提高,且便于操作、易于大规模生产操作。
本发明通过对美洲大蠊提取物进行研究发现,制备得到的美洲大蠊提取物具有意想不到的免疫调节功能,并经实验证实其可应用于制备免疫调节剂。
附图说明
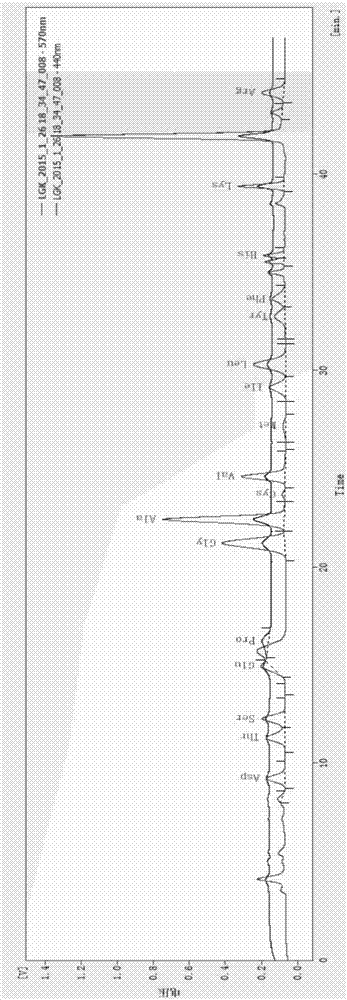
图1为本发明美洲大蠊提取物ento-pa的全自动氨基酸分析色谱图;
图2为药典方法制备的美洲大蠊浸出物的全自动氨基酸分析色谱图。
具体实施方式
本发明提供了一种具有免疫调节作用的美洲大蠊提取物,所述美洲大蠊提取物为美洲大蠊的水提醇沉的产物。
具体地,美洲大蠊提取物的制备方法包括以下步骤:先将美洲大蠊与水混合浸泡、回流提取制备美洲大蠊水提物,再将得到的美洲大蠊水提物进行醇沉,浓缩后弃去油脂,得到的溶液过滤后浓缩,得到美洲大蠊提取物。
本发明中,所用的美洲大蠊为干燥的美洲大蠊药材。本发明对美洲大蠊的来源没有限定,可以采用市售产品。本发明可以直接对美洲大蠊进行水提,也可以先将美洲大蠊进行粉碎,将粉粹得到的美洲大蠊粉末用水进行提取。本发明对美洲大蠊粉末的粒度没有限定,粒度越小越有利于美洲大蠊体内有效物质的溶出,本领域技术人员可以根据常规粉碎的程度制备得到美洲大蠊粉末。
本发明中,将美洲大蠊或其粉末在水中混合浸泡,优选浸泡过夜,使美洲大蠊充分地与水混合,以利于提高美洲大蠊体内的有效物质在水中的溶出率。本发明中,优选美洲大蠊或其粉末与水按照质量比1:8~12进行混合,更优选为1:9~11。
将浸泡后的美洲大蠊进行回流提取,收集提取液。本发明中,回流提取的温度为75~95℃,优选为80~90℃。本发明中,优选对美洲大蠊水混合液进行重复回流提取,回流提取的次数优选为1~4次,更优选为2~3次。每次提取的时间优选为1~5小时,更优选为2~4小时。
将回流提取收集的提取液过滤浓缩至65℃下相对密度为1.10~1.20,得到美洲大蠊水提物。本发明对过滤及浓缩的方法没有特殊限定,采用本领域中的常规过滤及浓缩方法即可。
将得到的美洲大蠊水提物进行醇沉。本发明中,所述美洲大蠊提取物与乙醇混合后,混合物的醇含量优选为60%~85%,更优选为70%。本发明中,优选所用乙醇的体积浓度为95%的高含量乙醇。
所述醇沉后,本发明将醇沉产物进行浓缩,至浓缩物至65℃下的相对密度为1.05~1.10。采用本领域常规的浓缩方法即可。
本发明优选将浓缩物经冷藏后除去上层油脂。冷藏是为了尽量除去油脂及浓缩后产生的沉淀物质,进一步精制了样品,相较于直接将油脂倾出,本发明去除冷凝后的脂肪层更便于操作、易于大规模生产操作。
将除去油脂后得到的下层溶液过滤后,将得到的滤液减压浓缩至干,得到美洲大蠊提取物。本发明中,减压浓缩的压力优选为-0.05~-0.2pa,更优选为-0.075pa。
本发明发现制备得到的美洲大蠊提取物具有免疫增强作用,可以进一步开发成为安全有效的免疫调节剂。
本发明的免疫调节剂中含有上述方法制备得到的美洲大蠊提取物。优选的,所述美洲大蠊提取物占所述免疫调节剂的质量百分含量为0.01~99.9%,更优选为1~99%,进一步优选为5~90%。本发明的免疫调节剂除了含有美洲大蠊水提醇沉提取物外,还包括药学上可接受的辅料或辅助成分。本发明对辅助成分的种类和比例没有特殊限定,采用本领域的常规方法即可。
为使本发明的目的、技术方案和优点更加清楚明白,下面结合实施例对本发明进行详细的说明,但是不能把它们理解为对本发明保护范围的限定。
在本发明具体实施例中,所述美洲大蠊提取物记为ento-pa。
实施例1
美洲大蠊药材5公斤粉碎,加水40~60升,室温浸泡过夜,然后在95℃下回流提取3次,每次3小时。收集提取液,过滤、浓缩至相对密度为1.10~1.20(65℃)。加入95%乙醇,调节含醇量至70%,搅拌30分钟,静置48小时,过滤、回收乙醇,浓缩至相对密度为1.05~1.10(65℃),冷藏库放置24h,弃去上层油脂,下层溶液过滤,滤液减压浓缩至干,即得ento-pa。
表1不同物料比下美洲大蠊提取物的收率及活性指标评价
根据表1结果,药材和水的重量体积比为1:8时,溶血素生成(有效部位活性评价指标)值最高,但干膏收率(产率评价指标)偏低;而药材和水的重量体积比为1:10、1:12时,产品收率和溶血素生成值两个指标的数值接近。考虑大规模产业化的成本控制,优选1:10的比例,进行下一步的提取工艺优化。
实施例2
美洲大蠊药材5公斤,粉碎,加水50升,室温浸泡过夜,在75~95℃下回流提取3次,每次3小时。收集提取液,过滤、浓缩至相对密度为1.10~1.20。加入95%乙醇,调节含醇量至70%,搅拌30分钟,静置48小时,过滤、回收乙醇,浓缩至相对密度为1.05~1.10,冷藏库放置24h,弃去上层油脂,下层溶液过滤,滤液减压浓缩至干,即得ento-pa。
表2不同提取温度下美洲大蠊提取物的收率及活性指标评价
根据表2结果可知,回流提取时的温度对提取物的活性影响不大,但温度越高、收率越高。
实施例3
美洲大蠊药材5公斤,粉碎,加水50升,室温浸泡过夜,在95℃下回流提取3次,每次1-3小时。收集提取液,过滤、浓缩至相对密度为1.10~1.20。加入95%乙醇,调节含醇量至70%,搅拌30分钟,静置48小时,过滤、回收乙醇,浓缩至相对密度为1.05~1.10,冷藏库放置24h,弃去上层油脂,下层溶液过滤,滤液减压浓缩至干,真空干燥,即得ento-pa。
表3不同提取时间下美洲大蠊提取物的收率及活性指标评价
根据表3结果可知,回流提取的提取时间对提取物的活性影响不大,但提取时间越长、收率越高。
实施例4
美洲大蠊药材5公斤,粉碎,加水50升,室温浸泡过夜,在95℃下回流提取3次,每次3小时。收集提取液,过滤、浓缩至相对密度为1.10~1.20。加入95%乙醇,调节含醇量至50%-70%,搅拌30分钟,静置48小时,过滤、回收乙醇,浓缩至相对密度为1.05~1.10,冷藏库放置24h,弃去上层油脂,下层溶液过滤,滤液减压浓缩至干,真空干燥,即得ento-pa。
表4不同提取时间下美洲大蠊提取物的收率及活性指标评价
根据表4结果可知,醇沉时的含醇量对干膏收率影响不大,但含醇量越高、提取物的活性越高。
实施例5
对实施例1~4制备得到的美洲大蠊提取物进行氨基酸含量检测
1仪器、材料与试剂:
s433-d氨基酸分析仪;
色谱条件:lcak06/na(水解氨基酸分析柱)
柱温:55℃~75℃梯度控温
洗脱泵:0.45ml/min;衍生泵:0.25ml/min
检测器:440nm/570nm双波长检测器;反应器温度:130℃;进样体积:50μl
供试品:实施例1~4制备得到的美洲大蠊提取物ento-pa。
2供试品溶液制备:精密称取ento-pa17.8mg,分别置于1.5ml的离心管中,加一定量超纯水,涡旋30s混匀,53khz超声使之充分溶解后放冷,定容至1ml,在离心机上10,000rpm/min,离心5min,取上清液即得供试品溶液。
4测定方法:分别取供样品溶液50μl,注入全自动氨基酸分析仪,按上述条件进样,记录色谱图。
美洲大蠊提取物ento-pa的全自动氨基酸分析色谱图见图1,具体结果见表5。
表5美洲大蠊提取物ento-pa中的氨基酸种类及含量
对比例
按照药典方法制备得到的美洲大蠊浸出物进行氨基酸含量检测
美洲大蠊浸出物制备(药典方法):取美洲大蠊干料2-4g,精密称定,置100-250ml的锥形瓶中,精密加水50-100ml,密塞,称定重量,静置1h后,连接回流冷流管,加热至沸腾,并保持微沸1h。放冷后,取下锥形瓶,密塞,再称定重量,用水补足损失的重量,摇匀,用干燥器滤过,滤液浓缩即为美洲大蠊浸出物。
检测方法同实施例5的检测方法。
按照药典方法制备的美洲大蠊浸出物的全自动氨基酸分析色谱图见图2,具体结果见表6。
表6美洲大蠊浸出物中的氨基酸种类及含量
在氨基酸分类中苏氨酸(thr)、缬氨酸(val)、蛋氨酸(met)、异亮氨酸(ile)、亮氨酸(leu)、苯丙氨酸(phe)、赖氨酸(lys)、色氨酸(trp)为人体必需氨基酸,精氨酸(arg)和组氨酸(his)为半必需氨基酸,天门冬氨酸(asp)、谷氨酸(glu)、甘氨酸(gly)、蛋氨酸(met)、异亮氨酸(ile)、亮氨酸(leu)、苯丙氨酸(phe)、赖氨酸(lys)、精氨酸(arg)为药效氨基酸。
由表5和表6可以看出,除色氨酸因水解损失无法检出、美洲大蠊提取物ento-pa的缬氨酸因含量较低而未计入含量分析外,ento-pa所含的必需氨基酸、半必需氨基酸、药效氨基酸的含量都高于以浸出物反应的美洲大蠊全虫的各种氨基酸含量。美洲大蠊提取物ento-pa的总游离氨基酸含量为
32.62%,按照药典方法提取出的美洲大蠊浸出物的总游离氨基酸含量为
9.32%,低于本申请的ento-pa。说明,按本申请公开的制备方法能有效富集美洲大蠊中的氨基酸成分。
实施例6
本发明美洲大蠊提取物ento-pa对免疫抑制小鼠免疫功能的影响
1实验材料
1.1实验仪器
gen5型酶标分析仪(基因有限公司);
xfa6000全自动动物血细胞分析仪(南京普朗医疗设备有限公司);
t6新世纪紫外可见分光光度计(北京普析通用有限公司);
5510型co2培养箱(美国nuaire公司);
ckx41型倒置显微镜(奥林巴斯有限公司);
sw-cj-2fd双人单面净化工作台(苏州净化设备有限公司)。
1.2实验动物
spf级昆明小鼠60只,雌雄各半,6-8周龄,体重(20±2)g,由湖南景莱克景达实验动物有限公司提供,许可证号:scxk(湘)2013-0004。
1.3实验试剂
都氏试剂(sigma公司,6vl,批号:slbq0489v);rpmi-1640(gibco公司,lot:1663939);mtt(solarbio公司,250mg,lot:no.303h0532);胎牛血清(gibco公司,lot:1618862);二甲基亚砜(dmso,solarbio公司,100ml,lot:no.302a0325);cona(sigma公司,lot:slbn5209v);pbs(solarbio公司,lot:11310220);中性红(solarbio公司,lot:20160912);小鼠淋巴细胞分离液(深圳市达科为生物工程有限公司,批号:dkw33-r0100);豚鼠血清、绵羊血(由大理大学动物实验中心提供)。
1.4实验药品
本发明美洲大蠊提取物ento-pa;
黄芪多糖注射液(河南复兴动物药业有限公司,批号:20160624);
注射用环磷酰胺(江苏盛迪医药有限公司,0.2g,批号:16070425)。
2实验方法
2.1分组及给药
将60只昆明小鼠,随机分为6组:空白对照组,模型对照组,阳性药组(黄芪多糖注射液,160mg·kg-1),ento-pa高、中、低剂量组(400、200、100mg·kg-1)。除空白对照组腹腔注射生理盐水,其余各组于给药前连续腹腔注射80mg·kg-1的环磷酰胺3d,复制小鼠免疫抑制模型;空白对照组和模型对照组灌胃给予等量生理盐水,其余各组给予相应剂量药物10d;各组均于给药第1、3、5d注射20%的绵羊红细胞(srbc)0.2ml致敏;并于造模小鼠于给药第7d注射100mg·kg-1环磷酰胺1次用于加强免疫,空白对照组按相同操作注射生理盐水。
2.2外周血细胞测定
末次给药后1h,小鼠摘眼球取血,取20μl全血放入预稀释液中,用动物血细胞分析仪以预稀释模式测定外周血细胞。
2.3溶血素含量测定
末次给药后1h,小鼠摘眼球取血,2000rpm离心10min,取血清,于56℃水浴30min以灭活补体,对血清溶血素效价进行滴定。取血清稀释相应倍数,置于ep管内,再加入0.5ml5%的绵羊红细胞,1.0ml稀释的豚鼠血清,空白对照管内用生理盐水代替小鼠血清。将所有试管于37℃水浴锅中恒温10min,取出放入冰浴中终止反应;2000rpm离心10min,取上清液1.0ml,加都氏试剂3.0ml于管内;同时取5%绵羊红细胞0.25ml,都氏试剂4.0ml于另一支试管内充分摇匀,放置10min,以对照管做空白,于540nm波长下,分别测量吸光度值,计算半数溶血值。
半数溶血值公式为:hc50=(样品吸光度值/srbc半数溶血时的吸光度)×稀释倍数。
2.4吞噬指数的测定
于末次给药后1h颈椎脱臼处死小鼠,放入75%的酒精中浸泡3min,腹腔注入4ml无菌pbs缓冲液(含10%胎牛血清),2ml空气,轻揉腹部3min,无菌条件下打开腹腔,吸取腹腔液于离心管中,1200rpm离心5min,弃上清液收集巨噬细胞,pbs洗涤细胞两次,用含10%胎牛血清的1640培养液调整细胞密度至5×106个·ml-1,以每孔100μl接种于96孔板,置5%co2,37℃培养,3h后用pbs洗去未贴壁细胞,加入0.1%的中性红溶液200μl,孵育3h。弃上清,洗涤细胞3次,每孔加入200μl细胞溶解液(乙醇、乙酸等体积混合),4℃静置过夜,于520nm波长下测定od值,并计算吞噬率(%)=实验组od值/对照组od值×100。
2.5脏器指数的影响
取出小鼠脾脏和胸腺,去除脂肪和筋膜组织,称取重量,计算脏器指数。脏器指数=脏器质量(mg)/小鼠体重(g)。
2.6脾t淋巴细胞增殖试验
取出小鼠的脾脏,制备脾脏细胞悬液,用淋巴细胞分离液分离脾淋巴细胞,用培养基调整细胞浓度至5×106个·ml-1,加入100μl细胞悬液到96孔板中,并加入cona(终浓度为10μg·ml-1)刺激。置于37℃,5%co2培养箱中培养68h。每孔加20μlmtt(5mg·l-1),继续培养4h后,移去微孔中所有液体,再加入150μldmso终止反应,振荡10min,酶标仪检测570nm处od值。
3结果
3.1美洲大蠊提取物ento-pa对小鼠免疫器官脏器指数的影响
注射环磷酰胺后,与空白对照组比较,模型对照组的脾脏指数、胸腺指数显著降低(p<0.01),提示造模成功;与模型对照组比较,各给药组脾脏指数和胸腺指数均有所增加;ento-pa高、中、低剂量组脾脏指数明显增加(p<0.01)并呈良好剂量依赖性,胸腺指数呈剂量依赖性上升趋势,其中高剂量组增加明显(p<0.01);结果详见表7。
表7美洲大蠊提取物ento-pa对小鼠免疫器官指数的影响(
注:与正常组比较,*p<0.05,**p<0.01;与模型组比较,△p<0.05,△△p<0.01;与阳性药组比较,▲p<0.05,▲▲p<0.01。
3.2美洲大蠊提取物ento-pa对免疫低下小鼠外周血细胞的影响
注射环磷酰胺后,与空白对照组比较,模型对照组的wbc、rbc、plt、hgb水平均显著降低(p<0.01);经药物治疗后,与模型对照组比较,各给药组外周血细胞水平均有所升高;ento-pa各组呈一定剂量依赖性,其中wbc、plt和hgb均已升高或超过正常水平,与空白对照组比较无统计学差异(p>0.05);结果详见表8。
表8美洲大蠊提取物ento-pa对免疫抑制小鼠外周血细胞的影响(
注:与正常组比较,*p<0.05,**p<0.01;与模型组比较,△p<0.05,△△p<0.01;与阳性药组比较,▲p<0.05,▲▲p<0.01。
3.3美洲大蠊提取物ento-pa对腹腔巨噬细胞吞噬作用的影响
模型对照组吞噬能力和吞噬率较正常对照组显著降低(p<0.01);与模型对照组比较,各给药组吞噬能力和吞噬率均显著提高(p<0.01);ento-pa各剂量组吞噬能力和吞噬率呈良好的剂量依赖性,其中高剂量组与阳性药黄芪多糖作用相当(p>0.05);结果详见表9。
表9美洲大蠊提取物ento-pa对腹腔巨噬细胞吞噬作用的影响(
注:与正常组比较,*p<0.05,**p<0.01;与模型组比较,△p<0.05,△△p<0.01;与阳性药组比较,▲p<0.05,▲▲p<0.01。
3.4美洲大蠊提取物ento-pa对血清溶血素含量的影响
模型对照组溶血素生成水平(hc50)较空白对照组显著降低(p<0.01),说明成功构建免疫抑制模型。与模型对照组比较,各给药组溶血素生成水平均显著增强(p<0.01);与黄芪多糖组比较,ento-pa高、中剂量组溶血素生成水平显著提高(p<0.01),且hc50呈一定的剂量依赖性,结果详见表10。
3.5美洲大蠊提取物ento-pa对脾t淋巴细胞增殖的影响
与空白对照组比较,模型对照组t淋巴细胞增殖显著降低(p<0.01);与模型对照组比较,黄芪多糖组及ento-pa高、中、低剂量组t淋巴细胞增殖明显增强(p<0.01),其中ento-pa高、中剂量组与黄芪多糖组相当(p>0.05),高剂量组已基本接近空白对照组(p>0.05);结果详见表10。
表10美洲大蠊提取物ento-pa对溶血素生成水平和脾脏t淋巴细胞增殖的影响(
注:与正常组比较,*p<0.05,**p<0.01;与模型组比较,△p<0.05,△△p<0.01;与阳性药组比较,▲p<0.05,▲▲p<0.01。
免疫抑制能引发数种疾病,而免疫调节药物能使得机体的免疫应答维持在正常水平,构建免疫抑制的动物模型可用来评价药物的免疫调节作用。本实验采用注射环磷酰胺造成免疫抑制模型,从非特异性免疫、细胞免疫、体液免疫三个方面考察ento-pa对小鼠免疫功能的影响。
胸腺和脾脏是重要的免疫器官,脾脏和胸腺的重量可以反映非特异性免疫的功能。巨噬细胞是非特异性免疫反应中的重要免疫细胞,在固有免疫中发挥防御功能,也是参与特异性免疫的专职抗原提呈细胞,具有吞噬、杀伤、调控机体免疫等多种功能,是非特异性免疫的指标之一。在环磷酰胺作用下,小鼠腹腔巨噬细胞吞噬中性红细胞的能力显著降低,脾脏指数和胸腺指数均显著降低,固有免疫受到抑制,而给药后,脾脏指数、胸腺指数、吞噬作用呈剂量依赖增加,这提示美洲大蠊提取物ento-pa可能有改善免疫抑制小鼠固有免疫的功能。
t淋巴细胞等免疫细胞增殖是机体正常免疫应答的前提与保证,研究t淋巴细胞体外增殖能力是研究细胞免疫的重要手段。在环磷酰胺的作用下,小鼠脾脏t淋巴细胞增殖受到抑制。而给予美洲大蠊提取物ento-pa后,可以显著促进脾脏t淋巴细胞体外增殖,提示ento-pa可以改善免疫抑制小鼠细胞免疫功能。
机体外周血细胞数量的变化可反映机体的免疫功能改变,而环磷酰胺不良反应最终会导致血小板和白细胞的减少。美洲大蠊提取物ento-pa可升高免疫抑制小鼠wbc、rbc、plt、hgb等血常规指标,提示ento-pa可以改善小鼠免疫功能低下引起的血细胞数量减少。
血清溶血素是b淋巴细胞受抗原刺激后产生的抗体,其含量反映了抗体生成能力的高低,是评价体液免疫的重要指标。ento-pa可以提高免疫抑制小鼠溶血素生成水平,具有提高免疫抑制小鼠体液免疫的功能。
本实施例研究结果提示,美洲大蠊提取物ento-pa具有免疫功能增强的作用。
实施例7
美洲大蠊提取物ento-pa对正常小鼠免疫功能的影响
1材料与方法
1.1实验材料、试剂
1.1.1药品及试剂
本发明美洲大蠊提取物ento-pa;
黄芪多糖注射液(河南复兴动物药业有限公司,批号:20160624);
都氏试剂(批号:slbq0489v)、cona(lot:slbn5209v)购自sigma公司;rpmi1640、胎牛血清(gibco公司);mtt、中性红、二甲基亚砜(dmso),均购自solarbio公司;小鼠淋巴细胞分离液(深圳市达科为生物工程有限公司);豚鼠血清、绵羊血由大理大学动物实验中心提供。
1.1.2实验动物
spf级昆明小鼠60只,♀♂各半,6-8周龄,体质量(20±2)g,由湖南景莱克景达实验动物有限公司提供,许可证号:scxk(湘)2013-0004。
1.1.3实验仪器
gen5型酶标分析仪(基因有限公司);xfa6000全自动动物血细胞分析仪(南京普朗医疗设备有限公司);t6新世纪紫外可见分光光度计(北京普析通用有限公司);5510型co2培养箱(美国nuaire公司);ckx41型倒置显微镜(奥林巴斯有限公司);sw-cj-2fd双人单面净化工作台(苏州净化设备有限公司)。
1.2实验方法
1.2.1分组及给药
将60只昆明小鼠,随机分为5组:空白对照组、黄芪多糖组(160mg·kg-1)、ento-pa高、中、低剂量组(400、200、100mg·kg-1)。空白对照组灌胃给予等量生理盐水,其余各组给予相应剂量药物10d;各组均于给药第1、3、5d注射2%的绵羊红细胞(srbc)0.2ml致敏。
1.2.2外周血细胞测定
末次给药后1h,小鼠摘眼球取血,取20μl全血放入预稀释液中,用动物血细胞分析仪以预稀释模式测定外周血细胞。
1.2.3溶血素含量测定
末次给药后1h,小鼠摘眼球取血,2000r·min-1离心10min,取血清,于56℃水浴30min以灭活补体,对血清溶血素效价进行滴定。取血清稀释相应倍数,置于ep管内,加入0.5ml5%的绵羊红细胞,1.0ml稀释的豚鼠血清,空白对照管内用生理盐水代替小鼠血清。将所有试管于37℃水浴锅中恒温10min,取出放入冰浴中终止反应;2000r·min-1离心10min,取上清液1.0ml,加都氏试剂3.0ml于管内;同时取5%的绵羊红细胞0.25ml,都氏试剂4.0ml于另一支试管内充分摇匀,放置10min,以对照管做空白,于540nm波长下,分别测量吸光度值,计算半数溶血值。半数溶血值公式为:hc50=(样品吸光度值/srbc半数溶血时的吸光度)×稀释倍数。
1.2.4吞噬指数的测定
于末次给药后1h颈椎脱臼处死小鼠,放入75%的乙醇中浸泡3min,腹腔注入4ml无菌pbs缓冲液(含10%胎牛血清),2ml空气,轻揉腹部3min,无菌条件下打开腹腔,吸取腹腔液于离心管中,1200r·min-1离心5min,弃上清液收集巨噬细胞,pbs洗涤细胞2次,用含10%胎牛血清的rpmi1640培养液调整细胞密度至5×109·l-1,以每孔100μl接种于96孔板,置37℃、5%co2培养箱中培养,3h后用pbs洗去未贴壁细胞,加入0.1%的中性红溶液200μl,孵育3h。弃上清,洗涤细胞3次,每孔加入200μl酸性乙醇溶解液(乙醇、乙酸等体积混合),4℃静置过夜,于520nm波长下测定od值,并计算吞噬率/%=实验组od值/对照组od值×100。
1.2.5脏器指数的测定
取出小鼠脾脏和胸腺,去除脂肪和筋膜组织,称取重量,计算脏器指数。脏器指数=脏器质量(mg)/小鼠体重(g)。
1.2.6脾t淋巴细胞增殖实验
取出小鼠的脾脏,制备脾脏细胞悬液,用淋巴细胞分离液分离脾淋巴细胞,用培养基调整细胞浓度至5×109·l-1,加入100μl细胞悬液到96孔板中,并加入cona(终浓度为10mg·l-1)刺激。置于37℃、5%co2培养箱中培养68h。每孔加20μlmtt(5mg·l-1),继续培养4h后,移去微孔中所有液体,再加入150μldmso终止反应,振荡10min,酶标仪检测570nm处od值。
2结果
2.1美洲大蠊提取物ento-pa对小鼠免疫器官脏器指数的影响
如表11所示,与空白对照组比较,黄芪多糖组的脾脏指数明显增高(p<0.01),对胸腺脏器指数无显著影响;ento-pa各浓度组脾脏指数、胸腺指数无显著性差异,但呈剂量依赖性上升趋势。
表11美洲大蠊提取物ento-pa对小鼠免疫器官脏器指数的影响(
注:与正常组比较,1)p<0.01。
2.2美洲大蠊提取物ento-pa对小鼠外周血细胞的影响
表12结果显示,与空白对照组比较,黄芪多糖组及ento-pa各剂量组的wbc、rbc、plt、hgb水平均均有所升高;ento-pa各组呈一定剂量依赖性,其中rbc、plt、hgb均已超过正常水平,与空白对照组比较无统计学差异(p>0.05)。
表12美洲大蠊提取物ento-pa对小鼠外周血细胞的影响(
2.3美洲大蠊提取物ento-pa对腹腔巨噬细胞吞噬功能的影响
表13结果显示,黄芪多糖组及ento-pa各剂量组吞噬能力和吞噬率较空白对照组呈增高趋势,ento-pa各剂量组吞噬能力和吞噬率呈良好的剂量依赖性,与空白对照组比较无统计学差异(p>0.05)。
表13美洲大蠊提取物ento-pa对小鼠巨噬细胞吞噬功能的影响(
2.4美洲大蠊提取物ento-pa对血清溶血素含量、脾t淋巴细胞增殖的影响
表14结果显示,与空白对照组比较,黄芪多糖组、ento-pa高剂量组溶血素生成水平(hc50)明显升高(p<0.01),ento-pa中剂量组显著升高(p<0.05),ento-pa低剂量组与正常组相当(p>0.05);黄芪多糖组、ento-pa高剂量组t淋巴细胞增殖显著增强(p<0.05),其余各组t淋巴细胞增殖与正常组相当(p>0.05)。且hc50和t淋巴细胞增殖呈一定的剂量依赖性。表14美洲大蠊提取物ento-pa对小鼠溶血素水平和t淋巴细胞增殖的影响(
注:与正常组比较,1)p<0.05,2)p<0.01。
本实施例从非特异性免疫、细胞免疫、体液免疫三个方面考察ento-pa对正常小鼠免疫功能的影响。脾脏是机体体液免疫的主要器官,胸腺是机体细胞免疫的主要器官,胸腺和脾脏器官指数在一定程度上可反映机体整体免疫水平;巨噬细胞是可以反应非特异性免疫功能中的重要免疫细胞;t淋巴细胞等免疫细胞增殖是机体正常免疫应答的前提与保证,研究t淋巴细胞体外增殖能力是研究细胞免疫的重要手段。机体外周血细胞数量的变化可反映机体的免疫功能改变,而血清溶血素是b淋巴细胞受抗原刺激后产生的抗体,是评价体液免疫的重要指标。
给予美洲大蠊提取物ento-pa后,可以明显促进脾脏t淋巴细胞体外增殖,显著提高小鼠溶血素生成水平,提示:美洲大蠊提取物ento-pa可增强体液免疫和细胞免疫的功能。对wbc、rbc、plt、hgb等血常规指标、腹腔巨噬细胞吞噬作用以及脾脏指数、胸腺指数影响不大,但呈剂量依赖性增高趋势,提示美洲大蠊ento-pa可以增强非特异性免疫,但在提高细胞免疫和体液免疫的同时,并不对小鼠的免疫器官造成抑制或引起生理性增大,且被动增强免疫未造成吞噬作用加强、白细胞等增多,产生自身免疫疾病。
本实施例研究结果提示,美洲大蠊提取物ento-pa对正常机体的免疫功功能具有增强作用且相对安全。
实施例8
一种免疫调节剂,包括以下重量百分含量的组分:
实施例1制备得到的美洲大蠊提取物ento-pa:40g;淀粉:40g;羧甲基淀粉钠:3g。
将美洲大蠊提取物ento-pa浓缩成比重为1.20~1.25的稠膏,取稠膏40g,加入淀粉40g、羧甲基淀粉钠3g,混合,过20目筛网制备湿颗粒,50℃干燥3h,整粒,过筛,填充胶囊,制备得到免疫调节剂。制备得到的免疫调节剂能够用于调节机体免疫能力。
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!