人参皂苷Rh2在制备防治炎症性肠病药物中的应用的制作方法
本发明涉及生物医药技术领域,具体涉及人参皂苷rh2在制备防治炎症性肠病药物中的应用。
背景技术:
炎症性肠病(ibd)是一种慢性、特发性的炎症性肠道疾病,主要累及回肠、结肠、直肠等病变部位,临床表现为肠道反复发作的溃疡和炎症,目前在我国发病率有逐年升高的趋势。炎症性肠病的病因和发病机制比较复杂,目前的研究还尚不明确,其中遗传因素、生活环境、饮食习惯和免疫感染等都可能是炎症性肠病发病的可能原因。目前临床防治炎症性肠病的药物主要以5-氨基水杨酸类、糖皮质激素和免疫调节剂等为主。然而长期服用这类药物会出现菌群紊乱不良反应,严重影响患者的治疗效果,因此常常限制炎症性肠病的临床疗效。目前,关于人参皂苷rh2对于在制备防治炎症性肠病药物中未见报道。
技术实现要素:
有鉴于此,本发明的目的在于提供人参皂苷rh2在制备防治炎症性肠病药物中的应用,能够有效防治炎症性肠病,而且患者不会出现肠道菌群紊乱的症状。
为了实现上述发明目的,本发明提供以下技术方案:
本发明提供了人参皂苷rh2在制备防治炎症性肠病药物中的应用。
优选的,所述人参皂苷rh2降低结肠中炎症因子的含量。
优选的,所述炎症因子包括tnf-α、il-6和il-1β中的一种或几种。
优选的,所述人参皂苷rh2调节肠道菌群。
优选的,所述肠道菌群中的微生物包括厚壁菌门、拟杆菌门、放线菌门和变形菌门中一种或几种。
优选的,所述厚壁菌门中的微生物包括肠球菌属和芽孢乳杆菌属。
优选的,所述拟杆菌门中的微生物包括拟杆菌属和拟普雷沃菌属。
优选的,所述放线菌门中的微生物包括双歧杆菌属和肠杆菌属。
优选的,所述变形菌门中的微生物包括大肠埃希菌-志贺菌属、嗜胆菌属和螺杆菌属。
优选的,所述防治炎症性肠病的药物的剂型包括液体制剂、颗粒剂、缓释剂、冲剂、片剂或胶丸;
所述防治炎症性肠病的药物包括人参皂苷rh2在药学上可接受的辅料;
所述防治炎症性肠病的药物中人参皂苷rh2的有效含量为98%以上。
本发明提供了人参皂苷rh2在制备防治炎症性肠病药物中的应用。在本发明中,所述人参皂苷rh2通过调节肠道微生物平衡,增加肠道中有益微生物的含量,降低肠道中有害微生物的含量,而且不会出现肠道菌群紊乱,从而降低结肠中炎症因子tnf-α、il-6和il-1β的含量,从而能够有效治疗炎症性肠病。
附图说明
图1为小鼠造模技术路线图和小鼠生存率、体重的结果;
图2为小鼠结肠病理切片和结肠形态结果;
图3为小鼠结肠中炎症因子tnf-α、il-6和il-1β的基因表达结果;
图4为小鼠结肠内肠道菌群分析结果。
具体实施方式
本发明提供了人参皂苷rh2在制备防治炎症性肠病药物中的应用。
在本发明中,所述人参皂苷rh2优选降低结肠中炎症因子的含量,所述炎症因子优选包括tnf-α、il-6和il-1β中的一种或几种,更优选为包括tnf-α、il-6和il-1β。在本发明中,为了能够表征人参皂苷rh2降低炎症因子的效果,在服用药物后通过检测结肠中炎症因子的基因表达水平,来确定炎症因子的含量。
本发明在检测结肠中炎症因子的基因表达水平前,优选对对结肠进行造模,所述造模的方法优选包括以下步骤:
1)将质量浓度为1~3%的葡聚糖硫酸钠溶液对小鼠进行第一饲喂,第一饲喂的时间为4~6天,再饲喂小鼠饮用水4~6天,上述步骤重复一次,得到第一饲喂小鼠;
2)再将质量浓度为1~3%的葡聚糖硫酸钠溶液对所述步骤1)得到的第一饲喂小鼠进行第二饲喂,第二饲喂的时间为6~8天,再饲喂小鼠饮用水4~6天,上述步骤重复一次,得到造模后的小鼠。
在本发明中,所述步骤1)和2)中的葡聚糖硫酸钠溶液的质量浓度独立为1~3%,优选为1.5~2.5%,更优选为2%。本发明对所述葡聚糖硫酸钠的来源没有特殊限定,采用本领域技术人员常规选用的市售产品即可。在本发明实施例中具体为购买于美国mpbiomedicals公司。
在本发明中,所述第一饲喂的时间为4~6天,优选为5天。
本发明对饲喂葡聚糖硫酸钠溶液的量和次数没有特殊限定,采用本领域技术人员正常饲喂小鼠饮用水的量和次数即可。
在本发明中,所述步骤1)和2)中饲喂小鼠饮用水的时间独立为4~6天,优选为5天。
本发明在对小鼠进行第一饲喂前优选对小鼠常规饲喂5~9天,更优选为6~8天,最优选为7天。在本发明中,所述小鼠优选为spf级c57/b6小鼠;所述小鼠优选为雄性;所述小鼠的体重优选为18~22g,更优选为19~21g,最优选为20g;所述小鼠的周龄优选为8~10周,更优选为9周。本发明对小鼠的来源没有特殊限定,采用本领域技术人员常规选用的实验小鼠即可,在本发明实施例中具体来源于北京维通利华实验动物技术有限公司。
在本发明中,所述常规饲喂的温度优选为22~24℃,更优选为23℃;所述常规饲喂的湿度优选为50~70%,更优选为55~65%,最优选为60%;所述常规饲喂在光暗交替中进行,先光照12h后再黑暗12h,本发明对所述光照的强度没有特殊限定,采用本领域技术人员常规饲养小鼠采用的光照强度即可。
在本发明中,所述葡聚糖硫酸钠溶液优选每2天重新配制,重新配置后再饲喂小鼠。
本发明对造模的小鼠优选从第六天开始给药,rh2组灌胃给予40~60mg/kg人参皂苷rh2,给药45天后处死小鼠。
在本发明中,所述给予造模的小鼠人参皂苷rh2的剂量优选为40~60mg/kg,更优选为45~55mg/kg,最优选为50mg/kg;所述人参皂苷rh2溶解使用的溶剂优选为cmc-na溶液,所述cmc-na溶液的质量浓度优选为0.3~0.7%,更优选为0.4~0.6%,最优选为0.5%。本发明对所述人参皂苷rh2的来源没有特殊限定,采用本领域技术人员常规选用的市售产品即可,在本发明实施例中具体购买于吉林大学,所述人参皂苷rh2的纯度>98%。本发明对所述cmc-na的来源没有特殊限定,采用本领域技术人员常规选用的市售产品即可。
本发明将小鼠处死后,取结肠,按照takara总rna提取试剂盒的说明书提取rna,再按照rt-pcr试剂盒的说明书将mrna逆转录为cdna,再按照thermalcyclerdicetmrealtimesystem(takaracode:tp800)使用说明书进行pcr扩增反应,所述pcr扩增反应的条件优选包括:
预变性:95℃,30s;
pcr反应:95℃,10s;60℃,30s;72℃,30s;40个循环;
熔解曲线分析:95℃,15s;70℃15s。
本发明对所述takara总rna提取试剂盒和rt-pcr试剂盒的来源没有特殊限定,采用本领域技术人员常规选用的市售产品即可,在本发明实施例中具体购买于takara(大连宝生物,japan)。
在本发明中,所述人参皂苷rh2优选调节肠道菌群;所述肠道菌群中的微生物包括厚壁菌门、拟杆菌门、放线菌门和变形菌门中一种或几种。
在本发明中,所述厚壁菌门中的微生物包括肠球菌属和芽孢乳杆菌属。在本发明中,所述人参皂苷rh2能够降低结肠中肠球菌属的含量。
在本发明中,所述拟杆菌门中的微生物包括拟杆菌属和拟普雷沃菌属等。在本发明中,所述人参皂苷rh2能够降低结肠中拟杆菌属的含量。
在本发明中,所述放线菌门中的微生物包括双歧杆菌属和肠杆菌属等。在本发明中,所述人参皂苷rh2能够增加结肠中双歧杆菌属的含量。
在本发明中,所述变形菌门中的微生物包括大肠埃希菌-志贺菌属、嗜胆菌属和螺杆菌属。在本发明中,所述人参皂苷rh2能够降低结肠中大肠埃希菌-志贺菌属的含量。
本发明为了能够表征人参皂苷rh2能够调节肠道菌群,在服用药物后通过检测结肠内容物,来确定微生物的种类和含量。
本发明在检测肠道内容物前,优选对小鼠进行造模,所述造模的方法与检测结肠中炎症因子的基因表达水平前对小鼠进行造模的方法相同,在此不再赘述。
本发明对造模后的小鼠优选从第六天开始给药,rh2组灌胃给予40~60mg/kg人参皂苷rh2,给药45天后处死小鼠。
在本发明中,所述给予人参皂苷rh2的剂量优选为40~60mg/kg,更优选为45~55mg/kg,最优选为50mg/kg;所述人参皂苷rh2溶解使用的溶剂优选为cmc-na溶液,所述cmc-na溶液的质量浓度优选为0.3~0.7%,更优选为0.4~0.6%,最优选为0.5%。本发明对所述人参皂苷rh2的来源没有特殊限定,采用本领域技术人员常规选用的市售产品即可,在本发明实施例中具体购买于吉林大学,所述人参皂苷rh2的纯度>98%。本发明对所述cmc-na的来源没有特殊限定,采用本领域技术人员常规选用的市售产品即可。
本发明将小鼠处死后,优选在无菌条件下取出结肠内容物,采用常规基因组dna的提取方法提取基因组dna,对提取后的基因组dna进行pcr扩增,以稀释后的基因组dna为模板,根据测序区域的选择,使用带barcode的特异引物,16sv4区引物为515f-806r;18sv4区引物为528f-706r;18sv9区引物为1380f-1510r;its1区引物为its5-1737f、its2-2043r;its2区引物为its3-2024f、its4-2409r。使用newenglandbiolabs公司的
本发明将得到的pcr扩增产物优选使用质量浓度为2%的琼脂糖凝胶进行电泳检测,再根据pcr扩增产物的浓度进行等量混样,混合后使用质量浓度为2%的琼脂糖凝胶进行电泳,电泳后对扩增的条带使用qiagen公司提供的胶回收试剂盒回收产物。
本发明优选使用
通过上述方案测序得到的原始数据存在一定比例的干扰数据,本发明为了使信息分析的结果更加准确、可靠,优选对原始数据进行拼接、过滤,得到有效数据,再基于有效数据进行otus聚类和物种分类分析。
本发明优选根据otus聚类结果,对每个otu的代表序列做物种注释,得到对应的物种信息和基于物种的丰度分布情况,再根据物种注释结果,选取每个分组在各门水平和属水平上最大丰度排名前10的物种,生成物种相对丰度柱形累加图。
本发明优选根据所有分组在属水平的物种注释及丰度信息,采用最大值排序法,选取丰度排名前35的属(分组的丰度为组内所有样品的平均丰度),根据其在每个样品中的丰度信息,从物种层面进行聚类,绘制成热图。
在本发明中,所述的提取结肠内容物的基因组dna与检测、pcr扩增、产物纯化、文库制备及库检、上机测序和结果分析委托给北京诺禾致源科技股份有限公司。
在本发明中,所述防治炎症性肠病的药物的剂型包括液体制剂、颗粒剂、缓释剂、冲剂、片剂或胶丸。在本发明中,所述防治炎症性肠病的药物含有人参皂苷rh2在药学上可接受的辅料。本发明对上述剂型的制备方法没有特殊限定,采用本领域技术人员常规制备上述剂型的方法即可。
在本发明中,所述防治炎症性肠病的药物中人参皂苷rh2的有效含量为98%以上。
下面结合本发明的实施例,对本发明中的技术方案进行清楚、完整地描述。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其它实施例,都属于本发明保护的范围。
实施例1
葡聚糖硫酸钠肠炎小鼠造模:c57/b6小鼠在动物房饲养7天后,在小鼠饮水中给予质量浓度为2%的葡聚糖硫酸钠溶液持续5天,每2天更换重新配制的葡聚糖硫酸钠溶液,然后恢复正常饮水5天,此10天为一个周期,持续2个周期,再给予质量浓度为2%的葡聚糖硫酸钠溶液持续7天,每2天更换重新配制的葡聚糖硫酸钠溶液,然后恢复正常饮水5天,此12天为一个周期,持续2个周期。总共4个周期的饲喂葡聚糖硫酸钠溶液循环,每天称量小鼠体重。然后将小鼠随机分为四组:空白组、模型组、人参皂苷rh2组、柳氮磺胺吡啶sasp组。自造模后第6天开始给药干预:rh2组灌胃给予50mg/kg的人参皂苷rh2,柳氮磺胺吡啶sasp组灌胃给予100mg/kg柳氮磺胺吡啶sasp,溶剂均为质量浓度为0.5%cmc-na溶液,空白组和模型组灌胃均给予同剂量的0.5%cmc-na溶液。饲喂第45天时断颈处死小鼠。
用天平每日称量小鼠的体重以及每日观察小鼠的生存情况,测定结果见图1。
根据图1可以得出,(a)是葡聚糖硫酸钠肠炎小鼠造模并给药干预的技术路线图;(b)是肠炎小鼠体重变化曲线图,结果表明人参皂苷rh2可以显著提升由肠炎造成的小鼠体重下降情况,模型组体重下降为原来的71.2%,而人参皂苷rh2干预后体重升为原来的113.3%;(c)是肠炎小鼠生存率曲线图,结果显示模型组小鼠死亡率为85%,而人参皂苷rh2干预后降低为25%。
测定结果表明,模型组小鼠体重明显低于对照组(p<0.001),人参皂苷rh2和阳性药sasp给药干预后可显著升高模型组小鼠体重(p<0.001)。此外,人参皂苷rh2给药干预后,模型组小鼠死亡率可由85%降低至25%。
实施例2
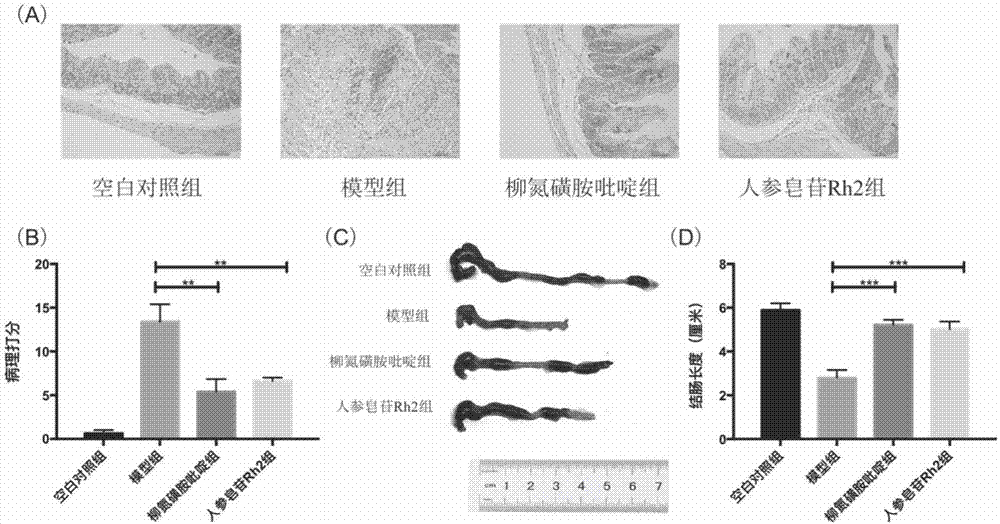
葡聚糖硫酸钠肠炎小鼠造模方法、饲喂小鼠方法和处死小鼠方法详见实施例1。在超净台中剖取结肠组织,量取结肠长度并拍照。取结肠远端0.5cm用生理盐水冲洗干净,质量浓度为4%多聚甲醛固定24h后脱水、石蜡包埋,切片,做he染色,其中脱水、石蜡包埋、切片和he染色采用常规方法即可,病理切片结果见图2。
组织学评分:在显微镜下观察,根据文献制定组织学评分标准:
①病变范围:无,0分;1~25%,1分;26~50%,2分;51~75%,3分;76~100%,4分;
②病变深度:无,0分;黏膜上层,1分;黏膜固有层,2分;黏膜层和黏膜下层,3分;肌层及浆膜层,4分;
③隐窝损害程度:无,0分;小部分隐窝、表面上皮缺失,1分;部分隐窝、表面上皮缺失,2分;大部分隐窝、表面上皮缺失,3分;全部分隐窝、表面上皮缺失,4分;
④炎症细胞浸润程度:无,0分;轻微,1分;轻度,2分;中度,3分;重度,4分;
⑤纤维组织增生程度:无,0分;轻微,1分;轻度,2分;中度,3分;重度,4分。
根据图2可以得出,(a)是病理切片结果,he染色结果显示模型组出现不同程度的病变,人参皂苷rh2以及柳氮磺胺吡啶sasp组病变程度均明显改善,(b)是组织学评分结果,结果显示人参皂苷rh2干预组组织学评分为6分、柳氮磺胺吡啶组为5.5分,均明显低于模型组的13.4分,(c)是不同组小鼠结肠性状图,结果表明模型组小鼠结肠相对于其他组红肿程度更为明显,长度更短,人参皂苷rh2给药后的小鼠结肠对此现象有所改善,(d)是不同组小鼠结肠长度统计图,结果显示模型组小鼠结肠长度约为2.8cm,而人参皂苷rh2干预组小鼠结肠明显增长,约为4.9cm,柳氮磺胺吡啶组约为5.2cm均明显高于模型组。
根据病理切片结果可以得出,模型组出现不同程度的表层上皮细胞脱落、炎性细胞浸润、隐窝损伤及纤维组织增生等病变,人参皂苷rh2明显减轻dss诱导的结肠炎病理改变程度(p<0.01),此外,人参皂苷rh2组结肠长度相对于模型组明显增长(p<0.001)。
由此可以得出,rh2组病变损伤程度改善明显,结肠长度和红肿程度明显改善。
实施例3
结肠组织炎症因子基因表达:
葡聚糖硫酸钠小鼠造模方法、饲喂小鼠方法和处死小鼠方法详见实施例1。剖取结肠组织,冲洗干净后,称取0.5mg,加入适量trizol,按照takara总rna提取试剂盒操作提取rna,并进行rna定量。按照rt-pcr试剂盒说明书,将mrna逆转录为cdna。按照thermalcyclerdicetmrealtimesystem(takaracode:tp800)使用说明书要求进行pcr实验操作,结果见图3。定量pcr反应条件为:
stage1:预变性:95℃,30sec;
stage2:pcr反应:95℃,10sec;60℃,30sec;72℃,30sec;40cycles;
stage3:融解曲线分析:95℃,15sec;70℃,15sec。
根据图3可以得出,(a)是不同组结肠组织tnf-αmrna相对表达情况,结果显示人参皂苷rh2干预后相对于模型组mrna表达降低了约3.3倍,(b)是不同组结肠组织il-6的mrna相对表达情况,结果显示人参皂苷rh2干预后相对于模型组mrna表达降低了约2.9倍,(c)是不同组结肠组织il-6的mrna相对表达情况,结果显示人参皂苷rh2干预后相对于模型组mrna表达降低了约11.7倍。
实验结果表明,葡聚糖硫酸钠造模后小鼠结肠il-6、il-1β和tnf-αmrna表达水平升高明显(p<0.001),与模型组相比,人参皂苷rh2给药干预可以显著下调il-6、il-1β水平(p<0.001),对于tnf-α的下调水平也比较明显(p<0.05)。
由此可以得出,人参皂苷rh2能够显著降低结肠中炎症因子tnf-α,il-β,il-6的基因水平。
实施例4
肠道内容物提取:
葡聚糖硫酸钠肠炎小鼠造模方法、饲喂小鼠方法和处死小鼠方法详见实施例1。剖取结肠组织,在无菌超净台中取出结肠内容物迅速装入无菌ep管中。
基因组dna的提取和pcr扩增:采用ctab或sds方法对样本的基因组dna进行提取,之后利用琼脂糖凝胶电泳检测dna的纯度和浓度,取适量的样品于离心管中,使用无菌水稀释样品至1ng/μl。以稀释后的基因组dna为模板,根据测序区域的选择,使用带barcode的特异引物。使用newenglandbiolabs公司的
pcr产物的混样和纯化:pcr产物使用2%浓度的琼脂糖凝胶进行电泳检测;根据pcr产物浓度进行等量混样,充分混匀后使用2%的琼脂糖凝胶电泳检测pcr产物,对目的条带使用qiagen公司提供的胶回收试剂盒回收产物。
文库构建和上机测序:使用
测序结果的信息分析:测序得到的原始数据,存在一定比例的干扰数据,为了使信息分析的结果更加准确、可靠,首先对原始数据进行拼接、过滤,得到有效数据。然后基于有效数据进行otus(operationaltaxonomicunits)聚类和物种分类分析。根据otus聚类结果,对每个otu的代表序列做物种注释,得到对应的物种信息和基于物种的丰度分布情况。根据物种注释结果,选取每个分组在各门水平(phylum)和属水平(genus)上最大丰度排名前10的物种,生成物种相对丰度柱形累加图。
根据所有分组在属水平的物种注释及丰度信息,采用最大值排序法,选取丰度排名前35的属(分组的丰度为组内所有样品的平均丰度),根据其在每个样品中的丰度信息,从物种层面进行聚类,绘制成热图。结果见图4。
根据图4可以得出,(a)是属水平上的物种相对丰度柱形图,(b)是门水平上的物种相对丰度柱形图,(c)属水平上的物种丰度聚类热图,(d)是不同组肠球菌属相对丰度图,(e)是不同组拟杆菌属相对丰度图,(f)是不同组双歧杆菌属相对丰度图,(g)是不同组大肠埃希菌-志贺菌属相对丰度图。
结果显示,在门水平上,厚壁菌门、拟杆菌门和变形菌门是正常小鼠肠道中最常见的三种菌群。同正常对照组相比,模型组中变形菌门的相对含量比例明显增高,拟杆菌门和厚壁菌门的比例明显降低,人参皂苷rh2给药干预后,三种菌群比例有向正常组恢复的趋势。相对丰度图和热图数据显示,在属水平上,不同组小鼠肠道菌群组成也有显著差异,模型组中有益菌如双歧杆菌等相对含量降低明显,人参皂苷rh2干预后,其含量显著增加;模型组中有害菌如大肠埃希氏杆菌-志贺菌等相对含量增加明显,人参皂苷rh2干预后,其含量显著降低。
由此可以得出,人参皂苷rh2可以调节肠道菌群,增加有益菌减少有害菌比例。
由以上实施例可以得出,人参皂苷rh2能够调节肠道微生物平衡,增加肠道中有益微生物的含量,降低肠道中有害微生物的含量,而且不会出现肠道菌群紊乱,从而降低结肠中炎症因子tnf-α、il-6和il-1β的含量,从而能够有效治疗炎症性肠病。
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!