可注射的微球的制作方法
本文件涉及与用于在患者的脉管系统内递送治疗剂的可注射微球相关的系统、装置和方法。
背景技术
严重肢体缺血(cli)与严重阻塞血液流向人的四肢(例如,手臂、腿或脚)相关,最终可能导致肢缺损。与cli相关的症状可以包括休息时足痛、不愈合的溃疡、肢体坏疽/脱疽和伤口愈合延迟。由于cli,估计在美国每年进行160,000至180,000例截肢。自1985年以来,美国的下肢截肢率增加了一倍,并且在80岁以上的人中增加了4到5倍。截肢后,不到一半的cli患者可以实现完全活动能力,并且仅有四分之一的膝上截肢患者会佩戴假肢。目前,仅在美国,每年治疗cli的估计成本约为每年100至200亿美元。
患有cli的患者的生活质量可能非常差,并且据报道与患有末期恶性肿瘤的患者的生活质量相似。大多数患有cli的患者可能会经历重复住院治疗和外科/血管内手术,以努力保护受影响的一个或多个肢体。在某些情况下,保肢手术努力不足以有效逆转缺血,并且尽管多次尝试进行血管重建,但一个或多个伤口可能无法正常愈合。此外,由于闭塞性或弥漫性病变的远端血管,许多患者可能不是传统形式的血管重建的合格候选者。因此,本领域需要可以治疗严重缺血性肢体的疗法和装置。
技术实现要素:
本文披露了涉及可注射组合物的装置、系统和方法的不同实施例,这些可注射组合物包括用于递送治疗剂的微球。
在第一方面,一种用于治疗剂的血管内递送的可注射组合物包括含有第一治疗剂的一个或多个第一微球、含有第二治疗剂的一个或多个第二微球和液体载体。每个第一微球包括含有可生物降解的聚合物的壁,该壁包封该第一治疗剂。每个第二微球包括含有可生物降解的聚合物的壁,该壁包封该第二治疗剂。
在一些情况下,该第一治疗剂、第二治疗剂或这两者选自下组,该组由以下组成:干细胞、腺病毒、化学治疗剂、免疫抑制剂、蛋白质、核酸或其组合。优选地,本文提供的可注射组合物可以包括按该可注射组合物重量计从约10%至约50%范围内的量的第一微球和第二微球,以及按该可注射组合物重量计从约90%至约50%范围内的量的载体。在一些情况下,第一微球和第二微球以按可注射组合物重量计从约35%至约45%范围内的量包括在该可注射组合物中,以及载体是按该可注射组合物重量计从约65%至约55%范围内的量。优选地,这些第一微球、这些第二微球或这两者悬浮在该液体载体中。在一些情况下,一个或多个第一微球被布置在至少一个第二微球内。在一些情况下,该液体载体可以包括纯化水、蒸馏水、盐水溶液或血清。在一些情况下,这些第一微球的壁具有比这些第二微球的壁更快的降解速率。在一些情况下,这些第一微球的平均壁厚可以大于这些第二微球的平均壁厚。在一些情况下,这些第一微球、这些第二微球或这两者的壁可以包括无孔聚合物层。优选地,这些第一微球可以进一步包封至少一部分液体载体,使得该第一治疗剂悬浮在这些第一微球内的液体载体内。
优选地,本文提供的可注射组合物可以包括具有从约0.2毫米至约5.0毫米范围内的直径的第一微球、第二微球或这两者。在一些情况下,该可生物降解的聚合物可以包括聚乳酸(pla)、聚乙醇酸(pga)、pla和pga的共聚物、聚-l-丙交酯(plla)、聚-d,l-丙交酯(pdla)、聚己内酯(pcl)或其组合。
在第二方面,用于可注射组合物的血管内递送的系统含有导管,与该导管的内腔处于流体连通的根据前述权利要求中任一项所述的可注射组合物的来源,以及用于将该可注射组合物输送通过该导管的输送元件。优选地,导管可以包括近端、远端和限定内腔的细长管状轴。
在一些情况下,输送元件可以包括用于施加注射压力以通过导管输送可注射组合物的注射器。输送元件可以任选地包括分配装置,该分配装置包括杯形尖端,用于接触一个或多个微球的至少一部分并将一个或多个微球推动通过导管。
在第三方面,制造可注射组合物的方法包括形成包含plga或plla的聚合物膜。本文提供的方法可以包括添加治疗剂并将该治疗剂包封在聚合物膜内。
优选地,形成和包封步骤可以包括将不混溶的治疗剂添加到包括二甲基甲酰胺和plga或plla的聚合物溶液中。在一些情况下,形成步骤可以包括挤出包括plga或plla的薄膜或微管或微丸。在一些情况下,包封步骤可以包括将治疗剂注射到膜中,使得该膜拉伸以形成微球。
虽然本文披露了多个实施例,但是通过以下详细描述,系统、装置和/或方法的仍其他实施例对于本领域技术人员将变得显而易见,该详细描述显示并描述了本文提供的系统、装置和/或方法的说明性实施例。因此,应该认为附图和详细说明都是示例性的,而不是限制性的。
附图说明
图1是用于在患者的外周脉管系统内递送本文提供的可注射组合物的示例性血管内递送系统的示意图。
图2是说明性地比较具有不同降解时间的两种不同示例性微球(例如,快速释放微球和缓慢释放微球)的图。
图3是在患者的外周脉管系统内递送本文提供的可注射组合物的另一示例性血管内递送系统的示意图。
图4-6是显示图3的示例性可注射组合物的不同阶段的降解的示意图。
尽管本文提供的系统、装置和/或方法的实施例可以适用于不同的修改和替代形式,但是在附图中以实例形式显示并且在下文详细描述了具体的实施例。然而,意图不是将本披露限制于所描述的特定实施例。相反,本披露旨在覆盖落入由所附权利要求所限定的系统、装置、和/或方法的范围内的所有修改、等效物和替代方案。
具体实施方式
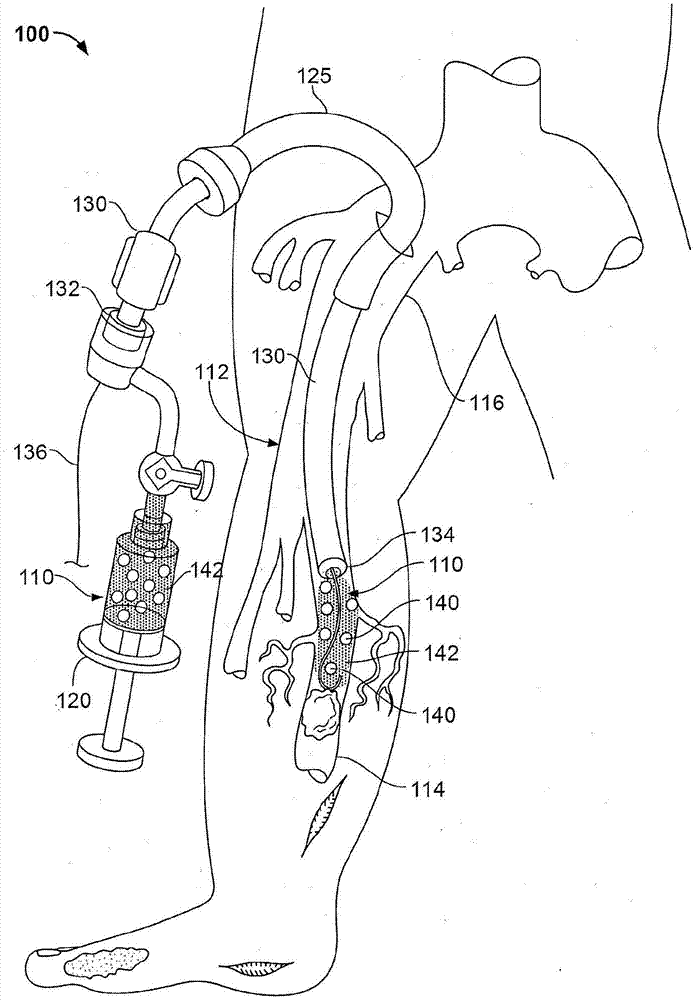
图1是根据本披露的不同实例的用于在患者的外周脉管系统112内递送可注射组合物110的示例性系统100的示意图。在一些情况下,系统100可以在患者的动脉或静脉脉管系统内递送可注射组合物110。在一些情况下,系统100可以配置用于在患者的外周脉管系统或冠状脉管系统内递送可注射组合物。在一些情况下,系统100可以配置用于在患者的神经血管区域内递送可注射组合物110。本文提供的系统100可以用于在血管114或血管系统(即,循环系统)内递送可注射组合物110的各种医学应用。
图1的示例性装置包括注射器120、导引鞘125、递送导管130和通过导管130递送的可注射组合物110。所描绘的系统100示出了可释放地偶联到递送导管130的近端132(例如,毂座或歧管)的注射器120(例如,手动操作或机器操作的注射器)。所描绘的递送导管包括在近端和远端尖端134之间延伸的细长管状轴。递送导管130的尺寸和形状可以调整成容纳在导引鞘125的内腔中。导引鞘125可以在股切口处插入股血管116(例如,股动脉)中并且朝向下肢区域推进到外周脉管系统中。导管130可以插入并延伸穿过鞘125的内腔进入下肢区域。本文提供的可注射组合物110可以含有包封在一个微球140(其也可以被称为微珠)或多个微球140内的一种或多种治疗剂。可注射组合物110可以由注射器120供应至导管130并通过导管130的内腔递送至脉管系统,并在导管130的远端尖端134处释放至血流中。
在使用中,用于递送可注射组合物110的递送导管130可以由医疗从业者在心脏导管插入实验室中使用荧光镜检查来引入患者中。通过在导丝136上推进导管,可以使导管130的远端尖端134被引导到患者脉管系统内的所希望的位置。注射器120可以由医疗从业者在医疗过程期间用可注射组合物110填充、或者由公司(例如制造商或分销商)预填充。注射器120可以通过连接器(例如通过鲁尔接头(如图1所示)或锥形尖端(未示出))连接到导管130。一旦导管130的远端尖端134定位在所希望的位置,注射器120可以由医疗从业者或机器致动。可以释放可注射组合物110,使得各自含有治疗剂的微球140分散在患者的靶脉管系统区域内。微球140可以在接近的预定时间或在最小预定时间之后降解和释放治疗剂,这可以通过微球140的聚合物膜(或也被称为“壳”)的降解速率来控制。
在本文提供的不同实施例中,组合物110可以包括不同的合适的生物相容性载体和含有治疗剂(例如干细胞)的微球140。在一些情况下,组合物110可以包括在载体142(或干细胞溶液)中的微球110的悬浮液。在一些情况下,组合物的组分(例如,微球140和载体142)的合适重量百分比产生具有接近血液粘度的粘度的溶液。
在一些情况下,组合物110包括按该组合物110重量计从约10%至约90%范围内的量的微球140(及其中的内容物),以及按该组合物110重量计从约90%至约10%范围内的量的载体142。在一些情况下,组合物110包括按该组合物110重量计从约10%至约50%范围内的量的微球140,以及按该组合物110重量计从约90%至约50%范围内的量的载体142。在一些情况下,组合物110包括按该组合物110重量计从约1%至约20%范围内的量的微球140,以及按该组合物110重量计从约99%至约80%范围内的量的载体142。优选地,在一些情况下,组合物110包括按该组合物110重量计从约30%至约50%范围内的量的微球140,以及按该组合物110重量计从约70%至约50%范围内的量的载体。更优选地,在一些情况下,组合物110包括按该组合物110重量计从约35%至约45%范围内的量的微球140,以及按该组合物110重量计从约65%至约55%范围内的量的载体。
合适的载体可以包括液体载体,例如水基溶液或非水性(例如有机)溶液。示例性液体载体可以包括但不限于纯化水、蒸馏水、盐溶液或血清(例如,牛血清或人血清白蛋白(hsa))。
包括可降解微球的组合物
本文提供的可注射组合物可以包括微球,每个微球包括含有可生物降解的聚合物膜的壁和治疗剂。聚合物膜包封包含于每个微球内的治疗剂。治疗剂的包封可以允许治疗剂的受控释放。包封还可以保护治疗剂免于过早降解。每个微球任选地包封本文所述的合适的载体(例如,液体载体),用于形成含有治疗剂的悬浮液。在一些情况下,悬浮微球的液体载体和将治疗剂悬浮在微球内的液体载体可以基本上相同、基本上相似或彼此不同。
每个微球140可以包括一系列合适重量百分比的聚合物膜和治疗剂。在一些情况下,治疗剂的重量百分比可以被配置为每个微球递送合适体积的治疗剂。在一些情况下,聚合物膜的重量百分比可以被配置为在其降解之前为微球提供合适的结构稳定性,以及合适的降解时间,在该合适的降解时间中微球的聚合物膜分解并允许治疗剂从微球内部释放。例如,在一些情况下,每个微球包括包括按微球140重量计从约2%至约50%(例如括按微球140重量计从约5%至约40%、从约10%至约30%、从约5%至约20%、从约从约2%至约5%、从约5%至约10%、从约10%至约20%、从约20%至约30%或括按微球140重量计从约30%至约50%)范围内的量的聚合物膜。在一些情况下,每个微球包括包括按微球140重量计从约50%至约98%(例如,括按微球140重量计从约55%至约95%、从约60%至约80%、从约50%至约70%、从约70%至约80%、从约80%至约90%、从约90%至约98%)范围内的量的治疗剂。
在一些情况下,微球140可以包括一系列合适重量百分比的聚合物膜、治疗剂和载体(例如盐水)。在一些情况下,治疗剂和载体的重量百分比被配置为实现粘度接近血液粘度的溶液(例如,悬浮液)。例如,在一些情况下,每个微球包括按微球140重量计从约10%至约90%范围内的量的治疗剂和按微球140重量计从约90%至约10%范围内的量的载体。在一些情况下,微球包括按微球140重量计从约10%至约50%范围内的量的治疗剂,以及按微球140重量计从约90%至约50%范围内的量的载体。在一些情况下,每个微球140包括按微球140重量计从约1%至约20%范围内的量的治疗剂,以及按微球140重量计从约99%至约80%范围内的量的载体。优选地,在一些情况下,每个微球140包括按微球140重量计从约30%至约50%范围内的量的治疗剂,以及按微球140重量计从约70%至约50%范围内的量的载体。更优选地,在一些情况下,每个微球140包括按该微球组合物140重量计约40%的量的治疗剂,以及按该微球组合物140重量计约60%的量的载体。
如本文所使用的,微球140可以包括不同形状,包括但不限于球形或圆柱形。本文提供的可注射组合物的微球140可以具有一系列合适的直径。例如,在一些情况下,在植入之前,微球140的直径可以在从约10微米至约5,000微米(例如从约20微米至约2,000微米、从约50微米至约1,000微米、从约100微米至约500微米、从约200微米至约400微米、从约10微米至约50微米、从约20微米至约70微米、从约50微米至约100微米、从约70微米至约150微米、从约100微米至约200微米、从约150微米至约350微米、从约200微米至约500微米、从约500微米至约1,000微米、从约1,000微米至约2,000微米、从约2,000微米至约5,000微米、从约100微米至约300微米、从约200微米至约300微米、从约250微米至约400微米或从约200微米至约5,000微米)的范围内。在一些情况下,微球的平均直径可为约10微米(例如,约50微米、约100微米、约200微米、约250微米、约300微米、约400微米、约500微米、约1毫米、约2毫米或约5毫米)。
本文提供的微球140的尺寸可以调整至合适体积的范围。在一些情况下,每个微球140的尺寸可以调整至包含从约0.1ml至约2ml(例如,从约0.1ml至约1.5ml、从约0.2ml至约1.2ml、从约0.3ml至约1.0ml、从约0.5ml至约0.7ml、从约0.1ml至约0.3ml、从约0.3ml至约0.5ml、从约0.5ml至约0.7ml、从约0.7ml至约1.0ml、从约1.0ml至约1.5ml或从约1.5ml至约2.0ml)体积的体液。
本文提供的每个微球140可以包括由可生物降解的聚合物制成的聚合物膜壁,用于包封治疗剂。本文提供的微球140的聚合物膜可以具有任何合适的厚度。合适的厚度可以基于一种或多种因素,例如,特定治疗处理类型、治疗剂量率和患者的健康。在一些情况下,聚合物膜的厚度与微球直径成比例。例如,聚合物膜厚度可以为从约5%至约20%(例如从约5%至约15%、从约10%至约15%、从约5%至约10%或从约5%至约7%)范围内的微球直径。在一些情况下,聚合物膜的厚度可以在从约0.5微米至约1,000微米(例如从约0.5微米至约750微米、从约1微米至约500微米、从约5微米至约250微米、从约10微米至约100微米、从约25微米至约50微米、从约0.5微米至约1微米、从约1微米至约10微米、从约10微米至约50微米、从约50微米至约100微米、从约100微米至约500微米或从约500微米至约1,000微米)的范围内。
本文提供的可注射组合物可以包括微球,其具有合适的聚合物膜降解速率以释放其中包含的治疗剂。可以改变降解的速率以实现所希望的降解时间,其中该降解时间是微球140的聚合物膜分解并允许治疗剂从微球140的内部释放的时间量。在一些情况下,降解时间可以在从约5分钟至约72小时(例如从约15分钟至约60小时、从约30分钟至约48小时、从约60分钟至约24小时、从约1小时至约24小时、从约2小时至约12小时、从约3小时至约6小时、从约5分钟至约30分钟、从约30分钟至约60分钟、从约1小时至约3小时、从约3小时至约6小时、从约6小时至约12小时、从约12小时至约24小时、从约24小时至约48小时、从约1小时至约48小时、从约6小时至约24小时、从约12小时至约24小时、从约24小时至约48小时或从约48小时至约72小时)的范围内。
本文提供的可注射组合物可以包括微球,该微球包括用于含有可生物降解的聚合物膜的壁的合适材料。在一些情况下,合适的可生物降解的聚合物膜包括对患者血液中的酶促降解敏感的材料。可生物降解的聚合物膜的示例性材料可以包括但不限于聚乳酸(pla)、聚乙醇酸(pga)、pla和pga的共聚物、聚-l-丙交酯(plla)、聚-d,l-丙交酯(pdla)、聚己内酯(pcl)及其组合。
可注射组合物可以含有不同合适的治疗剂。示例性治疗剂可以包括但不限于干细胞、腺病毒、化学治疗剂、免疫抑制剂、蛋白质、核酸及其组合。干细胞可以用于组织重建、再生和/或修复。示例性干细胞可以包括但不限于从成年组织分离的间充质干细胞,诱导的多能干细胞(ips细胞或ipsc)、胚胎干细胞及其组合。在一些情况下,治疗剂包括有效量的蛋白质,例如据称激活免疫系统的造血祖细胞抗原cd34。在一些情况下,治疗剂可以包括另外的成分,例如冷冻培养基,例如用于保存治疗剂。
本文提供的可注射组合物可以用于递送治疗剂以治疗不同疾病。本文提供的可注射组合物还可以将治疗剂递送到身体的不同位置,包括但不限于肾系统,或脑、心脏或四肢内的血管系统。例如,本文提供的可注射组合物可以将一种或多种治疗剂递送到靶血管区域并随时间提供受控释放以治疗靶区域。
包括快速和缓慢降解微球的组合物
在一些情况下,本文提供的可注射组合物可以包括含有第一微球(或多个第一微球)和第二微球(或多个第二微球)的液体载体,其中第一微球具有与第二微球不同的组成和/或不同的特征(例如,释放曲线)。例如,在一些情况下,第一微球可以包括如下聚合物膜,该聚合物膜具有与第二微球的聚合物膜不同的降解速率(例如,更快或更慢的降解速率)。在一些情况下,第一微球的聚合物膜可以包括与第二微球的聚合物膜不同的材料。在一些情况下,第一微球和第二微球的聚合物膜可由不同类型的聚合物、包括不同单体单元的共聚物、或具有不同比例的至少两种单体的共聚物制成。
在一些情况下,第一微球的聚合物膜可以具有与第二微球的聚合物膜不同的厚度,以产生具有不同降解时间的至少两种或更多种微球。在一些实例中,第一微球的聚合物膜具有比第二微球的聚合物膜更薄的壁,使得第一微球具有比第二微球更短的降解时间。在一些实例中,第一微球的聚合物膜通常可以比第二微球的聚合物膜更厚,使得第一微球将具有比第二微球更长的降解时间。因此,基于第一微球相对于第二微球的聚合物膜的厚度比,第一微球可以被配制为比第二微球更快或更慢地释放治疗剂。例如,在一些情况下,第一微球相对于第二微球的平均壁厚的比例可以是约1:1、1:2、1:3、1:4、1:5、5:1、4:1、3:1或2:1。在一些情况下,第一微球相对于第二微球的平均壁厚的比例可以在从约1:1至约1:5(例如从约1:1至约1:4、从约1:1至约1:3、从约1:1至约1:2、从约1:2至约1:4、从约1:2至约1:3、从约1:3至约1:4或从约1:4至约1:5)的范围内。在一些情况下,第一微球相对于第二微球的平均壁厚的比例可以在从约5:1至约1:1(例如从约5:1至约2:1、从约5:1至约3:1、从约5:1至约4:1、从约4:1至约1:1、从约4:1至约2:1、从约4:1至约3:1、从约3:1至约1:1、或从约3:1至约2:1或从约2:1至约1:1)的范围内。
图2是说明性地比较具有不同降解时间的两种不同示例性微球(例如,缓慢释放微球和快速释放微球)的图200。本文提供的组合物的某些实施例包括至少两种不同类型的微球,其中每种微球类型具有不同的降解速率。如本文所讨论的,组合物可以包括快速释放微球微球和缓慢释放微球,其中与缓慢释放微球的壁的平均降解速率或降解时间相比,快速释放微球的壁具有更快的平均降解速率或更短的降解时间间隔。如图中所描述的,示例性快速释放微球可能与聚合物(外部)膜的低释放时间和高降解速率相关,而示例性缓慢释放微球与聚合物膜的高释放时间和低降解速率相关。具有可变释放的微球的可注射组合物的益处包括允许医疗从业者在单次血管内手术期间给予患者治疗,该治疗在给定的时间段内提供多种治疗剂暴露。
本文提供的可注射组合物可以由合适的快速释放降解时间和合适的缓慢释放降解时间制备。例如,在某些情况下,快速释放微球可以在24小时内(例如,在1小时、3小时、6小时、9小时、12小时或24小时内)降解,并且缓慢释放微球可以在24小时和72小时之间(例如,25小时、30小时、40小时、48小时、54小时、60小时或72小时)降解。在一些情况下,快速释放微球可以在1周内(例如,在1天、2天、3天、4天、5天、6天或7天内)降解,并且缓慢释放微球可以从约1周至约1个月(1周、2周、3周、4周、1个月)降解。在一些情况下,缓慢释放微球可以具有比快速释放微球的降解时间大约1.1、约1.2、约1.5、约2、约3、约4、约5、约10、约20或大于20倍的降解时间。在一些情况下,在快速释放微球降解后约1小时至约1个月(例如,约1小时、约2小时、约3小时、约6小时、约12小时、约24小时、约48小时、约54小时、约60小时、约72小时),缓慢释放微球降解。
本文提供的可注射组合物的某些实施例包含含有不同微球内材料的至少两种或更多种微球。例如,在一些情况下,本文提供的可注射组合物可以包括第一微球,该第一微球含有与第二微球的治疗剂不同的治疗剂。在一些情况下,第一微球和第二微球可以含有不同浓度的相同治疗剂。
包括多包封微球的组合物
图3是在患者的外周脉管系统312内递送可注射组合物310的另一示例性血管内递送系统300的示意图。图1的示例性装置包括供应源320、递送导管330、任选的分配装置335、以及由导管330递送的可注射组合物310。导管330可以使用导丝336定位在解剖结构内,并且任选地被引入导引鞘(未示出)。所描绘的系统300示出了供应源320,该供应源320偶联到导管330的侧端口337并且与其处于流体连通。递送导管330可以在股切口处插入股血管316(例如,股动脉)中并且在外周脉管系统内朝向患者的下肢延伸。分配装置335可以通过递送导管330的近端332(例如,毂座或歧管)处的开口插入,并且任选地包括杯形尖端335。如所描述的,本文提供的可注射组合物310由供应源320提供、通过递送导管330递送、并且在导管330的远端尖端334处释放到患者的脉管系统312中。可注射组合物310含有包封在一个或多个多包封微球340内的治疗剂。如图3所示,多包封微球340包括包封在另一个(较大的)微球344内的至少一个(较小的)微球342。在一些情况下,可注射组合物可以通过推进分配装置335而被输送通过导管330,使得杯形尖端接触一个或多个多包封微球的至少一部分并推动一个或多个微球340通过导管330的内腔并到达靶递送部位。
在一些实施例中,本文提供的装置含有包括多包封微球340的组合物,其中至少一个(较小的)微球342被包封在另一个(较大的)微球344内,以提供在不同时间将治疗剂递送到脉管系统中或在脉管系统内的不同位置释放药剂的益处。本文提供的可注射组合物310的某些实施例包括多包封微球340,这些多包封微球340允许治疗剂的受控的、延长的递送。外微球344可以包括含有可生物降解的聚合物膜的壁,该可生物降解的聚合物膜包封任选地悬浮在载体中的治疗剂、和至少一个较小的(内)微球342。外微球344的聚合物膜包封治疗剂和包含在外微球344内的内微球342。治疗剂在外微球344内的包封可以允许治疗剂和其中包含的内微球342的受控释放。内微球342还包括含有可生物降解的聚合物膜的壁、和任选地悬浮在载体中的治疗剂。内微球342包封治疗剂并允许治疗剂的延长的、分阶段的释放。
在一些情况下,外微球可以包括多于一个的内微球(例如,两个或更多个微球、三个或更多个微球、四个或更多个微球、五个或更多个微球、十个或更多个微球、二十个或更多个微球、三十个或更多个微球、四十个或更多个微球或五十个或更多个微球)。
本文提供的可注射组合物310的一些实施例包括多包封微球(未显示)。例如,在一些情况下,本文提供的可注射组合物310可以包括两个内微球;第一内微球,其包封第二内微球。在一些情况下,本文提供的可注射组合物可以包括三个、四个、五个或多于五个内微球,其中除了最小的微球,每个微球被包封于另一个微球内。
图4-6是显示血管314内的图3中所示的可注射组合物310的示例性多包封微球340的不同降解阶段的示意图。参考图4,本文提供的可注射组合物310的微球340包含外微球350。外微球350包括含有包封治疗剂354(和任选的载体)的生物可降解聚合物膜352的壁,和内微球360。在注射到脉管系统后,外微球350可以从注射位置处的较大血管行进到脉管系统内的较小血管。在一些情况下,外微球350最终可以容纳在血管314内,该血管314具有与外微球350的外径相当的腔直径,如图4所示。因此,外微球350的外径可以预先确定以靶向特定血管尺寸或尺寸范围,以释放治疗剂354。
参考图5,外微球350的聚合物膜352随时间降解并最终将其内部内容物(例如,治疗剂354和任选的载体)释放到血管314中。一旦聚合物膜350降解,先前包含在外微球350的聚合物膜352、和内微球360的聚合物362之间的治疗剂354释放到脉管系统中。外微球350的降解也释放内微球360。内微球360具有比外微球350更小的直径,因此允许内微球360行进到脉管系统内的较小血管314。因此,多包封的微球340提供了靶向两种或更多种血管尺寸以释放治疗剂354的益处。多封装微球体340的另一个益处包括为患者提供治疗剂354的多次暴露,因为内微球360不会开始降解,直到外微球350充分降解并且允许内微球360暴露于血液和其中的蛋白质。
参考图6,在释放包含在内微球360中的治疗剂364之前,内微球360最终可以容纳在较小的血管内。内微球360的聚合物膜362随时间降解并最终将包含在内微球360内的治疗剂364释放到脉管系统中。由于外微球350和内微球360的顺序释放,本文提供的可注射组合物340的优点包括在患者体内提供受控的、延长的治疗剂释放以及沿着脉管系统的不同位置处的靶向(血管尺寸)释放。
制造方法
有许多方法可以用于制造本文提供的可注射组合物的微球。可以取决于所用的特定材料的示例性方法可以包括但不限于相分离或沉淀方法、乳液/溶剂蒸发方法、喷雾方法、挤出方法、注射模制方法、注射或显微注射方法、球形吹制方法、静电纺丝方法、3d打印及其组合。涉及用于填充本文提供的微球的注射的方法可以任选地包括用于密封一个或多个注射部位的加热步骤。
在一些情况下,本文提供的可注射组合物的微球可以通过使用微粒制备技术制备,如以下参考文献中所述:makadia,h.k.和siegel,s.j.,polylactic-co-glycolicacid(plga)asbiodegradablecontrolleddrugdeliverycarrier[作为可生物降解的可控药物递送载体的聚乳酸-共-乙醇酸(plga)],polymers[聚合物](巴塞尔);3(3):1377-1397;2011。
用于产生本文提供的可注射组合物的微球的一些示例性制造方法包括使用不混溶的溶液方法、或乳液和溶剂蒸发方法。例如,微球可以使用溶剂蒸发和溶剂萃取方法制备,如描述于:jainr.a.,themanufacturingtechniquesofvariousdrugloadedbiodegradablepoly(lactide-co-glycolide)(plga)devices.[不同载药可生物降解的聚(丙交酯-共-乙交酯)(plga)装置的制造技术]biomaterials[生物材料];21:2475-2490;2000(“jain参考文献(thejainreference)”)。
在一些情况下,不混溶的溶液方法可以包括配制溶液以形成聚合物膜(即壳)。在一些情况下,不混溶的溶液方法可以包括配制溶液以形成聚合物膜(即壳)。示例性溶液可以通过溶解所希望的量的聚合物溶液(例如,溶剂(如二甲基甲酰胺(dmf))中的plga和/或plla)形成。可以将不混溶的治疗剂添加到聚合物膜溶液中以在溶液内形成球体。随后可以除去任何过量的溶液以产生的微球,这些微球包括涂覆在由壳溶液制成的固化聚合物膜中的治疗剂。
用于产生本文提供的可注射组合物的微球的某些示例性制造方法可以使用“气泡形成”方法。例如,可以使用例如针注射器将治疗剂注射到软可生物降解的材料(例如,聚合物,如plga或plla)的薄层,以在可生物降解的材料层内形成填充有治疗剂的口袋(或气泡)。在一些情况下,可以添加治疗剂直到可生物降解的层伸展以形成本文所述的微球的壁。微球的一个或多个注射部位(即穿刺部位)可以通过在接近或处于可生物降解的材料层的玻璃化转变温度或熔融温度的温度下应用加热来密封,以形成在可生物降解的材料层内包封治疗剂的微球。
用于产生本文提供的可注射组合物的微球的一些示例性制造方法可以包括使用挤出方法。在一些情况下,可以通过挤出染料来将材料(例如,plga)挤出,以形成微管或微丸。每个微管或微丸可以用治疗剂填充,例如通过用针注射器将治疗剂注射到微管或微丸的中心部分。在一些情况下,可以同时切割和密封注射的微管,以形成填充有治疗剂的圆柱形囊泡。
在一些情况下,本文提供的微球可以通过使用喷雾方法来制备。例如,治疗剂可以作为液滴分散在聚合物膜(例如,plga膜)上。在将治疗剂的液滴放置在聚合物膜上之后,可以将聚合物膜溶液喷雾到液滴上以形成包括聚合物膜的微球,该聚合物膜包封治疗剂的液滴。在一些情况下,如jain参考文献所述的喷雾干燥方法以及其他类型的微球形成方法(例如,双乳液方法或相分离方法)可以用于产生本文提供的微球。参见2478-2480处的id。
所提供的微球的一些实施例可以使用模制方法和注射方法制备。例如,在一些情况下,可以用本文提供的合适的聚合物材料注射模具以产生微球的壁。一旦完成微球壁,就可以使用在一个或多个位置处刺穿壁的注射器、用治疗剂来填充内部中空区域。刺穿的位置可以任选地通过使用加热方法来密封,该加热方法允许聚合物膜壁回流并填充任何穿刺。
在一些情况下,3d打印可以用于形成本文提供的微球。例如,3d打印机的第一喷嘴可以用于形成第一微球的壁,而3d打印机的第二喷嘴用治疗剂填充第一微球的内腔。可选地,3d打印机可以用于形成壁并填充第一微球内的第二微球的内腔。在一些情况下,3d打印机可以用于形成中空(空的)微球的壁,使得内部中空区域可以通过在一个或多个位置处刺穿壁的注射器来填充治疗剂。在注射方法之后可以应用任选的加热方法以密封任何穿刺部位。
可以使用静电纺丝方法制备微球的一些实施例。例如,治疗剂的一个或多个液滴可以以所希望的接触角(例如,以相对于水平面的147°角)放置在基板(或平坦表面)上,以促进液滴的移动。当静电纺丝材料沿着平坦表面滚动以形成微球时,静电纺丝材料可以布置在液滴上,在微球中电纺丝材料形成包封治疗液滴的聚合物壁。
应当理解,本文提供的实施例的一个或多个设计特性可以与本文提供的其他实施例的其他特性组合。实际上,可以创建将来自本文提供的两个或更多个设备设计的不同特性进行组合的混合设计,并且这些设计是在本披露的范围内。
虽然本说明书含有许多具体的实现细节,但这些不应当被解释为对本披露的范围或可以要求保护的范围的限制,而是应当被解释为是特定于特定披露的特定实施例的特性的说明。本说明书中在分开的实施例的背景下所描述的某些特性也可以组合地被实现在单个实施例中。与此相反,在单个实施例的背景下描述的不同特性也可以分开地或以任何适合的子组合形式被实现在多个实施例中。此外,尽管特性在上文可以被描述为在某些组合中起作用并且甚至最初也是如此要求保护的,但是在一些情况下,可以从组合中除去来自所要求保护的组合的一个或多个特性,并且所要求保护的组合可以涉及子组合或子组合的变型。
除了针对上述和下面要求保护的教导之外,还考虑了具有上述特性和下面要求保护的特性的不同组合的系统、设备和方法。因此,该说明还涉及具有下面要求保护的从属特性的任何其他可能组合的其他设备和/或方法。
在前述说明中已经阐述了许多特征和优点,包括不同替代方案以及装置和/或方法的结构和功能的细节。本披露仅旨在是说明性的,并且因此不旨在是穷尽性的。对于本领域技术人员显而易见的是,可以在由所附权利要求表达的条款的广义通用含义所指明的全部范围内进行各种修改,尤其是在各部分的结构、材料、元件、组件、形状、尺寸和安排(包括本披露的原理内的组合)方面。在这些不同修改不脱离所附权利要求的精神和范围的程度上,它们旨在包含在涵盖于其中。本文提及的所有参考文献、出版物和专利,包括其中包括的图和附图,均通过援引以其全文并入。
- 还没有人留言评论。精彩留言会获得点赞!