温度敏感性复合物及其制备方法与流程
本发明涉及一种温度敏感性复合物及其制备方法。
背景技术
通过对温度敏感性水凝胶的作用原理的理解,已经报道了许多应用和开发。例如,由呈现温度诱导相变的普朗尼克(pluronic)f-127和控制粘度的透明质酸钠组成的聚合物混合物在室温下保持其液态并且在通过注射递送到体内时固化。由此,已经提出了在伤口中稳定化[韩国未审查专利申请公开第2007-0100701号;专利文献1],并且已经提出了使用普朗尼克f-127和透明质酸钠的共聚物作为抗癌剂递送系统的研究实例[chempharmbull57(5)453-458(2009);非专利文献1]。最近,本发明人报道了纳米颗粒/水凝胶复合物(载有艾塞那肽的普朗尼克f-68纳米颗粒与f-127一起),并且证实了一次给药具有三天或更长时间的血糖调节作用[europeanjournalofpharmaceuticsandbiopharmaceutics88,664-669(2014);非专利文献2]。
然而,由于上述的药物递送系统都依赖于递送系统的聚合物浓度,所以当给药时它们容易溶解(或分解)使得呈现出由于不稳定性而导致的快速药物释放状态。特别地,当含有水溶性药物或蛋白质药物和抗体时,由于在水溶液中的优异溶解性,诱导快速药物释放,因此难以实现期望的功效。为了克服这些困难,需要重复给予药物,并且在昂贵的蛋白质药物或抗体的情况下预期治疗成本增加。作为专利文献1中提出的替代方案,使用温度敏感性聚合物和各种类型的载药纳米颗粒的组合,但是使用聚合物和纳米颗粒的复合材料未实现显著的功效改善。
因此,存在对一种新类型的温度敏感性复合物的需求,该温度敏感性复合物在体内具有增加的稳定性,以粉末的形式制备时保持在水溶液中优良的再分散性并且表现出通过控制药物释放速率呈现出持续的药物功效。
技术实现要素:
技术问题
因此,本发明人曾试图解决这些问题,从而开发具有持续释放模式的新的温度敏感性药物递送载体,其包括:纳米颗粒,包含呈现温度诱导相变的生物相容性聚合物和药物;及稀释剂,从而完成了本发明。
技术方案
作为实现上述目的的手段,本发明提供一种温度敏感性复合物,其包含:纳米颗粒,包含呈现温度诱导相变的生物相容性聚合物和药物;及稀释剂。
有益效果
本发明的温度敏感性复合物可以用作药物递送系统,该药物递送系统保持稳定,当以粉末的形式制备时显示出在水溶液中优异的再分散性,并且通过控制药物释放速率表现出持续的药物释放。
特别地,作为根据本发明的温度敏感性复合物的组分的纳米颗粒由具有亲水性表面的普朗尼克聚合物组成,因此对于溶解度低的疏水性药物的递送非常有用。
附图说明
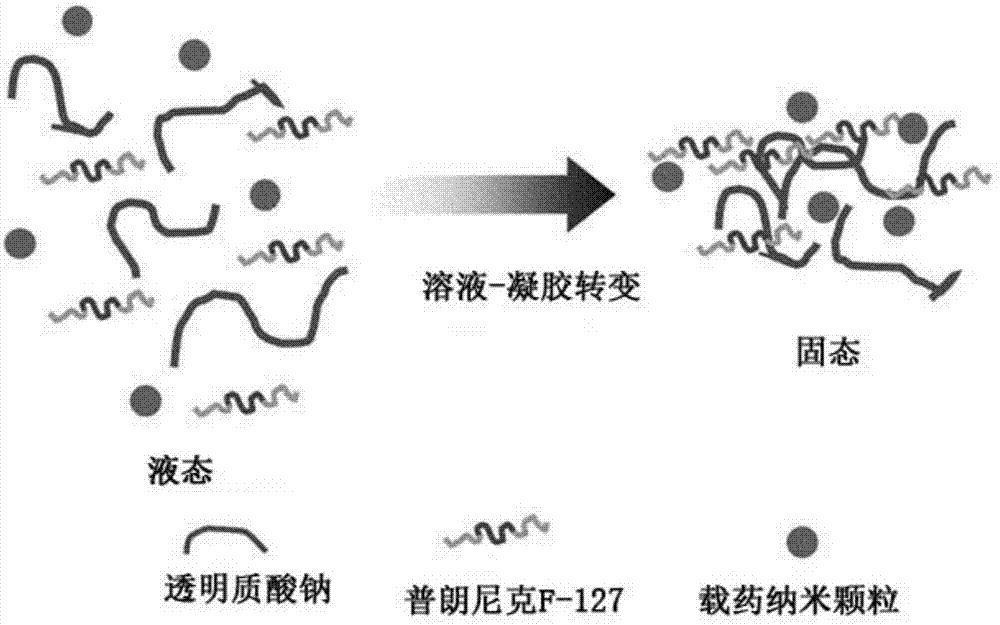
图1是根据韩国未审查专利申请公开第2007-0100701号的温度敏感性复合物的示意图。
图2是根据本发明的实施例1和2的温度敏感性纳米颗粒/稀释剂复合物的示意图。
图3是根据本发明的实施例3的温度敏感性纳米颗粒/稀释剂复合物的示意图。
图4是根据实施例1制备的温度敏感性复合物的透射电子显微镜(tem)图像[含有萘普生的纳米颗粒(用虚线圆圈标记)分散在sh网络中]。
图5是显示由透明质酸钠和载有药物的普朗尼克f-127纳米颗粒组成的复合物响应于从室温(25℃)到体温(37.5℃)的温度变化的机械强度变化的图(实施例1和2)。
图6是显示由透明质酸钠、普朗尼克f-127和药物组成的复合物响应于从室温(25℃)至体温(37.5℃)的温度变化的机械强度变化的图(对比例1和2)。
图7是显示在室温和体温下药物(萘普生)从根据实施例1和对比例1的复合物随时间推移的释放模式的图[sh+f-127纳米颗粒:实施例1,sh+f-127:对比例1]。
图8是显示在室温和体温下药物(萘普生)从根据实施例2和对比例2的复合物随时间推移的释放模式的图[sh+f-127纳米颗粒:实施例2,sh+f-127:对比例2]。
图9是显示根据实施例3的通过由普朗尼克f-127和药物组成的纳米颗粒以及由普朗尼克f-68和药物组成的纳米颗粒来组成的复合物响应于从室温(25℃)至体温(37.5℃)的温度变化的机械强度变化的图。
图10是显示根据对比例3的由普朗尼克f-127和普朗尼克f-68组成的聚合物复合物响应于从室温(25℃)至体温(37.5℃)的温度变化的机械强度变化的图。
图11是显示在室温和体温下药物(多柔比星)从根据实施例3和对比例3的复合物随时间推移的释放模式的一组图[f-127纳米颗粒+f-68纳米颗粒:实施例3,f-127+f-68:对比例3]。
图12是显示在室温和体温下药物(多西紫杉醇)从根据实施例3和对比例3的复合物随时间推移的释放模式的一组图[f-127纳米颗粒+f-68纳米颗粒:实施例3,f-127+f-68:对比例3]。
具体实施方式
本文所用的术语“温度诱导相变”是指溶液-凝胶相变,其中温度诱导相变聚合物(例如普朗尼克,pluronic)溶液在特定温度或更低温度时保持为液(溶液)相并且当环境保持在特定温度或更高温度时固化(凝胶)。这是因为普朗尼克的临界胶束浓度(cmc)取决于温度(参见非专利文献2)。
表现出温度诱导相变的生物相容性聚合物包含药物,并且以包围药物的方式与颗粒表面结合,具体地,该聚合物是聚(氧化乙烯)-聚(氧化丙烯)-聚(氧化乙烯)(peo-ppo-peo)共聚物。
peo-ppo-peo共聚物是由式1表示三嵌段共聚物。
[式1]
ho-(c2h4o)a(c3h6o)b(c2h4o)c-h
在式1中,b是10或更大的整数,并且a+c是使得式的末端例如((c2h4o)a和(c2h4o)c)的含量为peo-ppo-peo共聚物的5至95wt%,优选20至90wt%的数。
peo-ppo-peo共聚物的性能取决于聚氧丙烯嵌段与聚氧乙烯嵌段的比,即式1中b与a+c的比。peo-ppo-peo共聚物可以是通过已知文献中描述的方法制备或预先制备的市售产品。本发明的制备方法中使用的peo-ppo-peo共聚物没有特别限制,但可具有约1,000至16,000的分子量。
同时,peo-ppo-peo共聚物被称为泊洛沙姆(poloxamer)或普朗尼克。泊洛沙姆在室温下是固体,并且可溶于水和乙醇。根据本发明的示例性实施方式,peo-ppo-peo共聚物可以是选自由普朗尼克f-68、普朗尼克f-127、普朗尼克f-188、普朗尼克f-237、普朗尼克f-338和普朗尼克f-407组成的组中的至少一种,但是本发明不限于此。例如,普朗尼克f-188是式1中b为30且a+c为75的化合物,并且是指分子量为约8,350的泊洛沙姆。另外,当普朗尼克f-127含量为20wt%时,在室温(25℃)下形成凝胶(固化)。当普朗尼克f-127的浓度稀释至15wt%时,普朗尼克f-127具有在约30℃下形成凝胶的性质。
所述药物包括难溶性药物、水溶性药物、蛋白质药物和用于分子成像的造影剂,但本发明不限于此。难溶性药物是指在水性介质中溶解度低的药物,也指疏水性药物,例如抗癌剂或用于心血管疾病(例如动脉硬化、高脂血症等)的药物,但是本发明不限于此。具体地,难溶性药物包括:例如紫杉醇、多西紫杉醇、他莫昔芬(tamoxin)、阿那曲唑、卡铂、拓扑替康、贝洛替康、伊马替尼、伊立替康、氟尿苷、长春瑞滨、吉西他滨、亮丙瑞林、氟他胺、唑来膦酸盐、甲氨蝶呤、喜树碱、顺铂、长春新碱、羟基脲、链脲霉素、戊柔比星、洛伐他汀、辛伐他汀、氟伐他汀、阿托伐他汀、匹伐他汀、普伐他汀、罗苏伐他汀等,但本发明并不限于此。水溶性药物是指在水性介质中具有高溶解度的药物,例如布比卡因、罗哌卡因、多柔比星等,但本发明不限于此。大多数蛋白质药物具有表面电荷,其根据蛋白质的等电点在生理条件下可以是正电荷或负电荷,因此还可以称为离子型药物。蛋白质药物包括艾塞那肽、促红细胞生成素、血管内皮生长因子(vegf)、tgf-β等,但本发明不限于此。
包含呈现出温度诱导相变的生物相容性聚合物和药物的纳米颗粒是药物被包围或装载在作为外壳的呈现出温度诱导相变的生物相容性聚合物中的纳米颗粒。具体地,本发明的纳米颗粒可以是生物相容性纳米颗粒,其中本发明人制备的含药纳米颗粒被封装,并且peo-ppo-peo共聚物与其表面结合[具体描述与韩国未审查专利申请公开第2013-0084916号中所描述的相同]。或者,本发明的纳米颗粒为纳米脂质核存在于由peo-ppo-peo共聚物基质组成的壳中并且药物吸附在纳米脂质核的表面上的纳米颗粒[具体描述与韩国未审查专利申请公开第2007-0099767号中所描述的相同],但本发明不限于此。
稀释剂使得聚合物通过控制粘度被稀释到适当的浓度,从而使得聚合物在室温下保持为液相,而在体温下保持为固态例如凝胶,并且稀释剂可以例如为透明质酸钠;或为包含能够控制粘度的生物相容性且水溶性的聚合物和药物的纳米颗粒。用作稀释剂的纳米颗粒可以是其中纳米脂质存在于由peo-ppo-peo共聚物基质形成的外壳中并且药物吸附在纳米脂质核表面上的纳米颗粒,所述peo-ppo-peo共聚物基质由发明人根据韩国未审查专利申请公开第2007-0099767号预先制备。特别地,能够控制粘度的生物相容性且水溶性的聚合物可以是选自由普朗尼克f-68、聚乙烯醇(pva)、聚乙烯基吡咯烷酮和聚乙酸乙烯酯组成的组中的一种或多种,但是本发明不限于此。例如,普朗尼克f-68具有其35wt%水溶液在50℃或更高温度下形成凝胶的性质。
根据本发明的温度敏感性复合物在室温下保持为液相,而在体温下保持为固态例如凝胶,呈现出稳定性和再分散性,并显示出药物的持续释放,因此可以用作药物递送系统。
因此,本发明包括一种药物递送系统,其包括所述温度敏感性复合物。
此外,本发明提供一种制备温度敏感性复合物的方法,包括:
制备包含呈现温度诱导相变的生物相容性聚合物和药物的纳米颗粒;及
将所述纳米颗粒与稀释剂混合。
上述所有与温度敏感性复合物相关的内容可以直接应用或借鉴到制备温度敏感性复合物的方法中。
首先,在制备包含呈现温度诱导相变的生物相容性聚合物和药物的纳米颗粒的步骤中,制备了其中药物被包围或装载在作为外壳的显示出温度诱导相变的生物相容性聚合物中的纳米颗粒。
具体地,可以制备生物相容性纳米颗粒,其中本发明人使用根据韩国未审查专利申请公开第2013-0084916号的温度诱导相变方法预先制备的含药纳米颗粒被封装并且peo-ppo-peo共聚物与其表面结合,或者可以制备纳米颗粒,其中使用根据韩国未审查专利申请公开第2007-0099767号微胶囊化方法纳米脂质核存在于由peo-ppo-peo共聚物基质组成的壳中并且药物吸附在纳米脂质核的表面上,但本发明不限于此。
温度敏感性复合物通过将上文制备的纳米颗粒与稀释剂混合来制备。
通过上述方法制备的本发明的温度敏感性复合物可以容易地再分散,同时通过在溶液,例如水溶液中分散复合物而溶解以给予体内。另外,由于温度敏感性复合物可以通过使用生物相容性聚合物而不使用对人体显示出不利影响的有机溶剂或其它赋形剂的简单方法制备,因此可以实现稳定性和易加工性。此外,温度敏感性复合物具有改善的稳定性,因此可以以各种方式用作药剂。
本发明的实施方式
下文中,将参考根据本发明的实施例进一步详细描述本发明,但是本发明的范围不限于以下实施例。
[实施例]
实施例1:制备由透明质酸钠(sh)和载有疏水性药物(萘普生)的普朗尼克f-127纳米颗粒组成的温度敏感性复合物
使用韩国未审查专利申请公开第2013-0084916号中所述的温度诱导相变方法来制备包含普朗尼克f-127和药物的纳米颗粒。
简单地说,通过混合0.4g萘普生和0.1g聚乙二醇400(peg400)12小时来制备均匀的复合物。将0.4g泊洛沙姆(聚氧乙烯-聚氧丙烯-聚氧乙烯三嵌段共聚物,普朗尼克f-127)添加至混合物,随后的混合物在70℃下加热10分钟并搅拌5分钟。然后,当该混合物完全熔化并成为液体粘性物质时,停止搅拌,并将该混合物在室温下冷却,得到纳米颗粒。
另外,通过用50mg透明质酸钠与10ml蒸馏水混合来制备透明质酸钠水溶液,并通过进一步添加2g上文制备的水溶液中的纳米颗粒,从而制备的复合物水溶液。
如果必要,通过冻干储存上文制备的复合物水溶液。使用时,将冻干产品再分散于水溶液中。结果,制备了由载有疏水性药物(萘普生)的普朗尼克f-127纳米颗粒组成的温度敏感性复合物。
测量了温度敏感性复合物的机械性能(结果在误差范围内与图5所示相同),并测量了药物释放随时间的变化(图7)。
实施例2:制备由透明质酸钠(sh)和载有离子型药物(布比卡因)的普朗尼克f-127纳米颗粒组成的温度敏感性复合物
使用韩国未审查专利申请公开第2007-0099767号中所述的微胶囊化方法来制备包含普朗尼克f-127和药物的纳米颗粒。
使用超声制备20wt%的卵磷脂水溶液。此时,形成直径约65nm的卵磷脂纳米颗粒。将0.1g布比卡因添加至1ml卵磷脂纳米颗粒水溶液并与其混合。制备15wt%普朗尼克f-127水溶液,并将1ml普朗尼克f-127水溶液与卵磷脂/药物混合溶液混合,然后冻干,从而制备载有药物的核-壳型纳米颗粒。
另外,通过添加50mg透明质酸钠与10ml蒸馏水来制备透明质酸钠水溶液,然后将2g载有药物的核-壳型纳米颗粒进一步混合到水溶液中,从而制备复合物水溶液。
通过冻干储存上文制备的复合物水溶液。使用时,将冻干产品再分散于水溶液中。由此,制备了由载有离子型药物(布比卡因)的普朗尼克f-127纳米颗粒组成的温度敏感性复合物。
测量了温度敏感性复合物的机械性能(图5),并测量了药物释放随时间的变化(图8)。
实施例3:制备由含有普朗尼克f-127和药物的纳米颗粒以及含有普朗尼克f-68和药物的纳米颗粒组成的温度敏感性复合物
使用韩国未审查专利申请公开第2013-0084916号中所述的温度诱导相变方法来制备包含普朗尼克f-127和药物的纳米颗粒。
通过将75mg多西紫杉醇和0.1gsolutol混合12小时来制备均匀的复合物。将0.4g泊洛沙姆(聚氧乙烯-聚氧丙烯-聚氧乙烯三嵌段共聚物,普朗尼克f-127)添加至混合物,随后的混合物在70℃下加热10分钟并搅拌5分钟。然后,当该混合物完全熔化并成为液体粘性材料时,停止搅拌,并将该混合物在室温下冷却,以获得包含普朗尼克f-127和多西紫杉醇的纳米颗粒。
使用韩国未审查专利申请公开第2007-0099767号(稀释剂的制备)中所述的微胶囊化方法来制备包含普朗尼克f-68和药物的纳米颗粒。
使用超声制备20wt%的卵磷脂水溶液。此时,形成直径约65nm的卵磷脂纳米颗粒。将50mg多柔比星添加至1ml卵磷脂纳米颗粒水溶液并与其混合。制备15wt%普朗尼克f-68水溶液,并将1ml普朗尼克f-68水溶液与卵磷脂/药物混合溶液混合,然后冻干,从而制备载有普朗尼克f-68和多柔比星的核-壳型纳米颗粒。
通过将包含普朗尼克f-68和多柔比星的纳米颗粒(稀释液)和包含普朗尼克f-127和多西紫杉醇的纳米颗粒以2:8的重量比添加至水溶液中来制备25wt%的水溶液。
如果必要,通过冻干储存上文制备的复合物水溶液。使用时,将冻干产品再分散于水溶液中。由此,制备了由包含普朗尼克f-127和药物的纳米颗粒和包含普朗尼克f-68和药物的纳米颗粒组成的温度敏感性复合物。
测量了温度敏感性复合物的机械性能(图9),并测量了药物释放随时间的变化(图11和12)。
对比例1:制备由透明质酸钠(sh)、普朗尼克f-127和药物组成的温度敏感性聚合物复合物(药物不装载于普朗尼克f-127中)
通过将2g普朗尼克f-127、0.1g的萘普生和50mg透明质酸钠与10ml蒸馏水混合制备水溶液,从而制备萘普生分散于其中的聚合物复合物水溶液。
测量了温度敏感性复合物的机械性能(结果在误差范围内与图6所示相同),并测量了药物释放随时间的变化(图7)。
结果证实,由于萘普生的溶解度低,聚合物复合物中发生了沉淀。
对比例2:制备由透明质酸钠(sh)、普朗尼克f-127和药物组成的温度敏感性聚合物复合物(药物不装载于普朗尼克f-127中)
通过将2g普朗尼克f-127、0.1g的布比卡因和50mg透明质酸钠与10ml蒸馏水混合制备水溶液,从而制备布比卡因分散于其中的聚合物复合物水溶液。
测量了温度敏感性复合物的机械性能(图6),并测量了药物释放随时间的变化(图8)。
对比例3:制备由普朗尼克f-68、普朗尼克f-127、多柔比星和多西紫杉醇组成的温度敏感性聚合物复合物(药物不装载于普朗尼克f-127中)
通过将1.6g普朗尼克f-127、0.4g普朗尼克f-68、50mg的多柔比星和75mg多西紫杉醇与10ml蒸馏水混合制备水溶液,从而制备多柔比星和多西紫杉醇分散于其中的聚合物复合物水溶液。
测量了温度敏感性复合物的机械性能(图10),并测量了药物释放随时间的变化(图11和12)。
结果证实,由于多西紫杉醇的溶解度低,聚合物复合物中发生了沉淀。
实验例1:温度敏感性复合物的机械性能随时间的变化
使用实施例1和2各自的温度敏感性复合物、实施例3的温度敏感性纳米粒子复合物和对比例1,2和3中制备的复合物制备20wt%的复合物水溶液,在温度保持在25℃和37.5℃时测量其机械性能。
用instron500n测压元件(ag-x,岛津,日本)测量复合物的机械性能。在保持复合物的直径为5mm后,从上方向其垂直施加压力。在此,十字头速度为1mm/min,绘制了应力-应变曲线(图5、6、9和10)。图中获得的较高斜率表示更好的机械性能。在此基础上将温度保持在体温时,实施例1至3的温度敏感性复合物显示出比对比例1至3的温度敏感性聚合物复合物高得多的机械强度。基于这些结果,当本发明的复合物被地送至体内时,可以预期保持优异的稳定性。
实验例2:封装在温度敏感性复合物中的药物的释放模式
为了证实药物从本发明中的温度敏感性复合物的释放模式,进行如下的实验:
将每种20g的来自实施例1、2和3的温度敏感性复合物和来自实施例1、2和3的温度敏感性聚合物复合物放入透析袋中(截止过滤分子量-100,000),然后浸入20ml磷酸盐缓冲溶液(pbs,ph7.4)中。将温度保持在25℃和37.5℃,同时以600rpm搅拌。在预定时间处,取5ml磷酸盐缓冲溶液,通过hplc测量释放药物的量。取样后,完全移除剩余的磷酸盐缓冲溶液,并添加新的磷酸盐缓冲溶液。
参考实验结果(图7、8、11和12),在体温下,水溶性药物布比卡因(图8)和多柔比星(图11)的释放由于形成凝胶而减少,并且开始显示持续释放模式。此外,实施例1至3的温度敏感性复合物呈现出比对比例1至3的温度敏感性聚合物复合物更高的可持续性。
此外,在来自对比例1至3的温度敏感性聚合物复合物中,疏水性药物(萘普生和多西紫杉醇)沉淀,这是因为其在水性介质中的溶解度低,因此实验不能继续(参见图7和12)。因此,在来自实施例1的温度敏感性复合物的情况下,通过将疏水性药物加载到纳米颗粒中来维持水溶液中的稳定性和溶解性,因此与常规的温度敏感性聚合物复合物相比表现出更高的功能性。
- 还没有人留言评论。精彩留言会获得点赞!