一种双层人工血管及其制备方法与流程
本发明涉及一种功能化的双层人工血管,尤其涉及基于静电纺丝技术和热致相分离技术的一种新型介孔mirnas控释纳米球/肝素复合修饰的双层人造血管及其制备方法。
背景技术:
人造血管在临床上应用越来越普遍,在口径大于6mm的人造血管应用方面不如小口径人造血管面临的问题多,小口径血管在诸如冠状动脉和外周血管病变等心血管疾病治疗方面需求量很大。目前小口径人造血管面临的最主要的问题是不易随宿主周围环境进行适应性调整匹配,很容易导致血栓。通过组织工程与再生医学技术制备内层能够快速内皮化、外层具有能够促使平滑肌细胞长入的微观结构同时又具有很好的力学顺应性的血管支架,才能够满足临床上对小口径血管支架生物相容性、通畅性优异的力学性能的要求。
cn104921841a公开了一种双层结构的人工血管,该血管是由取向微米纤维内层和无规纳米纤维外层组成,但是单纯的合成高分子材料制备的血管有很多缺点,如:容易形成血栓、内膜增生、钙化及引起慢性炎症,同时不具有生长的潜能。
静电纺丝技术被广泛应用于制备组织工程支架,如cn102764171a公开了一种静电纺丝复合血管支架,而热致相分离技术被应用与制备人工血管的报道也已有文献报道,如cn104689382a公开了一种编织增强的纳米纤维小口径血管支架,采用了热致相分离法制备。由于热致相分离技术在制备三维支架时,获得的大部分是大孔结构的材料,同时其可选择的材料有限制,虽不如静电纺丝技术那么广泛应用,但与其他材料共混制备人造血管领域也有很好的应用。
但迄今为止,尚无采用静电纺丝技术和热致相分离技术结合的方法制备人工血管的报道。因此通过此此两种技术结合血管的功能化修饰制备出一种成熟的集力学性能和生物相容性于一体的多级功能化结构管状支架,将具有巨大的经济效益。
技术实现要素:
为了克服上述现有技术的不足,本发明提供了一种介孔mirnas控释纳米球/肝素复合修饰的双层人工血管及其制备方法。
本发明一方面提供了一种双层人工血管,该血管的内层为介孔mirnas控释纳米球/肝素复合修饰的可降解纳米纤维层,外层为大孔纳米纤维层。
其中,大孔纳米纤维层中的所述大孔的孔径介于20~150μm,优选为20~100μm。
进一步,所述介孔mirnas控释纳米球/肝素复合修饰的可降解纳米纤维由纤维丝纺成,所述纤维丝由芯层和皮层组成,所述芯层的成分为mirnas控释纳米球和肝素,所述皮层的材质为可降解纳米纤维。
优选地,所述介孔mirnas控释纳米球的粒径在120~150nm之间。
进一步,所述皮层的材质为可纺聚合物;可优选自c-peuu(聚氨酯脲酯)、plga(聚乳酸-羟基乙酸共聚物)、plla(聚左旋乳酸)、plcl(聚l-丙交酯-己内酯)、pdla(聚右旋乳酸)中的一种或几种。
在本发明的一种优选实施方式中,外层的所述大孔纳米纤维层的材质为可降解的c-peuu,孔径为20~100μm;在本发明的另一种优选实施方式中,外层的所述大孔纳米纤维层的材质为不可降解的tpu(热塑性聚氨酯),孔径为20~150μm。
进一步,上述双层人工血管为小口径人工血管;本发明所述小口径是指血管内径小于等于6mm;优选地,所述人工血管的内径小于等于5mm,且管壁厚度小于等于1.5mm;进一步优选地,所述人工血管的内径为1~3mm,且所述管壁厚度为0.6~1.0mm。
优选地,所述内层由同轴静电纺丝法制成。
优选地,所述外层由热致相分离法制成。
本发明另一方面提供了上述双层人工血管的制备方法,包括以下步骤:
1)制备介孔mirnas控释纳米球;
2)将介孔mirnas控释纳米球与肝素钠混合制成药物溶液;
3)将步骤2)中获得的药物溶液作为芯层,可降解聚合物纺丝液作为皮层,用同轴静电纺丝法纺得双层人工血管内层;
4)用热致相分离法将外层聚合物材料制成双层人工血管的外层。
优选地,所述mirnas为mirna200a、mirna21中的任意一种或两种。
进一步,所述介孔mirnas控释纳米球的制备方法的包括以下具体步骤:
a)将一定量的羧基化的介孔硅(msns-cooh)均匀分散到二甲基亚砜(dmso)中制成分散液一;
b)称取一定量的edc、nhs加入到上述分散液一中活化msns-cooh上的羧基;
c)将聚乙烯亚胺(pei)水溶液滴加入步骤b)获得的经羧基活化后的分散液一中,然后恒温振荡反应获得产物msns-pei,清洗所述产物;
d)将mirnas溶于一定量的n,n-二甲基甲酰胺(dmf)中,加入一定量的edc、nhs活化;
e)将步骤c)获得的msns-pei分散到dmf中制成分散液二;
f)将活化的mirnas溶液加入到分散液二中,然后恒温振荡反应,获得产物mirnas@msns纳米球。
其中,edc为1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐,nhs为n-羟基琥珀酰亚胺。
优选地,步骤a)中所述羧基化的介孔硅粒径在120~150nm之间,纳米硅表面羧基密度为3.0×10-2nmol/mg~3.5×10-2nmol/mg。
优选地,步骤b)和步骤d)中加入edc与nhs的摩尔比为2~3:1,最佳为2.5:1。
优选地,步骤c)中聚乙烯亚胺的重均分子量为1800,每个聚乙烯亚胺分子上含有40个氨基(-nh2),聚乙烯亚胺水溶液的浓度为50~80mg/ml,恒温振荡反应的温度优选为37℃。
优选地,步骤c)中msns-cooh与pei反应中羧基与氨基的摩尔投料比为1:1.2~1:1.5。
优选地,步骤d)中的mirnas为荧光染料标记cy5标记的mirnas。
优选地,步骤e)制得的分散液二中msns-pei的浓度为5~10mg/ml。
优选地,步骤f)中msns-pei与mirnas的摩尔投料比为比为1:1~1:2.5,恒温振荡反应的温度优选为37℃。
优选地,步骤3)中同轴静电纺丝法中芯层的推进速度为0.02~0.1ml/h,芯层针头的内径范围优选为0.20~0.45mm,例如国标6号针头,皮层溶液推进速度为1.0~2.0ml/h,皮层针头的内径范围优选为0.50~0.70mm,例如国标9号针头。
进一步,步骤3)中可降解聚合物纺丝液的浓度根据不同的聚合物相适应,优选的溶质质量(g)/溶剂体积(ml)浓度为5%~10%。
进一步,步骤4)中外层的制备方法具体为:将大孔纳米纤维层的聚合物材料的热熔液浇铸至已装配好内层介孔mirnas控释纳米球/肝素复合修饰的可降解纳米纤维层的聚四氟乙烯模具中,然后低温冷冻、干燥一段时间后脱模,得到所述介孔mirnas控释纳米球/肝素复合修饰的双层人工血管。
优选地,所述聚合物材料的热熔液的浓度根据不同的聚合物相适应,优选的溶质质量(g)/溶剂体积(ml)浓度为1%~18%。
优选地,所述低温冷冻、干燥的步骤为先在-80℃下冷冻2~4小时,再在4℃下干燥1~3天。
在本发明的一种优选实施方式中,所述聚合物材料的热熔液采用如下重量份数的原料制备:
二甲基亚砜(dmso)100份;
聚氨酯脲酯(c-peuu)1~10份。
在本发明的另一种优选实施方式中,所述聚合物材料的热熔液采用如下重量份数的原料制备:
1,4-二氧六环(diox)60~98份;
超纯水2~40份;
热塑性聚氨酯(tpu)1~10份。
本发明通过同轴技术制备纤维内包裹mirnas控释纳米球和肝素的功能性纳米纤维作为与血液接触的内层起到快速内皮化的目的,外层由通过热致相分离技术制备的大孔层组成。图1所示为本发明所述双层人工血管的具体制备流程图。图2中a所示为电纺纳米纤维人工血管的照片(中间)及其放大图(左边为表面纤维放大图,右边为截面纤维放大图),b为热致相分离大孔人工血管的照片(中间)及其放大图(左边为表面纤维放大图,右边为截面纤维放大图),c为本发明所述介孔mirnas控释纳米球/肝素复合修饰的双层人工血管的截面放大图。
与现有技术相比,本发明的有益效果是载有mirnas控释纳米球和肝素的纳米纤维具有优良的力学性能且对内皮细胞的黏附、增殖和迁移有很好的促进作用,其中肝素起到前期抗凝的作用,mirnas控释纳米球具有显著的促进内皮细胞增殖分化和调节炎性因子表达的作用,更有利于内皮细胞快速长满人工支架,从而实现快速内皮化;外层为热致相分离制备的大孔纳米纤维层,引导、促进平滑肌快速生长,从而达到仿生。这种具有很好的组织相容性和生物力学性能的复合型组织工程血管的制备为发展小口径血管支架提供了一种简单且有效的制备技术思路。
以下将结合附图对本发明的构思、具体结构及产生的技术效果作进一步说明,以充分地了解本发明的目的、特征和效果。
附图说明
图1为本发明的制备流程图;
图2为本发明制备的介孔mirnas控释纳米球/肝素复合修饰的双层人工血管(c)和电纺纳米纤维人工血管(a)、热致相分离大孔人工血管(b)的比较图;
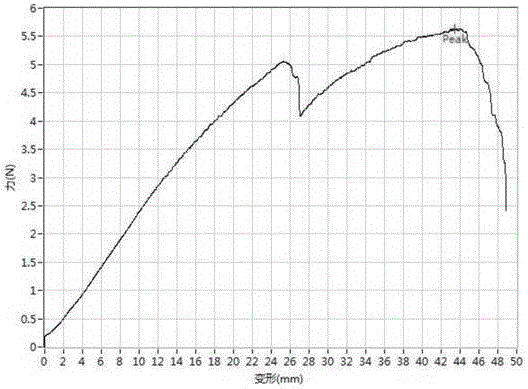
图3为实施例一制备的介孔mirnas控释纳米球/肝素复合修饰的双层人工血管的轴向力-形变图;
图4为载有mirna21的纳米硅扫描电镜照片;
图5为载有mirna21控释纳米球和肝素的纳米纤维扫描电镜照片。
具体实施方式
实施例1
1)将50mg表面羧基化的介孔硅(msns-cooh)分散到50ml二甲基亚砜(dmso)中,超声使其分散均匀;
2)称取总量为0.8g的摩尔比为2.5:1的edc、nhs加入到上述分散液中,32℃搅拌2小时活化msns-cooh上的羧基;
3)将50ml浓度为80mg/ml聚乙烯亚胺(pei)水溶液逐滴加入到羧基被活化的msns-cooh分散液中,先搅拌12小时,后放入恒温摇床37℃振荡12小时,最后产物经过离心,用乙醇和去离子水分别交替重复清洗各3次,得产物msns-pei;
4)将4mg的mirnas溶于15ml的n,n-二甲基甲酰胺(dmf)中,再加入总量为0.3g的摩尔比为2.5:1的edc、nhs,32℃搅拌2小时活化;
5)将步骤3)中制备的msns-pei分散到dmf中配制一定浓度的分散液;
6)将活化的mirnas溶液加入到msns-pei分散液中,先搅拌12小时,后放入恒温摇床37℃振荡12小时,最后产物经过离心,用乙醇和去离子水分别交替重复清洗各3次,得产物mirnas@msns纳米球(图4);
7)将肝素钠0.1g和20mg步骤6)中制备的mirnas@msns纳米球溶于20%乙醇水溶液中得内层负载的药物溶液;
8)以内层负载的药物溶液为芯层,溶质质量(g)/溶剂体积(ml)浓度为8%的plcl可降解聚合物纺丝液为皮层,同轴静电纺丝得内径为2mm的血管支架内层;其中,芯层溶液推进速度为0.05ml/h,皮层溶液推进速度为1.5ml/h,纺丝时间1小时,制得的纳米纤维如图5所示;
9)将步骤8)中所得的内径为2mm的血管支架内层装配到轴心直径为2.1mm的聚四氟乙烯模具轴心上,向模具内浇铸溶质质量(g)/溶剂体积(ml)浓度为5%的c-peuu/dmso热溶液;
10)-80℃冷冻3小时,放入冷冻干燥机内48小时后取出脱掉模具,得到内径为2mm、管壁厚为0.8mm的介孔mirnas控释纳米球/肝素复合修饰的双层人工血管。
实施例2
1)将50mg表面羧基化的介孔硅(msns-cooh)分散到50ml二甲基亚砜(dmso)中,超声使其分散均匀;
2)称取总量为0.8g摩尔比为2.5:1的edc、nhs加入到上述分散液中,32℃搅拌2小时活化msns-cooh上的羧基;
3)将50ml浓度为80mg/ml聚乙烯亚胺(pei)水溶液逐滴加入到羧基被活化的msns-cooh分散液中,先搅拌12小时,后放入恒温摇床37℃振荡12小时;最后产物经过离心,用乙醇和去离子水分别交替重复清洗各3次,得产物msns-pei;
4)将4mg的mirnas溶于15ml的n,n-二甲基甲酰胺(dmf)中,再加入总量为0.3g的摩尔比为2.5:1的edc、nhs,32℃搅拌2小时活化;
5)将步骤3)中制备的msns-pei分散到dmf中配制一定浓度的分散液;
6)将活化的mirnas溶液加入到msns-pei分散液中,先搅拌12小时,后放入恒温摇床37℃振荡12小时,最后产物经过离心,用乙醇和去离子水分别交替重复清洗各3次,得产物mirnas@msns纳米球;
7)将肝素钠0.1g和20mg步骤6)中制备的mirnas@msns纳米球溶于20%乙醇水溶液中得内层负载的药物溶液;
8)以内层负载的药物溶液为芯层,溶质质量(g)/溶剂体积(ml)浓度为8%plcl可降解聚合物纺丝液为皮层,同轴静电纺丝得内径为2mm的血管支架内层,内层溶液推进速度为0.05ml/h,皮层溶液推进速度为1.5ml/h,纺丝时间1小时;
9)将步骤8)中所得的内径为2mm的血管支架内层装配到轴心直径为2.1mm的聚四氟乙烯模具轴心上,向模具内浇铸溶质质量(g)/溶剂体积(ml)浓度为3%的体积比为4:1的1,4-二氧六环/水作为溶剂的tpu热溶液;
10)-80℃冷冻3小时,放入冷冻干燥机内48小时后取出脱掉模具,得到内径为2mm、管壁厚为0.8mm的介孔mirnas控释纳米球/肝素复合修饰的双层人工血管。
实施例3
测试实施例1制得的介孔mirnas控释纳米球/肝素复合修饰的双层人工血管的轴向力学数据,其结果如下表所示:
表1
测试其轴向力-形变图谱如图3所示。图中第一个峰点(5.05n,25.5mm)处为外层相分离得到的大孔层材料拉断的点,第二个峰点(peak点)为内层纳米纤维材料拉断的点。
应当理解,本领域的普通技术无需创造性劳动就可以根据本发明的构思作出诸多修改和变化。因此,凡本技术领域中技术人员依本发明的构思在现有技术的基础上通过逻辑分析、推理或者有限的实验可以得到的技术方案,皆应在由权利要求书所确定的保护范围内。
- 还没有人留言评论。精彩留言会获得点赞!