低分子量岩藻聚糖硫酸酯在预防和治疗肠炎中的应用的制作方法
本发明属于天然活性物质应用技术领域,具体涉及一种低分子量岩藻聚糖硫酸酯在预防和治疗肠炎中的应用,即低分子量岩藻聚糖硫酸酯在预防和治疗抗生素相关性腹泻和艰难梭菌(clostridiumdifficile)相关性肠道炎症和获得性腹泻的应用。
技术背景
抗生素相关性腹泻(antibiotic-associateddiarrhea,aad)是指在使用抗菌剂之后的良性、自限性腹泻。典型地,这种腹泻未鉴别出病原体,腹泻是由于肠道菌群的组成和功能改变所致。大多数患者响应于支持措施和停用抗生素。长期应用多种抗生素、特别是应用肠道吸收较差或高度胆汁分泌的广谱抗生素,导致肠道菌群的组成和功能发生变化,因此导致抗生素相关性腹泻高发。肠道菌群的组成及功能变化的程度受正常菌群抵抗建群的能力及所用抗生素类型的影响。结肠厌氧性菌群的减少干扰碳水化合物和胆汁酸的代谢,可以发生渗透性或分泌性腹泻,临床表现可以是从轻度腹泻至暴发性肠炎。在大多数aad病例中,患者具有稀便、轻度肠炎症状,无全身症状。所述腹泻对支持措施和停止应用抗生素迅速作出响应。
艰难梭菌(clostridiumdifficile)是一种革兰氏阳性专性厌氧的梭状杆菌,在恶劣的环境下可以形成次极端芽孢。艰难梭菌是肠道内一种重要的机会致病菌,在健康的肠道环境中,艰难梭菌的含量非常少,不会对宿主产生影响。大量服用抗肿瘤药物、免疫抑制剂和广谱抗生素,特别是针对肠杆菌及厌氧菌的抗生素(如氨苄青霉素、头孢菌素、克林霉素等)会造成肠道菌群稳态失衡,从而使得艰难梭菌的拮抗细菌变弱,艰难梭菌大量繁殖。艰难梭菌是抗生素疗法所引起的伪膜性结肠炎的致病菌,并且是引起抗生素相关的腹泻的最主要病原菌之一。而艰难梭菌致病菌株通常产生一种或两种毒素,毒素a是一种强效的肠毒素,而毒素b是一种强效的体外细胞内毒素,但在活体中几乎无活性,除非肠道黏膜上皮已经损伤。纯化的毒素a能使结肠表面上皮间紧密连接松散,并促进毒素b进入上皮细胞。这两种毒素能使rho蛋白糖基化,阻断细胞传导,导致细胞支架肌动蛋白分解和上皮细胞调亡,从而诱发肠道炎症。艰难梭菌在人体中导致胃肠道感染,从无症状携带至艰难梭菌相关性腹泻(cdad)、伪膜性肠炎(pmc)、中毒性巨结肠、结肠穿孔及死亡。
自从2003年以来,由于艰难梭菌毒力的改变,欧洲和北美相继出现了100多次的爆发性流行艰难梭菌感染,致死率迅速上升。艰难梭菌是大约25%的抗生素相关性腹泻的致病因素。艰难梭菌在一般成人中检出率不高,大约2/3的人群感染艰难梭菌后成为无症状携带者,所以由艰难梭菌感染引发肠炎的患者一般都是在出现症状之后才治疗,但是往往这个时候已经形成了顽固性肠炎,不易治愈,并且在治愈之后也很容易复发。艰难梭菌感染在临床上一般采用抗生素(万古霉素和甲硝唑)治疗,但是万古霉素或甲硝唑治疗艰难梭菌相关性腹泻(cdad)通过改变正常的保护性肠道菌群而导致恶性循环。结果,经治疗的首次发病患者通常在停止治疗两周内可能复发,并且抗生素会进一步破坏肠道微生态平衡,故艰难梭菌感染复发率较高。考虑到目前抗生素滥用现象十分普遍,且服用广谱抗生素的患者、肿瘤患者和免疫低下的患者,其感染艰难梭菌的危险性会更高。因此,开发非抗生素的预防和治疗艰难梭菌肠道疾病的药物十分重要。
目前已有报道使用益生菌-芽孢杆菌pb6(200680051949.8)、双歧杆菌(200910166898.9)用于治疗和预防艰难梭菌肠道炎症。但是有些益生菌,如非致病性酵母菌和多重乳酸发酵菌等,使用时是否能到达肠道目标位置还不确定,而且免疫缺陷患者需要慎用。
技术实现要素:
本发明提供低分子量岩藻聚糖硫酸酯在肠炎治疗中的应用,即通过给予有效量的低分子量岩藻聚糖硫酸酯来预防和治疗抗生素相关性腹泻或艰难梭菌相关性肠道感染和获得性腹泻;从而弥补当下艰难梭菌肠炎预防和治疗制剂的不足。
本发明首先提供低分子量岩藻聚糖硫酸酯在制备预防和治疗肠道炎症制品中的应用;
所述的低分子量岩藻聚糖硫酸酯,其制备方法如下:将岩藻聚糖硫酸酯粗糖在铜离子的催化下,使用过氧化氢氧化降解将高分子量岩藻聚糖硫酸酯降解为低分子量岩藻聚糖硫酸酯;
所述的低分子量岩藻聚糖硫酸酯,其重均分子量为7.74kda,分散系数为1.02。
所述的岩藻聚糖硫酸酯粗糖是从海参、海胆等棘皮动物或海带、泡叶藻等褐藻中提取得到的;
所述的肠道炎症,为抗生素相关性腹泻、艰难梭菌相关性肠道感染或获得性腹泻。
本发明再一个方面提供一种预防和治疗肠道炎症制品,所述的制品包含有药理有效浓度的低分子量岩藻聚糖硫酸酯。
所述的制品为口服液,口服液中低分子量岩藻聚糖硫酸酯的含量预选为0.25g/ml。
使用方法,是一个体重50kg的成年人摄入口服液的量为20ml/d-100ml/d)。
本发明的优点和有益效果:
海参、海胆等棘皮动物和海带、泡叶藻等褐藻中提取、降解而得到的低分子量岩藻聚糖硫酸酯属于天然活性物质,具有多种生理活性,且无毒副作用。岩藻聚糖硫酸酯可以到达肠道下部盲肠和结肠部位。口服低分子量岩藻聚糖硫酸酯可以促进肠道有益菌生长,抑制有害菌繁殖,抑制艰难梭菌在肠道中定植,抑制艰难梭菌产毒素,降低肠道炎症程度,从而起到保护肠粘膜的作用。该组分没有抗生素的副作用,不会对正常的肠道菌群结构有影响。低分子量岩藻聚糖硫酸酯是一种天然活性物质,可以作为一种膳食营养来源,所以将其作为一种保健食品,可以在预防艰难梭菌感染方面有良好的应用价值。
附图说明
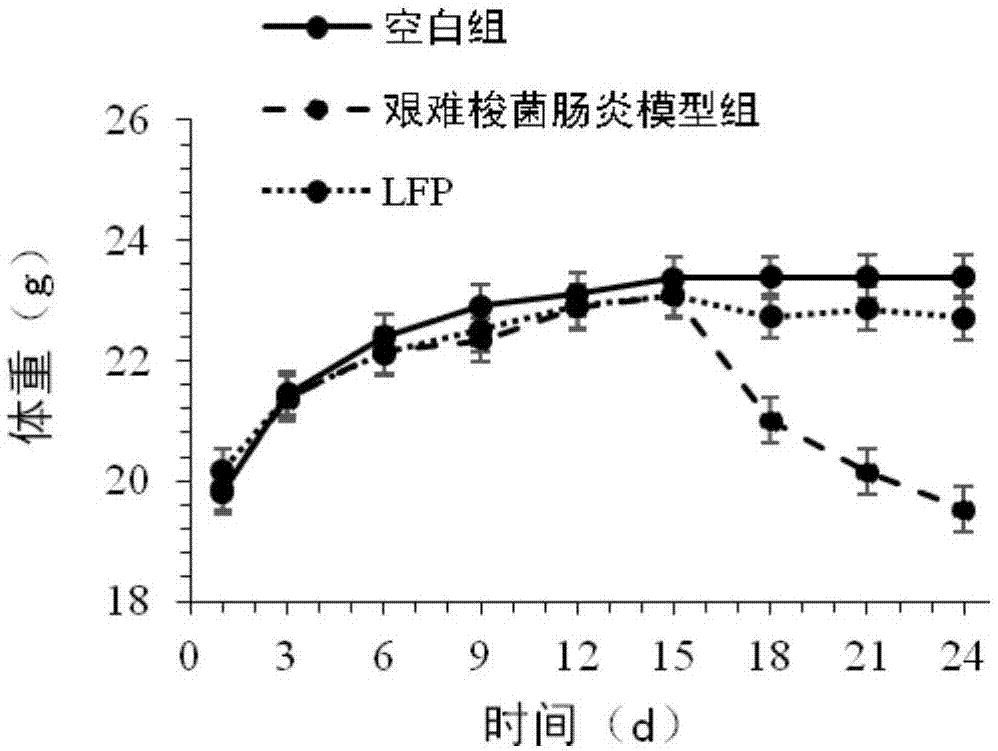
图1为实施例2中预防给予低分子量岩藻聚糖硫酸酯对艰难梭菌肠炎小鼠体重的影响图,其中lfp为低分子量岩藻聚糖硫酸酯预防组;
图2为实施例2中预防给予低分子量岩藻聚糖硫酸酯的难梭菌肠炎小鼠的小肠、盲肠和结肠的病理切片的he染色分析图,其中lfp为低分子量岩藻聚糖硫酸酯预防组;
图3为实施例3中治疗给予低分子量岩藻聚糖硫酸酯对艰难梭菌肠炎小鼠体重的影响图,其中lft为低分子量岩藻聚糖硫酸酯治疗组;
图4为实施例3中治疗给予低分子量岩藻聚糖硫酸酯的难梭菌肠炎小鼠的小肠、盲肠和结肠的病理切片的he染色分析图,其中lft为低分子量岩藻聚糖硫酸酯治疗组;
图5为实施例4中预防给予低分子量岩藻聚糖硫酸酯对抗生素相关性腹泻小鼠体重的影响图,其中lfp-aad为低分子量岩藻聚糖硫酸酯预防抗生素相关性腹泻组;
图6为实施例5中低分子量岩藻聚糖硫酸酯发酵前后的薄层层析和凝胶电泳分析。注:(a)1:岩藻糖单糖;2:硫酸软骨素酶解产物;no.1-5:依次为no.1-5志愿者肠道菌酵解低分子量岩藻聚糖硫酸酯的产物;(b)1:40kda的葡聚糖;2:10kda的葡聚糖;3:硫酸软骨素酶解产物;4:低分子量岩藻聚糖原糖;5-9:依次为no.1-5志愿者的肠道微生物对低分子量岩藻聚糖硫酸酯的酵解产物;
图7为实施例5中体外发酵对人肠道微生物的beta多样性的影响。注:a:肠道微生物群的聚类分析;b:肠道微生物群的nmds分析;c:肠道微生物群的pca分析;d:肠道微生物群的pcoa分析;cn1-cn5:五位志愿者的原始肠道微生物;lmwf1-lmwf5:发酵后五位志愿者的肠道微生物。
具体实施方式
下面结合实施例对本发明进行详细的描述。
实施例1
海带、泡叶藻等褐藻岩藻聚糖硫酸酯的提取:取海带、泡叶藻等褐藻于烘箱中烘干后粉碎,粉碎后的褐藻粉经20目过筛,用95%乙醇浸泡24h,期间更换乙醇继续脱色2-3次,直至倒出的乙醇为无色。室温下晾干后,于85℃热水中振荡提取3h,其中料液比为1∶30(g/ml),离心取出上清液,将残渣再加入30倍体积水,重复提取3次。将3次提取液合并,减压蒸馏,将粗提液加入无水乙醇,至乙醇浓度为50%,振荡均匀后,于4℃静置过夜,离心去除沉淀(褐藻胶,分子量约7000kda),保留上清液。上清液中再加入无水乙醇,至乙醇浓度为85%,4℃静置过夜,离心并收集沉淀,烘干后得到岩藻聚糖硫酸酯粗糖,其分子量在700kda至1000kda之间。
海参等棘皮动物岩藻聚糖硫酸酯的提取:将海参干品粉碎,用95%乙醇浸泡24h,期间更换乙醇继续脱色2-3次,直至倒出的乙醇为无色。室温下晾干后,于0.1mol/l的乙酸钠缓冲溶液(ph为6.0,含4g/l木瓜蛋白酶、5mmol/ledta-na2、5mmol/ll-半胱氨酸)中,60℃恒温搅拌浸提24h,其中料液比为1∶30(g/ml),之后将反应物沸水浴5min灭酶活,冷却至室温,离心取上清液。在上清液中加入cpc试剂,至终浓度为6g/l,静置24h,离心弃去上清液。将沉淀溶解于3mol/lnacl:乙醇混合液(100:15,v/v)中,使岩藻聚糖硫酸酯与cpc完全分离,而后加入95%乙醇,使得乙醇的最终浓度为85%,4℃下放置24h,离心取沉淀,将沉淀用85%和95%乙醇洗涤多次以除尽cpc,将沉淀烘干,得到岩藻聚糖硫酸酯粗糖,其分子量在700kda至1000kda之间。
低分子量海带岩藻聚糖硫酸酯的制备:称取1.0g岩藻聚糖硫酸酯和0.08gcu(ac)2,溶于15ml蒸馏水,用2mol/lnaoh调节ph至7.5,用蠕动泵以3ml/h的速度加入4.5%h2o2,在60℃的条件下水浴反应4h(ph为7.5-8.0),反应结束后用chelex100树脂除去cu2+,再用500da透析袋透析除盐,浓缩,冻干后得到粉末状低分子量岩藻聚糖硫酸酯,其重均分子量为7.74kda,分散系数为1.02。
实施例2
以下通过具体的动物实验说明本发明中低分子量岩藻聚糖硫酸酯对艰难梭菌相关性肠道感染和获得性腹泻的预防效果。
1.实验条件:三级动物实验室,温度:18-22摄氏度,湿度:空调调节。
2.实验对象:洁净雄性babl/c小鼠30只,体重19~20克,由济南朋悦实验动物繁育有限公司提供。
3.实验方法:将小鼠随机分为三组:空白组、艰难梭菌肠炎模型组、低分子量岩藻聚糖硫酸酯预防组(lfp),每组10只实验小鼠。空白组第1-24天均灌胃生理盐水。第1-12天,艰难梭菌肠炎模型组灌胃生理盐水,低分子量岩藻聚糖硫酸酯预防组(lfp)灌胃有效量(0.1g/(kg·d)至0.5g/(kg·d))低分子量岩藻聚糖硫酸酯。第13-14天,除空白组以外,所有动物灌胃0.2ml混合抗生素(卡那霉素0.4mg/ml、庆大霉素0.035mg/ml、粘菌素850u/ml、甲硝唑0.215mg/ml、万古霉素0.045mg/ml,均购于sigma公司,用生理盐水配制),造成抗生素肠道菌群损伤。第15-16天,除空白组以外,所有动物灌胃克林霉素50mg/(kg·d)进行肠道菌群的干扰。第17天,除空白组以外,所有动物灌胃艰难梭菌vpi10463(107cfu/ml,购于美国atcc菌种保藏中心),进行艰难梭菌的侵袭。第18-24天,所有动物灌胃生理盐水。
4.实验结果:
实验过程中对小鼠的腹泻情况和体重进行监测和记录(图1),发现预防性给予低分子量岩藻聚糖硫酸酯,可以很好地防止感染艰难梭菌的小鼠出现腹泻和体重下降。
实验结束后,颈椎脱臼处死小鼠,取各组小肠、盲肠及结肠组织1cm,用4%甲醛固定,石蜡切片,he染色,显微镜下观察小肠、盲肠和结肠的结构,鉴定肠道的损伤情况。如图2所示,模型组的小肠、盲肠和结肠均出现ⅲ级重度炎症。与之相比的,低分子量岩藻聚糖硫酸酯预防组(lfp)的小肠粘膜无水肿,绒毛结构完整,上皮细胞无脱落的现象,并且无中性粒细胞浸润,评为无炎症;盲肠出现局部水肿,粘膜结构稍有紊乱和脱落,少量中性粒细胞浸润,评为ⅰ级轻度炎症;结肠出现局部水肿,粘膜结构较完整,少量中性粒细胞浸润,评为ⅰ级轻度炎症。说明预防性给予低分子量岩藻聚糖硫酸酯,可以很好的保护抗生素和艰难梭菌对肠道组织结构的破坏,减少肠道炎症的发生。
取每只实验动物的盲肠内容物,按内容物:稀释液=1:10(w/v)加入pbs(ph7.0)稀释,混匀后离心(6000r/min,10min)取上清液,用elisa试剂盒检测艰难梭菌毒素a和毒素b,计算感染率(表1)。发现,预防性给予低分子量岩藻聚糖硫酸酯,可以抑制艰难梭菌产生艰难梭菌毒素a和毒素b。
表1:预防性给予低分子量岩藻聚糖硫酸酯对实验小鼠的盲肠内容物中艰难梭菌毒素感染率的影响表
取小肠、盲肠及结肠组织各1cm,进行组织匀浆,用elisa试剂盒检测各段肠道组织中tnf-α、ifn-γ、il-6的表达量(表2)。发现,预防性给予低分子量岩藻聚糖硫酸酯可以显著降低小肠、盲肠、结肠组织中的tnf-α、ifn-γ、il-6的含量(p<0.01)。
表2:预防给予低分子量岩藻聚糖硫酸酯对艰难梭菌肠炎小鼠的小肠、盲肠和结肠中tnf-α、il-6和ifn-γ的影响表
注:“#”:p<0.05,与空白组相比具有显著性差异;“*”p<0.05,与模型组相比具有显著性差异
收集各组小鼠的粪便,根据粪便微生物的16srrna测序结果分析肠道菌群变化。首先进行alpha多样性分析(表3),将得到的有效序列进行聚类分析,不同序列的相似性高于97%即可定义为一个聚类,每一个聚类称为一个物种操作单元(operationaltaxonomicunits,otu)。与艰难梭菌肠炎模型组相比,低分子量岩藻聚糖硫酸酯预防组的out数量、ace指数、chao1指数没有显著差异(p>0.05),说明菌群丰富度差异无统计学意义,但是shannon指数显著降低(p<0.05),同时simpson指数显著升高(p<0.05),说明低分子量岩藻聚糖硫酸酯预防组的肠道微生物群落的多样性显著升高。根据微生物门分类水平的分析(表4),预防性给予低分子量岩藻聚糖硫酸酯显著抑制了抗生素诱导的变形菌门比例的增加,使得变形菌门的比例保持在正常小鼠的水平,给予低分子量岩藻聚糖硫酸酯还大大提高肠道中拟杆菌门的比例,甚至超过了正常小鼠,同时厚壁菌门的比例得到很好的恢复。进一步的,根据微生物属分类水平的分析(表5),与模型组相比,预防性给予低分子量岩藻聚糖硫酸酯可以明显增加bacteroides、blautia、uminiclostridium_5、lactobacillus等的比例。其中bacteroides和ruminiclostridium_5能大量利用不被宿主消化的碳水化合物,产生短链脂肪酸,尤其是丁酸,酸化肠道内环境,抑制有害菌的生长,提高宿主的免疫力;blautia能产生抗炎效应,有效减少急性抗宿主病的死亡率;lactobacillus为乳酸菌属,是一种肠道益生菌。此外预防性给予低分子量岩藻聚糖硫酸酯可以明显降低robinsoniella、hungatella、eisenbergiella、parasutterella等有害菌的比例。
表3:预防给予低分子量岩藻聚糖硫酸酯对艰难梭菌肠炎小鼠的肠道微生物alpha多样性的影响表
注:“#”:p<0.05,与空白组相比具有显著性差异;“*”p<0.05,与模型组相比具有显著性差异
表4预防给予低分子量岩藻聚糖硫酸酯对感染艰难梭菌肠炎的小鼠的肠道微生物的门分类水平的分析表
表5:预防给予低分子量岩藻聚糖硫酸酯对感染艰难梭菌肠炎的小鼠的肠道微生物的属分类水平的分析表
实施例3
以下通过具体的动物实验说明本发明中低分子量岩藻聚糖硫酸酯对艰难梭菌相关性肠道感染和获得性腹泻的治疗效果。
1.实验条件:三级动物实验室,温度:18-22摄氏度,湿度:空调调节。
2.实验对象:洁净雄性babl/c小鼠30只,体重19~20克,由济南朋悦实验动物繁育有限公司提供。
3.实验方法:将小鼠随机分为三组:空白组、艰难梭菌肠炎模型组、低分子量岩藻聚糖硫酸酯治疗组(lft),每组10只实验小鼠。第1-12天,所有动物均灌胃生理盐水。第13-14天,除空白组以外,所有动物灌胃0.2ml混合抗生素(卡那霉素0.4mg/ml、庆大霉素0.035mg/ml、粘菌素850u/ml、甲硝唑0.215mg/ml、万古霉素0.045mg/ml,均购于sigma公司,用生理盐水配制),造成抗生素肠道菌群损伤。第15-16天,除空白组以外,所有动物灌胃克林霉素50mg/(kg·d)进行肠道菌群的干扰。第17天,除空白组以外,所有动物灌胃艰难梭菌vpi10463(107cfu/ml,购于美国atcc菌种保藏中心),进行艰难梭菌的侵袭。第18天,所有动物灌胃生理盐水。第19-24天,低分子量岩藻聚糖硫酸酯治疗组(lft)灌胃有效量(0.1g/(kg·d)至0.5g/(kg·d))低分子量岩藻聚糖硫酸酯进行治疗,而其他组只灌胃生理盐水。
4.实验结果
实验过程中对小鼠的腹泻情况和体重进行监测和记录(图3),发现治疗性给予低分子量岩藻聚糖硫酸酯,可以很好地缓解艰难梭菌肠炎小鼠的腹泻症状,同时减小了体重的下降幅度。
显微镜下观察小肠、盲肠和结肠的结构(图4)。模型组的小肠、盲肠和结肠均出现ⅲ级重度炎症。与之相比的,低分子量岩藻聚糖硫酸酯治疗组(lft)的小肠粘膜无水肿,部分绒毛结构出现中断,上皮细胞部分脱落,少量中性粒细胞浸润,评为ⅱ级中度炎症;盲肠出现局部水肿,粘膜结构稍有紊乱和脱落,部分中性粒细胞浸润,评为ⅱ级中度炎症;结肠出现局部水肿,粘膜结构较完整,少量中性粒细胞浸润,评为ⅱ级中度炎症。说明治疗性给予低分子量岩藻聚糖硫酸酯,可以在一定程度上保护抗生素和艰难梭菌对肠道组织结构的破坏,缓解肠道炎症的症状。
感染艰难梭菌的小鼠,再分别治疗性给予低分子量岩藻聚糖硫酸酯,可以显著降低艰难梭菌毒素a和毒素b的感染率,分别降低为50%和60%(表6),说明低分子量岩藻聚糖硫酸酯可以很好地抑制艰难梭菌感染造成的毒素a和毒素b的感染。
表6:治疗给予低分子量岩藻聚糖硫酸酯对实验小鼠的盲肠内容物中艰难梭菌毒素感染率的影响
低分子量岩藻聚糖硫酸酯治疗组(lft)小鼠的结肠组织中的tnf-α的含量明显低于模型组(p<0.05),但小肠、盲肠组织中的tnf-α的含量与模型相比组没有显著差异(p>0.05);结肠组织中的il-6的含量明显低于模型组(p<0.05),但是小肠、盲肠组织中的il-6的含量与模型组相比没有显著差异(p>0.05);小肠、结肠组织中的ifn-γ的含量明显低于模型组(p<0.05),但是盲肠组织中的ifn-γ的含量与模型组相比没有显著差异(p>0.05)(表7)。对比发现,低分子量岩藻聚糖硫酸酯治疗组(lft)的结肠部位的tnf-α、il-6和ifn-γ含量均显著低于模型组,说明低分子量岩藻聚糖硫酸酯对结肠部位的炎症有治疗效果,但是对小肠和盲肠的治疗效果不佳。
表7治疗给予低分子量岩藻聚糖硫酸酯对艰难梭菌肠炎小鼠的小肠、盲肠和结肠中tnf-α、il-6和ifn-γ的影响
注:“#”:p<0.05,与空白组相比具有显著性差异;“*”p<0.05,与模型组相比具有显著性差异
根据alpha多样性分析(表8),低分子量岩藻聚糖硫酸酯治疗组(lft)与艰难梭菌肠炎模型组相比,out数量、ace指数、chao1指数、shannon指数和simpson指数均没有显著差异(p>0.05),说明肠道微生物的菌群丰富度和菌群多样性的差异无统计学意义。根据微生物门分类水平的分析(表9),治疗给予低分子量岩藻聚糖硫酸酯能够显著减少变形菌门的比例,同时大大提高肠道中拟杆菌门的比例,甚至大大超过了正常小鼠的拟杆菌门,但是对厚壁菌门的比例没有很大的影响。进一步的,在属水平发现低分子量岩藻聚糖硫酸酯治疗组与模型组之间有多个菌属存在较大差异(表10)。其中,bacteroides的比例明显增加,bacteroides能大量利用不被宿主消化的碳水化合物,产生短链脂肪酸,尤其是丁酸,酸化肠道内环境,抑制有害菌的生长,提高宿主的免疫力;lactobacillus这种肠道益生菌的比例也得到恢复。此外,治疗给予低分子量岩藻聚糖硫酸酯可以明显降低robinsoniella、hungatella、eisenbergiella等有害菌的比例。
表8:治疗给予低分子量岩藻聚糖硫酸酯对艰难梭菌肠炎小鼠的肠道微生物alpha多样性的影响
注:“#”:p<0.05,与空白组相比具有显著性差异
表9:治疗给予低分子量岩藻聚糖硫酸酯对感染艰难梭菌肠炎的小鼠的肠道微生物的门分类水平的分析
表10:治疗给予低分子量岩藻聚糖硫酸酯对感染艰难梭菌肠炎的小鼠的肠道微生物的属分类水平的分析
实施例4
以下通过具体的动物实验说明本发明中低分子量岩藻聚糖硫酸酯对抗生素相关性腹泻(aad)的预防效果。
1.实验条件:三级动物实验室,温度:18-22摄氏度,湿度:空调调节。
2.实验对象:洁净雄性babl/c小鼠30只,体重19~20克,由济南朋悦实验动物繁育有限公司提供。
3.实验方法:将小鼠随机分为三组:空白组、抗生素相关性腹泻模型组(aad)、低分子量岩藻聚糖硫酸酯预防抗生素相关性腹泻组(lfp-aad),每组10只实验小鼠。第1-12天,空白组和抗生素相关性腹泻模型组(aad)灌胃生理盐水,低分子量岩藻聚糖硫酸酯预防抗生素相关性腹泻组(lfp-aad)灌胃有效量(0.1g/(kg·d)至0.5g/(kg·d))低分子量岩藻聚糖硫酸酯。第13-14天,除空白组以外,所有动物灌胃0.2ml混合抗生素(卡那霉素0.4mg/ml、庆大霉素0.035mg/ml、粘菌素850u/ml、甲硝唑0.215mg/ml、万古霉素0.045mg/ml,均购于sigma公司,用生理盐水配制),造成抗生素肠道菌群损伤。第15-21天,除空白组以外,所有动物灌胃克林霉素50mg/(kg·d)。
4.实验结果
实验结果显示,给予低分子量岩藻聚糖硫酸酯可以很好地防止小鼠出现抗生素相关性腹泻症状和体重下降(图5)。
根据alpha多样性分析(表11),低分子量岩藻聚糖硫酸酯预防抗生素相关性腹泻组(lfp-aad)与抗生素相关性腹泻模型组(aad)相比,out数量、ace指数、chao1指数、shannon指数和simpson指数均没有显著差异(p>0.05),说明肠道微生物的菌群丰富度和菌群多样性的差异无统计学意义。根据微生物门分类水平的分析(表12),lfp-aad和aad组中的优势菌群皆为变形菌门和厚壁菌门,但是相较于aad组,lfp-aad组中变形菌门的比例下降了10%,且厚壁菌门的比例上升了12%。进一步的,在属水平发现低分子量岩藻聚糖硫酸酯能够防止抗生素诱导的robinsoniella、hungatella、eisenbergiella、peptoclostridium等有害菌的增加。
表11预防给予低分子量岩藻聚糖硫酸酯对抗生素相关性腹泻小鼠的肠道微生物alpha多样性的影响表
注:“#”:p<0.05,与空白组相比具有显著差异
表12预防给予低分子量岩藻聚糖硫酸酯对抗生素相关性腹泻的小鼠的肠道微生物的门分类水平的分析
表13预防给予低分子量岩藻聚糖硫酸酯对抗生素相关性腹泻的小鼠的肠道微生物的属分类水平的分析
实施例5
以下通过具体的体外发酵实验说明本发明中低分子量岩藻聚糖硫酸酯被肠道微生物的降解利用情况以及对肠道微生物的影响
1.实验方法:
(1)培养基配制
基础培养基配方:胰蛋白胨3g/l、蛋白胨3g/l、粘液素0.5g/l、3#胆盐0.4g/l、血红素0.05g/l、l-半胱氨酸0.8g/l、kcl2.5g/l、nacl4.5g/l、cacl2·6h2o0.2g/l、mgcl2·6h2o4.5g/l、kh2po40.4g/l。
微量元素配方:mgso4·7h2o3.0g/l、cacl2·2h2o0.1g/l、feso4·7h2o0.1g/l、mncl2·4h2o0.32g/l、znso4·7h2o0.18g/l、cuso4·5h2o0.01g/l、mncl2·4h2o0.32g/l、coso4·7h2o0.18g/l、nicl2·6h2o0.092g/l。每升基础培养基中加2ml的微量元素。
在基础培养基中分别加入5g/l低分子量岩藻聚糖硫酸酯,作为唯一碳源,调节ph至6.4~6.5。各自取5ml分装至25ml厌氧瓶,充氮气后密封,用高压灭菌锅115℃灭菌30min。
(2)人粪便样品的收集和肠道微生物接种
提供粪便样本的5位志愿者(编号为no.1~5)身体健康,采样前2个月内无服用益生元、抗生素记录。取志愿者的粪便,用灭菌的磷酸缓冲液(0.1mol/l,ph7.0)配成20%(w/v)的菌悬液,充分混匀后低速离心去残渣。取0.5ml粪便菌悬液,分别接种至低分子量岩藻聚糖硫酸酯培养基中,接种后置于厌氧培养箱中,37℃培养48h,并于0h(空白组:cn1、cn2、cn3、cn4、cn5)和48h(实验组:lmwf1、lmwf2、lmwf3、lmwf4、lmwf5)取样。
(3)检测方法:采用薄层层析(tlc)法、凝胶电泳(page)法和液质联用(lc-ms)法分析肠道微生物对低分子量岩藻聚糖硫酸酯的降解利用情况,气相色谱法分析产生短链脂肪酸的情况,16srrna测序技术分析肠道菌群的变化。
2.实验结果
低分子量岩藻聚糖硫酸酯中含有单糖、寡糖和多糖,在经过人肠道微生物酵解48h之后,单糖和寡糖几乎被完全降解(图6a)。根据lc-ms分析(表14),硫酸岩藻寡糖里含量最高的是二硫岩藻糖单糖(f1s2),其利用率达到99%以上,另外岩藻寡糖里含量较高的二硫岩藻糖二糖(f2s2)利用率达到96%;在低分子量岩藻聚糖硫酸酯中,硫酸半乳糖寡糖种类和含量都相对较多,其中含量最多的是g1s1,而在经人肠道微生物酵解之后,其利用率达到了99%以上;硫酸半乳糖岩藻寡糖的含量也不少,其中含量较多的有g1f1s2、g1f1s3,经酵解之后,其利用率也都达到了100%。再者,人肠道微生物能够利用各种硫酸根含量的硫酸寡糖,如f3s1(81%)、f3s2(88%)、f3s3(86.60%)、f3s4(97%)、f3s5(100%)和g3s1(77.22%)、g3s2(76.35%)、g3s3(100%)、g3s4(100%),而且利用率随硫酸根含量而不同。尤其是二硫取代的寡糖f3s4、f3s5和g3s4的离子强度显著下降,说明人肠道微生物能够很好地利用高硫酸化的硫酸岩藻糖和硫酸半乳糖。根据page电泳分析(图6b),低分子量岩藻聚糖硫酸酯分布在10kda~20kda之间的组分明显减少,说明除了寡糖,分子量在10kda~20kda的低分子量岩藻聚糖硫酸酯也能够被肠道菌群降解利用。
表14低分子量岩藻聚糖硫酸酯寡糖在发酵后的利用情况
注:m/z:质荷比;z:电荷量;mexp:实验质量;mthero:理论质量;eic(发酵前):发酵前寡糖的离子强度;eic(发酵后):发酵后寡糖的离子强度;f:岩藻糖;g:半乳糖;s:硫酸根;化学式中的数字代表单糖或硫酸根的个数
人肠道微生物在低分子量岩藻聚糖硫酸酯培养液中厌氧发酵48h后,发酵液中主要产生了乙酸、丙酸和丁酸(表15),说明肠道微生物能将低分子量岩藻聚糖硫酸酯进一步降解为短链脂肪酸,而短链脂肪酸能够酸化肠道内环境,抑制有害菌的生长,提高宿主的免疫力。
表15低分子量岩藻聚糖硫酸酯发酵液中短链脂肪酸的变化(μg/ml)
注:“*”:p<0.05,与发酵前相比具有显著差异
根据alpha多样性分析(表16),发酵48h后,out数量、ace指数、chao1指数显著减小(p<0.05),说明肠道微生物菌群丰富度明显下降;此外,shannon指数显著降低(p<0.05),同时simpson指数显著升高(p<0.05),说明肠道微生物菌群多样性明显降低。根据beta多样性分析(图7),与发酵前相比,发酵48h后的肠道微生物的菌群结构发生了显著的变化。根据微生物门分类水平的分析(表17),发酵48h后,拟杆菌门的比例明显上升,厚壁菌门的比例显著下降,这是因为拟杆菌门是消耗岩藻聚糖硫酸酯的主要菌群。但是变形菌门的比例显著上升了,这可能是因为体外酵解环境更适合变形菌门的生长。
表16体外发酵对人肠道微生物alpha多样性的影响
注:“*”:p<0.05,与发酵前相比具有显著差异
表17体外发酵前后肠道微生物的门分类水平分析
- 还没有人留言评论。精彩留言会获得点赞!