一种PAMAM与CRISPR/Cas9系统重组质粒递送纳米粒的制备方法与流程
本发明属于生物技术领域,涉及一种具肿瘤靶向性的纳米复合物apt-pamam/egfr-sgrna/cas9的制备方法。
背景技术
卫生部和科技部发布的全国第三次死因回顾抽样调查报告显示,肺癌已跃居我国居民肿瘤死因的第1位,是我国死亡率上升速度最快、增长幅度最大的恶性肿瘤。肺癌分为小细胞肺癌(sclc)和非小细胞肺癌(nsclc),其中nsclc占所有肺癌的80~85%,且表皮生长因子受体(egfr)的过度表达是导致肺癌细胞无限增殖的主要原因之一(moschinii,dell'annac,losardopl,bordip,d'abbieron,tiseom.radiotherapyofnon-small-celllungcancerintheeraofegfrgenemutationsandegfreceptortyrosinekinaseinhibitors.futureoncol.2015;11(16):2329-42.)。
crispr-cas9被称为第三代基因编辑技术,可通过精确定位基因组某一位点,剪断靶标dna片段并插入、删除或替换新的基因片段高效地改造基因。crispr的成功实现通常需要cas9在一组细胞中引出有效的目标基因并敲除,研究发现crispr对目标基因的敲除高度依赖于sgrna引导序列的效力(yueng,khanfj,gaos,stommeljm,batchelore,wux,etal.crispr/cas9-mediatedgeneknockoutisinsensitivetotargetcopynumberbutisdependentonguidernapotencyandcas9/sgrnathresholdexpressionlevel.nucleicacidsres2017;45(20):12039-53.)。另有研究表明,sgrna靶向的基因缺失与egfr蛋白表达密切相关。因此,通过crispr-cas9基因编辑技术敲除sgrna在下调egfr蛋白过度表达导致的肿瘤细胞无限增殖具有广泛的应用前景。
聚酰胺-胺型树枝状高分子(polyamidoamine,pamam)是一种新型高分子,其表面富含氨基可与带负电的核酸结合,是目前研究最多的基因载体之一。因其内部存在空腔结构,且在体内外均无毒性,被认为是一种安全的药物载体广泛应用于靶向药物输送系统(marquez-mirandav,abrigoj,riverajc,araya-durani,aravenaj,simonf,etal.thecomplexofpamam-ohdendrimerwithangiotensin(1-7)preventedthedisuse-inducedskeletalmuscleatrophyinmice.intjnanomedicine.2017;12:1985-99.)。短单链寡核苷酸(aptamer)是一类具有特殊序列的核酸适配体,能够与egfr表面抗原特异性结合,从而实现靶向至肿瘤细胞的作用(kangyr,byunjs,kimtj,parkhg,parkjc,barangen,etal.monitoringofthebindingbetweenegfrproteinandegfraptamerusingin-situtotalinternalreflectionellipsometry.jnanoscinanotechnol.2016;16(6):6445-9.)。
本发明制备了具肿瘤靶向性的apt-pamam/egfr-sgrna/cas9纳米复合物,利用短单链寡核苷酸apt主动靶向egfr过表达肿瘤细胞,有效地提高药物的生物利用度。通过crispr-cas9基因编辑技术设计sgrna基因并构建egfr-sgrna重组质粒,从基因治疗层面抑制肿瘤细胞增殖,提升其临床应用价值。检索国内外相关文献和专利结果表明:具肿瘤靶向性的apt-pamam/egfr-sgrna/cas9纳米复合物及其制备方法,尚未见报道。
技术实现要素:
本发明的目的在于提供一种具有靶向抗癌作用的适配体修饰树枝状高分子作为运载体介导基因输送在egfr过表达肺癌中的作用及制备方法。通过基因重组质粒显著抑制egfr蛋白表达,同时利用纳米载体表面的特异性适配体靶向肺癌细胞,选择性浓集于肿瘤细胞,提高生物利用度。
为达到上述目的,本发明采用如下技术方案:
(1)将pamam,n-羟基琥珀酰亚胺(nhs)和1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(edc)溶于水中,滴加3’端修饰有fitc荧光的apt(anti-epcam)水溶液,室温低速搅拌反应4小时,超滤后得到apt-pamam聚合物;
(2)根据选定的egfr基因设计sgrna,对设计的sgrna进行退火,px459质粒进行酶切,再将sgrna与酶切后的质粒连接,构建egfr-sgrna/cas9重组质粒;
(3)将10mgapt-pamam纳米聚合物溶于10ml二次水中,将水溶液高速搅拌,加入1mgegfr-sgrna/cas9重组质粒,形成apt-pamam/egfr-sgrna/cas9纳米复合物。
步骤(1)中apt:edc:nhs的质量比为15:6:4.5。
步骤(1)中apt:edc:nhs的总浓度为1-20wt%。
步骤(1)中所采用的pamam的代数为1代。
步骤(1)中超滤管的孔径为10kd。
步骤(2)中设计的sgrna序列为tgaaccgcacggcgccatgc;
合成所设计sgrna与其互补序列,并在首尾端加入酶切位点。合成序列为:
egfr-sgrna-fcaccgtgaaccgcacggcgccatgc
egfr-sgrna-raaacgcatggcgccgtgcggttcac
步骤(2)中sgrna退火温度梯度设置为:95℃,10min;95℃-85℃,
2.5℃/s;85℃-25℃,0.25℃/s;25℃,5min。
步骤(2)中px459质粒的酶切条件为37℃,15min。
步骤(2)中sgrna与酶切后质粒连接的条件为16℃水浴过夜12-24h。
步骤(3)中apt-pamam和egfr-sgrna/cas9重组质粒的反应条件为低速搅拌过夜12-24h。
本发明的原理在于:
第一,利用纳米载体表面的特异性适配体选择性地浓集于肿瘤细胞,有效地提高了药物的生物利用度;
第二,利用crispr-cas9基因编辑技术构建egfr-sgrna重组质粒,显著下调egfr蛋白表达,抑制肿瘤细胞增殖;
第三,利用纳米级运载体pamam的被动靶向作用,增强apt-pamam/egfr-sgrna/cas9纳米复合物在肿瘤组织的滞留效应。
本发明的优点在于:
第一,本发明采用树枝状大分子pamam作为载体,它能与能够特异性识别egfr过表达肿瘤细胞的适配体共价偶联,形成apt-pamam运载体,通过apt的主动靶向作用提高apt-pamam/egfr-sgrna/cas9纳米复合物的肿瘤靶向作用。
第二,本发明采用crispr-cas9基因编辑技术设计sgrna并构建egfr-sgrna重组质粒,重组质粒与apt-pamam运载体结合形成apt-pamam/egfr-sgrna/cas9纳米复合物,达到从基因水平上治疗肿瘤细胞无限增殖的目的。
附图说明
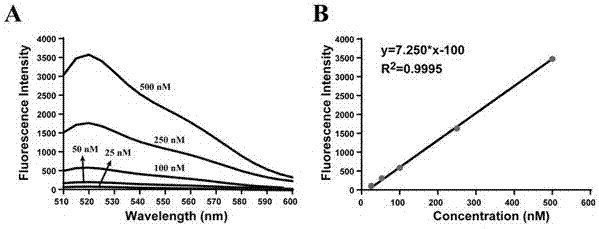
图1a图为实施例1设计的anti-epcam适配体具有fitc修饰,分别在20nm、50nm、100nm、250nm、500nm的荧光强度检测图;图1中的b图为实施例1设计的anti-epcam适配体20nm、50nm、100nm、250nm、500nm荧光标准曲线。
图2egfr-sgrna/cas9重组质粒序列对比图。
图3实施例4中复合纳米的粒径表征。
图4apt/pamam/egfr-sgrna/cas9作用于细胞后,egfr基因sgrna所在序列与野生型序列对比图。
图5apt/pamam/egfr-sgrna/cas9对肿瘤细胞a549的毒性实验结果。
具体实施方式
下面,将通过实施例,对本发明进行详细说明,但发明并不局限于此,在本发明权利要求所阐明的范围内,可进行各种改变或同等替换。
实施例1apt-pamam偶联物的制备
首先,精确称取15mg的g1pamam于20ml的圆底烧瓶中,然后称取edc6mg以及4.5mg的nhs,再取5ml二次水加入圆底烧杯中,使其完全溶解,随后滴加100μl的anti-epcam适配体(10mm),反应4h,然后选用10kd的超滤管除去未反应的pamam,即得apt-pamam偶联物。通过apt修饰的fitc荧光标曲,计算出每毫克pamam纳米载体anti-epcam的嫁接量为0.1nmol。
实施例2egfr-sgrna的设计及验证
(1)sgrna的设计
根据课题选定的egfr基因及人的种属,在pubmed进行检索其全基因序列,并检索其cds(codingsequence)编码区序列,将cds序列每250碱基一组复制到http://crispr.mit.edu/网站进行sgrna设计,根据设计结果优先选取设计结果评分在90分以上的,并在全基因中验证设计的合理性。
设计sgrna为tgaaccgcacggcgccatgc,
合成所设计sgrna与其互补序列,并在首尾端加入酶切位点。合成序列为:egfr-sgrna-f:caccgtgaaccgcacggcgccatgc;
egfr-sgrna-r:aaacgcatggcgccgtgcggttcac。
(2)sgrna的验证
将(1)设计的sgrna进行退火。将以上各管按照下表顺序加入到pcr管中,然后轻轻混匀,最后低速离心。按照如下温度梯度设置进行退火:95℃,10min;95℃-85℃,2.5℃/s;85℃-25℃,0.25℃/s;25℃,5min。等待结束后取样品进行1%琼脂糖凝胶电泳检测。
表1sgrna退火体系
实施例3egfr-sgrna/cas9重组质粒的构建
(1)px459质粒的酶切:
按照表2的成分及量,将上述混匀后低速离心,37℃反应15min后,取3μl与未使用酶切质粒共同用1%琼脂糖凝胶电泳进行检测。
表2酶切体系
(2)重组质粒的制备:sgrna与酶切后质粒的连接
按照表3的成分及量,将上述混匀后低速离心。16℃水浴过夜,然后放于4℃冰箱保存。
表3连接反应体系
(3)质粒的转化
1.5μl离心管中加入感受态细胞50μl,然后温和的加入重组质粒3μl混匀,冰浴30min;42℃水浴,45s之后冰上2min;加入800μllb;37℃摇床培养1h;室温4000rpm,离心5min;弃上清750μl;剩余菌液混匀涂板,采用amp平板;封口,37℃倒置过夜。
(4)质粒提取与测序验证
将40μl冻存菌液加入4ml具有amp抗性的lb中,过夜培养14h后细菌菌液加入10ml离心管中;于10000rpm离心1min并弃去上清液;加入250μlresuspensionbuffer重悬细菌体沉淀;加入250μllysisbuffer轻柔颠倒4~6次(勿超过5min否则dna易会被剪切成小片段失效);加入350μlneutralizationbuffer轻柔颠倒4~6次;于13000rpm离心10min;将离心所得上清液转移入spincolumn内,于6000rpm离心1min,并弃去移液管内液体;向spincolumn内加入650μlwashbuffer并于12000g离心1min,离心后弃去移液管内液体,之后重复此步骤1次;空管12000g离心1min,将spincolumn转移到无菌的1.5ml离心管中;将elutionbuffer提前加热至56℃,向spincolumn内加30μlelutionbuffe,并于室温中静置1min;12000rpm离心1min,得到的溶液即含有质粒dna;将提取出的dna进行浓度检测。提取出的质粒送至公司测序,使用u6引物将所得序列与sgrna比对,验证sgrna连接载体,获得egfr-sgrna/cas9质粒。
实施例4apt-pamam纳米与egrf-sgrna/cas9质粒的靶向递送纳米系统的制备
取apt-pamam纳米粉末10mg,使其超声重悬在10ml二次水中,然后加入2mg的egfr-sgrna/cas9质粒,低速搅拌过夜,即获得所需复合纳米。并测量其粒径电势,如图3复合纳米平均粒径为132nm,电势为-21.8mv。
实施例5靶向递送质粒的生物学验证
(1)基因水平
在所使用的sgrna上下游序列设计引物,通过pcr得到纳米复合物apt-pamam/egfr-sgrna/cas9作用后的目的序列,通过测序与野生型细胞序列对比,验证目的序列在sgrna序列位点发生碱基突变。通过基因水平检测,这种纳米系统能够成功递送重组质粒,并达到基因敲除的作用。
(2)细胞水平
取对数生长期的细胞,消化后将其铺在96孔板中,每孔细胞约1×104个,置于培养箱中培养,待细胞完全贴壁。设计四个不同实验组别(pbs,pamam,apt-pamam,apt-pamam-egfr-sgrna/cas9),作用24h后,每孔加入10ulmtt溶液,4h后使用dmso溶解,通过分光光度仪检测od值,计算各组对细胞的毒性大小。实验结果显示单独载体pamam具有较小的细胞毒性,当连接适配体apt与基因治疗crispr/cas9后复合纳米apt-pamam/egfr-sgrna/cas9有着显著的杀伤肿瘤细胞a549的能力。这种新型复合纳米通过基因治疗的手段为抗肿瘤研究提供了新的思路。
sequencelisting
<110>福州大学
<120>一种pamam与crispr/cas9系统重组质粒递送纳米粒的制备方法
<130>3
<160>3
<170>patentinversion3.3
<210>1
<211>20
<212>dna
<213>人工序列
<400>1
tgaaccgcacggcgccatgc20
<210>2
<211>25
<212>dna
<213>人工序列
<400>2
caccgtgaaccgcacggcgccatgc25
<210>3
<211>25
<212>dna
<213>人工序列
<400>3
aaacgcatggcgccgtgcggttcac25
- 还没有人留言评论。精彩留言会获得点赞!