基于柱芳烃的多肽缀合物、其制备方法及其应用与流程
本发明涉及生物医药领域,具体涉及一种基于柱芳烃的多肽缀合物、其制备方法及其应用。
背景技术:
近年来,癌症的发病率和死亡率急剧上升,成为严重威胁人类健康的疾病之一。尽管现下治疗癌症的手段多种多样,化学治疗仍然是目前临床治疗癌症最为主要的途径。但是,化疗药物在临床使用中面临许多问题,例如化疗药物多无靶向性,体内分布十分广泛,常在一些正常细胞蓄积,治疗剂量下对正常细胞和组织的毒副作用大,还有癌细胞的多重耐药性,导致治疗效果和应用范围受到限制。
整合素是介导细胞和外部环境连接的嵌段糖蛋白受体,对细胞的粘附、增殖、分化、转移、凋亡及新生血管形成有重要的调节作用,αvβ3就是其中的一种。αvβ3整合素在多种细胞均有表达,但在骨肉瘤、黑素瘤、神经母细胞瘤、胶质母细胞瘤、肺癌和乳腺癌等多种实体肿瘤表面高表达。精氨酸-甘氨酸-天冬氨酸(arg-gly-asp,rgd)三肽序列存在于多种生物细胞外基质和血浆蛋白结构中,可以和细胞表面的整合素受体特异性结合介导许多重要的生命活动。含rgd序列的多肽以其分子质量小、结构相对稳定并且容易制备等优点常用作为靶向基团。
多胺是真核生物细胞内普遍存在的脂肪胺类小分子,主要包括是精胺、腐胺和亚精胺。它参与调节细胞内一系列生理过程,为细胞提供存活能量,包括基因复制、翻译、细胞增殖、通路传导以及细胞膜稳定等。细胞内多胺水平的稳定对于细胞正常生理功能是很关键的。肿瘤细胞内多胺水平明显高于正常组织,并对肿瘤细胞的增殖起着关键的作用。通过下调细胞内多胺的合成或者上调细胞多胺的代谢来降低肿瘤细胞多胺水平已成为一个癌症治疗的潜在靶点。
柱芳烃作为新一代的超分子主体大环分子,具有高度对称的结构和疏水性空腔,易功能化,可以选择性键合客体小分子。其中柱[5]芳烃的空腔尺寸可以很好的络合线性脂肪链。
技术实现要素:
本发明的目的之一在于提供一种基于柱芳烃的多肽缀合物。
本发明的目的之二在于提供该多肽缀合物的制备方法。
本发明的目的之三在于提供该多肽缀合物在制备治疗癌症药物中的应用。
为达到上述目的,本发明采用如下技术方案:
一种基于柱芳烃的多肽缀合物,包括共价键连接的多肽和柱芳烃两部分,其特征在于该基于柱芳烃的多肽缀合物的结构通式为:
其中,n=0~5,b=1~8;c=1~7;r1为c1~c9的烷基基团。
上述的n为0或1;b为1、2或4;c为1、2、3或4;r1为c1、c2、c4的烷基基团。
1.一种制备上述的基于柱芳烃的多肽缀合物的方法,其特征在于该方法的具体步骤为:惰性气氛保护下,将单炔基修饰的柱芳烃的四氢呋喃溶液中加入至多肽的水溶液中,再分别加入cuso4·5h2o和抗坏血酸钠;常温搅拌4h,反应结束后减压蒸馏除去四氢呋喃溶液,离心取上清液,经rp-hplc纯化,得到基于柱芳烃的多肽缀合物;所述的柱芳烃、多肽cuso4·5h2o和抗坏血酸钠的摩尔比为:1.2:1:0.2:0.8;所述的柱芳烃的结构式为:
2.上述的柱芳烃采用如下方法制备:惰性气氛保护下,向烷氧基柱芳烃的二氯甲烷溶液中加入三溴化硼溶液,常温搅拌4h,用水淬灭反应,有机相用饱和食盐水洗涤,无水硫酸钠干燥,减压蒸馏浓缩后,过柱得到单羟基柱芳烃,所述的柱芳烃和三溴化硼的摩尔比为:1:0.9。惰性气氛保护下,向单羟基柱芳烃(1g,1.16mmol)的丙酮(50ml)溶液中加入碳酸钾(0.8g,5.8mmol),在65℃搅拌回流,滴加溴代烷(0.154ml,1.89mmol)溶液,约10min滴完,继续搅拌回流24h。停止反应待冷却到室温,抽滤除去碳酸钾,并用丙酮反复冲洗滤饼,合并有机相,减压蒸馏干溶剂得到单炔修饰的柱芳烃,所述的单羟基柱芳烃、碳酸钾和溴代烷的摩尔比为:1:5:1.5。
上述的多肽采用如下方法制备:根据氨基酸的序列以rink-酰胺树脂为固相载体,以hbtu-hobt为缩合剂,采取标准fmoc策略,利用微波多肽合成仪(cem,usa)合成目标肽序列。以三氟乙酸:苯甲硫醚:间甲酚:水(8.5:0.5:0.5:0.5,体积比)作裂解液,0℃反应30分钟,室温反应150分钟,将肽脱除保护基并从树脂上裂解下来。溶液经rp-hplc纯化,得到所需的纯肽化合物。。
一种基于柱芳烃的多肽缀合物在下调多胺的含量诱导肿瘤细胞凋亡中的应用。
一种基于柱芳烃的多肽缀合物在制备治疗肿瘤药物中的应用。
上述的肿瘤为骨肉瘤、黑素瘤、神经母细胞瘤、胶质母细胞瘤、肺癌或乳腺癌。
本发明的基于柱芳烃的多肽缀合物,其中多肽结构部分赋予其靶向性、溶解性,以及防止该缀合物与血浆蛋白的相互作用;柱芳烃作为效应分子,与细胞内的多胺发生超分子主客体络合作用,直接下调多胺的含量,抑制肿瘤的生长,发挥肿瘤治疗的作用。
本发明所述的柱芳烃指的是甲基柱[5]芳烃(mep5a)、乙基柱[5]芳烃(etp5a)、丁基柱[5]芳烃(bup5a),甲基柱[6]芳烃(mep6a)、乙基柱[6]芳烃(etp6a)、丁基柱[6]芳烃(bup6a)等,其结构如下面的式i所示:
其中,n为0、1、2、3、4或5;优选地,n为0或1;最优地,n为0;
r1选自下面的式ii:
其中,r1是烷基基团,a为0、1、2、3、4、5、6、7、8或9;优选地,a为0、1、3;最优地,a为1;
r2选自下面的式iii:
其中,r2是脂肪炔基团,b为1、2、3、4、5、6、7或8;优选地,b为1;
本发明所述的多肽序列为rgdsk(n3)e(e)cee,rgd是靶向序列,第四位为丝氨酸可产生最大的亲和性,赖氨酸是叠氮官能团修饰的,谷氨酸可以增加整条肽链的溶解性和减少与血浆蛋白的相互作用,其结构如下面的式iv所示:
其中c为1、2、3、4、5、6和7;优选地,c为1;
本发明所述的基于柱芳烃的多肽缀合物的最优结构是由单炔修饰的乙基柱[5]芳烃和引入叠氮基团的多肽rgdsk(n3)eeee,通过click点击化学反应形成均一稳定的化合物,其结构如下面的式v所示:
在本发明所述的多胺指的是精胺(spm)、亚精胺(spd)和腐胺(put),其结构如下面的式vi所示:
在本发明中,柱[5]芳烃含有多个苯环结构,可以与脂肪类阳离子或中性分子进行分子识别,超分子作用除了疏水作用外还有—c—h┄π,阳离子┄π等。将多肽与柱[5]芳烃相连接制备一种新的多肽缀合物,rgd序列肽可以将柱芳烃靶向递送到αvβ3整合素过表达的细胞表面,特异性胞吞让大量的缀合物进入细胞,柱[5]芳烃包裹细胞内的多胺分子形成主客体复合物,下调多胺的含量,诱导肿瘤细胞凋亡,从而发挥肿瘤治疗的作用。
本发明中,术语“超分子作用”指的是分子间的相互作用,包括静电作用、氢键、范德华力、π-π堆积和疏水作用等,是研究超分子化学的基础。术语“分子识别”指的是两个或两个以上的分子之间通过非共价键结合相互作用,产生某种特定功能的过程。
本发明的有益效果为:本发明设计合成了一种基于柱芳烃的多肽缀合物,反应条件温和高效,适用于工业生产,在一个小分子中集合了多种功能基团,为制备化疗药物提供了一个新的思路,有效地解决了肿瘤治疗的靶向性问题。
附图说明
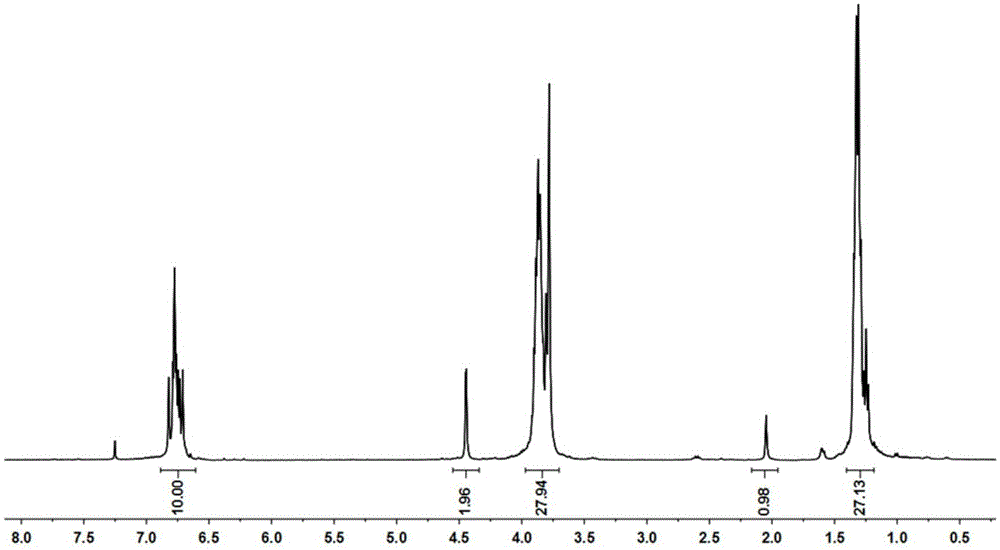
图1为实施例1中化合物3的1h-nmr图谱;
图2为实施例1中多肽rgdsk(n3)eeee纯化后的hplc图;
图3为实施例1中化合物p-etcp5a纯化后的hplc图;
图4为wcp5a和精胺(spm)作用的1h-nmr图谱;其中(a)spm;(b)wcp5a+spm;(c)wcp5a;d2o,2mm。
图5为wcp5a和亚精胺(spd)作用的1h-nmr图谱;其中(a)spd;(b)wcp5a+spd;(c)wcp5a;d2o,2mm。
图6为wcp5a和腐胺(put)作用的1h-nmr图谱;其中(a)put;(b)wcp5a+put;(c)wcp5a;d2o,2mm。
图7a为实施例2中化合物p-etcp5a对乳腺癌细胞mcf-7细胞抑制活性评价。
图7b为实施例2中化合物p-etcp5a对肝癌细胞hepg2细胞抑制活性评价。
图8为流式细胞仪检测细胞凋亡;示例2中化合物p-etcp5a的浓度为0μm(a)、25μm(b)、50μm(c)乳腺癌细胞mcf-7的凋亡情况,示例2中化合物p-etcp5a的浓度为0μm(d)、25μm(f)、50μm(e)肝癌细胞hepg2的凋亡情况。
具体实施方法
下面详细描述本发明的实施例,描述的实施例是示例性的,仅用于解释本发明,而不能理解为对本发明的限制。实施例中未注明具体条技术或条件的,按照本领域内文献所描述的常规技术或条件和制造商建议的技术或条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市购获得的常规产品。所用试剂的来源、商品名以及有必要列出其组成成分者,均在首次出现时标明,其后所用相同试剂如无特殊说明,均以首次标明的内容相同。
实施例1:基于柱[5]芳烃的多肽缀合物的合成,参见图1~图5,
1、乙氧基柱[5]芳烃衍生物的合成:
合成化合物2。氮气保护下,向化合物1(0.89g,1mmol)的二氯甲烷(50ml)溶液中加入三溴化硼(0.0835ml,0.9mmol)溶液。常温搅拌4h,用水淬灭反应,有机相用饱和食盐水洗涤,无水硫酸钠干燥,减压蒸馏浓缩后,过柱得到化合物2。
合成化合物3。氮气保护下,向化合物2(1g,1.16mmol)的丙酮(50ml)溶液中加入碳酸钾(0.8g,5.8mmol),在65℃搅拌回流,滴加3-溴丙炔(0.154ml,1.89mmol)溶液,约10min滴完,继续搅拌回流24h。停止反应待冷却到室温,抽滤除去碳酸钾,并用丙酮反复冲洗滤饼,合并有机相,减压蒸馏干溶剂得到化合物3,1h-nmr图谱如图1所示。
2、多肽rgdsk(n3)eeee的合成:
根据rgdsk(n3)eeee的氨基酸序列,合成ac-arg-gly-asp-ser-lys(n3)-glu-glu-glu-glu-nh2,以rink-酰胺树脂为固相载体,以hbtu-hobt为缩合剂,采取标准fmoc策略,利用微波多肽合成仪(cem,usa)合成目标肽序列。以20ml三氟乙酸:苯甲硫醚:间甲酚:水(8.5:0.5:0.5:0.5,体积比)作裂解液,0℃反应30分钟,室温反应150分钟,将肽脱除保护基并从树脂上裂解下来。溶液经rp-hplc纯化,得到多肽4,结果如图2所示。rp-hplc条件,a相:0.1%tfa/水;b相:0.1%tfa/70%乙腈/水;色谱柱:c8。q-ft-icr-ms:1145.1,结果如图3所示。
备注:本发明所制备的多肽4,氨基酸序列自左至右为从n末端至c末端。其中,对氨基酸序列n端的氨基进行了乙酰化修饰,对c端的羧基进行了酰胺化修饰。这是因为,化学合成的肽往往携带游离的氨基和游离的羧基,而肽的序列往往代表了母本蛋白的序列,为了与母本蛋白更为接近,肽末端往往进行封闭,即n端乙酰化和c端酰胺化,这些修饰会减少多肽的总电荷,降低多肽的溶解度,也可以使肽模拟它在母本蛋白中α氨基和羧基的原始状态。因此氨基酸序列依然是左端为n末端,右端为c末端。这些修饰不会对多肽的生物学活性产生显著的影响。
3、乙氧基柱[5]芳烃的多肽缀合物(p-etcp5a)的合成:
p-etcp5a;氮气保护下,将化合物3(1.88g,2.008mmol)的四氢呋喃(100ml)溶液加入至多肽4(2g,1.74mmol)的水(100ml)中,再分别加入cuso4·5h2o(87mg,0.348mmol)和抗坏血酸钠(0.27g,1.4mmol)。常温搅拌4h,反应结束后减压蒸馏除去四氢呋喃溶液,离心取上清液,经rp-hplc纯化,得到缀合物p-etcp5a,结果如图4所示。rp-hplc条件,a相:0.1%tfa/水;b相:0.1%tfa/90%乙腈/水;色谱柱:c8。q-ft-icr-ms:2045.58,结果如图5所示。
实施例2:wcp5a/多胺复合物的制备及表征
1、实验样品
由于多肽缀合物p-etp5a的1h-nmr图谱非常复杂,不利于分析其之间发生的主客体作用,所以选用一种水溶性的柱[5]芳烃(wcp5a)作为研究对象。
2、实验方法
准确称取21.25mg精胺(spm)、15.25mg亚精胺(spd)、9.26mg(put)腐胺(0.105mmol),分别和171mg水溶性柱[5]芳烃(wcp5a)(0.105mmol)混合,溶于5ml水中,充分搅拌均匀,然后将混合物的溶液进行真空冷冻干燥,得到多胺/wcp5a的复合物。所得复合物、水溶性柱[5]芳烃(wcp5a)和三种多胺溶于重水中,进行核磁测试。
3、实验结果
如下面的图6、7、8所示。
当多胺被水溶性柱[5]芳烃包结后,其化学位移值发生明显的变化,化学位移向高场移动,部分质子峰变宽。这表明多胺进入了水溶性柱[5]芳烃的空腔,受到主体分子的屏蔽效应,使得多胺的核磁信号峰向高场移动。部分峰型变宽基本消失,说明客体的该部分质子完全处在主体分子的空腔内屏蔽了核磁信号而导致。
实施例3:缀合物p-etp5a对肿瘤细胞抑制作用评价
1、实验样品
p-etcp5a由实施例1方法制得。
乳腺癌细胞mcf-7和肝癌细胞hepg2:均由北京协和细胞库提供。
2、试验方法
mcf-7用dmem培养基(含有10%fbs,1%青霉素/链霉素),hepg2用1640培养基(含有10%fbs,1%青霉素/链霉素)在5%co2,37℃恒温下培养,p-etcp5a溶于pbs制备成溶液。
收集对数期生长的细胞(mcf-7、hepg-2细胞),调整细胞悬液浓度,将细胞悬浮液接种于96孔板,铺板使待测细胞密度至约10000/孔,每孔100μl细胞悬液,在5%co2,37℃恒温下孵育24h,显微镜下观察可见细胞贴壁生长,吸出板中的培养基,然后加入90μl的培养基和10μlp-etcp5a。其中p-etcp5a浓度分别为100μm,80μm,60μm,40μm,20μm,10μm和1μm。每5个孔加入同样浓度的p-etcp5a,最后的5个孔加pbs作为空白对照。在摇床上轻摇5min后,将培养板放置于5%co2,37℃恒温培养箱中培养。48小时后,取出培养板,无菌条件下吸出板中的培养基,每孔加入90μl的pbs和10μl的cck-8溶液,继续孵育1h。在全自动酶标仪490nm处检测各孔的吸光值。
3、实验结果
如下面的图6所示。结果表明,p-etcp5a对乳腺癌细胞mcf-7抗肿瘤细胞抑制作用明显强于肝癌细胞hepg2,说明该缀合物起到了靶向治疗的效果。
实施例4:缀合物p-etp5a的细胞流式实验
1、实验样品
p-etcp5a由实施例1方法制得。
乳腺癌细胞mcf-7和肝癌细胞hepg2:均由北京协和细胞库提供。
2、试验方法
mcf-7用dmem培养基(含有10%fbs,1%青霉素/链霉素),hepg2用1640培养基(含有10%fbs,1%青霉素/链霉素)在5%co2,37℃恒温下培养,p-etcp5a溶于pbs制备成溶液。
收集对数期生长的细胞(mcf-7、hepg-2细胞),调整细胞悬液浓度,将细胞悬浮液接种于6孔板,铺板使待测细胞调密度至约200000/孔,每孔1.5ml细胞悬液,在5%co2,37℃恒温下孵育24h,显微镜下观察可见细胞贴壁生长,吸出板中的培养基,然后加入1.35ml的培养基和0.15mlp-etcp5a。其中p-etcp5a浓度分别为50μm和25μm。每2个孔加入同样浓度的p-etcp5a,最后的2个孔加pbs作为空白对照。在摇床上轻摇5min后,将培养板放置于5%co2,37℃恒温培养箱中培养。48小时后,取出培养板,无菌条件下将细胞悬浮液转移到离心管中,1000rpm离心3min,取出上清液,加入pbs再次离心3min去除上清液。然后每个离心管中加入400μl的buffer,吹打均匀得到细胞悬液,向细胞悬液中加入5μl的annexinv,fitc结合物,室温下避光培养20min,再加入10μlpisolution,室温下避光培养20min,加样到流式细胞仪检测。
3、实验结果
如下面的图7所示。结果表明,p-etcp5a包裹细胞内的多胺分子形成主客体复合物,诱导肿瘤细胞凋亡,从而起到了抑制肿瘤细胞的作用,并且对于αvβ3整合素过表达的乳腺癌细胞mcf-7促凋亡的效果明显优于肝癌细胞hepg2。
尽管本发明的具体实施方式已经得到详细的描述,本领域技术人员将会理解。根据已经公开的方法和数据,可以对细节进行各种修改和替换,这些改变均在本发明的保护范围之内。本发明的全部范围由所附权利要求及其任何等同物给出。
- 还没有人留言评论。精彩留言会获得点赞!