神经元活化剂的制作方法
本公开涉及使神经元活化的神经元活化剂。
背景技术:
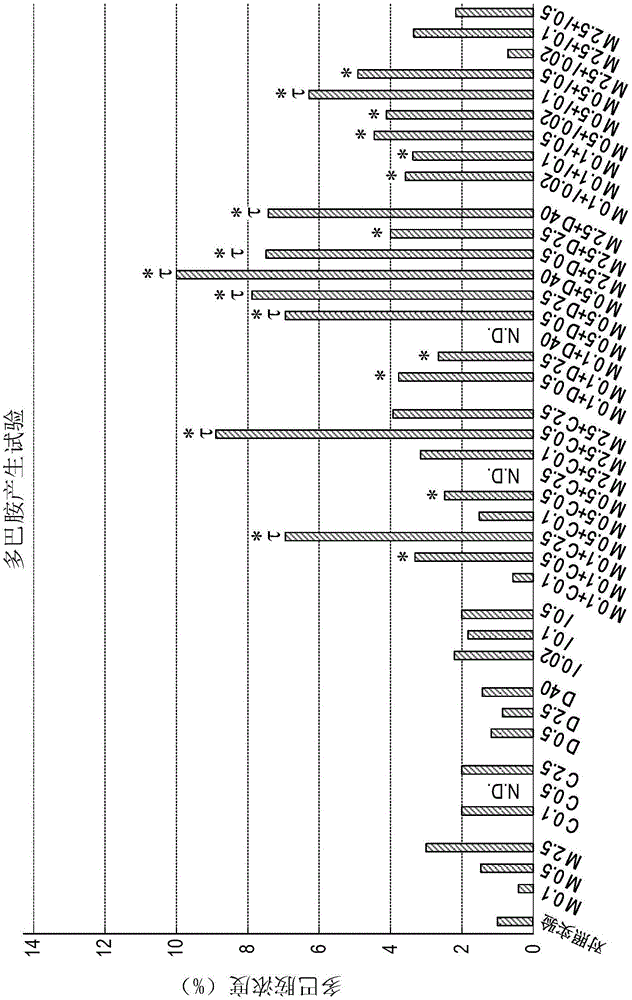
:近年来,为应对老龄化社会而进行了痴呆症的研究。作为痴呆症之一有帕金森病。帕金森病的发展被认为是由于多巴胺能神经元的变性以及脱落而使神经元的多巴胺产生能力下降所导致的。于是,以往对抑制神经元的多巴胺产生能力的下降或促进多巴胺产生进行了研究(例如,日本特开2006-321737号公报、日本特开2008-19242号公报、以及日本特开2015-208282号公报)。本申请的发明人对促进神经元的多巴胺产生能力的、不同于以往技术的物质进行了锐意钻研。此外,已知痴呆症的发病原因存在各种原因,不过,其中由于神经元的损伤以及变性而引起痴呆症的情况居多。神经元是一种特化的细胞,其延伸有长的神经突起以用来传递刺激信息。因此,以往开发了用于抑制神经元的损伤以及变性的药品。申请人常年开发使用山嵛菜成分的医药品以及功能性食品(日本特开2010-202559号公报、日本特开2015-051927号公报)。申请人尝试了利用山嵛菜成分促进神经元延伸。此外,包括为了应对考试、资格考核等而学习的学生或社会人在内,从年轻一代到老年一代均在寻求保持以及提高记忆力、学习能力等脑功能。作为由脑功能下降而引起的疾病,不仅包括以阿尔茨海默病为代表的痴呆症,还可以列举抑郁症、谵妄等精神疾病。导致脑功能下降的原因之一是神经元的死亡。神经元的死亡被认为是由β淀粉样蛋白等的累积而引起的。若β淀粉样蛋白在脑内纤维化并形成斑块(老年斑)而积累,则受其影响而会引起tau蛋白或突触的异常变化。因为该异常变化,使神经元内的物质输送以及神经元之间的信息传递受到阻碍,从而导致脑功能下降。近年来,对天然原材料有助于预防和改善脑功能的下降进行了探索研究。作为如上所述的天然原材料,已知有例如迷迭香、米糠等(日本特表2013-526865号公报)、银杏叶、姜黄素、虾青素等(日本特开2015-107960号公报)。此外,作为具有减少β淀粉样蛋白的效果的物质,还已知有dha等(日本特开2015-147775号公报)。现在迫切希望发现进一步有助于预防和改善脑功能下降的物质,并对其用于医药等方面的可能性进行探讨。技术实现要素:本公开优选提供一种新型的神经元活化剂。本公开的一个方面在于希望提供能够促进神经元的多巴胺产生能力的新型的多巴胺产生促进剂。本公开的一个方面在于希望提供能够促进神经元延伸的神经元延伸促进剂。本公开的一个方面在于希望提供能够增强神经元对β淀粉样蛋白的抗性的β淀粉样蛋白抗性增强剂。本公开涉及一种使神经元活化的神经元活化剂,所述神经元活化剂选自由促进所述神经元产生多巴胺的多巴胺产生促进剂、促进所述神经元的延伸的神经元延伸促进剂、以及增强所述神经元对β淀粉样蛋白的抗性的β淀粉样蛋白抗性增强剂组成的组中的一种以上,并且,所述神经元活化剂含有:6-甲基亚磺酰基己基异硫氰酸酯类或其配糖体;以及选自由不饱和脂肪酸和多酚组成的组中的一种以上。附图说明图1是示出实验例1的多巴胺产生试验结果的图。图2是示出实验例2的6-甲基亚磺酰基己基异硫氰酸酯(6-msitc)的毒性试验结果的图。图3是示出实验例2的姜黄素的毒性试验结果的图。图4是示出实验例2的dha的毒性试验结果的图。图5是示出实验例2的异鼠李素的毒性试验结果的图。图6是神经元的说明图。图7是示出实验例3的延伸试验结果的图。图8是示出实验例4的6-甲基亚磺酰基己基异硫氰酸酯(6-msitc)的毒性试验结果的图。图9是示出实验例4的姜黄素的毒性试验结果的图。图10是示出实验例4的dha的毒性试验结果的图。图11是示出实验例4的异鼠李素的毒性试验结果的图。图12是示出实验例5的β淀粉样蛋白神经毒性抗性试验结果的图。图13是示出实验例6的过氧化氢毒性抗性试验结果的图。具体实施方式本公开的实施方式为使神经元活化的神经元活化剂。神经元活化剂选自由促进神经元产生多巴胺的多巴胺产生促进剂、促进神经元的延伸的神经元延伸促进剂、以及增强神经元对β淀粉样蛋白的抗性的β淀粉样蛋白抗性增强剂组成的组中的一种以上。本实施方式的神经元活化剂含有:6-甲基亚磺酰基己基异硫氰酸酯(以下也称为“6-msitc”)类或其配糖体等异硫氰酸酯类;以及选自由不饱和脂肪酸和多酚组成的组中的一种以上。在本实施方式中,多巴胺产生促进剂含有:选自由6-甲基亚磺酰基己基异硫氰酸酯(以下也称为“6-msitc”)类或其配糖体等异硫氰酸酯类、不饱和脂肪酸、以及多酚组成的组中的一种以上。根据本实施方式的多巴胺产生促进剂,能够促进神经元的多巴胺产生能力。本实施方式的多巴胺产生促进剂促进神经元产生多巴胺。在本实施方式中,神经元延伸促进剂含有:6-甲基亚磺酰基己基异硫氰酸酯(以下也称为“6-msitc”)类或其配糖体等异硫氰酸酯类;以及选自由不饱和脂肪酸和多酚组成的组中的一种以上。根据本实施方式的神经元延伸促进剂,能够促进神经元的延伸。本实施方式的神经元延伸促进剂促进神经元的神经突起延伸。在本实施方式中,β淀粉样蛋白抗性增强剂含有:6-甲基亚磺酰基己基异硫氰酸酯(以下也称为“6-msitc”)类或其配糖体等异硫氰酸酯类;以及选自由不饱和脂肪酸和多酚组成的组中的一种以上。根据本实施方式的β淀粉样蛋白抗性增强剂,能够增强神经元对β淀粉样蛋白的抗性。本实施方式的β淀粉样蛋白抗性增强剂能够提高神经元对β淀粉样蛋白的抗性,从而能够保护神经元。异硫氰酸酯类、不饱和脂肪酸、以及多酚是神经元活化剂的构成组分,并且还是多巴胺产生促进剂、神经元延伸促进剂、以及β淀粉样蛋白抗性增强剂的构成组分。以下对异硫氰酸酯类、不饱和脂肪酸、以及多酚进行说明。异硫氰酸酯类在本实施方式中,异硫氰酸酯类是指含有-ncs基团的化合物。异硫氰酸酯类可以含有例如脂肪族或芳香族的基团作为支链。作为含有脂肪族基团的异硫氰酸酯类可列举例如:选自由异硫氰酸异丙酯、异硫氰酸异丁酯、异硫氰酸仲丁酯、异硫氰酸异戊酯、异硫氰酸戊酯、异硫氰酸烯丙酯、异硫氰酸3-丁烯酯、异硫氰酸4-戊烯酯、异硫氰酸5-己烯酯、异硫氰酸6-庚烯酯、异硫氰酸3-甲硫基丙酯、异硫氰酸4-甲硫基丁酯、异硫氰酸5-甲硫基戊酯、异硫氰酸6-甲硫基己酯、异硫氰酸7-甲硫基庚酯、4-甲基亚磺酰基丁基异硫氰酸酯、5-甲基亚磺酰基戊基异硫氰酸酯、6-甲基亚磺酰基己基异硫氰酸酯类(6-msitc类)、以及7-甲基亚磺酰基庚基异硫氰酸酯组成的组中的1种以上,其中,优选4-甲基亚磺酰基丁基异硫氰酸酯、5-甲基亚磺酰基戊基异硫氰酸酯、6-msitc类、7-甲基亚磺酰基庚基异硫氰酸酯。作为具有芳香族基团的异硫氰酸酯类,可列举例如苯乙基异硫氰酸酯。在本实施方式中,异硫氰酸酯类是还包括配糖体的概念。在本实施方式中,在异硫氰酸酯类中优选6-msitc类或其配糖体。在本实施方式中,6-msitc类是包括6-msitc以及6-msitc类似物的意思。由以下式1表示6-msitc。在本实施方式中,6-msitc类似物包括天然存在的6-甲基亚磺酰基己基异硫氰酸酯的类似物、以及非天然存在的而是通过合成而获得的6-甲基亚磺酰基己基异硫氰酸酯的类似物。是指例如异硫氰酸6-甲硫基己酯(具有硫未被氧化的结构,即具有甲基硫醚基的结构)以及6-甲基磺酰基己基异硫氰酸酯(具有硫被过氧化的结构,即具有含甲基磺酰基的结构)等。本实施方式使用的6-msitc类包含在例如十字花科植物中。十字花科中的山嵛菜以及/或者西洋山嵛菜含有较多的6-msitc类。本实施方式使用的6-msitc类可以通过化学合成法获取,也可以从植物提取精炼而成。作为可作为6-msitc类的原料的植物可列举例如:藜木科(bataceae)、十字花科(brassicaceae)、伯乐树科(bretschneideraceae)、山柑科(capparaceae)、番木瓜科(caricaceae)、大戟科(euphorbiaceae)、环蕊科(gyrostemonaceae)、池花科(limnanthaceae)、辣木科(moringaceae)、瘤药树科(pentadiplandraceae)、商陆科(phytolaccaceae)、海桐科(pittosporaceae)、木犀草科(resedaceae)、刺茉莉科(salvadoraceae)、烈味三叶草科(tovariaceae)、旱金莲科(tropaeolaceae)的植物等。具体有,例如山嵛菜(wasabiajaponica)[别称:山葵]、西洋山嵛菜(armoraciarusticana)[别称:西洋山葵]、白楔(batismaritima)、芥菜(brassicajuncea)、花椰菜(brassicaoleraceavar.italica)、拟南芥(arabidopsisthaliana)、荠菜(capsellabursa-pastoris)、豆瓣菜(nasturtiumofficinale)、伯乐树属(bretschneiderasinensis)、续随子(capparisspinosa)、番木瓜(caricapapaya)、drypetesroxburghii(中文名不详);putranjivaroxburghii(中文名不详)、tersoniabrevipes(中文名称不详)、荷包蛋花(limnanthesdouglasii)、辣木(moringaoleifera)、pentadiplandrabrazzeana(中文名不详)、垂序商陆(phytolaccaamericana)、bursarisspinosevar.incana(中文名不详)、白木犀草(resedaalba)、山柑藤(salvadorapersica)、芹味草(tovariapendula)、旱金莲(tropaeolummajus)等。不过,本公开可使用的6-msitc类不限于从上述植物获取,也可以使用所有含6-msitc类的天然资源作为原料。作为所述植物的提取精炼方法,可列举例如从作为十字花科植物的山嵛菜或西洋山嵛菜中提取6-msitc类的方法等。优选的提取方法已由日本专利3919489号公报公开。在本实施方式中,6-msitc类的配糖体是糖残基与6-msitc类结合而形成的化合物。与6-msitc类结合的糖残基可以是选自由葡萄糖、鼠李糖、果糖以及半乳糖组成的组中的1种以上的糖,不过更优选葡萄糖。糖残基既可以是单糖也可以是多糖,不过优选单糖。单糖是指含有单糖分子的糖。多糖是2个以上的单糖分子结合而形成的糖链。多糖可以是由2个以上10个以下的单糖结合而形成的,不过更优选由2个以上5个以下的单糖结合而形成。与6-msitc类结合的糖残基的结合位置可以是-ncs基团部分,不过更优选与s结合。6-msitc类的配糖体例如有6-甲基硫氧己基芥子油苷(glucohesperin)。6-甲基硫氧己基芥子油苷(glucohesperin)是由以下式2表示的化合物。6-msitc类的配糖体可从山嵛菜等含有6-msitc类的配糖体的植物中获取。例如,利用加热(还包括电磁波、远红外线、煅烧等)、干燥、冷冻、酶处理、化学处理等方法在使该植物的酶促反应停止后,利用水、有机溶剂等进行溶剂提取,或进行压搾、干燥、粉碎、精炼、酶促反应、化学反应等,由此,提取6-msitc类的配糖体,或对6-msitc类的配糖体进行分离和精炼。此外,6-msitc类的配糖体也可以通过化学合成而制得。不饱和脂肪酸不饱和脂肪酸是指含有1个或2个以上的双键的脂肪酸。优选含有2个以上的双键的不饱和脂肪酸。不饱和脂肪酸的碳原子数无特别限定,不过优选12~24个,更优选15~24个,特别优选18~22个。不饱和脂肪酸含有的双键的位置可以是ω3位、ω6位、以及ω9位中任一个以上的位置。不饱和脂肪酸尤其优选ω3脂肪酸。ω3脂肪酸是指在脂肪酸的至少ω3位上具有双键的不饱和脂肪酸。作为ω3脂肪酸可列举例如:二十二碳六烯酸(dha,22:6(△4,7,10,13,16,19))、二十二碳五烯酸(dpa,22:5(△7,10,13,16,19))、二十碳五烯酸(epa,20:5(△5,8,11,14,17))、α-亚麻酸(ala,18:3(△9,12,15))。ω3脂肪酸可从鱼贝类以及/或鱼油中提取。dha包含在例如沙丁鱼、鲭鱼、秋刀鱼等背部发青的青鱼类中。epa包含在例如鳕鱼、鲱鱼、鲭鱼、大麻哈鱼、沙丁鱼、磷虾等的鱼油中。其中,ω3脂肪酸可以是dha和epa,更优选dha。多酚在本实施方式中,多酚是指,分子内具有多个酚性羟基的化合物的总称。多酚可以选自由类姜黄素和黄酮类组成的组中的1种以上。类姜黄素可由以下式3表示。(式3中,ar表示含有oh基的芳香族基团。)类姜黄素可列举姜黄素、二甲氧基姜黄素、双二甲氧基姜黄素,其中优选姜黄素。在姜黄素中例示如以下式4中的(i-i)~(i-iv)所示之物。作为含有姜黄素的组分可列举例如姜黄提取物、姜黄色素、或印度姜黄色素等。类姜黄素可以从姜黄中提取。含姜黄素的类姜黄素可通过例如以姜黄等为原料,并通过使用有机溶剂、醇溶剂等的提取分离法、合成方法而获得。黄酮类优选由下列式5表示的黄酮醇。(式5中,x表示-o-或-oh,y表示-o-或-oh,z表示-o-或-oh,x、y以及z中具有共计2个以上的-oh。n表示1~4的整数,m表示1~5的整数。)作为黄酮醇,可列举下列式6中的(ii-i)~(ii-vi)以及式7中的(ii-vii)~(ii-xi)所示之物。其中,优选式6中的(ii-iii)所示的异鼠李素。作为含异鼠李素的组分,可列举例如银杏提取物。黄酮类可从银杏叶中提取。黄酮类可利用已知的方法从含黄酮类的植物中提取,或利用已知的合成方法获取。异鼠李素可利用已知的方法从银杏叶中提取。本实施方式的神经元活化剂可单独含有6-msitc类、二十二碳六烯酸(dha)、姜黄素、异鼠李素,或者也可以含有6-msitc类、二十二碳六烯酸(dha)、姜黄素、异鼠李素中的2者以上的组合。本实施方式的神经元活化剂可含有以下组分的组合。·6-msitc类和dha的组合·6-msitc类和姜黄素的组合·6-msitc类和异鼠李素的组合本实施方式的神经元活化剂还可以含有添加剂。作为添加剂,可以配合例如赋形剂、崩解剂、粘合剂、抗氧化剂、包衣剂、着色剂、矫味矫臭剂、表面活性剂、塑化剂等。此外,在无损于神经元活化剂的效果的范围内,还可以在本实施方式的神经元活化剂中配合抗过敏剂、清凉剂、维生素类、以及其他生药。本实施方式的神经元活化剂也可以包含在食品、准药品、医药品中。含有本实施方式的神经元活化剂的食品的形态为任意形态,没有限定。作为具体的食品的形态可列举例如一般食品、一般饮用品、营养补充品、健康食品、功能性标识食品、特定保健用食品等保健功能食品以及特殊用途食品、软性饮料、茶类饮料、能量饮料、葡萄酒等酒精饮料、糕点、米饭类、面包类、面条类、副食类、调料等。含有本实施方式的神经元活化剂的医药品以及准药品的使用方法为任意形式,没有限定,可列举例如内用外用剂等。含有本实施方式的神经元活化剂的医药品以及准药品的剂形没有限定,可列举例如胶囊剂、片剂、散剂、颗粒剂、液体剂等。本实施方式的神经元活化剂可以选自由多巴胺产生促进剂、神经元延伸促进剂、以及β淀粉样蛋白抗性增强剂组成的组中的一种以上,并可以用于予防或治疗与神经元相关的疾病或症状。本实施方式的神经元活化剂可用于选自以下组中的神经病变的予防或治疗,即:例如痴呆症、2型糖尿病、阿尔茨海默型痴呆症、糖尿病、帕金森病、传染性海绵状脑病即“疯牛病”、甲状腺髓样癌、心律失常、动脉硬化、类风湿关节炎、主动脉内侧淀粉样变、泌乳素瘤、家族性淀粉样变性周围神经病、遗传性非神经病变性淀粉样变、透析性淀粉样变、芬兰型淀粉样变、格子状角膜营养不良、脑淀粉样血管病、全身性al淀粉样变、包涵体肌炎(散发性包涵体肌炎)、嗜铬细胞瘤、骨髄炎、多发性骨髄瘤、脑炎、脑膜炎、前阿尔茨海默病、轻度认知障碍、早期阿尔茨海默病、后期阿尔茨海默病、与年龄增长相关的痴呆症、亨廷顿病、多发性硬化症、肌萎缩侧索硬化症(als或卢·贾里格症)、朊蛋白病、克雅氏病、路易体病、弗里德赖希共济失调、中风、遗传性脑病、精神分裂症、抑郁症、双相型障碍、注意缺陷多动障碍(adhd)、自闭症、亚斯伯格症候群、以及唐氏症候群。本实施方式的神经元活化剂适用于以下用途。·含有神经元活化剂的神经元活化用医药组合物。·含有神经元活化剂的神经元活化用食品组合物。·在制备神经元活化促进剂中的应用。·在制备含有神经元活化剂的神经元活化用医药组合物中的应用。·在制备含有神经元活化剂的神经元活化用食品组合物中的应用。·向个体施用神经元活化剂的改善神经元的方法。·向个体施用神经元活化用医药组合物的改善神经元的方法。·向个体施用神经元活化用食品组合物的改善神经元的方法。·组合物在制备使神经元活化的神经元活化剂中的应用,其中,所述神经元活性剂选自由促进所述神经元的多巴胺产生的多巴胺产生促进剂、促进所述神经元的延伸的神经元延伸促进剂、以及用于增强所述神经元对β淀粉样蛋白的抗性的β淀粉样蛋白抗性增强剂组成的组中的一种以上,所述组合物含有:6-甲基亚磺酰基己基异硫氰酸酯类或其配糖体、以及选自由不饱和脂肪酸和多酚组成的组中的一种以上。(多巴胺产生促进剂)本实施方式的神经元活化剂可以是多巴胺产生促进剂。当本实施方式的多巴胺产生促进剂含有6-msitc类以及二十二碳六烯酸(dha)时,dha与6-msitc类的摩尔比可以是0.2以上400以下,优选0.2以上80以下,更优选1以上80以下。当本实施方式的多巴胺产生促进剂含有6-msitc类以及姜黄素时,姜黄素与6-msitc类的摩尔比可以是0.04以上25以下,优选0.2以上25以下。当本实施方式的多巴胺产生促进剂含有6-msitc类以及异鼠李素时,异鼠李素与6-msitc类的摩尔比可以是0.008以上5以下,优选0.04以上0.2以下。在以上所述的诸情形下,可更有效地促进从神经元产生多巴胺的效果。在考虑患者的年龄、性別、体重、用法、用量等的前提下确定本实施方式的多巴胺产生促进剂的施用量。作为用法,可列举口服施用、血管注射、外用涂敷等。当口服施用时,多巴胺产生促进剂中的6-msitc类的每日的施用量可以是10μg~100mg/日,不饱和脂肪酸的施用量可以是100mg/日~10g/日,多酚的施用量可以是0.1mg/日~10g/日。当本实施方式的多巴胺产生促进剂的用法为血管注射时,多巴胺产生促进剂中的6-msitc类的每日的施用量可以是1μg/日~5mg/日,不饱和脂肪酸的施用量可以是1mg/日~100mg/日,多酚的施用量可以是0.1μg/日~1mg/日。本实施方式的多巴胺产生促进剂适用于以下用途。·含有多巴胺产生促进剂的多巴胺产生促进用医药组合物。·含有多巴胺产生促进剂的多巴胺产生促进用食品组合物。·在制备多巴胺产生促进剂中的应用。·在制备含有多巴胺产生促进剂的多巴胺产生促进用医药组合物中的应用。·在制备含有多巴胺产生促进剂的多巴胺产生促进用食品组合物中的应用。·向个体施用多巴胺产生促进剂的促进多巴胺产生的方法。·向个体施用多巴胺产生促进用医药组合物的促进多巴胺产生的方法。·向个体施用多巴胺产生促进用食品组合物的促进多巴胺产生的方法。(神经元延伸促进剂)本实施方式的神经元活化剂可以是神经元延伸促进剂。当本实施方式的神经元延伸促进剂含有6-msitc类以及二十二碳六烯酸(dha)时,dha与6-msitc类的摩尔比可以是0.2以上400以下,优选0.2以上80以下,更优选0.2以上16以下。当本实施方式的神经元延伸促进剂含有6-msitc类以及姜黄素时,姜黄素与6-msitc类的摩尔比可以是0.04以上25以下,优选0.04以上1以下,更优选0.2以上1以下。当本实施方式的神经元延伸促进剂含有6-msitc类以及异鼠李素时,异鼠李素与6-msitc类的摩尔比可以是0.008以上5以下,优选0.008以上1.0以下,更优选0.008以上0.2以下。在以上所述的诸情形下,可更有效地促进使神经突起延伸的效果。在考虑患者的年龄、性別、体重、用法、用量等的前提下确定本实施方式的神经元延伸促进剂的施用量。作为用法,可列举口服施用、血管注射、外用涂敷等。当口服施用时,神经元延伸促进剂中的6-msitc类的每日的施用量可以是10μg~100mg/日,不饱和脂肪酸的施用量可以是100mg/日~10g/日,多酚的施用量可以是0.1mg/日~10g/日。当本实施方式的神经元延伸促进剂的用法为血管注射时,神经元延伸促进剂中的6-msitc类的每日的施用量可以是1μg/日~5mg/日,不饱和脂肪酸的施用量可以是1mg/日~100mg/日,多酚的施用量可以是0.1μg/日~1mg/日。本实施方式的神经元延伸促进剂适用于以下用途。·含有神经元延伸促进剂的神经元延伸促进用医药组合物。·含有神经元延伸促进剂的神经元延伸促进用食品组合物。·在制备神经元延伸促进剂中的应用。·在制备含有神经元延伸促进剂的神经元延伸促进用医药组合物中的应用。·在制备含有神经元延伸促进剂的神经元延伸促进用食品组合物中的应用。·向个体施用神经元延伸促进剂的促进神经元的延伸的方法。·向个体施用神经元延伸促进用医药组合物的促进神经元的延伸的方法。·向个体施用神经元延伸促进用食品组合物的促进神经元的延伸的方法。(β淀粉样蛋白抗性增强剂)本实施方式的神经元活化剂可以是β淀粉样蛋白抗性增强剂。本实施方式的β淀粉样蛋白抗性增强剂含有6-甲基亚磺酰基己基异硫氰酸酯类或其配糖体。当本实施方式的β淀粉样蛋白抗性增强剂含有6-msitc类以及二十二碳六烯酸(dha)时,dha与6-msitc类的摩尔比可以是0.2以上400以下,优选0.2以上80以下,更优选1以上80以下。当本实施方式的β淀粉样蛋白抗性增强剂含有6-msitc类以及姜黄素时,姜黄素与6-msitc类的摩尔比可以是0.04以上25以下,优选0.2以上25以下。当本实施方式的β淀粉样蛋白抗性增强剂含有6-msitc类以及异鼠李素时,异鼠李素与6-msitc类的摩尔比可以是0.008以上5以下,优选0.04以上0.2以下。在以上所述的诸情形下,可更有效地提高神经元对β淀粉样蛋白的抗性。在考虑患者的年龄、性別、体重、用法、用量等的前提下确定本实施方式的β淀粉样蛋白抗性增强剂的施用量。作为用法,可列举口服施用、血管注射、外用涂敷等。当口服施用时,β淀粉样蛋白抗性增强剂中的6-msitc类的每日的施用量可以是10μg~100mg/日,不饱和脂肪酸的施用量可以是100mg/日~10g/日,多酚的施用量可以是0.1mg/日~10g/日。当本实施方式的β淀粉样蛋白抗性增强剂的用法为血管注射时,β淀粉样蛋白抗性增强剂中的6-msitc类的每日的施用量可以是1μg/日~5mg/日,不饱和脂肪酸的施用量可以是1mg/日~100mg/日,多酚的施用量可以是0.1μg/日~1mg/日。本实施方式的β淀粉样蛋白抗性增强剂适用于以下用途。·含有β淀粉样蛋白抗性增强剂的β淀粉样蛋白抗性增强用医药组合物。·含有β淀粉样蛋白抗性增强剂的β淀粉样蛋白抗性增强用食品组合物。·在制备β淀粉样蛋白抗性增强剂中的应用。·在制备含有β淀粉样蛋白抗性增强剂的β淀粉样蛋白抗性增强用医药组合物中的应用。·在制备含有β淀粉样蛋白抗性增强剂的β淀粉样蛋白抗性增强用食品组合物中的应用。·向个体施用β淀粉样蛋白抗性增强剂的增强神经元对β淀粉样蛋白的抗性的方法。·向个体施用β淀粉样蛋白抗性增强用医药组合物的增强神经元对β淀粉样蛋白的抗性的方法。·向个体施用β淀粉样蛋白抗性增强用食品组合物的增强神经元对β淀粉样蛋白的抗性的方法。[实施例](实验例1)使用各种组分并以如下方式进行了pc12细胞的多巴胺产生试验。(1)各种组分的调配(a)6-msitc(组分1)获取6-msitc(金印株式会社制造)。本实验例中所使用的6-msitc通过化学合成法制得。6-msitc的化学合成法的具体说明如下所示。原理上根据kjaer等方法(kjaer等,actachem..scand.,11,1298,1957)。使用6-氯己醇,并与ch3-sna回流以制得6-甲硫基己醇。对其作用氯化亚砜(socl2),以制得6-氯己基甲基硫化物。接下来利用盖布瑞尔法,通过酞酰亚胺钾盐导入氨基,以生成n-(6-甲硫基己基)-邻苯二甲酰亚胺。向其中添加水合肼并回流,以制得6-甲硫基己基胺,之后作用二氯硫化碳,以制得6-甲硫基己基异硫氰酸酯。此外,利用间氯过氧苯甲酸氧化所制得的6-甲硫基己基异硫氰酸酯中的甲硫基,以制得6-甲基亚磺酰基己基异硫氰酸酯(6-msitc)(morimitsu等,j.biol.chem.,277,3456,2002)。此外,本发明所涉及的6-msitc含在十字花科植物等中,也可以利用溶剂提取或粉碎等方法从十字花科植物等中获得6-msitc。将100mg的6-msitc溶解到dmso(二甲基亚砜)溶剂中,以调配出含有100mm的6-msitc的6-msitc溶液。(b)dha(组分2)获取dha(nacalaitesque公司制造,产品编号14122-64)。该dha是从例如沙丁鱼、鲭鱼、秋刀鱼等背部发青的青鱼类中提取的。将100mg的dha溶解到dmso溶剂中,以调配出含有100mm的dha的dha溶液。(c)姜黄素(组分3)获取姜黄素(cas编号458-37-7,东京化成工业株式会社制造,产品编号c2302)。姜黄素如以下式8所示。该姜黄素是合成物。将67.56mg的姜黄素溶解到dmso溶剂中,以调配出含有200mm的姜黄素的姜黄素溶液。(d)异鼠李素(组分4)获取异鼠李素(extrasynthese公司制造,产品编号1120s)。异鼠李素是从银杏叶中提取的。使用移液器将10mg的异鼠李素溶解到dmso溶剂中,以调配出含有10mm异鼠李素的异鼠李素溶液。(2)制备培养基准备含有以下组分的增殖培养基a和分化培养基b。(a)增殖培养基a的成分dmem(dulbecco’smodifiedeaglemedium,nacalaitesque公司制造,产品编号08458-45)10wt%的马血清(赛默飞世尔科技公司制造,产品编号16050-122)5wt%牛血清(赛默飞世尔科技公司制造,产品编号10437-028)1wt%青霉素链霉素(nacalaitesque公司制造,产品编号26253-84)(b)分化培养基b的成分dmem(dulbecco’smodifiedeaglemedium,nacalaitesque公司制造,产品编号08458-45)2wt%马血清(赛默飞世尔科技公司制造,产品编号16050-122)1wt%青霉素链霉素(nacalaitesque公司制造,产品编号26253-84)(3)pc12细胞增殖向细胞培养用烧瓶(tpp公司制造)加入上述增殖培养基a,并加入pc12细胞(理化学研究所制造,产品编号rcb0009)使其增殖。pc12细胞是来自白鼠的肾上腺髓质的嗜铬细胞瘤,并且是神经元分化的模型。当pc12细胞的汇合度达到80-90%时,将已增殖的pc12细胞移入到加入有增殖培养基a的新的烧瓶中进行传代培养。使细胞已增殖的培养液与新的增殖培养基a的比例为1:5(体积比)。如上所述的传代培养反复进行3次以上。(4)pc12细胞分化向96孔板的各孔中均接种100μl的在上述(3)中获得的以5×104/ml的浓度含有传代培养后的pc12细胞的增殖培养基a。在室温下放置一晩,以使pc12细胞稳定化。使孔板离心旋转,以使pc12细胞在孔板各孔中沉降。并去除上清液。向沉降有pc12细胞的各孔中均加入100μl的分化培养基b并进行搅拌,以使pc12细胞悬浮在分化培养基b中。向各孔内的分化培养基b中均加入ngf(sigma-aldrich公司制造,产品编号n2513)。所有的孔内的培养基所含的ngf浓度均为50ng/ml。然后,将上述(1)中制备的各种组分1~4以1种或2种组合的方式且以各种浓度加入到各孔内的培养基中,以制成以下各样本1~39。表1示出各孔内的培养基中构成各样本的组分的浓度。[表1](单位:μm)样本6-msitc姜黄素dha异鼠李素c10.120.532.540.150.562.570.582.5940100.02110.1120.5130.10.1140.10.5150.12.5160.50.1170.50.5180.52.5192.50.1202.50.5212.52.5220.10.5230.12.5240.140250.50.5260.52.5270.540282.50.5292.52.5302.540310.10.02320.10.1330.10.5340.50.02350.50.1360.50.5372.50.02382.50.1392.50.5将孔板放入二氧化碳培养箱(5%co2,37℃)内,对pc12细胞培养72小时。(5)多巴胺产生的评价测定各上清液中的多巴胺浓度。依照规格说明并使用elizakit(immusmol公司制造,产品编号:ba-e-5300)对多巴胺浓度进行了测定。当将对照实验的上清液中的多巴胺浓度设为1时,以百分比(%)示出使用各样本时的上清液中的多巴胺浓度的比率。测定结果如图1所示。在图1中,“m”、“c”、“d”、“i”依次表示“6-msitc”、“姜黄素”、“dha”、“异鼠李素”。该规定同样适用于图2~图5。在图1中,τ表示统计学上具有显著性。*表示确认到通过组合2种组分而具有协同效应。在此,协同效应是指,组合使用2种组分时产生的多巴胺的量多于单独使用各组分时的多巴胺产生量之和的情形。如图1所示,当培养基中含有6-msitc、姜黄素、dha、异鼠李素中的任一组分时,与不含这些组分的情形相比,能够提高多巴胺产生能力。并且,6-msitc的多巴胺产生效果高于姜黄素、dha、异鼠李素。在向培养基中添加有6-msitc的情形下,当6-msitc为0.5μm、2.5μm时,pc12细胞的多巴胺产生量多于对照实验。在向培养基中添加有姜黄素的情形下,当姜黄素为0.1μm、2.5μm时,pc12细胞的多巴胺产生量多于对照实验。在向培养基中添加有dha的情形下,当dha为0.5μm、40μm时,pc12细胞的多巴胺产生量多于对照实验。在向培养基中添加有异鼠李素的情形下,当异鼠李素为0.02μm、0.1μm、0.5μm时,pc12细胞的多巴胺产生量多于对照实验。经确认,当对6-msitc与除6-msitc以外的组分进行了组合时,与使用1种组分的情形相比,具有提高多巴胺产生量的倾向。在组合使用6-msitc和姜黄素的情形下,当6-msitc为0.1~2.5μm,姜黄素为0.1~2.5μm时,多巴胺产生量较多。在组合使用6-msitc和dha的情形下,当6-msitc为0.1~2.5μm,dha为0.5~40μm时,多巴胺产生量较多。在组合使用6-msitc和异鼠李素的情形下,当6-msitc为0.1~2.5μm,异鼠李素为0.02~0.5μm时,多巴胺产生量较多。(实验例2)使用mtt(3-(4,5-di-methylthiazol-2-yl)-2,5-diphenyltetrazoliumbromide,yellowtetrazole)试剂查验了各组分对pc12细胞的毒性。为了查验各组分对pc12细胞的毒性,实验例2中除向培养基添加的组分以外,均以与上述实验例1的(1)~(4)相同的方式培养了pc12细胞。在上述(4)中向各孔内的分化培养基b添加的组分为6-msitc(组分1)、姜黄素(组分3)、dha(组分2)、以及异鼠李素(组分4)中的任一组分。分化培养基b中的各组分的浓度如下,即,6-msitc(组分1)为:0(对照实验)、2.5μm、5μm、10μm、20μm、40μm、80μm、160μm;姜黄素(组分3)为:0(对照实验)、2.5μm、5μm、10μm、20μm、40μm;dha(组分2)为:0(对照实验)、2.5μm、5μm、10μm、20μm、40μm、80μm、160μm;异鼠李素(组分4)为:0(对照实验)、0.02μ、0.1μm、0.5μm、1μm、2.5μm、5μm、10μm。在上述实验例1的(4)pc12细胞分化中对pc12细胞培养72小时之后,以10μl/孔的方式添加mtt试剂(nacalaitesque公司制造,产品编号23547-21,mtt5mg/ml混合于磷酸盐缓冲生理盐水)。并放入二氧化碳培养箱(5%co2、37℃)内,对pc12细胞培养4小时。使孔板离心旋转以使细胞在孔中沉降,并去除上清液。以100μl/孔的方式向各孔添加dmso,并进行振荡搅拌,以使pc12细胞悬浮于dmso从而获得细胞液。对各孔内的细胞液分别在490nm处测定了吸光度。以对照实验的细胞液的吸光度作分母,以在含各样本的培养液中培养的pc12细胞的细胞液的吸光度作分子,并求算将分数转换成小数的数值,并将该数值作为mtt试验结果示出。图2、图3、图4、图5依次示出使用6-msitc、姜黄素、dha、以及异鼠李素时的测定结果。使用6-msitc、姜黄素、dha、以及异鼠李素时的mtt试验值高于不使用6-msitc、姜黄素、dha、以及异鼠李素时(对照实验)的mtt试验值。由此可知,6-msitc、姜黄素、dha、以及异鼠李素为毒性低的组分。(实验例3)以如下方式进行了使用各种组分的pc12细胞的神经突起延伸试验。进行实验例1中的(1)各种组分制备、以及(2)培养基制备的步骤,以准备6-msitc(组分1)、dha(组分2)、姜黄素(组分3)、增殖培养基a以及分化培养基b。(3)pc12细胞增殖向细胞培养用烧瓶(tpp公司制造)加入上述增殖培养基a,并加入pc12细胞(理化学研究所制造,产品编号rcb0009)并使其增殖。pc12细胞是来自白鼠的肾上腺髓质的嗜铬细胞瘤,并且是神经元分化的模型。当pc12细胞的汇合度达到80-90%时,将已增殖的pc12细胞移入到加入有增殖培养基a的新的烧瓶中进行传代培养。使细胞已增殖的培养液与新的增殖培养基a的比例为1:5(体积比)。如上所述的传代培养反复进行3次以上。(4)pc12细胞分化向96孔板的各孔中均接种100μl的在上述(3)中获得的以5×104/ml的浓度含有传代培养后的pc12细胞的增殖培养基a。在室温下放置一晩,以使pc12细胞稳定化。使孔板离心旋转,以使pc12细胞在孔板各孔中沉降。并去除上清液。向沉降有pc12细胞的各孔中均加入100μl的分化培养基b并进行搅拌,以使pc12细胞悬浮在分化培养基b中。向各孔内的培养基中均加入ngf(sigma-aldrich公司制造,产品编号n2513)。所有的孔内的培养基所含的ngf浓度均为50ng/ml。然后,将上述实验例1的(1)中制备的各种组分1~4以1种或2种组合的方式且以各种浓度加入到各孔内的培养基中,以制成以下各样本1~39。表2示出各孔内的培养基中构成各样本的组分的浓度。[表2](单位:μm)样本6-msitc姜黄素dha异鼠李素c10.120.532.540.150.562.570.582.5940100.02110.1120.5130.10.1140.10.5150.12.5160.50.1170.50.5180.52.5192.50.1202.50.5212.52.5220.10.5230.12.5240.140250.50.5260.52.5270.540282.50.5292.52.5302.540310.10.02320.10.1330.10.5340.50.02350.50.1360.50.5372.50.02382.50.1392.50.5将孔板放入二氧化碳培养箱(5%co2,37℃)内,对pc12细胞培养72小时。(5)细胞延伸的评价在上述(4)的培养之后,使孔板离心旋转以使细胞在孔中沉降,并去除上清液。对各孔中沉降的pc12细胞拍摄3张显微镜图像(明场显微镜,×10图像,每孔3张)。对显像在图像中的pc12细胞的整体细胞形状进行了观察。如图6所示,若pc12细胞进行分化,则神经突起2会从细胞体1延伸。对pc12细胞的细胞总数以及具有长度l2大于细胞体1的长径l1的神经突起2的细胞的数量进行计数。用具有长度l2大于细胞体1的长径l1的神经突起2的细胞的数量除以细胞总数,以获得pc12细胞延伸的延伸比率。在各图像中分别显示了至少80个以上的pc12细胞。所有图像中显示的pc12细胞共有720个以上。以显像在所有图像中的所有pc12细胞的平均值的形式示出延伸比率。各pc12细胞的延伸比率如图7所示。在图7中,“m”、“c”、“d”、“i”依次表示“6-msitc”、“姜黄素”、“dha”、“异鼠李素”。该规定同样适用于图8~图11。在图7中,τ表示统计学上具有显著性。*表示确认到通过组合2种组分而具有协同效应。在此,协同效应是指,组合使用2种组分时的延伸比率大于单独使用各组分时的延伸比率之和的情形。如图7所示,当培养基中含有6-msitc、姜黄素、dha、异鼠李素中的任一组分时,与不含这些组分的情形相比,能够提高细胞延伸效果。并且,6-msitc的细胞延伸效果高于姜黄素、dha、异鼠李素。确认到在向培养基中添加有6-msitc的情形下,当6-msitc为0.1μm、0.5μm、2.5μm时,显著地促进了pc12细胞的延伸。确认到在向培养基中添加有姜黄素的情形下,当姜黄素为0.1μm、0.5μm、2.5μm时,显著地促进了pc12细胞的延伸。确认到在向培养基中添加有dha的情形下,当dha为0.5μm、2.5μm、40μm时,显著地促进了pc12细胞的延伸。确认到在向培养基中添加有异鼠李素的情形下,当异鼠李素为0.02μm、0.1μm、0.5μm时,显著地促进了pc12细胞的延伸。当对6-msitc和除6-msitc以外的组分进行了组合时,与使用1种组分的情形相比,提高了延伸比率。在组合使用6-msitc和姜黄素的情形下,当6-msitc为0.1~2.5μm,姜黄素为0.1~2.5μm时,有效地提高了延伸比率。在组合使用6-msitc和dha的情形下,当6-msitc为0.1~2.5μm,dha为0.5~40μm时,有效地提高了延伸比率。在组合使用6-msitc和异鼠李素的情形下,当6-msitc为0.1~2.5μm,异鼠李素为0.02~0.5μm时,有效地提高了延伸比率。(实验例4)使用mtt(3-(4,5-di-methylthiazol-2-yl)-2,5-diphenyltetrazoliumbromide,yellowtetrazole)试剂查验了各组分对pc12细胞的毒性。为了查验各组分对pc12细胞的毒性,实验例4中除向培养基添加的组分以外,均以与上述实验例3的(3)~(4)相同的方式培养了pc12细胞。在上述(4)中向各孔内的分化培养基b添加的组分为6-msitc(组分1)、姜黄素(组分3)、dha(组分2)、或异鼠李素(组分4)中的任一组分。分化培养基b中的各组分的浓度如下,即,6-msitc(组分1)为:0(对照实验)、2.5μm、5μm、10μm、20μm、40μm、80μm、160μm;姜黄素(组分3)为:0(对照实验)、2.5μm、5μm、10μm、20μm、40μm;dha(组分2)为:0(对照实验)、2.5μm、5μm、10μm、20μm、40μm、80μm、160μm;异鼠李素(组分4)为:0(对照实验)、0.02μ、0.1μm、0.5μm、1μm、2.5μm、5μm、10μm。在上述实验例3的(4)中,于pc12细胞分化中对pc12细胞培养72小时之后,以10μl/孔的方式添加mtt试剂(nacalaitesque公司制造,产品编号23547-21,mtt5mg/ml混合于磷酸盐缓冲生理盐水)。并放入二氧化碳培养箱(5%co2、37℃)内,对pc12细胞培养4小时。使孔板离心旋转以使细胞在孔中沉降,并去除上清液。以100μl/孔的方式向各孔添加dmso,并进行振荡搅拌,以使pc12细胞悬浮于dmso从而获得细胞液。对各孔内的细胞液分别在490nm处测定了吸光度。以对照实验的细胞液的吸光度作分母,以在含各样本的培养液中培养的pc12细胞的细胞液的吸光度作分子,并求算将分数转换成小数的数值,并将该数值作为mtt试验结果示出。图8、图9、图10、图11依次示出使用6-msitc、姜黄素、dha、以及异鼠李素时的测定结果。使用6-msitc、姜黄素、dha、以及异鼠李素时的mtt试验值高于不使用6-msitc、姜黄素、dha、以及异鼠李素时(对照实验)的mtt试验值。由此可知,6-msitc、姜黄素、dha、以及异鼠李素为毒性低的组分。(实验例5)神经元对β淀粉样蛋白的抗性试验进行实验例1中的(1)各种组分制备、以及(2)培养基制备的步骤,以准备6-msitc(组分1)、dha(组分2)、姜黄素(组分3)、增殖培养基a以及分化培养基b。(3)pc12细胞增殖向细胞培养用烧瓶(tpp公司制造)加入上述增殖培养基a,并加入pc12细胞(理化学研究所制造,产品编号rcb0009)使其增殖。pc12细胞是来自白鼠的肾上腺髓质的嗜铬细胞瘤,并且是神经元分化的模型。当pc12细胞的汇合度达到80-90%时,将已增殖的pc12细胞移入到加入有增殖培养基a的新的烧瓶中进行传代培养。使细胞已增殖的培养液与新的增殖培养基a的比例为1:5(体积比)。如上所述的传代培养反复进行3次以上。(4)pc12细胞分化向96孔板的各孔中均接种100μl的在上述(3)中获得的以5×104/ml的浓度含有传代培养后的pc12细胞的增殖培养基a。在室温下放置一晩,以使pc12细胞稳定化。使孔板离心旋转,以使pc12细胞在孔板各孔中沉降。并去除上清液。向沉降有pc12细胞的各孔中均加入100μl的分化培养基b并进行搅拌,以使pc12细胞悬浮在分化培养基b中。向各孔内的培养基均加入ngf(sigma-aldrich公司制造,产品编号n2513)。所有的孔内的培养基所含的ngf浓度均为50ng/ml。将孔板放入二氧化碳培养箱(5%co2,37℃)内,对pc12细胞培养72小时。将上述实验例1的(1)中制备的各种组分1~4以1种或2种组合的方式且以各种浓度加入到各孔内的培养基中,以制成以下各样本1~38。在进行浓度调节时使用了分化培养基b。表3示出各孔内的培养基中构成各样本的组分的浓度。并且,向各孔内的培养基中添加β淀粉样蛋白(anaspec公司制造,产品编号as-24224)。并使培养基中的β淀粉样蛋白的浓度为1μmol/l。除上述样本外,将未向培养基添加组分1~4以及β淀粉样蛋白中的任一种的样本作为“对照实验样本”。此外,将向培养基添加了β淀粉样蛋白但未添加组分1~4的样本作为“amb”。之后,将孔板放入二氧化碳培养箱(5%co2,37℃)内,对pc12细胞培养24小时。[表3](单位:μm)样本6-msitc姜黄素dha异鼠李素对照实验样本(未添加β淀粉样蛋白)amb10.120.532.540.150.562.570.582.590.02100.1110.5120.10.1130.10.5140.12.5150.50.1160.50.5170.52.5182.50.1192.50.5202.52.5210.10.5220.12.5230.140240.50.5250.52.5260.540272.50.5282.52.5292.540300.10.02310.10.1320.10.5330.50.02340.50.1350.50.5362.50.02372.50.1382.50.5(5)β淀粉样蛋白神经毒性抗性试验使用mtt(3-(4,5-di-methylthiazol-2-yl)-2,5-diphenyltetrazoliumbromide,yellowtetrazole)试剂对pc12细胞对β淀粉样蛋白的抗性进行了试验。为了查验各样本对pc12细胞的毒性,在进行了上述(4)pc12细胞分化步骤后,以10μl/孔的方式添加mtt试剂(nacalaitesque公司制造,产品编号23547-21,mtt5mg/ml混合于磷酸盐缓冲生理盐水)。并放入二氧化碳培养箱(5%co2、37℃)内,对pc12细胞培养4小时。使孔板离心旋转以使细胞在孔中沉降,并去除上清液。以100μl/孔的方式向各孔添加dmso,并进行振荡搅拌,以使pc12细胞悬浮于dmso从而获得细胞液。对各孔内的细胞液分别在490nm处测定了吸光度。以对照实验的细胞液的吸光度作分母,以在含各样本的培养液中培养的pc12细胞的细胞液的吸光度作分子,并求算将分数转换成小数的数值,并将该数值作为mtt试验结果示出。测定结果如图12所示。在图12中,“m”、“c”、“d”、“i”依次表示“6-msitc”、“姜黄素”、“dha”、“异鼠李素”。该规定同样适用于图13。如图12所示,与在不含β淀粉样蛋白的培养基中培养pc12细胞的情形(对照实验)相比,在仅含有β淀粉样蛋白的培养基中培养pc12细胞的情形(amb)的mtt试验值显著下降。并且由6-msitc发挥的提高pc12细胞的β淀粉样蛋白抗性的效果高于姜黄素、dha、异鼠李素。与在仅含有β淀粉样蛋白的培养基中培养细胞的情形(amb)相比,将6-msitc与姜黄素、dha或异鼠李素进行组合后与β淀粉样蛋白一起添加到培养基的情形的mtt试验值提高。(实验例6)神经元对过氧化氢的抗性试验在实验例6中,试验了pc12细胞对过氧化氢的抗性。向分化培养基b中添加过氧化氢以取代上述实验例5中的向分化培养基b中添加β淀粉样蛋白,除此之外的实验方法与实验例5相同。在分化培养基b中的过氧化氢的浓度为100μm。实验结果示于图13。如图13所示,与在不含过氧化氢(h2o2)的培养基中培养pc12细胞的情形(对照实验)相比,在仅含有过氧化氢的培养基中培养pc12细胞的情形的mtt试验值显著下降。在将6-msitc、姜黄素、dha或异鼠李素单独添加到培养基的情形下,或在将6-msitc与姜黄素、dha或异鼠李素进行组合后添加到培养基的情形下,mtt试验值为不产生问题程度的数值。由上述实验可知,与不使用6-msitc、姜黄素、dha、异鼠李素中的任一组分的情形以及单独使用6-msitc、姜黄素、dha、异鼠李素中的任一组分的情形相比,将6-msitc与姜黄素、dha、或异鼠李素进行组合的情形具有对抗细胞体内产生的β淀粉样蛋白以及过氧化氢而保护神经元的功能。已知活性氧类也与β淀粉样蛋白对神经元的影响有关,活性氧类根据其反应活性的高低而呈现为一重态氧、过氧化氢、过氧化脂质等各种形态,并会加重对细胞的损伤。同时具有对β淀粉样蛋白以及对过氧化氢的抗性有可能会广泛抑制由上述这些活性氧产生的危害,故而更加实用。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1
- SPNP‑IX在制备Kv4.2通道工具试剂中的应用的制造方法与工艺
- SPNP‑IX在制备Kv4.3通道工具试剂中的应用的制造方法与工艺
- SPNP‑27在制备Nav1.5通道抑制剂中的应用的制造方法与工艺
- SPNP‑27在制备Nav1.3通道抑制剂中的应用的制造方法与工艺
- 一种多肽在制备Nav1.3钠通道工具试剂中的应用的制造方法与工艺
- SPKP‑XI在制备Kv4.2通道抑制剂中的应用的制造方法与工艺
- 基于水凝胶溶胀特性的可控自变形神经微电极的制造方法与工艺
- SPKP‑XI在制备Kv4.1钾通道抑制剂中的应用的制造方法与工艺
- 小驳骨提取物作为神经保护剂的应用的制造方法与工艺
- 巴戟天低聚果糖提取物在制备防治阿尔茨海默症药物、保健品或食品中的应用的制造方法与工艺