靶向HER2相变型PLGA纳米粒、应用及其制备方法与流程
本发明涉及超声影像领域,具体涉及一种靶向her2相变型plga纳米粒、应用及其制备方法。
背景技术:
乳腺癌作为一种最常见肿瘤严重威胁女性健康。目前常用的乳腺癌显像方法包括x射线、超声成像和磁共振成像。目前这些成像方式可提供乳腺组织多种解剖和功能信息,但还未能完全满足乳腺癌临床诊断的要求。有研究报道,乳腺钼靶摄片并不能有效减少乳腺癌的死亡率。磁共振成像对于小肿瘤的检出率高,但不够经济实惠且成像耗时长,难以作为常规成像手段。超声成像对于小于5mm的乳腺肿块难以判断其良恶性。超声造影剂可增强超声显像,对于肿瘤的鉴别有良好的指示作用,为超声分子影像不可或缺的一部分。然而,目前常用的超声造影剂为微米级,其粒径大,难以穿透血管内皮细胞,阻碍了其进一步实现血管外成像。光声成像,兼具光学成像高对比度和超声成像高穿透深度的优势,已获得人们的广泛关注。将多种成像技术整合一体化,可显示病灶更为丰富准确的生物学信息,比单一成像更可靠准确,有利于肿瘤的早期诊断。
随着医学的发展以及人们对生活质量和形体美容需求的增强,肿瘤的无创治疗成为发展趋势,尤其是乳腺肿瘤的保乳治疗越来越受到重视。光热治疗(ptt)作为一种新兴的无创治疗方式,通过热效应灭活局部组织,已广泛应用于肿瘤治疗。ptt利用光热剂如金纳米棒、石墨烯、硫化铜等在近红外光辐照下,吸收能量升高局部肿瘤组织的温度,从而杀死肿瘤细胞。然而,由于现有的光热剂缺乏靶向性,体内循环时间短,毒副作用较大,其治疗效果远未达到预期。因此,急需研发安全、高效的光热剂。将诊断和治疗高效融合在一起,可进一步提升肿瘤早期诊断与治疗水平,减少治疗环节,使治疗不再复杂,避免有创手术,减轻病人痛苦,进一步提高治疗效果。
赫赛汀是一种人源化的单克隆抗体,可有效靶向人表皮细胞生长因子受体2(humanepidermalgrowthfactorreceptor2,her2)。foodanddrugadministration(fda)已批准其可用于her2过表达的乳腺癌的早期和转移性治疗。赫赛汀是治疗乳腺癌的常用药物,赛汀又名曲妥珠单抗,是治疗her2过度表达的转移性乳腺癌常用的药物,从药品分类上说,赫赛汀是一种新型抗体药物,由曲妥珠单抗和小分子微管抑制剂dm1偶联而成,产生协同抗癌作用。但是目前该药在国内已经进入医保,医保后一支赫赛汀的价格7000元,价格昂贵,而且目前国内的赫赛汀处于断货阶段。
聚乳酸-羟基乙酸共聚物(plga)具有优异的生物相容性和载药能力,可作为载体。通过包裹光吸收子,其可进一步用于多模态成像和光热治疗,同时提供诊断和治疗疾病的功能。因此我们提出,制备一种新型诊疗纳米粒用于her2阳性乳腺癌的诊断与治疗一体化。其组成材料具有价廉、高生物安全性、高灵敏度和高特异度的优势。其粒径约为130nm,易穿透血管内皮细胞(肿瘤内皮间隙为100-780nm)到达靶组织。减小超声造影剂粒径使其为纳米级,同时联合靶向技术,就能使超声造影剂到达肿瘤间质,能从分子层面显示肿瘤内部情况。纳米粒壳膜主要由plga构成,壳膜上装载有四氧化三铁,可增强磁共振、光声显影。粒壳上修饰有聚乙二醇(peg),可显著延长纳米粒血液循环时间;修饰有her2靶向配体赫赛汀,能特异靶向her2表达阳性的肿瘤细胞。内核包裹全氟戊烷(pfp),在近红外激光辐照下,spio和dir促使光致相变(opticaldropletvaporization,odv)过程的发生,导致pfp吸收热能发生膨胀,由液态变为气态,产生的微泡可明显增强超声显像,同时可物理爆破肿瘤细胞。该新型诊疗纳米粒大大提高了her2阳性乳腺癌体内成像和治疗的精准度。
技术实现要素:
本发明要解决的技术问题是提供一种价格低廉、特异靶向her2阳性细胞,同时能明显增强超声/光声/磁共振多模态显像的用于治疗乳腺癌的靶向her2相变型plga纳米粒、应用及其制备方法。
本发明提供一种技术方案,靶向her2相变型plga纳米粒,包括外壳,外壳上嵌设有超顺磁性氧化铁,外壳上还链接有人表皮细胞生长因子受体2配合基。
进一步,所述的外壳为聚乳酸-羟基乙酸共聚物外壳。
进一步,所述的外壳内包载有液态氟碳。
进一步,其光学显微镜及透射电镜呈球形;平均粒径为131.1±44.7nm;平均电位为-2.61±3.53mv。
进一步,在560nm附近有吸收峰。
进一步,其超顺磁性氧化铁spio的包封率及负载量分别为82.8±1.2%、3.98±0.31%。
本发明还提供另外一个技术方案:靶向her2相变型plga纳米粒在制备乳腺癌治疗药物上的应用。
本发明还提供另外一个技术方案:靶向her2相变型plga纳米粒的制备方法,采用双乳化法和碳二亚胺法。
进一步,所述的双乳化法的操作步骤为:
①将10mg聚乳酸-羟基乙酸共聚物,200μl超顺磁性氧化铁溶于2ml二氯甲烷;
②加入200μl液态氟碳,冰浴条件下声振仪功率100w声振3min,工作5秒间断5秒;
③加入4%聚乙烯醇溶液5ml,冰浴条件下均质机12000rpm均质5min;
④冰浴条件下磁力搅拌6-8h,使二氯甲烷充分挥发;
⑤双蒸水洗涤,10000rpm,5min高速离心3次,倒掉上清液,获得载超顺磁性氧化铁相变型纳米粒;
碳二亚胺法制备靶向her2相变型plga纳米粒:
⑥将所制备的载超顺磁性氧化铁相变型纳米粒分散溶解于的ph=5.5的mes缓冲液中;
⑦加入edc\nhs,其质量比为3:1,于冰浴条件下振荡孵育2h后,pbs离心洗涤3次,将沉淀复溶于ph=7的mes缓冲液中,加入与plga相同摩尔数的赫赛汀,冰浴条件下振荡孵育过夜,pbs离心洗涤后,收集制得靶向her2相变型plga纳米粒,于4℃贮存。
结合了功能颗粒spio及温敏材料pfp的多功能分子探针,充分发挥了光热治疗、光致相变及生物分子治疗作用。结合人表皮细胞生长因子受体2配合基,即赫赛汀成分,可有效靶向人表皮细胞生长因子受体2,从而实现精确定位乳腺癌细胞,有效杀灭乳腺癌,同时还能在体、实时动态地监测治疗效果。研发集高效诊疗于一体的多功能分子探针,具有广阔的市场前景。由于赫赛汀的成分与纳米粒结合于一体,使用量较之前有所减少,因此,可大大降低其使用成本,也可达到相同的效果。
附图说明
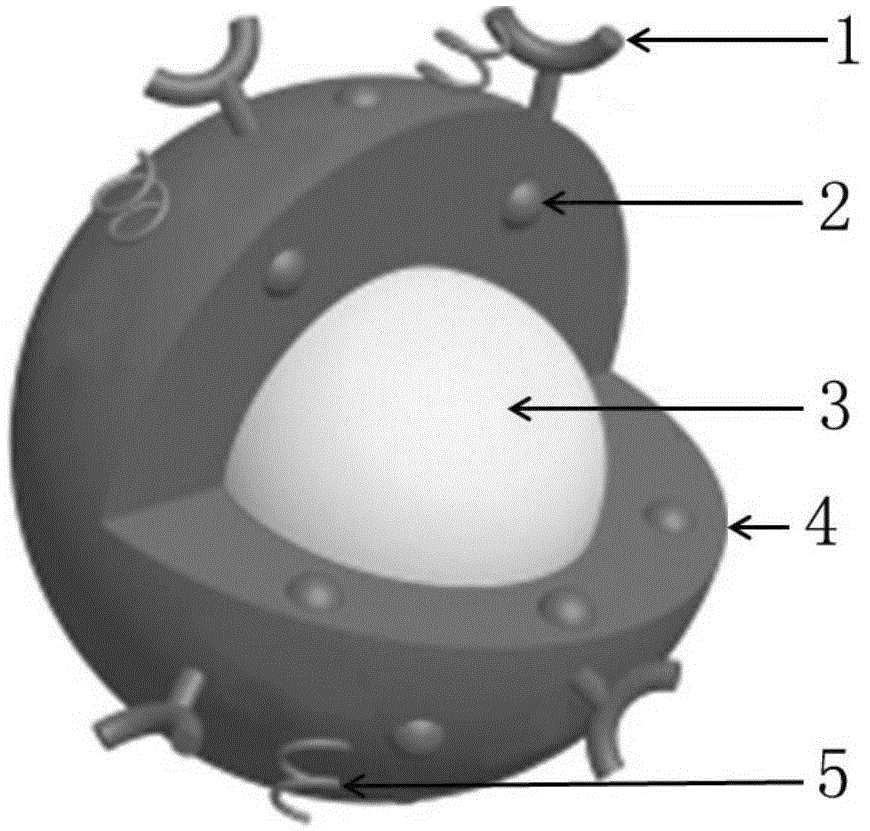
图1为本发明靶向纳米粒的示意图;
图2是本发明靶向纳米粒的光学显微镜示意图;
图3是本发明靶向纳米粒紫外分光光度计测的吸收曲线;
图4是非靶向纳米粒的粒径电位示意图;
图5是靶向纳米粒的粒径电位示意图。
具体实施方式
图1中,1为人表皮细胞生长因子受体2配合基、2为超顺磁性氧化铁spio、3为液态全氟戊烷pfp、4为plga、5为peg10000。
一、本发明靶向her2相变型plga纳米粒的制备方法为:
1.材料与仪器
超顺磁性氧化铁(spio,10nm,oceannanotech),聚乳酸-羟基乙酸共聚物(plga,50:50,济南岱罡),液态全氟戊烷(pfp,百灵威科技有限公司),聚乙烯醇(pva,sigma),赫赛汀(herceptin,roche),异丙醇、二氯甲烷(川东化工有限公司),fitc标记的山羊抗鼠igg抗体(abcam),edc/nhs(sigma),skbr3细胞株(第三军医大学药学院),染料dii(碧云天生物科技有限公司)。声振仪(sonic&material),高速分散均质机(xhf-d),激光粒径测量仪(zetasizernanozs90,malvern),透射电镜(h-7500,hitachi),激光共聚焦显微镜(tcssp2,lecia),光声成像系统(vevolazr),超声诊断仪(esaote),飞利浦achieva3.0t磁共振。
2.载超顺磁性氧化铁相变型纳米粒的制备方法:采用双乳化法制备纳米粒:
①将10mgplga,200μl超顺磁性氧化铁溶于2ml二氯甲烷;
②加入200μlpfp,声振仪声振5min;
③加入4%pva溶液,均质机均质5min;
④磁力搅拌器搅拌6-8h,使二氯甲烷充分挥发;
⑤双蒸水洗涤,高速离心3次(10000r/min,3min),获得载超顺磁性氧化铁相变型纳米粒。
3.靶向her2载超顺磁性氧化铁相变型纳米粒的制备
①将所制备的载超顺磁性氧化铁相变型纳米粒分散溶解于适量的mes缓冲液中(ph5.5,0.1m);
②加入edc\nhs,其质量比为3:1,于冰浴条件下振荡孵育2h后,pbs离心洗涤3次,将沉淀复溶于mes缓冲液中(ph8.0,0.1m),加入过量的赫赛汀,冰浴条件下振荡孵育过夜,多次pbs离心洗涤后,收集制得:靶向her2载超顺磁性氧化铁相变型纳米粒(her-spio-plga/pfp),即本发明的靶向her2相变型plga纳米粒。
如图1所示:本发明的靶向her2相变型plga纳米粒成球形,包括聚乙二醇化的聚乳酸-羟基乙酸共聚物(plga-peg10000)外壳即图中的4和5,核内包载有液态氟碳(pfp)3,外壳上嵌设有超顺磁性氧化铁(spio)2,外壳上还链接有人表皮细胞生长因子受体2(her2)配合基1。
二、靶向her2相变型plga纳米粒的特性及性能
1、光学显微镜、透射电镜观察靶向her2相变型plga纳米粒her-spio-plga/pfp的形态、分布。观察结果如图2所示:外观呈咖啡色,光学显微镜及透射电镜观察her-spio-plga/pfp纳米粒呈均一球形,超顺磁性氧化铁spio均匀分布于纳米粒中。
2、采用紫外分光光度仪测量her-spio-plga/pfp纳米粒在300-800nm的吸光度值。如图3所示:紫外分光光度计测得her-spio-plga/pfp纳米粒在560nm左右有吸收峰,证明超顺磁性氧化铁spio被包裹进纳米粒。
3、应用原子吸收光谱法测量超顺磁性氧化铁的包封率及负载量。原子吸收光谱法测出超顺磁性氧化铁spio的包封率及负载量分别为82.8±1.2%、3.98±0.31%。
4、采用malvern激光粒径测量仪检测靶向及非靶向纳米粒的粒径和zeta电位。
如图4所示:非靶向纳米粒平均粒径为(109.7±55.95)nm,如图5所示:her-spio-plga/pfp靶向纳米粒平均粒径为(131.1±44.7)nm。其平均电位非靶向纳米粒为(-2.01±4.53)mv、靶向纳米粒为(-2.61±3.53)mv。
5、采用激光共聚焦显微镜检测纳米粒与赫赛汀连接率。
激光共聚焦显微镜显示赫赛汀抗体成功连接到纳米粒表面。激光共聚焦显微镜观察纳米粒与细胞靶向情况,靶向与非靶向纳米粒呈红色荧光,细胞膜呈绿色荧光。靶向纳米粒组显示有较多的红色荧光围绕在绿色荧光的skbr3细胞膜周围,而抗体封闭组和非靶向纳米粒组几乎没有纳米粒与细胞结合。
三:her-spio-plga/pfp纳米粒的体外寻靶实验
体外培养人乳腺癌skbr3细胞,接种于激光共聚焦培养皿中,培养24h,预设为三组,分别为靶向组,非靶向组和抗体封闭组。每组设3个培养皿。在加入her-spio-plga/pfp纳米粒前,过量赫赛汀对抗体封闭组细胞进行预处理30min,后每个培养皿加入100μl经dii标记的靶向/非靶向纳米粒后与细胞在37℃敷箱内孵育1h,用适量dio染细胞膜10min,pbs冲洗3次,在激光共聚焦显微镜下,观察各组纳米粒与细胞结合情况。
经dii标记的靶向与非靶向纳米粒均呈红色荧光,细胞膜呈绿色荧光。靶向组显示有较多的红色荧光信号围绕在呈绿色荧光的skbr3细胞膜周围,而非靶向组和抗体封闭组未见红色荧光信号,说明靶向纳米粒具有主动靶向skbr3细胞的能力,能特异靶向her2阳性的skbr3细胞。靶向组skbr3细胞周围及细胞内部可见较多纳米粒聚集,而非靶向组细胞周围基本无纳米粒聚集,充分说明了赫赛汀具备高效连接her2受体的能力。拮抗组在加入游离赫赛汀后,skbr3细胞的her2受体被游离赫赛汀占据,阻断了纳米粒与细胞的结合,故而细胞周围未见明显纳米粒荧光聚集,也从侧面反映了赫赛汀与细胞结合的特异性。
2、纳米粒体内寻靶实验研究
结果表明:靶向组裸鼠在注射靶向纳米乳液后,肿瘤局部可见代表靶向纳米粒的红色荧光,6h时红色荧光达到最大,为非靶向组的3.4倍,后荧光信号逐渐减弱。而非靶向组肿瘤局部于整个观察时间内均未见明显红色荧光聚集。注射纳米粒24h后离体荧光实验显示,纳米粒主要聚集在肝肾等网状内皮系统,靶向组肿瘤组织的荧光强度仍明显高于非靶向组,为1.5倍。进一步证实该纳米粒具有特异靶向her2阳性肿瘤细胞的能力。
体内靶向性实验中,靶向组裸鼠肿瘤局部可见代表靶向纳米粒的红色荧光区域,并且荧光强度和范围随着时间发生变化,而非靶向组裸鼠其肿瘤处始终未见明显荧光,这说明了靶向纳米粒在活体对her2受体高表达的skbr3人乳腺癌肿瘤具有很好的靶向性。本发明制作的纳米粒粒径约130nm,而肿瘤毛细血管内皮间隙约100nm-780nm,所以纳米粒可以顺利穿过毛细血管内皮间隙达到血管外,即具有epr(enhancedpermeationandretentioneffect)效应。在靶向组和非靶向组,纳米粒均可通过epr效应穿过肿瘤血管内皮间隙达到肿瘤细胞周围(被动靶向),而在靶向组,纳米粒除了被动靶向,还可通过赫赛汀的靶向作用而主动结合细胞表面并进而被吞噬,即主动靶向。该实验证明,通过主动靶向和被动靶向两种方式而沉积到肿瘤细胞周围的纳米粒数量远多于单纯经被动靶向而沉积的纳米粒。实验结果显示,30分钟时肿瘤处荧光强度逐渐增大,6小时达到高峰。而6小时后,随着血液循环内的纳米粒的减少和肿瘤局部纳米粒的不断代谢消耗,致使局部荧光强度和范围不断减小。
四:her-spio-plga/pfp纳米粒的体外超声显像
分为her-spio-plga/pfp纳米粒组和生理盐水组。将一定浓度的her-spio-plga/pfp与生理盐水分别置于凝胶模型中,用脉冲激光辐照两组样品(140mj,5s)后,运用百盛超声显像仪观察其基波及谐波模式下的成像效果,并用自制的dfy定量分析仪测定激光辐照前后各组的平均回声强度。
脉冲激光140mj作用5s,her-spio-plga/pfp纳米粒组基波及谐波模式下感兴趣区回声强度均明显提高,分别较作用前增强约27倍和11倍。而生理盐水组激光作用前后基波及谐波模式下感兴趣区回声信号强度均无明显变化。本实验证明her-spio-plga/pfp可吸收光能转化成热能,促进pfp汽化,使纳米粒膨胀变成微气泡,明显增强超声显像效果。同时通过超声显像也可证明pfp有效包裹在纳米粒中,在激光辐照下能完成可控的相变过程。五:her-spio-plga/pfp纳米粒的体外光声成像
将her-spio-plga/pfp纳米粒按一定比例稀释成spio浓度为0.125,0.25,0.5,1,2mg/ml,分别置于凝胶模型中,脉冲激光辐照下,采集光声图像,并对光声信号强度进行分析。
随实验组浓度的增加,光声信号成线性增强,证实her-spio-plga/pfp具有光声成像的潜能。
六:her-spio-plga/pfp纳米粒的体外磁共振成像
将her-spio-plga/pfp纳米粒与凝胶按一定比例稀释,分别放入2.0ml密封ep管内,振荡摇匀后固定于带孔塑料板上。应用philips3.0t磁共振扫描仪,扫描序列ffe,设置扫描参数,得到t2*wi,测定分析各孔样品信号强度。
her-spio-plga/pfp在t2*wi呈负性增强显像,即随着fe含量增高,mr信号强度逐渐降低。当fe含量为90μg/ml时,mr几乎呈黑色,进一步说明her-spio-plga/pfp是一种良好的t2磁共振显影剂。
在体内实验中,通过设置生理盐水组和非靶向组作为对照,结果发现靶向组(本发明)在体内多模态成像中具有绝对的优势,靶向组呈现出最强的超声/光声/磁共振信号,其次是非靶向组,生理盐水组未见明显信号。此外,在体外及体内超声实验中,应用目前的激光能量分别在体外及体内成功实现pfp相变。
靶向纳米造影剂her-spio-plga/pfp在体内外均能实现超声/光声/磁共振多模态显影,具有成为多功能造影剂的潜能。
裸鼠skbr3乳腺癌模型的建立人乳腺癌skbr3细胞采用含10%胎牛血清的5a培养基,在37℃、5%co2条件下常规培养。调整处于对数生长期的skbr3细胞浓度为5×106个/ml,以100μl/只的剂量接种于雌性裸鼠左侧背臀部。
体内治疗及效果评价待荷瘤鼠肿瘤直径约1cm的时候将瘤鼠随机分为四组,每组5只:分别为单纯激光辐照组,单纯靶向分子探针组,非靶向分子探针加激光辐照组及靶向分子探针加激光辐照组。通过尾静脉向裸鼠体内注入等量的靶向或非靶向分子探针6小时后,再给予532nm脉冲激光辐照。辐照强度为200mj,辐照时间为5min。辐照结束后,取出各组肿瘤组织,一半常规石蜡包埋切片行he染色,光镜下观察其组织病理学改变;另一半置于2%戊二醛溶液中固定,行透射电镜观察组织超微结构改变。
本试验中,各组肿瘤切片he染色后光镜下观察,靶向分子探针联合激光辐照组,肿瘤组织出现大量的凝固性坏死,伴核固缩、破裂,且坏死区域与周围组织边界清晰。非靶向分子探针联合激光辐照组,可见少量细胞发生凝固性坏死,伴有细胞核大、深染,且坏死区域与周围组织边界不清,此组体现出一定的治疗效应,但因缺乏赫赛汀的靶向作用,与靶向组相比明显减弱。单纯激光辐照组和单纯靶向分子探针组乳腺肿瘤组织排列紧密成巢状,未见凝固性坏死、细胞核大、浓染等,说明我们所用的激光能量和所制备的靶向分子探针不会产生副作用,是安全有效的。透射电镜下进一步观察,靶向分子探针联合激光辐照组,细胞结构不清,细胞膜和核膜断裂,染色质固缩、碎裂呈团块状,可见靶向分子探针分布于胞浆;非靶向分子探针联合激光辐照组,细胞结构欠清晰,部分细胞膜失去连续性,线粒体和内质网轻微肿胀;单纯激光辐照后,肿瘤细胞结构清晰,细胞膜和核膜完整。
因此,本发明研制的一种靶向纳米粒her-spio-plga/pfp在激光的作用下,可通过主动及被动靶向作用到达并结合于skbr3细胞周围,不仅能够实现skbr3人乳腺癌细胞的超声/光声/磁共振多模态显像,同时还有良好的治疗效果。
超顺磁性氧化铁是已用于临床的磁共振阴性对比剂。由于其在紫外波段有光学吸收峰,还可作为光声对比剂。anaespinosa等证实联合磁热与光热治疗,氧化铁热效应显著扩大,治疗效果明显增强,大幅降低了所需氧化铁浓度,说明铁具有良好的产热效率。本研究中,通过脉冲激光的辐照,超顺磁性氧化铁作为光吸收子吸收热能,产生热膨胀效应。拉普拉斯压力(laplacepressure)作用下,包裹液态氟碳pfp(沸点29℃)纳米粒在室温保持稳定。但当激光能量超过拉普拉斯压力时,超顺磁性氧化铁将热能传递给pfp使其汽化,纳米粒发生相变膨胀为微泡,使周围组织与微泡声阻抗不匹配,这是纳米粒增强光声/超声显影的主要机制。我们通过调整纳米粒的尺寸及光吸收子的含量,可实现对汽化温度的可控。
本发明成功制备了靶向her2载超顺磁性氧化铁相变型纳米粒,其具有特异靶向her2高表达乳腺癌细胞的能力,同时能明显增强超声/光声/磁共振多模态显像。该纳米粒在脉冲激光辐照下可发生光致相变,使纳米粒体积膨胀数百倍,有望成为肿瘤超声分子靶向显影与治疗的可行性工具之一,为下一步临床乳腺癌显像与治疗一体化奠定了研究基础。
- 还没有人留言评论。精彩留言会获得点赞!