药物组合物以及肿瘤免疫活性促进剂的制作方法
本发明涉及药物组合物以及肿瘤免疫活性促进剂。
背景技术:
作为葡萄糖衍生物的2-脱氧-d-葡萄糖(以下,简称为“2dg”),与葡萄糖相同地通过葡萄糖转运蛋白(glucosetransporte)被取入细胞内。被取入癌细胞内积聚的2dg具有抗癌作用,所述抗癌作用是通过伴随阻碍糖酵解途径(glycolysispathway)的atp(adenosinetriphosphate,三磷酸腺苷)的产生的抑制。
关于针对癌症的2dg的使用,正在研究与作用机理不同于2dg的抗癌剂的并用。例如,专利文献1表明,当对移植人非小细胞肺癌株的小鼠给药2dg以及紫杉醇(paclitaxel)时,与仅给药紫杉醇的情况相比较,抗肿瘤效果增加。
另外,在非专利文献1中,作为第一阶段临床试验,报告了与多西他赛(docetaxel)并用的口服给药2dg剂量递增试验的结果。
现有技术文献
专利文献
专利文献1:日本特表2006-515883号公报
非专利文献
非专利文献1:luise.raez、外14人、「aphaseidose-escalationtrialof2-deoxy-d-glucosealoneorcombinedwithdocetaxelinpatientswithadvancedsolidtumors.」、cancerchemotherapyandpharmacology、2013年、71、p.523-530
技术实现要素:
(要解决的问题)
根据非专利文献1,在63mg/kg为止的给药量下2dg的耐受性被确认,但是在63~88mg/kg的给药量下见到消化道出血、qt延长综合征以及高血糖等严重的副作用。为了在临床上应用2dg,需要抑制副作用以及提高抗肿瘤效果等的改善。
本发明是鉴于上述情况而提出,本发明的目的是提供一种以少的副作用获得高的抗肿瘤效果的药物组合物以及肿瘤免疫活性促进剂。
(解决问题的手段)
根据本发明的第一观点的药物组合物,包括:
含有糖衍生物的生物相容性粒子,
所述生物相容性粒子包括乳酸乙醇酸共聚物。
在这种情况下,上述根据本发明的第一观点的药物组合物,
可以与抗癌剂并用。
根据本发明的第二观点的药物组合物,包括:
抗癌剂,
与上述根据本发明的第一观点的药物组合物并用。
根据本发明的第三观点的药物组合物,包括:
含有糖衍生物的生物相容性粒子;以及
抗癌剂,
所述生物相容性粒子包括乳酸乙醇酸共聚物。
另外,所述抗癌剂也可以是索拉非尼(sorafenib)、阿霉素(doxorubicin)或顺铂(cisplatin)。
另外,所述糖衍生物也可以是2-脱氧-d-葡萄糖。
另外,所述生物相容性粒子的平均粒径也可以是50~170nm。
另外,根据上述本发明的第一、第二以及第三观点的药物组合物,
也可以是用于肝细胞癌、肾脏癌、大肠癌或胰腺癌的治疗。
根据本发明的第四观点的肿瘤免疫活性促进剂,包括:
含有糖衍生物的生物相容性粒子,
所述生物相容性粒子包括乳酸乙醇酸共聚物。
(发明的效果)
根据本发明,可以以少的副作用获得高的抗肿瘤效果。
附图说明
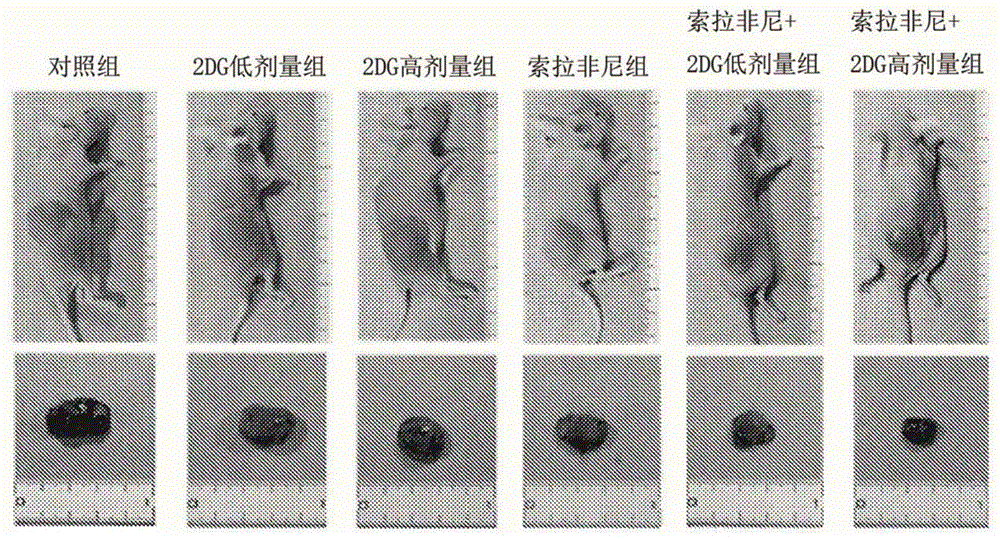
图1是示出根据实施例1的肝癌细胞株皮下移植裸鼠以及肿瘤外观的图。
图2是示出根据实施例1的肝癌细胞株皮下移植裸鼠的肿瘤体积随时间变化的图。
图3是示出根据实施例1的肝癌细胞株皮下移植裸鼠的体重随时间变化的图。
图4是示出根据实施例1的肝癌细胞株皮下移植裸鼠的进食量随时间变化的图。
图5是示出根据实施例1的2dg高剂量组中的给药2dg溶液后的血糖值随时间变化的图。
图6是示出根据实施例2的2dg纳米粒子的粒度分布的图。
图7是示出根据实施例3的肝癌细胞株皮下移植裸鼠以及肿瘤外观的图。
图8是示出根据实施例3的肝癌细胞株皮下移植裸鼠的肿瘤体积随时间变化的图。
图9是示出根据实施例3的肝癌细胞株皮下移植裸鼠的体重随时间变化的图。
图10是示出根据实施例3的肝癌细胞株皮下移植裸鼠的进食量随时间变化的图。
图11是示出根据实施例3的给药2dg纳米粒子后小鼠的血糖值随时间变化的图。
图12是示出根据实施例4的肝癌细胞株皮下移植裸鼠的肿瘤体积随时间变化的图(之一)。
图13是示出根据实施例4的肝癌细胞株皮下移植裸鼠以及肿瘤外观的图(之一)。
图14是示出根据实施例4的肝癌细胞株皮下移植裸鼠的肿瘤体积随时间变化的图(之二)。
图15是示出根据实施例4的肝癌细胞株皮下移植裸鼠以及肿瘤外观的图(之二)。
图16是示出根据实施例5的肾癌细胞株皮下移植裸鼠的肿瘤体积随时间变化的图。
图17是示出根据实施例5的肾癌细胞株皮下移植裸鼠以及肿瘤外观的图。
图18是示出根据实施例6的大肠癌细胞株皮下移植裸鼠的肿瘤体积随时间变化的图。
图19是示出根据实施例6的大肠癌细胞株皮下移植裸鼠以及肿瘤外观的图。
图20是示出根据实施例7的胰腺癌细胞株皮下移植裸鼠的肿瘤体积随时间变化的图。
图21是示出根据实施例7的胰腺癌细胞株皮下移植裸鼠以及肿瘤外观的图。
图22是示出给药含有色素的纳米粒子后,根据实施例8的肝癌细胞株皮下移植裸鼠的色素肿瘤以及生物分布随时间变化的图。
图23是示出给药含有色素的纳米粒子7天后,图22示出的肝癌细胞株皮下移植裸鼠的肿瘤组织以及色素在各器官中的分布图。
图24是示出根据实施例9的肝癌细胞株皮下移植裸鼠的肿瘤体积随时间变化的图。
图25是示出根据实施例9的肝癌细胞株皮下移植裸鼠以及肿瘤外观的图。
图26是示出根据实施例10的肝发癌小鼠的外观的图。
图27是示出根据实施例10的肝发癌小鼠的最大肿瘤直径的图。
图28是示出根据实施例10的肝发癌小鼠的总肿瘤体积的图。
图29是示出根据实施例10的肝发癌小鼠的肝肿瘤组织的免疫染色结果的图。
具体实施方式
(实施方式)
对根据本发明的实施方式进行说明。根据本实施方式的药物组合物,包括含有糖衍生物的生物相容性粒子。例如,糖衍生物是d-葡萄糖的衍生物,并阻碍糖酵解途径。
优选地,糖衍生物是在葡萄糖环的2位不具有羟基的葡萄糖衍生物。作为葡萄糖衍生物,可以列举甘露糖、半乳糖以及5-硫代-葡萄糖。葡萄糖衍生物,也可以代替葡萄糖环上的任意位置的氢具有氟。作为具有氟的葡萄糖衍生物可以列举,例如,2-氟-2-脱氧-d-葡萄糖以及2-二氟-2-d-脱氧-葡萄糖等。葡萄糖衍生物,也可以代替在葡萄糖环的6位以外的任意位置的羟基具有氨基。作为具有氨基的葡萄糖衍生物可以列举,例如,2-氨基-2-脱氧-d-葡萄糖以及2-氨基-2-脱氧-d-半乳糖等。除上述以外,作为葡萄糖衍生物可以列举,2-f-甘露糖、2-甘露糖胺、2-脱氧半乳糖、2-f-脱氧半乳糖等。优选地,糖衍生物是2dg。
在根据本实施方式的药物组合物中,生物相容性粒子含有上述糖衍生物。生物相容性粒子是指对生物的刺激或毒性低,且具备给药后分解并代谢的性质的粒子。这里的“含有”是指糖衍生物可以是被内包或封装在生物相容性粒子中,也可以是糖衍生物被内包或封装在生物相容性颗粒中且糖衍生物的一部分露出在生物相容性粒子的表面。
生物相容性粒子,包括乳酸乙醇酸共聚物(也称为聚丙交酯乙交酯共聚物。以下,简称为“plga”)。plga是由乳酸或丙交酯、和乙醇酸或乙交酯构成的共聚物,例如,比例为1:99~99:1,优选75:25,更加优选3:1。plga可以通过公知的方法由任意单体合成,也可以使用市售的plga。作为市售的plga可以列举,例如,plga7520(乳酸:乙醇酸=75:25,重均分子量为20,000,和光纯药公司制造)。乳酸以及乙醇酸的含量为25重量%~65重量%的plga是非晶态,且可溶于丙酮等的有机溶剂,这一点上是优选的。
生物相容性粒子的粒径不足1000nm,例如,2.5~900nm,优选5~500nm或10~300nm,更加优选30~250nm,进一步优选40~180nm,特别优选50~100nm。例如,生物相容性粒子的粒径为50~170nm。也可以通过筛分法、沉降法、显微镜法、光散射法、激光衍射散射法、电阻试验、通过透射电子显微镜观察、以及通过扫描电子显微镜观察等,测量生物相容性粒子的粒径。也可以使用粒度分布仪测量粒径。根据测量方法,粒径可以由斯托克斯当量直径、圆当量直径以及球当量直径表示。另外,粒径也可以是以多个粒子作为测定对象平均表示的平均粒径、体积平均粒径以及面积平均粒径等。另外,粒径也可以是从基于激光衍射散射法等的测量的个数分布等计算的平均粒径。
具体地,当将粒子团的总体积作为100%求出累积曲线时,也可以将50%径(d50)当作粒径,所述50%径(d50)是其累积曲线成为50%的点的粒径。累积曲线以及d50,可以使用市售的粒度分布仪来求出。作为粒度分布仪可以列举,例如,nikkisonanotracwave-ex150(日机装公司制造)。
为了增加上述生物相容性粒子中所含的糖衍生物的生物利用度,生物相容性粒子的粒度分布优选单峰。作为上述生物相容性粒子的粒径均匀性指标的跨度值,由(d90-d10)/d50求出。在这里,d90是90%径,是上述累积曲线成为90%的点的粒径。d10是10%径,是上述累积曲线成为10%的点的粒径。d90以及d10,可以使用市售的粒度分布计求出。跨度值只要能够获得生物相容性粒子的作用效果就没有限制,例如,2.5以下,优选2.3以下,更加优选2.0以下或1.8以下,特别优选1.6以下。
上述生物相容性粒子的表面,也可以用聚乙二醇(peg)进行修饰。例如,通过在上述生物相容性粒子的制造上使用plga的peg修饰体,获得表面被peg修饰的生物相容性粒子。通过用peg修饰表面,提高生物相容性粒子的血液中的稳定性。
作为含有糖衍生物的生物相容性粒子的制造方法,可以采用公知的任意制造方法。例如,可以通过水中乳化法制造生物相容性粒子。在水中乳化法中,使用两种类型的溶剂:plga溶解的良溶剂、和plga不溶解的不良溶剂。使用plga溶解且与不良溶剂混合的有机溶剂作为良溶剂。良溶剂以及不良溶剂的种类没有特别限制。
作为不良溶剂可以列举,水。当将水作为不良溶剂时,也可以在水中添加表面活性剂。例如,作为表面活性剂,优选聚乙烯醇(pva)。作为除pva以外的表面活性剂可以列举,卵磷脂、羟甲基纤维素以及羟丙基纤维素等。
作为良溶剂可以列举,作为低沸点且水溶性差的有机溶剂的卤代烷烃类、丙酮、甲醇、乙醇、乙酸乙酯、乙醚、环己烷、苯以及甲苯等。优选地,例如,仅使用对环境和人体不利影响少的丙酮或使用丙酮和乙醇的混合液。
在水中乳液法中,首先,在良溶剂中溶解plga之后,将糖衍生物溶液加入良溶剂中并混合,使plga不会析出。当在搅拌下将包含plga和糖衍生物的混合液滴入不良溶剂中时,混合液中的良溶剂迅速向不良溶剂中扩散并移动。其结果,在不良溶剂中发生良溶剂的乳化,并且形成良溶剂的乳液滴。
进一步,由于良溶剂和不良溶剂的相互扩散,有机溶剂从乳液滴内继续向不良溶剂扩散,从而降低在乳液滴中plga以及糖衍生物的溶解度。最终,生成含有糖衍生物的球形结晶粒子的生物相容性粒子。之后,将作为良溶剂的有机溶剂进行离心分离或减压蒸馏除去,获得生物相容性粒子粉末。将获得的粉末原样或根据需要通过冷冻干燥等复合成可再分散的凝集粒子。获得的生物相容性粒子中糖衍生物的含有率为,例如,0.01~99重量%,0.1~30重量%,0.5~20重量%,1~15重量%,3~10重量%或5~10重量%。另外,这里的糖衍生物的含有率是指相对于生物相容性粒子重量的糖衍生物的重量比例。通过定量从规定重量的纳米粒子中提取的糖衍生物的重量,并计算相对于生物相容性粒子重量的糖衍生物的重量比例来求出含有率。
另外,为了增加生物相容性粒子中糖衍生物的含有率,也可以在不良溶剂中添加阳离子聚合物。作为阳离子聚合物,可以列举壳聚糖和壳聚糖衍生物,纤维素上结合有多个阳离子基团的阳离子化纤维素以及聚乙烯基亚胺,聚乙烯基胺和聚烯丙基胺等的聚氨基化合物等。
优选地,使用强制薄膜式微反应器制备含有糖衍生物的生物相容性粒子。在使用强制薄膜式微反应器的情况下,首先,将上述的良溶剂和不良溶剂导入设置成相互面对面且至少一方对于另一方相对旋转的处理用面之间。在由此形成的薄膜流体中,混合良溶剂和不良溶剂,以在薄膜流体中析出含有糖衍生物的生物相容性粒子。作为强制薄膜式微反应器,优选使用ulreass-11(mtechnique公司制造)。
根据本实施方式的药物组合物的药物用途没有特别限制。优选地,该药物组合物作为抗癌剂,用于治疗癌症,特别是实体癌。具体地,作为实体癌可以列举肝细胞癌、胃癌、胰腺癌、肺癌、大肠癌、乳腺癌、肝脏癌(肝癌)、肾脏癌(肾癌)、舌癌、甲状腺癌、子宫癌、卵巢癌、前列腺癌、骨肉瘤、软骨肉瘤、横纹肌肉瘤以及平滑肌瘤等。优选地,该药物组合物用于形成多血性肿瘤的癌症的治疗。多血性肿瘤是指在造影计算机断层摄影法等的造影检查中,可通过造影来增强的富含动脉血流的肿瘤。形成多血性肿瘤的癌症为,例如,肝细胞癌以及肾细胞癌。
上述药物组合物,作为抗肝细胞癌药剂、抗肾脏癌药剂、抗大肠癌药剂、或抗胰腺癌药剂有效。另外,在另一个实施方式中,上述药物组合物作为抗肿瘤剂使用。
如下述实施例10所示,上述药物组合物增加向肿瘤内部的t细胞浸润。因此,在另一个实施方式中,上述药物组合物作为肿瘤免疫活性促进剂使用。
根据本实施方式的药物组合物,对人的给药途径没有特别限制。上述药物组合物优选作为注射剂以及口服给药剂使用。此时,例如,药物组合物也可以是与药学上可接受的载体配合的合剂。药学上可接受的载体是指作为制剂材料使用的各种有机载体物质或无机载体物质。药学上可接受的载体作为,例如,固体制剂中的赋形剂、润滑剂、粘合剂以及崩解剂、或液状制剂中的溶剂、增溶剂、悬浮剂、等渗剂、缓冲剂以及无痛化剂等,与药物组合物配合。另外,可以根据需要使用防腐剂、抗氧化剂、着色剂以及甜味剂等的添加剂。
根据本实施方式的药物组合物,通过已知的方法制备,作为有效成分,包含0.000001~99.9重量%,0.00001~99.8重量%,0.0001~99.7重量%。0.001~99.6重量%,0.01~99.5重量%,0.1~99重量%,0.5~60重量%,1~50重量%或1~20重量%的生物适合性粒子。
根据患者的性别、年龄、体重以及症状等,适当确定根据本实施方式的药物组合物的给药量。给药该药物组合物,以使糖衍生物成为有效量。有效量是指达到所希望的结果所必需的糖衍生物的量,是实现治疗或处置的状态进展的延迟、抑制、预防、逆转或治愈所必需的量。
该药物组合物的给药量,通常,以0.01mg/kg~1000mg/kg,优选0.1mg/kg~200mg/kg,更加优选0.2mg/kg~20mg/kg,可以一天一次或者分多次给药。当分多次给药药物组合物时,该药物组合物优选一天给药1~4次。另外,也可以以每天、每隔一天、每周一次、每隔一周、每月一次等各种给药频率对药物组合物进行给药。优选地,给药频率很容易由医生等确定。另外,根据需要,可以使用超出上述范围的量。
根据本实施方式的药物组合物,也可以与抗癌剂并用。并用是指在规定期间内将药物组合物和抗癌剂对同一患者给药。并用时,优选将药物组合物与抗癌剂在时间上同时给药,不过也可以在一个的效果仍然存在的期间给药另一个,在时间上前后分别单独给药。在并用中,药物组合物以及抗癌剂的给药途径可以相同,也可以不同。例如,在并用中,根据规定了药物组合物以及抗癌剂各自剂量和用法的一个方案,在规定期间,给药药物组合物以及抗癌剂。
并用的抗癌剂没有特别限制,只要对癌有效,例如,使用具有抗肿瘤效果的抗癌剂就可以。作为抗癌剂可以列举,例如,烷基化剂、抗代谢剂、抗癌抗生素、植物生物碱、铂制剂(铂化合物制剂)、生物治疗剂、激素剂以及分子靶标药等。作为抗癌剂,具体可以列举顺铂、卡铂、奥沙利铂、环磷酰胺、甲氨蝶呤、氟尿嘧啶、阿霉素、伊立替康、盐酸吉西他滨、替加氟尿嘧啶以及多西他赛等。优选地,为了治疗肝细胞癌,上述药物组合物作为抗癌剂与分子靶标药的索拉非尼并用。另外,上述药物组合物也可以与阿霉素或顺铂并用。
如上面的详细说明,由于包含了plga的生物相容性粒子中含有糖衍生物,因此通过epr(enhancedpermeabilityandretention,高通透性和滞留性)效应,根据本实施方式的药物组合物可以将糖衍生物选择性地、有效率地积聚在靶癌组织。因此,能够最大程度地抑制对正常组织的影响,从而能够抑制副作用。另外,通过将糖衍生物高效率地转移至靶癌组织,可以获得高的抗肿瘤效果。
另外,在本实施方式中,药物组合物也可以与抗癌剂并用。由于包含在药物组合物中的糖衍生物被取入癌细胞并抑制糖酵解途径,因此,通过抑制由葡萄糖代谢的能量产生和物质合成,示出抗肿瘤效果。除了糖衍生物以外,通过使用具有不同的作用机理的抗癌剂,例如,通过与作为激酶抑制剂的索拉非尼等并用,可以获得进一步的抗肿瘤效果。
在另一个实施方式中,提供了一种包含上述抗癌剂的药物组合物。该药物组合物与包含生物相容性粒子的药物组合物并用,所述生物相容性粒子含有上述糖衍生物。另外,该药物组合物中作为活性成分的抗癌剂的含量,与上述药物组合物中的生物相容性粒子的含量相同。另外,该药物组合物的给药量以及给药方法,也与包含上述生物相容性粒子的药物组合物相同。
根据其他实施方式的药物组合物,包括含有糖衍生物的生物相容性粒子和抗癌剂。即,该药物组合物在单一制剂中包含生物相容性粒子以及抗癌剂两种成分,所述生物相容性粒子含有糖衍生物。据此,可以在相同的给药途径中同时给药糖衍生物和抗癌剂。该药物组合物中的生物相容性粒子与抗癌剂的重量比没有特别限制,可以根据抗肿瘤效果等适当调整。优选地,根据包含在生物相容性粒子中的糖衍生物与抗癌剂的重量比,调整该药物组合物中的生物相容性粒子与抗癌剂的重量比。
在其他实施方式中,提供了一种通过向患者给药含有糖衍生物的上述生物相容性粒子来治疗或预防该患者癌症的方法。在这种情况下,也可以将抗癌剂进一步对该患者给药。
实施例
通过以下的实施例,进一步具体地说明本发明,但是本发明不限于这些实施例。
(实施例1:使用肝癌细胞株皮下移植裸鼠研究通过2dg的抗肿瘤效果)移植给小鼠的肝癌细胞株huh-7(国立大学法人东北大学加龄医学研究所医用细胞资源中心细胞库),使用5%co2培养箱在37℃下培养。huh-7培养基,使用包含10%胎牛血清的dmem(dulbecco’smodifiedeagle’smedium,改良培养基)。
给六周大的裸鼠(balbc-nu/nu,雄性)皮下移植1×107个的huh-7。为了确认移植细胞的植入以及增殖,用游标卡尺测量肿瘤大小,当肿瘤的体积达到100~150mm3的时间点,将小鼠分为以下6组。
(a)对照组:每天腹膜内给药pbs200μl。
(b)2dg低剂量组:将2dg溶解在pbs的100mg/ml的2dg溶液,以100mg/kg/天,每天腹膜内给药。
(c)2dg高剂量组:将100mg/ml的2dg溶液,以1000mg/kg/天,每天腹膜内给药。
(d)索拉非尼组:使用探子(sonde),以5mg/kg/天,每天口服给药索拉非尼(santacruzbiotechnology公司制造)溶液,并且每天腹膜内给药pbs200μl。另外,索拉非尼溶液是将原料粉末以dmso总量溶解,然后再用橄榄油将其溶液稀释至1/20获得(最终为5%dmso溶液)。
(e)索拉非尼+2dg低剂量组:使用探子,以5mg/kg/天,每天口服给药索拉非尼溶液,并且以100mg/kg/天,每天腹膜内给药2dg溶液。
(f)索拉非尼+2dg高剂量组:使用探子,以5mg/kg/天,每天口服给药索拉非尼溶液,并且以1000mg/kg/天,每天腹膜内给药2dg溶液。
在各组中,从开始给药每3天测量一次肿瘤体积以及体重。另外,在开始给药7天后,14天后、21天后的时间点,从过去一周的进食量算出日平均进食量。在开始给药第14天,在规定的时间从2dg高剂量组的小鼠采集血液,并使用glucocard(グルコカード(商标))mydia(arkray公司制造)测量血糖值。进一步,在开始给药21天后,观察肿瘤,并按照常规方法从小鼠采集血液,并切除肝脏。使用spotchem(スポットケム(商标))ezsp-4430system(arkray公司制造)测量采集到的血液的血清学特征。测量切除的肝脏的重量。
(结果)
图1示出各组的开始给药21天后的小鼠以及切除肿瘤的外观。2dg减小了移植肝癌细胞的肿瘤大小。2dg通过与索拉非尼并用进一步减小了肿瘤大小。图2示出肿瘤体积随时间的变化。在2dg低剂量组以及2dg高剂量给药组中,确认到依赖于给药量的肿瘤体积的显著减小。在索拉非尼+2dg低剂量组以及索拉非尼+2dg高剂量组中,通过2dg与索拉非尼并用,确认到依赖于给药量的肿瘤体积的进一步显著减小。
如图3所示,在实验期间,与对照组以及索拉非尼组相比较,索拉非尼+2dg高剂量组的小鼠体重显著减少。图4示出在开始给药7天后,14天后以及21天后的时间点的日平均进食量。关于日平均进食量,未在所有组之间确认到显著差异。表1示出开始给药21天后的血清学特征以及肝重量。在alt值中,索拉非尼+2dg高剂量组示出显著高值。关于中性脂肪,2dg高剂量组以及索拉非尼+2dg高剂量组示出显著低值。
【表1】
**:p<0.001,*:p<0.05vs.索拉非尼+2dg高剂量组
##:p<0.001,##:p<0.05vs.2dg高剂量组
另外,图5示出在开始给药第14天给药2dg溶液后2dg高剂量组的血糖值随时间的变化。在2dg高剂量组中,血糖值明显升高,同时发生意识障碍。从以上结果表明,通过高剂量的给药2dg,可引起体重减轻、肝损害以及高血糖的副作用。
(实施例2:2dg纳米粒子的制备以及2dg纳米粒子的分析)
如下所示,使用ulreass-11(mtechnique公司制造),制备2dg纳米粒子(2dg-plga)。首先,将a液填充到a液罐中,并将罐加压至0.3mpa。之后,在设定值43℃下将a液以167ml/min进行送液,接着,在设定值41℃下(实际测量值约为29℃)将b液以100ml/min进行送液。a液是包含0.5%pva的水溶液。另外,b液是重量比为0.65∶0.25∶66∶33的plga∶2dg∶丙酮:乙醇的溶液。旋转速度设为1000rpm,背压设为0.02mpa。回收400.5ml的排出液,从排出液中用蒸发器80分钟蒸馏除去溶剂。另外,作为b液中的plga,使用plga-7520(乳酸:乙醇酸=75:25,重均分子量为20,000,和光纯药公司制造)。将获得的2dg-plga水性分散液224ml冷冻干燥,得到2.16g的2dg-plga。
将3.7mg上述制备的2dg-plga称重到管中,添加3.7ml的milli-q水。用涡旋混合器搅拌30秒后,超声处理5分钟。使用milli-q水作为对照,通过nikkisonanotracwave-ex150(日机装公司制造)测量2dg-plga的粒度分布。
如下评价2dg-plga中的2dg的含有率。首先,制备标准溶液。将200mg的2dg称重到100ml容量瓶中,并添加50ml水溶解。接着,用乙腈补足至100ml,作为标准原液(2000μg/ml)。将标准原液用乙腈:水(1:1)连续稀释至250、125、62.5、31.25μg/ml,作为标准溶液。
在制备试样溶液时,称量约20mg的2dg-plga作为试样,并添加10ml的milli-q水。用涡旋混合器搅拌30秒后,进行30分钟的超声波处理,作为试样原液。在1.0ml的试样原液中添加乙腈,制成2ml。将该溶液在20℃下、以10,000×g离心分离15分钟。将离心后的上清液用0.2μm的膜过滤器过滤,将得到的滤液作为试样溶液。以n=3对试样溶液实施试验。在以下条件下,通过高效液相色谱法(hplc)分析标准溶液以及试样溶液,并从标准溶液的校准曲线计算求出试样溶液中2dg的浓度。基于上述2dg-plga的重量以及2dg的浓度,计算2dg的含有率。
hplc条件
设备:shimadzu10a系列(岛津制作所制造)
检测:shimadzuelsd-lt
增益:8
漂移管温度:40℃
气压:350kpa(实际测量值358kpa)
雾化气体:n2
色谱柱:shodexasahipaknh2p-504d(150mmx4.6mm)
柱温:40℃
流动相:a:水,b:乙腈
b.浓度75%→69%(8分钟)69→75%(8分钟→16分钟)
流量:1.0ml/分钟
柱温:40℃
注入量:20μl
测量时间:16分钟
(结果)
2dg-plga中2dg的含有率为8.1±0.4%。如图6所示,2dg-plga的粒度分布为单峰,d50为166nm±5.4nm,跨度值为1.52±0.15。
(实施例3:使用肝癌细胞株皮下移植裸鼠研究通过2dg-plga的抗肿瘤效果)
与实施例1相同地,将通过皮下移植huh-7制造的皮下移植裸鼠,分为以下6组。
(g)对照组:每周通过颈静脉给药pbs200μl一次。
(h)plga组:每周通过颈静脉给药plga一次。
(i)2dg组:将100mg/ml的2dg溶液,以100mg/kg/天,每周通过颈静脉给药一次。
(j)2dg-plga组:每周通过颈静脉给药2dg-plga一次。
(k)2dg腹膜内注射组:以100mg/kg/天,每天腹膜内给药上述2dg溶液。
(l)索拉非尼+plga组:使用探子,以5mg/kg/天,每天口服给药索拉非尼溶液,并且每周通过颈静脉给药plga一次。
(m)索拉非尼+2dg-plga组:使用探子,以5mg/kg/天,每天口服给药索拉非尼溶液,并且每周通过颈静脉给药2dg-plga一次。
另外,上述(i)和(k)中100mg/kg/天的2dg剂量,作为每只小鼠(按平均体重25g计算)实质上的2dg单次给药量约相当于2.5mg。另外,上述(h)以及(1)中的plga以及上述(j)以及(m)中的2dg-plga,在每次给药之前作成100mg/ml的pbs悬浮液,每只小鼠每次给药200μl。考虑到2dg-plga中2dg的含有率约为8%,上述(j)以及(m)中每只小鼠实质上的2dg单次给药量约相当于1.6mg,是上述(i)以及(k)的约60%左右。
对于各组,与实施例1相同地,测量肿瘤体积以及体重,算出日平均进食量。以开始给药第14天的2dg-plga组中的小鼠作为对象,以与实施例1相同的方式测量血糖值。开始给药21天后,以与实施例1相同的方式观察肿瘤并测量血清学特征以及肝重量。
(结果)
图7示出给药开始21天后的肿瘤外观。2dg-plga减小了移植肝癌细胞的肿瘤大小。进一步,2dg-plga通过与索拉非尼并用进一步减小了肿瘤大小。图8示出肿瘤体积随时间的变化。相对于对照组、plga组以及2dg静脉注射组,在2dg-plga组中确认到肿瘤体积显著减小。在并用索拉非尼的索拉非尼+2dg-plga组,也确认到肿瘤体积显著减小。
在图8示出的开始给药后第21天的肿瘤体积中,相对于索拉非尼+plga组与对照组之间具有p<0.01的显著差异,索拉非尼+2dg-plga组与对照之间为显著性更高的p<0.001。据此,表明将2dg-plga与索拉非尼并用可获得显著的抗肿瘤效果。
如图9所示,在实验期间,未确认到所有组之间的小鼠体重有显著差异。如图10所示,在开始给药7天后,14天后以及21天后的时间点,日平均进食量也没有显著差异。表2示出开始给药21天后的血清学特征以及肝重量。开始给药21天后,在血清学特征以及肝脏重量方面,所有组之间未确认到显著差异。
【表2】
在实施例1中的2dg高剂量组中,在开始给药第14天2dg给药后,血糖值明显升高同时伴有意识障碍,但是在本实施例中,如图11所示,在2dg-plga组中,在开始给药第14天的2dg-plga给药后,未确认到血糖值升高,也未确认到意识障碍。从以上结果表明,通过2dg-plga可以在没有体重减轻、肝损害以及高血糖等副作用的前提下,得到高抗癌作用。
(实施例4:研究2dg-plga与抗癌剂并用时的抗肿瘤效果以及安全性)
与实施例1相同地,将皮下移植huh-7的小鼠分为以下4组,并研究与不同于索拉非尼的抗癌剂并用时的抗肿瘤效果以及安全性。
阿霉素+plga组:将阿霉素溶液(sigma公司制造)以4mg/kg,隔天一次腹膜内口服给药,并且每周通过颈静脉给药plga一次。
阿霉素+2dg-plga组:将阿霉素溶液以4mg/kg,隔天一次腹膜内口服给药,并且每周通过颈静脉给药2dg-plga一次。
顺铂+plga组:将顺铂溶液(sigma公司制造)以3mg/kg,每周一次腹膜内给药,并且每周通过颈静脉给药plga一次。
顺铂+2dg-plga组:将阿霉素溶液以3mg/kg,每周一次腹膜内给药,并且每周通过颈静脉给药2dg-plga一次。
另外,在本实施例的plga以及2dg-plga的给药中,与实施例3相同地,在每次给药前将plga或2dg-plga作成100mg/ml的pbs悬浮液,每只小鼠每次给药200μl。
与上述实施例3相同地,评价肿瘤体积、体重、日平均进食量、血糖值、血清学特征以及肝重量,并观察肿瘤。对于抗肿瘤效果以及安全性,与上述实施例3的对照组等进行比较。
(结果)
如图12所示,在2dg-plga组以及阿霉素+2dg-plga组,确认到相对于对照组肿瘤体积显著减小。另外,在阿霉素+2dg-plga组,确认到相对于阿霉素+plga组肿瘤体积显著减小。从图13示出的开始给药21天后的小鼠以及肿瘤的外观可以明显看出,2dg-plga的给药增强阿霉素的抗肿瘤效果。
如图14所示,在2dg-plga组以及顺铂+2dg-plga组,确认到相对于对照组肿瘤体积显著减小。另外,顺铂+2dg-plga组的肿瘤体积与2dg-plga组的肿瘤体积具有显著差异。从图15示出的开始给药21天后的小鼠以及肿瘤的外观可以明显看出,2dg-plga的给药增强顺铂的抗肿瘤效果,并且几乎使肿瘤消失。
关于体重以及日平均进食量,在包括上述实施例3的(g)~(m)的所有组之间,未确认到显著变化。表3示出开始给药21天后的血清学特征以及肝重量。对于血清学特征以及肝重量,所有组之间未确认到显著差异。
【表3】
(实施例5:使用肾癌细胞株皮下移植裸鼠研究通过2dg-plga的抗肿瘤效果)
使用5%co2培养箱在37℃下培养肾癌细胞株os-rc-2(从理化学研究所获得)。os-rc-2培养基使用包含10%胎牛血清的rpmi。
给六周大的裸鼠(balbc-nu/nu,雄性)皮下移植5×106个os-rc-2。用游标卡尺测量肿瘤大小,并且当肿瘤体积达到100~150mm3的时间点,将小鼠分为以下三组。
对照组:每周通过颈静脉给药pbs200μl一次。
2dg组:将100mg/ml的2dg溶液,以100mg/kg/天,每天腹膜内给药。
2dg-plga组:每周通过颈静脉给药2dg-plga一次。
2dg-plga组中2dg-plga的给药方法,与实施例3相同。对于各组,以与实施例1相同的方式测量肿瘤体积以及体重。开始给药14天后,对小鼠实施安乐死,与实施例1相同的方式观察肿瘤。
(结果)
图16示出肿瘤体积随时间的变化。相对于对照组以及2dg组,在2dg-plga组中确认到肿瘤体积显著减小。在开始给药14天后,小鼠以及肿瘤的外观如图17所示。与2dg组相比较,2dg-plga组的肿瘤大小明显很小。在肾癌细胞株os-rc-2皮下移植裸鼠中,2dg-plga也显示出抗肿瘤效果。
(实施例6:使用大肠癌细胞株皮下移植裸鼠研究通过2dg-plga的抗肿瘤效果)
使用5%co2培养箱在37℃下培养大肠癌细胞株ht-29。ht-29的培养基,使用包含10%胎牛血清的mccoy's5a。除了用ht-29代替os-rc-2移植到小鼠的这一点以及在开始给药21天后而不是14天后对小鼠实施安乐死之外,以与上述实施例5相同的方式评价通过2dg-plga的抗肿瘤效果。
(结果)
图18示出肿瘤体积随时间的变化。相对于对照组以及2dg组,在2dg-plga组中确认到肿瘤体积显著减小。在开始给药21天后,小鼠以及肿瘤的外观如图19所示。与2dg组相比较,2dg-plga组的肿瘤大小明显很小。在大肠癌细胞株ht-29皮下移植裸鼠中,2dg-plga也显示出抗肿瘤效果。
(实施例7:使用胰腺癌细胞株皮下移植裸鼠检测通过2dg-plga的抗肿瘤效果)
使用5%co2培养箱在37℃下培养胰腺癌细胞株bx-pc-3。bx-pc-3的培养基,使用包含10%胎牛血清的rpmi。以与上述实施例6相同的方式评价通过2dg-plga的抗肿瘤效果。
(结果)
图20示出肿瘤体积随时间的变化。相对于对照组以及2dg组,在2dg-plga组中确认到肿瘤体积显著减小。在开始给药21天后,小鼠以及肿瘤的外观如图21所示。与2dg组相比较,2dg-plga组的肿瘤大小明显很小。在胰腺癌细胞株bx-pc-3皮下移植裸鼠中,2dg-plga也显示出抗肿瘤效果。
(实施例8:使用肝癌细胞株皮下移植裸鼠分析icg-plga的肿瘤以及生物内分布)
使用ulreass-11(由mtechnique公司制造),以制备内包吲哚青绿(indocyaninegreen,以下简称为“icg”,第一三共公司制造)的plga粒子。将从以与实施例2相同的方法制备的包含0.5%pva的水溶液(a液)和plga∶icg∶丙酮:乙醇的重量比为0.65∶0.1∶66∶33的溶液(b液)获得的icg-plga水性分散液冷冻干燥,获得0.61g的icg-plga。
通过高效液相色谱法(hplc)分析icg-plga,并从标准溶液的校准曲线算出试料溶液中的icg含有率(含量)。icg-plga中的icg含量为6.2±0.3%。
用nikkisonanotracwave-ex150(日机装公司制造)测量icg-plga的粒度分布。icg-plga的粒度分布为单峰,d50为187nm。icg-plga的粒径跨度值为1.5nm。
给八周大的裸鼠(balbc-nu/nu,雄性)皮下移植1×107个huh-7。用游标卡尺测量肿瘤大小,并且在确认肿瘤的最大直径为15mm左右之后,将icg-plga注射到小鼠的颈静脉(800mg/kg)。注射1.5小时后、6小时后、24小时后、两天后、三天后以及七天后,在异氟烷吸入麻醉下,通过活体成像系统(invivoimagingsystem,ivis)分析icg-plga的肿瘤以及生物分布的随时间变化。ivis使用了ivisspectrum(xenogen公司制造)。
(结果)
图22以及图23示出ivis下的分析结果。如图22所示,在给药icg-plga后,立即通过ivis确认全身的icg分布,icg-plga在给药后立即向肿瘤积聚。给药7天后icg也还积聚在肿瘤部位,不过,未确认到icg向其他生物组织积聚。另外,在给药icg-plga7天后,采集肿瘤组织以及各个器官,并通过ivis进行成像,如图23所示,仅在肿瘤组织确认到了icg的强积聚,没有确认到向其他器官的明显积聚。
(实施例9:通过具有不同粒径的2dg-plga研究抗肿瘤效果)
给六周大的裸鼠(balbc-nu/nu,雄性)皮下移植1×107个huh-7。用游标卡尺测量肿瘤大小,并且当肿瘤体积达到约100~150mm3的时间点,将小鼠分为以下三组。
对照组:每周通过颈静脉给药pbs200μl一次。
2dg-plga(d50=49nm)组:将d50为49nm的2dg-plga每周通过颈静脉给药一次(800mg/kg)。另外,该2dg-plga中的2dg含有率为8.5±0.5%,跨度值为0.95。
2dg-plga(d50=153nm)组:将d50为153nm的2dg-plga每周通过颈静脉给药一次(800mg/kg)。另外,该2dg-plga中的2dg含有率为7.2±0.2%,跨度值为1.3。
2dg-plga(d50=313nm)组:将d50为313nm的2dg-plga每周通过颈静脉给药一次(800mg/kg)。另外,该2dg-plga中的2dg含有率为6.6±0.2%,跨度值为1.6。
在本实施例的2dg-plga给药中,在每次给药之前将2dg-plga作成100mg/ml的pbs悬浮液,并且以每只小鼠每次800mg/kg的剂量进行给药。对于上述各组,从开始给药每3天测量肿瘤体积,并评价肿瘤体积的随时间变化。开始给药21天后对小鼠实施安乐死,并观察肿瘤。
(结果)
图24示出肿瘤体积随时间的变化。相对于对照组以及2dg-plga(d50=313nm)组,在2dg-plga(d50=49nm)组以及2dg-plga(d50=153nm)组中确认到肿瘤体积显著减小。在开始给药21天后,小鼠以及肿瘤的外观如图25所示。与对照组相比较,在2dg-plga(d50=49nm)组以及2dg-plga(d50=153nm)组中,同等移植的肝癌细胞的肿瘤体积显著减少,不过在2dg-plga(d50=313nm)组,虽然相对于对照组肿瘤体积有所减小,但未达到2dg-plga(d50=50nm)组以及2dg-plga(d50=153nm)组。
(实施例10:使用非免疫缺陷的肝发癌小鼠研究通过2dg-plga的抗肿瘤效果)
为了评价通过2dg-plga在抗肿瘤效果中的抗肿瘤免疫活性,使用非免疫缺陷的肝发癌小鼠进行了实验。
作为肝发癌小鼠,获得stam(商标)小鼠(smc实验室公司(smclaboratories,inc.)制造),所述stam(商标)小鼠是通过给出生后2天的c57bl6/n雄性小鼠皮下注射链脲佐菌素,从出生的第4周开始断奶,并将饲料改为高脂饮食而制造的。
将十二周大的肝发癌小鼠(雄性),分为以下4组。
(1)对照组:每周通过颈静脉给药pbs200μl一次。
(2)2dg组:将100mg/ml的2dg溶液,以100mg/kg/天,每天腹膜内给药。
(3)2dg-plga低剂量组:每周通过颈静脉给药2dg-plga一次。
(4)2dg-plga高剂量组:每周通过颈静脉给药(3)的10倍剂量的2dg-plga一次。
上述(2)中给药的2dg浓度100mg/kg/天,作为每只小鼠(按平均体重27g计算)实质上的2dg单次给药量约相当于2.7mg。在每次给药之前将上述(3)中的2dg-plga以pbs作成10mg/ml的悬浮液,每只小鼠每次给药200μl。在每次给药之前将上述(4)中的2dg-plga作成100mg/ml的pbs悬浮液,每只小鼠每次给药200μl。
考虑到2dg-plga中2dg的填充率约为8%,上述(3)中每只小鼠的实质2dg单次给药量相当于约0.16mg,约为上述(2)的6%左右。上述(4)中每只小鼠的实质2dg单次给药量相当于约1.6mg,约为上述(2)的60%左右。
在上述(1)~(4)中,从开始给药的第21天观察整个肝脏,并测量肝脏内的肿瘤最大直径、肿瘤个数以及总肿瘤体积(n=5)。另外,使用兔单克隆cd3抗体(genetex公司制造)对肝肿瘤组织进行免疫染色。
(结果)
开始给药21天后的肿瘤外观示于图26。2dg-plga不仅在高剂量组中,而且在低剂量组中也抑制了肿瘤个数。如图27所示,2dg-plga在高剂量组以及低剂量组中,减小了最大肿瘤直径,特别是在高剂量组中,最大肿瘤直径相对于对照组显著减小。另外,如图28所示,2dg-plga不仅在高剂量组中,而且在低剂量组中,相对于对照组显著减小了总肿瘤体积。
将免疫染色的结果示于图29。在图29中,用箭头表示cd3染色阳性t细胞。在2dg给药组以及2dg-plga高剂量组中,确认到向肿瘤内部的t细胞浸润的增加。在本实施例中使用的肝发癌模型是没有包括t细胞免疫在内的免疫缺陷的小鼠。在本实施例中,即使使用在实施例1中对具有免疫缺陷的肝癌细胞株皮下移植裸鼠给药的2dg-plga的1/10的低剂量,2dg-plga也显示出与高剂量相同的抗肿瘤效果。如图29所示,作为其原因考虑是由于在免疫缺陷的肝癌细胞株皮下移植裸鼠中未确认到的t细胞性肿瘤免疫活性促进效果加入了抗肿瘤效果的机理中。
在不脱离本发明的广义精神和范围的情况下,可以对本发明进行各种实施方式以及变形。另外,上述实施方式是用于说明本发明,并不限定本发明的范围。即,本发明的范围不是由实施方式,而是由权利要求示出。并且,在权利要求的范围内以及与其同等发明的意义范围内所进行的各种变形,被认为在本发明的范围内。
本申请基于2017年6月28日申请的日本专利申请2017-125770号以及2017年10月5日申请的日本专利申请2017-195178号。在本说明书中,将日本专利申请第2017-125770号和日本专利申请第2017-195178号的说明书、权利要求书、整个附图作为参考引入。
工业应用性
本发明适用于药物组合物,特别是抗癌剂。
- 还没有人留言评论。精彩留言会获得点赞!