软骨再生用生物墨水组合物、利用其的定制型软骨再生用支架的制造方法以及利用所述制造方法制造的定制型软骨再生用支架与流程
本说明书要求于2018年1月31日向韩国专利局提交的韩国专利申请第10-2018-0012221号的申请日的权益,其全部内容包含于本说明书。
本发明涉及一种软骨再生用生物墨水组合物、利用其的定制型软骨再生用支架的制造方法以及利用所述制造方法制造的定制型软骨再生用支架。
背景技术:
退行性关节炎(degenerativearthritis)是一种随着关节软骨的磨损消失而出现局部退行性变化的疾病,也称为骨关节炎(osteoarthritis)或骨关节病。退行性关节炎为一种慢性关节炎,是一种受到的体重负荷大的关节软骨发生退行性变化,而使关节面的骨过度生长而发生的疾病,大量出现于中年期成人。该疾病首先是,因合成软骨组成成分的软骨细胞老化而功能下降,导致软骨丧失弹性。并且,随着时间流逝,软骨表面变得粗糙,被关节膜包裹的关节腔内部流入多种物质而出现炎症。在临床上出现反复疼痛、关节强直感、关节的渐进性运动障碍等。退行性关节炎的原因与老化现象或体重过高关系密切,随着年龄增大,在女性中出现更多且更严重。初期症状是一个或两个关节出现强直并伴有刺痛般的疼痛,如果长期化,则导致软骨下骨硬化、关节周边骨过度形成、关节变形等。
关节软骨的退行性变化的原因尚未明确,但所公知的一个原因是,软骨细胞数的绝对减少和发生于软骨细胞(chondrocytes)的软骨基质合成与分解不均衡。因此,关节软骨的退行性变化为,由于软骨基质分解,使软骨强度和作为衬垫的功能减小。
原有的细胞治疗剂,缺点在于,移植的细胞因重力而聚集到一个方向,因而难以均等地分布于缺损部位,细胞移植植活困难,使软骨缺损部的细胞再生减少。此外,就自体软骨细胞移植术及干细胞移植术而言,提取组织后经过培养过程而应用于患者,因而需要2次手术,需要为期约4周的细胞培养时间或操作。同时,问题在于,移植的细胞因重力而难以在缺损部位均等地分布及植活,诱导向纤维软骨的分化而不是向玻璃软骨的分化,因此在此之后会出现软骨易碎的现象。因此,实情是,需要开发一种方法,能够有效执行软骨缺损部的细胞再生。
[现有技术文献]
[专利文献]
kr专利公开公报10-2017-0012099
技术实现要素:
发明所要解决的技术问题
本发明旨在提供一种用来制作用于使缺损的软骨部位的软骨再生的定制型软骨再生用支架的软骨再生用生物墨水组合物。进而,提供一种利用所述软骨再生用生物墨水组合物的定制型软骨再生用支架的制造方法以及利用其制造的定制型软骨再生用支架。
解决技术问题的技术手段
本发明的一种实施状态提供一种软骨再生用生物墨水组合物,包括:第一液,其包含脂肪组织源性基质血管组分(adiposetissuederivedstromalvascularfraction)、透明软骨(hyalinecartilage)粉末及纤维蛋白原;以及第二液,其包含凝血酶。
本发明的另一实施状态提供一种定制型软骨再生用支架的制造方法,包括:a)利用3d扫描仪,获取缺损的软骨部位的三维数据,利用3d打印机制造支架用模具的步骤;b)利用包含脂肪组织源性基质血管组分(adiposetissuederivedstromalvascularfraction)、透明软骨(hyalinecartilage)粉末及纤维蛋白原的第一液,涂布在所述支架用模具内而形成第一层的步骤;c)将包含凝血酶的第二液涂布于所述第一层上而形成第二层的步骤;以及d)所述第一层及所述第二层进行反应而形成软骨再生用支架的步骤。
本发明的又一实施状态提供一种利用所述制造方法制造的定制型软骨再生用支架。
发明的效果
根据本发明的软骨再生用生物墨水组合物,优点在于,能够制造患者定制型软骨再生用支架。
根据本发明的利用软骨再生用生物墨水组合物制造的定制型软骨再生用支架,能够提高移植的脂肪组织源性基质血管组分的软骨分化能力,进而增加在移植部位的软骨再生,实现有效的软骨治疗。
根据本发明的定制型软骨再生用支架,优点在于,对患部具有优秀的接合力,因而软骨分化能力及软骨再生效果优秀。
根据本发明的定制型软骨再生用支架的制造方法,优点在于,能够在手术室对患部的软骨缺损部进行3d扫描并直接制造定制型软骨再生用支架,因而能够通过一次手术过程来移植支架。
附图说明
图1示出了实验例1的用于确认软骨分化能力的团粒的制造过程。
图2显示了对根据实验例1的比较例1(mccm0㎎)的团粒进行番红o染色的结果。
图3显示了对根据实验例1的实施例1(mccm10㎎)的团粒进行番红o染色的结果。
图4显示了对根据实验例1的实施例2(mccm50㎎)的团粒进行番红o染色的结果。
图5显示了对根据实验例1的实施例3(mccm100㎎)的团粒进行番红o染色的结果。
图6显示了实验例2的用于确认软骨再生与否的动物实验过程。
图7显示了根据实验例2的实施例4的动物实验过程中的图像以及支架移植后6周后的缺陷区域的显微ct拍摄图像。
图8显示了根据实验例2的比较例2的动物实验过程中的图像以及支架移植后6周后的缺陷区域的显微ct拍摄图像。
图9显示了针对根据实验例2的比较例2的移植后6周后的缺陷区域进行番红o染色的结果。
图10显示了针对根据实验例2的实施例4的移植后6周后的缺陷区域进行番红o染色的结果。
图11显示了针对根据实验例2的比较例2的移植后6周后的缺陷区域,用1型胶原(collagentype1)进行免疫组织化学染色(immunohistochemistry、ihc)处理的结果。
图12显示了针对根据实验例2的实施例4的移植后6周后的缺陷区域,用1型胶原(collagentype1)进行免疫组织化学染色(immunohistochemistry、ihc)处理的结果。
图13显示了针对根据实验例2的比较例2的移植后6周后的缺陷区域,用2型胶原(collagentype2)进行免疫组织化学染色(immunohistochemistry、ihc)处理的结果。
图14显示了针对根据实验例2的实施例4的移植后6周后的缺陷区域,用2型胶原(collagentype2)进行免疫组织化学染色(immunohistochemistry、ihc)处理的结果。
具体实施方式
在本说明书中,当提到某构件位于另一构件“之上”时,这不仅仅涉及某构件与另一构件接触的情形,还包括还有其他构件存在于两构件之间的情形。
在本说明书中,当提到某部分“包括”某组成要素时,只要没有特别记载相反的情况,这并不意味着排除其他组成要素,而是意味着还可包括其他组成要素。
以下对本发明进行详细说明。
本发明的一种实施状态提供一种软骨再生用生物墨水组合物,包括:第一液,其包含脂肪组织源性基质血管组分、透明软骨粉末及纤维蛋白原;以及第二液,其包含凝血酶。
本发明的软骨再生用生物墨水组合物为二液型,所述第一液与所述第二液依次涂布后能够反应而形成软骨再生用支架。具体地,所述第二液中的凝血酶与所述第一液中的纤维蛋白原反应而可以形成纤维蛋白网络,这能够起到充分固定所述脂肪组织源性基质血管组分、透明软骨粉末的作用。
所述脂肪组织源性基质血管组分(adiposetissuederivedstromalvascularfraction)包括脂肪组织源性干细胞(adiposederivedstemcells)。优选地,所述脂肪组织源性基质血管组分实质上可以不包含除脂肪组织源性干细胞之外的其他细胞(例如,脂肪细胞、红血球细胞及其他基质细胞等)以及细胞外基质物质,更优选地,可以完全不包含其他细胞及细胞外基质物质。
所述脂肪组织源性基质血管组分可以提取自同种动物或异种动物的脂肪组织。优选地,所述脂肪组织源性基质血管组分可以提取自自体脂肪组织。更具体地,所述脂肪组织源性基质血管组分可以利用手术对象患者或动物的脂肪细胞来进行提取。
根据本发明一种实施状态,所述脂肪组织源性基质血管组分的含量在每1ml第一液中可以为105个至107个。当所述脂肪组织源性基质血管组分的含量在所述范围内时,所制造的支架的软骨分化能力及软骨再生能力能够大幅提高。
将所述脂肪组织源性基质血管组分与透明软骨粉末合用,则能够分化为软骨细胞,由此,当将所述定制型软骨再生用支架移植到患部时,能够诱导向软骨细胞的活跃的分化。
所述透明软骨(hyalinecartilage)粉末能够成为,利用所述软骨再生用生物墨水组合物制造的支架的支撑体的构成要素。具体地,通过所述纤维蛋白原与凝血酶反应而得的纤维蛋白基质,能够使所述透明软骨粉末的颗粒相互结合。
所述透明软骨粉末可以来源于同种或异种的透明软骨。优选地,所述透明软骨粉末可以来源于同种的透明软骨。具体地,当软骨手术对象是人时,可以使用提取自人的透明软骨的透明软骨粉末。此外,当软骨手术对象是动物时,可以使用提取自同种类动物的透明软骨的透明软骨粉末。
所述透明软骨粉末能够排出与软骨再生相关的生长因子,诱导所述脂肪组织源性基质血管组分分化为软骨细胞。进而,所述透明软骨粉末所包含的蛋白质能够起到帮助患部的软骨活跃地实现再生的作用。
根据本发明的一种实施状态,所述透明软骨粉末可以来源于肋软骨(costalcartilage)。具体地,当所述定制型软骨再生用支架的应用对象为人时,所述透明软骨粉末可以来源于人的肋软骨。此外,当所述定制型软骨再生用支架的应用对象为动物时,所述透明软骨粉末可以来源于对象动物的同种类的肋软骨。例如,所述透明软骨粉末可以将市售的同种异体肋软骨(allogeniccostalcartilage)进行粉末化而使用。
根据本发明的一种实施状态,所述透明软骨粉末的粒径可以为30μm以上、300μm以下。当所述透明软骨粉末的平均粒径在所述范围内时,优点在于,有效实现软骨细胞的分化及再生。
根据本发明的一种实施状态,所述透明软骨粉末的浓度可以为0.005%(w/v)至0.1%(w/v)。即,所述第一液每1ml中,可以包含所述透明软骨粉末0.005g至0.1g。所述透明软骨粉末的浓度优选地可以为0.005%(w/v)至0.07%(w/v),更优选地可以为0.005%(w/v)至0.03%(w/v),最优选地可以为0.007%(w/v)至0.03%(w/v)。当所述透明软骨粉末的浓度在所述范围内时,在移植了定制型软骨再生用支架之后,软骨细胞的存活性、向软骨细胞的分化以及形态学能够实现为最优秀。
根据本发明的一种实施状态,相对于所述透明软骨粉末5㎎至100㎎,所述脂肪组织源性基质血管组分的个数可以为105个至107个。优选地,相对于所述透明软骨粉末5㎎至70㎎,所述脂肪组织源性基质血管组分的个数可以为105个至107个。更优选地,相对于所述透明软骨粉末5㎎至30㎎,所述脂肪组织源性基质血管组分的个数可以为105个至107个。
根据本发明的一种实施状态,所述第一液还可以包含抑肽酶。所述抑肽酶(aprotinin)作为胰腺分泌的蛋白酶的抑制剂,是由总共58个氨基酸组成的多肽。据悉,主要提取自牛肺,在血液中阻止纤维蛋白分解,从而起到止血作用。
根据本发明的一种实施状态,每1ml第一液中可以包含所述纤维蛋白原65㎎至115㎎。
根据本发明的一种实施状态,每1ml第一液中可以包含所述抑肽酶900kiu至1,100kiu(激肽原灭活剂单位,kininogeninactivatorunit),具体可以包含1000kiu。
具体地,根据本发明的一种实施状态,所述第一液每1ml可以包含:105个至107个脂肪组织源性基质血管组分、5㎎至100㎎的透明软骨粉末、65㎎至115㎎的纤维蛋白原及900kiu至1,100kiu的抑肽酶。
根据本发明的一种实施状态,所述第二液可以是在氯化钙溶液中分散有凝血酶。具体地,所述第二液每1ml可以包含400iu至600iu的凝血酶、5㎎至6.5㎎的氯化钙。
所述第一液及第二液的溶剂可以为水,具体可以为生理盐水。此外,所述第一液中的纤维蛋白原与所述第二液中的凝血酶可以通过商用的纤维蛋白胶试剂盒获得。
所述第一液与第二液在10分钟以内,优选地,在5分钟以内完成反应,因而所述软骨再生用生物墨水组合物,优点在于,可以在手术现场利用3d打印机当场制造患者定制型软骨再生用支架。
本发明将由纤维蛋白原及纤维蛋白组成的纤维蛋白胶作用粘合剂,这能够确保高于透明质酸粘合剂或胶原蛋白粘合剂的粘性,因而所述定制型软骨再生用支架具有与患部的优秀粘合力,进而能够保持高强度。
本发明的另一实施状态提供一种定制型软骨再生用支架的制造方法,包括:a)利用3d扫描仪,获取缺损的软骨部位的三维数据,利用3d打印机制造支架用模具的步骤;b)利用包含脂肪组织源性基质血管组分(adiposetissuederivedstromalvascularfraction)、透明软骨(hyalinecartilage)粉末及纤维蛋白原的第一液,涂布在所述支架用模具内而形成第一层的步骤;c)将包含凝血酶的第二液涂布于所述第一层上而形成第二层的步骤;以及d)所述第一层及所述第二层进行反应而形成软骨再生用支架的步骤。
步骤a)可以利用本行业所知的3d扫描仪装备及3d打印装备。此外,所述支架用模具能够起到在涂布所述第一液及第二液时能够固定立体形态的作用。所述支架用模具可以在形成所述软骨再生用支架后去除。所述支架用模具可以利用本行业一般使用的生物相容性高分子形成。
根据本发明一种实施状态,步骤b)及步骤c)可以利用喷墨打印或3d打印执行。具体地,步骤b)及步骤c)可以利用本行业所知的具有2个以上喷嘴的打印装置,各个喷嘴可以分别吐出所述第一液及第二液而制作立体形状。
根据本发明的一种实施状态,步骤b)及步骤c)可以交替重复执行2次以上。具体地,当需要形成体积大的软骨再生用支架时,可以交替执行步骤b)及步骤c),从而以如同“第一层/第二层/第一层/第二层”的方式层叠后,进行凝固而形成软骨再生用支架。
根据本发明的一种实施状态,步骤d)可以在10分钟以内完成,优选地,可以在5分钟以内完成。具体地,步骤d)可以为,反应3分钟至7分钟,所述第一层及所述第二层进行反应而形成软骨再生用支架。
原有的自体软骨细胞移植术及干细胞移植术,问题在于,为了提取患者缺损的软骨区域的组织而第一次切开患部后,经过所述组织的培养过程,需要进行第二次切开以移植到患部,因此需要两次手术过程。与此相反,所述定制型软骨再生用支架的制造方法,优点在于,能够在通过第一次切开而确认缺损的软骨区域后,在短时间内制造与缺损的软骨区域对应的支架并移植到缺损的软骨区域。即,根据本发明的定制型软骨再生用支架的制造方法,优点在于,仅需要1次切开,便能够将定制型支架移植到患部。
本发明的又一实施状态提供一种利用所述制造方法制造的定制型软骨再生用支架。
所述定制型软骨再生用支架,如前所述,能够在短时间内制造成与缺损的软骨区域对应的形状并进行移植。所述定制型软骨再生用支架不需要细胞培养过程,移植后,所述支架内的脂肪组织源性基质血管组分能够分化为软骨细胞,透明软骨粉末能够激活软骨的再生,能够提高再生的软骨细胞的存活率。
当将所述定制型软骨再生用支架移植于患部时,借助于所述透明软骨粉末所分泌的透明软骨(玻璃软骨)生长因子及蛋白质,可以诱导软骨(具体为膝盖软骨)原本的透明软骨再生。由此,当将所述定制型软骨再生用支架应用于患部时,能够有效恢复为与原有的软骨相同或类似的状态。
以下,为了具体说明本发明,举实施例进行详细说明。但是,根据本发明的实施例可以变形为其他各种形态,本发明的范围不被解释为限定于以下所叙述的实施例。提供本说明书的实施例,是旨在向本行业普通技术人员更完整地说明本发明。
脂肪组织源性基质血管组分(svf)细胞的分离
脂肪组织源性基质血管组分(svf)细胞通过下述步骤获得。
1.在无菌手术室中,在医生主导下实施吸脂术,提取约60cc的脂肪组织,按与之相同的量,添加0.075%的胶原酶脂质噬菌体(collagenaselipidphage),在37℃温度下,通过230rpm的振荡培养,使其反应30分钟。
2.如上所述进行反应后,将420g的反应物在25℃下离心分离10分钟,离心分离结果,分成了svf团粒层、胶原酶层以及油层3个层。
3.去除除svf团粒层之外的上部液,将svf团粒层用磷酸盐缓冲盐水(phosphatebufferedsaline,pbs)进行再悬浮后,利用100μm的尼龙过滤器(cellstrainer)去除再悬浮的svf层的纤维质以及残留的杂质。
4.将经过滤的包含svf的溶液再悬浮,进行3次离心分离后,进行去除而只留下最下层的团粒后,利用细胞计数器计算有核细胞的结果,能够确认:获得了105个至107个svf。
透明软骨粉末的制造
透明软骨粉末可以利用可从市面购入的肋软骨(costalcartilage),制造成具有30μm至300μm颗粒大小的粉末。所述透明软骨粉末以下称为mccm(micronizedcostalcartilagematrix,微细化肋软骨基质)。
实验例1–制造用于确认软骨形成分化(chondrogenesisdifferentiation)与否的团粒(体外实验)
[实施例1至实施例3]
图1示出了用于确认软骨分化能力的团粒的制造过程。具体地,用于确认软骨分化能力的实验如下实施。
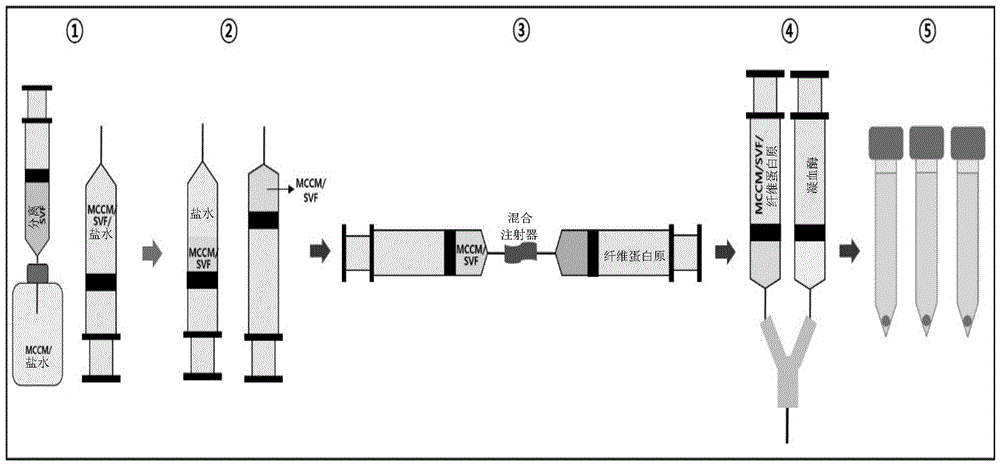
1.将所述获得的svf(105个至107个)与分散有所述制造的透明软骨粉末(mccm)10㎎(实施例1)、50㎎(实施例2)及100㎎(实施例3)的生理盐水混合。
2.将所述混合液在4℃下按1000rpm离心分离5分钟后,去除生理盐水上清液,获得mccm/svf混合物。
3.利用混合注射器(mixsyringe),将mccm/svf混合物与混合有纤维蛋白原的抑肽酶液1ml混合。
4.将mccm/svf/纤维蛋白原溶液1ml与分散有凝血酶的氯化钙溶液1ml分别连接于y型件,分别向15ml锥形管(conicaltube)分配注入200μl,在常温下固化5分钟而形成团粒。
5.将无生长因子培养基(growthfactorfreemedia)每周更换投入3次,并使其充分没过团粒,在37℃、5%co2条件下培养(incubating)5周后,实施番红o染色,确认软骨形成分化。
[比较例1]
在没有mccm的情况下,仅将svf与混合有纤维蛋白原的抑肽酶液混合(mccm0㎎、比较例1),以如上所述方法形成团粒,进行培养后,实施番红o染色,确认软骨形成分化。
图2至图5分别显示了根据比较例1(mccm0㎎)、实施例1(mccm10㎎)、实施例2(mccm50㎎)及实施例3(mccm100㎎)的对团粒进行番红o染色的结果。在图2至图5中,随着番红o染色,软骨部分及mccm被染色成红色,能够确认,在实施例1至3的mccm周边观察到软骨细胞的核,能够确认,存在多个活软骨细胞。只是,没有使用mccm的比较例1,则无法确认软骨细胞发生分化。通过上述结果能够推测,mccm的蛋白质及生长因子等被释放,从而诱导了svf向软骨细胞的分化。进而,关于mccm含量,则能够确认,实施例1(mccm10㎎)相比于实施例2及实施例3,软骨细胞的存活性及向软骨细胞的分化最活跃。即,判断为,当mccm的含量过多时,能够向软骨细胞分化的空间减少,因而向软骨细胞的分化变慢。
实验例2–用于确认软骨再生(cartilageregeneration)与否的动物实验(体内实验)
[实施例4]
图6示出了用于确认软骨再生与否的动物实验过程。具体地,如下进行用于确认软骨再生与否的动物实验。
1.将所述获得的svf(105个至107个)与分散有所述制造的透明软骨粉末(mccm)10㎎的生理盐水混合。
2.将所述混合液在4℃下按1000rpm离心分离5分钟后,去除生理盐水上清液,获得mccm/svf混合物。
3.利用混合注射器(mixsyringe),将mccm/svf混合物与混合有纤维蛋白原的抑肽酶液1ml混合。
4.分别制备mccm/svf/纤维蛋白原溶液1ml与分散有凝血酶的氯化钙溶液1ml。
5.使实验用比格犬的膝盖大腿关节区暴露,在此形成直径约6㎜、深度约2㎜大小的缺陷(defect)区域。
6.为了制造支架用模具,利用3d扫描仪获得实验用比格犬的缺损软骨部位的三维数据,以此为基础,使用3dbio3d打印机(invivo,rokit),输出医疗级别的聚己内酯(polycaprolactone,pcl)外壁。进而,利用3dbio3d打印机(invivo,rokit),将mccm/svf/纤维蛋白原溶液和分散有凝血酶的氯化钙溶液分别依次涂布于所述支架用模具内后,固化5分钟,制造了定制型软骨再生用支架。
7.在实验用比格犬的缺陷区域注入纤维蛋白胶(beriplast)100μl,移植所制造的定制型软骨再生用支架后,缝合手术部位。
8.6周后,确认在移植的定制型软骨再生用支架内是否形成了软骨细胞。
[比较例2]
在没有mccm的情况下,仅将svf与混合有纤维蛋白原的抑肽酶液混合,以如上所述方法进行动物实验。
图7及图8分别显示了,根据实验例2的实施例4及比较例2的动物实验过程中的图像以及支架移植后6周后的缺陷区域的显微ct拍摄图像。在图7及8中,能够确认,根据实施例4的显微ct拍摄结果,与根据比较例2的显微ct拍摄结果相比,表现出很高的骨密度。由此能够确认,利用mccm的实施例4,具有高软骨生成能力。
图9及图10分别显示了针对根据实验例2的比较例2及实施例4的移植后6周后的缺陷区域进行番红o染色的结果。番红o染色结果能够确认,仅实施例4的缺陷区域的软骨再生。这能够通过图10的箭头表示的部分中的出现呈现红色的体积的部分进行确认。进而,图9中呈现红色的部分只不过是,制作缺陷区域时的正常软骨遗留部分所对应的区域。
图11及图12分别显示了,为了确认根据实验例2的比较例2及实施例4的移植后6周后的缺陷区域的软骨再生究竟再生为何种软骨而利用1型胶原(collagentype1)进行免疫组织化学染色(immunohistochemistry、ihc)处理的结果。所述1型胶原结合了用于确认纤维软骨(fibro-cartilage)的抗体(antibody),起到仅检测纤维软骨并呈现为褐色的作用。根据图12,能够确认,在缺陷区域再生的部分呈现为蓝色,由此可知,再生的软骨并非纤维软骨而是透明软骨,再生为适合缺陷区域的软骨细胞。与此相反,图11则无法确认分化为透明软骨的区域。
图13及图14分别显示了,为了确认根据实验例2的比较例2及实施例4的移植后6周后的缺陷区域中的软骨再生究竟再生为何种软骨而利用2型胶原(collagentype2)进行免疫组织化学染色(immunohistochemistry、ihc)处理的结果。所述2型胶原结合了用于确认透明软骨(hyalinecartilage)的抗体(antibody),起到仅检测透明软骨并呈现为褐色的作用。根据图14,能够确认,在缺陷区域再生的部分呈现为褐色,由此可知,再生的软骨并非纤维软骨而是透明软骨,再生为适合缺陷区域的软骨细胞。与此相反,图13则无法确认分化为透明软骨的区域。
通过所述实施例及比较例的结果能够确认,如实施例,当移植同时使用了脂肪组织源性基质血管组分与透明软骨粉末的本发明的定制型软骨再生用支架时,向软骨细胞的分化有效实现,进而,软骨细胞的扩散及再生得以提高。
- 还没有人留言评论。精彩留言会获得点赞!