主动脉载药支架及其制备方法与流程
本发明涉及血管外科技术领域,具体涉及一种主动脉载药支架及其制备方法。
背景技术:
主动脉夹层(aorticdissection,ad)作为最凶险的血管系统疾病之一,是指血液撕裂主动脉内膜形成裂口,进入中膜或中外膜交界处,形成主动脉真假两腔,可短时间内造成主动脉破裂导致患者死亡。近年来快速发展的主动脉腔内微创治疗(endovascularaorticrepair,evar)是指通过在外周动脉(如股动脉)切1~3cm小切口,然后将移植物从血管腔内输送至病变部位,从而封闭裂口进行腔内修补。由于避免了开胸、开腹以及主动脉阻断,微创且快速有效,腔内治疗已广泛应用于主动脉夹层的治疗。
主动脉夹层假腔血栓化(falselumenthrombosis,flt),可以反映主动脉夹层假腔中的血栓形成和剩余血流情况,临床常通过主动脉ct分层面分析、整体三维重建以及mri对其进行评价。主动脉夹层腔内治疗后最显著的并发症是假腔内持续存在血流,这会导致主动脉的整体扩张、局部瘤样扩张以及破裂的发生。flt是这一并发症最相关的评价指标,是夹层患者院外死亡的独立预测因素;同时也是参与评价evar治疗效果和主动脉重塑情况的重要指标。而对于evar术后的主动脉夹层患者而言,因主动脉是通过假腔血栓化进展和假腔收缩而良性重塑并最终归于稳定的,假腔未能形成有效血栓化的主动脉则有更高的瘤样扩张和破裂风险。由于促进主动脉假腔血栓化十分重要和必要,多种主动脉夹层治疗策略被不断研发和报道,而假腔血栓化也逐渐从评价预后的指标前移成为腔内治疗的目标。
当今适用于主动脉夹层患者的evar技术主要通过重塑主动脉,同时阻断或部分阻断假腔血流,使假腔完全血栓化形成,从而起到治疗主动脉夹层的作用。然而,当今主动脉支架使用过程中发现了大量的内漏问题,即腔内治疗后仍有血液流经由移植物与主动脉管壁之间的空隙进入裂口和夹层假腔,严重影响患者预后。同时,部分特殊形态学特征的主动脉夹层,不能做到全部主动脉夹层裂口完全隔绝,因此假腔内凝血状态差。现有技术中的主脉支架存在如下缺陷:一、主动脉支架与主动脉管壁贴合性差,刚性支架与管壁存在间隙,完全假腔血栓化形成率仅可达到50%;二、主动脉载药支架起步较晚,缺乏促进局部凝血的主动脉载药支架;三、现有载药覆膜技术主要依靠静电纺丝技术(cn201210444956.1)和药物喷涂技术,但是这两种技术都存在药物在到达病灶前会有大量损失的问题,使得药物的功效被大打折扣。
技术实现要素:
本发明是为了解决上述问题而进行的,目的在于提供主动脉载药支架及其制备方法。
本发明提供了一种主动脉载药支架,具有这样的特征,包括:支架本体以及包覆并固定在支架本体上的载药覆膜,其中,载药覆膜包括由内至外依次设置的分隔层、药物层以及降解层,分隔层由非渗透材料制成,药物层由促凝血药物构成,降解层由可降解材料制成。
在本发明提供的主动脉载药支架中,还可以具有这样的特征:其中,促凝血药物为人凝血酶原复合物或人凝血因子ⅱ、ⅶ、ⅸ、ⅹ中的一种或多种。
在本发明提供的主动脉载药支架中,还可以具有这样的特征:其中,可降解材料为酸降解壳聚糖或聚乳酸,酸降解壳聚糖为经过酸降解处理的壳聚糖,分子量为1000~1500。
在本发明提供的主动脉载药支架中,还可以具有这样的特征:其中,载药覆膜还包括缓释层,该缓释层设置在药物层和降解层之间,具有均匀分布的多个药物释放微孔,药物释放微孔的直径小于或等于100nm。
在本发明提供的主动脉载药支架中,还可以具有这样的特征:其中,缓释层和分隔层均为自膨聚四氟乙烯制成。
在本发明提供的主动脉载药支架中,还可以具有这样的特征,还包括:两个保护固定环,环绕设置在载药覆膜的外侧并分别设置在支架本体的两端,均由凝胶海绵制成。
在本发明提供的主动脉载药支架中,还可以具有这样的特征:其中,药物层的长度小于降解层以及分隔层,保护固定环所对应的载药覆膜的区域不设置药物层。
本发明提供了一种主动脉载药支架的制备方法,具有这样的特征,包括以下步骤:步骤一,制备载药覆膜;步骤二,在低于35℃的条件下,将载药覆膜包覆并固定在支架本体上,得到主动脉载药支架,其中,步骤一中,在低于35℃的条件下,至少将分隔层、药物层以及降解层依次放置得到载药覆膜,分隔层由非渗透材料制成,用于分隔药物层和支架本体,药物层由促凝血药物构成,降解层由可降解材料制成。
在本发明提供的主动脉载药支架的制备方法中,还可以具有这样的特征:其中,可降解材料为酸降解壳聚糖,降解层的制备过程为:步骤s1-1,将可溶性淀粉与壳聚糖以等质量比混合后加入酸溶液进行溶解,得到第一混合溶液;步骤s1-2,向第一混合溶液中加入甘油进行反应,直到不再产生气泡为止,得到第二混合溶液;步骤s1-3,将第二混合溶液均匀平铺在洁净干燥的玻璃板上,干燥冷却后用氢氧化钠溶液浸泡,待膜与玻璃板分离后,揭膜得到降解层。
在本发明提供的主动脉载药支架的制备方法中,还可以具有这样的特征:其中,步骤一中,在低于35℃的条件下,将分隔层、药物层、缓释层以及降解层依次放置得到载药覆膜。
发明的作用与效果
根据本发明所涉及的主动脉载药支架,因为具有支架本体以及载药覆膜,载药覆膜包括由内至外依次设置的分隔层、药物层以及降解层,其中,分隔层由非渗透材料制成,降解层由可降解材料制成,因此,本发明的主动脉载药支架在使用时,分隔层能够使得药物层无法通过支架本体的空隙与血液相接触,同时,降解层能够使得药物层在主动脉载药支架被输送过程中不与血液相接触,从而解决了药物层在输送过程中的损失问题。此外,当本发明的主动脉载药支架被输送至病灶部位之后,载药覆膜作用于夹层破口处,封堵夹层破口及支撑主动脉管壁,随着降解层的降解,药物层暴露在血液中,在药物层的作用下,主动脉载药支架与主动脉管壁之间形成血栓,进而将夹层破口完全隔绝,阻断假腔流血,解决了主动脉支架使用过程中的内漏问题。
进一步地,本发明的药物层由促凝血药物构成,促凝血药物暴露在人体的血液中之后能够快速地溶解,进而促进血栓的快速形成。
根据本发明所涉及的主动脉载药支架的制备方法,因为在低于35℃的条件下制备载药覆膜并将载药覆膜包覆在支架本体上,避免了了主动脉载药支架在制备过程中因温度过高而造成的药物层的促凝血药物活性降低的问题。此外,本制备方法简单、容易操作,易于推广应用。
附图说明
图1是本发明的实施例一中主动脉载药支架的结构示意图;
图2是图1的剖视图;以及
图3是本发明的实施例一中载药覆膜的结构示意图。
具体实施方式
为了使本发明实现的技术手段、创作特征、达成目的与功效易于明白了解,以下实施例结合附图对本发明主动脉载药支架及其制备方法作具体阐述。
<实施例一>
本实施例提供了一种主动脉载药支架及其制备方法。
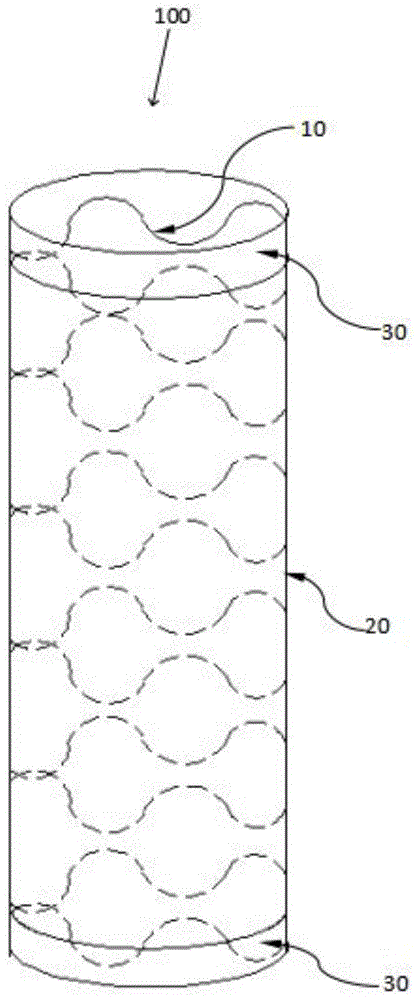
图1是本发明的实施例一中主动脉载药支架的结构示意图。
图2是图1的剖视图。
如图1、2所示,本实施例中的主动脉载药支架100包括支架本体10、载药覆膜20、保护固定环30以及不透x射线标记(图中未示出)。
支架本体10为镍钛合金材质的、激光切割的多个连续正弦波型的支架环组成的支架骨架。
图3是本发明的实施例一中载药覆膜的结构示意图。
载药覆膜20包覆固定在支架本体10上,包括由内至外依次设置的分隔层21、药物层22、缓释层23以及降解层24。在本实施例中,通过缝合的方式将载药覆膜20固定在支架本体10上,并且缝合所使用的缝合线为cv线等不溶性的高强度缝合线。
分隔层21直接包覆在支架本体10的外表面上,由非渗透材料制成。在本实施例中,非渗透材料为自膨聚四氟乙烯。分隔层21的长度和支架本体10的长度相等。
药物层22包覆在分隔层21上,包括促凝血药物以及适宜的稳定剂。稳定剂为海藻糖,还可含有常用的甘氨酸、nacl、柠檬酸三钠、肝素中的一种或几种。促凝血药物为人凝血酶原复合物或人凝血因子ⅱ、ⅶ、ⅸ、ⅹ中的一种或多种。在本实施例中,促凝血药物为人凝血酶原复合物。人凝血酶原复合物由健康人血浆经低温乙醇蛋白分离法或经批准的其他分离法分离纯化,并经病毒去除和灭活、冻干制成。人凝血酶原复合物在20-30℃,轻轻摇动条件下可在15分钟内完全溶解,因此要需在支架释放前被隔绝,而释放后再与血液接触并做到缓释。
药物层22的长度小于分隔层21的长度,并且当药物层22覆盖在分隔层21表面后,分隔层21的上、下两端的没有被药物层22所覆盖的部分的大小是相同的。
缓释层23包覆在药物层22上,由非渗透材料制成。在本实施例中,非渗透材料为自膨聚四氟乙烯。缓释层23上设置有均匀分布的多个药物释放微孔231。药物释放微孔231为圆形,直径小于或等于100nm。缓释层23的长度与分隔层21的长度相等。
降解层24包覆在缓释层23上,由可降解材料制成。在本实施例中,可降解材料为酸降解壳聚糖,该酸降解壳聚糖为经过酸降解处理的壳聚糖,分子量为1000~1500。壳聚糖的分子量在10万~30万,而酸法降解后的壳聚糖的分子量会降低,当分子量达在1000~1500时壳聚糖可以基本完全溶于水。酸降解法即应用醋酸、盐酸、亚硝酸、浓硫酸、氢氟酸等进行非特异性降解。降解过程中壳聚糖中的氨基可与质子相结合而使自身带正电荷。降解层24的长度与分隔层21的长度相等。
保护固定环30的数目为两个,为中空环形结构,分别环绕设置在载药覆膜20的外侧,并且设置在载药覆膜20的未设置药物层22的端部位置,此位置也是支架本体的端部位置。保护固定环30的大小与载药覆膜20的未设置药物层22的部分的大小相符,并且厚度与药物层20的厚度大致相等。保护固定环30由凝胶海绵制成。
在本实施例中,通过缝合的方式将保护固定环30固定在支架本体10和载药覆膜20上,并且缝合所使用的缝合线为cv线等不溶性的高强度缝合线。
不透x射线标记的数目为多个,设置在保护固定环30和载药覆膜20之间,用于对主动脉载药支架100的两端进行定位,进而便于精确释放。
本实施例中的主动脉载药支架100的制备过程如下:
步骤一、制备降解层24。
具体过程为:以质量比1:1将可溶性淀粉与壳聚糖混合,加入1%的冰醋酸溶液,搅拌至完全溶解,转移到100ml容量瓶中,得到第一混合溶液。向第一混合溶液加1ml甘油,搅拌均匀,待溶液中的气泡全部脱去为止,得到第二混合溶液。取一定量的得到第二混合溶液,均匀地平铺于洁净干燥的玻璃板上,在一定温度下干燥、冷却。用氢氧化钠溶液浸泡,待膜与玻璃板分离后,揭膜制成薄膜结构的降解层。降解层保存在干燥器内待用。
步骤二、制备缓释层23。将自膨聚四氟乙烯打孔,孔径小于100nm以保证未溶解的药物不能通过。
步骤三、在低于35℃的条件下,将分隔层21、药物层22、缓释层23以及降解层24按顺序依次堆积并用cv线进行缝合,得到载药覆膜20。注意分隔层21、缓释层23以及降解层24大小相等,需要完全对齐;药物层22的长度小于与其余各层,需要与其余各层居中对齐(即、载药覆膜20的不设置药物层22的上下两端等尺寸)。缝合用的缝线和缝针直径需要严格一致,避免缝合时出现缝隙。将制作好的载药覆膜20保存在-20℃条件下备用。
步骤四、在低于35℃的条件下,将载药覆膜20包覆在支架本体10上,保持分隔层21与支架本体10直接接触而降解层24位于最外侧。然后将不透x射线标记放置在载药覆膜20两端(未设置药物层22)的外侧。再将保护固定环30套设在载药覆膜20的两端外侧,使得不透x射线标记被夹在保护固定环30和载药覆膜20之间。最后用cv线将保护固定环30、载药覆膜20端部以及支架本体10用cv线进行缝合,并将载药覆膜20(除端部以外的部分)与支架本体10进行缝合,得到主动脉载药支架100。缝合用的缝线和缝针直径需要严格一致。将制作好的主动脉载药支架100保存在-20℃条件下备用。
本实施例中的主动脉载药支架100的使用过程为:
首先,主动脉载药支架100压缩过程中注意轻柔压缩,避免损伤降解层21,且应该避免与水接触。
然后,在主动脉载药支架100被植入之前,打入少量生理盐水进行润滑,并在dsa指导下进行定位释放。
最后,主动脉载药支架100释放后,降解层21会在10小时内部分降解,对缓释层23和药物释放微孔231进行暴露。药物释放微孔231允许人凝血酶原复合物和血液混合,并在体温、脉搏摇晃情况下进行溶解,全面激活凝血反应促进支架与主动脉间隙以及主动脉夹层假腔内的凝血反应,起到促进局部血栓化,加速主动脉良性重塑进程,优化主动脉夹层治疗效果的作用。同时酸降解壳聚糖带有正电荷,会吸引血液中带有负电荷的凝血物质聚集,亦起到促进局部血栓化的作用,同时有着一定的抗细菌作用。支架两端的保护固定环30可以吸水完全贴合主动脉壁,起到防止支架移位和血栓远端栓塞发生的作用。
实施例一的作用与效果
根据实施例一所涉及的主动脉载药支架,因为具有支架本体以及载药覆膜,载药覆膜包括由内至外依次设置的分隔层、药物层以及降解层,其中,分隔层由非渗透材料制成,降解层由可降解材料制成,因此,本发明的主动脉载药支架在使用时,分隔层能够使得药物层无法通过支架本体的空隙与血液相接触,同时,降解层能够使得药物层在主动脉载药支架被输送过程中不与血液相接触,从而解决了药物层在输送过程中的损失问题。此外,当本发明的主动脉载药支架被输送至病灶部位之后,载药覆膜作用于夹层破口处,封堵夹层破口及支撑主动脉管壁,随着降解层的逐渐降解,药物层暴露在血液中,在药物层的作用下,主动脉载药支架与主动脉管壁之间形成血栓,进而将夹层破口完全隔绝,阻断假腔流血,解决了主动脉支架使用过程中的内漏问题,加速了主动脉良性重塑进程,优化主动脉夹层治疗效果的作用。
进一步地,实施例一中的药物层由促凝血药物构成,促凝血药物暴露在人体的血液中之后能够快速地溶解,进而促进血栓的快速形成。
进一步地,实施例一中的促凝血药物为人凝血酶原复合物,人凝血酶原复合物在20~30℃,轻轻摇动条件下可在15分钟内完全溶解,促进血栓的快速形成。并且,人凝血酶原复合物还能够使单一凝血因子缺乏的患者的血液产生血栓,因此本实施例的主动脉载药支架同样适用于单一凝血因子缺乏的主动脉夹层患者的治疗。
进一步地,实施例一中的可降解材料为酸降解壳聚糖,分子量为1000~1500,因此酸降解壳聚糖基本上能完全溶于水,并且由于酸降解壳聚糖带正电荷,因此它可以吸引一般带负电荷的凝血物质(如血小板)聚集,促进局部凝血。此外,壳聚糖无毒无害、生物相容性好,安全可靠。
进一步地,实施例一中的载药覆膜还包括缓释层,缓释层设置在药物层和降解层之间,具有多个药物释放微孔,因此,当降解层降解后,血液能够通过释放微孔与药物层中的促凝血药物混合溶解,达到缓释药物的效果,并且药物释放微孔的直径必须小于或等于100nm,才能够与促凝血药物的溶解性质相适应,保证未溶解的促凝血药物不能通过该药物释放微孔,从而持续对患者进行治疗。
进一步地,实施例一中的保护固定环环绕在载药覆膜的外侧并设置在支架本体的端部,因此保护固定环能够对载药覆膜的端部进行更好的固定。此外,保护固定环由凝胶海绵制成,因此保护固定环能够吸水从而完全贴合主动脉壁,起到防止支架移位、防止血栓流到其他部位的作用。
进一步地,实施例一中的保护固定环所对应的载药覆膜的区域不设置药物层,一方面,避免了在支架本体的端部位置由于药物层与血液接触所造成的血栓远端栓塞的发生;另一方面减少了支架本体端部的载药覆膜的厚度,使得保护固定环固定后的端部厚度与支架本体其它的部分厚度相同,从而便于整个主动脉载药支架的输送以及更好地支撑主动脉管壁。
根据实施例一所涉及的主动脉载药支架的制备方法,因为在低于35℃的条件下制备载药覆膜并将载药覆膜包覆在支架本体上,避免了了主动脉载药支架在制备过程中因温度过高而造成的药物层的促凝血药物活性降低的问题。此外,本制备方法简单、容易操作,易于推广应用。
<实施例二>
本实施例提供了一种主动脉载药支架及其制备方法。
本实施例中的主动脉载药支架同样包括支架本体、载药覆膜、保护固定环以及不透x射线标记。本实施例中的主动脉载药支架与实施例一中的主动脉载药支架100之间的唯一区别在于载药覆膜的降解层的降解材料不同,其它结构与实施例一中的结构完全相同。
本实施例中的降解层的降解材料为聚乳酸(pla),并且降解层是由聚乳酸经双向拉伸技术生产的。
本实施例中的主动脉载药支架的制备方法与实施例一中的主动脉载药支架100的制备方法的唯一不同之处在于降解层的制备过程不同,其它步骤与实施例一中的制备步骤完全相同。
本实施例中的降解层的制备过程为:
首先,将聚乳酸在干燥条件为80℃的条件干燥5h。
然后,将聚乳酸按照下述薄膜成型参数进行双向拉伸:铸片锟温度20~25℃;纵向拉伸时,余热区温度40~75℃,拉伸区温度60~70℃度,定型区温度20~30℃;横向拉伸时,预热区温度50~120℃,拉伸区温度60~130℃,定型区温度11~160℃;纵、横拉伸比为3.0*3.0。
实施例二的作用与效果
实施例二中与实施例一相同的结构具有同样的作用与效果,此外,实施例二中的降解层由于采用聚乳酸作为降解材料,并且聚乳酸经双向拉伸技术制备成型,该制备过程便于机械化扩大生产,并且能够严格控制降解层的制备参数,因此获得的降解层的厚度易于进行批次化控制。
上述实施方式为本发明的优选案例,并不用来限制本发明的保护范围。
例如,在实施例一中,可降解材料为酸降解壳聚糖,在实施例二中可降解材料为聚乳酸,但在实际应用中,可降解材料还可以为其它任何一种可降解的薄膜型材料,例如海藻酸盐等。
在实施例一和实施例二中,促凝血药物为人凝血酶原复合物或人凝血因子ⅱ、ⅶ、ⅸ、ⅹ中的一种或多种,但在实际应用中,促凝血药物还可以为垂体后叶素、去甲肾上腺素、生长抑素、卡巴克洛/卡洛柳钠、酚磺乙胺、氨甲环酸氨甲苯酸、氨基乙酸、二乙酰氨乙酸乙二胺、抑肽酶、凝血酶、蛇毒血凝酶、维生素k1、硫酸鱼精蛋白、凝血质、纤维蛋白原等。
在实施例一和实施例二中,稳定剂均为海藻糖,但在实际应用中,稳定剂还可以为蔗糖、明胶等。
在实施例一和实施例二中,都采用人工行缝合的方式将支架本体和载药覆膜进行固定,但在实际应用中,为了便于扩大生产,还可以采用机械缝合的手段来替代人工缝合,或者是应用α氰基丙烯酸酯、光固化、热熔等多种粘接方法进行将支架本体和载药覆膜进行固定、连接。
在实施例一和实施例二中,支架本体都采用正弦波型的支架环组成的支架骨架,但在实际应用中,支架本体还可以采用网格状、编织网、“z”形波或高低相间弹性波形的支架骨架。
- 还没有人留言评论。精彩留言会获得点赞!