一种微纳米等级结构仿生支架及其制备方法与流程
本发明涉及生物医药领域,尤其涉及一种微纳米等级结构仿生支架及其制备方法。
背景技术:
目前,关于促进骨再生的生物支架的构建,主要围绕两种基本策略:即在支架中添加活性成分或调控支架的结构形态。随着生物活性因子合成技术和干细胞治疗技术的进步,生物材料支架依靠添加生物活性因子、无机盐以及具有再生能力的干细胞,可获得良好的骨再生效果。然而,由于外源性生物活性成分的应用,导致了诸如再生不受控制、潜在的癌症风险等问题。相对的,结构因素促进成骨尽管得到了部分研究,但其促成骨效果的不确切,且促成骨机制未知,仍难以堪用。
天然骨组织由纤维胶原相和羟基磷灰石按照复杂的顺序堆叠在纤维中,表现出极强的机械稳定性和再生能力。当骨折发生后,新生骨的形成始于肉芽组织的浸润和骨痂的形成,这些组织不仅提供了临时固定效果,同时也提供了下一步修复所需的营养和钙质。此后,机体自身的干细胞分泌产生细胞外基质网络,丰富的纳米纤维基质网络充当细胞-基质的相互作用的基础以及羟基磷灰石沉积的模板。最后,这些纳米纤维网络的进一步矿化和重构,同时,支持组织逐渐降解。可见,人类骨骼的自然愈合过程是一个高度协调和层次化的过程。与人工支架相比,由微米级支持组织和纳米纤维基质网络组成的骨折修复复合体可以通过其特有的微纳米结构促进骨再生。受到这种自然过程的启发,模拟人体骨骼的自然修复过程,通过支架本身的微观结构促进骨再生,是目前研究的重点。
胶原蛋白作为天然骨有机相中最丰富的蛋白质,以其优越的生物学性能在骨仿生重建中得到了广泛的报道。然而,目前构建胶原蛋白仿生细胞外基质网络结构的材料学方法较为单一,如电纺支架和自组装水凝胶,制得的支架力学性能差,应用受到限制。另一方面,丝素蛋白(sf)多孔支架作为骨组织工程支架的传统原材料之一,无法像细胞外基质那样提供仿生微环境。有学者尝试在丝素蛋白中添加无机盐如羟基磷灰石(ha)、生物活性玻璃(bg)可使支架具有良好的骨传导性和力学性能,这种增强效应与无机成分中的钙离子与丝素中丰富的羧基和羟基之间的离子键有关。但是,添加无机盐无法改变这种材料与细胞的相互作用模式。因此,提供一种不仅力学性能好而且生物活性高的仿生支架具有重要意义。
技术实现要素:
有鉴于此,本发明所要解决的技术问题在于提供了一种微纳米等级结构仿生支架及其制备方法,本发明提供的仿生支架不仅力学性能好,而且生物活性高。
本发明提供了一种微纳米等级结构的仿生支架,通过运用自组装胶原蛋白纳米纤维和生物活性玻璃纳米颗粒对微米级丝素蛋白多孔支架进行强化而得到。本发明还提供了一种微纳米等级结构仿生支架的制备方法,包括:
1)将生物活性玻璃纳米颗粒与丝素蛋白溶液混合并进行超声振荡,在加入甘油并进行预冻后通过冷冻干燥得到生物活性玻璃纳米颗粒强化的丝素蛋白多孔支架;
2)将胶原蛋白溶液滴到步骤1)制备得到的生物活性玻璃纳米颗粒强化的丝素蛋白多孔支架上并置于合适环境下进行自组装,得到促进成骨的仿生支架。
优选的,所述丝素蛋白溶液浓度为4~8%,更优选为6%。
优选的,所述丝素蛋白与生物活性玻璃纳米颗粒的质量比为(15~30)∶1。
优选的,所述步骤1)中还加入甘油进行反应,丝素蛋白与甘油的质量比为1∶(0.2~0.3)。
优选的,所述生物活性玻璃纳米颗粒按照以下方法制备得到:
在tris-hcl缓冲溶液中,以十六烷基溴化氨为模板剂,加入钙源、磷源和硅源反应,得到生物活性玻璃纳米颗粒。
优选的,所述自组装的温度为35~40℃。
优选的,所述胶原溶液按照以下方法制备得到:
将i型胶原溶解于0.05~0.2m乙酸溶液中得到含胶原的溶液,随后在冰浴下用十倍浓度的磷酸盐缓冲液稀释含胶原的溶液,逐滴添加naoh水溶液调节ph至7.0,得到待自组装的胶原溶液。
与现有技术相比,本发明提供了一种微纳米等级结构仿生支架,通过运用自组装胶原蛋白纳米纤维和生物活性玻璃纳米颗粒对微米级丝素蛋白多孔支架进行强化而得到;本发明建立了内外双重强化的微纳米等级结构仿生支架,且通过实验发现,本发明得到的仿生支架不仅具有很好的力学性能,且胶原蛋白纳米纤维、生物活性玻璃及丝素蛋白三种组分得到了稳定的整合,能够通过其自身的仿生结构更好地促进干细胞的成骨。
附图说明
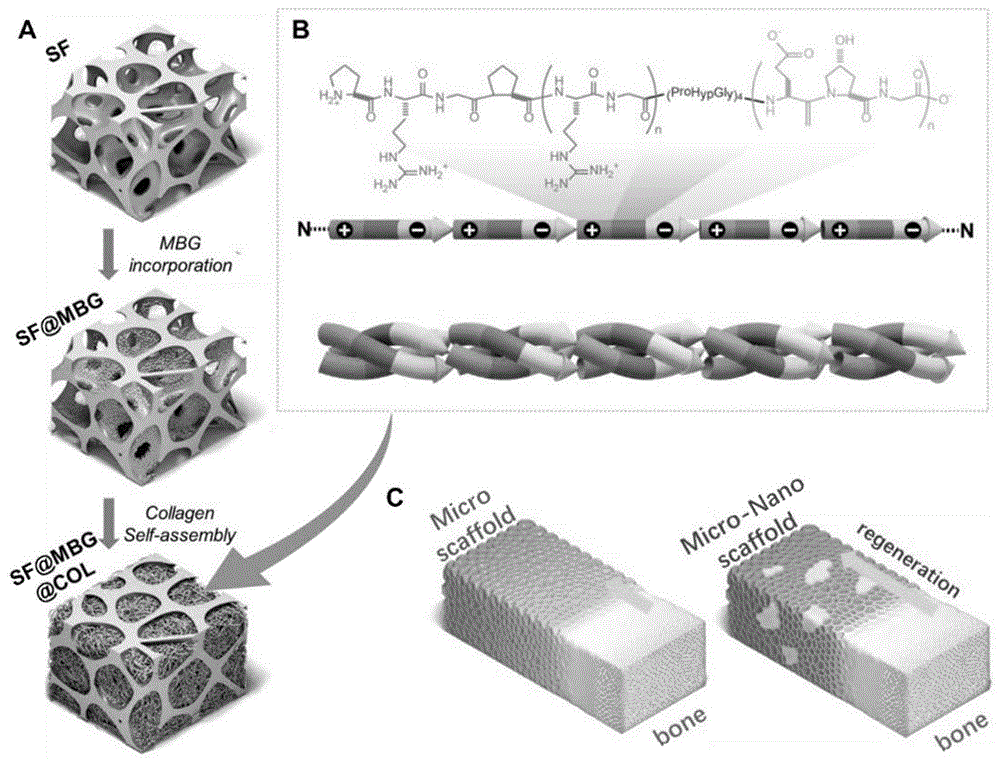
图1为仿生支架的构建示意图;
图2为仿生支架的形态和组成结构示意图;
图3为得到的仿生支架的结构示意图、丝素蛋白,胶原纤维和生物玻璃颗粒之间相互作用的放大图示以及相应的sem视图;
图4支架力学性能和促矿化能力表征图;
图5为仿生支架的细胞粘附和增殖测定结果;
图6为仿生支架粘附模式和整合素表达的表征;
图7微纳米等级仿生结构促成骨的机制研究结果;
图8为实施例得到的仿生支架在体内的性能评估结果;
图9为骨缺损模型的组织学分析。
具体实施方式
本发明提供了一种微纳米等级结构仿生支架,通过运用自组装胶原蛋白纳米纤维和生物活性玻璃纳米颗粒对微米级丝素蛋白多孔支架进行强化而得到。其中,所述胶原蛋白优选为i型胶原蛋白;所述微米级丝素蛋白与生物活性玻璃纳米颗粒的质量比优选为(15~30)∶1,更优选为(20~25)∶1;本发明对胶原蛋白的用量没有特殊要求,本领域技术人员可以根据本领域公知常识选择合适的用量。通过研究发现,本申请得到的微纳米等级结构仿生支架通过生物玻璃增强微孔支架和纳米胶原网络的协调,建立了用层次结构加强的骨因子-干细胞-释放支架,实现了丝素蛋白,胶原纳米纤维和生物玻璃纳米粒子之间的活性相互作用,并赋予其优异的力学性能和促矿化活性,促进祖细胞的细胞粘附、扩散和成骨分化。
本发明提供了一种微纳米等级结构仿生支架的制备方法,包括:
1)将生物活性玻璃纳米颗粒与丝纤维蛋白溶液混合并进行超声振荡,在进行预冻后通过冷冻干燥得到生物活性玻璃纳米颗粒强化的丝素蛋白多孔支架;
2)将胶原蛋白溶液滴到步骤1)制备得到的生物活性玻璃纳米颗粒强化的丝素蛋白多孔支架上并置于合适环境下进行自组装,得到微纳米等级结构仿生支架。
按照本发明,本发明将生物活性玻璃纳米颗粒与丝素蛋白溶液混合超声反应,得到生物活性玻璃纳米颗粒强化的丝蛋白多孔支架;其中,所述丝纤维蛋白溶液的质量浓度优选为4~8w/w%,更优选为6~7w/w%;所述丝纤维蛋白与生物活性玻璃纳米颗粒的质量比优选为(15~30)∶1,更优选为20∶1;本发明中,为了使所述步骤1)中还加入甘油进行反应,得到生物活性玻璃纳米颗粒强化的丝蛋白多孔支架;其中,所述丝素蛋白与甘油的质量比优选为1∶(0.2~0.3),更优选为1∶0.25;所述超声反应的温度为室温反应;所述超声反应的时间为0.5~2小时,优选为1~1.5小时;所述超声反应完毕后,还包括将得到的产物进行冷冻干燥,得到生物活性玻璃纳米颗粒强化的丝素蛋白多孔支架。
本发明中,所述丝素蛋白溶液按照以下方法制备得到:
将丝素蛋白在碱性水溶液中煮沸、清洗,得到脱胶丝的丝素蛋白;然后将脱胶丝的丝素蛋白与溴化锂溶液混合,透析,然后脱水,得到丝纤维蛋白溶液;其中,所述碱性水溶液优选为碳酸钠水溶液或碳酸钾水溶液,更优选为碳酸钠水溶液;所述碱性水溶液的质量浓度优选为0.3~0.7%,更优选为0.5~0.6%;所述脱水用脱水剂为聚乙二醇粉末,更优选为数均分子量为20000的聚乙二醇粉末。
本发明中,所述生物活性玻璃纳米颗粒按照以下方法制备得到:在tris-hcl缓冲溶液中,以十六烷基溴化氨为模板剂,加入钙源、磷源和硅源反应,得到生物活性玻璃纳米颗粒。其中,所述反应的温度为50~70℃,更优选为60~65℃;所述反应的时间优选为20~30小时,更优选为24~26小时。本发明中,反应完毕后还优选在500~600℃条件对反应产物煅烧出去ctba,得到,生物活性玻璃纳米颗粒。
按照本发明,本发明还将胶原溶液滴到步骤1)制备得到的生物活性玻璃纳米颗粒强化的丝素蛋白多孔支架上进行自组装,得到促进成骨的仿生支架,其中,所述自组装的温度为35~40℃,优选我37~38℃;所述自组长的时间为30~50min。
本发明中,所述胶原蛋白溶液按照以下方法制备得到:
将i型胶原溶解于0.05~0.2m乙酸溶液中得到含胶原的溶液,随后用十倍浓度的磷酸盐缓冲液稀释含胶原蛋白的溶液,然后,逐滴添加naoh水溶液调节ph至7.0,得到胶原溶液。其中,所述乙酸溶液的浓度优选为0.1~0.15m;其中,本发明对i型胶原的来源没有特殊要求,可以购买也可以自制。
更具体的,本发明所述的仿生支架的构建过程如图1所示,图1为本发明提供的仿生支架的构建图,其中,(a)微纳米等级结构仿生支架构建过程示意图;(b)i型胶原分子水平自组装过程示意图;(c)微支架与微纳米支架再生模式示意图比较。
本发明提供了一种促进成骨的仿生支架,通过将胶原蛋白自组装在生物活性玻璃纳米颗粒强化的丝素蛋白多孔支架上得到;其中,通过采用生物玻璃纳米可以丝素蛋白微孔支架,并自组装纳米胶原网络的协调,建立了用层次结构加强的骨因子-干细胞-释放支架,且通过实验发现,本申请得到的仿生支架不仅具有很好的力学性能,且稳定性好,而且本申请得到的仿生支架能够更好地促进干细胞的成骨。
下面将结合本发明实施例的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
实施例1
(1)丝素蛋白溶液与介孔生物活性玻璃纳米颗粒的制备。
在na2co3水溶液(0.5%w/w)中煮沸生丝1小时,反复8次彻底清洗煮沸后的生丝,使其充分脱去丝胶,所得到的脱胶丝在60℃下干燥,随后使用9.3mlibr溶液在60℃油浴加热的条件加入脱胶丝并磁力搅拌4小时,使其溶解。将所得溶液装入透析袋,并置于去离子水中透析,透析用水每天更换两次,持续透析4天。最后,通过对聚乙二醇粉末(分子量20,000)对透析后的丝素溶液进行脱水,使其浓缩纯化,最终获得具有6%w/w浓度的丝素蛋白溶液用于进一步实验。
生物活性玻璃纳米颗粒的制备反应在tris-hcl缓冲溶液(ph8.0)中进行,使用ctab(十六烷基三甲基溴化铵)作为模板剂。分别加入钙原、磷原及硅原,60℃下反应24小时,将得到的纳米颗粒分别用乙醇和去离子水洗涤3次,然后在500℃下煅烧以除去ctab,得到生物活性玻璃纳米颗粒,通过检测得知,其生物活性玻璃纳米颗粒直径为200~300nm(纳米级)。
(2)微米级支架的制备。
通过冻干制备生物活性玻璃纳米颗粒(mbg)强化的丝素蛋白(sf)支架。在6%(w/w)sf溶液中加入mbg(sf和mbg的质量比:20∶1)与甘油(sf和甘油的质量比:80∶20),所得溶液在室温下水浴超声1小时随后将溶液置于模具中,将模具迅速置于-80℃环境中预冻,随后冷冻干燥48小时得到mbg强化的sf多孔支架。
通过检测得知,生物活性玻璃纳米颗粒强化的丝素蛋白支架孔径为72.2±5.5μm(微米级)。
(3)微纳米等级结构的构建。
微米-纳米等级结构的制备以上一步获得的mbg强化的sf多孔支架为微米级基础。将来自大鼠尾巴的i型胶原(coli)溶解于0.1m乙酸溶液中,随后,胶原的自组装在冰浴中进行,首先用十倍浓度的磷酸盐缓冲液(pbs,10x)以6∶1的比例稀释胶原蛋白溶液,(其中,溶液中胶原蛋白纳米纤维直径为200~300nm(纳米级)。然后,逐滴添加0.5m的naoh水溶液以将ph调节至7.0,然后将25μl中和后的胶原溶液滴到直径6mm、高度1mm的圆柱形多孔支架上,并确保胶原溶液渗入多孔支架孔隙中,随后将支架在37℃下孵育30分钟以完成自组装过程,将所得支架用去离子水洗涤三次得到微纳米等级结构仿生支架。
对得到的仿生支架的形态和结构进行表征,结果见图2~图3:
图2为仿生支架的形态和组成结构示意图,其中,(a)为各种支架的扫描电子显微镜(sem)图像;(b)为添加mbg前后的傅里叶红外变光光谱图(ftir);(c)以coli添加前后及纯胶原对照的ftir光谱图;从扫描电子显微镜观察表面形貌,可见生物活性玻璃纳米颗粒(mbg)和纳米纤维胶原蛋白成功整合于丝素蛋白支架中,ftir也验证了支架经过冲洗后,mbg和胶原蛋白仍稳定整合在支架中。
图3为得到的仿生支架的结构示意图、丝素蛋白,胶原纤维和生物玻璃颗粒之间相互作用的放大图示以及相应的sem视图;其中,(a)分层支架的示意图,(b)丝素蛋白,胶原纤维和生物玻璃颗粒之间相互作用的放大图示,(c)相应的sem视图。
在对对仿生支架的理化性质进行了充分表征后,还对骨髓间充质干细胞(bmscs)与支架共培养的生物学反应进行了研究,揭示了其潜在的机制,采用sd大鼠临界尺寸骨缺损模型,采用放射学和组织学方法研究生物支架的再生模式,探讨骨缺损的重建细节,具体见图4~图9:
图4支架力学性能和促矿化能力表征图,其中,(a)为组装的胶原纳米纤维的tem图像;(b)为自组装胶原水凝胶的流变学性能表征;(c)为单轴压缩试验下支架的应力-应变曲线及其压缩模量;(d)为微纳米支架与微米级支架的流变学性能;(e)为在sbf中矿化不同时间后支架的sem图像。(f)为sbf中钙、磷离子浓度检测结果;(g)为矿化前后支架的xrd图像;从图中可以看出,支架经过mbg和胶原蛋白的添加,力学性能上得到了大幅改进(四倍),且材料促进矿化的能力显著增强。
图5为仿生支架的细胞粘附和增殖测定结果;其中,(a)为粘附在支架上的bmscs的sem图像(由白色三角形表示);(b)为在支架上共培养1,3,5,7天后bmscs的增殖结果;(c)为sbf中硅离子的释放结果;(d)为茜素红染色14天和21天的结果;(e)为第7天和第14天的alp染色结果;(f)为各自的定量,从图5的检测结果可以看出,仿生支架可显著促进间充质干细胞的成骨分化。
图6为仿生支架的粘附模式和整合素表达的表征,其中,(a)为使用激光共聚焦显微镜(clsm)观察,bmscs与支架共培养3天后,观察细胞骨架(phalloidin红色)和细胞核(dapi蓝色)形态结果图。(b)为bmscs在支架上的粘附模式的示意图;(c)为于普通培养基中将bmscs在支架上培养24小时后β-整合素的免疫荧光染色(clsm)结果;(d)为不同支架上的细胞铺展区域的定量结果;(e)为β-整合素的westernblot检测及其半定量;从图中可以看出,细胞在微纳米等级结构仿生支架表面呈现出更好的铺展状态,铺展面积显著大于微米级多孔支架,且细胞对整合素的表达显著增高,提示细胞在仿生结构下状态更好。
图7微纳米等级仿生结构促成骨的机制研究结果;通过在正常培养基中与支架共培养7天后,使用clsm观察bmscs中的(a)黏着斑蛋白(vinculin)和(b)yap(yes-associatedprotein)的免疫荧光染色;(c)vinculin和yap的westernblot及其半定量分析(d)成骨培养基中共培养7天后,bmscs中runx2和骨钙素(ocn)的westernblot检测及其在的半定量;从图中可以看出,在微纳米等级结构仿生支架表面培养的细胞,相对于微米级支架的细胞,更多地表达vinculin和yap两种蛋白,即,仿生支架可通过微纳米等级结构以及其较高的力学性能促进两种蛋白的表达增多;通过对runx2和ocn两种成骨标志进行westernblot检测,可得出仿生支架相对于微米级支架可以更好地促进干细胞成骨。
图8为实施例得到的仿生支架在体内的性能评估结果;其中,(a)为临界骨缺损模型的制备和支架植入的照片;(b)为术后8、12周缺损区骨形态学三维分析结果;(c)为不同支架填充的缺损区域的三维重建图像;从图中可以看出,microct显示微纳米等级结构仿生支架在术后8周和12周均得到了良好的愈合效果,显著优于其他微米级支架。
图9为骨缺损模型的组织学分析结果;其中,(a)为手术后4周和12周在高倍和低倍镜下对缺损区域进行h&e染色结果;(b)为术后4周和12周缺损区的马松三色染色结果;(c)为术后4、12周缺损区i型胶原免疫组化染色结果;从图中可以看出,病理学检测显示:微纳米等级结构仿生支架在术后4周可更好地促进骨组织长入,在术后12周的愈合效果显著优于其他微米级多孔支架组。
以上实施例的说明只是用于帮助理解本发明的方法及其核心思想。应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以对本发明进行若干改进和修饰,这些改进和修饰也落入本发明权利要求的保护范围内。
- 还没有人留言评论。精彩留言会获得点赞!