非IGF1R结合型的物质在预防和/或治疗炎症性疾病中的应用的制作方法
非igf1r结合型的物质在预防和/或治疗炎症性疾病中的应用
技术领域
1.本发明涉及生物医药领域,具体地,涉及非igf1r结合型的物质在预防和/ 或治疗炎症性疾病中的应用。
背景技术:
2.胰岛素样生长因子2(insulin like growth factor2,igf2)属于胰岛素样生长因子家族,与其他家族共同参与调控细胞增殖、分化、代谢、衰老和死亡,影响生物体的发育,生长,健康与疾病
1,2
。igf2受体包括igf1r、igf2r,其中与igf2r具有最高亲和力,其次可以与igf1r结合,几乎不与胰岛素受体结合2。
3.目前研究认为,igf2的主要生物学功能是依赖于激活igf1r的酪氨酸激酶开启的,而与igf2r和ir没有正向关联性2。
4.约90%的igf2r分布于细胞内的高尔基体,剩余10%的igf2r分布于细胞外膜3。igf2r不是igf2的唯一受体,igf2也不是igf2r的唯一配体,其配体还包括甘露糖-6-磷酸,在现有报道中,igf2r的主要功能是将其配体转运至溶酶体,完成蛋白质加工或者降解4。此外,有研究发现,细胞膜上的igf2r可以被剪切下来以一种可溶的形式,进入血液以及其他液体环境,有效结合igf2,抑制igf2发挥功能
4,5
。
5.自身免疫性疾病是免疫系统异常攻击自身器官和组织细胞所产生的疾病,美国卫生与人类服务部公布的数据显示,目前有2400万美国人——达到7%的美国人口承受着超过八十种的自身免疫性疾病的折磨,几乎涉及到身体的各个部分
6,7
。多数自身免疫性疾病的致病因素尚不清楚,可能与遗传,感染,药物和环境等因素有关,病程较长,出现反复的缓解和发作,发病患者中女性多于男性。多数自身免疫性疾病涉及到了单核细胞和巨噬细胞的参与。
6.在多种自身免疫性疾病中,活化的巨噬细胞分泌乳脂肪球-表皮生长因子8 (milk fat globule-epidermal growth factor 8,mfg-e8),mfg-e8的c端的结构域和凋亡细胞的磷脂酰丝氨酸结合,介导巨噬细胞对凋亡细胞的吞噬,清除自身免疫性疾病中受攻击而凋亡的细胞和死亡的免疫细胞碎片,帮助机体恢复稳态8。一些炎症因子如脂多糖,会抑制巨噬细胞表达mfg-e8,抑制凋亡碎片清除而加重炎症反应9。相反的,mfg-e8介导的巨噬细胞吞噬凋亡碎片的事件,又可以抑制脂多糖等炎症因子对巨噬细胞的促进炎症的作用,包括对 p38,erk1/2,c-jnk,mapk以及p65的抑制
10
。
7.炎症是机体对于自身的以及外来的致炎因子产生的防御反应,致炎因子包括生物性因子,物理性因子,化学性因子,异物,坏死组织,变态反应和病理变化,炎症反应受到致炎因子和机体自身的调节
11
。在炎症性疾病中既有天然免疫的参与,又有适应性免疫的参与,在炎症产生的早期,天然免疫率先到组织损伤部位,影响和决定了后期天然免疫和适应性免疫的反应类型
12
。当炎症调节出现紊乱或障碍时,即发生炎症性疾病,失去抵抗刺激和病原体的能力,加速加重疾病病情。按照炎症反应速度,炎症反应包含了急性和慢性的炎症反应。
8.目前治疗炎症性疾病和自身免疫性疾病的药物有两大类:第一类是甾体抗炎药,即类固醇类药物,如肾上腺皮质激素、雄性激素、雌性激素,具有一定的抗炎作用,长期使用将引起内分泌紊乱等多系统功能障碍
13-15
。第二类是非甾体抗炎药包括阿司匹林、对乙酰氨基酚、吲哚美辛、萘普生、萘普酮、双氯芬酸、布洛芬、尼美舒利、罗非昔布、塞来昔布等,在临床上广泛用于骨关节炎、类风湿性关节炎等抗炎治疗
14-16
。非甾体抗炎药作用原理单一,主要通过抑制前列腺素的合成,减少缓激肽的形成,减少白细胞和血小板的聚集和凝集来发挥抗炎作用
17
。因此,固醇类药物受限于副作用,非固醇类药物则受限于作用通路单一,联合用药增敏效果不佳。
9.因此,本领域迫切需要开发一种能更有效治疗自身免疫性疾病和/或炎症性疾病的药物。
技术实现要素:
10.本发明的目的在于提供一种能更有效治疗自身免疫性疾病和/或炎症性疾病的药物。
11.本发明第一方面提供了一种非igf1r结合型的物质的用途,用于制备组合物或制剂,所述组合物或制剂用于预防和/或治疗炎症性疾病。
12.在另一优选例中,所述非igf1r结合型的物质选自下组:igf2突变体、表达 igf2突变体的载体、抗体、小分子化合物、或其组合。
13.在另一优选例中,所述炎症性疾病选自下组:腹膜炎、炎症性肠病、多发性硬化、糖尿病、系统性红斑狼疮、硬皮病、桥本甲状腺炎、自身免疫性肝炎、自身免疫葡萄膜炎、间质性肺病、银屑病、白癜风、皮肌炎、川崎病、成人耳氏病、强制性脊柱炎、类肉状瘤病、起止点炎相关的关节炎、多关节青少年特发性关节炎、类风湿性关节炎、移植物抗宿主病、自身免疫性胰腺炎、帕金森病、老年痴呆、或其组合。
14.在另一优选例中,所述非igf1r结合型的物质包括对igf2r的选择性或亲和力高于igf1r的物质,以及可以高效激活igf2r的不激活igf1r的物质(如视黄酸等非igf1r配体)。
15.在另一优选例中,所述表达igf2突变体的载体包括病毒载体。
16.在另一优选例中,所述病毒载体选自下组:腺病毒载体、慢病毒载体、或其组合。
17.在另一优选例中,所述非igf1r结合型的物质还包括选自下组的一种或多种物质:血纤维蛋白溶酶原(plasminogen)、丝甘蛋白聚糖(serglycin)、e1a刺激基因的细胞抑制因子(cellular repressor of e1a-stimulated genes,creg)、硫酸胺酶(sulfamidase,sgsh)、磷酸化的β-葡萄糖醛酸酶(phosphorylated β-glucuronidase,gusb)等igf2r有效抑炎配体。
18.在另一优选例中,所述igf2突变体在野生型igf2蛋白的对应于seq id no.:1 的第27位的酪氨酸发生突变。
19.在另一优选例中,所述第27位的酪氨酸突变为选自下组的一种或多种氨基酸:亮氨酸、异亮氨酸、缬氨酸、甲硫氨酸、丙氨酸、苯丙氨酸、丝氨酸、脯氨酸、苏氨酸、组氨酸、赖氨酸、色氨酸、精氨酸、谷氨酸、甘氨酸、天冬氨酸、半胱氨酸。
20.在另一优选例中,所述第27位的酪氨酸突变为亮氨酸。
21.在另一优选例中,所述igf2突变体在野生型igf2蛋白的对应于seq id no.:1 的
第12位的谷氨酸发生突变,并任选的删除d-domain(seq id no.:1的第62位苏氨酸至第67位谷氨酸)。
22.在另一优选例中,所述第12位的谷氨酸突变为选自下组的一种或多种氨基酸:
23.asp、ala、gln、his、arg、lys。
24.在另一优选例中,所述igf2突变体在野生型igf2蛋白的对应于seq id no.:1 的第26位的苯丙氨酸发生突变,并任选的删除d-domain(seq id no.:1的62位苏氨酸至67位谷氨酸)。
25.在另一优选例中,所述第26位的苯丙氨酸突变为选自下组的一种或多种氨基酸:ser、asp、ala、gln、his、arg、lys。
26.在另一优选例中,所述第26位的苯丙氨酸突变为丝氨酸。
27.在另一优选例中,所述igf2突变体在野生型igf2蛋白的对应于seq id no.:1 的第27位的酪氨酸发生突变,并任选的删除d-domain(seq id no.:1的62位苏氨酸至67位谷氨酸)。
28.在另一优选例中,所述第27位的酪氨酸突变为选自下组的一种或多种氨基酸: leu、asp、ala、gln、his、arg、lys。
29.在另一优选例中,所述第27位的酪氨酸突变为亮氨酸。
30.在另一优选例中,所述igf2突变体在野生型igf2蛋白的对应于seq id no.:1 的第43位的缬氨酸发生突变,并任选的删除d-domain(seq id no.:1的62位苏氨酸至67位谷氨酸)。
31.在另一优选例中,所述第43位的缬氨酸突变为选自下组的一种或多种氨基酸: leu、asp、ala、gln、his、arg、lys。
32.在另一优选例中,所述第43位的缬氨酸突变为亮氨酸。
33.在另一优选例中,所述第27位的酪氨酸突变为选自下组的一种或多种氨基酸: leu、asp、ala、gln、his、arg、lys,且同时将43位的缬氨酸突变为选自下组的一种或多种氨基酸:leu、asp、ala、gln、his、arg、lys。
34.在另一优选例中,所述第27位的酪氨酸和第43位的缬氨酸同时突变为亮氨酸。
35.在另一优选例中,所述第27位的酪氨酸和第43位的缬氨酸同时突变为亮氨酸,并任选的删除d-domain(seq id no.:1的62位苏氨酸至67位谷氨酸)。
36.在另一优选例中,所述igf2突变体的氨基酸序列如seq id no.:2-58中任一所示。
37.在另一优选例中,所述的igf2突变体为具有seq id no.:2-58任一所示氨基酸序列的多肽、其活性片段、或其保守性变异多肽。
38.在另一优选例中,所述的igf2突变体除所述突变(如12位glu,26位phe, 27位tyr,43位val以及对应删除d-domain的突变序列)外,其余的氨基酸序列与seq id no.:1所示的序列相同或基本相同。
39.在另一优选例中,所述第12位的谷氨酸突变为谷氨酰胺。
40.在另一优选例中,所述的基本相同是至多有50个(较佳地为1-20个,更佳地为1-10个、更佳地1-5个)氨基酸不相同,其中,所述的不相同包括氨基酸的取代、缺失或添加(如第62位t至第67位e的缺失),且所述的igf2突变体具有抑制炎症的活性。
41.在另一优选例中,与seq id no.:1所示序列的同源性至少为80%,较佳地至少为
85%或90%,更佳地至少为95%,最佳地至少为98%或99%。
42.在另一优选例中,所述igf2蛋白来源于人或非人哺乳动物。
43.在另一优选例中,所述igf2突变体选自下组:
44.(a)具有seq id no.:2-58任一所示氨基酸序列的多肽;
45.(b)将seq id no.:2-58任一所示氨基酸序列经过一个或多个(如2个、3个、 4个或5个)氨基酸残基的取代、缺失或添加而形成的,且具有抑制炎症活性的由 (a)衍生的多肽。
46.在另一优选例中,所述的衍生的多肽与seq id no.:2-58任一所示序列的同源性至少为60%,较佳地至少为70%,更佳地至少为80%,最佳地至少为90%,如 95%、97%、99%。
47.在另一优选例中,所述igf2突变体为seq id no.:1所示的野生型的igf2蛋白经突变形成的。
48.在另一优选例中,所述组合物或制剂还用于选自下组的一种或多种用途:
49.(i)减少结肠中致病单个核细胞浸润;
50.(ii)抑制巨噬细胞的致病表型;
51.(iii)降低巨噬细胞浸润数目;
52.(iv)赋予巨噬细胞显著抑制炎症的免疫记忆;
53.(v)预防和/或治疗自身免疫性疾病;
54.(vi)用于巨噬细胞参与的多种其他涉及炎症反应的疾病(如与肝纤维化、肾纤维化、肺纤维化等疾病的发生有关的炎症反应,与组织、器官或细胞移植引起的炎症反应,与肺癌、乳腺癌、前列腺癌、肝癌、胰腺癌、黑色素瘤、淋巴瘤等癌症的发生和转移相关的炎症反应,以及与自身免疫性疾病相关的炎症反应);
55.(vii)促进移植组织或细胞的植入。
56.在另一优选例中,所述自身免疫性疾病选自下组:多发性硬化、炎症性肠病、自身免疫性肝炎、系统性红斑狼疮、类风湿性关节炎、胰岛素抵抗、糖尿病、自身免疫性肝炎、白癜风、银屑病、腹膜炎、硬皮病、桥本甲状腺炎、移植物抗宿主病、皮肌炎、川崎病、成人耳氏病、强制性脊柱炎、类肉状瘤病、起止点炎相关的关节炎、多关节青少年特发性关节炎、自身免疫性胰腺炎、以及部分未明确定义的自身免疫性疾病、或其组合。
57.在另一优选例中,组合物包括药物组合物。
58.在另一优选例中,所述组合物包含(a)非igf1r结合型的物质;和(b)药学上可接受的载体。
59.在另一优选例中,所述组合物中含有0.001-99wt%,较佳地0.1-90wt%,更佳地1-80wt%的非igf1r结合型的物质,按组合物的总重量计。
60.在另一优选例中,所述的组合物为液态制剂或冻干制剂。
61.在另一优选例中,所述的组合物为注射剂。
62.本发明第二方面提供了一种细胞制剂,包括:
63.经过非igf1r结合型的物质处理的巨噬细胞。
64.在另一优选例中,所述非igf1r结合型的物质选自下组:igf2、igf2突变体、表达igf2突变体的载体、抗体、小分子化合物、或其组合。
65.在另一优选例中,所述非igf1r结合型的物质还包括选自下组的一种或多种物质:
血纤维蛋白溶酶原(plasminogen)、丝甘蛋白聚糖(serglycin)、e1a刺激基因的细胞抑制因子(cellular repressor of e1a-stimulated genes,creg)、硫酸胺酶(sulfamidase,sgsh)、磷酸化的β-葡萄糖醛酸酶(phosphorylated β-glucuronidase,gusb)等igf2r有效抑炎配体。
66.在另一优选例中,所述细胞制剂还包括非igf1r结合型的物质。
67.在另一优选例中,所述巨噬细胞具有选自下组的特征:
68.(a)igf1r未激活,igf2r激活;和/或
69.(b)巨噬细胞以氧化磷酸化为主要获能方式;和/或
70.(c)具备选自下组的一个或多个特征:
71.·
低表达il-1β;
72.·
低表达tnfα;
73.·
低表达cxcl10;
74.·
高表达ccl22;
75.·
高表达clec7a;
76.·
高表达pd-l1;
77.·
高表达pd-l2;
78.·
高表达il-10;
79.·
高表达tgfβ。
80.在另一优选例中,所述巨噬细胞来源于骨髓、腹腔、外周血、炎症发生部位、或其组合。
81.在另一优选例中,所述细胞制剂包括液体制剂。
82.在另一优选例中,所述的细胞制剂中的细胞基本上(≥90%、95%、96%、97 %、98%、99%、99.5%、99.9%)或全部由(a)经过非igf1r结合型的物质预处理的巨噬细胞和(b)任选的非igf1r结合型的物质构成。
83.在另一优选例中,所述的组合物中,所述巨噬细胞的浓度1
×
104-5
×
107/ml,较佳地5
×
104-5
×
106/ml,更佳地1
×
105-1
×
106/ml。
84.在另一优选例中,所述的载体选自下组:输液剂载体和/或注射剂载体,较佳地,所述的载体是选自下组的一种或多种载体:生理盐水、葡萄糖盐水、或其组合。
85.在另一优选例中,所述细胞制剂还包括其他预防和/或治疗炎症性疾病的药物。
86.在另一优选例中,所述其他预防和/或治疗炎症性疾病的药物选自下组:非甾体抗炎药、糖皮质激素、甲氨蝶呤、tnfα中和抗体、tnfr1抗体、tnfr2抗体、抗cd20抗体、il-1r拮抗剂、il-12和il-23p40中和抗体、il-23p19中和抗体、 il-17中和抗体、il-17a受体中和抗体、或其组合。
87.在另一优选例中,所述其他的预防和/或治疗自身免疫性疾病的药物选自下组:非甾体抗炎药、糖皮质激素、甲氨蝶呤、tnfα中和抗体、tnfr1抗体、tnfr2抗体、抗cd20抗体、il-1r拮抗剂、il-12和il-23p40中和抗体、il-23p19中和抗体、il-17中和抗体、il-17a受体中和抗体、ctla-4融合蛋白、或其组合。
88.本发明第三方面提供了一种药盒,包括:
89.(i)第一容器,以及装于该第一容器中的活性成分(a)经过非igf1r结合型的物质
处理的巨噬细胞,或含有活性成分(a)的药物;
90.(ii)任选的第二容器,以及装于该第二容器中的活性成分(b)非igf1r结合型的物质,或含有活性成分(b)的药物;和
91.(iii)说明书,所述说明书中记载了联合给予活性成分(a)和活性成分(b)从而预防和/或治疗炎症性疾病的说明。
92.在另一优选例中,所述药盒还包括:
93.(iv)第三容器,以及装于该第三容器中的活性成分(c)其他预防和/或治疗炎症性疾病的药物,或含有活性成分(c)的药物。
94.在另一优选例中,所述药盒还包括:
95.(v)第四容器,以及装于该第四容器中的活性成分(d)其他预防和/或治疗自身免疫性疾病的药物,或含其他预防和/或治疗自身免疫性疾病的药物的药物。
96.在另一优选例中,所述第一容器、第二容器、任选的第三容器、任选的第四容器可以相同,可以不同。
97.在另一优选例中,所述的第一容器的药物是含经过非igf1r结合型的物质处理的巨噬细胞的单方制剂。
98.在另一优选例中,所述的第二容器的药物是含非igf1r结合型的物质的单方制剂。
99.在另一优选例中,所述的第三容器是含其他预防和/或治疗炎症性疾病的药物的单方制剂。
100.在另一优选例中,所述第四容器是含其他预防和/或治疗自身免疫性疾病的药物的单方制剂。
101.在另一优选例中,所述药物的剂型为注射剂型。
102.在另一优选例中,所述试剂盒还含有说明书,所述说明书中记载了联合给予活性成分(a)、活性成分(b)、任选的(c)和任选的(d)从而(i)预防和/或治疗炎症性疾病;和/或(ii)预防和/或治疗自身免疫性疾病的说明。
103.在另一优选例中,所述含有(b)非igf1r结合型的物质的制剂中,所述非 igf1r结合型的物质的浓度为0.01μg-1mg/kg体重,较佳地0.1-10μg/kg 体重,更佳地0.5-5μg/kg体重。
104.在另一优选例中,所述含有(a)经过非igf1r结合型的物质处理的巨噬细胞的制剂中,所述巨噬细胞的浓度为0.2*10
4-1*108个/kg体重,较佳地1*10
5-5*107个/kg体重,更佳地1*10
6-5*106个/kg体重。
105.在另一优选例中,所述含有(c)其他预防和/或治疗炎症性疾病的药物的制剂中,所述其他预防和/或治疗炎症性疾病的药物的浓度为0.0002-40mg/kg体重,较佳地0.001-30mg/kg体重,更佳地0.02-25mg/kg体重。
106.在另一优选例中,所述含有(d)其他预防和/或治疗自身免疫性疾病的药物的制剂中,所述其他预防和/或治疗自身免疫性疾病的药物的浓度为 0.0002-0.1mg/kg体重,较佳地0.001-0.08mg/kg体重,更佳地 0.002-0.01mg/kg体重。
107.本发明第四方面提供了一种筛药方法,包括步骤:
108.(a)测试组中,在细胞的培养体系中添加测试物质,并观察所述测试组的细胞中所述测试物质与igf1r和/或igf2r的结合活性;在对照组中,在相同细胞的培养体系中不添加
测试物质;
109.其中,如果测试组的细胞中所述测试物质与igf1r的结合活性降低;并且与igf2r的结合活性不变或升高,则表明,所述测试物质为非igf1r结合型的 igf2突变型。
110.在另一优选例中,所述方法还包括步骤:
111.(b)对于步骤(a)所获得的非igf1r结合型的igf2突变型,进一步测定其对igfbp蛋白的结合活性;和/或进一步测试其对igfbp蛋白的结合保持不变还是略有增加。
112.在另一优选例中,所述方法还包括步骤:
113.(c)引入一个阳性对照,所述阳性对照为igf2蛋白或igf2突变体,将其对igf1r和/或igf2r的结合活性与步骤(a)所获得的非igf1r结合型的igf2突变型对igf1r和/或igf2r的结合活性进行比较。
114.在另一优选例中,步骤(a)所获得的非igf1r结合型的igf2突变型对igf1r 和/或igf2r的结合活性与所述阳性对照对igf1r和/或igf2r的结合活性相当。
115.本发明第五方面提供了一种筛药方法,包括:
116.(a)测试组中,在细胞的培养体系中添加测试物质,并观察所述测试组的细胞中所述测试物质对igf2与igf1r和/或igf2r的结合活性的影响;在对照组中,在相同细胞的培养体系中不添加测试物质;
117.其中,如果测试组的细胞中所述测试物质抑制igf2与igf1r的结合活性;并且对igf2与igf2r的结合活性无影响或有促进作用,则表明,所述测试物质为非igf1r结合型的物质。
118.在另一优选例中,所述非igf1r结合型的物质选自下组:抗体、小分子化合物、或其组合。
119.在另一优选例中,所述方法还包括步骤:
120.(b)对于步骤(a)所获得的非igf1r结合型的物质,进一步测定其对igfbp 蛋白的结合活性;和/或进一步测试其对igfbp蛋白的结合保持不变还是略有增加。
121.在另一优选例中,所述方法还包括步骤:
122.(c)引入一个阳性对照,所述阳性对照为igf2蛋白或igf2突变体,将其对igf1r和/或igf2r的结合活性与步骤(a)所获得的非igf1r结合型的物质对 igf1r和/或igf2r的结合活性进行比较。
123.在另一优选例中,步骤(a)所获得的非igf1r结合型的物质对igf1r和/或 igf2r的结合活性与所述阳性对照对igf1r和/或igf2r的结合活性相当。
124.本发明第六方面提供了一种体外获得促炎样本和抑炎样本的方法,包括:
125.在第一组实验中,用低剂量的igf2进行处理,获得抑炎样本;和
126.在第二组实验中,用高剂量的igf2进行处理,获得促炎样本。
127.在另一优选例中,所述促炎样本中,进一步测定igf2对igf2r的结合活性。
128.在另一优选例中,所述抑炎样本中,进一步测定igf2对igf2r的结合活性。
129.本发明第七方面提供了一种组合物,包括:
130.(a)由本发明第四方面所述的方法获得的非igf1r结合型的igf2突变型;其中所述非igf1r结合型的igf2突变型不包括选自下组的igf2突变型:野生型igf2、野生型igf2第25~91位氨基酸片段、12位谷氨酸突变为asp、ala、gln、his、 arg、或lys的igf2突变型、26位
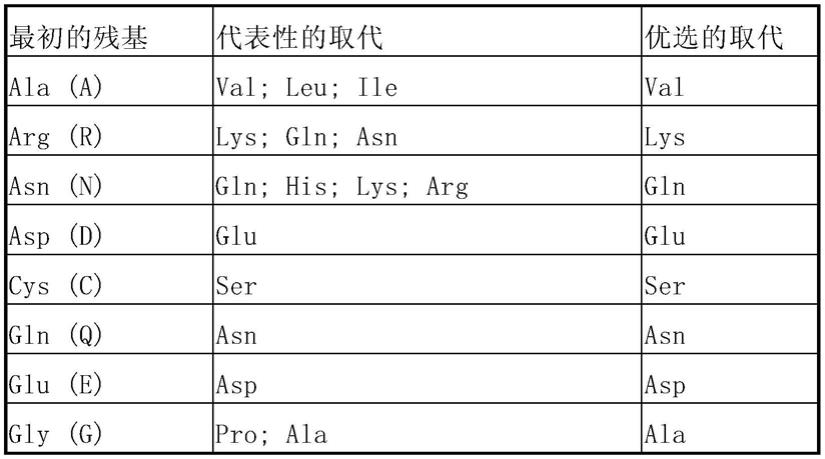
苯丙氨酸突变为ser的igf2突变型、27位酪氨酸突变为leu的igf2突变型、43位缬氨酸突变为leu的igf2突变型、删除d-domain 的igf2突变型、或其组合。
131.在另一优选例中,所述非igf1r结合型的igf2突变型不包括seq id no.:1-2、 16、18、20、22、24、26、28、43中任一所示的igf2突变型。
132.在另一优选例中,所述非igf1r结合型的igf2突变型的氨基酸序列如seq id no.:3-15、17、19、21、23、25、27、29-42、44-58中任一所示。
133.本发明第八方面提供了一种抑制炎症活性的方法,包括步骤:
134.在非igf1r结合型的物质存在下,培养巨噬细胞,从而抑制炎症活性。
135.在另一优选例中,所述非igf1r结合型的物质的施用浓度为0.0000005-0.0005 mg/ml,较佳地,0.000001-0.0001mg/ml,更佳地,0.000005-0.00005mg/ml。
136.本发明第九方面提供了一种预防和/或治疗炎症性疾病的方法,包括:
137.(a)给需要的对象施用本发明第二方面所述的细胞制剂或本发明第三方面所述的药盒或本发明第七方面所述的组合物。
138.在另一优选例中,所述的对象包括非人哺乳动物和人。
139.在另一优选例中,所述非igf1r结合型的物质的施用剂量为0.01μg-1mg/kg 体重,较佳地0.1-10μg/kg体重,更佳地0.5-5μg/kg体重。
140.在另一优选例中,所述非igf1r结合型的物质的施用频率为1次/天-2次/天。
141.在另一优选例中,所述的施用包括同时施用或先后施用。
142.本发明第十方面提供了一种预防和/或治疗自身免疫性疾病的方法,包括:
143.(a)给需要的对象施用本发明第二方面所述的细胞制剂或本发明第三方面所述的药盒或本发明第七方面所述的组合物。
144.在另一优选例中,所述的对象包括非人哺乳动物和人。
145.在另一优选例中,所述非igf1r结合型的物质的施用剂量为0.01μg-1mg/kg 体重,较佳地0.1-10μg/kg体重,更佳地0.5-5μg/kg体重。
146.在另一优选例中,所述非igf1r结合型的物质的施用频率为1次/天-2次/天。
147.在另一优选例中,所述的施用包括同时施用或先后施用。
148.本发明第十一方面提供了一种本发明第二方面所述的细胞制剂、本发明第三方面所述的药盒或本发明第七方面所述的组合物的用途,用于制备用于预防和/或治疗炎症性疾病的药物。
149.应理解,在本发明范围内中,本发明的上述各技术特征和在下文(如实施例)中具体描述的各技术特征之间都可以互相组合,从而构成新的或优选的技术方案。限于篇幅,在此不再一一累述。
附图说明
150.图1显示了低剂量igf2抑制腹膜炎。分别使用低剂量igf2(l-igf2,5-50 ng igf2每只小鼠)和高剂量igf2(h-igf2,1000ng igf2每只小鼠)处理腹膜炎小鼠。分离腹膜炎小鼠腹腔单核细胞和巨噬细胞并分析每只小鼠可以分离到的腹腔巨噬细胞的数目。实验重复三次,显著性差异由student’s t检验完成。*p<0.05;**p<0.01;***p<0.001。
151.图2显示了低剂量igf2改变了巨噬细胞能量代谢偏好和炎症因子表达趋势和潜
力。分别使用低剂量igf2(l-igf2,5-50ng igf2每只小鼠)和高剂量igf2(h-igf2,1000ng igf2每只小鼠)处理腹膜炎小鼠。分离腹膜炎小鼠腹腔单核细胞和巨噬细胞并分析。a-b,低剂量igf2增强巨噬细胞氧化磷酸化潜能,而高剂量igf2无效。c,低剂量igf2降低巨噬细胞乳酸产生量,对应较弱的有氧糖酵解代谢。d-f,低剂量igf2抑制促炎基因表达潜力,增加抗炎修复相关基因表达的潜力。实验重复三次,显著性差异由student’s t检验完成。*p<0.05;**p<0.01;***p<0.001。
152.图3显示了构建igf2r基因缺陷小鼠,以及igf1r或igf2r条件性敲除小鼠。a-c,利用crisper-cas9技术,通过造成2bp或者13bp基因缺失引起的移码突变,敲低igf2r基因表达(igf2r基因完全敲除,小鼠胚胎致死),利用基因测序技术鉴定子代小鼠,利用流式细胞术鉴定敲低效率。d-i,通过杂交igf1r
fl/fl
或者igf2r fl/fl
小鼠和lyz
cre
小鼠,获得特异性敲除髓系淋巴细胞igf1r或者igf2r的小鼠。敲除效率根据pcr和流式分析鉴定。e,琼脂糖凝胶电泳结果,泳道1指示野生型小鼠(124bp),泳道2指示igf1r
fl/fl
(220 bp),泳道3无条带,指示igf1r
fl/fl
小鼠不具备lyz2
cre
活力,泳道4(320bp) 指示igf1r
fl/fl
小鼠具备lyz2
cre
活力。h,泳道1指示野生型小鼠(2000bp),泳道2指示igf2r
fl/fl
小鼠,不具备lyz2
cre
活力(2200bp)。
153.图4显示了低剂量igf2抑制葡聚糖硫酸钠(dextran sulfate sodium salt, dss)诱导的炎症性肠病。通过饲饮4%dss溶液诱导肠炎小鼠模型。a-e,低剂量igf2缓解dss诱导的炎症性肠病,表现为体重指数、生存时间、粪便评分和粪便出血评分以及结肠长度的明显改善。f-h,igf2用于治疗dss诱导结肠炎小鼠时,小鼠结肠组织的h&e染色、tunel和ki67免疫组织化学染色。实验重复三次,显著性差异由student’s t检验完成。*p<0.05;**p<0.01; ***p<0.001。
154.图5显示了低剂量igf2处理的巨噬细胞可以有效抑制炎症性肠病。通过饲饮4%dss溶液诱导炎症性肠病小鼠模型。a-b,低剂量或高剂量igf2诱导的腹腔巨噬细胞在dss诱导的炎症性肠病中的治疗作用,体重改变和生存曲线被记录。实验重复三次,显著性差异由student’s t检验完成。**p<0.01。
155.图6显示了低剂量igf2减少结肠中致病单个核细胞浸润。通过饲饮4%dss 溶液诱导炎症性肠病小鼠模型。a,低剂量igf2改善dss诱导的炎症性肠病,减少结肠组织中单个核细胞的浸润。b-c,通过比较白介素-1β阳性巨噬细胞比例,分析igf2对于炎症性肠病小鼠的结肠中浸润的巨噬细胞的炎性表型的影响。实验重复三次,显著性差异由student’s t检验完成。***p<0.001。
156.图7显示了igf2r执行低剂量igf2的抗炎任务。通过饲饮4%dss溶液诱导肠炎小鼠模型。a,体重指数评价低剂量igf2治疗dss在igf2r
fl/fl
lyz2
cre
小鼠和igf2r
fl/fl
小鼠中诱导的炎症性肠病。b,体重指数评价高剂量igf2治疗 dss在igf1r
fl/fl
lyz2
cre
小鼠和igf1r
fl/fl
小鼠中诱导的炎症性肠病。实验重复三次,显著性差异由student’s t检验完成。*p<0.05;***p<0.001。
157.图8显示了leu27-igf2靶向激活igf2r最优效抑制腹膜炎和炎症性肠病。分别使用低剂量igf2/leu27-igf2(50ng igf2/leu27-igf2每只小鼠)和高剂量igf2/leu27-igf2(1000ng,或者2000ng igf2/leu27-igf2每只小鼠) 处理腹膜炎小鼠。分离腹膜炎小鼠腹腔单核细胞和巨噬细胞并分析。a, leu27-igf2预编程的腹腔巨噬细胞的细胞质的相对ph。b-c,不同剂量igf2 和leu27-igf2预编程的腹腔巨噬细胞产生一氧化氮和乳酸的能力。通过
饲饮 4%dss诱导炎症性肠病小鼠模型。d,体重指数评价leu27-igf2对dss诱导的炎症性肠病的缓解作用。e,结肠长度评价leu27-igf2对dss诱导的炎症性肠病的缓解作用。f,野生型igf2和leu27-igf2缓解ftg诱导的腹膜炎和dss 诱导的炎症性肠病的有效阈值示意图。实验重复三次,显著性差异由 student’s t检验完成。**p<0.01;***p<0.001。ns,非著性差异。
具体实施方式
158.本发明人经过广泛而深入的研究,首次意外地发现,非igf1r结合型的物质可显著(a)预防和/或治疗炎症性疾病;和/或(b)预防和/或治疗自身免疫性疾病。在此基础上,本发明人完成了本发明。
159.如本文所用,野生型igf2、野生型igf2第25~91位氨基酸片段、12位谷氨酸突变为asp、ala、gln、his、arg、或lys的igf2突变型、26位苯丙氨酸突变为ser的igf2突变型、27位酪氨酸突变为leu的igf2突变型、43 位缬氨酸突变为leu的igf2突变型、删除d-domain的igf2突变型均为在seq id no.:1的基础上进行的氨基酸的截取、突变和/或删除。
160.igf2蛋白及其突变体
161.胰岛素样生长因子2(insulin like growth factor2,igf2)属于胰岛素样生长因子家族,与其他家族共同参与调控细胞增殖、分化、代谢、衰老和死亡,影响生物体的发育,生长,健康与疾病
1,2
。igf2受体包括igf1r、igf2r,其中与igf2r具有最高亲和力,其次可以与igf1r结合,几乎不与胰岛素受体结合2。
162.igf2与igf1在氨基酸序列上具有高度的同源性,存在62%的重叠序列,因此,igf2常常可以体现出igf1所能激活的生物学效应2。目前研究认为,igf2 的主要生物学功能是依赖于激活igf1r的酪氨酸激酶开启的,而与igf2r和ir 没有正向关联性。从进化的角度看,igf1r与ir具有基因的同源性,而且,igf1r 与ir下游激活的信号通路是十分相似的。然而igf2r的基因则与igf1r或者 ir基因的来源完全不同,因而,igf2r常常被认为具有与igf1r、ir相反的生物学功能,igf2r作为igf2的降解受体,通过内化降解igf2来抑制igf2对于 igf1r的激活作用。
163.约90%的igf2r分布于细胞内的高尔基体,剩余10%的igf2r分布于细胞外膜3。igf2r不是igf2的唯一受体,igf2也不是igf2r的唯一配体,其配体还包括甘露糖-6-磷酸,在现有报道中,igf2r的主要功能是将其配体转运至溶酶体,完成蛋白质加工或者降解4。此外,细胞膜上的igf2r可以被剪切下来以一种可溶的形式,进入血液以及其他液体环境,有效结合igf2,抑制igf2 发挥功能
4,5
。本发明的前期研究发现igf2可以抑制多发性硬化和溃疡性结肠炎等疾病的动物模型,但是其具体调控机制仍不清楚。
164.具体地,本发明涉及一种igf2蛋白及其变体,在本发明的一个优选例中,所述igf2蛋白的氨基酸序列如seq id no.:1所示。本发明的igf2蛋白或表达 igf2蛋白的载体可(a)预防和/或治疗炎症性疾病。
165.本发明的igf2蛋白或表达igf2蛋白的载体还可用于选自下组的一种或多种用途:
166.(i)减少结肠中致病单个核细胞浸润;
167.(ii)抑制巨噬细胞的致病表型;
168.(iii)降低巨噬细胞浸润数目;
169.(iv)赋予巨噬细胞显著抑制炎症的免疫记忆;
170.(v)预防和/或治疗自身免疫性疾病;
171.(vi)用于巨噬细胞参与的多种其他涉及炎症反应的疾病(如与肝纤维化、肾纤维化、肺纤维化等疾病的发生有关的炎症反应,与组织、器官或细胞移植引起的炎症反应,与肺癌、乳腺癌、前列腺癌、肝癌、胰腺癌、黑色素瘤、淋巴瘤等癌症的发生和转移相关的炎症反应,以及与自身免疫性疾病相关的炎症反应);
172.(vii)促进移植组织或细胞的植入。
173.本发明还包括与本发明的seq id no.:1所示序列具有50%或以上(优选60%以上,70%以上,80%以上,更优选90%以上,更优选95%以上,最优选98%以上,如 99%)同源性的具有相同或相似功能的多肽或蛋白。
174.其中,seq id no.:1为人源igf2蛋白 (ayrpsetlcggelvdtlqfvcgdrgfyfsrpasrvsrrsrgiveeccfrscdlalletycatpakse)。
175.所述“相同或相似功能”主要是指:“(a)预防和/或治疗炎症性疾病;和/ 或(i)减少结肠中致病单个核细胞浸润;和/或(ii)抑制巨噬细胞的致病表型;和/或(iii)降低巨噬细胞浸润数目;和/或(iv)赋予巨噬细胞显著抑制炎症的免疫记忆;和/或(v)预防和/或治疗自身免疫性疾病;和/或(vi)用于巨噬细胞参与的多种其他涉及炎症反应的疾病(如与肝纤维化、肾纤维化、肺纤维化等疾病的发生有关的炎症反应,与组织、器官或细胞移植引起的炎症反应,与肺癌、乳腺癌、前列腺癌、肝癌、胰腺癌、黑色素瘤、淋巴瘤等癌症的发生和转移相关的炎症反应,以及与自身免疫性疾病相关的炎症反应);和/或(vii)促进移植组织或细胞的植入”。
176.本发明的蛋白可以是重组蛋白、天然蛋白、合成蛋白。本发明的蛋白可以是天然纯化的产物,或是化学合成的产物,或使用重组技术从原核或真核宿主 (例如,细菌、酵母、高等植物、昆虫和哺乳动物细胞)中产生。根据重组生产方案所用的宿主,本发明的蛋白可以是糖基化的,或可以是非糖基化的。本发明的蛋白还可包括或不包括起始的甲硫氨酸残基。
177.本发明还包括具有igf2蛋白活性的igf2蛋白片段和类似物。如本文所用,术语“片段”和“类似物”是指基本上保持本发明的天然igf2蛋白相同的生物学功能或活性的蛋白。
178.在一优选实施方式中,本发明的igf2蛋白的突变体在野生型igf2蛋白的对应于seq id no.:1 (ayrpsetlcggelvdtlqfvcgdrgfyfsrpasrvsrrsrgiveeccfrscdlalletycatpakse) 的第27位的酪氨酸发生突变,并且本发明的igf2蛋白的突变体可显著(a)预防和 /或治疗炎症性疾病;和/或(b)预防和/或治疗自身免疫性疾病。
179.优选的,所述第27位的酪氨酸突变为亮氨酸。
180.在一优选实施方式中,所述的igf2突变体为具有seq id no.:2-58任一所示氨基酸序列的多肽、其活性片段、或其保守性变异多肽。
181.应理解,本发明突变体中的氨基酸编号基于seq id no.:1作出,当某一突变体与seq id no.:1所示序列的同源性达到80%或以上时,突变体的氨基酸编号可能会有相对于seq id no.:1)的氨基酸编号的错位,如向氨基酸的n 末端或c末端错位1-5位,而采用本领域常规的序列比对技术,本领域技术人员通常可以理解这样的错位是在合理范围内的,且不应当由于氨基酸编号的错位而使同源性达80%(如90%、95%、98%)的、具有相同或相似的可显著(a)预防和/或治疗炎症性疾病;和/或(i)减少结肠中致病单个核细胞浸润;和/或
(ii)抑制巨噬细胞的致病表型;和/或(iii)降低巨噬细胞浸润数目;和/或(iv)赋予巨噬细胞显著抑制炎症的免疫记忆;和/或(v)预防和/或治疗自身免疫性疾病;和/或(vi)用于巨噬细胞参与的多种其他涉及炎症反应的疾病(如与肝纤维化、肾纤维化、肺纤维化等疾病的发生有关的炎症反应,与组织、器官或细胞移植引起的炎症反应,与肺癌、乳腺癌、前列腺癌、肝癌、胰腺癌、黑色素瘤、淋巴瘤等癌症的发生和转移相关的炎症反应,以及与自身免疫性疾病相关的炎症反应);和/ 或(vii)促进移植组织或细胞的植入的活性不在本发明突变体的范围内。
182.本发明的突变蛋白片段、衍生物或类似物可以是(i)有一个或多个保守或非保守性氨基酸残基(优选保守性氨基酸残基)被取代的突变蛋白,而这样的取代的氨基酸残基可以是也可以不是由遗传密码编码的,或(ii)在一个或多个氨基酸残基中具有取代基团的突变蛋白,或(iii)成熟突变蛋白与另一个化合物 (比如延长突变蛋白半衰期的化合物,例如聚乙二醇)融合所形成的突变蛋白,或(iv)附加的氨基酸序列融合到此突变蛋白序列而形成的突变蛋白(如前导序列或分泌序列或用来纯化此突变蛋白的序列或蛋白原序列,或与抗原igg片段的形成的融合蛋白)。根据本文的教导,这些片段、衍生物和类似物属于本领域熟练技术人员公知的范围。本发明中,保守性替换的氨基酸最好根据表i进行氨基酸替换而产生。
183.表i
184.[0185][0186]
本发明还包括与本发明的天然igf2蛋白具有50%或以上(优选60%以上, 70%以上,80%以上,更优选90%以上,更优选95%以上,最优选98%以上,如 99%)同源性的具有相同或相似功能的多肽或蛋白。在蛋白质变体可以经过若干个(通常为1-60个,较佳地1-30个,更佳地1-20个,最佳地1-10个)取代、缺失或添加至少一个氨基酸所得的衍生序列,以及在c末端和/或n末端添加一个或数个(通常为20个以内,较佳地为10个以内,更佳地为5个以内)氨基酸。例如,在所述蛋白中,用性能相近或相似的氨基酸进行取代时,通常不会改变蛋白质的功能,在c末端和/或\末端添加一个或数个氨基酸通常也不会改变蛋白质的功能。本发明包括天然igf2蛋白类似物与天然igf2蛋白的差别可以是氨基酸序列上的差异,也可以是不影响序列的修饰形式上的差异,或者兼而有之。这些蛋白的类似物包括天然或诱导的遗传变异体。诱导变异体可以通过各种技术得到,如通过辐射或暴露于诱变剂而产生随机诱变,还可通过定点诱变法或其他已知分了生物学的技术。类似物还包括具有不同于天然l-氨基酸的残基(如d-氨基酸)的类似物,以及具有非天然存在的或合成的氨基酸(如β、γ-氨基酸)的类似物。应理解,本发明的蛋白并不限于上述例举的代表性蛋白。
[0187]
修饰(通常不改变一级结构)形式包括:体内或体外蛋白的化学衍生形式如乙酸化或羧基化。修饰还包括糖基化,如那些在蛋白质合成和加工中进行糖基化修饰。这种修饰可以通过将蛋白暴露于进行糖基化的酶(如哺乳动物的糖基化酶或去糖基化酶)而完成。修饰形式还包括具有磷酸化氨基酸残基(如磷酸酪氨酸,磷酸丝氨酸,磷酸苏氨酸)的序列。此外,还可以对本发明突变蛋白进行修饰。修饰(通常不改变一级结构)形式包括:体内或体外的突变蛋白的化学衍生形式如乙酰化或羧基化。修饰还包括糖基化,如那些在突变蛋白的合成和加工中或进一步加工步骤中进行糖基化修饰而产生的突变蛋白。这种修饰可以通过将突变蛋白暴露于进行糖基化的酶(如哺乳动物的糖基化酶或去糖基化酶)而完成。修饰形式还包括具有磷酸化氨基酸残基(如磷酸酪氨酸,磷酸丝氨酸,磷酸苏氨酸)的序列。还包括
被修饰从而提高了其抗蛋白水解性能或优化了溶解性能的突变蛋白。
[0188]
本发明还提供了编码igf2蛋白的多核苷酸序列。本发明的多核苷酸可以是 dna形式或rna形式。dna形式包括:dna、基因组dna或人工合成的dna,dna可以是单链的或是双链的。编码成熟多肽的多核苷酸包括:只编码成熟多肽的编码序列;成熟多肽的编码序列和各种附加编码序列;成熟多肽的编码序列(和任选的附加编码序列)以及非编码序列。术语“编码多肽的多核苷酸”可以是包括编码此多肽的多核苷酸,也可以是还包括附加编码和/或非编码序列的多核苷酸。本发明还涉及上述多核苷酸的变异体,其编码与本发明有相同的氨基酸序列的多肽的片段、类似物和衍生物。此多核苷酸的变异体可以是天然发生的等位变异体或非天然发生的变异体。这些核苷酸变异体包括取代变异体、缺失变异体和插入变异体。如本领域所知的,等位变异体是一个多核苷酸的替换形式,它可能是一个或多个核苷酸的取代、缺失或插入,但不会从实质上改变其编码的多肽的功能。
[0189]
根据本文所述的核苷酸序列,本技术领域人员可方便地用各种已知方法制得本发明的编码核酸。这些方法例如但不限于:pcr,dna人工合成等,具体的方法可参见j.萨姆布鲁克,《分子克隆实验指南》。作为本发明的一种实施方式,可通过分段合成核苷酸序列再进行重叠延伸pcr的方法来构建本发明的编码核酸序列。
[0190]
本发明还涉及与上述的序列杂交且两个序列之间具有至少50%,较佳地至少 70%,更佳地至少80%相同性的多核苷酸。本发明特别涉及在严格条件(或严紧条件) 下与本发明所述多核苷酸可杂交的多核苷酸。在本发明中,“严格条件”是指:(1) 在较低离子强度和较高温度下的杂交和洗脱,如0.2
×
ssc,0.1%sds,60℃;或(2) 杂交时加有变性剂,如50%(v/v)甲酰胺,0.1%小牛血清/0.1%ficoll,42℃等;或(3)仅在两条序列之间的相同性至少在90%以上,更好是95%以上时才发生杂交。
[0191]
本发明的蛋白和多核苷酸优选以分离的形式提供,更佳地,被纯化至均质。
[0192]
本发明多核苷酸全长序列通常可以通过pcr扩增法、重组法或人工合成的方法获得。对于pcr扩增法,可根据本发明所公开的有关核苷酸序列,尤其是开放阅读框序列来设计引物,并用市售的cdna库或按本领域技术人员已知的常规方法所制备的cdna库作为模板,扩增而得有关序列。当序列较长时,常常需要进行两次或多次pcr扩增,然后再将各次扩增出的片段按正确次序拼接在一起。
[0193]
一旦获得了有关的序列,就可以用重组法来大批量地获得有关序列。这通常是将其克隆入载体,再转入细胞,然后通过常规方法从增殖后的宿主细胞中分离得到有关序列。
[0194]
此外,还可用人工合成的方法来合成有关序列,尤其是片段长度较短时。通常,通过先合成多个小片段,然后再进行连接可获得序列很长的片段。
[0195]
目前,已经可以完全通过化学合成来得到编码本发明蛋白(或其片段,或其衍生物)的dna序列。然后可将该dna序列引入本领域中已知的各种现有的dna分子 (或如载体)和细胞中。此外,还可通过化学合成将突变引入本发明蛋白序列中。
[0196]
应用pcr技术扩增dna/rna的方法被优选用于获得本发明的多核苷酸。特别是很难从文库中得到全长的cdna时,可优选使用race法(race-cdna末端快速扩增法),用于pcr的引物可根据本文所公开的本发明的序列信息适当地选择,并可用常规方法合成。可用常规方法如通过凝胶电泳分离和纯化扩增的dna/rna片段。
[0197]
表达载体
[0198]
本发明也涉及包含本发明的多核苷酸的载体,以及用本发明的载体或本发明突变蛋白编码序列经基因工程产生的宿主细胞,以及经重组技术产生本发明所述多肽的方法。
[0199]
通过常规的重组dna技术,可利用本发明的多聚核苷酸序列可用来表达或生产重组的突变蛋白。一般来说有以下步骤:
[0200]
(1).用本发明的编码本发明突变蛋白的多核苷酸(或变异体),或用含有该多核苷酸的重组表达载体转化或转导合适的宿主细胞;
[0201]
(2).在合适的培养基中培养的宿主细胞;
[0202]
(3).从培养基或细胞中分离、纯化蛋白质。
[0203]
本发明中,编码突变蛋白的多核苷酸序列可插入到重组表达载体中。术语“重组表达载体”指本领域熟知的细菌质粒、噬菌体、酵母质粒、植物细胞病毒、哺乳动物细胞病毒如腺病毒、逆转录病毒或其他载体。只要能在宿主体内复制和稳定,任何质粒和载体都可以用。表达载体的一个重要特征是通常含有复制起点、启动子、标记基因和翻译控制元件。
[0204]
本领域的技术人员熟知的方法能用于构建含本发明突变蛋白编码dna序列和合适的转录/翻译控制信号的表达载体。这些方法包括体外重组dna技术、 dna合成技术、体内重组技术等。所述的dna序列可有效连接到表达载体中的适当启动子上,以指导mrna合成。这些启动子的代表性例子有:大肠杆菌的 lac或trp启动子;λ噬菌体pl启动子;真核启动子包括cmv立即早期启动子、hsv胸苷激酶启动子、早期和晚期sv40启动子、反转录病毒的ltrs和其他一些已知的可控制基因在原核或真核细胞或其病毒中表达的启动子。表达载体还包括翻译起始用的核糖体结合位点和转录终止子。
[0205]
此外,表达载体优选地包含一个或多个选择性标记基因,以提供用于选择转化的宿主细胞的表型性状,如真核细胞培养用的二氢叶酸还原酶、新霉素抗性以及绿色荧光蛋白(gfp),或用于大肠杆菌的四环素或氨苄青霉素抗性。
[0206]
包含上述的适当dna序列以及适当启动子或者控制序列的载体,可以用于转化适当的宿主细胞,以使其能够表达蛋白质。
[0207]
宿主细胞可以是原核细胞,如细菌细胞;或是低等真核细胞,如酵母细胞;或是高等真核细胞,如哺乳动物细胞。代表性例子有:大肠杆菌,链霉菌属;鼠伤寒沙门氏菌的细菌细胞;真菌细胞如酵母、植物细胞(如人参细胞)。
[0208]
本发明的多核苷酸在高等真核细胞中表达时,如果在载体中插入增强子序列时将会使转录得到增强。增强子是dna的顺式作用因子,通常大约有10到 300个碱基对,作用于启动子以增强基因的转录。可举的例子包括在复制起始点晚期一侧的100到270个碱基对的sv40增强子、在复制起始点晚期一侧的多瘤增强子以及腺病毒增强子等。
[0209]
本领域一般技术人员都清楚如何选择适当的载体、启动子、增强子和宿主细胞。
[0210]
用重组dna转化宿主细胞可用本领域技术人员熟知的常规技术进行。当宿主为原核生物如大肠杆菌时,能吸收dna的感受态细胞可在指数生长期后收获,用cacl2法处理,所用的步骤在本领域众所周知。另一种方法是使用mgcl2。如果需要,转化也可用电穿孔的方法进行。当宿主是真核生物,可选用如下的 dna转染方法:磷酸钙共沉淀法,常规机械方法如显微注射、电穿孔、脂质体包装等。
[0211]
获得的转化子可以用常规方法培养,表达本发明的基因所编码的多肽。根据所用的宿主细胞,培养中所用的培养基可选自各种常规培养基。在适于宿主细胞生长的条件下
进行培养。当宿主细胞生长到适当的细胞密度后,用合适的方法(如温度转换或化学诱导)诱导选择的启动子,将细胞再培养一段时间。
[0212]
在上面的方法中的重组多肽可在细胞内、或在细胞膜上表达、或分泌到细胞外。如果需要,可利用其物理的、化学的和其它特性通过各种分离方法分离和纯化重组的蛋白。这些方法是本领域技术人员所熟知的。这些方法的例子包括但并不限于:常规的复性处理、用蛋白沉淀剂处理(盐析方法)、离心、渗透破菌、超处理、超离心、分子筛层析(凝胶过滤)、吸附层析、离子交换层析、高效液相层析(hplc)和其它各种液相层析技术及这些方法的结合。
[0213]
非igf1r结合型的物质
[0214]
在本发明中,非igf1r结合型的物质包括对igf2r的选择性或亲和力高于 igf1r的物质,以及可以高效激活igf2r的不激活igf1r的物质(如视黄酸等非 igf1r配体)。在一优选实施方式中,所述非igf1r结合型的物质对igf2r的亲和力或选择性高于其对igf1r的亲和力或选择性。在一优选实施方式中,所述非igf1r 结合型的物质选自下组:igf2突变体、表达igf2突变体的载体、抗体、小分子化合物、或其组合。
[0215]
在一优选实施方式中,所述非igf1r结合型的物质还包括选自下组的一种或多种物质:血纤维蛋白溶酶原(plasminogen)、丝甘蛋白聚糖(serglycin)、e1a 刺激基因的细胞抑制因子(cellular repressor of e1a-stimulated genes,creg)、硫酸胺酶(sulfamidase,sgsh)、磷酸化的β-葡萄糖醛酸酶(phosphorylated β-glucuronidase,gusb)等igf2r有效抑炎配体。
[0216]
在本发明中,首次意外的发现,非igf1r结合型的物质可显著(a)预防和/或治疗炎症性疾病;和/或(i)减少结肠中致病单个核细胞浸润;和/或(ii)抑制巨噬细胞的致病表型;和/或(iii)降低巨噬细胞浸润数目;和/或(iv)赋予巨噬细胞显著抑制炎症的免疫记忆;和/或(v)预防和/或治疗自身免疫性疾病;和/ 或(vi)用于巨噬细胞参与的多种其他涉及炎症反应的疾病(如与肝纤维化、肾纤维化、肺纤维化等疾病的发生有关的炎症反应,与组织、器官或细胞移植引起的炎症反应,与肺癌、乳腺癌、前列腺癌、肝癌、胰腺癌、黑色素瘤、淋巴瘤等癌症的发生和转移相关的炎症反应,以及与自身免疫性疾病相关的炎症反应);和/或(vii)促进移植组织或细胞的植入。
[0217]
复方药物组合物和药盒
[0218]
本发明提供了含有活性成分(a)经过非igf1r结合型的物质处理的巨噬细胞;(b)任选的非igf1r结合型的物质;以及(c)药学上可接受的载体的复方药物组合物。这类载体包括(但并不限于):盐水、缓冲液、葡萄糖、水、甘油、乙醇、粉剂、及其组合。药物制剂应与给药方式相匹配。本发明的药物组合物可以被制成针剂形式,例如用生理盐水或含有葡萄糖和其他辅剂的水溶液通过常规方法进行制备。诸如片剂和胶囊之类的药物组合物,可通过常规方法进行制备。药物组合物如针剂、溶液、片剂和胶囊宜在无菌条件下制造。本发明的药物组合也可以被制成粉剂用于雾化吸入。本发明的药物组合物的剂型为注射剂。活性成分的给药量是治疗有效量。本发明的药物制剂还可制成缓释制剂。本发明的药物组合物优选为注射制剂。此外,本发明药物组合物还可与其他治疗剂一起使用。并且,本发明的药物组合物还可以包括额外的组分,所述额外的组分选自下组:(a)预防和/或治疗炎症性疾病的药物;和/或(b)预防和/或治疗自身免疫性疾病的组分。
[0219]
本发明所述的活性成分的有效量可随给药的模式和待治疗的疾病的严重程度等
而变化。优选的有效量的选择可以由本领域普通技术人员根据各种因素来确定(例如通过临床试验)。所述的因素包括但不限于:所述的活性成分的药代动力学参数例如生物利用率、代谢、半衰期等;患者所要治疗的疾病的严重程度、患者的体重、患者的免疫状况、给药的途径等。通常,当本发明的活性成分每天以约0.01μg-1mg/kg体重,较佳地0.1-10μg/kg体重,更佳地 0.5-5μg/kg体重。的剂量给予,能得到令人满意的效果。最佳剂量将根据病程和病情适当调整,例如,由治疗状况的迫切要求,可每天给予若干次分开的剂量,或将剂量按比例地减少。
[0220]
本发明所述的药学上可接受的载体包括(但不限于):水、盐水、脂质体、脂质、蛋白、蛋白-抗体缀合物、肽类物质、纤维素、纳米凝胶、或其组合。载体的选择应与给药方式相匹配,这些都是本领域的普通技术人员所熟知的。
[0221]
本发明还提供了一种可用于(a)预防和/或治疗炎症性疾病的药物;和/或((i) 减少结肠中致病单个核细胞浸润;和/或(ii)抑制巨噬细胞的致病表型;和/或 (iii)降低巨噬细胞浸润数目;和/或(iv)赋予巨噬细胞显著抑制炎症的免疫记忆;和/或(v)预防和/或治疗自身免疫性疾病;和/或(vi)用于巨噬细胞参与的多种其他涉及炎症反应的疾病(如与肝纤维化、肾纤维化、肺纤维化等疾病的发生有关的炎症反应,与组织、器官或细胞移植引起的炎症反应,与肺癌、乳腺癌、前列腺癌、肝癌、胰腺癌、黑色素瘤、淋巴瘤等癌症的发生和转移相关的炎症反应,以及与自身免疫性疾病相关的炎症反应);和/或(vii)促进移植组织或细胞的植入的药盒,该药盒含有:
[0222]
(i)第一容器,以及位于该第一容器中的活性成分(a)经过非igf1r结合型的物质处理的巨噬细胞,或含有活性成分(a)的药物;和
[0223]
(ii)任选的第二容器,以及装于该第二容器中的活性成分(b)非igf1r结合型的物质,或含有活性成分(b)的药物;和
[0224]
(ii)说明书,所述说明书中记载了给予活性成分(a)从而(a)预防和/或治疗炎症性疾病;和/或(i)减少结肠中致病单个核细胞浸润;和/或(ii)抑制巨噬细胞的致病表型;和/或(iii)降低巨噬细胞浸润数目;和/或(iv)赋予巨噬细胞显著抑制炎症的免疫记忆;和/或(v)预防和/或治疗自身免疫性疾病;和/或(vi) 用于巨噬细胞参与的多种其他涉及炎症反应的疾病(如与肝纤维化、肾纤维化、肺纤维化等疾病的发生有关的炎症反应,与组织、器官或细胞移植引起的炎症反应,与肺癌、乳腺癌、前列腺癌、肝癌、胰腺癌、黑色素瘤、淋巴瘤等癌症的发生和转移相关的炎症反应,以及与自身免疫性疾病相关的炎症反应);和/或(vii)促进移植组织或细胞的植入的说明。
[0225]
本发明的药物组合物和药盒适用于(a)预防和/或治疗炎症性疾病;和/或(i) 减少结肠中致病单个核细胞浸润;和/或(ii)抑制巨噬细胞的致病表型;和/或 (iii)降低巨噬细胞浸润数目;和/或(iv)赋予巨噬细胞显著抑制炎症的免疫记忆;和/或(v)预防和/或治疗自身免疫性疾病;和/或(vi)用于巨噬细胞参与的多种其他涉及炎症反应的疾病(如与肝纤维化、肾纤维化、肺纤维化等疾病的发生有关的炎症反应,与组织、器官或细胞移植引起的炎症反应,与肺癌、乳腺癌、前列腺癌、肝癌、胰腺癌、黑色素瘤、淋巴瘤等癌症的发生和转移相关的炎症反应,以及与自身免疫性疾病相关的炎症反应);和/或(vii)促进移植组织或细胞的植入。
[0226]
本发明制剂可以每一天服用三次到每十天服用一次,或者以缓释方式每十天服用
一次。优选的方式是每天服用一次,因为这样便于病人坚持,从而显著提高病人服药的顺应性。
[0227]
服用时,极大多数病例一般每天应用的总剂量应低于(或少数病例等于或略大于)各个单药的每天常用剂量,当然,所用的活性成分的有效剂量可随给药的模式和待治疗的疾病的严重程度等而有所变化。
[0228]
治疗方法
[0229]
本发明还提供了用本发明的两种活性成分或相应的药物来(a)预防和/或治疗炎症性疾病;和/或(i)减少结肠中致病单个核细胞浸润;和/或(ii)抑制巨噬细胞的致病表型;和/或(iii)降低巨噬细胞浸润数目;和/或(iv)赋予巨噬细胞显著抑制炎症的免疫记忆;和/或(v)预防和/或治疗自身免疫性疾病;和/或 (vi)用于巨噬细胞参与的多种其他涉及炎症反应的疾病(如与肝纤维化、肾纤维化、肺纤维化等疾病的发生有关的炎症反应,与组织、器官或细胞移植引起的炎症反应,与肺癌、乳腺癌、前列腺癌、肝癌、胰腺癌、黑色素瘤、淋巴瘤等癌症的发生和转移相关的炎症反应,以及与自身免疫性疾病相关的炎症反应);和/或(vii) 促进移植组织或细胞的植入的方法,它包括给哺乳动物施用有效量的活性成分 (a)经过非igf1r结合型的物质处理的巨噬细胞,或者施用含有所述活性成分(a) 的药物组合物;以及(b)非igf1r结合型的物质,或含有活性成分(b)的药物组合物。
[0230]
当本发明两种活性成分被用于上述用途时,可与一种或多种药学上可接受的载体或赋形剂混合,如溶剂、稀释剂等,而且可以用如下形式口服给药:片剂、丸剂、胶囊、可分散的粉末、颗粒或悬浮液(含有如约0.05-5%悬浮剂)、糖浆(含有如约10-50%糖)、和酏剂(含有约20-50%乙醇),或者以无菌可注射溶液或悬浮液形式(在等渗介质中含有约0.05-5%悬浮剂)进行非肠胃给药。例如,这些药物制剂可含有与载体混合的约0.01-99%,更佳地约为0.1%-90%(重量)的活性成分。
[0231]
本发明的两种活性成分或药物组合物可以通过常规途径进行给药,其中包括(但并不限于):肌内、腹膜内、静脉内、皮下、皮内、口服、瘤内或局部给药。优选的给药途径包括口服给药、肌内给药或静脉内给药。
[0232]
从易于给药的立场看,优选的药物组合物是液态组合物,尤其是注射剂。
[0233]
此外,本发明的两种活性成分或药物还可与其他(a)预防和/或治疗炎症性疾病;和/或(i)减少结肠中致病单个核细胞浸润;和/或(ii)抑制巨噬细胞的致病表型;和/或(iii)降低巨噬细胞浸润数目;和/或(iv)赋予巨噬细胞显著抑制炎症的免疫记忆;和/或(v)预防和/或治疗自身免疫性疾病;和/或(vi)用于巨噬细胞参与的多种其他涉及炎症反应的疾病(如与肝纤维化、肾纤维化、肺纤维化等疾病的发生有关的炎症反应,与组织、器官或细胞移植引起的炎症反应,与肺癌、乳腺癌、前列腺癌、肝癌、胰腺癌、黑色素瘤、淋巴瘤等癌症的发生和转移相关的炎症反应,以及与自身免疫性疾病相关的炎症反应);和/或(vii)促进移植组织或细胞的植入的组分或药物(非甾体抗炎药、糖皮质激素、甲氨蝶呤、tnfα中和抗体、tnfr1抗体、tnfr2抗体、抗cd20抗体、il-1r拮抗剂、il-12和il-23p40 中和抗体、il-23p19中和抗体、il-17中和抗体、il-17a受体中和抗体、ctla-4 融合蛋白)联合使用。
[0234]
本发明的主要优点包括:
[0235]
(1)本发明首次发现,非igf1r结合型的物质可显著(a)预防和/或治疗炎症性疾病;和/或(i)减少结肠中致病单个核细胞浸润;和/或(ii)抑制巨噬细胞的致病表型;和/或
(iii)降低巨噬细胞浸润数目;和/或(iv)赋予巨噬细胞显著抑制炎症的免疫记忆;和/或(v)预防和/或治疗自身免疫性疾病;和/或(vi)用于巨噬细胞参与的多种其他涉及炎症反应的疾病(如与肝纤维化、肾纤维化、肺纤维化等疾病的发生有关的炎症反应,与组织、器官或细胞移植引起的炎症反应,与肺癌、乳腺癌、前列腺癌、肝癌、胰腺癌、黑色素瘤、淋巴瘤等癌症的发生和转移相关的炎症反应,以及与自身免疫性疾病相关的炎症反应);和/或(vii)促进移植组织或细胞的植入。
[0236]
(2)本发明首次发现,胰岛素样生长因子2(igf2)赋予诱导巨噬细胞抗炎的免疫记忆。这一特性依赖于igf2受体(igf2r)。功能性封闭igf2r,igf2 不再赋予巨噬细胞抵抗炎症的免疫记忆。
[0237]
(3)本发明首次发现,低剂量的igf2可以诱导非经典的线粒体动力学,赋予巨噬细胞抵抗炎症的免疫记忆,高剂量igf2会激活igf1受体(igf1r),抑制igf2r的效应,促进单核细胞和巨噬细胞利用有氧糖酵解代谢获得促炎能力。
[0238]
(4)本发明首次发现,与igf1r低亲和力的igf2突变体,特异性激活igf2r,最大程度缓解腹膜炎和炎症性肠病等自身免疫性疾病和炎症性疾病。这些发现说明,igf2r靶向性激活能够决定巨噬细胞长期的免疫抑制记忆,igf2r是治疗巨噬细胞参与的炎症相关疾病的理想靶点
[0239]
(5)本发明首次发现,定向激活单核细胞的igf2r抑制炎症性肠病。
[0240]
(6)本发明首次发现,igf2治疗炎症性肠病依赖于巨噬细胞。
[0241]
(7)本发明首次发现,igf2在巨噬细胞参与的多种其他炎症反应疾病。
[0242]
下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件如sambrook等人,分子克隆:实验室手册(new york:cold spring harbor laboratory press,1989)中所述的条件,或按照制造厂商所建议的条件。除非另外说明,否则百分比和份数按重量计算。
[0243]
如无特别说明,实施例所用的所有材料和试剂均为市售产品。
[0244]
材料与方法
[0245]
1试剂
[0246]
本研究所涉及的实验试剂较多,为了减少字数,节约版面,将按照试剂的不同品牌依次列出。
[0247]
重组人源胰岛素样生长因子-2(recombinant human igf2,292-g2-250),重组鼠源巨噬细胞集落刺激因子(recombinant mouse m-csf protein, 416-ml-050)购买于r&d systems。
[0248]
人源第27为亮氨酸点突变igf2(human leu27-igf2,tu100)购买于gropep bioreagents。
[0249]
2实验小鼠构建和鉴定
[0250]
igf2r
+/-小鼠利用crisper-cas9技术敲除igf2r基因第6外显子上2bp或 13bp碱基,造成移码突变。由于igf2r缺陷纯合子会胚胎致死,我们以igf2r
+/-杂合子小鼠保种传代和鉴定。鉴定使用引物为:
[0251]
primer 1,5
’-
cgtgaagtctgtctatggaagagactggacc-3’(seq id no.:59),
[0252]
primer 2,5
’-
cattaccaagctcacactcccttctcttctctatt-3’(seq id no.:60),
[0253]
基因型结果判定方法将体现于实验结果部分。
[0254]
igf2r
fl/fl
小鼠在igf2r基因第2外显子两侧插入loxp序列,鉴定使用引物为:
[0255]
primer 1,5
’-
ccccggtgttgaggttgatagata-3’(seq id no.:61),
[0256]
primer 2,5
’-
caatttagggctgaagcgatggat-3’(seq id no.:62),
[0257]
基因型结果判定方法将体现于实验结果部分。
[0258]
igf1r
fl/fl
小鼠鉴定使用引物为:
[0259]
primer 1,5
’-
cttcccagcttgctactctagg-3’(seq id no.:63),
[0260]
primer 2,5
’-
caggcttgcaatgagacatggg-3’(seq id no.:64),
[0261]
primer 3,5
’-
tgagacgtagcgagattgctgta-3’(seq id no.:65)
[0262]
基因型结果判定方法将体现于实验结果部分。
[0263]
lyz2
cre
小鼠鉴定使用引物为:
[0264]
primer 1,5
’-
cccagaaatgccagattacg-3’(seq id no.:66),
[0265]
primer 2,5
’-
cttgggctgccagaatttctc-3’(seq id no.:67),
[0266]
primer 3,5
’-
ttacagtcggccaggctgac-3’(seq id no.:68)
[0267]
基因型结果判定方法将体现于实验结果部分。
[0268]
3腹膜炎小鼠模型
[0269]
配置5%(质量/体积)的巯基乙酸盐培养基水溶液(5%ftg),在121℃高温高压条件下灭菌30分钟,冷却至室温后备用。使用前检查巯基乙酸盐培养基的物理性状,粘稠度以不至于摇晃时出现气泡为佳,培养基颜色由最初配置时的蓝绿色,转变为摇晃时呈现棕褐色为宜。
[0270]
选取9-12周范围内,同周龄的c57/bl6雌性小鼠进行实验。每只小鼠缓慢注射2ml巯基乙酸盐培养基至腹腔,24小时后,给予igf2或其他药物治疗,在巯基乙酸盐注射后的第24小时和第48小时分别给药一次,第72小时安乐死小鼠,分离腹腔巨噬细胞。
[0271]
4腹腔巨噬细胞分离
[0272]
用75%乙醇浸泡已经安乐死的巯基乙酸盐(ftg)诱导72小时的小鼠数分钟,沿垂直于小鼠头尾的方向撕开腹部毛皮,用注射器吸取10ml四摄氏度预冷的磷酸盐缓冲液(pbs,实验中发现,使用预冷的pbs灌洗小鼠腹腔,可以获得最多数目的细胞),将磷酸盐缓冲液用力快速注射(有助于将贴壁细胞吹下)进入小鼠腹腔,右手食指无名指夹住小鼠尾巴,轻轻握住小鼠,上下剧烈摇晃三至五次,用注射器缓慢地将细胞灌洗液吸出,这个过程中要避免刺穿肠道而污染细胞,避免吸入脂肪组织而堵塞针头。腹腔巨噬细胞灌洗液需四度保存,常温下细胞容易吸附离心管管壁。
[0273]
5炎症性肠病模型
[0274]
预先配置16%(质量/体积)葡聚糖硫酸钠(dextran sulfate sodium salt, dss)水溶液,用0.45μm滤头过滤除菌后传递进入spf屏障。以常规饮用水对于16%dss溶液进行4倍稀释至4%终浓度。选择9-12周龄雌性小鼠喂食 4%dss溶液至不同天数,终止日期根据实验目的不同而定。在最初验证igf2治疗效果的实验中,4%dss溶液持续喂养,生存曲线统计完成后终止;在后续实验中通常连续喂养5天的4%dss溶液,不同批次的实验的具体饮用时间将会在实验结果中体现。
[0275]
对于炎症性肠病的临床评分,按以下标准进行。在用4%dss溶液喂养小鼠 4天后,评价“stool scores”和“bleeding scores”。“stool scores”的标准为:0分,粪便形态正常;1分,半成型粪便且肛门无附着;2分,半成型粪便且存在肛门附着;3分,液态粪便附着于肛门。“bleeding scores”的判断标准:0分,粪便潜血试纸阴性;1分,粪便潜血试纸阳性;2分,笼具可见血痕;3分,直肠出血,肛门呈现红色血斑。
[0276]
6结肠浸润淋巴细胞分离
[0277]
安乐死4%dss诱导4-5天的小鼠,解剖小鼠,获取结肠组织,放置于四摄氏度预冷的磷酸盐缓冲液中,洗去结肠表面血污。纵向剪开结肠,在四度预冷的磷酸盐缓冲液中,小心洗去粪便。用含有200μg/ml dnasei和1mg/ml viii型胶原酶的1640培养液,于消化前加入dtt,摇床200转/分钟消化60 分钟,小心取出结肠基底层组织,剪成小段后,进行再次消化,以70μm细胞筛网过滤,将滤液以400g转速离心5分钟,获得单细胞沉淀。
[0278]
配置40%和80%的percoll分离液,用2ml体积的40%浓度的percoll 重悬单细胞沉淀,向40%浓度的percoll下层的离心管底部,小心加入80%的 percoll分离液,适当控制对移液枪的压力,防止两层分离液混合浑浊。调节离心机温度至25摄氏度,升降加速梯度为0,2000转/分钟离心25分钟。收集40%和80%的percoll分离液中间层细胞,用10ml四摄氏度预冷的磷酸盐缓冲液洗涤至少两次,以完全去除percoll,最终获得纯净的结肠来源的单个核细胞。
[0279]
7流式细胞分析
[0280]
因为单核细胞和巨噬细胞相对高水平表达igg的受体——cd16/32,对于单核细胞和巨噬细胞抗体染色,需要提前用无荧光素偶联的cd16/32抗体封闭细胞(抗体:磷酸盐缓冲液=1:50比例稀释抗体,100μl抗体工作液/1
×
107细胞,室温孵育30分钟)。因为巨噬细胞具有易贴壁且不易消化的特性,巨噬细胞染色时应该选择超低吸附的培养板来承放细胞。
[0281]
细胞膜表面蛋白染色。对于cd16/32抗体封闭过的细胞,按照1:100比例用磷酸盐缓冲液稀释抗体,100μl染色工作液/1
×
107细胞,室温染色30 分钟后以磷酸盐缓冲液洗涤,离心后用200μl磷酸盐缓冲液重悬,上机检测或者用1%的中性甲醛固定。
[0282]
细胞内和细胞核内蛋白染色。细胞内蛋白以及细胞核内蛋白需要在细胞膜表面蛋白染色完成后进行。对于细胞内蛋白,使用细胞固定和破膜试剂盒 (fixation/permeabilization solution and perm/wash buffer)进行破膜和固定后染色;对于细胞核蛋白,使用细胞固定/细胞破膜试剂盒(foxp3/ transcription factor staining buffer set)固定和破膜后染色。
[0283]
8细胞外通量分析(海马实验)
[0284]
将腹腔巨噬细胞或者thp1细胞的培养液更换为seahorse专用培养基(xf medium),培养基添加了10mm葡萄糖,2mm谷氨酰胺和2mm丙酮酸。氧气消耗率测定实验和胞外产酸率测定实验在添加或者不添加以下刺激条件下: 1μm寡霉素,0.75mm fccp,100nm鱼藤酮和1μm抗霉素,使用细胞外流量分析仪(extracellular flux analyzer,agilent)测定。
[0285]
9实时定量pcr
[0286]
使用天根生物细胞/细菌rna分离试剂盒提取细胞总rna,每个样本通常可以获得
30μl体积的300ng/ml的rna。利用takara反转录试剂盒将全部rna 反转录为cdna(pcr条件为:37℃持续15分钟,85℃灭活5秒钟,温度下降至4℃保存)。cdna可在负二十摄氏度条件下保存数天,时间延长会发生降解。
[0287]
在使用cdna前,用双蒸水对cdna进行10倍稀释,实时定量pcr体系为 10μl,包含5μl sybr,4μl cdna,1μl引物。于384孔板点好样本后, 2500转/分在室温下离心2分钟,此步骤若以4℃条件离心将会在膜上形成水雾。实时定量pcr条件为:step 1,95℃持续10分钟,step 2,95℃持续15 秒,step 3,60℃持续1分钟,step 4,95℃持续15秒,step 5,60℃持续1 分钟,step 6,95℃持续15秒,其中step 2和step 3循环40次。
[0288]
实时定量pcr实验所涉及的引物如下:
[0289]
tnfα-f:5
’-
cctgtagcccacgtcgtag-3’(seq id no.:69),
[0290]
tnfα-r:5
’-
gggagtagacaaggtacaaccc-3’(seq id no.:70);
[0291]
il-1β-f:5
’-
gcaactgttcctgaactcaact-3’(seq id no.:71),
[0292]
il-1β-r:5
’-
atcttttggggtccgtcaact-3’(seq id no.:72);
[0293]
cxcl10-f:5
’-
ccaagtgctgccgtcattttc-3’(seq id no.:73),
[0294]
cxcl10-r:5
’-
ggctcgcagggatgatttcaa-3’(seq id no.:74);
[0295]
retnla-f:5
’-
ccaatccagctaactatccctcc-3’(seq id no.:75),
[0296]
retnla-r:5
’-
acccagtagcagtcatccca-3’(seq id no.:76);
[0297]
ccl22-f:5
’-
aggtccctatggtgccaatgt-3’(seq id no.:77),
[0298]
ccl22-r:5
’-
cggcaggattttgaggtcca-3’(seq id no.:78);
[0299]
clec7a-f:5
’-
gacttcagcactcaagacatcc-3’(seq id no.:79),
[0300]
clec7a-r:5
’-
ttgtgtcgccaaaatgctagg-3’(seq id no.:80);
[0301]
10h&e染色
[0302]
脱水包埋:取相同位置的结肠组织于4%多聚甲醛溶液中固定24小时,依次经过以下步骤脱水处理后包埋。70%乙醇,浸泡过夜;80%乙醇,浸泡2小时;85%乙醇,浸泡1.5小时;90%乙醇,浸泡1小时;95%乙醇,浸泡1 小时;100%乙醇,浸泡30分钟,重复操作一次;二甲苯,浸泡5分钟,重复操作一次;60摄氏度液体石蜡,浸泡1小时,重复操作一次;使用石蜡包埋机完成石蜡包埋。
[0303]
切片染色:以3μm厚度切片,56摄氏度水浴延展石蜡组织切片数秒钟,用载玻片吸附石蜡组织切片,于60摄氏度烘箱中过夜烘片,然后按如下步骤进行染色。二甲苯,浸泡5分钟,重复操作一次;100%乙醇,浸泡5分钟,重复操作一次;95%乙醇,浸泡5分钟,重复操作一次;70%乙醇,浸泡5分钟;蒸馏水,浸泡5分钟;苏木精,染色5分钟;自来水流水冲洗适当时间;氨水,浸洗适当时间;流水冲洗适当时间;伊红,染色1分钟;95%乙醇,浸泡1分钟;100%乙醇,浸泡1分钟,重复操作一次。二甲苯,浸泡1分钟;重复操作一次;封片剂封片。
[0304]
11免疫组化
[0305]
石蜡切片抗原复性:石蜡切片于60摄氏度烘箱中烘片两小时;用ph 7.4 的磷酸盐缓冲液浸洗石蜡切片三次,每次三分钟;将脱蜡水化的石蜡切片置于沸腾的ph=6.0的柠檬酸盐缓冲液中煮沸十分钟;自来水流水自然冷却后,用蒸馏水浸洗两次,每次三分钟;用ph 7.4的磷酸盐缓冲液浸洗两次,每次三分钟。每张石蜡切片滴加一滴3%双氧水,室温孵育十分钟。
(extracellular acidification rate,ecar),发现,低剂量igf2预编程的腹腔巨噬细胞的胞外最大产酸率显著低于pbs对照组和高剂量igf2组。这些结果被更好的体现于最大氧气消耗率与胞外最大产酸率(ocr:ecar)的比对值(图2b)。低剂量igf2预编程的巨噬细胞体现更高水平的ocr:ecar值,说明这组巨噬细胞倾向于以氧化磷酸化(oxidative phosphorylation,oxphos) 为主要方式来获取能量,而对照组和高剂量igf2组的巨噬细胞则更倾向于选择有氧糖酵解的方式产生能量供细胞所需。
[0320]
乳酸是有氧糖酵解的中间代谢产物,在有氧糖酵解的过程中,过量的乳酸会被细胞分泌到细胞外,因此,检测和对比细胞培养基上清中乳酸的累积量,是衡量细胞进行有氧糖酵解水平的有效方式。我们利用脂多糖 (lipopolysaccharide,lps)再次刺激这些分离得到的腹腔巨噬细胞,24小时后检测培养基上清中乳酸含量,结果发现,pbs和高剂量igf2预编程的腹腔巨噬细胞的培养基上清中的乳酸积累量显著高于低剂量igf2处理组(图2c)。上述研究表明,低剂量igf2赋予小鼠腹腔巨噬细胞更强的氧化磷酸化获能潜力,而高剂量的igf2则逆转了这一特性,甚至增加了细胞的无氧糖酵解获能偏好。以氧化磷酸化为主要获能方式的巨噬细胞,往往具备替代激活巨噬细胞的特征,体现抵抗炎症的表型。为了验证不同剂量igf2预编程的腹腔巨噬细胞的免疫表型,研究分别用脂多糖(lps)以及白介素-4/13(il-4/13)分别处理这些分离出来的巨噬细胞,模拟经典激活途径和替代激活途径刺激巨噬细胞。实时定量pcr(real-time pcr,rt-pcr)结果显示,脂多糖经典激活的巨噬细胞的炎症因子表达被低剂量igf2(l-igf2)抑制,高剂量igf2对部分基因无效(图2d);白介素4/13替代激活的巨噬细胞的抗炎因子表达被igf2 (l-igf2)放大,高剂量igf2无效(图2e,f)。
[0321]
这些结果说明,低剂量igf2引起的氧化磷酸化能量代谢偏好能够促进腹腔巨噬细胞体现较强的抗炎表型,而高剂量igf2逆转了低剂量igf2的效应,将能量代谢方式回归为与对照组接近的有氧糖酵解为主的方式,相应地逆转了炎症表型。
[0322]
实施例3
[0323]
构建igf2r基因缺陷小鼠,以及igf1r或igf2r条件性敲除小鼠。
[0324]
igf2可以与igf1r和igf2r结合,与igf2r具有最大亲和力,当igf2与 igf2r结合后,引起igf2r内化,igf2将被运往溶酶体发生降解,因此igf2r 往往被认为是igf2的诱骗受体(decoy receptor),而igf2与igf1r结合则发挥丝裂原功能,促进细胞增殖和生存2。根据前一部分的研究,我们发现高剂量igf2体现出了丝裂原功能,促进腹膜炎小鼠腹腔巨噬细胞增殖和生存,而低剂量igf2则没有这样的功能。又鉴于igf2与igf2r的最大亲和力,我们假设低剂量igf2优先结合与igf2r,诱导igf2r依赖的生物学效应,比如非经典的线粒体动力学的发生,高剂量igf2在“耗尽”细胞外膜igf2r后依然有机会与igf1r结合,抵消igf2r的生物学效应,进而促进腹膜炎小鼠腹腔巨噬细胞增殖和生存。
[0325]
为了研究igf2分别依赖于何种受体实现对于单核细胞的双向调节功能,我们构建了基因工程小鼠。在igf2r基因全身敲除小鼠中,我们利用 crisper-cas9技术打靶敲除igf2基因第6外显子2bp或13bp碱基,造成移码突变来完成(图3a)。鉴于igf2r基因完全缺失会引起小鼠胚胎致死,我们最终获得igf2r基因敲除的杂合子小鼠——igf2r
+/-小鼠进行繁殖保种和实验,igf2r
+/-小鼠子代基因型鉴定依赖于测序比对(图3b)。我们诱导了小鼠腹腔巨噬细胞,并用流式检测这些细胞igf2r的表达,确认了敲除效率(图3c)。
[0326]
为了构建igf2r条件性敲除小鼠,我们利用es细胞打靶技术,在igf2r 基因第二外
显子两端引入了同方向的loxp序列,首先构建出igf2r
fl/fl
小鼠。然后将igf1r
fl/fl
小鼠以及igf2r
fl/fl
小鼠分别与lyz2
cre
小鼠交配,其中lyz2在髓系淋巴细胞中高水平表达
18
,直至获得igf1r
fl/fl
lyz2
cre
纯合子小鼠和 igf2r
fl/fl
lyz2
cre
纯合子小鼠(图3d,g)。dna水平和蛋白水平鉴定结果验证了敲除效率(图3e,f,h,i)。
[0327]
实施例4定向激活单核细胞的igf2r抑制炎症性肠病。
[0328]
为了评价igf2-igf2r预编程的单核细胞和巨噬细胞在其他炎症模型中的作用,我们使用葡聚糖硫酸钠(dextran sulfate sodium salt,dss)诱导了炎症性肠病模型,这是一种与人类克罗恩病和溃疡性结肠炎症状最为相似的一种实验动物模型
19,20
。接下来,我们使用不同剂量的igf2以及igf2处理的腹腔巨噬细胞对于dss诱导的炎症性肠病进行治疗。
[0329]
4.1低剂量igf2抑制dss诱导的炎症性肠病
[0330]
我们发现,低剂量igf2治疗,可以显著减缓dss引起的小鼠体重下降,显著延长小鼠生存时间,然而,高剂量的igf2则加速了小鼠体重下降,不能延长小鼠的生存时间(图4a,b)。此外,我们还对小鼠的其他指标做了记录和评价,比如“stool score”和“bleeding score”以及结肠的长度,结果发现,低剂量igf2可以显著降低“stool score”和“bleeding score”的评分,更好的保持小鼠结肠的长度(图4c,d,e)。
[0331]
在h&e病理检查结果中,我们发现,对照组和高剂量igf2处理组小鼠的结肠绒毛大部分被破坏,而低剂量igf2组相对完好(图4f)。在tunel免疫组化染色结果中,我们发现,死亡的细胞沿着结肠绒毛向基底层蔓延,对照组和高剂量igf2处理组的阳性死亡信号明显强于低剂量igf2处理组(图4g)。在ki67免疫组化染色结果中,我们发现,ki67阳性增值信号由基底膜向绒毛方向延伸,低剂量igf2组的ki67阳性信号显著强于对照组和高剂量igf2处理组,这说明了基底膜附近的单核细胞和巨噬细胞对于肠绒毛的修复发挥作用,低剂量igf2治疗的小鼠的结肠基底膜处的巨噬细胞能够更好地促进结肠绒毛修复(图4h)。
[0332]
综上所述,低剂量igf2可以显著改善dss诱导的炎症性肠病小鼠的生活质量和生存时间,高剂量的igf2无治疗作用,甚至会加重一些症状。
[0333]
4.2igf2治疗炎症性肠病依赖于巨噬细胞
[0334]
为了验证igf2预编程的单核细胞和巨噬细胞在dss诱导的炎症性肠病中的关键作用,我们利用pbs,低剂量igf2,以及高剂量igf2预编程的腹腔巨噬细胞来治疗dss诱导的炎症性肠病小鼠。结果发现,pbs预处理的,和高剂量igf2预处理的腹腔巨噬细胞治疗的炎症性肠病小鼠,体重下降加剧,生存时间减少,而低剂量igf2预处理的腹腔巨噬细胞治疗的炎症性肠病小鼠,体重指数被显著改善,生存时间得以延长(图5a,b)。
[0335]
因此,在低剂量igf2缓解的dss诱导的炎症性肠病,以及高剂量igf2加重的炎症性肠病的过程中,巨噬细胞都发挥着至关重要的作用。
[0336]
4.3低剂量igf2减少结肠中致病巨噬细胞浸润
[0337]
鉴于巨噬细胞在dss诱导的炎症性肠病中发挥的重要作用,我们对于结肠浸润的单个核细胞进行了数目和表型分析。结果表明,低剂量igf2治疗显著降低了结肠中单个核细胞的浸润,而高剂量igf2则增加了单个核细胞在结肠组织中的浸润(图6a)。这一现象与低剂量igf2和高剂量igf2处理的腹膜炎小鼠的可获得的腹腔巨噬细胞数目相类似。
[0338]
在检测炎症性肠病小鼠结肠组织中分离到的单个核细胞的表型之前,我们利用脂多糖刺激这些细胞5小时,并加入布雷菲德菌素a(brefeldin a,bfa) 以抑制细胞内因子释
放。实验结果表明,相对于对照组的细胞,低剂量igf2 治疗的炎症性肠病小鼠结肠组织的巨噬细胞表达更少的白介素-1β(il-1β),而高剂量igf2治疗的结肠炎小鼠结肠组织的巨噬细胞则显著高表达白介素
ꢀ-
1β(图6b)。同时我们统计了致病性的il-1β阳性巨噬细胞在全部浸润的巨噬细胞的比例(图6c)。
[0339]
这些结果说明,低剂量igf2治疗抑制了炎症性肠病小鼠结肠组织浸润的巨噬细胞的致病表型,同时降低巨噬细胞浸润数目,而高剂量igf2治疗则会加重巨噬细胞的这一致病表型,同时增加这一类群细胞的浸润数目。
[0340]
4.4igf2r执行低剂量igf2的抗炎任务
[0341]
为了验证igf2在治疗dss诱导的炎症性肠病小鼠中的作用机制,是否与我们之前的研究结果相一致,我们用dss诱导髓系淋巴细胞特异性敲除igf2r 或者igf1r的小鼠发生炎症性肠病,并以igf2治疗。结果表明,相对于对照组igf2r
fl/fl
小鼠,特异性敲除igf2r的igf2r
fl/fl
lyz2
cre
小鼠对于dss更加敏感,体重下降更加显著,而且低剂量igf2不再发挥有效的抵抗炎症性肠病的作用,体重持续下降(图7a)。
[0342]
与之对应的是,相对于对照组igf1r
fl/fl
小鼠,特异性敲除igf1r的 igf1r
fl/fl
lyz2
cre
小鼠对于dss更加抵抗,无论在pbs处理组还是高剂量igf2治疗组,小鼠体重都显著高于对照组igf1r
fl/fl
小鼠在对应治疗条件下的体重(图 7b)。
[0343]
以上实验结果表明,在dss诱导的炎症性肠病小鼠模型中,igf2的治疗依然依赖于igf2r来执行抗炎表型的塑造,而igf1r激活的信号则促进了巨噬细胞在炎症性肠病中的促炎症表型。
[0344]
4.5leu27-igf2靶向激活igf2r能够最为有效地抑制腹膜炎和炎症性肠病
[0345]
为了方便对于igf2r和igf1r功能的研究,已经有很多igf2突变体被设计和报道出来,这其中就包括了可以选择性结合igf2r的igf2突变体。研究人员将igf2肽段的第27位酪氨酸突变为亮氨酸而制备了leu27-igf2突变体 (l27-igf2),leu27-igf2突变体与igf2r以及igfbp蛋白的亲和力不变,与 igf1r的亲和力极显著降低。
[0346]
与野生型igf2相比,leu27-igf2可以显著降低腹膜炎小鼠腹腔单核细胞和腹腔巨噬细胞的细胞质相对ph,甚至在2000ng/ml的高剂量下,我们也对比了低剂量下leu27-igf2的对于细胞质ph的改变效果,排除了leu27-igf2 效价低的可能性(图8a)。与之对应的,低剂量leu27-igf2和高剂量leu27-igf2 预编程的腹膜炎小鼠来源的腹腔巨噬细胞均可以显著抑制脂多糖刺激后一氧化氮(图8b)和乳酸(图8c)的产生量。这说明,低剂量leu27-igf2和高剂量leu27-igf2都可以赋予腹膜炎小鼠的腹腔巨噬细胞具备抗炎表型。
[0347]
同样的,在dss诱导的炎症性肠病小鼠模型中,低剂量leu27-igf2和高剂量leu27-igf2都可以显著抑制dss引起的小鼠体重降低(图8d)。从这些小鼠的结肠的长度也可以反映出低剂量leu27-igf2和高剂量leu27-igf2的治疗效果(图8e)。
[0348]
综合以上实验结果可以分析出,在巯基乙酸盐培养基诱导的腹膜炎和dss 诱导的炎症性肠病模型中,leu27-igf2的有效抑制炎症的阈值相对于野生型 igf2提高了20倍以上(图8f)。
[0349]
在这一部分研究中,我们验证了igf2在dss诱导的炎症性肠病小鼠模型中的治疗作用。确认了低剂量igf2有效抑制炎症性肠病依赖于与低剂量igf2 治疗腹膜炎相同的作用机制,在这两种验证模型中,igf2r依赖的途径都可以赋予巨噬细胞显著的抑制炎症的免
疫记忆。igf2突变体靶向激活igf2r,发挥最稳定的抑制炎症的效果。
[0350]
在本发明提及的所有文献都在本申请中引用作为参考,就如同每一篇文献被单独引用作为参考那样。此外应理解,在阅读了本发明的上述讲授内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本申请所附权利要求书所限定的范围。
[0351]
参考文献:
[0352]
1yu,h.&rohan,t.role of the insulin-like growth factor family in cancer development and progression.journal of the national cancer institute 92,1472-1489(2000).
[0353]
2enguita-german,m.&fortes,p.targeting the insulin-like growth factor pathway in hepatocellular carcinoma.world journal of hepatology 6,716-737,doi:10.4254/wjh.v6.i10.716(2014).
[0354]
3killian,j.k.&jirtle,r.l.genomic structure of the human m6p/igf2 receptor.mammalian genome:official journal of the international mammalian genome society 10,74-77(1999).
[0355]
4gary-bobo,m.,nirde,p.,jeanjean,a.,morere,a.&garcia,m. mannose 6-phosphate receptor targeting and its applications in human diseases.current medicinal chemistry 14,2945-2953(2007).
[0356]
5costello,m.,baxter,r.c.&scott,c.d.regulation of soluble insulin-like growth factor ii/mannose 6-phosphate receptor in human serum:measurement by enzyme-linked immunosorbent assay.the journal of clinical endocrinology and metabolism 84,611-617, doi:10.1210/jcem.84.2.5488(1999).
[0357]
6 sheet,a.d.f.us,department of health and human services. (2016).
[0358]
7 borgelt,l.m.immunity and autoimmune diseases.women's health across the lifespan:a pharmacotherapeutic approach(2010).
[0359]
8 hanayama r,t.m.,miwa k,shinohara a,iwamatsu a,nagata s. identification of a factor that links apoptotic cells to phagocytes. nature 417(6885):182-7(2002).
[0360]
9 miksa,m.,amin,d.,wu,r.,ravikumar,t.s.&wang,p. fractalkine-induced mfg-e8 leads to enhanced apoptotic cell clearance by macrophages.molecular medicine 13,553-560, doi:10.2119/2007-00019.miksa(2007).
[0361]
10 miksa,m.et al.maturation-induced down-regulation of mfg-e8 impairs apoptotic cell clearance and enhances endotoxin response. international journal of molecular medicine 22,743-748(2008).
[0362]
11 ferrero-miliani,l.,nielsen,o.h.,andersen,p.s.&girardin, s.e.chronic inflammation:importance of nod2 and nalp3 in interleukin-1beta generation.clinical and experimental immunology 147, 227-235,doi:10.1111/j.1365-2249.2006.03261.x(2007).
[0363]
12 a.h.,a.a.b.l."ch.2 innate immunity".in saunders(elsevier) (ed.)
.basic immunology.functions and disorders of the immune system (3rd ed.)(2009).
[0364]
13 hocking,p.m.,robertson,g.w.&gentle,m.j.effects of anti-inflammatory steroid drugs on pain coping behaviours in a model of articular pain in the domestic fowl.research in veterinary science 71,161-166,doi:10.1053/rvsc.2001.0510(2001).
[0365]
14 menkes,c.j.effects of disease-modifying anti-rheumatic drugs,steroids and non-steroidal anti-inflammatory drugs on acute-phase proteins in rheumatoid arthritis.british journal of rheumatology 32 suppl 3,14-18(1993).
[0366]
15 ohuchi,s.t.s.s.a review of mechanism of action of steroid and non-steroid anti-inflammatory drugs.in:willoughby d.a.,giroud j.p.(eds)inflammation:mechanisms and treatment.inflammation: mechanisms and treatment 4(1980).
[0367]
16 warden,s.j.prophylactic use of nsaids by athletes:a risk/benefit assessment.the physician and sportsmedicine 38,132-138, doi:10.3810/psm.2010.04.1770(2010).
[0368]
17 kumeji takeuchi,n.i.,noboru hasegawa,yoko yoshida,kenji yamada,hiroshi kogo,yoshio aizawa.inhibitory action of non-steroidal anti-inflammatory drugs on prostaglandin synthesis and release.folia pharmacologica japonica 76,525-531(1980).
[0369]
18 clausen,b.e.,burkhardt,c.,reith,w.,renkawitz,r.&forster, i.conditional gene targeting in macrophages and granulocytes using lysmcre mice.transgenic research(1999).
[0370]
19 zigmond,e.et al.ly6c hi monocytes in the inflamed colon give rise to proinflammatory effector cells and migratory antigen-presenting cells.immunity 37,1076-1090,doi:10.1016/j.immuni.2012.08.026 (2012).
[0371]
20 chassaing,b.,aitken,j.d.,malleshappa,m.&vijay-kumar, m.dextran sulfate sodium(dss)-induced colitis in mice.current protocols in immunology 104,unit 15 25, doi:10.1002/0471142735.im1525s104(2014)。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1