一种具有抗蛋白质吸附能力和适体修饰的干酪素纳米粒子及其制备方法与流程
本发明属于生物医药材料领域,具体涉及一种具有抗蛋白质吸附能力和适体修饰的干酪素纳米粒子及其制备方法。
背景技术:
纳米药物载体是指在纳米尺寸,用来负载药物的载体,通常的药物载体可以分为无机和有机两大类。无机类的纳米药物载体多以纳米金粒子和纳米二氧化硅为核,通过化学方法在表面修饰一些药物结合位点和靶向识别位点,以达到运载药物的目的,此类纳米药物载体由于其内核不可降解,注射到人体中不易排出,具有比较大的纳米毒性。有机类的纳米药物载体通常是以自组装,乳液聚合等方法合成的,相比与无机类纳米药物载体可以在人体内被降解,生物毒性要小,但其稳定性要低于无机类纳米药物载体。处于纳米尺寸的载体能够更好的进入到细胞中。
蛋白吸附是指当纳米药物载体进入到人体血清环境中,由于纳米粒子表面所带电荷和表面能的影响,而被血清中的生物大分子所包覆,丧失其靶向识别能力,并且很快会被血清中吞噬细胞排出体外。蛋白吸附能够降低药物的释放效率,从而影响药物的靶向效率。
抗蛋白吸附是指当纳米药物载体进入到人体血清环境中,不被生物大分子所吸附,仍然具有很好的靶向识别能力的特征。第一代抗蛋白吸附的纳米载体多以聚乙二醇为代表,在纳米金颗粒或者纳米二氧化硅表面修饰一层聚乙二醇的长链,由于聚乙二醇长链具有很高的亲水性,能够在纳米粒子表面形成一层水合层,能够有效的组织生物大分子的吸附,但此类纳米药物载体的稳定性较差,在一些高盐环境中容易发生聚集沉淀。第二代的抗蛋白吸附纳米药物载体是在纳米粒子表面修饰一层带正负离子对的结构,此类结构多以羧基甜菜碱和磺基甜菜碱为代表,使纳米粒子呈现电中性,表面的离子化官能团也能形成一层水合层,这种电中性的纳米药物载体具有较好的抗蛋白吸附能力,相比于第一代抗蛋白吸附纳米药物载体具有较好的稳定性,但其要求表面完全电中性,限制了其靶向官能团的引入,从而限制了靶向识别的能力以及药物负载的能力。
技术实现要素:
为了克服上述技术缺陷的不足,本发明设计了一种具有抗蛋白质吸附能力和适体修饰的干酪素纳米粒子及其制备方法。
为了达到上述目的,本发明提供一种具有抗蛋白质吸附能力和适体修饰的干酪素纳米粒子,关键在于:由干酪素纳米粒子经核酸适配体as1411表面修饰而成。
优选的,所述干酪素纳米粒子的粒径为90-100nm,多分散系数(pdi)为0.05-0.08。
优选的,所述干酪素纳米粒子采用以下方法制备而成:将丙烯酸、干酪素、碳酸钠和水投入反应釜中进行混合溶解,丙烯酸、干酪素和碳酸钠的质量比为1:(4-20):(1.6-8),将反应釜中通氮气保护,投入甲基丙烯酸甲酯进行预乳化,所述甲基丙烯酸甲酯与所述丙烯酸的质量比为(16-80):1,然后将体系温度升高至80℃,加入引发剂,进行聚合反应,制得所述干酪素纳米粒子。
优选的,溶解条件为:在体系温度为55℃下,将所述丙烯酸、碳酸钠和水混合溶解,然后加入所述干酪素进行混合溶解。
优选的,所述引发剂为叔丁基过氧化氢,所述叔丁基过氧化氢为干酪素质量的0.18%-0.54%。
一种具有抗蛋白质吸附能力和适体修饰的干酪素纳米粒子的制备方法,关键在于包括以下步骤:
步骤一、制备干酪素纳米粒子;
步骤二、将步骤一制得的干酪素纳米粒子,投入pbs缓冲溶液中进行分散,然后再加入1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(edc)和n-羟基琥珀酰亚胺-磺酸(nhs-sulfo)进行活化,离心洗涤后,除杂,得到活化后的干酪素纳米粒子;
步骤三、将步骤二制得活化后的干酪素纳米粒子,投入核酸适配体as1411溶液中进行偶联,纯化后,得到核酸适配体修饰的干酪素纳米粒子。
优选的,所述步骤二具体为:所述步骤二中所述干酪素纳米粒子、所述1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(edc)和n-羟基琥珀酰亚胺-磺酸(nhs-sulfo)的摩尔比为(400-800):3:(6-13)。
优选的,所述步骤三中所述核酸适配体as1411和所述活化干酪素纳米粒子的摩尔比为(1-3):(2-1),在37℃摇床中孵育过夜后,然后离心洗涤3-5次,将游离的核酸适配体as1411除去,得到核酸适配体修饰的干酪素纳米粒子。
优选的,所述步骤二中摇床活化条件为:37℃摇床以30-100转/分钟的转速活化10-20分钟,离心洗涤条件为:10000-13000转/分钟转速下离心15-30分钟。
优选的,所述步骤三中离心洗涤条件为:10000-13000转/分钟转速下离心30分钟。
本发明的有益效果是:本发明所提供的具有抗蛋白质吸附能力和适体修饰的干酪素纳米粒子的制备方法简易,经过核酸适配体表面修饰的干酪素纳米粒子无生物毒性,粒径小,单分散性好,稳定性优良,含有靶向识别基团,且具有优异的抗蛋白吸附能力,从而不会被血液中的生物大分子等包覆而丧失靶向识别能力,因此可以应用于高效靶向药物载体及肿瘤标记等对应用于药物载体方面有重大的意义。
附图说明
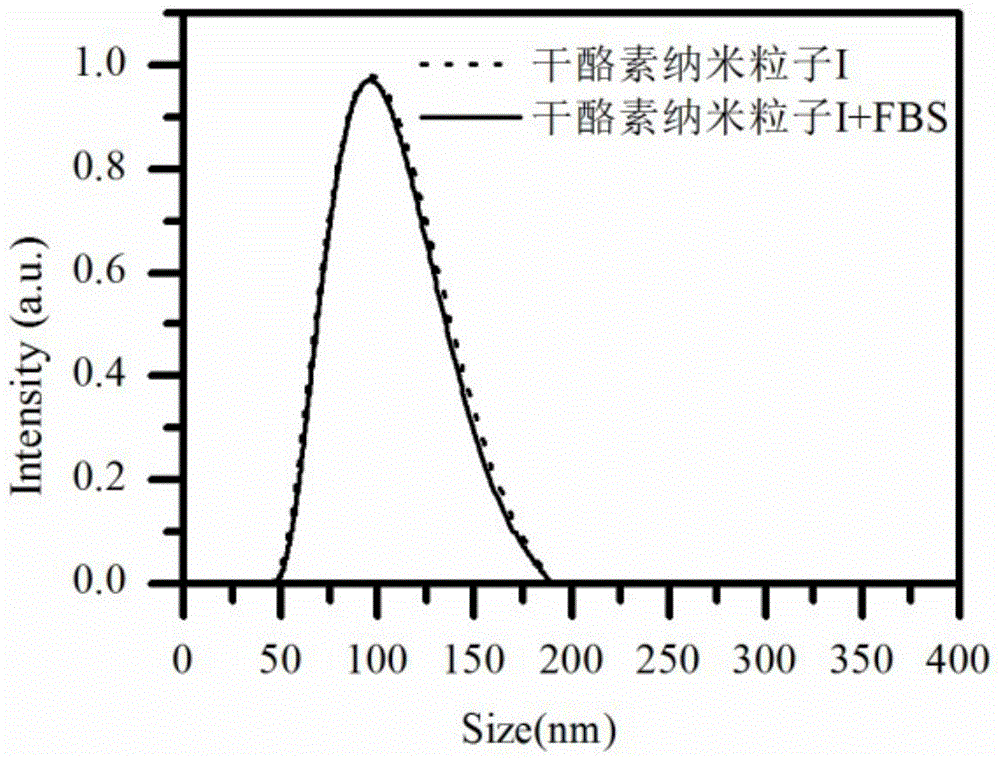
图1为核酸适配体修饰的干酪素纳米粒子及其加入胎牛血清(fbs)孵育后的粒径图;
图2为核酸适配体修饰的干酪素纳米粒子的dna尿素变性凝胶电泳显影图。
具体实施方法
实施例1一种具有抗蛋白质吸附能力和适体修饰的干酪素纳米粒子i的制备
步骤一、将0.8克碳酸钠、0.1克丙烯酸和90克超纯水投入反应釜中,温度设定为55℃,混合溶解,再加入2克干酪素,通氮气30分钟后,加入8克甲基丙烯酸甲酯,以1000转/分钟的转速预乳化30分钟后,再将转速调整至250转/分钟。升高温度至80℃,加入0.0036克叔丁基过氧化氢(tbhp)聚合2小时,即可得到粒径为93-97nm,多分散系数(pdi)为0.06的干酪素纳米粒子;
步骤二、将步骤一制得的干酪素纳米粒子,投入pbs缓冲溶液中进行分散,然后再加入1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(edc)和n-羟基琥珀酰亚胺-磺酸(nhs-sulfo)中充分分散均匀,所述干酪素纳米粒子、所述1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(edc)和n-羟基琥珀酰亚胺-磺酸(nhs-sulfo)的摩尔比为400:3:6,并在37℃摇床中以70转/分钟的转速活化20分钟,后以10000转/分钟的转速离心洗涤30分钟3次,以除去游离的1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(edc)和n-羟基琥珀酰亚胺-磺酸(nhs-sulfo),得到活化后的干酪素纳米粒子;
步骤三、将步骤二制得活化后的干酪素纳米粒子加入核酸适配体as1411溶液中,置于37度摇床中孵育过夜进行偶联,所述核酸适配体as1411和所述活化干酪素纳米粒子的摩尔比为1:2,在37℃摇床中孵育过夜后,再在10000转/分钟转速下离心30分钟,洗涤3次后,将游离的核酸适配体as1411除去,得到核酸适配体修饰的干酪素纳米粒子i。
实施例2一种具有抗蛋白质吸附能力和适体修饰的干酪素纳米粒子ii的制备
步骤一、将0.8克碳酸钠、0.5克丙烯酸和90克超纯水投入反应釜中,温度设定为55℃,混合溶解,再加入2克干酪素,通氮气30分钟后,加入8克甲基丙烯酸甲酯,以1000转/分钟的转速预乳化30分钟后,再将转速调整至250转/分钟。升高温度至80℃,加入5.6微升(0.0036克)叔丁基过氧化氢(tbhp)聚合2小时,即可得到粒径为96-99nm,多分散系数(pdi)为0.08的干酪素纳米粒子;
步骤二、将步骤一制得的干酪素纳米粒子,投入pbs缓冲溶液中进行分散,然后再加入1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(edc)和n-羟基琥珀酰亚胺-磺酸(nhs-sulfo)充分分散均匀,所述干酪素纳米粒子、所述1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(edc)和n-羟基琥珀酰亚胺-磺酸(nhs-sulfo)的摩尔比为800:3:13,并在37℃摇床中以70转/分钟的转速活化10分钟,后以10000转/分钟的转速离心洗涤30分钟3次,以除去游离的1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(edc)和n-羟基琥珀酰亚胺-磺酸(nhs-sulfo),得到活化后的干酪素纳米粒子;
步骤三、将步骤二制得活化后的干酪素纳米粒子加入核酸适配体as1411溶液中,置于37度摇床中孵育过夜进行偶联,所述核酸适配体as1411和所述活化干酪素纳米粒子的摩尔比为3:1,在37℃摇床中孵育过夜后,再在10000转/分钟转速下离心30分钟,洗涤3次后,将游离的核酸适配体as1411除去,得到核酸适配体修饰的干酪素纳米粒子ii。
实施例3一种具有抗蛋白质吸附能力和适体修饰的干酪素纳米粒子iii的制备
步骤一、将0.8克碳酸钠、0.1克丙烯酸和90克超纯水投入反应釜中,温度设定为55℃,混合溶解,再加入2克干酪素,通氮气30分钟后,加入8克甲基丙烯酸甲酯,以1000转/分钟的转速预乳化30分钟后,再将转速调整至250转/分钟。升高温度至80℃,加入0.0108克叔丁基过氧化氢(tbhp)聚合2小时,即可得到粒径为94-97nm,多分散系数(pdi)为0.06的干酪素纳米粒子;
步骤二、将步骤一制得的干酪素纳米粒子,投入pbs缓冲溶液中进行分散,然后再加入1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(edc)和n-羟基琥珀酰亚胺-磺酸(nhs-sulfo)充分分散均匀,所述干酪素纳米粒子、所述1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(edc)和n-羟基琥珀酰亚胺-磺酸(nhs-sulfo)的摩尔比为600:3:10,并在37℃摇床中以30转/分钟的转速活化10分钟,后以10000转/分钟的转速离心洗涤30分钟3次,以除去游离的1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(edc)和n-羟基琥珀酰亚胺-磺酸(nhs-sulfo),得到活化后的干酪素纳米粒子;
步骤三、将步骤二制得活化后的干酪素纳米粒子加入核酸适配体as1411溶液中,置于37度摇床中孵育过夜进行偶联,所述核酸适配体as1411和所述活化干酪素纳米粒子的摩尔比为1:1,在37℃摇床中孵育过夜后,再在10000转/分钟转速下离心30分钟,洗涤3次后,将游离的核酸适配体as1411除去,得到核酸适配体修饰的干酪素纳米粒子iii。
实施例4一种具有抗蛋白质吸附能力和适体修饰的干酪素纳米粒子iv的制备
步骤一、将0.8克碳酸钠、400微升(0.1克)丙烯酸和90克超纯水投入反应釜中,温度设定为55℃,混合溶解,再加入2克干酪素,通氮气30分钟后,加入8克甲基丙烯酸甲酯,以1000转/分钟的转速预乳化30分钟后,再将转速调整至250转/分钟。升高温度至80℃,加入5.6微升(0.0036克)叔丁基过氧化氢(tbhp)聚合2小时,即可得到粒径为95-97nm,多分散系数(pdi)为0.08的干酪素纳米粒子;
步骤二、将步骤一制得的干酪素纳米粒子,投入pbs缓冲溶液中进行分散,然后再加入1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(edc)和n-羟基琥珀酰亚胺-磺酸(nhs-sulfo)充分分散均匀,所述干酪素纳米粒子、所述1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(edc)和n-羟基琥珀酰亚胺-磺酸(nhs-sulfo)的摩尔比为500:3:8,并在37℃摇床中以100转/分钟的转速活化20分钟,后以13000转/分钟的转速离心洗涤20分钟3次,以除去游离的1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(edc)和n-羟基琥珀酰亚胺-磺酸(nhs-sulfo),得到活化后的干酪素纳米粒子;
步骤三、将步骤二制得活化后的干酪素纳米粒子加入核酸适配体as1411溶液中,置于37度摇床中孵育过夜进行偶联,所述核酸适配体as1411和所述活化干酪素纳米粒子的摩尔比为3:2,在37℃摇床中孵育过夜后,再在11000转/分钟转速下离心30分钟,洗涤3次后,将游离的核酸适配体as1411除去,得到核酸适配体修饰的干酪素纳米粒子iv。
对本发明制备的干酪素纳米粒子进行如下测试,以干酪素纳米粒子i为例:
将干酪素纳米粒子i与胎牛血清(fbs)在37℃的摇床中以70转/分钟的速度孵育30分钟,再离心纯化洗掉游离的血清。
(1)动态光散射(dls)粒径测量
测试结果表明:图1可得,干酪素纳米粒子的粒径在血清孵育前后没有发生变化,证明其有优异的抗蛋白吸附性能;
(2)dna尿素变性凝胶电泳显影测试:dna尿素变性凝胶电泳后,取出凝胶,加入100ml超纯水,并加入3μlgelred染料混匀,在超纯水中清洗2min,置于凝胶成像仪中选择核酸凝胶进行显影拍照。
测试结果表明:图2可得,1.离心洗涤后的纳米粒子,2.核酸适配体,3.dna-maker。3号条带只在上方有明显显影,说明几乎没有游离的核酸适配体存在,由于纳米粒子无法进入胶图中,所以核酸适配体与纳米粒子的偶联物只能存在于最上方,进而证明了干酪素纳米粒子成功被核酸适配体所修饰。
最后需要说明,上述描述仅为本发明的优选实施例,本领域的技术人员在本发明的启示下,在不违背本发明宗旨及权利要求的前提下,可以做出多种类似的表示,这样的变换均落入本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!