人参皂苷M1用于制造供治疗口腔癌的药物的用途的制作方法
相关申请
本申请主张于2018年4月17日提交的美国临时申请号62/658,732的利益,其全部内容通过引用并入本文。
本发明关于人参皂苷m1用于治疗口腔癌,特别是口腔鳞状细胞癌(oscc)的新用途。
背景技术:
根据中国台湾卫生部门最近的报告,口腔癌影响了大量处于经济生产年龄的患者,而每年中国台湾约有2300名平均年龄为58.3岁的男性死于口腔癌。口腔癌也是全世界常见的恶性肿瘤,并且口腔癌的发病率每年持续增加(murugan等,2012)。口腔癌的常用疗法有关于以下一种或多种形式:手术、化学疗法及放射疗法。不幸的是,尽管临床管理有进展,存活率仍然低(petti和scully,2007;tsantoulis等,2007)。此外,一些抗癌治疗具有毒性副作用(例如,对正常牙龈上皮样细胞的毒性损害),并且经历抗癌治疗的患者通常遭受低生活质量甚至危及生命的并发症。这强烈强调了发现和开发新的有效治疗方法以改善口腔癌患者预后的重要性,尤其是减少副作用。
已知人参的主要活性成分人参皂苷具有多种药理活性,例如抗肿瘤、抗疲劳、抗过敏及抗氧化活性。人参皂苷具有基本结构,由具有17个碳原子排列成四环的性脂烷(gonane)类固醇核组成。人参皂苷在体内金属化,而最近的一些研究表明,人参皂苷代谢物,而不是天然存在的人参皂苷,很容易被人体吸收并充当活性成分。其中,经由人类肠道细菌的绞股蓝皂苷途径(gypenosidepathway),人参皂苷m1已知为原人参二醇型(protopanaxadiol-type)人参皂苷的一种代谢产物。迄今为止,并无先前技术参考文献报导了人参皂苷m1在治疗口腔癌中的效用。
技术实现要素:
本发明中,非可预期地发现人参皂苷m1能有效抑制口腔癌细胞的生长、群落形成及迁移,并减少口腔癌动物中的肿瘤生长。特别是,发现人参皂苷m1对口腔癌细胞具有选择性毒性,因此其可以有效治疗口腔癌而对正常的牙龈上皮样细胞毒性较小的定量投予。因此,本发明提供了一种通过投予人参皂苷m1作为抗癌剂及/或癌转移抑制剂来治疗个体口腔癌的新方法,其具有较少的副作用。
特别地,本发明提供了治疗有需要的个体的口腔癌的方法,包含向个体投予有效治疗个体的量的人参皂苷m1。
特定而言,本发明的治疗方法能有效抑制口腔癌细胞的生长或移转。本发明的治疗方法亦有效于减少患有口腔癌的个体中的肿瘤生长。
在一些具体实施例中,本发明的治疗方法包含以对口腔癌细胞选择性毒性的量投予人参皂苷m1。
在一些具体实施例中,口腔癌细胞为口腔鳞状细胞癌(oscc)。
在一些具体实施例中,人参皂苷m1通过肠胃外或肠内途径而投予。
本发明还提供了人参皂苷m1用于制备治疗有需要的个体的口腔癌的药物的用途。本发明进一步提供包含人参皂苷m1的组合物,其用于治疗有需要的个体的口腔癌。
下面的描述中阐述了本发明的一或多个具体实施例的细节。由以下对若干具体实施例的详细描述以及由所附申请专利范围,本发明的其他特征或优点将显而易见。
附图说明
当结合附图阅读时,将更佳地理解前述发明内容以及本发明的以下详细描述。出于说明本发明的目的,在图式中显示出目前较佳的具体实施例。然而应理解的是,本发明不限于所示的精确安排及手段。
在图式中:
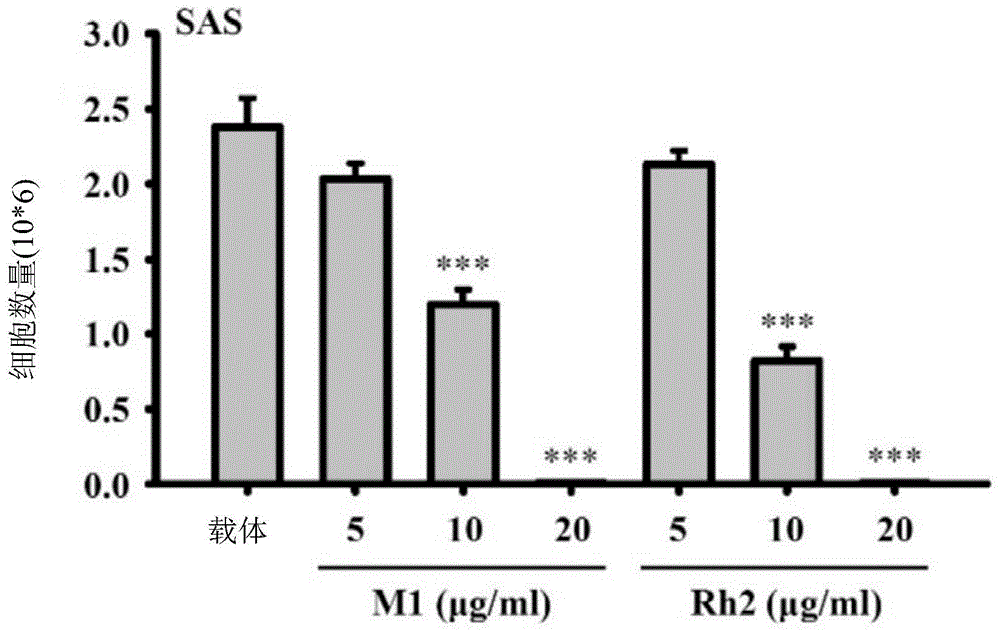
图1a-1b显示人参皂苷m1抑制人类口腔癌细胞的存活力。将人类口腔癌细胞株sas细胞(图1a)或oecm-1细胞(图1b)与人参皂苷m1(5~20μg/ml)、人参皂苷rh2(5~20μg/ml)或载体(0.1%dmso)一起培育24小时。通过台盼蓝排除法计数活细胞数。数据表示为平均值±sd;n=3。*,**和***分别表示与载体对照细胞相比在p<0.05,p<0.01和p<0.001上的显著差异。(dunnett多重比较检验的单因子变异数分析)。
图2显示人参皂苷m1对正常人类牙龈上皮样细胞的毒性低于人参皂苷rh2。将人类正常的人类牙龈上皮样细胞株sg细胞与人参皂苷m1(5~20μg/ml)、人参皂苷rh2(5~20μg/ml)或载体(0.1%dmso)一起培育24小时。通过台盼蓝排除法计数活细胞数。数据表示为平均值±sd;n=3。**和***分别表示与载体对照细胞相比在p<0.01和p<0.001上的显著差异。(dunnett多重比较检验的单因子变异数分析)。
图3a-3d显示人参皂苷m1诱导人类口腔癌细胞的凋亡。将人类口腔癌细胞株oecm-1细胞与人参皂苷m1(10-20μg/ml),50μm顺铂(cistaplatin,cddp)或载体(0.1%dmso)一起培育24小时。(图3a)通过使用流式细胞仪的末端脱氧核苷酸转移酶dutp缺口末端标记(tunel)测定,测定凋亡dna断裂。(图3b)通过使用流式细胞仪的pi染色,确定细胞周期分布。(图3c)通过使用流式细胞仪的pi/膜联蛋白v双染色测定法,测量凋亡程度。(图3d)通过使用西方墨点法侦测凋亡蛋白酶原-9(pro-caspase-9)和凋亡蛋白酶原-3的降解,测量凋亡蛋白酶-9(caspase-9)和凋亡蛋白酶-3的活化程度。流式细胞仪和西方墨点法结果代表三种不同的实验,直方图显示这三个实验定量表示为平均值±sd。**和***分别表示与载体对照细胞相比在p<0.01和p<0.001上的显著差异。(dunnett多重比较检验的单因子变异数分析)。
图4a-4b显示人参皂苷m1降低了人类口腔癌细胞的群体形成能力。将人类口腔癌细胞株sas细胞(图4a)或oecm-1细胞(图4b)与人参皂苷m1(5~20μg/ml)或载体(0.1%dmso)一起培育10天。将细胞在4%冰冷的多聚甲醛中固定,并用0.1%结晶紫来染色,并对群体计数。数据表示为平均值±sd;n=4。*和***分别表示与载体对照细胞相比在p<0.05和p<0.001上的显著差异。(dunnett多重比较检验的单因子变异数分析)。
图5a-5b显示人参皂苷m1降低了人类口腔癌细胞的迁移能力。将人类口腔癌细胞株sas细胞(图5a)或oecm-1细胞(图5b)在6公分培养皿中培养,直至细胞达到100%聚集形成单层。通过使用无菌的200μl移液管尖端刮擦产生透明区域。将细胞与人参皂苷m1(5~10μg/ml)或(0.1%dmso)一起培育24小时(sas细胞)或18小时(oecm-1细胞)。测量迁移距离并与载体对照细胞比较。数据表示为平均值±sd;n=3。***表示与载体对照细胞相比在p<0.001上的显著差异。(dunnett多重比较检验的单因子变异数分析)。
图6a-6c显示口服投予人参皂苷m1减少小鼠中人类口腔癌的生长。人类口腔癌细胞株sas细胞肿瘤大小约40~60mm3的异种移植小鼠被每天口服投予人参皂苷m1(30-90mg/kg)或载体连续5天。(图6a)通过测量肿瘤的长度(l)和宽度(w)确定肿瘤体积,并计算为肿瘤体积(mm3)=(lxw2)/2。(图6b)在小鼠被牺牲以后测量肿瘤重量。(图6c)记录小鼠的体重。数据表示为平均值±sd;n=6。**和***分别表示与载体对照小鼠相比在p<0.01和p<0.001上的显著差异。(dunnett多重比较检验的单因子变异数分析)。
图7a-7c显示皮下(sc)注射人参皂苷m1减少小鼠中人类口腔癌的生长。人类口腔癌细胞株sas细胞肿瘤大小约40~60mm3的异种移植小鼠被每天sc注射人参皂苷m1(20mg/kg)或载体连续5天。(图7a)通过测量肿瘤的长度(l)和宽度(w)确定肿瘤体积,并计算为肿瘤体积(mm3)=(lxw2)/2。(图7b)在小鼠被牺牲以后测量肿瘤重量。(图7c)记录小鼠的体重。数据表示为平均值±sd;n=6。**表示与载体对照小鼠相比在p<0.01上的显著差异。(dunnett多重比较检验的单因子变异数分析)。
具体实施方式
除非另外定义,否则本文使用的所有技术和科学术语具有本发明所属领域的技术人员通常理解的含义。如本文所用,除非另有说明,否则以下术语具有归属于它们的含义。
本文使用的冠词“一”和“一个”指的是冠词的一个或多于一个(即,至少一个)语法对象。举例来说,“一元素”表示一个元素或多于一个元素。
“包含(comprise)”或“包含(comprising)”等词通常以包括(include/including)的含义使用,其意味着允许存在一种或多种特征、成分或要素。“包含(comprise)”或“包含(comprising)”等词包括“组成了”或“由......组成”等词。
细胞凋亡是抗癌药物媒介细胞死亡的重要机制之一。其由两种主要途径诱导:线粒体(内在)途径和死亡受体(外在)途径。线粒体途径通过从线粒体向胞质液中释放促凋亡因子(proapoptoticfactor),例如细胞色素c和凋亡诱导因子,而被活化。线粒体外膜通透性受bcl-2家族蛋白调节,bcl-2家族蛋白是细胞色素c释放与凋亡蛋白酶活化的中心调节剂(martinou和youle,2011)。从线粒体释放后,细胞色素c可与datp和凋亡蛋白酶活化因子-1结合,导致凋亡蛋白酶-9和凋亡蛋白酶-3的活化。活化的凋亡蛋白酶-3切割各种基质,包括聚(adp-核糖)聚合酶(parp),一种dna修复酶,从而导致不可避免的细胞死亡(green和reed,1998)。死亡受体途径有关于fas和肿瘤坏死因子受体家族的其他成员,触发凋亡蛋白酶-8活化(thorburn,2004)。凋亡蛋白酶-8直接活化凋亡蛋白酶-3并切割bid,然后触发线粒体途径(yin,2000)。在经历抗癌药物治疗的细胞中,通常在细胞凋亡过程中观察到活性含氧物(ros)的产生(meshkini和yazdanparast,2012)。增加的ros量可能导致dna损伤,并且这些受损细胞随后经历细胞周期停滞以促进dna修复,或诱导细胞凋亡以消除过度受损的细胞(norbury和zhivotovsky,2004)。dna损伤可能通过通过直接刺激p21waf1/cip1(细胞周期蛋白依赖性酶抑制剂(cdks))的表现来抑制g1/s和g2/m两者转换,从而活化p53依赖性细胞凋亡(vousden和lu,2002)。dna损伤也可能活化蛋白酶atm和atr,其随后触发蛋白酶chk1和chk2的活化,而蛋白酶chk1和chk2通过去活化cdc25(通常活化cdc2的磷酸酶)来抑制cdc2(canton和scott,2010)。
本发明中,非可预期地发现人参皂苷m1可抑制口腔癌细胞的生长和迁移。本发明中还证明,人参皂苷m1在患有口腔癌的动物模型中有效减少肿瘤生长。特定而言,人参皂苷m1在诱导口腔癌细胞的凋亡和降低迁移活性的同时,抑制存活力和群落形成是有效的。这些结果表明人参皂苷m1可预防和减轻口腔癌。更特定而言,人参皂苷m1对口腔癌细胞具有选择性毒性,因此可以有效杀死口腔癌细胞而对正常细胞(例如:正常的牙龈上皮样细胞)的毒性较小的定量投予。
因此,本发明提供了一种治疗有此需要的个体的口腔癌的方法,包含向个体投予有效治疗个体的量的人参皂苷m1。本发明还提供了一种人参皂苷m1用于制备治疗有需要的个体的口腔癌的药物的用途。本发明进一步提供一种包含人参皂苷m1的组合物,其用于治疗有需要的个体的口腔癌。
在一些具体实施例中,治疗方法有效抑制口腔癌细胞的生长。特定而言,治疗方法有效抑制口腔癌细胞的存活力和群落形成及/或诱导细胞凋亡。
在一些具体实施例中,治疗方法有效抑制口腔癌细胞的迁移。
人参皂苷m1、20-o-β-d-吡喃葡萄糖基-20(s)-原人参二醇为本领域已知的皂苷代谢物之一。人参皂苷m1的化学结构如下:
经由人类肠道细菌的绞股蓝皂苷途径,人参皂苷m1已知为原人参二醇型人参皂苷的一种代谢产物。摄入后可在血液或尿液中发现人参皂苷m1。人参皂苷m1可通过本领域已知的方法通过真菌发酵从人参植物制备,例如中国台湾专利申请号094116005(i280982)和美国专利号7,932,057,其全部内容通过引用并入本文。在某些具体实施例中,用于制备人参皂苷m1的人参植物包括五加科(araliaceae),人参(panax)属,例如,人参属(p.ginseng)及假人参属(p.pseudo-ginseng)(也称为三七)。通常,制备人参皂苷m1的方法包括以下步骤:(a)提供人参植物材料(例如叶子或茎)的粉末;(b)提供用于发酵人参植物材料的真菌,其中发酵温度范围为20-50℃,发酵湿度范围为70-100%,ph值范围为4.0-6.0,发酵周期范围为5-15天;(c)萃取并收集发酵产物;以及(d)从发酵产物中分离20-o-β-d-吡喃葡萄糖基-20(s)-原人参二醇。
当在本发明中将人参皂苷m1描述为“分离的”或“纯化的”时,应理解为不是绝对地分离或纯化,而是相对地分离或纯化。例如,纯化的人参皂苷m1是指与其天然存在的形式相比更纯化的人参皂苷。在一具体实施例中,包含纯化的人参皂苷m1的制剂可包含总制剂的大于50%、大于60%、大于70%、大于80%、大于90%或100%(w/w)的人参皂苷m1。应理解,当在本文中使用一定数量以显示比率或剂量时,该数量通常包括正负10%的范围,或更特定而言,该数量的正负5%的范围。
本文使用的“个体”或“受试者”等词包括人与非人动物,例如宠物(例如狗、猫等)、农畜(如牛、羊、猪,马等)、或实验动物(如大鼠,小鼠,天竺鼠等)。
本文所用的“治疗”一词是指施用或投予包括一或多种活性剂的组合物给患有失调、失调的症状或病症、失调的进展或有发展失调的风险的个体,目的是治疗、治愈、减轻、缓解、改变、补救、改善、增进或影响失调、失调的症状或病症、由失调引起的残疾、或失调的发作或进展。
本文所用的“副作用”一词是指由抗癌治疗所诱导的不良作用。具体而言,对于口腔癌治疗来说,所产生的副作用包括例如对正常牙龈上皮样细胞的毒性损伤。
本文使用的“治疗有效量”一词是指对受治疗的个体赋予治疗效果的活性成分的量。例如,用于治疗癌症的成分的有效量是能够抑制癌细胞生长或迁移的这种成分的量。特定而言,与未用这种成分治疗的目标癌细胞的数量相比,这样的量有效地将目标癌细胞的数量减少至少10%,例如20%、30%、40%、50%、60%、70%、80%、90%或100%。较佳地,这样的量对目标癌细胞具有选择性毒性。在一些具体实施例中,该成分的投予量选择性地对目标癌细胞提供比对正常细胞更多的毒性。例如,在某些实例中,该成分可以这样的量投予,其有效地减少目标癌细胞数量,与未用该成分治疗的目标癌细胞的数量相比,减少超过50%(例如,60%、70%、80%、90%或100%),同时对正常细胞引发的毒性较小,例如,与未用该成分治疗的正常细胞的数量相比,减少正常细胞的数量少于50%(例如40%、30%、20%、10%或更少)。
治疗有效量可根据各种原因而改变,例如投予途径和频率、接受该药物的个体的体重和种类、以及投予目的。本领域技术人员可基于本文的揭示、已建立的方法、及其自身经验确定每种情况下的剂量。例如,在某些具体实施例中,用于本发明的人参皂苷m1的口服剂量为每天10至1000mg/kg。在一些实例中,口服本发明中使用的人参皂苷m1的口服剂量为每日100至300mg/kg、每日50至150mg/kg、每日25至100mg/kg、每日10至50mg/kg,或每日5至30mg/kg。此外,在本发明的一些具体实施例中,定期地投予人参皂苷m1一段时间,例如,每日投予至少15天、一个月或两个月或更长时间。
根据本发明,人参皂苷m1可用作治疗口腔癌的活性成分。在一具体实施例中,治疗有效量的活性成分可与医药上可接受的载体一起配制成适当形式的医药组合物,以达递送和吸收的目的。取决于投予模式,本发明的医药组合物较佳包含约0.1%重量至约100%重量的活性成分,其中重量百分比是基于整个组合物的重量而计算。
如本文所用,“医药上可接受的”意指载体与组合物中的活性成分兼容,并且较佳地可稳定该活性成分并且对接受治疗的个体来说是安全的。该载体可为活性成分的稀释剂、载体、赋形剂或基质。合适的赋形剂的一些实例包括乳糖、右旋糖、蔗糖、山梨糖、甘露糖、淀粉、阿拉伯胶、磷酸钙、藻酸盐、黄蓍胶(tragacanthgum)、明胶、硅酸钙、微晶纤维素、聚乙烯吡咯烷酮、纤维素、无菌水、糖浆和甲基纤维素。该组合物可另外包含润滑剂,例如滑石、硬脂酸镁和矿物油;润湿剂;乳化和悬浮剂;防腐剂,如甲基和丙基羟基苯甲酸酯;甜味剂;及调味剂。本发明的组合物可在投予患者后提供活性成分快速、持续或延迟释放的效果。
根据本发明,该组合物的形式可为片剂、丸剂、粉末、锭剂、小包、药片、酏剂、悬浮液、洗剂、溶液、糖浆、软和硬明胶胶囊、栓剂、无菌注射液和包装粉末。
本发明的组合物可经由任何生理学上可接受的途径递送,例如口服、肠胃外(例如肌肉内、静脉内、皮下和腹膜内)、透皮、栓剂和鼻内方法。关于肠胃外投予,较佳以无菌水溶液的形式使用,其可包含足以使溶液与血液等渗透压的其他物质,例如盐或葡萄糖。根据需要,水溶液可适当地缓冲(较佳ph值为3至9)。在无菌条件下制备合适的肠胃外组合物可用本领域技术人员熟知的标准药理学技术完成,并且不需要额外的创造性劳动。
根据本发明,人参皂苷m1或包含人参皂苷m1作为活性成分的组合物可用于治疗患有口腔癌或有口腔癌风险的个体。特定而言,人参皂苷m1或包含人参皂苷m1作为活性成分的组合物可投予患有口腔癌的个体或有患口腔癌风险的个体,以有效抑制口腔癌细胞生长或迁移的量,以防止疾病的发生或改善症状或推迟症状的恶化。口腔癌的一特定实例为口腔鳞状细胞癌(oscc)。在一些较佳具体实施例中,人参皂苷m1或包含根据本发明的人参皂苷m1的组合物以对口腔癌细胞具有选择性毒性但对正常细胞毒性较小的量而投予。
通过以下实施例进一步说明本发明,提供这些实例是为了说明的目的而非限制。根据本揭示,本领域技术人员应当理解,在不脱离本发明的精神和范畴的情况下,可对所揭示的具体实施例进行许多改变并仍然获得相同或相似的结果。
实施例
通过本领域已知的方法制备人参皂苷m1、20-o-β-d-吡喃葡萄糖基-20(s)-原人参二醇,例如在中国台湾专利申请号094116005(i280982)及美国专利号7,932,057中描述的。
在本研究中,我们已研究人参皂苷m1在体外和体内的功效和相关机制。我们证明人参皂苷m1剂量依赖地抑制人类osccsas和oecm-1细胞的存活力,具有与人参皂苷rh2相似的功效。值得注意的是,人参皂苷m1对正常人类牙龈上皮样细胞株sg的毒性低于人参皂苷rh2。为了进一步了解人参皂苷m1的作用模式,进行了针对细胞凋亡的标志的四种测定,即(1)通过末端脱氧核苷酸转移酶dutp缺口末端标记(tunel)测定法测定凋亡dna断裂,(2)在碘化丙啶(propidiumiodide,pi)染色核之后,通过流式细胞仪检测细胞周期,(3)pi/annexinv双染色试验,及(4)凋亡蛋白酶活化。我们证明了人参皂苷m1在oecm-1和sas细胞中显著增加凋亡dna断裂、g1期阻滞(g1phasearrest)、pi/annexinv双阳性染色和凋亡蛋白酶-3/9活化。此外,我们证明了人参皂苷m1剂量依赖性地抑制了sas和oecm-1细胞的群体形成和迁移能力。此外,口服投予或皮下注射人参皂苷m1显著降低了sas异种移植小鼠中的肿瘤生长。这些结果表明人参皂苷m1可发展成对抗oscc的潜在治疗剂。
实施例1:人参皂苷m1抑制人类口腔癌细胞的存活力
每个6公分培养皿平铺有5×105个人类口腔癌细胞sas于2ml培养基中,并在5%co2培养箱中在37℃下生长过夜。将细胞与人参皂苷m1(5~20μg/ml)、人参皂苷rh2(5~20μg/ml)或载体一起培育24小时。每组含有0.1%的最终dmso浓度。此后,通过台盼蓝排除法计数细胞数。我们发现人参皂苷m1和人参皂苷rh2剂量依赖地抑制人类口腔癌sas细胞(图1a)和人类口腔癌oecm-1细胞的细胞数(图1b)。这些结果表明,人参皂苷m1和人参皂苷rh2均抑制人类口腔癌细胞的存活力;然而,人参皂苷m1和人参皂苷rh2之间没有显著差异。数据表示为平均值±sd;n=3。*,**和***分别表示与载体对照细胞相比在p<0.05,p<0.01和p<0.001上的显著差异。(dunnett多重比较检验的单因子变异数分析)。
实施例2:人参皂苷m1显示出对正常人类牙龈上皮样细胞的毒性低于人参皂苷rh2
每个6公分培养皿平铺有5×105个正常人类牙龈上皮样细胞株sg于2ml培养基中,并在5%co2培养箱中在37℃下生长过夜。将细胞与人参皂苷m1(5~20μg/ml)、人参皂苷rh2(5~20μg/ml)或载体一起培育24小时。每组含有0.1%的最终dmso浓度。此后,通过台盼蓝排除法计数细胞数。我们发现人参皂苷m1显示出对sg细胞的毒性低于人参皂苷rh2(图2)。20μg/ml的人参皂苷rh2完全杀死sg细胞;然而,与对照细胞相比,20μg/ml的人参皂苷m1仅减少了50%的细胞数(即保留了至少50%的正常细胞)(图2)。数据表示为平均值±sd;n=3。**和***分别表示与载体对照细胞相比在p<0.01和p<0.001上的显著差异。(dunnett多重比较检验的单因子变异数分析)。
实施例3:人参皂苷m1诱导人类口腔癌细胞的凋亡
为了进一步了解人参皂苷m1的作用模式,进行了针对细胞凋亡的标志的三种测定,即(1)通过末端脱氧核苷酸转移酶dutp缺口末端标记(tunel)测定法测定凋亡dna断裂,(2)在碘化丙啶(pi)染色核之后,通过流式细胞仪检测细胞周期,(3)pi/annexinv双染色试验,和(4)凋亡蛋白酶活化。每个6公分培养皿平铺有1×106个人类口腔癌细胞oecm-1于2ml培养基中,并在5%co2培养箱中在37℃下生长过夜。将细胞与人参皂苷m1(10-20μg/ml)、50μm顺铂(cistaplatin,cddp)或载体一起培育24小时。每组含有0.1%的最终dmso浓度。此后,进行三次测定。我们发现是20μg/ml人参皂苷m1和50μmcddp,而不是10μg/ml人参皂苷m1,会显著诱导oecm-1细胞中的凋亡dna断裂(图3a)。此外,测定人参皂苷m1对oecm-1细胞的细胞周期分布的影响,我们发现用人参皂苷m1和cddp处理后,g1期细胞以浓度依赖性方式增加,与对照细胞相比,同时降低s和g2/m期细胞的百分比,表明人参皂苷m1和cddp在g1期诱导细胞周期停滞(图3b)。用人参皂苷m1和cddp处理后,亚g1期细胞增加。(图3b)。此外,我们发现是20μg/ml人参皂苷m1和50μmcddp,而不是10μg/ml人参皂苷m1,会显著增加具有pi/annexinv双阳性染色的oecm-1细胞的百分比(图3c)。这些结果表明,人参皂苷m1在浓度为20μg/ml时显著诱导人类口腔癌细胞oecm-1凋亡。人类口腔癌sas细胞中人参皂苷m1的凋亡诱导活性被证实为人参皂苷m1以剂量依赖性方式诱导凋亡蛋白酶-3和凋亡蛋白酶-9前驱物的减少,表明凋亡蛋白酶-3和凋亡蛋白酶-9被人参皂苷m1活化(图3d)。数据表示为平均值±sd;n=3。**和***分别表示与载体对照细胞相比在p<0.01和p<0.001上的显著差异。(dunnett多重比较检验的单因子变异数分析)。
实施例4:人参皂苷m1降低人类口腔癌细胞的群体形成能力
每个6公分培养皿平铺有150个人类口腔癌细胞sas或oecm-1于3ml培养基中,并在5%co2培养箱中在37℃下生长过夜。将细胞与人参皂苷m1(5~20μg/ml)或载体一起培育10天。在第5天将细胞更换为含有相同浓度人参皂苷m1的新鲜培养基。将细胞在4%冰冷的多聚甲醛中于37℃固定15分钟,并在室温下用0.1%结晶紫染色10分钟。对菌落进行计数,我们发现人参皂苷m1剂量依赖地抑制sas细胞(图4a)和oecm-1细胞(图4b)的群体形成能力。数据表示为平均值±sd;n=4。*和***分别表示与载体对照细胞相比在p<0.05和p<0.001上的显著差异。(dunnett多重比较检验的单因子变异数分析)。
实施例5:人参皂苷m1降低人类口腔癌细胞的迁移能力
通过伤口愈合测定法测量细胞迁移能力。每个6公分培养皿平铺有5×106个人类口腔癌sas细胞或oecm-1细胞于2ml培养基中,并在5%co2培养箱中37℃下生长过夜,直至细胞达到100%聚集形成单层。我们使用无菌的200μl移液管尖端在培养皿上产生划痕的透明区域,并且通过位相差显微镜(phasecontrastmicroscope)拍摄的伤口作为基线。将细胞与人参皂苷m1(5~10μg/ml)或载体一起培育24小时(sas细胞)或18小时(oecm-1细胞),然后再次拍照伤口。我们发现5或10μg/ml的人参皂苷m1显著抑制人类口腔癌细胞sas(图5a)和oecm-1细胞(图5b)的迁移能力。数据表示为平均值±sd;n=3。***表示与载体对照细胞相比在p<0.001上的显著差异。(dunnett多重比较检验的单因子变异数分析)。
实施例6:人参皂苷m1减少小鼠中的人类口腔癌生长
为了评估体内人参皂苷m1的抗癌活性,使用人类口腔癌异种移植物。6周龄雄性先天性无胸腺balb/c裸(nu/nu)小鼠购自biolascotaiwanco.,ltd(宜兰,中国台湾),并放置在受控温度(23±3℃)和相对湿度(50±5%)的房间内。根据nih实验动物护理和使用指南,经中国台湾宜兰大学机构动物护理和使用委员会(批准号:第106-13号)批准进行动物实验。通过在裸鼠背部皮下(sc)注射2×106个人类口腔癌细胞sas(在75μlpbs+75μl基质胶中)建立异种移植小鼠。在肿瘤大小达到约40~60mm3后,将小鼠随机分成6组(每组6只小鼠):(1)口服载体对照;(2)口服30mg/kg人参皂苷m1;(3)口服60mg/kg人参皂苷m1;(4)口服90mg/kg人参皂苷m1;(5)sc载体对照;(6)sc20mg/kg人参皂苷m1。给小鼠每天口服投予或sc注射载体或人参皂苷m1连续5天。在接受最后一剂人参皂苷m1或载体后24小时,将小鼠牺牲。通过测量肿瘤的长度(l)和宽度(w)来确定肿瘤体积(tv)。第n天的肿瘤体积(tvn)计算为tv(mm3)=(lxw2)/2。第n天与第0天的相对肿瘤体积(rtvn)根据下式表示:rtvn=tvn/tv0。我们发现,与载体对照组相比,口服投予90mg/kg的人参皂苷m1显著降低肿瘤大小;然而,口服投予30和60mg/kg的人参皂苷m1并没有显著降低肿瘤大小(图6a)和肿瘤重量(图6b)。口服投予人参皂苷m1不会显著影响小鼠的体重(图6c)。数据表示为平均值±sd;n=6。**和***分别表示与载体对照小鼠相比在p<0.01和p<0.001上的显著差异。(dunnett多重比较检验的单因子变异数分析)。
此外,与载体对照组相比,sc注射20mg/kg人参皂苷m1亦显著降低肿瘤大小(图7a)和肿瘤重量(图7b)。sc注射人参皂苷m1不会显著影响小鼠的体重(图7c)。数据表示为平均值±sd;n=6。**表示与载体对照小鼠相比在p<0.01上的显著差异。(dunnett多重比较检验的单因子变异数分析)。
参考文献
cantonda,scottjd.(2010)chk-inginandchk-ingout:kinasecompartmentalizationcomestocheckpointcontrol.molcell40:1-2.
greendr,reedjc.(1998)mitochondriaandapoptosis.science281:1309-1312.
martinoujc,youlerj.(2011)mitochondriainapoptosis:bcl-2familymembersandmitochondrialdynamics.devcell21:92-101.
meshkinia,yazdanparastr.(2012)involvementofoxidativestressintaxol-inducedapoptosisinchronicmyelogenousleukemiak562cells.exptoxicolpathol64:357-365.
muruganak,munirajanak,tsuchidan.(2012)rasoncogenesinoralcancer:thepast20years.oraloncol48:383-392.
norburycj,zhivotovskyb.(2004)dnadamage-inducedapoptosis.oncogene23:2797-2808.
pettis,scullyc.(2007)oralcancerknowledgeandawareness:primaryandsecondaryeffectsofaninformationleaflet.oraloncol3:408-415.
thorburna.(2004)deathreceptor-inducedcellkilling.cellularsignalling16:139-144.
tsantoulispk,kastrinakisng,tourvasad,laskarisg,gorgoulisvg.(2007)advancesinthebiologyoforalcancer.oralonc.43:523-534.
vousdenkh,lux.(2002)liveorletdie:thecell'sresponsetop53.natrevcancer2:594-604.
yinxm.(2000)signaltransductionmediatedbybid,apro-deathbcl-2familyproteins,connectsthedeathreceptorandmitochondriaapoptosispathways.cellresearch10:161-167.
- 还没有人留言评论。精彩留言会获得点赞!