用于高尿酸血症和痛风性关节炎的N-酰化透明质酸的制作方法
本发明涉及透明质酸衍生物,尤其涉及透明质酸的n-乙酰基被取代的衍生物,及其制备方法和用途。
背景技术:
透明质酸是广泛分布于动物组织内的糖胺聚糖,由n-乙酰氨基葡萄糖(n-acetyl-2-amidoglucose)和葡萄糖醛酸交替的单糖单元组成。透明质酸具有多种功能,包括水合作用、为细胞的迁移提供基质以及润滑关节。完整无损的透明质酸具有大于1000kda的高分子量,但可以以较低分子量的形式存在,例如,100–250kda。完整无损的透明质酸通常从鸡冠或细菌中商业获取。高分子量透明质酸具有高粘度,这对关节的润滑性能十分重要。然而,与较小分子量透明质酸相比,分子量大于1000kda的透明质酸的尺寸和可能的折叠对细胞受体和相互影响的基质大分子组织表现出不同的物理化学环境。通常认为组织中的高分子量透明质酸被酶降解为较低分子量片段。
人类的先天免疫力通过toll样(toll-like)受体或tlr调解。组成性活性tlr4突变体可以诱导nf-kappab活化,从而促进促炎性细胞因子的产生(medzhitov,r.etal.(1997)nature388:394)。先天免疫系统对细菌脂多糖(lps)的识别会导致炎症反应,其特点在于产生了细胞因子,例如tnf、il-1、il-6和il-8,以及icam-1的基因激活(luy.c.etal.cytokine.(2008)42:145-151)。透明质酸能够结合细胞膜受体cd44和许多蛋白质基质,尤其是蛋白多糖核心蛋白连接域(linkdomain)。已报道,cd44可上调许多类型的炎症性关节炎,例如类风湿性关节炎。较小分子量的透明质酸能够与cd44相互作用,激活细胞参与炎症性疾病并影响基质分子,而高分子量透明质酸通常不会发生这种情况(hortonmr.etal.jbiolchem1998vol.273,no.52,35088–35094)。在慢性炎症病症中,许多细胞因子被诱导并具有较高含量。针对这些细胞因子的人源化单克隆抗体可用于慢性炎症病症的治疗中。
痛风是一种与慢性高尿酸血症相关的代谢性和炎症性综合症,其特征是在关节和组织中沉积单钠尿酸盐(msu)晶体。降低尿酸的血清含量、溶解msu晶体并抑制炎症反应被认为是治疗痛风的关键临床任务。
痛风是最普遍的代谢紊乱性疾病之一,伴有血液中的高含量的尿酸以及在关节和组织中的单钠尿酸盐(msu)晶体沉淀。关节肿胀和过敏性疼痛是痛风发作的主要症状。在不进行治疗的情况下,由于进行性(progressive)关节组织退化和骨质退化而引起剧烈的疼痛和僵硬,急性痛风发作会再次发生。由于持续性高尿酸血症,尿酸晶体也可以在组织中沉积,导致痛风石性痛风。此外,痛风有可能导致细胞因子过度生产、全身性凝血、器官衰竭和死亡。
痛风性关节炎的主要发病机制是:单核细胞通过内吞作用摄取了msu晶体,并促进了炎症因子例如白介素-1β(il-1β)和肿瘤坏死因子-α(tnf-α)等的分泌,这将引起炎症性细胞的流入,增强炎症反应。炎症性细胞因子(例如il-1β和il-8)是痛风性关节炎的发病机制中的重要影响因子,因此,抑制它们的产生可以作为治疗困难病例的一种策略(so,a.etal.arthritisres.ther.(2007)9(2):1-6;busso,n.etal.,arthritisres.ther.(2010)12(2):1-8;kienhorst,l.b.e.etal.,arthritisrheumatol.(2015)67(12):3303-3313)。il-1β是痛风性关节炎发病机制中的重要炎症因子,因此,抑制其产生被广泛认为是实现抗痛风疗效的有效手段。研究人员还认为,抗炎因子白介素-10(il-10)在痛风的治疗中起着重要作用。此外,高尿酸血症通常被认为与痛风有密切关系,因此,尿酸(ua)的代谢在病理学中也起着关键作用。上调直接催化ua产生的黄嘌呤氧化酶(xo)和缺乏对于ua的新陈代谢必不可少的尿酸氧化酶,会导致高尿酸血症。ua的生产过程中会产生大量活性氧(ros)产物,这些活性氧会促进氧化应激,破坏体内的生物氧化还原平衡,并最终损害细胞功能。高尿酸血症通常是无症状的,但是痛风的可能性会随着血清ua含量的升高而增加。目前,缓解疼痛、减轻炎症、降低关节肿胀和降低血清ua含量是痛风疗法的基本临床目标。
根据痛风的病理学,治疗痛风的不同药物通常被设计治疗不同的症状。痛风治疗药物主要分为抗急性发作药物和降低ua药物。抗急性发作药物主要包括秋水仙碱(colchicine)(col)和非甾体抗炎药物(nsaids)。col,秋水仙(colchicumautumnale)的生物碱,主要通过减轻炎症和减少ua晶体的沉积而用于治疗急性痛风。大多数nsaids作为环氧合酶的非选择性抑制剂,发挥其抗炎和镇痛作用。然而,使用col和nsaid可能会引起胃肠道不适、腹泻,并增加患心脏病以及其他副作用的风险。降低ua的药物包括抑制ua产生的药物(例如别嘌呤醇和促尿酸排泄药物(例如丙磺舒))。严重的副作用和单一效果制约着别嘌呤醇和丙磺舒的应用。因此,迫切需要研发一种全面且安全的替代药物用于痛风治疗。
技术实现要素:
一方面,本发明提供了一种用于预防或治疗高尿酸血症、痛风性关节炎和/或痛风石的药物组合物,包括:药学上可接受的辅料或载体,和治疗有效量的透明质酸衍生物,所述透明质酸衍生物包括式(i)所示的二糖、或其药学上可接受的钠盐或钾盐、酯或葡萄糖苷的重复单元,其中部分式(i)所示的二糖单元独立地被式(ii)所示的二糖结构取代,在式(ii)中,r为-c(o)-(c2-c4)-烷基,
其中所述透明质酸衍生物的分子量至少约为20kda。在一个实施方案中,所述透明质酸衍生物是交联的。在所述药物组合物的一个实施方案中,r为-c(o)-(c3)-烷基。在一个实施方案中,被取代的部分n-乙酰基的量至少约为10%。在一个实施方案中,被取代的部分n-乙酰基的量约为20%–80%。在一个实施方案中,所述分子量至少约为30kda。在一个实施方案中,所述分子量约为20kda–250kda。
一方面,本发明提供了一种预防或治疗病症或疾病的方法,所述病症或疾病选自高尿酸血症、痛风性关节炎、痛风石、痛风、痛风性炎症、肾病、肝病、肝损伤或非酒精性脂肪肝、由尿酸引起的疼痛、氧化应激疾病、急性痛风、尿酸肾病、尿酸肾结石、心血管疾病、肾脏疾病、杜兴氏肌营养不良症(duchennemusculardystrophy)、莱-尼氏综合征(lesch-nyhansyndrome)、牛皮癣、肿瘤溶解综合征和尿路结石,包括按需向患者施用上述技术方案的透明质酸衍生物。在一个实施方案中,炎症是由患者体内促炎细胞因子的产生引起的。在一个实施方案中,所述透明质酸衍生物包括含有葡萄糖醛酸和n-乙酰基葡糖胺的二糖、或其药学上可接受的钠盐或钾盐、酯或葡糖苷的重复单元,其中所述n-乙酰基葡糖胺的部分n-乙酰基独立地被–n-c(o)-(c2-c4)-烷基取代,其中所述透明质酸衍生物的分子量至少约为20kda。
一方面,本发明提供了一种调节肌酸酐含量、尿素氮和/或尿酸含量的方法,包括按需向患者施用上述技术方案所述的透明质酸衍生物。在一个实施方案中,所述调节防止供体器官的排斥。一方面,本发明提供了透明质酸衍生物在制备用于治疗病症或疾病的制剂中的用途,所述病症或疾病选自高尿酸血症、痛风性关节炎、痛风石、痛风、痛风性炎症、肾病、肝病、肝损伤或非酒精性脂肪肝、由尿酸引起的疼痛、氧化应激疾病、急性痛风、尿酸肾病、尿酸肾结石、心血管疾病、肾脏疾病、杜兴氏肌营养不良症、莱-尼氏综合征、牛皮癣、肿瘤溶解综合征和尿路结石。在一个实施方案中,所述炎症是由患者体内促炎细胞因子的产生引起的。
另一方面,本发明提供了一种调节肌酸酐含量、bun(血尿素氮)和/或尿酸含量的方法,包括按需向患者施用一种透明质酸衍生物,所述透明质酸衍生物包括含葡萄糖醛酸和n-乙酰基葡糖胺的二糖、或其药学上可接受的钠盐或钾盐、酯或葡糖苷的重复单元,其中所述n-乙酰基葡糖胺的部分n-乙酰基独立地被–n-c(o)-(c2-c4)-烷基取代,并且其中所述透明质酸衍生物的分子量至少约为20kda。
另一方面,本发明提供了一种预防a)高尿酸血症、b)痛风性关节炎、c)痛风石、d)痛风(例如急性或慢性)、e)痛风性炎症、f)肾病、肝病、肝损害、或非酒精性脂肪肝疾病、g)由尿酸引起的疼痛、h)氧化应激疾病、i)急性痛风、j)尿酸肾病和/或k)尿酸肾结石的方法。
一方面,本发明提供了一种治疗高尿酸血症的方法,所述高尿酸血症是某些疾病的危险因素。一方面,本发明提供了一种提高黄嘌呤氧化酶活性或表达的方法,所述黄嘌呤氧化酶是某些疾病的危险因素。一方面,本发明提供了一种治疗心血管疾病的方法,所述心血管疾病包括动脉粥样硬化、代谢性综合征、冠心病和/或心力衰竭。一方面,本发明提供了一种治疗肾脏疾病的方法,所述肾脏疾病包括急性肾脏疾病或慢性肾脏疾病。一方面,本发明提供了一种治疗杜兴氏肌营养不良症、莱-尼氏综合征、牛皮癣、肿瘤溶解综合征和/或尿路结石的方法。
附图说明
为了更好地理解本发明,并更清楚地说明本发明是如何实施的,将通过示例的方式参考附图,这些附图阐释了本发明实施方案的多个方面和特征,在附图中:
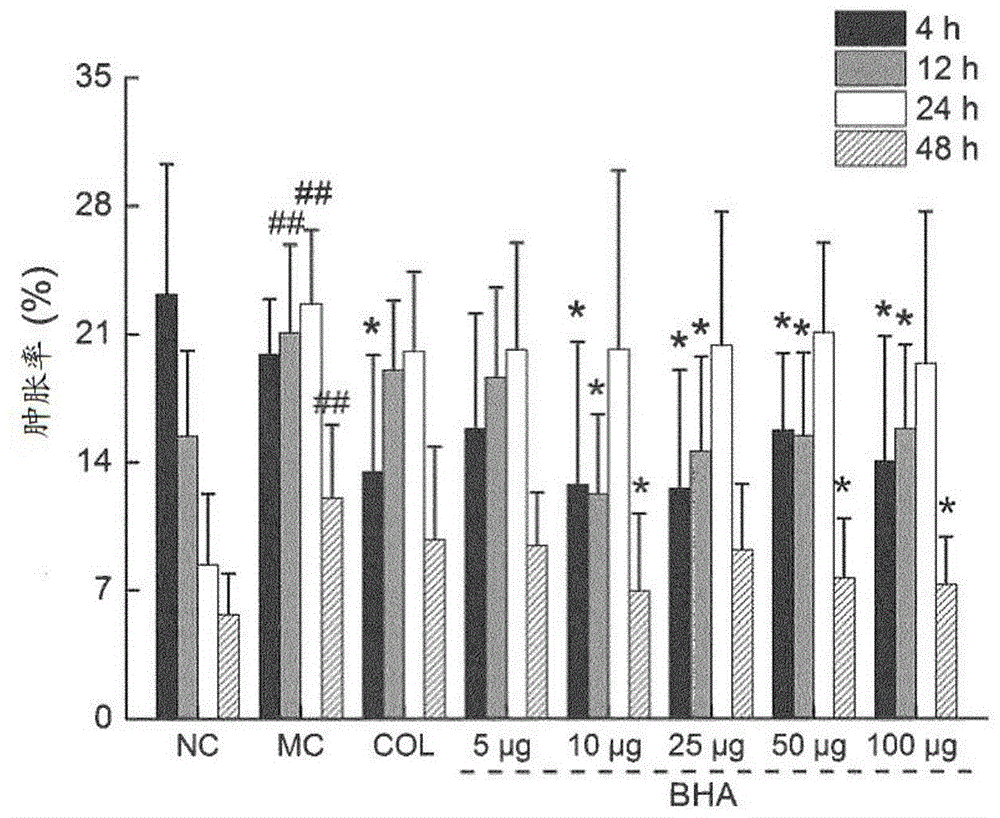
图1示出了注射msu晶体大鼠的踝关节肿胀率与治疗的关系柱状图。数据表示为平均值±标准差(n=6),并通过单向方差分析该数据,然后再进行事后(post-hoc)邓肯氏(dunn’s)多重比较测试。相对于对照大鼠,##p<0.01,相对于模型大鼠,*p<0.05。
图2a示出了本文描述的大鼠中msu晶体注射的方案概要和药物施用情况。
图2b示出了注射msu晶体大鼠的踝关节肿胀率与治疗的关系柱状图。
图2c示出了不同大鼠的右踝骨的x射线图。
图2d示出了通过显微镜(200x)观察h&e染色情况得到的大鼠踝关节的组织病理学评估图像,其中在注射msu晶体大鼠(mc)的脚踝中观察到炎症细胞。
图2e示出了治疗的概要。
图3a示出了本文描述的高尿酸血症小鼠的方案概要和药物施用情况。
图3b示出了表明al和bha对高尿酸血症小鼠中ua血清含量的影响的柱状图。
图3c示出了表明al和bha对高尿酸血症小鼠血清中xo含量的影响的柱状图。数据表示为平均值±标准差(n=10),并通过单向方差分析该数据,然后再进行事后邓肯氏多重比较测试。相对于正常对照组,#p<0.05和##p<0.01,相对于模型对照组,*p<0.05和**p<0.01。
图3d示出了表明al和bha对高尿酸血症小鼠肝脏中xo含量的影响的柱状图。数据表示为平均值±标准差(n=10),并通过单向方差分析该数据,然后再进行事后邓肯氏多重比较测试。相对于正常对照组,#p<0.05和##p<0.01,相对于模型对照组,*p<0.05和**p<0.01。
图3e示出了治疗的概要。
图4a示出了al和bha对高尿酸血症小鼠的血清和肝脏中尿氮含量的影响。
图4b示出了al和bha对高尿酸血症小鼠的血清和肝脏中cr含量的影响。
具体实施方式
定义
如本文所用,术语“ha”是指透明质酸。
如本文所用,术语“bha”是指n-丁酰化ha。
如本文所用,术语“msu”是指尿酸单钠。
如本文所用,术语“ros”是指活性氧。
如本文所用,术语“mda”是指丙二醛。
如本文所用,术语“sod”是指超氧化物歧化酶。
如本文所用,术语“nsaid”是指非甾体炎性药物。
如本文所用,术语“急性痛风”是指可能影响仅一个或多于一个关节的疼痛和炎症。
如本文所用,术语“慢性痛风”是指在一个或多于一个关节处反复发作疼痛和炎症。
透明质酸(ha),也称为玻尿酸(hyaluronan),是一种属于糖胺聚糖家族的线性多糖,其由含有n-乙酰基-d-葡萄糖胺(glcnac)和d-葡萄糖醛酸(glca)的二糖单元简单重复构成,具有β1,4和β1,3交替糖苷键。高分子量ha(hmha)(>2000kda)是细胞外基质(ecm)的主要成分,在人体关节软骨中含量丰富。而在炎症性病症中,如痛风性关节炎,关节中的hmha降解为低分子量ha(lmha),该低分子ha与某些细胞表面受体例如toll样受体(tlrs)结合,刺激促炎性细胞因子的过度产生,并促进白细胞去除msu,从而加剧关节发炎。
先前的研究表明,分子量降低的化学n-丁酰化ha(bha)显著降低了人类培养的刺激的吞噬细胞中促炎细胞因子(例如thp-1il-1、il-6、il-8和tnf-a)的产生(参见国际专利申请号pct/ca2014/000225,公开号为wo2014/138897,以及babasolao.,etal.jbiolchem2014;289:24779-91)。这种抗炎症活性是通过与细胞表面tlr-4受体的相互作用而不是通过与tlr-2受体的相互作用。
实施方案
如本文中详细描述的,检验了以化学方法修饰的ha(特别是bha)是否在表现出msu晶体诱导的急性痛风的大鼠中提供抗炎症的作用和减轻关节肿胀。bha的抗高尿酸血作用还在小鼠中进行研究,研究表明高尿酸血症由氧嗪酸钾(oxo)和酵母提取物粉末诱导。还研究了与氧化应激和炎症相关的潜在机制。
透明质酸(ha)已用于临床,通常在关节腔内作用于骨关节炎,以减轻膝关节疼痛的症状。然而,关于ha治疗痛风的研究很少。
本发明一个方面提供了一种用于预防或治疗高尿酸血症和痛风性关节炎的药物组合物,包括药理学上可接受的辅料或载体,和治疗有效量的透明质酸衍生物,所述透明质酸衍生物包括式(i)所示的二糖、或其药学上可接受的钠盐或钾盐、酯或葡萄糖苷的重复单元,其中部分式(i)所所示的二糖结独立地被式(ii)所示的二糖结构取代,在式(ii)中,r为-c(o)-(c2-c4)-烷基,
其中所述透明质酸衍生物的分子量至少约为20kda。
实施方案中提供了治疗高尿酸血症、痛风性关节炎、痛风石、痛风、痛风性炎症、肾病、肝病、肝损伤或非酒精性脂肪肝、由尿酸引起的疼痛和/或氧化应激疾病的方法,包括按需向患者施用一种透明质酸,所述透明质酸包括含葡萄糖醛酸和n-乙酰基葡糖胺的二糖、或其药学上可接受的钠盐或钾盐、酯或葡糖苷的重复单元,其中所述n-乙酰基葡糖胺的部分n-乙酰基独立地被–n-c(o)-(c2-c4)-烷基取代,其中所述透明质酸衍生物的分子量至少约为20kda。
如本文所述,建立了msu诱导痛风性关节炎大鼠模型以及氧嗪酸钾和酵母提取物诱导的高尿酸血症小鼠模型。合成了部分丁基化ha(参见上述式i和式ii,其中r为-c(o)-(c3)-烷基)作为上述式i和式ii(其中r为-c(o)-(c2-c4)-烷基)所示的化合物的一个代表例。用本文所述的动物模型研究了部分丁基化ha(bha)的治疗效果。通过elisa分析了细胞因子的表达水平和氧化应激标志物含量。
本文所述的结果证明了治疗效果,并提出了约30kda的bha用于治疗高尿酸血症和痛风性关节炎的分子机制。结果表明,关节腔内注射bha改善了msu诱导痛风性关节炎的大鼠模型中踝关节肿胀的症状。组织学研究(h&e染色)表明,与未经治疗的msu诱发痛风性关节炎的大鼠相比,关节内注射bha减少了炎症细胞的数量并保留了关节间隙。组织病理学上,与正常对照组相比,msu晶体的注射在滑膜中引起了明显的炎性细胞浸润。用col和低剂量的bha治疗减轻了炎症反应,因为是在col组和10bha组中观察到的炎症细胞较少。较高剂量的bha(50bha)不如10bha剂量有效。此外,bha降低了促炎性细胞因子,包括白介素-1beta(il-1beta)、白介素-8(il-8)和ifn-γ的表达,下调了单核细胞趋化蛋白1(mcp-1)的表达,提高了抗炎细胞因子白介素10(il-10)的表达。此外,腹膜内注射bha显著降低了氧嗪酸钾和酵母提取物诱发的高尿酸血症小鼠的血清尿酸含量和肝黄嘌呤氧化酶(xo)活性。
在一个实施方案中,如果推荐bha的剂量范围,关节内注射剂量约为0.3mg/人至40mg/人、腹膜内注射剂量约为3mg/人至400mg/人、或口服剂量约为25mg/天至5g/天。在一个实施方案中,推荐口服给药作为给药途径。特别地,本发明领域的技术人员知道如何在物种之间转换剂量(参见anoop,a.b.,etal.,(2016),j.basic.clin.pharm.7(2):27-31)。例如,大鼠体重约为200g的大鼠的剂量为10ug/大鼠,转换为体重为65kg的人的剂量为0.3–0.4mg/人。
尽管不囿于理论,但发明人建议机制可以通过调节与氧化应激相关的因素进行研究,例如降低肝组织中一氧化氮含量,降低氧化应激标志物、活性氧(ros)丙二醛(mda)在血清和肝脏中含量,以及增加肝脏中的超氧化物歧化酶(sod)活性。综上所述,这些发现表明bha有作为抗痛风治疗剂的功效、具有抗炎作用和抗尿酸作用。
作为一种历史悠久的世界性疾病,痛风病例的数量逐年增加。痛风的扩散似乎不仅是由于与这种疾病有关的病例,例如使用利尿剂、饮酒、嘌呤摄入和胃肠分流术的数量增加,而且还与缺乏同时具有抗炎症和抗高尿酸血症作用的有效药物有关。据报道,在关节炎的治疗期间,用ha治疗具有与糖皮质激素和nsaid相似的溶胀抑制作用。然而,没有关于ha对抗高尿酸血症的作用的报道。如本文所述,已经评估了bha在痛风性关节炎大鼠和高尿酸血症小鼠中表现出的作用。
痛风发作伴有中性粒细胞的浸润,这会产生大量的ros,导致细胞损伤,以及溶酶体酶类和炎性因子的释放。结果表明,在msu注射引起的急性痛风发作的48h内,不会引起踝关节的结构损伤(图2c)。组织病理学切片显示炎症细胞明显浸润了大鼠的踝关节(图2d)以及msu注射显著提高了大鼠中mcp-1和6-keto-pgf1α含量,并降低了il-10含量。用0.3mg/kgcol和bha进行治疗显著逆转了msu晶体注射大鼠的病理。数据表示为平均值±标准差(n=10),并通过单向方差分析该数据,然后再进行事后邓肯氏多重比较测试。与对照组大鼠相比,##p<0.01,与模型组大鼠相比,*p<0.05和**p<0.01。因此,假定该大鼠模型提供了急性痛风的准确表示。与col的情况一样,用bha进行治疗在减轻由msu注射引起的大鼠踝关节肿胀方面具有显著作用。用col和bha进行治疗均减少了炎症细胞的浸润。用bha进行治疗显著降低了急性痛风大鼠血清中il-1β、il-8、mcp-1和ifn-γ含量,但提高了il-10含量(表2)。
如表1所示,急性痛风发作患者的血清中il-1β、il-8、mcp-1、ifn-γ和il-10含量显著提高。il-1β参与骨关节炎的软骨分解。用bha抑制il-8表达可以有助于il-8在痛风性关节炎中发挥抗炎作用。如本文所示,与健康志愿者相比,痛风患者的il-8的百分比变化为784.6%。il-8是一种重要的趋化因子,其具有促进炎症细胞增长和增加氧化应激介质产生的作用。mcp-1,也称为ccl2,具有诱导趋化性单核细胞的能力,并在类风湿关节炎中起重要作用。ifn-γ促进炎症的发展。相反,抗炎细胞因子il-10在控制免疫反应和抑制吞噬细胞活性中起重要作用。因此,bha的抗急性痛风活性是通过抑制炎症因子,增加抗炎细胞因子,并降低大鼠的总炎症含量获得的。先前已有报道,ua可以与细胞表面受体tlr4相互作用,以激发tlr4-nlrp3炎性体,导致pro-il-1β的半胱氨酸天冬氨酸酶依赖(caspase-1-dependent)的分裂,从而引发il-1β的释放。因此,bha的抗炎作用机制可能是通过bha与tlr4的结合来防止tlr4与ua的相互作用,从而调节nf-kb的信号通路。此外,痛风患者血清中il-10的浓度升高可能与反馈调节有关。
在一项研究中,对h&e染色后的大鼠踝关节滑膜进行了组织病理学评估。切除小鼠的右脚踝,并固定在4%的多聚甲醛中,随后使用10%乙二胺四乙酸进行脱钙处理。然后在不同比例和浓度的乙醇/二甲苯混合物中进行脱水处理。组织切片用苏木精和曙红染色。由经验丰富的组织病理学家通过关节滑膜的组织病理学变化来评估炎性细胞浸润的程度。对五组中的每组的典型区域,均以40倍、100倍、200倍和400倍的放大倍数进行了显微镜研究。正常大鼠(nc)表现出正常滑膜。在msu晶体注射大鼠(mc)的滑膜中观察到炎性细胞浸润的增加。观察到用col和10μgbha进行治疗,部分预防了msu晶体注射大鼠的病理变化。
血清ua含量被认为是高尿酸血症临床诊断的直接指标,xo是一种在ua生产过程中起关键催化作用的酶。结果表明,高尿酸血症小鼠的血清ua和肝xo含量显著增加。然而,通过xo抑制剂-al的治疗,高尿酸血症小鼠的血清ua含量降低至正常含量,并且明显抑制血清xo活性。与al的情况一样,用bha进行治疗显著降低血清ua含量,而施用10μgbha显著降低肝脏xo活性,而施用50μgbha则不会比施用10μgbha更显著的降低xo活性。特别地,口服al使血清ua含量降至正常含量,而bha的情况也是如此,口服bha显著降低了血清ua含量(图3b)。腹膜内10μgbha的剂量显著降低了肝脏xo活性。
因此,bha作为一种抗炎药物在治疗痛风性关节炎中表现了治疗潜力。bha的抗高尿酸血症活性是通过至少部分抑制xo活性并降低血清ua含量获得的。用50μgbha进行治疗,对高尿酸血症小鼠肝脏中的xo活性没有明显影响,但显著降低了血清ua含量(见图3a、e)。因此,很明显,bha针对高尿酸血症的治疗不限于抑制xo活性。
xo可以催化次黄嘌呤和黄嘌呤c氧化为ua,并伴随产生大量的氧自由基。在高尿酸血症小鼠中,肝脏中的ros和mda含量显著升高,血清中的sod含量显著降低。mda是由ros降解的多元不饱和脂肪形成的,因此可以认为是氧化损伤的生物标记。bha治疗显著降低了高尿酸血症小鼠血清和肝脏中ros含量,并增加肝脏中sod含量,这与观察到降低血清ua含量的结果一致。据报道,高尿酸血症与肾功能障碍有密切联系,ua在这种病理中起主要作用。铬和尿素氮可作为肾功能评估的指标。在该高尿酸血症小鼠模型中,在血清和肝脏中均测量了cr和尿素氮,以了解其病原性变化,并评估bha治疗的安全性。高尿酸血症小鼠表现出肝脏中cr含量显著增加,而血清中cr含量没有实质性增加。与用al进行治疗高尿酸血症小鼠的情况一样,用bha进行治疗显著降低肝脏中的尿素氮以及血清和肝脏中的cr含量。如上所述,用bha进行治疗显著降低高尿酸血症小鼠的ros含量,因此可像al一样,对肾功能提供保护作用。在高尿酸血症小鼠中,肝脏cr含量显著增加。与al的情况一样,用bha进行治疗显著降低肝脏中的bun以及血清和肝脏中的cr含量(见图4)。从这些结果可以看出,用bha进行治疗显著降低了高尿酸血症小鼠的氧化程度,并对肾脏功能起到保护作用。
bha具有抑制由msu注射引起的踝关节肿胀和炎症反应的作用,并降低由oxo和酵母提取物粉末诱发的高尿酸血症小鼠的血清ua含量。bha可通过包括抑制炎症因子(il-1β、il-8、mcp-1和ifn-γ)和促进抗炎细胞因子(il-10)来降低大鼠中炎症水平的主要机制而表现出抗通风和抗高尿血酸的作用,并通过调节小鼠的氧化应激来抑制xo活性。同时,bha在保护高尿酸血症小鼠的肾功能中具有一定作用。总之,由于bha具有出色的药理活性,因此可作为临床痛风治疗的候选药物。
关于bha对具有msu晶体诱发的急性痛风的大鼠的作用,msu注射显著提高了大鼠右脚踝的肿胀率(与对照组大鼠相比,在注射msu4h、12h、24h和48h后,分别增加了29.5%、32.8%、28.8%和23.9%,p<0.01,f=66.51至203.12;图2b)。与msu治疗组相比,用0.3mg/kgcol进行治疗抑制了12h时的踝关节肿胀(p<0.05,f=6.307;图2b)。与msu治疗组相比,用10μg和50μg剂量的bha进行治疗抑制了每只大鼠在4h、12h和48h时的踝关节肿胀(p<0.01,f=9.06至68.75;图2b)。用10μgbha进行治疗提供了在12h时的最佳肿胀抑制,肿胀率降低了11.0%(p<0.01,f=42.11;图2b)。另外,用50μgbha治疗提供了48h时的最佳肿胀抑制,肿胀率降低了9.5%(p<0.01,f=68.75;图2b)。此外,x射线结果表明,所有大鼠的踝骨均未见损伤(见图2c)。根据痛风性关节炎的病理学,注射msu晶体在痛风性关节炎模型组中引起炎性细胞浸润,而对照组和治疗组未观察到。令人鼓舞的是,用col和bha进行治疗可以改善这种现象(见图2a、e)。
结果表明,在痛风中检测到十五种炎症因子。与对照组相比,mcp-1和6-keto-pgf1α含量增加(p<0.05,f=5.25至14.97;表2),il-10显著降低(p<0.05,f=5.27;表2),而msu注射大鼠血清中的ifn-γ和nf-kb没有显著提高(p>0.05,f=1.08至4.52;表2)。与注射msu的大鼠相比,用0.3mg/kg的col进行治疗仅使血清中mcp-1含量降低了9.93%(p<0.05,f=7.60;表2),用10μgbha进行治疗,il-8和mcp-1含量分别显著降低了7.13%和7.76%(p<0.05,f=5.17至8.72;表2),而il-10增加了9.49%(p<0.05,f=5.875;表2),而用50μgbha进行治疗,il-1β、il-8、mcp-1和ifn-γ含量分别显著降低了5.56%、6.55%、15.58%和33.18%(p<0.05,f=5.84至14.29;表2)。
关于bha对高尿酸血症小鼠的作用,血清ua含量提高是高尿酸血症的一个症状。与正常小鼠相比,高尿酸血症小鼠的血清ua含量显著提高(p<0.01,f=19.99,见图3b)。在图3a-e所示结果的研究中,数据表示为平均值±标准差(n=10),并通过单向方差分析该数据,然后再进行事后邓肯氏多重比较测试。相对于正常对照组,#p<0.05和##p<0.01,相对于模型对照组,*p<0.05和**p<0.01。用bha进行治疗,显著抑制了血清ua含量(p<0.05,f=5.26至7.23;见图3b),类似于al。用20mg/kgal进行治疗降低使血清ua含量降低了46.38%(p<0.01,f=1.65;见图3b)。
xo在产生ua和治疗高尿酸血症中起着重要作用。与在对照组小鼠中观察到的相比,在高尿酸血症小鼠中,肝脏xo含量提高了22.52%(p<0.05,f=7.36;图3d)。与未治疗的小鼠相比,用al进行治疗使血清中的xo含量降低了23.76%(p<0.05,f=8.17;图3c),而用10μgbha治疗仅使肝脏xo含量降低了19.78%(p<0.05,f=7.80;图3d)。
xo在合成ua的过程中催化ros的产生,这对肾功能构成了较高的风险。在高尿酸血症小鼠中,血清中的ros、gsh-px、cat和mda含量(p>0.05,f=0.43至1.79;表3)以及肝脏中的sod、gsh-px和cat含量(p>0.05,f=0.34至0.56;表3)没有显示出显著变化。然而,肝脏中ros和mda含量显著增加(p<0.05,f=5.68至16.42;表3),而血清中的sod含量下降了7.81%(p<0.05,f=6.72;表3)。用al进行治疗,使血清和肝脏中的ros和mda含量分别降低了9.48%、17.86%和6.66%、13.47%(p<0.05,f=5.80至29.75;表3)。用10μgbha进行治疗使血清和肝脏中的ros含量分别降低了14.87%和8.04%(p<0.01,f=10.50至21.99;表3)。同时,用50μgbha进行治疗还显著降低了血清和肝脏中的ros含量,分别降低了14.6%和9.59%(p<0.05,f=6.64至22.43;表3)。用10μg和50μgbha进行治疗,显著提高了肝脏中sod含量,分别提高了12.7%和13.69%(p<0.05,f=8.52至16.27;表3)。在高尿酸血症小鼠中,肝脏中cr含量显著增加了11.09%(p<0.01,f=10.95;图4b)。用al和bha进行治疗显著降低了肝脏中尿素氮含量,分别降低了25.25%、11.65%和12.81%(p<0.05,f=6.07至36.39;图4a),并显著降低了血清中的铬含量,分别降低了11.52%、8.21%和12.02%(p<0.05,f=4.808至16.31;图4b)。数据表示为平均值±标准差(n=10),并通过单向方差分析该数据,然后再进行事后邓肯氏多项比较测试。相对于正常对照组,##p<0.01,相对于模型对照组,*p<0.05和**p<0.01。
以下工作实施例进一步说明了本发明,但并不旨在限制任何方面。
工作实施例
实施例1a:制备部分脱乙酰化的ha
通过肼解反应制备部分脱乙酰化的ha(dha)(参见babasolao.,etal.,jbiolchem2014;289:24779-91)。简而言之,将6gha溶解在300ml包含3g硫酸肼的水合肼中。将反应混合物在65℃水浴中温育72h。在冰水浴中淬灭反应,并用冷乙醇沉淀产物。该产物用冷乙醇洗涤两次,并在室温下真空干燥。然后将样品重新溶解在100ml的5wt%的乙酸水溶液和60ml的0.5m碘酸水溶液的混合物中,并将混合物在4℃下保持1.5h。加入57wt%的ch3i水溶液(17.5ml),并将混合物再持续搅拌15min。将深紫罗兰色溶液转移至分液漏斗中,并使用150ml乙醚萃取紫罗兰色有机组分,回收含有部分脱乙酰化的ha(dha)的水层。用乙醚重复液-液萃取步骤,直到完全变色。用hcl将含有dha的水层的ph调节至7.0,并用冷乙醇沉淀dha,用冷乙醇洗涤并干燥。然后将产物溶解在双蒸馏水中,用分子量为8,000da的防渗透析管透析5天,然后冻干。
实施例1b:dha的丁基化
通过先前论文中描述的制备方法,将dha与丁酸酐再酰化(reacylated)以获得部分丁基化的ha(bha)(参见babasolao.,etal.,jbiolchem2014;289:24779-91)。简而言之,将0.1gdha溶解在30ml的双蒸馏水中,然后加入6ml的饱和碳酸氢钠溶液,然后添加6ml10%(v/v,即体积/体积)丁酸酐于无水乙醇中。将以上反应混合物在室温下搅拌1.5h。随后,将反应在沸水浴中进行淬灭,持续5min。通过旋转蒸发将反应混合物中残留的乙醇蒸发。用分子量为8000da的防渗透析管将bha样品在双蒸馏水中透析5天,然后进行冻干。
实施例1c:dha和bha的1hnmr分析
为了表征dha和bha的结构,使用500mhz的bruker光谱仪在348k下记录了10mg样品在d2o中的1hnmr谱图。在ha多糖中,对于每个重复的二糖单元(-glcnac-glca-),glcnac中有三个甲基质子,而glcnac和glca部分中有两个异头质子。对应于甲基质子的信号与对应于异头质子的信号的积分比为1.5。基于dha的1hnmr谱,在2.4–2.5ppm处的三个甲基质子与在4.9–5.3ppm处的glcnac和glca的两个异头质子的积分比为y。脱乙酰的程度可根据下式计算:脱乙酰率(%)=(1.0-(y/1.5)100)。bha的光谱显示了额外的-ch2ch2ch3质子信号,bha样品中丁基化与乙酰化的比率是glcnac中甲基质子与-ch2ch2ch3中甲基质子的积分比。
关于ha、dha和bha的1hnmr分析,数据如下,ha:52.50(s,-ch3),δ4.40-3.83(m,碳水化合物环上的其他h),δ5.09-5.08(d,在ha的glcnac上的异头h),δ4.94-4.93(d,在ha的glca上的异头h)。dha:δ2.50(s,-ch3),δ4.45-3.84(m,在糖环上的其他h),δ5.10-(d,在ha的glcnac上的异头h),δ4.95(d,在ha的glca上的异头h),δ5.31(d,在dha的glcnac上的异头h),δ5.18(d,在dha的glca上的异头h)。bha:δ2.50(s,glcnac的-ch3),δ4.40-3.83(m,糖环上的其他hs),δ5.10-5.09(d,ha的glcnac上的异头h),δ4.94-4.93(d,ha的glca上的异头h),δ5.13(d,bha的glcnac上的异头h),δ5.10-5.09(d,bha的glca上的异头h),δ2.74(t,bha的glcnbu的-ch2),δ2.09-2.08(m,bha的glcnbu的-ch2),δ1.42(t,bha的glcnbu的-ch3)。ha的glcnac-glca二糖单元进行了部分脱乙酰化,并且一些glcnac被转化为glcn以产生dha。在5.09-5.08ppm处观察到与glcnac-glca单元中的glcnac相对应的异头质子,为双峰。还在4.94-4.93ppm处观察到glcnac-glca单元中的glca的异头质子,为双峰。在5.15-5.31ppm处新可见的较小峰对应于glcn-glca单元的异头质子。在5.09-5.08ppm处观察到在glcn-glca单元中的glcn的异头质子,为双峰。还在4.94-4.93ppm处观察到glcn-glca单元中的glca的异头质子,为双峰。在dha的光谱中,三个甲基质子与异头质子的积分比经计算为1.13。根据该积分比,脱乙酰化的百分比计算为24.8%。bha的光谱显示了额外的-ch2ch2ch3质子信号,表明发生了酰化反应,丁基化与乙酰化的比例计算为25.4%。
实施例1d:ha、dha和bha的分子量估算
dha和bha的分子量通过电泳进行估算。简而言之,使用0.75(w/v,即重量/体积)琼脂糖凝胶在tris-乙酸盐-edta(tae)缓冲液中表征样品,该缓冲液包含400mmtris、50mm乙酸和9mmedta,ph为8.0。用0.02wt%溴酚蓝和2m蔗糖在tae缓冲液中制备样品上样缓冲液。上样样品制备为15μl浓度为0.5mg/ml(ha、dha、bha)的溶液加3μl上样缓冲液,然后在100v下分离样品约90分钟,直到跟踪染料迁移到凝胶边缘。运行后,将凝胶用在50%(v/v)乙醇中的0.005%(w/v)全染色剂(stains-all)染色,保持在黑暗中,染色48h。为了脱色,将凝胶置于10%(v/v)乙醇中,保持在黑暗中,脱色48h,在此期间将脱色溶液更换三次。
关于ha、dha和bha的分子量估算,通过琼脂糖凝胶电泳估算ha及其衍生物的分子量。低分子量ha阶梯包括500–30kda的分子量范围,用于估算ha、dha和bha的分子量。购买的ha的分子量范围为1800至30kda,而dha(dha1和dha2)的分子量约为60kda。dha1和dha2样品的制备方法相同,但批次不同,表明通过肼解反应制备60kdadha是可重复的。bha1和bha2的分子量估计约为30kda。它们的制备方法相同,但批次不同,表明再酰化反应也是可重复的。aha是用乙酸酐再酰化的部分脱乙酰化的ha。aha的分子量也估计约为30kda,这表明用于制备不同ha衍生物的酰化方法产生了具有相似分子量的产物。
实施例1e:ha、dha和bha的质谱分析
使用配备有负扫描模式运行的电喷雾电离源的triple-tof5600质谱仪(sciex,concord,canada)对样品进行ms分析。通过注射泵注入10μg/mlha溶液优化的ms参数如下:源温度=550℃;离子喷雾电压=-4500v;雾化器气体(n2)压力=25psi,加热器气体(n2)压力=50psi,幕帘气体压力=25psi,dp=-100v,ce=-35ev。通过注射泵将浓度为10μg/ml的样品注入质谱仪,以tof-ms扫描模式扫描对应于ha及其衍生物的特定片段,如表1所示。数据采集由analyst1.6.1软件控制。
关于ha、dha和bha的质谱分析,通过注射泵注入q-tofms系统后,以tof-ms模式扫描样品溶液。观测的m/z值与预测的m/z非常相似,如表1所示。在ha样品的质谱图中观察到glcnac和glca的单电荷二糖(m/z396.1160)、以及单电荷(m/z775.2257和797.2076)和双电荷(m/z387.1089)四糖glcnac和glca。通过tof-ms光谱观察到的另外的glcn和glca单电荷二糖(m/z354.1053)表明dha样品由部分脱乙酰化的ha组成。在bha的tof-ms光谱中观察到的glcnbu和glca的另一个单电荷二糖(m/z424.1462),表明样品中含有部分丁基化的ha。在这些特定的片段中,glcnac和glca的单电荷二糖(理论m/z396.1142)在所有样品中含量最高,因此该信号被用作目标峰。如表1所示,根据目标峰计算其他相关峰的相对强度。
实施例2:msu晶体诱发的大鼠痛风的剂量筛选
48只雄性wistar大鼠(8周:180–200g),购自中国吉林省亿斯实验动物技术有限公司(scxk(ji)-2016-0003),饲养在塑料笼中,并在相对湿度为55%和23±1℃的标准实验室条件下,保持12小时光照/12小时黑暗(在7:00–19:00光照)的周期。他们随意获取标准饲料和自来水。所有实验程序均已获得吉林大学动物伦理委员会(animalethicscommitteeofjilinuniversity)批准(参考号:201605)。
为了评估bha的抗炎活性,使用与先前的研究类似的msu诱导的痛风性关节炎的实验模型,但进行了一些修改。将大鼠随机分为8组(n=6),包括对照组(no)、模型组(mc)、0.3mg/kg秋水仙碱组(col)、5μgbha组(5bha)、10μgbha组(10bha)、25μgbha组(25bha)、50μgbha组(50bha)和100μgbha组(100bha)。使用前,将msu晶体悬浮在0.9%无菌生理盐水(30mg/ml)中。秋水仙碱组大鼠口服秋水仙碱(0.3mg/kg)治疗8天。在第6天,在除nc组以外的所有大鼠的右踝关节内注射msu溶液(100μl,30mg/ml),nc组注射生理盐水。5bha、10bha、25bha、50bha和100bha组分别用包含5μg、10μg、25μg、50μg或100μgbha的msu溶液进行关节内注射(100μl的30mg/mlmsu溶液包含5μg、10μg、25μg、50μg或100μgbha),按照规定的bha剂量给药。
在msu注射0h、4h、12h、24h和48h后,测量所有大鼠的右踝围。肿胀率(%)用于评估痛风性关节炎,并根据下式根据周长的变化进行计算:肿胀率(%)=(ct-co)/co,其中,ct代表在时间为th时的周长,co代表时间为0h时的周长。与对照组大鼠相比,msu注射显著增加了分别在msu注射后12h、24h和48h时大鼠右踝的肿胀率(p<0.01,f=12.09至28.24)。与msu治疗组相比,用0.3mg/kgcol进行治疗仅显著抑制了4h时的脚踝肿胀(p<0.05,f=6.79)。用bha进行治疗显著抑制了4h(p<0.05,f=4.89至8.32)和12h(p<0.05,f=5.33至15.70)时的肿胀。与msu治疗组相比,在10μg、50μg和100μg剂量下,bha表现出在48h时明显的肿胀抑制作用(p<0.05,f=4.97至7.29)。
实施例3a:msu晶体注射诱发大鼠急性痛风和bha治疗的方案
雄性wistar大鼠(n=50,8周:160–200g),购自中国吉林省辽宁长生生物技术有限公司(scxk(辽)-2015-0001)。这些大鼠饲养在塑料笼中,并在相对湿度为55%和23±1℃的标准实验室条件下,保持12小时光照/12小时黑暗(在7:00–19:00光照)的周期。他们随意获取标准饲料(辽宁长生生物技术有限公司,吉林,中国)和自来水。所有实验程序均已获得吉林大学动物伦理委员会批准(参考号:201605)。
为了评估bha的抗炎活性,使用了msu诱导的痛风性关节炎的实验模型。将大鼠随机分为五组(n=10),包括对照组(nc)、模型组(mc)、0.3mg/kg秋水仙碱组(col)、10μgbha组(10bha)和50μgbha组(50bha)。使用前,将msu晶体悬浮在0.9%无菌生理盐水(30mg/ml)中。秋水仙碱组大鼠口服秋水仙碱(0.3mg/kg)8天,除对照组外,所有大鼠在第6天,在灌胃喂饲1h后,均向右踝滑膜注射3mgmsu(sigma,usa)。同时,对于10bha组或50bha组大鼠,msu的混合样品混有每毫升溶液100μgbha或500μgbha。在第8天,在最后一次给药1h后,从大鼠的尾静脉取样血液,并收集大鼠的右踝关节并固定在4%的多聚甲醛中。分离血清并在-80℃条件下保存,直到进行分析(图2a、e)。
在msu注射0h、4h、12h、24h和48h后,测量所有大鼠的右踝围。肿胀率(%)用于评估痛风性关节炎,并通过下式根据周长的变化进行计算:肿胀率(%)=(ct-co)/co,其中,ct代表在时间为t时的周长,co代表时间为0h时的周长。
msu晶体注射48h后,用多模式小动物生存成像系统(kodak,usa)记录右脚踝骨骼的x射线图像,以评估每只大鼠脚踝的骨骼损伤情况。
收集大鼠的右脚踝并固定在4%的多聚甲醛中,然后用10%的乙二胺四乙酸进行脱钙处理。然后通过在不同比例和浓度的乙醇/二甲苯混合物中处理进行脱水。随后用苏木精和曙红对组织切片进行染色,并在光学显微镜(200x)下观察。分析关节滑膜畸形和炎性细胞渗入踝关节的组织病理学变化。
根据制造商的说明,使用elisa试剂盒(中国上海源叶生物技术有限公司)通过elisa方法测定大鼠中的白细胞介素-1α(il-1α,41734)、il-1β(43360)、白细胞介素-6(il-6,41731)、白细胞介素-8(il-8,41716)、il-10(41736)、白细胞介素-16(il-16,41628)、c-x-c基序趋化因子10(cxcl10,41570)、单核细胞趋化因子蛋白1(mcp-1,41640)、吞噬细胞炎性蛋白1α(mip-1α,41645)、干扰素γ(ifn-γ,41739)、tnf-α(41721)、肿瘤坏死因子-β(tnf-β,41673)、激活的b细胞核因子k-轻链增强子(nf-kb,43358)、6-酮-前列腺素f-1α(6-keto-pgf1α,41809)和前列腺素e2(pge2,41609)的血清含量。
实施例3b:oxo诱发的小鼠高尿酸血症及用bha治疗的实验
雄性balb/c小鼠(n=50,8周:18–22g),购自中国吉林省亿斯实验动物科技有限公司(scxk(ji)-2016-0003)。这些小鼠饲养在塑料笼中,并在相对湿度为55%和23±1℃的标准实验室条件下保持12小时光照/12小时黑暗(在7:00–19:00光照)的周期。他们随意获取标准饲料和自来水。所有实验程序均已获得吉林大学动物伦理委员会批准(参考号:201605)。
由于小鼠中存在尿酸酶,因此通过使用尿酸酶抑制剂和大量嘌呤建立了高尿酸血症小鼠模型。将小鼠随机分为五组(n=10),包括对照组(nc)、模型组(mc)、20mg/kg的al(中国江苏省世贸天阶制药有限公司)组、10μgbha(10bha)组和50μgbha组(50bha)。根据所需剂量口服al和腹膜内注射bha,除了nc组小鼠,其他所有小鼠均在施用al和bha12h前,进行灌胃饲喂20g/kg酵母提取物粉末8天。从第6天到第8天,除对照组外,所有小鼠均在施用al和bha1h前,进行腹膜内注射300mg/kgoxo(sigma,usa)。在最后一次给药1h后,从小鼠的尾静脉采样血液,分离血清并迅速收集其肝脏(图3a、e)。将所有样品都在-80℃下保存直到进行测定。
根据制造商的说明,使用标准诊断试剂盒(mak077,mak078,sigma,usa)确定血清和肝脏中的血清ua浓度和xo含量。
根据制造商的说明,使用elisa试剂盒(中国上海源叶生物技术有限公司)测定小鼠血清和肝脏中活性氧(ros,43355)、丙二醛(mda,43124)、谷胱甘肽过氧化物酶(gsh-px,43390)、超氧化物歧化酶(sod,43125)、过氧化氢酶(cat,43356)、肌酐(cr,43353)和小鼠血清和肝脏中的血尿素氮(bun,43352)含量。
实施例4:统计分析
体内收集的所有结果均表示为平均值±标准差。使用单向方差分析(anova)评估数据的统计显著性,然后采用spss19.0软件(ibm公司,armonk,usa)进行事后邓肯氏多重比较测试。p值<0.05被认为具有统计学意义。
本领域技术人员将理解,上述说明是参照某些实施方案进行的,并且可以利用本发明的原理制作其他实施方案,这些实施方案落入权利要求所限定的范围内。
表1.ha和ha衍生物中的理论和观察到的分子离子种类及其相对强度
表2.col和bha对msu诱导的急性痛风大鼠炎症因子的影响
数据表示为平均值±标准差(n=10),并通过单向方差分析该数据,然后再进行事后邓肯氏多项比较测试。与对照大鼠相比,#p<0.05,与模型大鼠相比,*p<0.05和**p<0.01。
表3.al和bha对高尿酸血症小鼠氧化应激和肾功能相关因子的影响
数据表示为平均值±标准差(n=10),并通过单向方差分析该数据,然后再进行事后邓肯氏多项比较测试。与对照小鼠相比,#p<0.05和##p<0.01,与模型小鼠相比,*p<0.05、**p<0.01和***p<0.001。
- 还没有人留言评论。精彩留言会获得点赞!