内皮蛋白C受体的新用途的制作方法
本发明涉及治疗细胞损伤的药物,尤其是内皮蛋白c受体作为靶点在制备对抗利莫司类及紫杉醇等药物诱导的内皮细胞损伤中的应用。
背景技术:
利莫司类及紫杉醇是目前心脏冠状动脉支架上应用最广泛的洗脱(涂层)药物,其中尤以雷帕霉素、依维莫司、佐他莫司、紫杉醇最为常见。冠状动脉支架植入术通过植入心脏支架达到重构血管、进而改善心肌缺血的目的,已经成为冠心病最重要的治疗手段。涂层药物可有效抑制人血管平滑肌的增殖从而预防再狭窄的发生。但随着临床应用和相关研究不断深入,发现药物洗脱支架可能导致支架内血栓,尤其是晚期血栓等并发症。支架内血栓是支架植入术后最严重的并发症之一,可导致心梗甚至猝死的严重后果。
以前的大量研究认为,涂层药物利莫司类及紫杉醇诱导内皮细胞损伤、导致内皮化延迟,进而引起血管内皮功能障碍、自我修复能力受损是支架内晚期血栓形成的主要原因。
目前临床上并没有有效的保护性干预利莫司类及紫杉醇诱导内皮细胞损伤的手段。目前临床上对于支架内血栓,除了全身抗凝预防外,尚无特异的防治方法。但是抗凝治疗并不能提高内皮功能,不能从根本上解决这个问题。而且全身抗凝用药有不良反应(如消化道出血)、依从性差(时间长)和停药后再血栓的风险。因此,寻找保护性干预利莫司类及紫杉醇诱导内皮细胞损伤的方法,促进再内皮化、进而有效防治支架内血栓,是目前心脏涂层支架亟待解决的问题。也是目前国内外新型支架研发的热点。
寻找有效抑制血管平滑肌而不影响、甚至促进内皮细胞的新涂层药物是研究的前沿方向。从探索策略上又大致分为两类。一是寻找新的化合物作为涂层药物。比如一系列雷帕霉素的衍生物、他汀类、三氧化二砷等新涂层药物的应用。希望既不减弱涂层药物抑制平滑肌的增殖效应,又能够保护性干预冠脉内皮细胞的损伤作用。但是实际效果并不如预期:不是抑制平滑肌的效果不如利莫司类,就是损伤内皮细胞作用更明显。二是在原有的利莫司类(抑制平滑肌)的基础上联合应用促进内皮细胞的药物。这是一种相对可行的、现实的策略,但是目前效果也并不理想。现有报道的一些联合使用的涂层药物并不是从细胞特异性分子靶点这个角度出发,因此存在很大的盲目性。即从机制上并不是只针对内皮细胞、而不针对平滑肌细胞发挥作用。比如雷帕霉素+vegf(血管内皮生长因子)组合。vegf虽然能够大幅提高内皮细胞功能,但是vegf也促进平滑肌细胞的增殖迁移、削弱雷帕霉素的作用。
技术实现要素:
基于上述问题,本发明的目的在于克服上述现有技术的不足之处而提供一种增加epcr表达或者激活epcr作为特异性促进内皮细胞功能、而不影响心脏涂层药物利莫司类及紫杉醇抑制平滑肌细胞效果的方法。
为实现上述目的,本发明采取的技术方案包括如下几个方面:
在第一个方面,本发明提供了内皮蛋白c受体(epcr)作为靶点在制备治疗内皮细胞损伤的药物中的应用。
优选地,所述内皮细胞损伤由药物诱导,诱导内皮细胞损伤的药物为利莫司类或/和紫杉醇。
在另一个方面,本发明提供了过表达epcr的试剂或epcr的激活剂在制备治疗内皮细胞损伤的药物中的应用。
优选地,所述内皮细胞损伤由药物诱导,诱导内皮细胞损伤的药物为利莫司类或/和紫杉醇。
优选地,所述过表达epcr的试剂为腺病毒载体。由此,过表达epcr保护性干预利莫司类及紫杉醇等药物诱导的内皮细胞损伤,且不影响平滑肌细胞。
优选地,所述epcr的激活剂为apc(活化的蛋白c)、tr47或parmodulin2。由此,多肽tr47、化合物parmodulin2可以激活epcr;apc(活化的蛋白c)、tr47、parmodulin2可以保护性干预利莫司类及紫杉醇等药物诱导的内皮细胞损伤,且不影响平滑肌细胞。
在第三个方面,本发明提供了一种心脏支架涂层,其中含有epcr的激活剂。
优选地,所述epcr的激活剂为apc、tr47或parmodulin2。
在第四个方面,本发明提供了epcr的激活剂与利莫司类或紫杉醇的联合使用在制备心脏支架涂层药物中的应用。
优选地,所述epcr的激活剂为apc、tr47或parmodulin2。
综上所述,本发明的有益效果为:
本发明以病毒为载体过表达epcr或者使用apc(活化的蛋白c)、多肽tr47、化合物parmodulin2等激活epcr的方法,可有效地发挥保护性干预利莫司类及紫杉醇等药物诱导的内皮细胞损伤,但是不影响平滑肌细胞。
附图说明
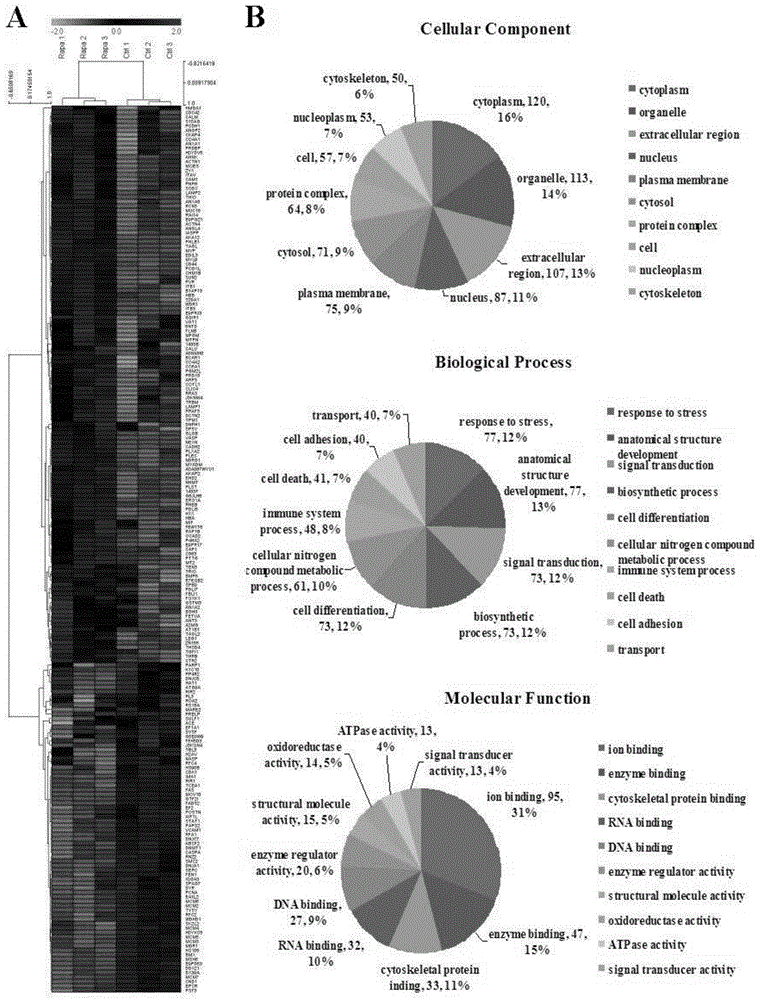
图1为雷帕霉素损伤人冠脉内皮细胞的蛋白质组学研究结果图;其中,(a)差异蛋白热图;(b)go分类分析结果图;
图2为利莫司类药物和紫杉醇与内皮细胞作用的结果图,结果显示利莫司类药物和紫杉醇诱导人冠脉内皮细胞epcr表达下调,其中,(a)雷帕霉素、紫杉醇、佐他莫司(zotarolimus)、依维莫司(everolimus)呈浓度依赖性的抑制人冠脉内皮细胞epcr的蛋白表达;(b)吡美莫司(pimecrolimus)、他克莫司(tacrolimus)、地磷莫司(deforolimus,也叫ridaforolimus)、拜尔莫司(biolimusa9,也叫umirolimus)等抑制epcr的表达;
图3为epcr表达下调对内皮细胞的影响结果图,显示epcr表达下调抑制人冠脉内皮细胞的功能,其中:(a)epcr表达下调降低人冠脉内皮细胞的p-enos(磷酸化一氧化氮合酶)水平;(b)epcr表达下调降低人冠脉内皮细胞的no(一氧化氮)释放;(c)epcr表达下调抑制人冠脉内皮细胞的细胞活力;(d)epcr表达下调抑制人冠脉内皮细胞的迁移能力;(e)epcr表达下调抑制人冠脉内皮细胞的小管形成能力;与对照组比较:*p<0.05,统计学有差异;**p<0.01,统计学有显著差异;***p<0.001,统计学有极显著差异;
图4为epcr表达下调对内皮细胞和内皮的影响结果图,显示epcr表达下调促进炎症细胞粘附人冠脉内皮细胞、损伤内皮屏障功能,其中:(a)epcr表达下调促进人冠脉内皮细胞粘附分子icam-1(细胞间黏附分子-1)、vcam-1(血管细胞粘附分子-1)表达;(b)epcr表达下调促进中性粒细胞粘附人冠脉内皮细胞;(c)epcr表达下调损伤人冠脉内皮细胞屏障功能;与对照组比较:**p<0.01,统计学有显著差异;***p<0.001,统计学有极显著差异;
图5为过表达epcr对内皮细胞影响的结果图,显示过表达epcr可以保护性干预利莫司类及紫杉醇药物诱导的人冠脉内皮细胞功能损伤,其中:(a)epcr-1-rac1-pak/akt-enos通路图;(b)腺病毒为载体过表达epcr;(c)过表达epcr保护性激活受利莫司类及紫杉醇药物抑制的rac1-pak/akt-enos通路;(d)过表达epcr保护性促进受损的人冠脉内皮细胞no释放;(e)过表达epcr保护性促进受损的人冠脉内皮细胞活力;(f)过表达epcr保护性促进受抑制的人冠脉内皮细胞细胞屏障功能;药物处理与未处理组比较:*p<0.05,统计学有差异;**p<0.01,统计学有显著差异;***p<0.001,统计学有极显著差异。过表达epcr与过表达gfp(绿色荧光蛋白)对照组的比较:#p<0.05,统计学有差异;##p<0.01,统计学有显著差异;###p<0.001,统计学有极显著差异;
图6为过表达epcr对内皮细胞的增殖、迁移和小管形成能力的影响结果图,显示过表达epcr可以保护性干预利莫司类及紫杉醇药物损伤的人冠脉内皮细胞的增殖、迁移和小管形成能力,其中:(a)过表达epcr保护性干预利莫司类及紫杉醇药物损伤的人冠脉内皮细胞的增殖;(b)过表达epcr保护性干预受损的人冠脉内皮细胞的迁移能力;(c)过表达epcr保护性干预受损的人冠脉内皮细胞的小管形成能力;药物处理与未处理组比较:*p<0.05,统计学有差异;**p<0.01,统计学有显著差异;***p<0.001,统计学有极显著差异;过表达epcr与过表达gfp(绿色荧光蛋白)对照组的比较:#p<0.05,统计学有差异;##p<0.01,统计学有显著差异;###p<0.001,统计学有极显著差异;
图7为过表达epcr对炎症细胞、血小板粘附的影响的结果图,显示过表epcr可以保护性干预利莫司类及紫杉醇药物诱导的炎症细胞、血小板粘附,其中:(a)过表达epcr保护性干预利莫司类及紫杉醇药物诱导的粘附分子sicam-1(分泌型icam-1)和svcma-1(分泌型icam-1)释放增加;(b)过表达epcr保护性抑制血小板粘附人冠脉内皮细胞;(c)过表达epcr保护性抑制中性粒细胞粘附人冠脉内皮细胞;药物处理与未处理组比较:*p<0.05,统计学有差异;**p<0.01,统计学有显著差异;***p<0.001,统计学有极显著差异;过表达epcr与过表达gfp(绿色荧光蛋白)对照组的比较:#p<0.05,统计学有差异;##p<0.01,统计学有显著差异;###p<0.001,统计学有极显著差异;
图8为apc、tr47、parmodulin2对epcr-biasedpar1-rac1-pak/akt-enos通路的影响结果图,显示apc、tr47、parmodulin2可以保护性激活epcr-biasedpar1-rac1-pak/akt-enos通路,其中:(a)apc、tr47、parmodulin2激活epcr-biasedpar1-rac1-pak/akt-enos通路;(b)apc、tr47、parmodulin2保护性上调受利莫司类及紫杉醇药物抑制的epcr表达;
图9为过表达或激活epcr不影响雷帕霉素抑制人平滑肌细胞的效果图,其中:(a)epcr在内皮细胞细胞特异表达,平滑肌细胞几乎不表达;(b)apc不影响雷帕霉素抑制平滑肌细胞活力;(c)apc不影响雷帕霉素抑制平滑肌细胞增殖的能力;(d)apc不影响雷帕霉素抑制平滑肌细胞迁移的能力;**、##,p<0.01,统计学有显著差异;***,p<0.001,统计学有极显著差异;n.s.,没有统计学差异。
具体实施方式
本申请的发明人认为精准、特异的分子靶点是找到保护性干预利莫司类及紫杉醇诱导的内皮细胞损伤新型防治方法的内在要求。因此,采取了一个新的、巧妙的策略:从分子机制上寻找内皮细胞中特异表达的、而在平滑肌细胞中不表达的新的激动型靶点。期望激动内皮特异性新靶点,保护性干预利莫司类及紫杉醇诱导的内皮细胞,进而促进再内皮化进程,达到干预支架内血栓的目的。于是在前期工作中,发明人应用蛋白质组学的方法进行筛选,首次发现epcr(内皮蛋白c受体)是这样一个潜在的激动型靶点。而受体epcr是在内皮细胞中广泛特异表达、但在平滑肌细胞中几乎不表达的蛋白。
已经获得广泛证明的是,受体epcr是“apc-epcr-rac1-pak/akt-enos通路”中的关键一环。epcr既在抗凝血系统中发挥重要作用,也是维持内皮功能,包括内皮细胞的增殖迁移、小管形成、屏障功能的关键效应分子。因此,通过增加epcr表达或者激活epcr有望能够不影响涂层药物抑制平滑肌的能力、但是能够发挥抗凝和提高内皮细胞功能的三种效应。达到“一石三鸟”的效果。同时,因为epcr是细胞膜上的受体蛋白,药物干预方便可行。因此,本发明提出这样一种方法:增加epcr表达或者激活epcr作为特异性促进内皮细胞功能、而不影响支架涂层药物利莫司类及紫杉醇抑制平滑肌细胞效果的方式。
为更好的说明本发明的目的、技术方案和优点,下面将结合附图和具体实施例对本发明作进一步说明。如无特别说明,本申请中的实验方法均为常规方法。如无特别说明,本申请中的试剂、培养基、细胞或材料均可以从市场等公开渠道获得。
实施例1利莫司类药物和紫杉醇抑制人冠脉内皮细胞epcr的表达
为了全面、系统的探索雷帕霉素(rapamycin,也叫西罗莫司sirolimus)损伤人冠脉内皮细胞的具体分子机制,以期寻找干预雷帕霉素支架不良反应的方法,发明人进行了基于itraq(同位素标记相对和绝对定量)技术的蛋白质组学研究。
人冠脉内皮细胞(hcaecs)在100nm雷帕霉素处理48小时后,与对照组相比,发现一批雷帕霉素调控的蛋白分子(参见图1),其中一个受体蛋白epcr受雷帕霉素调控而下调表达3.7倍(参见图1)。进一步发现,除雷帕霉素外,紫杉醇(paclitaxel)、佐他莫司(zotarolimus)、依维莫司(everolimus)在0.1nm-1000nm等浓度处理hcaecs48小时后,免疫印迹实验显示都能够呈浓度依赖性的抑制人冠脉内皮细胞epcr的蛋白表达(参见图2a)。其它利莫司类药物,包括100nm他克莫司(tacrolimus)、100nm地磷莫司(deforolimus,也叫ridaforolimus)、20μm吡美莫司(pimecrolimus)、10μm拜尔莫司(biolimusa9,也叫umirolimus)等也能抑制epcr的表达(参见图2b)。因此,本发明首次发现利莫司类及紫杉醇能够抑制epcr的表达。
实验例2腺病毒过表达epcr保护性干预利莫司类及紫杉醇药物诱导的人冠脉内皮细胞功能和屏障功能损伤、炎症细胞及血小板粘附
用脂质体分别转染100nmsi-epcr1#、si-epcr2#(epcr的小分子干扰1#和2#)48小时的方法作为下调epcr的手段,考察对人冠脉内皮细胞的影响。分别用免疫印迹法检测p-enos、检测细胞上清no浓度反映enos的活性、cck-8检测细胞活力、edu检测细胞增殖、transwell法检测细胞迁移能力、观察小管形成能力等。免疫印迹法检测粘附分子icam-1、vcma-1的表达或elisa检测分泌型粘附分子sicam-1、svcma-1的释放。伊文思蓝染色法考察内皮细胞通透性。粘附实验观察中性粒细胞粘附内皮细胞能力,瑞氏-吉姆萨染色观察血小板粘附。本实施例涉及的si-rna的碱基序列如下:
si-epcr1#:tggcctccaaagacttcatat(seqidno.1);
si-epcr2#:gcactcggtatgaactgcgggaatt(seqidno.2)。
检测结果如图3和4所示,epcr表达下调降低内皮细胞的p-enos水平(参见图3a)、no释放(参见图3b)、细胞活力(参见图3c)、迁移(参见图3d)、小管形成能力(参见图3e)。同时,epcr表达下调促进内皮细胞粘附分子icam-1、vcam-1的表达(参见图4a)、中性粒细胞粘附(参见图4b),损伤屏障功能(参见图4c)。因此,epcr表达下调抑制人冠状动脉内皮细胞功能、促进炎症细胞粘附、损伤内皮屏障功能。
与此相一致,用腺病毒为载体过表达epcr(参见图5b)(选取moi=10)激活受利莫司类(均为100nm)及紫杉醇(10nm)药物抑制的rac1-pak/akt-enos通路(参见图5c)、促进no释放(参见图5d)、细胞活力(参见图5e),抑制屏障功能损伤(参见图5f)。过表达epcr(moi=10)保护性干预利莫司类(均为100nm)及紫杉醇(10nm)药物损伤的人冠脉内皮细胞的增殖(参见图6a)、迁移(参见图6b)和小管形成能力(参见图6c)。过表达epcr保护性干预利莫司类及紫杉醇药物诱导的粘附分子sicam-1和svcma-1释放增加(参见图7a)、血小板粘附(参见图7b)、中性粒细胞粘附(参见图7c)。
总之,本实施例的检测结果表明,epcr表达下调抑制人冠脉内皮细胞的功能。过表达epcr保护性干预利莫司类及紫杉醇药物诱导的人冠脉内皮细胞功能和屏障功能损伤、炎症细胞及血小板粘附。
实验例3apc、tr47、parmodulin2保护性激活因利莫司类及紫杉醇药物而受损的epcr-biasedpar1-rac1-pak/akt-enos通路
apc(活化蛋白c)是受体epcr的天然配体。除了激活epcr外,免疫印迹证实40nmapc能够诱导epcr的表达(参见图8a),与文献报道的一致[1]。tr47是取自par1蛋白本身的多肽[2],多肽tr47和化合物pm2(parmodulin2)均能激活biasedpar1通路(par1旁路)而发挥保护内皮细胞的效应[2-3]。
本实施例通过免疫印迹实验率先发现40μm的tr47和10μm的parmodulin2也能增加epcr的表达(参见图8a),从而apc、tr47、parmodulin2激活epcr-biasedpar1-rac1-pak/akt-enos通路(参见图8a)。而且apc、tr47和parmodulin2能够保护性增加利莫司类及紫杉醇药物抑制的epcr的表达(参见图8b)。因此,apc、tr47、parmodulin2具有激活epcr发挥保护性干预利莫司类及紫杉醇药物诱导的人冠脉内皮细胞的功能。
实验例4过表达epcr或激活epcr不影响人平滑肌细胞的增殖迁移
免疫印迹检测表明epcr主要在内皮细胞表达,如hcaec、haec(人主动脉内皮细胞)、huvec(人脐静脉内皮细胞),而平滑肌细胞,如hasmc(人主动脉平滑肌细胞)、masmc(小鼠主动脉平滑肌细胞)几乎不表达(参见图9a)。腺病毒介导的epcr(moi=10)过表达抑制平滑肌细胞的增殖(参见图9c)、迁移(参见图9d)。而40nmapc处理不影响100nm雷帕霉素抑制平滑肌细胞活力、增殖和迁移的能力(参见图9b-d)。
参考文献:
1.seoljw,leeyj,jacksoncj,sambrookpn,parksy.activatedproteincinhibitsbisphosphonate-inducedendothelialcelldeathviatheendothelialproteincreceptorandnuclearfactor-κbpathways.intjmolmed.2011jun;27(6):835-40.doi:10.3892/ijmm.2011.649.
2.mosnierlo,sinhark,burnierl,bouwensea,griffinjh.biasedagonismofprotease-activatedreceptor1byactivatedproteinccausedbynoncanonicalcleavageatarg46.blood.2012dec20;120(26):5237-46.doi:10.1182/blood-2012-08-452169.
3.deceunynckk,peterscg,jaina,higginssj,aisikuo,fitch-tewfikjl,chaudhrysa,dockendorffc,parikhsm,ingberde,flaumenhaftr.par1agonistsstimulateapc-likeendothelialcytoprotectionandconferresistancetothromboinflammatoryinjury.procnatlacadsciusa.2018jan30;115(5):e982-e991.doi:10.1073/pnas.1718600115.
最后应当说明的是,以上实施例仅用以说明本发明的技术方案而非对本发明保护范围的限制,尽管参照较佳实施例对本发明作了详细说明,本领域的普通技术人员应当理解,可以对本发明的技术方案进行修改或者等同替换,而不脱离本发明技术方案的实质和范围。
sequencelisting
<110>广州医科大学附属第二医院
<120>内皮蛋白c受体的新用途
<130>2020
<160>2
<170>patentinversion3.3
<210>1
<211>21
<212>dna
<213>人工合成
<400>1
tggcctccaaagacttcatat21
<210>2
<211>25
<212>dna
<213>人工合成
<400>2
gcactcggtatgaactgcgggaatt25
- 还没有人留言评论。精彩留言会获得点赞!