药物组合物及其制备方法与应用与流程
本发明涉及医药
技术领域:
,尤其涉及药物组合物及其制备方法与应用。
背景技术:
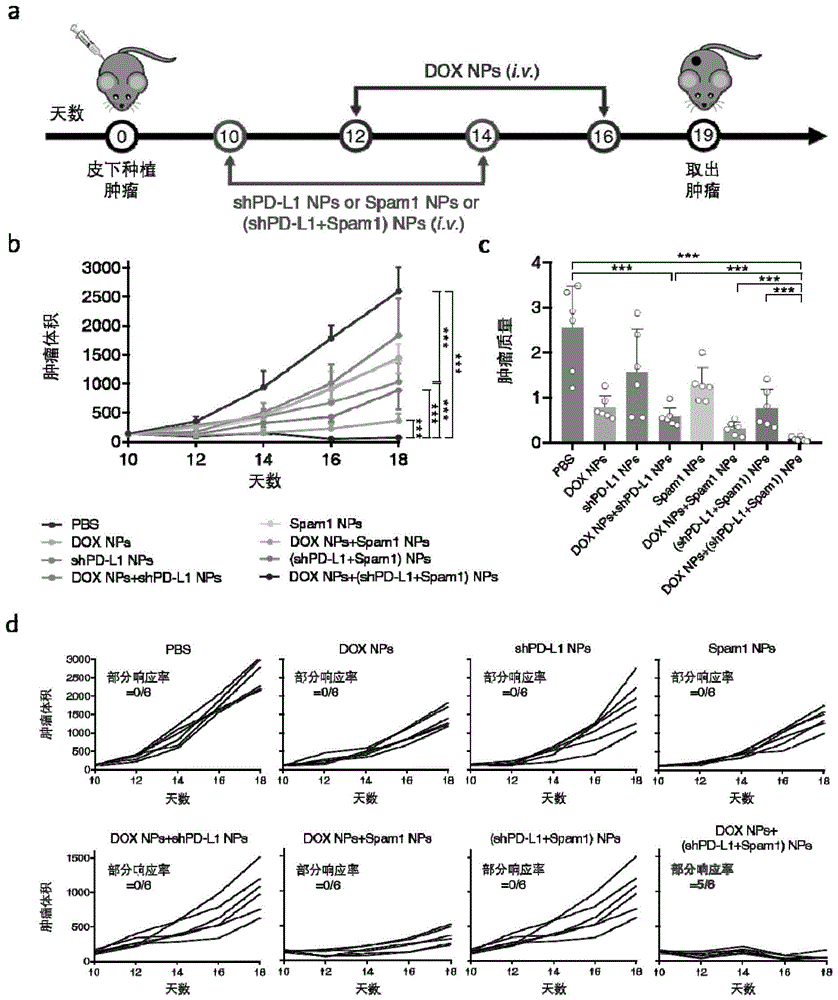
:癌症免疫疗法,手术,化学疗法和放射疗法已成为临床上对抗癌症的一线疗法。与其他针对癌细胞的疗法不同,癌症免疫疗法旨在正常化人体抵抗癌症的免疫系统,而非直接靶向肿瘤。免疫检查点封锁(icb)是癌症免疫疗法的一种典型疗法。icb可以干扰免疫检查点及其受体之间的相互作用,在许多癌症类型中都取得了令人鼓舞的治疗效果。但是,icb的低响应率在很大程度上限制了其进一步的发展。先前的研究结果表明,改善肿瘤抗原的质量和促进免疫细胞浸润将大大提高icb的治疗效果。特殊化疗药物(例如阿霉素、奥沙利铂)引发的免疫原性化疗可以诱导肿瘤细胞免疫原性死亡(icd)。通过将钙网蛋白(crt)暴露在细胞表面,icd可促进树突状细胞(dc)摄取肿瘤抗原。同时,危险信号分子的释放,包括高迁移率族蛋白b1(hmgb1)和三磷酸腺苷(atp),将促进dc的募集和激活。icd诱导高质量的肿瘤抗原加工能力与随之而来的肿瘤特异性t细胞的浸润有关,因此与免疫检查点抗体具有协同作用。但由于肿瘤区域的免疫抑制微环境,原先存在于肿瘤部位的t细胞会逐渐耗竭,即使在采用检查点疗法治疗后,也丧失了增殖能力和转变为记忆细胞的能力,不利于长期的抗肿瘤治疗。这需要我们增加外周功能正常的t细胞进入,同时清除抑制性的免疫微环境,防止持续性的t细胞耗竭。清除肿瘤细胞外基质(ecm)具有调节免疫抑制性肿瘤微环境并同时促进外周t细胞浸润的潜力。先前的研究已经证明透明质酸(ha)是肿瘤ecm中的关键成分,并具有通过多种机制促进肿瘤进展的功能。ha降解依赖于透明质酸酶(haase)家族。透明质酸酶联合化疗或光动力疗法都可以取得较好的抗肿瘤治疗效果。但是,直接静脉注射化疗药物和检查点抗体会引起不良反应,例如心脏毒性或严重的免疫相关不良反应(iraes)。近年来,已经开发了许多对肿瘤微环境有响应的纳米递送系统,以实现更好的靶向肿瘤的药物释放。与正常组织相比,肿瘤区域的ph值通常较低,范围为6.5-7.2。酸敏感的纳米递送系统可以通过epr效应增加纳米颗粒的积累,并在受到肿瘤特异性酸性环境刺激时释放更多的药物。因此,亟需开发一种肿瘤微环境响应的纳米化策略,同时涵盖免疫原性化疗、检查点封锁与细胞外基质清除策略,以达到更好的肿瘤治疗效果。技术实现要素:有鉴于此,本发明要解决的技术问题在于提供药物组合物及其制备方法与应用,该药物组合物能够应用于包括免疫原性化疗、免疫检查点阻断和细胞外基质清除的纳米鸡尾酒免疫疗法。本发明提供的药物组合物包括如下组分中的至少两种:i)、引发肿瘤细胞免疫原性死亡的物质;ii)、免疫检查点抑制剂;iii)、降解肿瘤区域细胞外基质的物质;所述引发肿瘤细胞免疫原性死亡的物质包括:植物碱类抗肿瘤药物、抗生素抗肿瘤药物或铂类抗肿瘤药物;所述免疫检查点包括:pd-l1/pd1、ctla-4、tim3或lag-3;所述降解肿瘤区域细胞外基质的物质包括:纤维细胞酶、透明质酸酶或胶原蛋白酶。在本发明中,所述引发肿瘤细胞免疫原性死亡的物质包括:紫杉醇、米托蒽醌、阿霉素或奥沙利铂;所述免疫检查点抑制剂包括pd-l1/pd1、ctla-4、tim3、lag-3的sirna或shrna;所述降解肿瘤区域细胞外基质的物质为透明质酸酶spam1。一些实施例中,所述药物组合物中包括:阿霉素、表达shpd-1基因的质粒和表达spam1基因的质粒中至少两种。本发明研究表明,阿霉素、shpd-1和spam1三者联用可以提高对肿瘤的抑制效果,其效果优于三种组分分别单独使用,或者两者联用。为了使药物具有良好的靶向性,以酸敏感载体材料对药物进行担载。本发明中,所述引发肿瘤细胞免疫原性死亡的物质担载于plg-g-mpeg载体;一些实施例中,免疫原性化疗药物采取的是阿霉素,以plg-g-mpeg担载阿霉素。在一些实施例中,所述plg-g-mpeg高分子载体由亲水的聚乙二醇链和疏水的氨基酸链段组成。所述高分子载体包含的聚乙二醇链段分子量为500~10000da;氨基酸链段分子量为10000~70000da。一些具体实施例中,所述聚乙二醇的分子量为5000da,聚谷氨酸的分子量为21600da。本发明中,所述免疫检查点抑制剂和/或降解肿瘤区域细胞外基质的物质担载于双醛基peg/聚乙烯亚胺/聚谷氨酸纳米载体。其中,聚乙烯亚胺和聚谷氨酸的分子量为25kda和2000da。一些实施例中,所述药物组合物中包括:plg-g-mpeg/dox纳米颗粒和peg/plg/pei/(spam1+shpd-l1)纳米颗粒。本发明提供的药物组合物中,plg-g-mpeg/dox纳米颗粒是一种酸敏感的,能够运载引发肿瘤免疫原性死亡化疗药物的组合物,以侧链接枝peg的聚谷氨酸为载体运载化疗药物,载体通过非化学键的疏水作用和氢键作用与能够引发肿瘤免疫原性死亡的化疗药阿霉素结合,形成纳米粒子(plg-g-mpeg/doxnps)达到高效运载阿霉素,并特异性在肿瘤酸性微环境中释放阿霉素,引发肿瘤细胞免疫原性死亡的目的。本发明提供的药物组合物中,peg/plg/pei/(spam1+shpd-l1)纳米颗粒是一种肿瘤酸性微环境酸响应基因递送系统用于清除细胞外基质和封锁免疫检查点的纳米粒子。其利用酸响应递送系统双醛基peg/聚乙烯亚胺/聚谷氨酸担载具有降解细胞外基质中透明质酸功能的表达spam1的质粒,同时担载具有沉默肿瘤细胞免疫检查点pd-l1功能的表达shpd-l1的质粒。通过在酸性肿瘤微环境中脱去peg遮蔽层,纳米粒子可以顺利进入肿瘤细胞内部,其中质粒spam1可以表达透明质酸酶,降解肿瘤区域细胞外基质中的透明质酸,从而达到清除细胞外基质的目的。而质粒shpd-l1则可以沉默肿瘤细胞表面的pd-l1,达到检查点封锁的目的。在一些实施例中,所述plg-g-mpeg/dox纳米颗粒中,plg-g-mpeg与dox的质量比为为2:1;所述peg/plg/pei/(spam1+shpd-l1)纳米颗粒中,peg、plg、pei、表达spam1的载体、表达shpd-l1的载体的质量比为5:2.5:1:1;所述plg-g-mpeg/dox纳米颗粒与所述peg/plg/pei/(spam1+shpd-l1)纳米颗粒的比例,以dox、spam1、shpd-l1的质量比计为5:0.75:0.75。所述药物组合物的制备方法包括:将plg-g-mpeg溶解于二甲基亚砜至plg-g-mpeg浓度为1~20mg/ml,制成载体溶液;将dox溶于二甲基亚砜至dox的浓度为1~20mg/ml,制成药物溶液;将载体溶液与药物溶液以体积比为(0.1~10):1混合后,滴加至水中,混合后以3500分子量透析袋透析,制得plg-g-mpeg/dox纳米颗粒。一些实施例中,plg-g-mpeg的dmso溶液中,plg-g-mpeg浓度为20mg/ml,溶解时间为1~10分钟,溶解温度为10~40℃。一些实施例中,盐酸阿霉素的dmso溶液中盐酸阿霉素的浓度为10mg/ml,溶解时间为1~10分钟,溶解温度为10~40℃。一些实施例中,两种溶液混合的体积比为2:1,所述混合采用涡旋振荡的方式,时间为1~10分钟。一些实施例中,所述水为超纯水,所述水与混合后的溶液的体积比为(0.1~10):1,优选为8:1。一些实施例中,所述滴入的时间为1~10分钟,滴入后混合采用搅拌的方式,搅拌的时间为20min。一些实施例中,所述透析的时间为2~5天。保存温度为0~37℃。实验结果表明,得到的纳米粒子(plg-g-mpeg/doxnps)具有体外酸响应释放阿霉素的能力,并能够在体内、体外有效引发肿瘤细胞免疫原性死亡。所述组合的制备中还包括制备peg/plg/pei/(spam1+shpd-l1)纳米颗粒的步骤:将pei溶解于水至pei浓度为5mg/ml,制成pei溶液;将plg溶解于水至plg浓度为1mg/ml,制成plg溶液;将双醛基peg溶解于水至双醛基peg浓度为10mg/ml,制成双醛基peg溶液;将pei溶液与plg溶液以体积比5:1混合,涡旋振荡15min,制成pei/plg纳米粒子;spam1质粒与shpd-l1质粒的混合溶液与peg/plg纳米粒子溶液混合,涡旋振荡15min,然后与双醛基peg溶液混合,涡旋振荡15min,制成peg/plg/pei/(spam1+shpd-l1)纳米颗粒。将pei溶解于水至pei浓度为0.1~5mg/ml,制成pei溶液;将plg溶解于水至plg浓度为0.1~5mg/ml,制成plg溶液;将双醛基peg溶解于水至双醛基peg浓度为0.1~20mg/ml,制成双醛基peg溶液;将pei溶液与plg溶液以体积比0.1~10:1混合,制成pei/plg纳米粒子;spam1质粒与shpd-l1质粒的混合溶液与peg/plg纳米粒子溶液混合,涡旋振荡15min,然后与双醛基peg溶液混合,涡旋振荡15min,制成peg/plg/pei/(spam1+shpd-l1)纳米颗粒。一些实施例中,pei溶液中pei浓度为5mg/ml。一些实施例中,plg溶液中plg浓度为1mg/ml。一些实施例中,双醛基peg溶液中双醛基peg浓度为10mg/ml。一些实施例中,将pei溶液与plg溶液以体积比5:1混合,涡旋振荡15min,制成pei/plg纳米粒子;一些实施例中,spam1质粒与shpd-l1质粒的混合溶液与peg/plg纳米粒子溶液混合的体积比为1:1。本发明将三种组分制成两种纳米粒子,通过不同用量组合的方式,联合用于抗肿瘤免疫治疗,同时涵盖免疫原性化疗、检查点封锁与细胞外基质清除策略。本发明提供的药物组合物在制备治疗癌症的药物中的应用。本发明还提供了一种治疗癌症的药物,其包括本发明所述的药物组合物。所述治疗癌症的药物中还包括药学上可接受的辅料。所述药物的剂型为注射剂。本发明还提供了一种治疗癌症的方法,其为给予本发明所述的药物组合物。所述给予的方式为注射。本发明提供的药物组合物中,包括引发肿瘤细胞免疫原性死亡的物质、免疫检查点抑制剂、降解肿瘤区域细胞外基质的物质中的至少两种,其中组分以载体担载,能够特异性在肿瘤酸性微环境中释放药物,引发肿瘤细胞死亡,从而实现治疗癌症的目的。研究表明,三者联用可以提高对肿瘤的抑制效果,其效果优于三种组分分别单独使用,或者两者联用。附图说明图1示组合疗法的抗肿瘤治疗效果;其中a示实验方案,b示各组处理对荷瘤小鼠的肿瘤体积的影响;c示各组处理后荷瘤小鼠的肿瘤质量;d示各组处理对荷瘤小鼠的肿瘤体积的影响。具体实施方式本发明提供了药物组合物及其制备方法与应用,本领域技术人员可以借鉴本文内容,适当改进工艺参数实现。特别需要指出的是,所有类似的替换和改动对本领域技术人员来说是显而易见的,它们都被视为包括在本发明。本发明的方法及应用已经通过较佳实施例进行了描述,相关人员明显能在不脱离本
发明内容、精神和范围内对本文的方法和应用进行改动或适当变更与组合,来实现和应用本发明技术。免疫原性化疗药物采取的是plg-g-mpeg担载阿霉素。在本发明中,所述plg-g-mpeg高分子载体由亲水的聚乙二醇链和疏水的氨基酸链段组成。所述高分子载体包含的聚乙二醇链段分子量为500~10000da;氨基酸链段分子量为10000~70000da。在本发明中,所述能够引发免疫原性死亡的化疗药物包括米托蒽醌、阿霉素在内的所有蒽环类抗肿瘤药物以及奥沙利铂。引发肿瘤检查点封锁的药物采用担载shpd-l1沉默基因的peg/plg/pei纳米粒子。在本发明中,所述能够引发检查点封锁的基因包括其余检查点沉默基因,例如ctla-4、tim3和lag-3等。引发肿瘤细胞外基质清除的药物采用担载spam1基因的peg/plg/pei纳米粒子。在本发明中,所述能够引发肿瘤细胞外基质清除的基因包括其余对细胞外基质有破坏作用的基因,例如胶原酶基因、杀伤成纤维细胞的基因等。本发明的疗法组合具有引发肿瘤细胞免疫原性死亡,封锁肿瘤区域免疫检查点功能和清除肿瘤细胞外基质的功能。能够显著抑制肿瘤细胞生长,并增加瘤内cd8+t细胞数量1、诱导肿瘤细胞免疫原性死亡的实验:游离药物阿霉素和纳米粒子plg-g-mpeg担载阿霉素均可以在诱导肿瘤细胞免疫原性死亡,具体表现为细胞释放的atp含量升高和细胞表达的钙网蛋白表达量升高。细胞存活率通过mtt方法检测,atp含量通过atp检测试剂盒检测,细胞钙网蛋白表达水平通过流式细胞术测量。2、降解肿瘤细胞免疫检查点实验:担载shpd-l1沉默基因的peg/plg/pei纳米粒子可以在体内高效降低肿瘤细胞表达pd-l1蛋白的水平。pd-l1蛋白的水平通过elisa检测。3、降解肿瘤细胞外基质实验:担载spam1基因的peg/plg/pei纳米粒子可以在体内提升透明质酸酶的表达量,有利于肿瘤区域透明质酸的降解,从而破坏细胞外基质。透明质酸酶的表达量通过elisa检测。4、抗肿瘤实验:plg-g-mpeg担载阿霉素与共载spam1基因/shpd-l1沉默基因的peg/plg/pei纳米粒子协同可以发挥最好的抗肿瘤效果。5、增加瘤内cd8+t细胞数量的实验:plg-g-mpeg担载阿霉素与共载spam1基因/shpd-l1沉默基因的peg/plg/pei纳米粒子协同可以增加肿瘤内部cd8+t细胞的数量。cd8+t细胞的数量通过流式细胞术检测。本发明采用的试材皆为普通市售品,皆可于市场购得。下面结合实施例,进一步阐述本发明:实施例1plg-g-mpeg/dox纳米粒子(简称doxnps)的制备分别选择聚乙二醇与聚谷氨酸分子量5000da和21600da,将药物载体plg-g-mpeg溶解于二甲基亚砜溶液中,溶解浓度为20mg/ml。将市售盐酸阿霉素dox溶于二甲基亚砜溶液中,溶解浓度为10mg/ml。将载体溶液和药物溶液按照相应的质量比2:1混合,后将混合溶液缓慢滴加至超纯水中,所用超纯水体积为二甲基亚砜体积的八倍,后搅拌20min,搅拌混合液置于3500分子量透析袋,透析2天,制备出plg-g-mpeg/dox纳米颗粒。所制备的纳米颗粒的粒径为100纳米。载药量为28.6%,载药率为80.3%。将制备出的纳米颗粒与纯药以及pbs组同时在体外对比对b16f10肿瘤细胞的杀伤能力、atp释放的影响及钙网蛋白表达的影响,证明doxnps具有引发肿瘤细胞免疫原性死亡的功能(表1)。表1纳米粒子及游离药物引发肿瘤细胞免疫原性死亡肿瘤细胞存活率(%)atp释放量(nm)钙网蛋白表达量(%)pbs1001254.4dox游离药31.53679.7doxnps32.24028.3实施例2peg/plg/pei/spam1+shpd-l1(简称spam1+shpd-l1nps)的制备分别选择聚乙烯亚胺和聚谷氨酸的分子量为25kda和2000da,将pei溶于水溶液中,浓度为5mg/ml,将聚谷氨酸溶于水溶液中,浓度为1mg/ml。二者按照质量比pei:plg=5:1混合。涡旋振荡混匀,复合15分钟,形成pei/plg纳米粒子。将spam1质粒与shpd-l1质粒等量混合形成水溶液,质粒浓度分别为1mg/ml。将质粒混合溶液与peg/plg纳米粒子溶液混合,涡旋振荡混匀,复合15分钟。将双醛基peg溶于水中,浓度为10mg/ml。并加入到之前的质粒纳米粒子中,涡旋振荡混匀,复合15分钟。最终各物质质量比为:peg:pei:plg:dna=5:2.5:1:1。实施例3doxnps联合spam1+shpd-l1nps的抗肿瘤治疗4-6周龄的c57bl6小鼠,随机分为8组,每组6只。在皮下注射100万b16f10细胞,以构建皮下肿瘤模型。各组小鼠分别接受不同的疗法,实验方案如图1中的a所示:pbs组小鼠作为对照,仅给予等量pbs缓冲液;doxnps组给药剂量为5mg/kg;shpd-l1nps组给药剂量为0.75mg/kg;doxnps+shpd-l1nps组,按照图1中a所示,给予5mg/kg的doxnps和0.75mg/kg的shpd-l1nps;spam1nps组给药剂量为0.75mg/kg;doxnps+spam1nps组,按照图1中a所示,给予5mg/kg的doxnps和0.75mg/kg的spam1nps;(shpd-l1+spam1)nps组,按照图1中a所示,给予(shpd-l1和spam1)的nps,以基因含量计算,(spam1+shpd-l1)给药量是每种基因0.75mg/kgdoxnps+(shpd-l1+spam1)nps组,按照图1中a所示,给予5mg/kg的doxnps和(shpd-l1和spam1)的nps,以基因含量计算,(spam1+shpd-l1)给药量是每种基因0.75mg/kg。在联合疗法中,(spam1+shpd-l1)nps隔4天给药一次,共两次,doxnps隔4天给药一次,共两次。对肿瘤的抑制效果如图1所示。结果显示,三者联合用药的效果相对于其他给皆存在显著性的优势,p<0.001.实施例4联合治疗对免疫检查点的阻断效果治疗结束后,将小鼠肿瘤取出,利用elisa试剂盒检测肿瘤组织内免疫检查点pd-l1的含量,检测结果如表3所示。表2联合治疗对pd-l1的阻断效果实施例5联合治疗产生细胞外基质清除剂的能力治疗结束后,将小鼠肿瘤取出,利用elisa试剂盒检测肿瘤组织内透明质酸酶的含量。透明质酸酶可以降解肿瘤组织的透明质酸,属于细胞基质清除剂。检测结果如表4所示。表3联合治疗产生透明质酸酶的能力实施例6联合治疗增加肿瘤内部cd8+t细胞的数量治疗结束后,将小鼠肿瘤取出,利用流式细胞术检测肿瘤内部cd8+t细胞的数量。检测结果如表4所示。表4联合治疗增加肿瘤内部cd8+t细胞的数量以上仅是本发明的优选实施方式,应当指出,对于本
技术领域:
的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1