lncRNAAK124826及其相关分子在诊断多发性肌炎/皮肌炎中的应用的制作方法
本发明属于生物技术和治疗领域,具体涉及lncrnaak124826及其相关分子在诊断多发性肌炎/皮肌炎中的应用。
背景技术:
多发性肌炎/皮肌炎(pm/dm)是较常见的自身免疫性疾病,发病过程中cd4+t细胞发挥重要作用,th17/treg细胞数量和功能失衡,但具体发病机制尚不完全清楚。
多发性肌炎和皮肌炎(polymyositisanddermatomyositis,pm/dm)是一种典型的自身免疫性疾病,其主要表现为肌肉组织淋巴细胞浸润、累及横纹肌,血清特征性抗jo-1抗体阳性,近年来pm/dm发病率逐年升高,目前尚无有效根治疗法。pm/dm的发病机理复杂,涉及遗传、感染、免疫功能及microrna异常表达等众多因素,近年来,不断深入研究该病的发病机制,目前认为在+t细胞异常活化,th17细胞因子反应异常,但具体机理尚未完全阐明。pm/dm患者中存在th17表达异常。th17细胞是新发现的cd4+t细胞的亚型。tournadrea等研究发现,pm/dm患者肌肉组织中cd4+t细胞阳。tournadrea等研究发现,pm/dm患者肌肉组织中cd4+t细胞阳性,il-17表达阳性,th17细胞数量显著增加。
白细胞介素-27(il-27)在调控th17细胞反应中起重要作用。il-27是一种新的il-6/il-12家族细胞因子,主要作用于各种免疫细胞而发挥广泛调节作用,在自身免疫性疾病中扮演重要角色。il-27可以通过下调il-6和tgf-β的表达抑制th17细胞的分化,同时,il-27还可以通过抑制stat1、stat3的磷酸化,调控th17细胞反应。研究发现,多发性硬化急性期患者外周血il-27水平显著降低,il-17水平和th17细胞数量显著增加,il-27和il-17的表达呈显著负相关,初步提示il-27可能通过抑制il-17的分泌,参与多发性硬化的发病。自身免疫性脑脊髓炎小鼠模型研究中发现,il-27受体ebi3基因敲除,小鼠炎症反应加重,炎症组织中th17细胞数量增多。
技术实现要素:
发明目的:本发明研究发现,pm/dm患者外周血cd4+t细胞中th17细胞百分率显著增多,初步结果提示pm/dm患者存在th17细胞表达失调,其机制尚不清楚。本发明研究发现,pm/dm患者外周血il-27表达水平较健康对照者显著降低,但pm/dm患者中il-27的表达如何被调节,及其与th17/treg细胞平衡关系,尚不清楚。
本发明研究发现,lncrnaak124826在pm/dm患者cd4+t细胞中高表达,il-27在pm/dm患者中低表达,芯片网络调控图预测il-27是lncrnaak124826的作用靶点。
因此,我们提出lncrnaak124826通过靶基因il-27影响th17/treg平衡,参与pm/dm的发病。首先观察lncrnaak124826在pm/dm患者中的表达特点;其次,采用慢病毒过表达和干扰技术研究lncrnaak124826对pm/dm患者th17/treg细胞分化的作用机制;第三,验证il-27是lncrnaak124826的功能靶点。本发明为诊断和治疗pm/dm提供新的思路。
本发明以pm/dm患者为疾病组;运动神经元病,重症肌无力,进行性肌肉营养不良,风湿性多肌痛等患者为疾病对照组;肝肾功能指标正常的健康体检者为正常对照组。分离上述研究对象的外周血cd4+t细胞及血清标本。
本发明发现pm/dm患者外周血il-27表达水平较健康对照者显著降低,在明确pm/dm的自身免疫调节机制,找出新的诊断和免疫治疗靶点,以及为研发新的治疗手段提供理论依据。
本发明内容还包括荧光原位杂交(fish)检测各研究组cd4+t细胞lncrnaak124826和il-17共表达。
本发明内容还包括分析各研究组cd4+t细胞内th17/treg细胞的表达、lncrnaak124826、il-27基因和蛋白的表达差异。
本发明内容还包括检测各研究组血清中il-17、tgf-β和肌酸激酶(creatinekinase,ck)的表达情况。
本发明内容还包括综合上述指标及临床资料,分析lncrnaak124826与疾病的关系,以验证lncrnaak124826是否参与pm/dm发病。
技术方案:为了解决上述技术问题,本发明提供了lncrnaak124826在制备预防或治疗多发性肌炎/皮肌炎药物或诊断试剂或试剂盒中的应用。
本发明还提供了lncrnaak124826慢病毒过表达载体在制备预防或治疗多发性肌炎/皮肌炎药物或诊断试剂或试剂盒中的应用。
本发明还提供了lncrnaak124826的rnai干扰载体在制备预防或治疗多发性肌炎/皮肌炎药物或诊断试剂或试剂盒中的应用。
其中,所述lncrnaak124826的靶点为il-27基因。
其中,所述lncrnaak124826调控il-27、tgf-β和/或肌酸激酶的表达水平。
有益效果:与现有技术相比,本发明的优点是:
1、本发明研究发现pm/dm患者外周血中tgf-β和ck表达显著高于健康对照组升高,pm/dm患者外周血cd4+t细胞中th17细胞百分比是(3.24土1.47)%,显著高于健康对照组的(0.82±0.24)%,pm/dm患者外周血cd4+t细胞treg细胞百分比是(3.27土0.45)%,显著低于对照组的(6.78±0.92)%;
2、lncrnaak124826慢病毒过表达载体、rnai干扰载体转入pm/dm患者外周血初始cd4+cd45ra+t细胞,免疫荧光表明转染效率达到80%,荧光定量pcr检测过表达和干扰效果,结果表明表达分别上升和下调了5.6、2.2倍。在cd4+cd45ra+t细胞中过表达lncrnaak124826能够显著活化jak-stat和mapk/p38信号通路,降低lncrnaak124826的表达能够显著抑制上述信号通路,lncrnaak124826过表达组th17细胞比例显著增加,同时treg细胞显著减少;
3、lncrnaak124826可显著降低野生型il-273’utr的报告基因活性,表达下调30%左右,rna免疫共沉淀实验验证il-27为lncrnaak124826的功能靶点。干扰lncrnaak124826后,th17细胞明显减少(1.00±0.03)%,treg细胞显著增加(6.13±0.64)%(p<0.01);然而,将lncrnaak124826和il27同时干扰掉后,发现th17细胞明显增加(3.12±0.19)%,treg细胞显著减少(3.92±0.25)%(p<0.01)。
附图说明
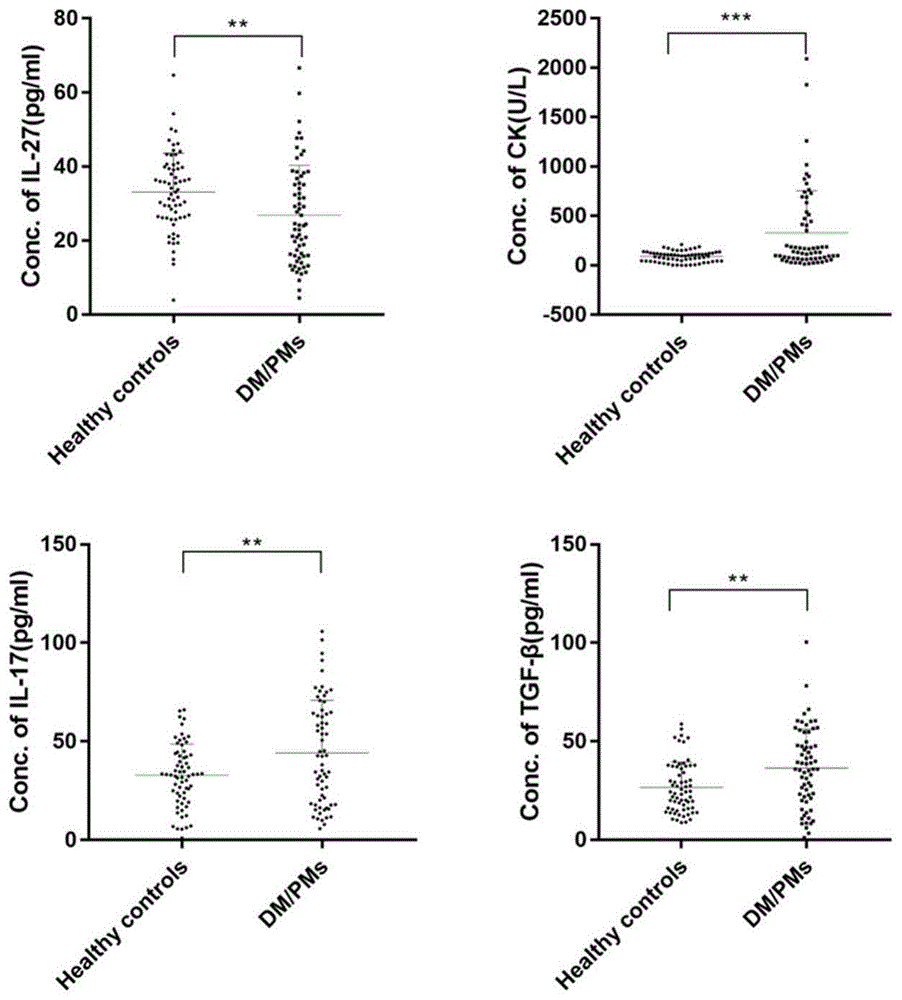
图1健康组和pm/dm患者血清中il-27、tgf-β和肌酸激酶的表达水平;
图2lncrna芯片差异聚类图;
图3为健康组和pm/dm患者血清中lncrnaak124826、il-17和foxp3基因的表达情况;
图4为健康组和pm/dm患者中cd4+t细胞中th17和treg细胞百分比综合;
图5a、图5b为慢病毒过表达载体、rnai干扰载体转入pm/dm患者外周血初始cd4+cd45ra+t细胞,荧光定量pcr检测lncrnaak124826的表达情况;图5c、慢病毒过表达载体、rnai干扰载体转入pm/dm患者外周血初始cd4+cd45ra+t细胞,th17/treg细胞分化信号通路变化;图5d慢病毒过表达载体、rnai干扰载体转入pm/dm患者外周血初始cd4+cd45ra+t细胞,流式细胞术检测各组th17和treg细胞百分比;con表示空白对照,vector表示空载体对照,shnc表示阴性对照;
图6a、pm/dm患者lncrnaak124826调控靶基因网络图;图6b、健康组和pm/dm患者外周血il-27的表达水平;图6c、慢病毒过表达il-27显著抑制jak2/stat3和mapk/p38信号通路;con表示空白对照,vector表示空载体对照;
图7a、lncrnaak124826慢病毒过表达载体、rnai干扰载体转入pm/dm患者外周血初始cd4+cd45ra+t细胞,比较其对含野生型il-273’utr全长的荧光素酶报告基因载体荧光素酶活性的影响图;图7b、rna免疫共沉淀实验验证il-27为lncrnaak124826的功能靶点;图7c、lncrnaak124826慢病毒干扰载体转入pm/dm患者外周血初始cd4+cd45ra+t细胞,采用sirna技术下调il-27的表达;图7d、lncrnaak124826慢病毒干扰载体转入pm/dm患者外周血初始cd4+cd45ra+t细胞,采用sirna技术下调il-27的表达,流式细胞术检测各组th17和treg细胞百分比;igg表示蛋白阴性对照,input表示阳性对照,shnc表示阴性对照。
具体实施方式
下面通过具体的实施例对本发明进一步说明,应当指出,对于本领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干变型和改进,这些也应视为属于本发明的保护范围。下述实施例中的实验方法,如无特殊说明,均为常规方法。
实施例1分析lncrnaak124826在pm/dm患者中的表达
本实施例中以pm/dm患者为疾病组,肝肾功能指标正常的健康体检者为正常对照组,分别收集来自无锡市第二人民医院50例pm/dm患者和50例健康对照组样本,分离上述研究对象的外周血cd4+t细胞并留存血清标本。
1、分析疾病组和对照组血清中il-27、tgf-β和肌酸激酶(creatinekinase,ck)的表达情况。
应用elisa技术分别检测健康对照组和pm/dm患者血清中il-27、tgf-β和肌酸激酶(creatinekinase,ck)的表达水平。操作步骤分别依据il-27、tgf-β和ck的elisa试剂盒说明书进行,酶标仪在450nm波长处测定各孔的吸光度,以标准品浓度为横坐标,标准品od值为纵坐标,绘制标准曲线,通过标准曲线公式计算各样本浓度。结果表明,与健康对照组相比,pm/dm患者tgf-β和ck表达显著升高(p<0.01)(图1)。
2、分析对照组和研究组cd4+t细胞内lncrnaak124826、il-27、foxp3基因和蛋白的表达差异以及th17/treg细胞的比例。
我们对pm/dm患者外周血cd4+t细胞进行lncrna表达谱芯片筛选得到原始数据,首先对原始数据进行预处理,信号值去除背景后,进行中值归一化。通过归一化,有效的消除了实验随机误差对数据分析带来的影响。
lncrna标准为:p值小于0.05,且三组ratio中至少两组大于2倍;筛选下调lncrna标准为:p值小于0.05,且三组ratio中至少两小于0.5倍,lncrna芯片差异聚类图见图2。结果表明,lncrnaak124826表达显著升高(图2)。
我们采用荧光定量pcr检测pm/dm患者外周血cd4+t细胞lncrnaak124826、il-17和foxp3基因的表达。用trizol从培养细胞中提取总rna,用taqman-mirna反转录试剂盒进行反转录。用逆转录试剂盒反应体系将所得rna转录成cdna,然后进行pcr引物合成,引物序列如下:
按照实时定量pcr(rt-pcr)试剂盒的厂家规范进行操作后,构建real-timepcr反应体系。反应条件为:95℃预变性30s,95℃变性10s,然后60℃退火30s,共40个周期。以β-actin作为内参基因,根据待测基因和内参的ct值,采用2-δδct计算待测基因的相对表达量。
流式细胞术检测外周血cd4+t细胞中th17和treg细胞百分比。
(1)流式细胞术检测th17细胞
自培养箱内取出培养后的外周血单个核细胞(pbmc),吸取细胞悬液置于两个流式管中并重悬,标记试验管和对照管。加入1mlpbs洗涤,2000rpm离心5min后弃去上清液。加入5μlpe-cy5.5标记的鼠抗人cd4抗体(购自美国ebioscience公司),对细胞膜表面的cd4分子进行特异性染色,室温下避光孵育30min。再加入1mlpbs洗涤,2000rpm离心5min后弃去上清液。加入100μlil-17a破膜剂(fix&perm)a液(购自美国ebioscience公司)后轻轻混匀,室温避光孵育15min。再用1mlpbs洗涤一次,然后加入100μlil-17a破膜剂(fix&perm)b液(购自美国ebioscience公司)轻轻混匀,在实验管加入5μlpe标记的鼠抗人il-17抗体(购自美国ebioscience公司),在对照管中加入5μl抗鼠pe标记的抗鼠igg1抗体(购自美国ebioscience公司),于室温下避光孵育30min。然后加入1mlpbs洗涤,2000rpm×5min离心,弃上清。并重复洗涤一次。最后加入400μlpbs重悬细胞,混匀后采用流式细胞仪检测cd4+t细胞中il-17a+所占的百分比,表示th17细胞所占百分比,foxp3所占百分比,表示treg细胞所占比例。
(2)流式细胞术检测treg细胞
自培养箱内取出培养后的外周血单个核细胞(pbmc),加入1mlpbs洗涤,2000rpm离心5min后弃去上清液。加入5μlpe-cy5.5标记的鼠抗人cd4抗体(购自美国ebioscience公司),同时加入5μlpe标记的抗人cd25抗体(购自美国ebioscience公司)对细胞膜表面的cd4分子进行特异性染色,室温避光孵育30min。再加入1mlpbs洗涤,2000rpm离心5min后弃去上清液。加入500μlfoxp3专用破膜液后混匀于室温避光孵育30min。加入1mlpbs洗涤,离心(1500rpm×5min),弃上清,重复洗涤一次。然后在实验管加入5μlfitc标记的鼠抗人foxp3抗体(购自美国ebioscience公司)后轻轻混匀,在对照管中加入5μl抗鼠pe-cy5抗鼠igg1抗体(购自美国ebioscience公司),于4℃避光孵育30min。然后加入1mlpbs洗涤,2000rpm×5min离心,弃上清,重复洗涤一次。最后加入400μlpbs重悬细胞,混匀后采用流式细胞仪检测cd4+t细胞中treg细胞百分比。
结果表明,与健康对照组相比,pm/dm患者lncrnaak124826表达显著升高(p<0.01),同时,il-17的基因表达显著升高(p<0.01),而foxp3的基因表达显著下降(p<0.01)(图3);应用流式细胞术分析健康对照组和研究组中th17/treg细胞的分化比例,结果表明pm/dm患者外周血cd4+t细胞中th17细胞百分比是(3.24±1.47)%,显著高于健康对照组的(0.82±0.24)%(p<0.01),pm/dm患者外周血cd4+t细胞treg细胞百分比是(3.27±0.45)%,显著低于对照组的(6.78±0.92)%(p<0.01)(图4)。
实施例2lncrnaak124826对pm/dm患者th17/treg细胞分化的调控作用机制研究
(1)lncrnaak124826过表达载体的构建
首先克隆lncrnaak124826基因全长,以健康人外周血细胞基因组为模板扩增得到ncrnaak124826的cdna链,反应体系:上游引物1μl,下游引物1μl,模版dna1μl,5×pbs缓冲液10μl,dntpmix4μl,
(2)lncrnaak124826rnai干扰载体的构建
遵从rna干扰序列设计原则,设计2个干扰靶点,干扰序列如下:5’-gccgcaggcgtataccataga-3’。同时,设计阴性对照插入序列为5’-gcaagctgaccctgaagttcat-3’。根据干扰靶点序列设计合成寡核苷酸序列,在寡核苷酸序列的5’和3’端分别插入ecori与xbai酶切的真核表达载体pcdna3.1(+)的酶切位点之间得到干扰载体,每对寡核苷酸序列退火后可形成短发夹结构,其中,发夹环为9个碱基组成的小片段dna双链。
(3)lncrnaak124826对pm/dm患者th17/treg细胞分化的研究
将过表达载体pcdna3.1(+)-lncrnaak124826导入cd4+cd45ra+t细胞中分析对th17/treg细胞分化起到重要调控作用的信号通路,同时应用rnai干扰技术敲减cd4+cd45ra+t细胞中lncrnaak124826,下调lncrnaak124826表达水平来进一步验证lncrnaak124826对th17/treg细胞分化的调控作用。其中,基因敲减操作如下:根据lncrnaak124826基因序列,选取干扰lncrnaak124826的靶点序列(5’-gccgcaggcgtataccataga-3’)和阴性对照序列(5’-gcaagctgaccctgaagttcat-3’),按照lipofectamine2000试剂盒在pm/dm患者外周血初始cd4+cd45ra+t细胞对数生长期瞬时转染入细胞,制备为稳定感染lncrnaak124826短发夹rna的cd4+cd45ra+t细胞。
在pm/dm患者外周血初始cd4+cd45ra+t细胞中分别过表达和敲减lncrnaak124826,24h后利用il-6、tgf-β、pm/dm自身抗原jo-1共刺激,进行分化培养,应用流式细胞术分析各研究组cd4+t细胞分化后th17/treg细胞的比例。
lncrnaak124826慢病毒过表达载体、rnai干扰载体转入pm/dm患者外周血初始cd4+cd45ra+t细胞,免疫荧光表明转染效率达到80%(图5a);分别应用荧光定量pcr检测过表达和干扰效果,结果表明表达分别上升和下调了5.6、2.2倍(图5b)。
在cd4+cd45ra+t细胞中过表达lncrnaak124826能够显著活化jak-stat和mapk/p38信号通路,该信号通路可以促进cd4+t细胞向th17的分化,降低treg细胞的比例,诱导pm/dm的发生发展;同样,降低lncrnaak124826的表达能够显著抑制上述信号通路(图5c)。在过表达和敲减lncrnaak124826的cd4+cd45ra+t中分别加入il-6、tgf-β、pm/dm自身抗原jo-1共刺激后进行分化培养,流式细胞术检测th17和treg细胞百分比。结果表明,lncrnaak124826过表达组th17细胞比例显著增加,同时treg细胞显著减少;而降低lncrnaak124826的表达后,th17细胞的比例显著降低,treg细胞显著增加(图5d)。
以上实验结果表明,lncrnaak124826对pm/dm患者th17/treg细胞的分化起调控作用,促进cd4+cd45ra+t细胞向th17细胞分化,抑制其向treg细胞分化。
实施例3lncrnaak124826与il27基因和蛋白表达的相关关系
lncrna的作用方式之一是调控其临近染色体位置的编码基因表达,我们通过生物信息学对lncrnaak124826进行cis作用和trans作用靶基因的预测分析,形成了以lncrnaak124826为中心的网络调控图(图6a),结果发现il-27位于其临近染色体位置,可能受到其调控作用作为靶基因。我们应用elisa法检测pm/dm和健康对照组外周血il-27的水平,操作步骤依据il-27的elisa试剂盒说明书进行,酶标仪在450nm波长处测定各孔的吸光度,以标准品浓度为横坐标,标准品od值为纵坐标,绘制标准曲线,通过标准曲线公式计算各样本浓度。结果表明pm/dm患者外周血il-27的表达达水平为13.42±3.73pg/ml,显著低于健康对照者的36.3±8.09pg/ml(p<0.01)(图6b)。为了进一步研究il-27在pm/dm患者中的作用机制,应用慢病毒过表达技术进一步上调il-27在pm/dm患者初始cd4+cd45ra+t细胞内的表达,结果如图6c所示,上调il-27的表达水平能够显著抑制jak-stat和mapk/p38信号通路的活化(图6c)。
实施例4验证il-27是lncrnaak124826的功能靶点
在确认lncrnaak124826参与pm/dm的发生发展,并与il-27蛋白表达呈负相关的基础上,进一步验证il-27是否为lncrnaak124826的功能靶点,从以下三个方面开展研究:
通过双荧光素酶报告基因实验,观察lncrnaak124826对含野生型il-273’utr全长的荧光素酶报告基因载体荧光素酶活性的直接抑制作用。用rt-pcr方法扩增il-27上lncrnaak124826结合位点的3’utr区基因片段。方法如下:以健康人外周血细胞基因组为模板,根据引物序列:forword:5’-atggactatcatatgcttaccgta-3’;reverse:5’-ctgcactgtaccccccaatc-3’,反应体系:premixtaq25μl(购自大连宝生物公司),h2o22μl,上游引物1ul,下游引物1μl,模版dna1μl。反应条件:95℃,5min预解螺旋,95℃(30s),60℃(30s),72℃(3min),共32个循环,72℃(10min),然后用1.0%琼脂糖凝胶电泳30min,应用dna胶回收试剂盒回收目的片段。将该片段插入pgl3启动子荧光素酶报告载体中,构建il-273′utr野生型(il-273′utr-wt)质粒。然后,利用基因突变技术对上述结合位点的部分核苷酸进行突变,具体突变位点序列如下:forword:5’-ggtgcaaagtgggaactgtg-3’;reverse:5’-cgtgcgacggatgagttaacg-3’。从而构建il-273′utr突变(il-273′utr-mut)质粒。所有质粒均由上海生物工程公司合成,并经过dna测序验证。将il-273′utr-wt质粒或il-273′utr-mut质粒与lncrnaak12482模拟物(购于上海吉凯制药技术有限公司合成,序列5‘-ggagagacttagtt-3’)共转染入pm/dm患者外周血初始cd4+cd45ra+t细胞,转染过程按照lipofectamine2000试剂盒说明书进行。培养48h后根据双荧光素酶报告基因试剂盒的说明,在无光条件下测定荧光素酶活性。
lncrnaak124826可显著降低野生型il-273’utr的报告基因活性(p<0.01),表达下调30%左右(图7a)。结果表明,lncrnaak124826对il-27有靶向调控作用,能够抑制il-27的表达。rna免疫共沉淀实验验证il-27为lncrnaak124826的功能靶点(图7b)。
lncrnaak124826慢病毒干扰载体转入pm/dm患者外周血初始cd4+cd45ra+t细胞,采用sirna技术下调il-27的表达,elisa检测各组il27的表达(图7c)。用il-6、tgf-β、pm/dm自身抗原jo-1共刺激培养,流式细胞术检测各组cd4+t细胞内th17和treg细胞的表达。结果表明,干扰掉lncrnaak124826后,th17细胞明显减少(1.00±0.03)%,treg细胞显著增加(6.13±0.64)%(p<0.01);然而,将lncrnaak124826和il27同时干扰掉后,发现th17细胞明显增加(3.12±0.19)%,treg细胞显著减少(3.92±0.25)%(p<0.01)(图7d)。
以上实验结果表明,lncrnaak124826通过负向调控il27,参与th17/treg细胞分化的调控,从而参与pm/dm的发生。
序列表
<110>常熟市第二人民医院
<120>ncrnaak124826及其相关分子在诊断多发性肌炎/皮肌炎中的应用
<160>15
<170>siposequencelisting1.0
<210>1
<211>20
<212>dna
<213>lncrnaak124826上游引物(artificialsequence)
<400>1
cagaccgttgaaaagacccc20
<210>2
<211>21
<212>dna
<213>lncrnaak124826下游引物(artificialsequence)
<400>2
ccatcgtcgttgtgactctcg21
<210>3
<211>17
<212>dna
<213>il-27上游引物(artificialsequence)
<400>3
caggcgaccttggctgg17
<210>4
<211>20
<212>dna
<213>il-27下游引物(artificialsequence)
<400>4
ggtacaggttcactcctggc20
<210>5
<211>22
<212>dna
<213>foxp3上游引物(artificialsequence)
<400>5
acagcacattcccagagttcct22
<210>6
<211>21
<212>dna
<213>foxp3下游引物(artificialsequence)
<400>6
cattgagtgtccgctgcttct21
<210>7
<211>29
<212>dna
<213>上游引物(artificialsequence)
<400>7
gcaagctttatgaactttctgctgtcttg29
<210>8
<211>31
<212>dna
<213>下游引物(artificialsequence)
<400>8
gctctagattaccgcctcggcctgtcacatc31
<210>9
<211>21
<212>dna
<213>干扰lncrnaak124826的靶点序列(artificialsequence)
<400>9
gccgcaggcgtataccataga21
<210>10
<211>22
<212>dna
<213>干扰阴性对照序列(artificialsequence)
<400>10
gcaagctgaccctgaagttcat22
<210>11
<211>24
<212>dna
<213>il-27上游引物(artificialsequence)
<400>11
atggactatcatatgcttaccgta24
<210>12
<211>20
<212>dna
<213>il-27下游引物(artificialsequence)
<400>12
ctgcactgtaccccccaatc20
<210>13
<211>20
<212>dna
<213>il-27突变上游引物(artificialsequence)
<400>13
ggtgcaaagtgggaactgtg20
<210>14
<211>21
<212>dna
<213>il-27突变下游引物(artificialsequence)
<400>14
cgtgcgacggatgagttaacg21
<210>15
<211>13
<212>dna
<213>lncrnaak12482模拟物(artificialsequence)
<400>15
ggagagacttagt13
- 还没有人留言评论。精彩留言会获得点赞!