一种促进骨折修复的可降解柔性薄膜器件的制备方法与流程
本发明属于功能器件技术领域,具体涉及一种植入式生物可降解柔性薄膜器件的制备方法,以及该柔性薄膜器件在促进骨折修复过程中的应用。
背景技术:
骨折是典型的肌肉骨骼疾病,是一种公共卫生领域的重大问题,给人们的日常生活造成严重破坏,甚至夺走了数百万人的活动能力并导致残疾。大于骨组织承载能力的强力冲击可能会导致骨折,而在某些削弱骨质疏松和成骨不全的病理状态下,轻微的创伤性损伤也可能导致脆性骨折。在我国,每年就有超过600万人遭受骨折困扰。骨折的发生率随年龄的增长而增加,全世界每年因年龄相关的脆性骨折约为900万例。骨折还导致了巨大的经济负担,预计2025年的全球因骨折疾病的花费为252.6亿美元,在2050年的全球支出将增至1315亿美元。
研究人员已经用生物惰性材料或合成材料代替缺失的骨组织,但是移植材料很难在修复过程中对生物信号实时响应。为了实现骨组织的再生,许多药物已经研发用来防止骨折并有效促进骨折愈合。但是,普通药物(例如维生素d和口服钙)的作用不够明显,且需要长期服用。干细胞疗法已显示出对骨不连骨折修复的巨大潜力,但它价格昂贵且处于初步临床阶段。因此,随着人口老龄化和骨折风险的增加,亟需低成本、高效的干预措施和再生疗法来增强骨骼强度和促进骨折愈合。
通过电刺激模拟内源性电场能够调节生物电状态并加速骨折修复,在临床治疗中作为一种有前途的非药物治疗方法脱颖而出并已获得fda批准。适当的电场可以激活细胞相关基因的表达,促进受损组织细胞的增殖和分化,并积极诱导和刺激组织再生。但是,目前临床电场干预依赖于大型设备,该类设备仍然庞大且不方便日常治疗。为了克服现有电刺激方法的局限性,压电骨支架等可植入生物活性材料已经被广泛研究,尽管这些材料可以促进细胞增殖和分化,但它们的电输出难以达到最佳的骨刺激电压,并且由于不可降解特性而导致再次手术的风险进一步阻碍了其临床应用。因此,如何摆脱传统的笨重电池以实现最佳的有效刺激,并避免移除设备的二次手术风险,仍然是骨折修复策略的主要挑战。
技术实现要素:
本发明针对背景技术存在的缺陷,提出了一种基于金字塔结构聚乳酸-羟基乙酸共聚物(plga)薄膜和岛桥结构金属镁电极制备的植入式生物可降解柔性薄膜器件,该器件能够捕获身体运动能量产生低频交变电场,进而促进骨折快速修复。本发明方法操作简单、成本低,通过生物体自身运动能量驱动器件工作,进而摆脱传统电池的限制,所制备柔性薄膜器件的机电耦合输出性能和可穿戴性能够协同提升。本发明得到的植入式柔性薄膜器件用于骨折的修复治疗,相较于无器件作用的愈合时间(>10周),能够明显缩短骨折损伤愈合时间(~6周)。柔性薄膜器件作用修复的大鼠骨密度及骨强度能够提升至正常水平,且明显高于无器件作用大鼠的骨密度(>35%)和骨断裂强度(>85%),而且在愈合后薄膜器件能够生物降解,进而规避二次手术的风险。
本发明的技术方案如下:
一种促进骨折修复的可降解柔性薄膜器件的制备方法,其特征在于,包括以下步骤:
步骤1:将聚乳酸-羟基乙酸共聚物(plga)粉末加入有机溶剂中,超声混合后磁力搅拌,得到均匀的plga分散溶液;其中,在plga分散溶液中,plga的质量浓度为10~100g/l;
步骤2:在倒金字塔基板上旋涂步骤1得到的plga分散溶液,旋涂转速为500~1000r/min,然后在60~100℃的干燥箱中处理18~24h以使plga成膜并充分去除溶剂,得到的金字塔结构plga柔性薄膜作为可降解柔性薄膜器件的机电耦合功能层;
步骤3:在平整基板上旋涂步骤1得到的plga分散溶液,旋涂转速为500~1000r/min,然后在60~100℃的干燥箱中处理18~24h以使plga成膜并充分去除溶剂,得到的平整结构的plga柔性薄膜作为可降解柔性薄膜器件的封装层;
步骤4:取两张镁箔,分别将两张镁箔平整地粘附于热释放胶带上,并利用激光烧蚀制备带岛桥结构和梳状结构的两个镁电极,作为上、下镁电极;然后将上、下镁电极在100~150℃温度下转印至步骤2制备平整结构的plga柔性薄膜上,用点阵焊枪在200~300℃下热塑性固定,得到镁上电极和镁下电极;
步骤5:按照镁下电极、步骤2金字塔结构plga柔性薄膜、镁上电极的顺序层叠得到三明治结构,其中,镁上电极和镁下电极层叠后,岛桥结构完全重合,梳状结构形成叉指电极结构;然后用平头焊枪在200~300℃下将边沿热塑性封装,即可得到所述可降解柔性薄膜器件。
进一步地,步骤1所述有机溶剂为三氯甲烷、四氢呋喃或乙酸乙酯等。
进一步地,步骤2所述倒金字塔基板为硅基板、玻璃基板等。
进一步地,步骤2所述的倒金字塔基板、步骤3所述的平整基板和步骤4所述镁上电极、镁下电极均具有对准标记,以实现步骤5的封装集成。
进一步地,步骤2所述金字塔结构plga柔性薄膜的厚度为100微米以上,步骤3所述平整结构的plga柔性薄膜的厚度为100微米以上。
进一步地,步骤4所述的激光烧蚀的最小线宽为80μm。
进一步地,步骤4所述岛桥结构中,相邻方块电极的距离l以及方块电极的边长l均为800μm;相邻方块电极采用蜿蜒线连接,蜿蜒线由四分之一圆弧、半圆圆弧和四分之一圆弧依次连接得到。
进一步地,步骤2得到的金字塔结构plga柔性薄膜和步骤3得到的平整结构的plga柔性薄膜的尺寸为12mm×12mm×0.1mm。
进一步地,步骤5得到的柔性薄膜器件的尺寸为35mm×15mm×0.5mm。
本发明的有益效果为:
1、本发明可降解柔性薄膜器件贴附于组织捕获身体运动能量,驱动金字塔结构plga和上下镁电极接触和分离,基于电负性差异上下镁电极之间会输出交变电压,通过梳状电极产生低频交变电场,进而作用于骨折部位促进快速修复。特别地,金字塔结构一方面能够为镁电极和plga功能层提供接触/分离空间,另一方面能够灵敏地响应生物体自身运动;基于蜿蜒线互连的岛桥结构镁电极在大形变范围下保证了器件的柔韧性能和鲁棒性能。
2、本发明通过金字塔结构plga薄膜、岛桥结构镁电极和plga封装层制备的器件具有优异的生物兼容性和生物可降解特性,与不具有降解特性的器件相比,规避了二次手术去除器件的风险。
3、本发明首先通过制备plga溶液,将其涂覆于倒金字塔微结构基板上并烘干制备微结构薄膜,接着采用激光烧蚀和转印技术制备岛桥结构镁电极,最后利用热塑性集成封装实现柔性薄膜器件的制备;制备的基于金字塔微结构薄膜和岛桥结构镁电极的柔性器件具有较大的机电耦合性能,岛桥结构构型及热塑性封装能够降低降解过程中器件的器件溶胀效应进而保持长期输出稳定特性。
4、本发明器件制备方法简单,成本低廉,具有较好的鲁棒性能和较短的骨折修复时间,而且具有良好的工艺可控性和重复性,有利于批量大规模生产。
附图说明
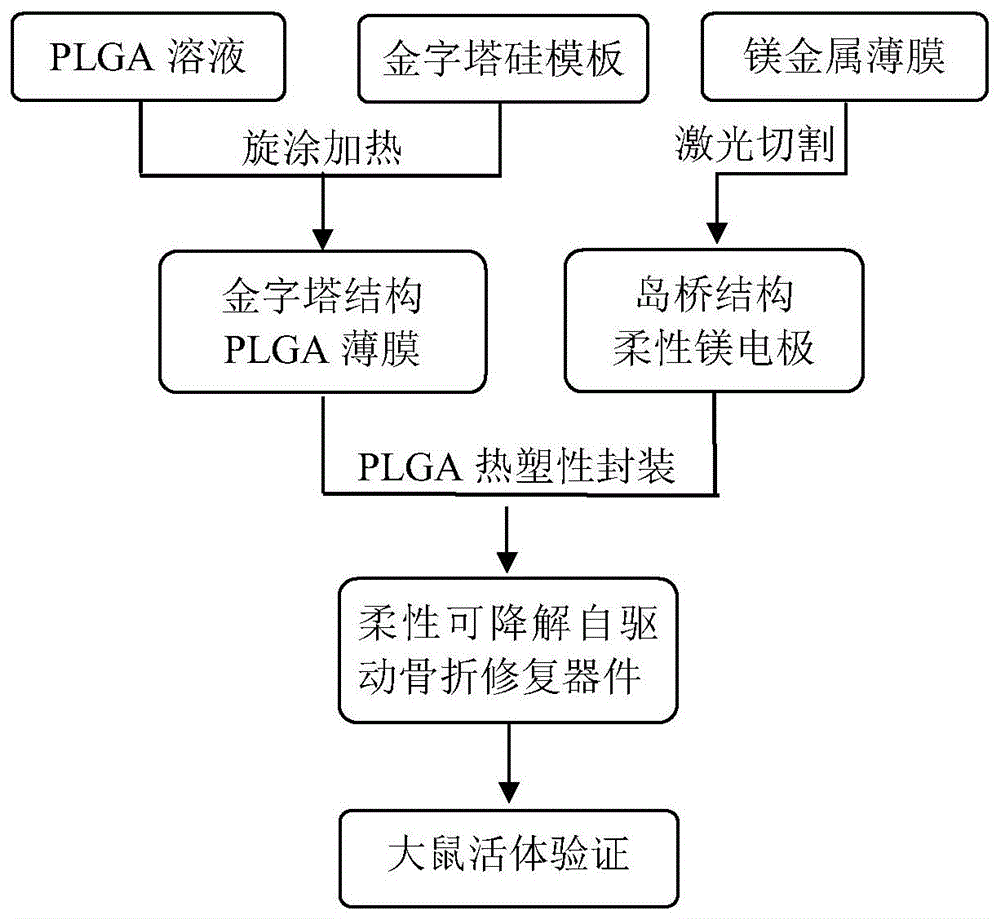
图1为本发明促进骨折修复的可降解柔性薄膜器件的制备流程图;
图2为本发明促进骨折修复的可降解柔性薄膜器件的具体制备过程示意图;
图3为实施例步骤3平整结构plga薄膜和步骤2金字塔微结构薄膜的sem、3d显微图;其中(a)对应平整和金字塔结构plga薄膜的sem结构表征,(b)对应金字塔微结构plga薄膜的3d显微镜表征,(c)对应(b)3d显微镜线扫描高度图;
图4为实施例步骤3平整结构plga薄膜和步骤2金字塔微结构plga薄膜的机电耦合输出性能;
图5为岛桥结构镁电极的器件输出和力学性能表征;其中(a)为岛桥构型示意图和不同l(400μm、500μm、600μm、800μm、1000μm、2000μm和4000μm)的岛桥结构镁电极实物图,(b)为基于不同l岛桥结构的器件电压输出,(c)为岛桥电极(l=800μm)的力学性能测试结果,(d)实施例柔性薄膜器件的长期稳定性测试结果;
图6为实施例制备的柔性器件在pbs溶液中降解过程示意图;
图7为器件作用于大鼠胫骨骨折的修复测试结果;其中,(a)为不同组的x-ray胫骨扫描对比图(s组为实施例完整器件的作用效果图、p组为对比例2中岛桥电极和叉指电极断开器件作用效果图、n组为未植入器件的作用效果图);(b)为不同组胫骨修复后的骨密度对比图(i组是未经骨折手术的完整组);(c)不同组胫骨修复后的骨强度对比图。对于图(b)和(c),样本数量为4,样本数据以圆球表示,箱式图的数据均以平均值±s.d表示(中线为平均值)。统计分析是通过双尾t检验进行的。n.s.表示无统计学差别(p>0.05),*(p<0.05)、**(p<0.01)和***(p<0.001)表示具有统计学差别。
具体实施方式
下面结合附图和实施例,详述本发明的技术方案。
实施例
实施例中各原料来源为:plga(>99wt%)和三氯甲烷(>98wt%)购于阿拉丁生化科技公司,sio2/si基片购于合肥科晶有限公司。
一种用于骨折修复的植入式生物可降解柔性薄膜器件(电极连通)的制备方法,包括以下步骤:
步骤1:常温下,将5gplga粉末加入100ml三氯甲烷中,超声10min混合,磁力搅拌2h,得到均匀的plga分散溶液;
步骤2:在sio2/si倒金字塔基板上旋涂步骤1得到的plga分散溶液,旋涂转速为1000r/min,然后在60℃的干燥箱中处理18h以使plga成膜并充分去除三氯甲烷,提高plga薄膜的结晶性能,得到的金字塔结构plga柔性薄膜作为可降解柔性薄膜器件的机电耦合功能层;
步骤3:在平整基板上旋涂步骤1得到的plga分散溶液,旋涂转速为500r/min,然后在60℃的干燥箱中处理18h以使plga成膜并充分去除三氯甲烷,提高plga薄膜的结晶性能,得到的平整结构的plga柔性薄膜作为可降解柔性薄膜器件的封装层;
步骤4:如图2所示,取两张30μm的金属镁箔,分别将两张金属镁箔平整地粘附于热释放胶带上,并利用激光烧蚀制备带岛桥结构和梳状结构、以及对准标记的两个镁电极,其中,岛桥结构和梳状结构相连,作为上、下镁电极;然后将上、下镁电极在150℃温度下转印至步骤2制备平整结构的plga柔性薄膜上,用点阵焊枪在200℃下热塑性固定,得到镁上电极和镁下电极;岛桥结构中,相相邻方块电极的距离l以及方块电极的边长l均为800μm;相邻方块电极采用蜿蜒线连接,蜿蜒线由四分之一圆弧、半圆圆弧和四分之一圆弧依次连接得到;
步骤5:基于每层的对准标记,按照镁下电极、步骤2金字塔结构plga柔性薄膜、镁上电极的顺序层叠得到三明治结构,其中,镁上电极和镁下电极层叠后,岛桥结构完全重合,梳状结构形成叉指电极结构;然后用平头焊枪在200℃下将边沿热塑性封装,即可得到所述可降解柔性薄膜器件,器件尺寸约为35mm×15mm×0.5mm;
步骤6:在sd大鼠造胫骨骨折模型,将步骤5制备的器件植入腿部皮下,用x-ray扫描仪监测骨痂形成和骨折线消失速度;利用小动物骨密度仪检测骨密度;采用万能试验机分别检测骨强度。
对比例1
一种用于骨折修复的植入式生物可降解柔性薄膜器件(岛桥电极和叉指电极连通)的制备方法,包括以下步骤:
步骤1:常温下,将5gplga粉末加入100ml三氯甲烷中,超声10min混合,磁力搅拌2h,得到均匀的plga分散溶液;
步骤2:在平整基板上旋涂步骤1得到的plga分散溶液,旋涂转速为500r/min,然后在60℃的干燥箱中处理18h以使plga成膜并充分去除三氯甲烷,提高plga薄膜的结晶性能,得到的平整结构的plga柔性薄膜作为可降解柔性薄膜器件的功能层和封装层;
步骤3:取两张30μm的金属镁箔,分别将两张金属镁箔平整地粘附于热释放胶带上,并利用激光烧蚀制备带岛桥结构和梳状结构、以及对准标记的两个镁电极,其中,岛桥结构和梳状结构相连,作为上、下镁电极;然后将上、下镁电极在150℃温度下转印至步骤2制备平整结构的plga柔性薄膜上,用点阵焊枪在200℃下热塑性固定,得到镁上电极和镁下电极;
步骤4:基于每层的对准标记,按照镁下电极、步骤2平整结构的plga柔性薄膜、镁上电极的顺序层叠得到三明治结构,其中,镁上电极和镁下电极层叠后,岛桥结构完全重合,梳状结构形成叉指电极结构;然后用平头焊枪在200℃下将边沿热塑性封装,即可得到所述可降解柔性薄膜器件
对比例2
一种用于骨折修复的植入式生物可降解柔性薄膜器件(岛桥电极和叉指电极断开)的制备方法,包括以下步骤:
步骤1:常温下,将5gplga粉末加入100ml三氯甲烷中,超声10min混合,磁力搅拌2h,得到均匀的plga分散溶液;
步骤2:在倒金字塔基板上旋涂步骤1得到的plga分散溶液,旋涂转速为1000r/min,然后在60℃的干燥箱中处理18h以使plga成膜并充分去除三氯甲烷,提高plga薄膜的结晶性能,得到的金字塔结构plga柔性薄膜作为可降解柔性薄膜器件的机电耦合功能层;
步骤3:在平整基板上旋涂步骤1得到的plga分散溶液,旋涂转速为500r/min,然后在60℃的干燥箱中处理18h以使plga成膜并充分去除三氯甲烷,提高plga薄膜的结晶性能,得到的平整结构的plga柔性薄膜作为可降解柔性薄膜器件的封装层;
步骤4:取两张30μm的金属镁箔,分别将两张金属镁箔平整地粘附于热释放胶带上,并利用激光烧蚀制备带岛桥结构和梳状结构、以及对准标记的两个镁电极,其中,岛桥结构和梳状结构断开、不连接,作为上、下镁电极;然后将上、下镁电极在150℃温度下转印至步骤2制备平整结构的plga柔性薄膜上,用点阵焊枪在200℃下热塑性固定,得到镁上电极和镁下电极;
步骤5:基于每层的对准标记,按照镁下电极、步骤2金字塔结构plga柔性薄膜、镁上电极的顺序层叠得到三明治结构,其中,镁上电极和镁下电极层叠后,岛桥结构完全重合,梳状结构形成叉指电极结构;然后用平头焊枪在200℃下将边沿热塑性封装,即可得到所述可降解柔性薄膜器件,器件尺寸约为35mm×15mm×0.5mm;
步骤6:在sd大鼠造胫骨骨折模型,将步骤5制备的器件植入腿部皮下,用x-ray扫描仪监测骨痂形成和骨折线消失速度;利用小动物骨密度仪检测骨密度;采用万能试验机分别检测骨强度。
下面对对比例1和对比例2、实施例制得的生物可降解柔性薄膜器件促进骨折修复进行分析:
图1为本发明促进骨折修复的可降解柔性薄膜器件的制备流程图;图2为本发明促进骨折修复的可降解柔性薄膜器件的具体制备过程示意图;金属镁电极通过激光烧蚀进行图形化,接着转印至制备的平整plga薄膜上得到上下镁电极,再将上下镁电极和制备的plga功能层薄膜多层组装形成三明治结构,最后热塑性封装制备柔性薄膜器件用于骨折修复治疗。其中,对比例1中的plga功能层不具有金字塔微结构,对比例2中的岛桥电极和叉指电极之间的导线处于断开状态。
图3为实施例步骤3平整结构plga薄膜和步骤2金字塔微结构薄膜的sem、3d显微图;其中(a)对应平整和金字塔结构plga薄膜的sem结构表征,(b)对应金字塔微结构plga薄膜的结构3d显微镜表征,(c)对应(b)3d显微镜线扫描高度图。由图3可知,平整结构plga薄膜的表面平整,而通过硅模板制备的金字塔结构薄膜表面具有均匀的微结构,且由线扫描图可知金字塔高度约为7.5μm,切斜角度约为58.5°。
图4为实施例步骤3平整结构plga薄膜和步骤2金字塔微结构plga薄膜的机电耦合输出性能;由图4可知,相较于平整plga薄膜的机电耦合输出(峰峰值约为2.2v),金字塔微结构的plga薄膜具有更高的峰值电压输出(~4.6v),表明金字塔结构能够显著提高plga薄膜的机电耦合性能。
图5为岛桥结构镁电极的器件输出和力学性能表征;其中(a)为岛桥构型示意图和不同l(400μm、500μm、600μm、800μm、1000μm、2000μm和4000μm)的岛桥结构镁电极实物图,岛桥结构为多个方块电极阵列排列得到的矩形,相邻方块电极的间距和方块电极的边长记为l,相邻方块电极之间采用蜿蜒线连接;(b)为基于不同l的岛桥结构的器件电压输出,表明在l为800μm和1000μm时具有较大输出(峰峰值约为4.5v);(c)为岛桥电极(l=800μm)的力学性能测试结果,通过球形结构戳动岛桥结构进行岛桥结构的力学测试,结果表明:在戳动幅度为6mm,循环100次之后,岛桥结构能够恢复原来形状,表明该结构具有优异的鲁棒性能;(d)实施例柔性薄膜器件的长期稳定性测试结果,表明在大于10周的长期测试过程中,薄膜器件的输出电压基本保持稳定,表明基于微结构plga薄膜和岛桥结构制备的器件具有优异可靠性。
将实施例制得的器件在pbs溶液(磷酸缓冲盐溶液)中进行降解监测,结果如图6所示。由图6可知,在12周内,器件能够保持良好的密封性;从第13周开始,器件的plga封装层及岛桥结构镁电极逐步降解;到第18周岛桥结构电极完全降解,金字塔结构和封装层的plga薄膜大部分降解,表明器件能够在一定时间范围内稳定工作,在修复工作完成后能够生物降解。
图7为器件作用于大鼠胫骨骨折的修复测试结果;其中,(a)为不同组的x-ray胫骨扫描对比图(s组为实施例完整器件的作用效果图、p组为对比例2中岛桥电极和叉指电极断开器件作用效果图、n组为未植入器件的作用效果图);(b)为不同组胫骨修复后的骨密度对比图(i组是未经骨折手术的完整组);(c)不同组胫骨修复后的骨强度对比图。对于图(b)和(c),样本数量为4,样本数据以圆球表示,箱式图的数据均以平均值±s.d表示(中线为平均值)。统计分析是通过双尾t检验进行的。n.s.表示无统计学差别(p>0.05),*(p<0.05)、**(p<0.01)和***(p<0.001)表示具有统计学差别。从图7(a)s、p和n组的x-ray扫描结果可知,s组的骨痂形成、骨折线消失和骨痂消失的速度明显高于p组和n组,在第6周时s组基本完成骨折愈合,而p组和n组的骨折愈合速度类似。在6周修复后,将未经骨折的完整组(i)、s组、p组和n组的胫骨取出,进行骨密度扫描。扫描结果表明,i、s、p和n组的骨密度平均值分别为0.20、0.19、0.14和0.15g/cm2,且i组和s组没有明显差异,p组和n组没有明显差异,而i组、s组和p组、n组具有统计学差异(>35%),表明器件能够有效促进胫骨骨折愈合。采用万能试验机对骨强度进行测试,i、s、p和n组的骨断裂强度平均值分别为14.3、13.5、7.6和7.4mpa。类似地,i组和s组没有明显差异,p组和n组没有明显差异,而i组、s组和p组、n组具有统计学差异(>85%),进一步表明器件能够有效促进胫骨骨折愈合。
本发明提出了一种基于金字塔结构聚乳酸-羟基乙酸共聚物(plga)薄膜和岛桥结构金属镁电极制备的植入式生物可降解柔性薄膜器件,用于促进大鼠胫骨骨折快速修复。本发明方法操作简单、成本低,通过生物体自身运动能量驱动器件产生低频交变电场,进而摆脱传统电池的限制,所制备柔性薄膜器件的机电耦合输出性能和可穿戴性能够协同提升;本发明得到的植入式柔性薄膜器件用于骨折的修复治疗,相较于无器件作用的愈合时间(>10周),能够明显缩短骨折损伤愈合时间(~6周)。柔性薄膜器件作用修复的大鼠骨密度及骨强度能够提升至正常水平,且明显高于无器件作用大鼠的骨密度(>35%)和骨断裂强度(>85%),而且在愈合后生物降解规避二次手术的风险。
- 还没有人留言评论。精彩留言会获得点赞!