布鲁氏菌病和口蹄疫二联疫苗及制备方法和应用与流程
本发明涉及生物技术领域,尤其是涉及一种布鲁氏菌病和口蹄疫二联疫苗及制备方法和应用。
背景技术:
随着奶牛养殖行业集约化和养殖密度的提升,布鲁氏菌病、口蹄疫成为了危害奶牛业发展的重大疾病,同时布鲁氏菌病作为人蓄共患病危害日益增大,患病动物为主要传染源,人无疫苗可用,但当下所使用的活疫苗对人和动物均有感染风险;口蹄疫疫苗在使用过程中因其含有大量的佐剂成份,奶牛免疫后存在一定的副反应,比如体温升高、食欲废退、产奶量下降等。
有鉴于此,特提出本发明。
技术实现要素:
本发明的第一个目的在于提供一种布鲁氏菌病和口蹄疫二联疫苗,以至少缓解了现有技术中存在的技术问题之一。
本发明的第二个目的在于提供上述布鲁氏菌病和口蹄疫二联疫苗的制备方法。
本发明的第三个目的在于提供上述布鲁氏菌病和口蹄疫二联疫苗在制备预防布鲁氏菌病和/或口蹄疫的产品中的应用。
本发明提供了一种布鲁氏菌病和口蹄疫二联疫苗,所述布鲁氏菌病和口蹄疫二联疫苗包括口蹄疫病毒样颗粒和装载所述口蹄疫病毒样颗粒的布鲁氏菌菌影。
进一步的,所述布鲁氏菌菌影与口蹄疫病毒样颗粒的用量比为2:1~3:1(w/w),优选为2.5:1。
进一步的,每头份所述布鲁氏菌病和口蹄疫二联疫苗中含布鲁氏菌菌影25~35μg,优选为28μg。
进一步的,所述布鲁氏菌菌影由含有噬菌体裂解蛋白e基因和金黄色葡萄球菌核酸酶a基因的布鲁氏菌疫苗菌株制备得到。
进一步的,所述噬菌体裂解蛋白e基因具有如seqidno.1所示的核苷酸序列;
优选地,所述金黄色葡萄球菌核酸酶a基因具有如seqidno.2所示的核苷酸序列;
优选地,所述布鲁氏菌菌株为a19菌株。
进一步的,所述噬菌体裂解蛋白e基因表达噬菌体裂解蛋白e,所述金黄色葡萄球菌核酸酶a基因表达金黄色葡萄球菌核酸酶a;
所述噬菌体裂解蛋白e与所述金黄色葡萄球菌核酸酶a通过linker氨基酸相连接。
进一步的,由氨基端至羧基端依次为噬菌体裂解蛋白e、linker氨基酸和金黄色葡萄球菌核酸酶a;
优选地,所述linker氨基酸具有如seqidno.3所示的氨基酸序列。
进一步的,所述口蹄疫病毒样颗粒由酵母菌表达组装制成。
本发明还提供了上述的布鲁氏菌病和口蹄疫二联疫苗的制备方法,将口蹄疫病毒样颗粒装载入布鲁氏菌菌影中,得到所述布鲁氏菌病和口蹄疫二联疫苗。
进一步的,所述装载至少满足如下条件之一:
温度为2~8℃;转速为100~120转/min;时间为25~30min;
优选地,温度为4~6℃;转速为115转/min;时间为26min。
此外,本发明还提供了上述布鲁氏菌病和口蹄疫二联疫苗在制备预防布鲁氏菌病和/或口蹄疫的产品中的应用。
与现有技术相比,本发明具有如下有益效果:
本发明提供的布鲁氏菌病和口蹄疫二联疫苗,利用布鲁氏菌菌影抗原作为载体,将口蹄疫病毒样颗粒装载其中,进而做到一种疫苗预防两种疾病的目的,同时杜绝布鲁氏菌活疫苗使用过程中的生物安全风险,克服口蹄疫疫苗使用过程中副反应问题。并且,本发明的发明人通过实验还证实了,应用本发明提供的布鲁氏菌病和口蹄疫二联疫苗进行免疫后,可以有效的诱导产生免疫反应,抵御布鲁氏菌及口蹄疫强毒的攻击。同时,免疫奶牛后副反应显著降低,单日奶产量与对照组无差异,无明显体温反应。
本发明提供的上述布鲁氏菌病和口蹄疫二联疫苗的制备方法,通过将口蹄疫病毒样颗粒装载入布鲁氏菌菌影中即可得到所述布鲁氏菌病和口蹄疫二联疫苗。该方法工艺简单,操作方便,且制备得到的布鲁氏菌病和口蹄疫二联疫苗具有良好的免疫原性和生物安全性,适于推广应用。
附图说明
为了更清楚地说明本发明具体实施方式或现有技术中的技术方案,下面将对具体实施方式或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图是本发明的一些实施方式,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
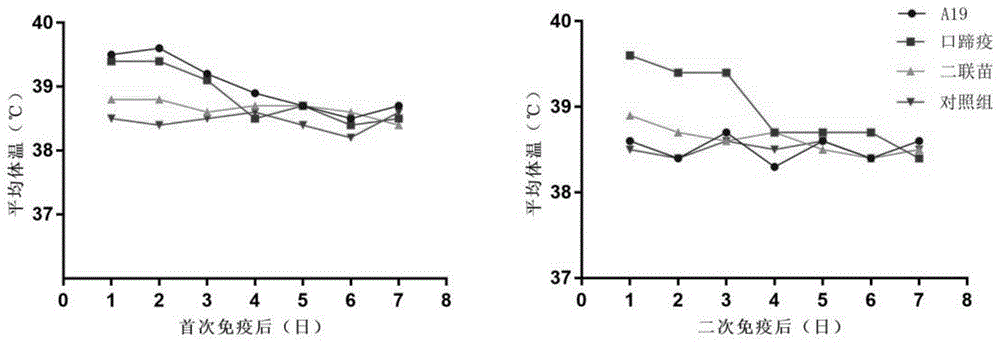
图1为本发明实验例1提供的免疫后体温检测结果图,其中,左图为首次免疫后的体温检测结果,右图为二次免疫后的体温检测结果;
图2为本发明实验例1提供的免疫后奶产量检测结果图;
图3为本发明实验例1提供的免疫后抗体检测结果图,其中,左图为布鲁氏菌抗体检测结果,右图为口蹄疫抗体检测结果(口蹄疫o型);
图4为本发明实验例1提供的免疫后攻毒保护结果图,其中,左图为2308攻毒保护率,右图为口蹄疫o型强毒攻毒保护率。
具体实施方式
下面将结合实施例对本发明的技术方案进行清楚、完整地描述,显然,所描述的实施例是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
除非本文另有定义,连同本发明使用的科学和技术术语应具有本领域普通技术人员通常理解的含义。术语的含义和范围应当清晰,然而,在任何潜在不明确性的情况下,本文提供的定义优先于任何字典或外来定义。在本申请中,除非另有说明,术语“包括”及其他形式的使用是非限制性的。
一般地,连同本文描述的细胞和组织培养、分子生物学、免疫学、微生物学、遗传学以及蛋白和核酸化学和杂交使用的命名法和其技术是本领域众所周知和通常使用的那些。除非另有说明,本发明的方法和技术一般根据本领域众所周知,且如各种一般和更具体的参考文献中所述的常规方法来进行,所述参考文献在本说明书自始至终引用和讨论。酶促反应和纯化技术根据制造商的说明书、如本领域通常实现的或如本文所述来进行。连同本文描述的分析化学、合成有机化学以及医学和药物化学使用的命名法、以及其实验室程序和技术是本领域众所周知和通常使用的那些。
根据本发明的第一个方面,本发明提供了一种布鲁氏菌病和口蹄疫二联疫苗,所述布鲁氏菌病和口蹄疫二联疫苗包括口蹄疫病毒样颗粒和装载所述口蹄疫病毒样颗粒的布鲁氏菌菌影。
其中,布鲁氏菌菌影保留了细菌表面抗原决定簇的天然结构,接种后能有效的激发机体的免疫反应。口蹄疫病毒样颗粒(口蹄疫vlp)是一种不含口蹄疫病毒核酸的假病毒颗粒,但可以组装成颗粒样结构,其结构和抗原表位与天然的病毒颗粒十分相似,具有很强的免疫原性及很好的安全性。
本发明提供的布鲁氏菌病和口蹄疫二联疫苗,包括口蹄疫病毒样颗粒和装载所述口蹄疫病毒样颗粒的布鲁氏菌菌影,能够达到一种疫苗预防两种疾病的目的,同时杜绝布鲁氏菌活疫苗使用过程中的生物安全风险,克服口蹄疫疫苗使用过程中副反应问题。并且,本发明的发明人通过实验还证实了,应用本发明提供的布鲁氏菌病和口蹄疫二联疫苗进行免疫后,可以有效的诱导产生免疫反应,抵御布鲁氏菌及口蹄疫强毒的攻击。同时,免疫奶牛后副反应显著降低,单日奶产量与对照组无差异,无明显体温反应。
在一些优选的实施方式中,所述布鲁氏菌菌影与口蹄疫病毒样颗粒的用量比为2:1~3:1(w/w),例如可以为,但不限于2:1、2.5:1或3:1。当布鲁氏菌菌影与口蹄疫病毒样颗粒的用量比为2.5:1时,在节约成本的基础上制备得到的布鲁氏菌病和口蹄疫二联疫苗具有更高的免疫原性。
在一些优选的实施方式中,每头份所述布鲁氏菌病和口蹄疫二联疫苗中含布鲁氏菌菌影25~35μg,例如可以为,但不限于25μg、28μg、30μg、32μg或35μg,优选为28μg。
在本发明提供的布鲁氏菌病和口蹄疫二联疫苗中,布鲁氏菌菌影优选由含有噬菌体裂解蛋白e基因和金黄色葡萄球菌核酸酶a基因的布鲁氏菌疫苗菌株制备得到。
其中,噬菌体裂解蛋白e基因和金黄色葡萄球菌核酸酶a基因在布鲁氏菌菌株内可分别表达噬菌体裂解蛋白e和金黄色葡萄球菌核酸酶a,二者均能够以生物灭活的方式得到布鲁氏菌抗原。裂解蛋白e能作用于细菌细胞壁,在细胞壁上形成一定大小的孔洞,在渗透压的作用下使其细胞质,核酸流出,使细菌死亡;核酸酶a可作用于细菌核酸,使其降解为一定大小的片段,失去活性,进而灭活细菌;两种灭活方式联合使用可提高灭活效率,降解细菌核酸具有更高的生物安全性。
具体地,所述噬菌体裂解蛋白e基因具有如seqidno.1所示的核苷酸序列;通过优化噬菌体裂解蛋白e的基因序列,能够使得其在布鲁氏菌中的表达效率更高。
具体地,所述金黄色葡萄球菌核酸酶a基因具有如seqidno.2所示的核苷酸序列;金黄色葡萄球菌核酸酶a的基因序列为完整的经优化的序列,通过优化金黄色葡萄球菌核酸酶a的基因序列,能够使得其在布鲁氏菌中的表达效率更高。
优选地,所述布鲁氏菌菌株为a19菌株。
疫苗菌株a19为当下奶牛布病防控的主要疫苗菌株,其市场需求较大,且牛布病适合用牛种布鲁氏菌(如疫苗菌株a19)进行防控。
在一些优选的实施方式中,所述噬菌体裂解蛋白e基因能够表达噬菌体裂解蛋白e,所述金黄色葡萄球菌核酸酶a基因能够表达金黄色葡萄球菌核酸酶a,表达得到的噬菌体裂解蛋白e和金黄色葡萄球菌核酸酶a优选通过linker氨基酸相连接,形成融合蛋白。
优选地,由氨基端至羧基端依次为噬菌体裂解蛋白e、linker氨基酸和金黄色葡萄球菌核酸酶a;通过linker氨基酸相连,可以降低蛋白质构象改变的可能。e蛋白在前可保证核酸酶a的充分表达。
优选地,所述linker氨基酸具有如seqidno.3所示的氨基酸序列。通过特定氨基酸序列的linker进行连接,可以进一步提高融合蛋白的稳定性、表达量和生物活性。
在一些优选的实施方式中,所述口蹄疫病毒样颗粒由酵母菌表达组装制成。酵母表达体系可以加大翻译后蛋白修饰,让蛋白质可溶增加,更能让vlp原件更趋于天然状态,这样所得到的vlp粒子更能有效诱导机体的免疫反应。
根据本发明的第二个方面,本发明还提供了上述的布鲁氏菌病和口蹄疫二联疫苗的制备方法,将口蹄疫病毒样颗粒装载入布鲁氏菌菌影中,得到所述布鲁氏菌病和口蹄疫二联疫苗。
该方法工艺简单,操作方便,且制备得到的布鲁氏菌病和口蹄疫二联疫苗具有良好的免疫原性和生物安全性,适于推广应用。
在一些优选的实施方式中,所述装载至少满足如下条件之一:
温度为2~8℃,例如可以为,但不限于2℃、3℃、4℃、5℃、6℃、7℃或8℃;
转速为100~120转/min,例如可以为,但不限于100转/min、105转/min、110转/min、115转/min或120转/min;
时间为25~30min,例如可以为,但不限于25min、26min、27min、28min、29min或30min;
当在温度为4~6℃;转速为115转/min;时间为26min条件下进行装载时,其装载效率更高。
此外,基于本发明提供的布鲁氏菌病和口蹄疫二联疫苗的有益效果,本发明还提供了上述布鲁氏菌病和口蹄疫二联疫苗在制备预防布鲁氏菌病和/或口蹄疫的产品中的应用。
其中,“和/或”表示“和”或者“或”,也就说,本发明提供的布鲁氏菌病和口蹄疫二联疫苗可以用于预防布鲁氏菌病,或者用于预防口蹄疫,或者同时用于预防布鲁氏菌病和口蹄疫。可以理解的是,当同时用于预防布鲁氏菌病和口蹄疫时,其使用价值得到了更完整的体现。
下面通过具体的实施例进一步说明本发明,但是,应当理解为,这些实施例仅仅是用于更详细地说明之用,而不应理解为用于以任何形式限制本发明。
本发明实施例中用到的主要试剂信息如下:
限制性内切酶ecori、bamhi、nedi、saci和t4dna连接酶购自宝生物工程(大连)有限公司;甲醇购自美国sigma公司;phil-s1质粒购自thermo公司;胰蛋白大豆肉汤培养基(tsb)、胰蛋白大豆肉汤琼脂培养基(tsa)购自美国bd公司;氨苄青霉素(amp)、卡那霉素(kan)购自美国sigma公司;质粒提取试剂盒、核酸凝胶回收试剂盒、基因组提取试剂盒均购自天根生化科技有限公司。
实施例1布鲁氏菌菌影菌株的制备及培养
1.布鲁氏菌菌影菌株的制备
1.1构建布鲁氏菌菌影菌株是通过电转化方式将含有噬菌体裂解蛋白e基因、金黄色葡萄球菌核酸酶a基因(sna)、温控原件的质粒转化至a19菌株内构成。
1.2噬菌体e基因扩增及克隆
1.2.1e基因扩增
以puc57-e质粒为模板,用e基因扩增引物e-f,e-r进行扩增,反应条件为:94℃预变性5分钟,94℃变性30秒,56℃退火30秒,72℃延伸30秒,30个循环,72℃延伸10分钟。采用50μl反应体系,具体成份如下:
e基因扩增pcr反应体系表
1.2.2e基因克隆
用琼脂糖胶回收试剂盒回收e基因,4℃过夜将e基因与pmd18-tsimple载体连接,转化至dh5α感受态细胞中,取100μl感受态细胞与载体混合液涂布于取含amp(100μg/ml)tsa平皿上,36~38℃培养24小时。
连接体系信息
1.2.3e基因阳性克隆的鉴定
挑取单克隆菌落,以其为模板,用e-f,e-r引物进行菌落pcr鉴定,阳性菌落经dna测序进一步鉴定。
1.2.4pbv220-e质粒的构建及鉴定
对测序正确pmd18-t-e和pbv220质粒用内切酶ecori,bamhi分别进行双酶切,琼脂糖胶回收试剂盒分别回收e基因和pbv220载体序列,4℃过夜将e基因与pbv220载体连接,连接产物转化至dh5α感受态细胞中。取100μl感受态细胞与载体混合液涂布于取含amp(100μg/ml)tsa平皿上,27~29℃培养24小时。挑取单克隆菌落,以其为模板,用e-f,e-r引物进行菌落pcr鉴定,阳性菌落经dna测序进一步鉴定。
1.3pbbr1mcs-2-tc/e质粒的构建及鉴定
1.3.1tc/e序列扩增
以正确构建的pbv220-e质粒为模板,用引物tc/e-f,tc/e-e进行扩增,反应条件为:94℃预变性5分钟,94℃变性45秒,56℃退火45秒,72℃延伸2分钟,30个循环,72℃延伸10分钟。采用50μl反应体系,具体成份如下:
tc/e基因序列扩增pcr反应体系表
按照2.2中方法将tc/e序列连接至pmd18-tsimple载体,对pmd18-t-tc/e质粒进行测序鉴定。
1.3.2tc/e序列与pbbr1mcs-2载体连接
将鉴定正确的pmd18-t-tc/e质粒和pbbr1mcs-2载体用内切酶xbai,xhoi分别进行双酶切,回收tc/e序列和pbbr1mcs-2载体序列,用t4连接酶连接后转化入dh5α感受态细胞中。取100μl感受态细胞与载体混合液涂布于取含kan(100μg/ml)tsa平皿上,27~29℃培养24小时。挑取电转化后单克隆菌落,以其为模板,用tc/e-f,tc/e-r引物进行菌落pcr鉴定,阳性菌落经dna测序进一步鉴定,测序无误后置-80℃备用。
1.4布鲁氏菌a19株感受态细胞的制备
将布鲁氏菌a19株划线接种于tsa平皿,36~38℃培养72小时,挑取单菌落接种于10mltsb培养基,以200r/min,36~38℃培养48小时,按照2%的比例将菌液接种于200mltsb培养基,以200r/min,36~38℃培养18~24小时,以8000r/min离心20分钟收取菌体,用预冷的蒸馏水洗涤菌体2次,用预冷的15%甘油洗涤2次,尽量弃去上清,沉淀用2ml预冷的15%甘油重悬,分装为100μl/管,置-80℃备用。
1.5重组pbbr1mcs-2-tc/e质粒的电转化
将布鲁氏菌感受态细胞从-80℃取出置冰上备用,吸取重组pbbr1mcs-2-tc/e质粒10μl缓慢加入到感受态细胞中,轻轻混匀。吸取100μl混合液贴壁加入直径为0.1cm的电转杯中,盖紧橡胶盖。擦去电转杯外壁多余的水分,放入电转仪中,以1.8kv,400ω进行电转。电转完成后立即向电转杯中加入1mltsb培养基,以160r/min,27~29℃培养4小时,吸取200μl菌液涂布于含kan(100μg/ml)tsa平皿,27~29℃培养3~7日。
1.6布鲁氏菌a19-bg株的鉴定
挑取单菌落以引物tc/e-f,tc/e-r进行鉴定,阳性克隆即为布鲁氏菌a19-bg株。
2.布鲁氏菌菌影菌株的培养工艺
2.1种子制备为:布鲁氏菌菌影菌株原始种子划线接种于含卡那抗生素(终浓度50μg/ml)的tsa琼脂平皿,25~30℃培养24~36小时,挑取2~5个菌落接种于10~20ml含有卡那抗生素(终浓度50μg/ml)的tsb肉汤培养基,25~30℃,以120~160转/min培养24~36小时,即为种子液。
2.2抗原菌液制备为:将种子液以1%~2%的比例接种于1~2l含有卡那抗生素(终浓度50μg/ml)的tsb肉汤培养基中,25~30℃培养24~36小时,活菌计数后升高温度至41~43℃培养48~72小时进行灭活,即为灭活抗原菌液。
2.3菌液浓缩为:将灭活后布鲁氏菌菌影抗原菌液以8000~10000转/min,离心20~30min,收集沉淀,用无菌水重悬洗涤抗原,重复3~4次,调整抗原浓度至1000~2000cfu/ml(灭活前),即为浓缩后抗原。
2.4灭活检验为:吸取灭活后抗原菌液涂布于3个tsa平皿,每皿100μl;吸取灭活后抗原菌液,分别接种于3只tsb肉汤试管,接种比例为1%~2%。将平皿和试管放置于36~37℃恒温培养箱,培养3~5日,均无菌生长即为灭活完全。
实施例2口蹄疫病毒样颗粒的制备
1重组质粒构建
1.1vp1、vp2、vp4基因扩增
以o型口蹄疫病毒基因组为模板,用含有酶切位点的引物vp1-f/vp1-r(酶切位点ecorⅰ、ndeⅰ)、vp2-f/vp2-r(酶切位点ndeⅰ、sacⅰ)、vp4-f/vp4-r(酶切位点sacⅰ、bamhⅰ)分别扩增,得到vp1、vp2、vp4基因序列。
1.2vp1、vp2、vp4基因克隆
用琼脂糖胶回收试剂盒分别回收vp1、vp2、vp4基因,4℃过夜将基因片段与pmd18-tsimple载体连接,转化至dh5α感受态细胞中,取100μl感受态细胞与载体混合液涂布于取含amp(100μg/ml)tsa平皿上,36~38℃培养24小时。
连接体系信息
1.3阳性克隆的鉴定
分别挑取单克隆菌落,以其为模板,用vp1-f/vp1-r、vp2-f/vp2-r、vp4-f/vp4-r引物进行菌落pcr鉴定,阳性菌落经dna测序进一步鉴定。
1.4重组phil-s1-vp1-vp2-vp4质粒构建
分别提取重组pmd18-t-vp1、pmd18-t-vp2、pmd18-t-vp4质粒用限制性内切酶ndeⅰ单酶切重组质粒pmd18-t-vp1,用限制性内切酶ndeⅰ、sacⅰ双酶切重组质粒pmd18-t-vp2,用核酸电泳分别回收pmd18-t-vp1和vp2基因序列,4℃过夜将vp2基因片段与pmd18-t-vp1载体连接,转化至dh5α感受态细胞中取100μl感受态细胞与载体混合液涂布于取含amp(100μg/ml)tsa平皿上,36~38℃培养24小时。挑取单菌落进行pcr鉴定,阳性菌落经dna测序进一步鉴定。
按照上述方法,依次定向连接vp1-vp2-vp3基因序列,构建pmd18-t-vp1-vp2-vp3重组质粒,鉴定合格后用ecorⅰ,bamhⅰ进行双酶切,回收vp1-vp2-vp3基因片段,同时用ecorⅰ,bamhⅰ对phil-s1质粒进行双酶切,回收phil-s1质粒片段。4℃过夜将vp1-vp2-vp3基因片段与phil-s1载体连接,转化至dh5α感受态细胞中,取100μl感受态细胞与载体混合液涂布于取含amp(100μg/ml)tsa平皿上,36~38℃培养24小时。挑取单克隆菌落,以其为模板,进行菌落pcr鉴定,阳性菌落经dna测序进一步鉴定。
1.5重组菌株的鉴定
提取phil-s1-vp1-vp2-vp4重组质粒电转入酵母菌中,涂布于含有amp(100μg/ml)tsa平皿上,30℃培养48小时,挑取单克隆菌落进行pcr进行。阳性菌落接种于tsb(amp100μg/ml)培养基中,30℃,以150转/min培养15小时,添加甲醇溶液(终浓度0.5%)30℃,以180转/min继续培养18小时,以12000转/min离心15分钟,收取菌液上清,用westernblot鉴定蛋白表达情况,应可见到大小约为46kda的特异性条带。
1.6口蹄疫病毒样粒子组装
将纯化后重组蛋白vp1-vp2-vp4加入到组装缓冲液中(ph7.4,50mmtris,0.2mnacl,0.01%吐温80),2~8℃静止36小时,即获得口蹄疫病毒样粒子。
实施例3布鲁氏菌病和口蹄疫二联疫苗的制备
用中空纤维柱将口蹄疫病毒样粒子进行10倍浓缩,与布鲁氏菌菌影按照质量比1:2.5进行混合,4~6℃,以115转/min混合26分钟,所得混合液即为布鲁氏菌病和口蹄疫二免疫苗,其中布鲁氏菌菌影抗原含量不低于28μg/头份,口蹄疫病毒样粒子含量不低于11.2μg/头份。
实验例1
布鲁氏菌抗体及口蹄疫抗体双阴性泌乳奶牛30头,其中20头为免疫组,10头为对照组,布鲁氏菌病和口蹄疫二联疫苗组10头,首次免疫每头奶牛肌肉接种1头份,28日后以同样的剂量进行加强免疫,口蹄疫单苗免疫组5头,首次免疫每头奶牛肌肉接种1头份,28日后用相同剂量加强免疫;布病活疫苗a19组5头,每头奶牛皮下接种1头份;所有实验组牛只加强免疫后28日,分别用口蹄疫及布鲁氏菌强毒进行攻击。收集免疫后试验奶牛血清样本检测血清中布鲁氏菌及口蹄疫o型抗体水平,测量产奶量及体温反应,评价攻毒后有无发病及组织中布鲁氏菌强毒载量。具体结果如图1、图2、图3和图4所示。由以上结果可以看出,布鲁氏菌病和口蹄疫二联疫苗在免疫后可以产生与单苗一致的保护效力,由于为灭活疫苗且无油佐剂成份,布鲁氏菌病和口蹄疫二联疫苗在免疫后大大降低了疫苗注射给机体带来的应激反应。所以本发明提供的布鲁氏菌病和口蹄疫二联疫苗同时解决了a19活疫苗在实际应用中的生物安全风险和疫苗使用过程中的副反应问题,为奶牛业布鲁氏菌病和口蹄疫的防控提供有力的武器。
最后应说明的是:以上各实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述各实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分或者全部技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的范围。
sequencelisting
<110>天康生物股份有限公司
<120>布鲁氏菌病和口蹄疫二联疫苗及制备方法和应用
<160>3
<170>patentinversion3.5
<210>1
<211>273
<212>dna
<213>人工序列
<400>1
atggtacgatggactttgtgggataccctcgctttcctgctcctgttgagtttattgctg60
ccgtcattgcttattatgttcatcccgtcaacattcaaacggcctgtctcatcatggaag120
gcgctgaatttacggaaaacattattaatggcgtcgagcgtccggttaaagccgctgaat180
tgttcgcgtttaccttgcgtgtacgcgcaggaaacactgacgttcttactgacgcagaag240
aaaacgtgcgtcaaaaattacgtgcggaaagag273
<210>2
<211>687
<212>dna
<213>人工序列
<400>2
atgacagaatacttattaagtgctggcatatgtatggcaattgtttcaatattacttata60
gggatggctatcagtaatgtttcgaaagggcaatacgcaaagaggtttttctttttcgct120
actagttgcttagtgttaactttagttgtagtttcaagtctaagtagctcagcaaatgca180
tcacaaacagataacggcgtaaatagaagtggttctgaagatccaacagtatatagtgca240
acttcaactaaaaaattacataaagaacctgcgacattaattaaagcgattgatggtgac300
acggttaaattaatgtacaaaggtcaaccaatgacattcagactattattagttgataca360
cctgaaacaaagcatcctaaaaaaggtgtagagaaatatggccctgaagcaagtgcattt420
acgaaaaaaatggtagaaaatgcaaataaaattgaagtcgagtttgacaaaggtcaaaga480
actgataaatatggacgaggcttagcgtatatttatgctgatggaaaaatggtaaacgaa540
gctttagttcgtcaaggcttggctaaagttgcttatgtttataaacctaacaatacacat600
gaacaacttttaagaaaaagtgaagcacaagcgaaaaaagagaaattaaatatttggagc660
gaagacaacgctgattcaggtcaataa687
<210>3
<211>10
<212>prt
<213>人工序列
<400>3
glyserglyglnglyserglyglnglyser
1510
- 还没有人留言评论。精彩留言会获得点赞!