咖啡酸在制备促进葡萄糖吸收药物方面的应用的制作方法
本发明属于医药
技术领域:
,具体涉及咖啡酸在制备促进葡萄糖吸收药物方面的新应用。
背景技术:
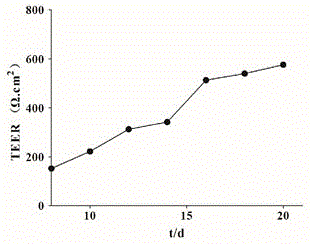
:咖啡酸(英文名称:cafficacid),结构式如下所示:分子式:c9h8o4;分子量:180.15;性状:黄色结晶状粉末;来源:咖啡酸可以直接购买普通市售产品,或者参见现有文献的方法从卷丹花中提取获得。咖啡酸是从卷丹花中提取获得的活性成分之一,其药理活性主要包括抗炎、调血脂、抗氧化和抗抑郁等;但其促进caco-2葡萄糖吸收的作用未见报道。本申请是以caco-2细胞为研究对象,探讨了咖啡酸对caco-2细胞对葡萄糖摄取及消耗的影响,并探究了其作用机制。技术实现要素:本发明目的在于克服现有技术缺陷,提供一种咖啡酸在制备促进葡萄糖吸收药物方面的新应用。为实现上述目的,本发明采用如下技术方案:咖啡酸在制备促进葡萄糖吸收药物方面的应用。咖啡酸可被用作促进caco-2细胞葡萄糖吸收的药物,即可被用作制备小肠上皮细胞葡萄糖吸收的药物,以促进营养吸收。上述的应用,具体的,咖啡酸能显著促进正常caco-2细胞对葡萄糖的吸收,并能促进caco-2细胞摄取葡萄糖示踪剂2-nbdg;其机制可能是通过促进caco-2细胞转运蛋白sglti和glut2蛋白的表达和mrna的转录而发挥促进caco-2细胞葡萄糖吸收的作用。上述的应用,进一步的,咖啡酸能极显著地促进sglt1和glut2蛋白的表达和mrna的转录。本发明还提供了上述咖啡酸与本领域常规辅料复配制成具有促进葡萄糖吸收的复方制剂。具体的,上述复方制剂的剂型为片剂、颗粒剂、丸剂、胶囊剂或注射剂等。和现有技术相比,本发明的有益效果:本发明通过大量研究和实验发现了化合物咖啡酸和槲皮素-3-o-β-d-半乳糖苷的一种新用途,其能够显著促进正常caco-2细胞对葡萄糖的吸收和caco-2细胞摄取葡萄糖示踪剂2-nbdg,其作用机制具体可能是咖啡酸和槲皮素-3-o-β-d-半乳糖苷能显著促进sglt1和glut2蛋白的表达和mrna的转录。因此,咖啡酸和槲皮素-3-o-β-d-半乳糖苷可被用来制作促进caco-2细胞葡萄糖吸收的药物,也就是说可以用作制备促进葡萄糖吸收的药物。附图说明图1为caco-2细胞单层跨膜电阻值;图2为化合物山奈酚(a)、咖啡酸(b)和槲皮素-3-o-β-d-半乳糖苷(c)对正常caco-2葡萄糖摄取和消耗的影响;注:与空白组***p<0.001;图3为化合物山奈酚、咖啡酸和槲皮素-3-o-β-d-半乳糖苷促进caco-2细胞摄取葡萄糖示踪剂2-nbdg;图中,(a)空白组、(b)200μm山奈酚、(c)100μm山奈酚、(d)50μm山奈酚;(e)200μm咖啡酸、(f)100μm咖啡酸、(g)50μm咖啡酸;(h)200μm槲皮素-3-o-β-d-乳糖苷、(i)100μm槲皮素-3-o-β-d-半乳糖苷、(j)50μm槲皮素-3-o-β-d-半乳糖苷;图4为采用westernblotting法测定化合物咖啡酸(a)和槲皮素-3-o-β-d-半乳糖苷(b)对sglt1和glut2信号通路相关蛋白表达影响(***p<0.001,**p<0.01,*p<0.05);图5为使用qrt-pcr法检测化合物咖啡酸和槲皮素-3-o-β-d-半乳糖苷显著地促进sglt1(a)和glut2(b)通路中关键蛋白mrna的转录;注:与空白组***p<0.001,**p<0.01,*p<0.05;上述图中数据表示为平均值±sd,图中,control为空白组,200、100和50μm分别指代的卷丹花成分的不同浓度组。具体实施方式以下结合实施例对本发明的技术方案作进一步地详细介绍,但本发明的保护范围并不局限于此。应用试验:化合物咖啡酸和槲皮素-3-o-β-d-半乳糖苷能够显著促进正常caco-2细胞对葡萄糖的吸收和caco-2细胞摄取葡萄糖示踪剂一、实验细胞caco-2细胞,购于中国科学院典型培养物保藏委员会细胞库二、实验样品山奈酚、咖啡酸和槲皮素-3-o-β-d-半乳糖苷,由河南大学国家食用菌加工技术研发专业中心分别照现有文献(①xiaomei,caoning,fanjing-jing,etal.studiesonflavonoidsfromtheleavesoflinderaaggregata[j]journalofchinesemedicinalmaterials,2011,34(1):62-64.②wujing-yi.etal.chemicalconstituentsfromseedmealofpaeoniasuffruticosa[j]actachinesemedicineandpharmacology.③lisheng-hua.etal.flavonoidconstituentsofwholeplantofkummerowiastriata[j]chinesepharmaceuticaljournal,2014,49(10):817-820.)从卷丹花中分离纯化而得(纯度>95%)。三、仪器与试剂四、实验方法1、细胞培养caco-2细胞在含有90%dmem和10%胎牛血清的完全培养基中,于37℃、5%co2的培养箱中培养。2、结肠癌细胞跨膜电阻值测定取对数生长期的caco-2细胞,以104个/孔细胞浓度接种于24孔,孔径为0.4μm的transwell小室中,设置3个复孔,同时设对照孔(不含细胞,只含完全培养基);24h后换液(即更换新鲜的完全培养基),接下来一周隔天换液一次,一周后每天换液。于培养的第8、10、12、14、16、18和21d用细胞电阻仪测定跨膜电阻值(teer),探究细胞单层完整性及紧密性形成过程,培养至21d。电阻值测定:将细胞置于室温下平衡30min,测量电极在紫外灯下照射30min后,再在70%的乙醇中浸泡15min,取出测量电极风干15s。弃去transwell小室中上室和下室的上清液,用pbs洗两次,第三次加入pbs后将细胞放在37℃培养箱中平衡30min后取出;将电极和培养板成90°浸入培养板内部,测定并记录其电阻值;先测3个对照孔的电阻值,再测实验组电阻值,求其平均值;测完后,弃去pbs,加入完全培养基,继续培养。结果见图1。计算电阻值(r),24孔transwell板薄膜面积为0.33cm2,按下式计算:(r-r对照孔)*0.33=电阻值(ω.cm2)。3、god-pod方法检测化合物对caco-2细胞上清中葡萄糖含量的影响按照细胞传代的方法取对数生长期的caco-2细胞吹打成细胞悬液,在倒置显微镜下计数后,调整细胞密度为104个/ml,24孔板中每孔接种500μl,分为空白组和给药组,培养箱中孵育培养16d,电阻值达到513ω.cm2,电阻已大于500ω.cm2。此时细胞已形成了紧密的细胞单层结构。给药组加入含不同浓度的化合物,培养12h和24h后,根据葡萄糖检测试剂盒说明书操作,于酶标仪505nm测定od值,通过测定的葡萄糖含量判断葡萄糖摄取量,评估卷丹花提取物对葡萄糖摄取和消耗能力的影响。结果见图2。4、荧光d-葡萄糖同系物(2-nbdg)为示踪探针检测caco-2细胞葡萄糖摄取将对数生长期的caco-2细胞接种于24孔板中(104个/孔),分为空白组和给药组,培养16d,此时细胞已形成了紧密的细胞单层结构。给药组加入含不同浓度的药物,继续培养培养24h,100μm2-nbdg处理各组caco-2细胞(空白组加入等量pbs),37℃避光孵育30min(此过程保证在无菌环境中完成),用冰pbs洗3次,倒置荧光显微镜拍照。结果见图3。5、qrt-pcr检测卷丹花成分对caco-2细胞sglt1信号通路mrna转录的影响(1)细胞培养:按照细胞传代的方法取对数生长期的caco-2细胞吹打成细胞悬液,在倒置显微镜下计数后,调整细胞密度为104个/ml,24孔板中每孔接种500μl,分为空白组和给药组,培养箱中孵育培养16d,给药组加入含不同浓度的化合物,培养24h,收集细胞。(2)提取总rna①裂解细胞:各孔均加入1mltrizol试剂,用移液枪吹打后收集至无酶ep管中,置于冰上裂解5min。②分离rna:加入200μl氯仿,上下颠倒混匀后,置于冰上分层3min。4℃,12000rpm离心15min后,吸取250μlrna上清液于新的无酶ep管中。③沉淀rna:加入250μl异丙醇,上下颠倒混匀后,于冰上静置10min。4℃,12000rpm离心15min后,弃去上清液,管底的沉淀即为rna。④洗涤rna:向rna沉淀中加入1ml75%乙醇,上下颠倒洗去残余的异丙醇,4℃,12000rpm离心5min,弃去上清,空气中干燥5min。⑤溶解rna:加入30μl无酶水混匀,-80℃冰箱中保存。⑥检测rna纯度和浓度:用微量核酸蛋白测定仪测定rna纯度和浓度,并加适量的无酶水使rna浓度约为500ng/μl。(3)去除gdna:所需加入的rna质量为1000ng,根据测定的rna浓度,计算出所需的rna体积x。该混合反应体系如表1,反应条件为:42℃,3min。表1、去除gdna所用反应体系试剂含量gdnaeraser1μl5×gdnaeraserbuffer2μltotalrnaxrnasefreeh2oupto10μl(4)逆转录为cdna:该混合反应体系如表2-4,在pcr仪上进行逆转录,反应条件为:37℃,15min→80℃,5s→4℃,∞。表2、逆转录所用反应体系试剂含量去除gdna产物10μlrtprimemix1μlprimescriptrtenzymemixi1μl5×primescriptbuffer24μlrnasefreeh2o4μl以上述逆转录所得cdna片段进行pcr扩增,过程如下。结果见图5。将各个引物的浓度稀释为100μmol/l,扩增的各基因引物序列见下表3。pcr反应体系如下表4所示。表3、引物序列表4、pcr扩增反应体系试剂含量tbgreenpremixextaqⅱ12.5μlpcrreverseprime1μlpcrforwardprime1μlcdna溶液2μlrnasefreeh2o8.5μl6、westernblotting检测化合物对caco-2细胞sglt1信号通路蛋白表达的影响实验所需溶液配制:①10×tbs配制:称取nacl80g,tris-base24.2g,加入900ml双蒸水,置于磁力搅拌器上搅拌溶解。使用浓盐酸调至ph为7.6,使用1000ml容量瓶定容,室温保存备用。②tbst溶液配制:先将10×tbs稀释成1×tbs,每500ml1×tbs加入2.5ml吐温20即得,室温保存备用。③1.5mtrishcl配制:精确称取18.17gtris-base,加入80ml双蒸水,置于磁力搅拌器上搅拌溶解。用浓盐酸调ph至8.8,定容至100ml,室温保存备用。④1.0mtris-hcl配制:称取12.11g的tris-base加入到80ml的双蒸水中,然后用单双向磁力加热搅拌器搅拌至均匀,采用100ml容量瓶定容至100ml,最后用浓盐酸调ph至6.8,室温保存备用。⑤30%丙烯酰胺配制:取29g的丙烯酰胺和1g的n,n-亚甲基双丙烯酰胺,加入到100ml的蒸馏水中,然后使用磁力搅拌器使其完全溶解,最后于4℃保存备用。⑥1×蛋白电泳缓冲液配制:取tris-base3.03g,甘氨酸18.77g,sds1g加蒸馏水定容至1000ml,室温保存备用。⑦10×转膜缓冲液配制:取tris-base30.3g,glycine142.6g,加蒸馏水900ml,使用磁力搅拌器搅拌溶解,定容至1l,室温保存备用。⑧1×转膜缓冲液配制:50ml10×转膜缓冲液中先加入350ml蒸馏水,再加入100ml甲醇,混匀即得,4℃保存备用。⑨细胞裂解混合液配制:ripa强裂解液:磷酸酶抑制剂:pmsf=100:1:1的比例进行配制混匀,置于冰上,现用现配。实验方法:(1)细胞培养:按照细胞传代的方法取对数生长期的caco-2细胞吹打成细胞悬液,在倒置显微镜下计数后,调整细胞密度为104个/ml,24孔板中每孔接种500μl,分为空白组和给药组,培养箱中孵育培养16d,给药组加入含不同浓度的化合物,培养24h,收集细胞。(2)细胞总蛋白的提取:①以ripa裂解液:pmsf:磷酸酶抑制剂=100:1:1的比例配制总蛋白裂解液,每个细胞样品加入200μl,重悬后置于冰上裂解30min。②4℃,12000rpm离心10min,吸取上清液转移至新的ep管中,即为总蛋白。③加入1/4蛋白体积的5×loadingbuffer,混匀,然后在100℃水浴5min使蛋白变性,于-20℃保存。(3)bca法蛋白浓度的测定:①以bca:铜试剂=50:1的比例配制bca工作液。②在96孔板中各加入2μl蛋白样品,并用pbs稀释液稀释10倍,即每孔需预先加入18μlpba稀释液,每个样品设置3个复孔。③各孔均加入200μlbca工作液,充分混匀,避免产生气泡,放置于37℃恒温箱30min,用酶标仪在562nm处测定吸光度值。④将测定的吸光度值代入标准曲线y=0.766x+0.998,计算出蛋白浓度。(4)sds-page①配胶:在10%sds聚丙烯酰胺凝胶(使用表1配制的8%分离胶,37℃恒温放置30min,然后加入5%浓缩胶,37℃恒温放置30min,即获得10%sds聚丙烯酰胺凝胶)中,加入指示marker,分离相同量的蛋白样品(30/60μg)。将其在含有1×电泳缓冲液的垂直电泳槽中,80v,30min,进行蛋白浓缩。待蛋白跑至分离胶时,将电压调为120v,60min,进行蛋白分离。表5、10%sds聚丙烯酰胺凝胶配制②转膜:电泳结束后,根据marker切下所需蛋白分子量范围内的胶,剪下与胶相同大小的pvdf膜,浸泡在甲醇中使之活化,按照正极—海绵垫—滤纸—pvdf膜—胶—滤纸—海绵垫—负极的顺序放置并夹紧板后,放入转膜槽内并加入转膜缓冲液,放置于-4℃冰箱中,72v转移60min。(5)免疫印迹显色①封闭:转膜结束后,将pvdf膜取出浸泡在含5%脱脂奶粉的tbst缓冲液中,置于摇床封闭2h。②孵育一抗:将inos/cox-2/β-actin:tbst=1:1000的比例进行稀释,根据相应的蛋白分子量大小切取pvdf膜,并浸泡于相应的一抗稀释液中,4℃孵育过夜。pbst洗涤pvdf膜5次,每次5min。③孵育二抗:将兔/鼠抗:tbst=1:2000的比例进行稀释,将pvdf膜浸泡在相应的二抗稀释液中,室温孵育2h。pbst洗涤pvdf膜5次,每次5min。④显色:在pvdf膜上滴加显影液,置于化学发光成像仪里进行显影。最后使用imagej测定灰度值以进行定量分析。结果见图4。以上实验均进行3次重复,实验结果采用spss19.0软件进行统计学分析。实验数据以表示。两组间比较采用t检验,多组比较采用方差分析(one-wayanova),以p<0.05为有统计学意义。五、实验结果图1所示,teer值是反应细胞单层完整性的一个重要指标,通过测定培养8、10、12、14、16、18和21d的caco-2细胞单层的的跨膜电阻,发现随着培养时间的延长,跨膜电阻值也随之增大,在16dteer值已经>500ω.cm2。16d以后,电阻值持续增大并逐渐趋于平缓,表明结肠细胞已经形成了紧密的细胞单层,证明造模成功。图2采用葡萄糖氧化酶试剂盒测量了不同浓度的三种化合物给药12h、24h后上清液中葡萄糖含量。结果表明:咖啡酸和槲皮素-3-o-β-d-半乳糖苷在给药12h和24h在200μm、100μm和50μm浓度上清中葡萄糖含量明显降低,咖啡酸和槲皮素-3-o-β-d-半乳糖苷均能显著提升caco-2细胞葡萄糖消耗(***p<0.001),证明了咖啡酸和槲皮素-3-o-β-d-半乳糖苷具有促进caco-2细胞对葡萄糖吸收的作用。山奈酚在200μm、100μm和50μm对上清中葡萄糖含量无明显影响。图3为化合物处理caco-2细胞24h,100μm2-nbdg处理各组caco-2细胞,倒置荧光显微镜拍照,2-nbdg的摄取量与荧光强度成正比,以此衡量caco-2的糖摄取能力。与空白组相比(图3-a),山奈酚200μm、100μm和50μm(图3-b、c、d)作用后,caco-2细胞内绿色荧光信号无显著变化。槲皮素-3-o-β-d-半乳糖苷200μm、100μm和50μm(图3-h、i、j)和咖啡酸200μm、100μm和50μm(图3-e、f、g)作用后,caco-2细胞内绿色荧光信号均显著性增强,证明咖啡酸和槲皮素-3-o-β-d-半乳糖苷能促进2-nbdg在caco-2细胞上快速摄取、在细胞内积累、激发荧光的作用,并且在一定剂量范围内与荧光强度成正比。为了探究咖啡酸和槲皮素-3-o-β-d-半乳糖苷促进caco-2葡萄糖吸收作用机制,本申请研究了咖啡酸和槲皮素-3-o-β-d-半乳糖苷对sglt1信号通路相关蛋白表达的影响。图4结果显示:与空白组相比,浓度为200μm,100μm的咖啡酸(图4-a)能显著促进glut2蛋白的表达(***p<0.001),浓度为200μm时能显著促进sglt1蛋白的表达。槲皮素-3-o-β-d-半乳糖苷在浓度为200μm,100μm和50μm时(图4-b)均显著增加sglt1和glut2蛋白表达(***p<0.001,**p<0.01,*p<0.05)。图5使用实时荧光定量pcr检测咖啡酸和槲皮素-3-o-β-d-半乳糖苷对sglt1信号通路基因表达的影响。结果显示,与空白组相比,咖啡酸在浓度为200、100μm时能显著促进sglt1和glut2mrna的转录(***p<0.001,**p<0.01,*p<0.5),而浓度为50μm时只能促进sglt1mrna的转录,且具有显著性(*p<0.5)(图5-a)。同时槲皮素-3-o-β-d-半乳糖苷在浓度为200、100和50μm时也显著增加sglt1和glut2基因的表达(***p<0.001,**p<0.01,*p<0.5)(图5-b)。由此可见,咖啡酸和槲皮素-3-o-β-d-半乳糖苷可通过上调sglt1和glut2的基因水平及其蛋白表达,增加caca-2细胞对葡萄糖的摄取。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1