一种沙门菌菌蜕疫苗的制备方法及应用与流程
本发明涉及兽医学生物制品技术领域,具体为一种沙门菌菌蜕疫苗的制备方法及应用。
背景技术:
沙门菌病长期困扰着各国养殖业,是沙门菌属的不同血清型感染动物后引起的多种疾病的总称。该病对幼畜和幼禽的危害最为严重,表现为肠热、急性败血症等致死性病症,成年畜禽多呈慢性或隐性感染。患病和带菌动物是本病的主要传染源,不仅在种群中持续排毒,也可以垂直传播给下一代。疫苗是控制该病的有效手段,但是传统灭活疫苗由于不良反应明显,引起细胞介导的免疫应答的能力较弱等问题无法满足市场的需求。而且根据临床病症对群体进行阳性净化的方法无法及时淘汰隐性感染的群体,因此亟需开发一种免疫效果良好且具有diva(differentiationofinfectedandvaccinatedanimals)特性的新型疫苗,通过与血清学检测相配合来实现沙门菌的有效净化。
细胞穿透肽(cellpenetratingpeptides,cpps)是一些能够穿透细胞膜的小分子多肽,具有与抗微生物肽类似的功能。它们一般长度不超过30个氨基酸。map就是其中的一种。该多肽最早合成于上世纪90年代,对g+巨大芽孢杆菌和g-大肠杆菌均表现出相同的抗菌作用。研究中利用细胞穿透肽map对鸭致病性大肠杆菌de17进行处理后,出现了特异性孔道。在保持细胞膜相对完整的前提下,利用渗透压作用将胞内物质部分排出,形成菌蜕。菌蜕是革兰氏阴性菌在被噬菌体phix174裂解基因e裂解后,膜内容物大量流出形成的细菌空壳。内容物的流失降低了菌蜕疫苗的不良反应性。温和的裂解方式使菌蜕膜组分得以完整保留,包括脂多糖、肽聚糖和鞭毛蛋白等天然的细菌组分。这些结构使菌蜕具有成为佐剂的巨大潜力,因此受到研究人员的广泛关注。
pagc蛋白是沙门菌属内高度保守的特异性蛋白,属内的同源性高达95%以上。编码该蛋白的pagc基因广泛分布于各类禽源和鼠源的沙门菌血清型中,是标记疫苗理想的鉴别诊断靶点。
基于上述考虑,本发明人在前期实验室利用λ-red同源重组法获得的鸡白痢沙门菌δpagc突变株基础上,用人工合成的穿孔肽map研制了一种沙门菌菌蜕疫苗,并对其免疫效果和diva特性进行了评估。
技术实现要素:
本发明的目的在于提供一种沙门菌菌蜕疫苗的制备方法及应用,所述疫苗株接种小鼠后无不良反应,对鸡白痢沙门菌cvcc1800、肠炎沙门菌atcc19585和鼠伤寒沙门菌cvcc542均起到良好的保护效果,该疫苗能够能够与基于pagc蛋白的沙门菌抗体间接elisa检测试剂盒联用,实现鉴别诊断,表现出良好的diva特性。
为实现上述目的,本发明提供如下技术方案:一种沙门菌菌蜕疫苗的制备方法,包括以下步骤:
步骤s1,利用λ-red系统制备获得鸡白痢沙门菌基因缺失突变株δpagc;
步骤s2,缺失株lb平板划线,挑取单菌落转接到新鲜的lb培养基中过夜培养;
步骤s3,取过夜培养的鸡白痢沙门菌δpagc菌液,1:100接种到50ml液体lb培养基中,37℃、180rpm振荡培养至od值约0.8;
步骤s4,4℃,5000rpm离心10min后用无菌的pbs缓冲液洗涤3次,然后用终浓度为50μm的map溶液重悬菌体至od值为0.3,21℃恒温静置16h,4℃、5000rpm离心10min收集菌体;
步骤s5,再次洗涤重悬后获得菌蜕原液,多次调整原液使其稀释10倍后测得的od值为1(此时原液的浓度大约在109cfu/ml);
步骤s6,将原液浓缩一倍后与佐剂进行1:1混合,然后加到2ml的灭菌匀浆管(含钢珠)中,使用组织匀浆仪中进行乳化,待乳化完全后,取100μl均匀涂布于lb固体培养基上,37℃培养16h后观察无菌落长出,此时成功制备鸡白痢沙门菌cvcc1800δpagc菌蜕疫苗。
一种沙门菌菌蜕疫苗的应用,其特征在于:包括鸡白痢沙门菌δpagc菌蜕疫苗的免疫保护试验和鸡白痢沙门菌cvcc1800δpagc甲醛灭活苗的diva特性评估。
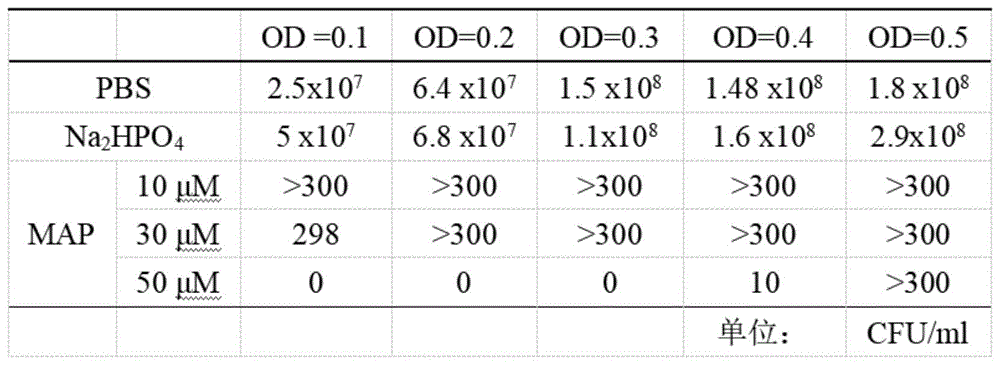
进一步的,map作用条件的确定及细菌灭活效率的计算;
map是细胞穿孔肽的一种,分子式为c90h170n24o18,分子量大小1876.51,由18个氨基酸残基组成,其氨基酸序列为h-klalklalkalkaalkla-nh2,该细胞穿孔肽交由南京金斯瑞生物科技有限公司合成;
本试验通过使用细胞穿透肽map来制备鸡白痢沙门菌δpagc菌蜕,根据其溶菌效果来确定map的最佳使用条件;
鸡白痢沙门菌δpagc缺失株lb平板划线,挑取单菌落转接到新鲜的lb培养基中过夜培养;次日将其按照1:100接种到50ml液体lb培养基中,37℃、180rpm振荡培养至od值约0.8;4℃、5000rpm离心10min收集菌体沉淀,洗涤重悬3次后,用无菌的pbs缓冲液将菌体分别稀释到od值为0.1,0.2,0.3,0.4和0.5,每个od值的菌液倍比稀释至合适的稀释度,每个稀释度设3个重复;从稀释液中取出100μl均匀涂布在lb固体培养基上,37℃倒置培养16h后进行菌落计数,统计cfu;
同时,用含10μm、30μm、50μmmap的na2hpo4溶液分别将菌体稀释到od值为0.1,0.2,0.3,0.4和0.5,每种处理设3个重复;将其转接到96孔板,每孔200μl,21℃恒温培养作用1h;培养结束后,每孔取100μl均匀涂在lb固体培养基上,37℃倒置培养16h后进行菌落计数;根据cfu统计结果,计算map的细菌灭活效率;大量制备疫苗时,在上述试验确定的条件基础上,采用100ml菌液进行制备,并计算灭活效率;
其计算公式为:灭活率=(1-map作用后cfu/pbs重悬cfu)×100%;
用终浓度为50μm的map溶液处理od值为0.3的沙门菌δpagc菌液,对制备的菌蜕疫苗进行灭活效果检测;当处理体积为200μl时,细菌的裂解效率为100%;当处理体积为100ml时,发现有少量的细菌生长,经计算得知细菌的实际灭活效率可达99%;说明随着待处理菌液体积的增加,map溶液的灭活效率有所降低。
进一步的,鸡白痢沙门菌δpagc菌蜕形态观察;
取过夜培养的鸡白痢沙门菌δpagc菌液,将其按照1:100接种到50ml液体lb培养基中,37℃、180rpm振荡培养到od值约0.8;4℃、5000rpm离心10min收集菌体沉淀,用无菌的pbs缓冲液洗涤3次后,用终浓度为50μm的map溶液重悬菌体至od值为0.3,21℃恒温静置作用1h,离心后用无菌的pbs缓冲液洗涤3次,调整至合适的稀释度备用;
3.1透射电镜观察沙门菌δpagc菌蜕形态
取处理后的菌体固定到2.5%的戊二醛溶液中,样品的制备及透射电镜扫描工作交由武汉博尔夫生物科技有限公司完成。
与阴性对照组相比,map处理组的鸡白痢沙门菌δpagc菌蜕内容物明显减少,但尚能维持细胞膜结构的基本形态,与光学显微镜观察结果一致;
3.2荧光显微镜观察dapi染色后菌蜕的核酸残留情况
取10μl处理后的细菌悬液,均匀地涂到载玻片上,酒精灯固定后加入dapi染色液避光作用10min;去离子水冲洗晾干后,置于荧光显微镜下观察菌蜕的核酸残留情况;
与阴性对照组相比,dapi染色后的map处理组的菌蜕的荧光强度明显减弱;对应的明场条件下,细菌的总量和密度并无明显减少;由此可知,map处理组的细菌菌蜕,包膜内容物大量释出,核酸残留显著减少。
进一步的,鸡白痢沙门菌δpagc菌蜕疫苗的免疫保护试验;
5.1免疫原性试验:血清效价检测
将制备的cvcc1800δpagc菌蜕疫苗株对3-4周龄icr小鼠进行皮下多点注射,注射剂量为1x108cfu/只,每组4只,同时设立注射pbs的阴性对照组,注射剂量为每只100μl;免疫分为3次进行,每次免疫间隔为14天;首免前和每次免疫后第13天下颌静脉采血,次日分离血清进行间接elisa试验,将每份血清样品1:400稀释后检测其血清效价;
随着免疫次数的增加,疫苗组小鼠的抗体效价逐步上升,在三免后达到高峰,与pbs对照组差异极其显著;
5.2保护效力试验
三免后第14天对小鼠进行腹腔攻毒,攻毒后每天观察存活状态,绘制存活曲线并计算免疫保护率;
5.3盲肠病理组织变化
疫苗三免后第14天,用上述三株不同血清型的沙门菌攻毒;根据小鼠的临床症状陆续将其处死,观察盲肠组织的病理变化;
盲肠病理变化三株不同血清型沙门菌感染小鼠后,其免疫组的盲肠粘膜层细胞出现轻微坏死脱落;对应的pbs阴性对照组小鼠的盲肠粘膜层受损严重,结构无法清晰辨别。
进一步的,鸡白痢沙门菌cvcc1800δpagc甲醛灭活苗的diva特性评估;
以pagc抗原包被elisa酶标板,评价沙门菌δpagc疫苗的鉴别诊断效果;抗原包被浓度为2μg/ml,血清稀释倍数为1:400;阳性血清由鸡白痢沙门菌cvcc1800野生株多次腹腔感染小鼠后分离获得。
与现有技术相比,本发明的有益效果是:
本发明的疫苗株接种小鼠后无不良反应,可保护小鼠应对鸡白痢沙门菌cvcc1800、肠炎沙门菌atcc19585和鼠伤寒沙门菌cvcc542的感染,该疫苗能够能够与基于pagc蛋白的沙门菌抗体间接elisa检测试剂盒联用,实现沙门菌人工免疫和自然感染的鉴别诊断,表现出良好的diva特性。
附图说明
图1为本发明的map的灭活效果表示意图;
图2为本发明的三株不同血清型沙门菌的攻毒剂量及免疫保护率示意图;
图3为本发明的鸡白痢沙门菌δpagc菌蜕透射电镜观察结果示意图;
图4为本发明的鸡白痢沙门菌δpagc菌蜕荧光显微镜观察结果示意图;
图5为本发明的抗体效价检测结果示意图;
图6为本发明的疫苗免疫后小鼠感染鸡白痢沙门菌cvcc1800存活曲线示意图;
图7为本发明的疫苗免疫后小鼠感染肠炎沙门菌atcc19585存活曲线示意图;
图8为本发明的疫苗免疫后小鼠感染鼠伤寒沙门菌cvcc542存活曲线示意图;
图9为本发明的盲肠组织病理变化示意图;
图10为本发明的基于pagc抗原评价疫苗的鉴别诊断效果示意图;
具体实施方式
下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
请参阅图1-10,本发明提供一种技术方案:一种沙门菌菌蜕疫苗的制备方法,包括以下步骤:
步骤s1,利用λ-red系统制备获得鸡白痢沙门菌基因缺失突变株δpagc;
步骤s2,缺失株lb平板划线,挑取单菌落转接到新鲜的lb培养基中过夜培养;
步骤s3,取过夜培养的鸡白痢沙门菌δpagc菌液,1:100接种到50ml液体lb培养基中,37℃、180rpm振荡培养至od值约0.8;
步骤s4,4℃,5000rpm离心10min后用无菌的pbs缓冲液洗涤3次,然后用终浓度为50μm的map溶液重悬菌体至od值为0.3,21℃恒温静置16h,4℃、5000rpm离心10min收集菌体;
步骤s5,再次洗涤重悬后获得菌蜕原液,多次调整原液使其稀释10倍后测得的od值为1(此时原液的浓度大约在109cfu/ml);
步骤s6,将原液浓缩一倍后与佐剂进行1:1混合,然后加到2ml的灭菌匀浆管(含钢珠)中,使用组织匀浆仪中进行乳化,待乳化完全后,取100μl均匀涂布于lb固体培养基上,37℃培养16h后观察无菌落长出,此时成功制备鸡白痢沙门菌cvcc1800δpagc菌蜕疫苗。
一种沙门菌菌蜕疫苗的应用,包括鸡白痢沙门菌δpagc菌蜕疫苗的免疫保护试验和鸡白痢沙门菌cvcc1800δpagc甲醛灭活苗的diva特性评估;
本发明中map作用条件的确定及细菌灭活效率的计算;
map是细胞穿孔肽的一种,分子式为c90h170n24o18,分子量大小1876.51;由18个氨基酸残基组成;其氨基酸序列为h-klalklalkalkaalkla-nh2;该细胞穿孔肽交由南京金斯瑞生物科技有限公司合成;
本试验通过使用细胞穿透肽map来制备鸡白痢沙门菌δpagc菌蜕,根据其溶菌效果来确定map的最佳使用条件;
鸡白痢沙门菌δpagc缺失株lb平板划线,挑取单菌落转接到新鲜的lb培养基中过夜培养;次日将其按照1:100接种到50ml液体lb培养基中,37℃、180rpm振荡培养至od值约0.8;4℃、5000rpm离心10min收集菌体沉淀,洗涤重悬3次后,用无菌的pbs缓冲液将菌体分别稀释到od值为0.1,0.2,0.3,0.4和0.5,每个od值的菌液倍比稀释至合适的稀释度,每个稀释度设3个重复;从稀释液中取出100μl均匀涂布在lb固体培养基上,37℃倒置培养16h后进行菌落计数,统计cfu;
同时,用含10μm、30μm、50μmmap的na2hpo4溶液分别将菌体稀释到od值为0.1,0.2,0.3,0.4和0.5,每种处理设3个重复;将其转接到96孔板,每孔200μl,21℃恒温培养作用1h;培养结束后,每孔取100μl均匀涂在lb固体培养基上,37℃倒置培养16h后进行菌落计数;根据cfu统计结果,计算map的细菌灭活效率;大量制备疫苗时,在上述试验确定的条件基础上,采用100ml菌液进行制备,并计算灭活效率;
其计算公式为:灭活率=(1-map作用后cfu/pbs重悬cfu)×100%;
用终浓度为50μm的map溶液处理od值为0.3的沙门菌δpagc菌液,对制备的菌蜕疫苗进行灭活效果检测;当处理体积为200μl时,细菌的裂解效率为100%;当处理体积为100ml时,发现有少量的细菌生长,经计算得知细菌的实际灭活效率可达99%;说明随着待处理菌液体积的增加,map溶液的灭活效率有所降低;
本发明中鸡白痢沙门菌δpagc菌蜕形态观察;
取过夜培养的鸡白痢沙门菌δpagc菌液,将其按照1:100接种到50ml液体lb培养基中,37℃、180rpm振荡培养到od值约0.8;4℃、5000rpm离心10min收集菌体沉淀,用无菌的pbs缓冲液洗涤3次后,用终浓度为50μm的map溶液重悬菌体至od值为0.3,21℃恒温静置作用1h,离心后用无菌的pbs缓冲液洗涤3次,调整至合适的稀释度备用;
2.1透射电镜观察沙门菌δpagc菌蜕形态
取处理后的菌体固定到2.5%的戊二醛溶液中,后续工作交由武汉博尔夫生物科技有限公司完成;
结果如图3(图a为细菌经map处理后透射电镜观察结果,图b为阴性对照组)所示:与阴性对照组相比,map处理组的鸡白痢沙门菌δpagc菌蜕内容物明显减少,但尚能维持细胞膜结构的基本形态,与光学显微镜观察结果一致;
2.2荧光显微镜观察dapi染色后菌蜕的核酸残留情况
取10μl处理后的细菌悬液,均匀地涂到载玻片上,酒精灯固定后加入dapi染色液避光作用10min;去离子水冲洗晾干后,置于荧光显微镜下观察菌蜕的核酸残留情况;
结果如图4(图a为阴性对照组未处理的细菌在dapi染色后下的荧光观察结果,图b为阴性对照组未处理的细菌在dapi染色后下的明场观察结果;图c为map处理组的细菌在dapi染色后下的荧光观察结果,图d为map处理组的细菌在dapi染色后下的明场观察结果;)所示:与阴性对照组相比,dapi染色后的map处理组的菌蜕的荧光强度明显减弱;对应的明场条件下,细菌的总量和密度并无明显减少;由此可知,map处理组的细菌菌蜕,包膜内容物大量释出,核酸残留显著减少;
本发明中鸡白痢沙门菌δpagc菌蜕疫苗的免疫保护试验;
2.1免疫原性试验:血清效价检测
将制备的cvcc1800δpagc菌蜕疫苗株对3-4周龄icr小鼠进行皮下多点注射,注射剂量为1x108cfu/只,每组4只,同时设立注射pbs的阴性对照组,注射剂量为每只100μl;免疫分为3次进行,每次免疫间隔为14天;首免前和每次免疫后第13天下颌静脉采血,次日分离血清进行间接elisa试验,将每份血清样品1:400稀释后检测其血清效价;具体方法可参考文献:徐步,高明燕,龚建森,吕晓娟,单艳菊,刘学贤,采用全菌抗原干燥包被法elisa检测禽霍乱血清抗体的研究[j].中国家禽,2009,31(5):31-33.
结果如图5显示:随着免疫次数的增加,疫苗组小鼠的抗体效价逐步上升,在三免后达到高峰,与pbs对照组差异极其显著;
2.2保护效力试验
三免后第14天对小鼠进行腹腔攻毒(攻毒剂量参考图2),攻毒后每天观察存活状态,绘制存活曲线并计算免疫保护率;(存活曲线见图6,图7和图8)
2.3盲肠病理组织变化
疫苗三免后第14天,用上述三株不同血清型的沙门菌攻毒;根据小鼠的临床症状陆续将其处死,观察盲肠组织的病理变化;
盲肠病理变化如图9(图片a,c和e分别为免疫组小鼠感染鸡白痢沙门菌、肠炎沙门菌和鼠伤寒沙门菌后的盲肠病理切片;b,d和f为对应的pbs对照组)显示:三株不同血清型沙门菌感染小鼠后,其免疫组的盲肠粘膜层细胞出现轻微坏死脱落;对应的pbs阴性对照组小鼠的盲肠粘膜层受损严重,结构无法清晰辨别;
本发明中鸡白痢沙门菌cvcc1800δpagc甲醛灭活苗的diva特性评估;
以pagc抗原包被elisa酶标板,评价沙门菌δpagc疫苗的鉴别诊断效果;抗原包被浓度为2μg/ml,血清稀释倍数为1:400;阳性血清由鸡白痢沙门菌cvcc1800野生株多次腹腔感染小鼠后分离获得;具体方法参考文献:方一臻.沙门氏菌间接elisa抗体检测方法的建立及重组猪痘活载体疫苗的研制[d];南京农业大学,2016.(鉴别诊断效果如图10显示,实线对应为野生型鸡白痢沙门菌cvcc1800阳性血清od450nm读值,虚线对应阴性血清od450nm读值,并附数值表)。
需要说明的是,在本文中,诸如第一和第二等之类的关系术语仅仅用来将一个实体或者操作与另一个实体或操作区分开来,而不一定要求或者暗示这些实体或操作之间存在任何这种实际的关系或者顺序。而且,术语“包括”、“包含”或者其任何其他变体意在涵盖非排他性的包含,从而使得包括一系列要素的过程、方法、物品或者设备不仅包括那些要素,而且还包括没有明确列出的其他要素,或者是还包括为这种过程、方法、物品或者设备所固有的要素。
尽管已经示出和描述了本发明的实施例,对于本领域的普通技术人员而言,可以理解在不脱离本发明的原理和精神的情况下可以对这些实施例进行多种变化、修改、替换和变型,本发明的范围由所附权利要求及其等同物限定。
- 还没有人留言评论。精彩留言会获得点赞!