癌症的靶向免疫治疗的制作方法
本申请是申请号为201210248481.9、申请日为2012年7月18日、发明名称为“癌症的靶向免疫治疗”的发明专利申请的分案申请。
发明背景:
治疗性抗体在临床上的应用已有二十多年的时间了,临床应用的抗肿瘤抗体药物现在已有十三种,包括rituxan(1997),herceptin(1998),mylotarg(2000),campath(2001),zevalin(2002),bexxer(2003),avastin(2004),erbitux(2004)和vectibix(2006);arzerra(2009);benlysta(2011);yervoy(2011);adcetris(2011)。靶点主要集中在egfr,her2,cd20和vegf四个分子上。
单纯的治疗性抗体的肿瘤细胞杀伤机制有三种(scottam,wolchokjd,oldlj.antibodytherapyofcancer.natrevcancer.2012mar22;12(4):278-87):1)抗体的直接作用即抗体使配体/受体信号的阻断或激动活性、诱导凋亡、呈递药物。抗体的受体激动活性可产生直接肿瘤细胞杀伤作用,比如,有些抗体可结合到肿瘤细胞表面受体上,激活该受体,从而导致细胞凋亡(以线粒体为代表)。抗体也可以通过受体拮抗活性介导肿瘤细胞杀伤,比如,某些抗体可结合到细胞表面受体上,并阻断二聚化、激酶激活和下游信号,从而抑制增殖,促进凋亡。抗体结合到酶上可以导致中和作用、信号阻断和细胞死亡。2)通过免疫介导的细胞杀伤机制包括补体依赖的细胞毒作用(complement-dependentcytotoxicity,cdc),抗体依赖细胞介导的细胞毒作用(antibody-dependentcellularcytotoxicity,adcc),t细胞功能调控等。免疫介导的肿瘤细胞杀伤可通过以下途径来完成:诱导吞噬作用;补体激活;抗体依赖细胞介导的细胞毒作用;遗传修饰的t细胞通过单链可变片段靶向肿瘤;通过抗体介导抗原交叉递呈给树突状细胞激活t细胞;抑制t细胞抑制性受体,如细胞毒性t淋巴细胞相关抗原4(ctla4)。其中抗体fc部分的功能对于通过cdc和adcc介导的肿瘤细胞杀伤作用尤其重要。3)抗体对肿瘤血管和基质的特异性效应。通过对血管受体拮抗或配体捕获诱导血管和基质细胞消融,包括:基质细胞的抑制作用;向基质细胞传递毒素;向脉管系统传递毒素。(scottam,wolchokjd,oldlj.antibodytherapyofcancer.natrevcancer.2012mar22;12(4):278-87.)
单纯治疗性单抗药物的推动了抗癌药物的研究发展,但仍有些问题需要进一步研究解决。例如抗体的免疫原性,长期使用的肿瘤靶点耐受,单纯阻断单一信号传导通路的长期效果等等,总而言之,绝大部分的单纯抗体都较难做到长期的,高效率的抑制和杀伤肿瘤细胞。
1964年《自然》杂志提出了抗体-药物偶联(adc)技术的新思路,这方面的技术在近年来有了突破性的进展。adc是一种通过化学连接子(linker)将强毒性药物(toxin)与抗体共价连接起来。抗体识别癌细胞表面的抗原分子,由于细胞内吞adc药物的作用将其内吞至胞质内,在胞内特殊环境下,linker水解后释放的毒素来杀伤细胞。
seattlegenetics公司开发的这类药物brentuximabvedotin(商品名adcetris)已通过了fda的上市批准。它是由monomethylauristatine(mmae)这种人工合成的毒性抗癌药和特异性靶向淋巴瘤细胞特异性的cd30分子的抗体偶联而成,提高了杀灭肿瘤细胞的作用。
现在,有数十款这类adc药物正在开展临床试验,其中genentech生物技术公司和immunogen公司联合开发的曲妥珠单抗与美登素偶联成的,用于治疗乳腺癌的药物t-dm1已经进入了最后上市前准备。美登素是一种小分子毒素,可与微管蛋白结合,通过非还原的双-马来酰亚胺-丙二醇联合体防止微管形成。而曲妥珠单抗可靶向作用于乳腺癌和胃癌人表皮生长因子受体2(her2),是被批准用于her2阳性的癌症的新药,但曲妥珠单抗并非能够促使所有的her2阳性细胞凋亡。t-dm1结合了选择性地靶向her2受体的曲妥珠单抗与强效的细胞毒性剂maytansine而杀死肿瘤细胞。即t-dm1抗体与her2受体结合,引起从偶联物释放的美登素细胞内化,进而杀死肿瘤细胞。t-dm1具有较好的整体疗效和药代动力学特性,并且毒性较低。
传统的小分子化疗药物具有毒性强和药代动力学的优势,但在治疗肿瘤过程中可能结合和影响其他生理靶点产生严重的副作用;抗体-药物偶联就是把具有优异临床疗效的靶向特异性抗体和小分子药物的药代动力学结合起来。抗体药物偶联物结构是具有靶向作用的单克隆抗体与具有特定药理学特性的化合物结合。这种技术的要求是治疗性抗体必须具有靶点结合特异性;必须与一个具有治疗或其他功能作用的分子如细胞毒素偶联,诸多因素影响这类抗体的作用如偶联抗体的细胞内吞功能、偶联稳定性、细胞毒素的释放及杀伤性等。
目前常用的毒素分子主要包括微管蛋白抑制剂auristatin类似物monomethylauristatine,monomethylauristatinf和美登素。monomethylauristatine是人工合成的微管聚合物抑制剂,能够抑制微管聚集,干扰肿瘤细胞有丝分裂和凋亡诱导作用(naumovskilandjunutulajr.glembatumumabvedotin,aconjugateofananti-glycoproteinnon-metastaticmelanomaproteinbmabandmonomethylauristatineforthetreatmentofmelanomaandbreastcancer.curropinmolther2003;12(2):248-57.franciscoja,cervenycgetal.cac10-vcmmae,ananti-cd30-monomethylauristatineconjugatewithpotentandselectiveantitumoractivity.blood102(4):1458-65)monomethylauristatinf是一种抗有丝分裂的auristatin衍生物,c末端具有带电荷的苯基丙氨酸残基,与未带电荷的mmae相比,它最小化细胞信号通路的损伤,最小化细胞毒性。在大量cd30细胞株试验中发现,mab-maleimidocaproyl-缬氨酸-瓜氨酸-p-aminobenzyloxycarbonyl-mmaf(mab-l1-mmaf)的毒性比单独mmaf强2200倍以上(doroninasoetal.,enhancedactivityofmonomethylauristatinfthroughmonoclonalantibodydelivery:effectsoflinkertechnologyonefficacyandtoxicity.bioconjugchem,2006;17(1):p114-24)。美登素也是一种能与微管蛋白结合小分子毒素,通过非还原的双-马来酰亚胺-丙二醇联合体防止微管形成。
抗体-药物偶联具有直接和间接杀伤癌细胞的作用,这种抗体使配体/受体信号的阻断或激动活性、诱导凋亡同时还可以将负载药物直接或间接(例如药物、毒素、小分子干扰rna或放射性同位素)呈递或传递给肿瘤细胞。治疗性偶联抗体药物就是利用抗体和偶联药物的双重特性,一是结合功能,与靶分子特异性结合;二是抗体本身肿瘤细胞杀伤的效应功能,三是偶联药物的特定功效。目前的抗体-药物偶联药物是局限在如何直接杀伤肿瘤细胞。但基于这种技术在抗体,链接分子,毒素分子,链接技术等方面的高要求,以及能够带到肿瘤微环境内的毒素分子有限,在实际临床研究方面还存在着一定困难。
本文引用的参考文献不应视为承认是请求保护的本发明的现有技术。
发明概述
本发明涉及一个用于治疗肿瘤的具有靶向细胞功效以及细胞免疫调节功能的免疫治疗分子,此免疫治疗分子是具有靶向集团-链接分子-调节剂结构的偶联复合物。此免疫治疗分子在体内能达到杀伤肿瘤细胞同时更有效的激活肿瘤免疫和的作用。
本发明提供一种靶向免疫治疗分子,其具有如下结构:靶向集团,连接集团,和免疫调节剂,其中靶向集团和免疫调节剂经连接集团连接在一起。
在一个实施方案中,所述靶向集团可特异性地结合肿瘤。
在一个实施方案中,所述靶向集团可特异性地结合肿瘤抗原。所述肿瘤抗原可选自cd19,cd20,cd22,cd33,cd37,cd40,cd52,cd70,或cd79。所述肿瘤抗原也可选自syndecan-1,lewis,muc1,muc16,psma,cripto,epha2,epha3,ephb2,avintegrin,mesothelin,tag-72,caix,5t4,folatereceptor1,bt-062,slc44a4,nectin-4,gd2,ed-b,fap,gpnmb,gpa33,met,igf1r,trailr1,trailr2,rankl,fap,或tenascin。
在一个实施方案中,所述靶向集团是抗体。所述抗体可以是单克隆抗体。所述单克隆抗体可以是人源化,或人源性单克隆抗体。在再一个实施方案中,所述靶向集团选自rituxan(rituximab,利妥昔单抗),herceptin(trastuzumab,曲妥珠单抗),或erbitux(cetuximab,西妥昔单抗)。
在一个实施方案中,所述靶向集团选自afab,fab’,f(ab′)2,singledomainantibody,tandabsdimer,fv,scfv,dsfv,ds-scfv,fd,单域抗体(linearantibody),小分子抗体(minibody),双特异抗体(diabody),双特异抗体片断(bispecificantibodyfragment),bibody,tribody,sc-diabody,kappa(lamda)body,bite,dvd-ig,sip,smip,dart,或含有一个或多个cdr的抗体类似物(asmallantibodymimeticcomprisingoneormorecdrs)。
在一个实施方案中,所述靶向集团选自vegfr的atwlppr多肽片段,thrombospondin-1mimetics,cdcrgdcfcg(cyclic)多肽,sch221153片段,ncngrc(cyclic)多肽,ctthwgftlc多肽,cgnkrtrgc多肽(lyp-1),octreotide,vapreotide,lanreotide,c-3940多肽,decapeptyl,lupron,zoladex,或cetrorelix。
在一个实施方案中,权利要求1的免疫治疗分子,其中所述靶向集团是叶酸或其衍生物。
在一个实施方案中,所述免疫调节剂是免疫激活剂。
在一个实施方案中,所述免疫调节剂是tlr配体。在一个实施方案中,所述免疫调节剂是下列tlr中至少一个的配体:tlr1,tlr2,tlr3,tlr4,tlr5,tlr6,tlr7,tlr8,或tlr9。在再一个实施方案中,权利要求1的免疫治疗分子,其中所述免疫调节剂是tlr7和tlr8的配体。
在一个实施方案中,所述免疫调节剂选自imiquimod,resiquimod(r848),imo2134,imo205,mgn-1703,mgn-1704,agatolimod,sd-101,qax-935,dims0150,pollinexquattro,om-174,eritoran,tak-242,ni-0101,聚肌胞苷酸(polyi:c),cpg寡聚脱氧核苷酸,或干扰素-b。
在一个实施方案中,所述连接集团选自腙链,多肽链,二硫键链或硫醚键链。
在一个实施方案中,所述连接集团是可被酶切的或非酶切位点的。
本发明还提供一种药物组合物,其包含所述的免疫治疗分子或其药物学可接受的盐以及一种或多种药物学可接受的载体。
在一个实施方案中,所述的药物组合物,还含有第二化学治疗剂。所述的第二化学治疗剂可选自他莫昔芬、雷洛昔芬、阿那曲唑、依西美坦、来曲唑、imatanib、紫杉醇、环磷酰胺、洛伐他汀、minosine、吉西他滨、阿糖胞苷、5-氟尿嘧啶、甲氨喋呤、多西他奇、戈舍瑞林、长春新碱、长春碱、诺考达唑、替尼泊苷、依托泊苷、吉西他滨、epothilone、诺维本、喜树碱、柔红霉素、放线菌素d、米托蒽醌、安吖啶、多柔比星、表柔比星或伊达比星。
本发明还提供一种一种治疗细胞增生性疾病的方法,所述方法包括将治疗有效量的如所述的免疫治疗分子、或其药物学可接受的盐,与药物学可接受的载体一起给药于有此需要的对象,其中所述的细胞增生性疾病得到治疗。
在一个实施方案中,所述的细胞增生性疾病为癌前期病变,或癌症。其中所述的癌症为肺癌、结肠癌、乳腺癌、胰腺癌、前列腺癌、慢性髓细胞性白血病、黑素瘤或卵巢癌。
在一个实施方案中,所述的细胞增生性疾病为乳腺细胞增生性疾病。
在一个实施方案中,所述的乳腺细胞增生性疾病为乳腺癌前期病变。在再一个实施方案中,所述的乳腺癌前期病变选自乳腺非典型增生、原位管癌、和原位小叶癌。
在一个实施方案中,所述的乳腺细胞增生性疾病为乳腺癌。在再一个实施方案中,所述的乳腺癌为雌激素受体阴性乳腺癌。
在一个实施方案中,所述的治疗分子、或其药物学可接受的盐与第二化学治疗剂联合给药。在再一个实施方案中,所述的第二化学治疗药剂选自他莫昔芬、雷洛昔芬、阿那曲唑、依西美坦、来曲唑、imatanib、紫杉醇、环磷酰胺、洛伐他汀、minosine、吉西他滨、阿糖胞苷、5-氟尿嘧啶、甲氨喋呤、多西他奇、戈舍瑞林、长春新碱、长春碱、诺考达唑、替尼泊苷、依托泊苷、吉西他滨、epothilone、诺维本、喜树碱、柔红霉素、放线菌素d、米托蒽醌、安吖啶、多柔比星、表柔比星或伊达比星。
在一个实施方案中,所述的癌症治疗包括肿瘤尺寸的减小。
在一个实施方案中,所述的癌症为转移癌。在再一个实施方案中,所述的癌症治疗包括抑制转移癌细胞的侵袭。
从本文提供的其它描述,包括不同实施例,本发明的其他特征和优点将是显而易见的。所提供的实施例举例说明在实践本发明中有用的不同组分和方法。实施例不限制请求保护的本发明。基于本公开内容,本领域技术人员可以鉴定和采用对于实践本发明有用的其他组分和方法。
附图简述
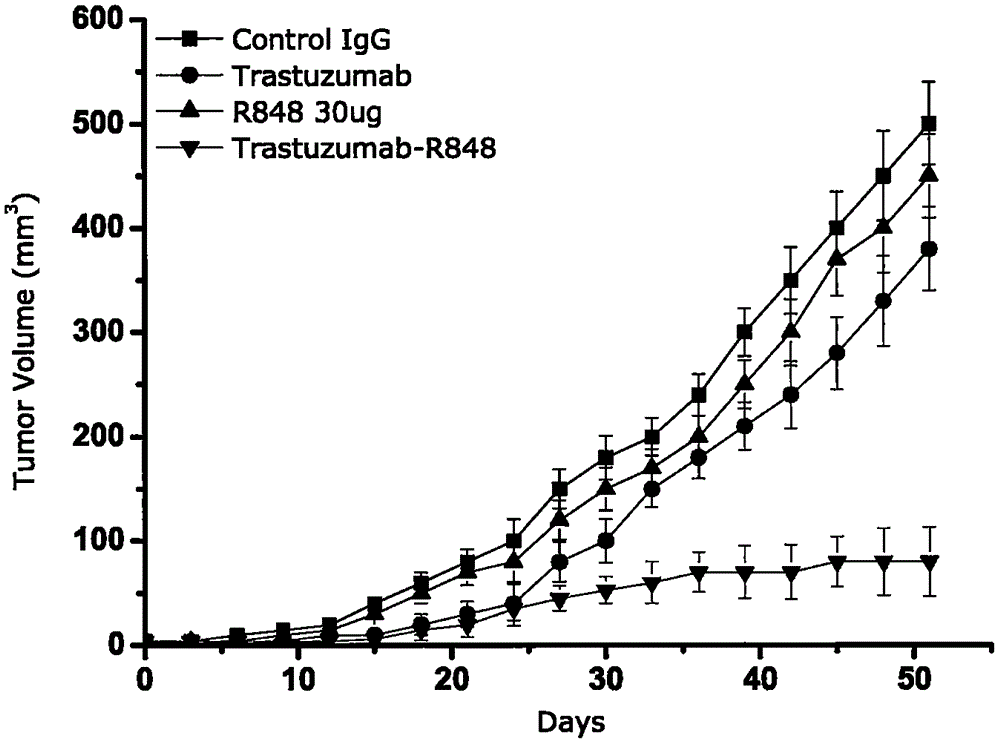
图1.balb/c裸鼠注射4x106肿瘤细胞建立癌症模型,每3天鼠尾静脉注射给药一次,对照组(n=10)抗体igg5mg/kg,trastuzumab抗体组(n=10)5mg/kg,r848组(n=10)30ug,trastuzumab偶联r848抗体组(n=10)5mg/kg,实验为50天测定肿瘤体积为其中观察项目之一。
发明详述
树突细胞是一类在免疫应答与免疫耐受中发挥重要作用的免疫细胞,其最突出的功能特点是在病毒刺激下产生大量的i型干扰素,因此又被称为是天然i型干扰素生产细胞。
树突状细胞是迄今所知的功能最强的抗原提呈细胞。根据其表面分子标记,树突状细胞可以被分成二个亚型,浆细胞样树突细胞(plasmacytoiddc,pdc)和骨髓样树突细胞(myeloiddc,mdc)。通过大量产生i型干扰素、细胞因子、趋化因子以及与其它细胞之间的相互作用等途径,浆细胞样树突细胞广泛地参与到机体的固有免疫和适应性免疫应答过程中,它可以调控nk、t、b等细胞参与免疫反应的强度、持续时间以及应答方式,从而在肿瘤、感染和自身免疫性疾病过程中均发挥十分重要的功能(liuyj.ipc:professionaltype1interferon-producingcellsandplasmacytoiddendriticcellprecursors.annurevimmunol.2005;23:275-306.gillietm,caow,liuyj.plasmacytoiddendriticcells:sensingnucleicacidsinviralinfectionandautoimmunediseases.natrevimmunol.2008aug;8(8):594-606)。
研究发现许多实体肿瘤如乳腺癌和头,颈肿瘤,卵巢癌中有pdc的侵润(treilleuxi,blayjy,bendriss-vermarenetal.dendriticcellinfiltrationandprognosisofearlystagebreastcancer.clincancerres2004;10:7466-7474,hartmanne,wollenbergb,rothenfussersetal.identificationandfunctionalanalysisoftumor-infiltratingplasmacytoiddendriticcellsinheadandneckcancer.cancerres2003;63:6478-6487.zouwp,machelonv,coulomb-l’hermina,etal.stromal-derivedfactor-1inhumantumorsrecruitsandaltersthefunctionofplasmacytoidprecursordendriticcells.natmed2001;7:1339-1346)而肿瘤细胞分泌的因子抑制的dc细胞的成熟(gabrilovichdi,corakj,ciernikifetal.decreasedantigenpresentationbydendriticcellsinpatientswithbreastcancer.clincancerres1997;3:483-490.belld,chomaratp,broylesdetal.inbreastcarcinomatissue,immaturedendriticcellsresidewithinthetumor,whereasmaturedendriticcellsarelocatedinperitumoralareas.jexpmed1999;190:1417-1425.menetrier-cauxc,montmaing,dieumcetal.inhibitionofthedifferentiationofdendriticcellsfromcd34(+)progenitorsbytumorcells:roleofinterleukin-6andmacrophagecolony-stimulatingfactor.blood1998;92:4778-4791)。这些未成熟的dc细胞没能起到调节免疫功能的作用。有证据表明toll样受体7激动剂imiquimod,和toll样受体9激动剂cpg类药物能够刺激肿瘤周边的pdc产生i型ifn进而抑制肿瘤的发展。(dummerr,urosevicm,kempfwetal.imiquimodinbasalcellcarcinoma:howdoesitwork?brjdermatol2003;149:57-58.millerrl,gersterjf,owensmletalimiquimodappliedtopically:anovelimmuneresponsemodifierandnewclassofdrug.intjimmunopharmacol1999;21:1-14.hofmannma,korsc,audringhetalphase1evaluationofintralesionallyinjectedtlr9-agonistpf-3512676inpatientswithbasalcellcarcinomaormetastaticmelanoma.jimmunother2008;31:520-527).
本发明涉及一个用于治疗肿瘤的具有靶向细胞功效以及细胞免疫调节功能的免疫治疗分子,此免疫治疗分子是具有靶向集团-链接分子-调节剂结构的偶联复合物。此免疫治疗分子在体内能达到激活肿瘤免疫和杀伤肿瘤细胞的作用。
本发明提供一种靶向免疫治疗分子,其具有如下结构:靶向集团,连接集团,和免疫调节剂,其中靶向集团和免疫调节剂经连接集团连接在一起。
1.靶向集团
1.1.肿瘤靶点
肿瘤靶点是肿瘤细胞表面相对特异的受体或特定的基因表达蛋白以及相关的配体,可溶性蛋白等。针对该靶标的抗体或其他药物特异性干预调节肿瘤细胞生物学行为的信号通路直接或阻断信号通路来抑制肿瘤细胞生长或促进其凋亡,迄今为止,已有几十余种分子靶点药物被批准用于实体肿瘤或血液系统肿瘤的临床研究及治疗,另有数种分子靶向药物用于血液系统肿瘤。目前非实体肿瘤如血液病肿瘤较常见的靶点为cd19,cd20,cd22,cd30,cd33,cd37,cd40,cd52,cd70,cd79;而在实体肿瘤中syndecan-1,lewis,muc1,epcam,her1,her2,her3,muc16,psma,cripto,ephb2,epha2,epha3,avintegrin,mesothelin,tag-72,caix,5t4,folatereceptor1,bt-062,slc44a4,nectin-4,gd2,ed-b,fap,gpnmb,gpa33,vegf,vegfr,met,igf1r,tnfr,trailr1,trailr2,rankl,fap,tenascin。(scottam,wolchokjd,oldlj.antibodytherapyofcancer.natrevcancer.2012mar22;12(4):278-87.)
1.2.治疗性抗体
临床上成功的案例如:rituxan(rituximab,利妥昔单抗),是人鼠嵌合抗体,用来治疗b细胞非霍奇金淋巴瘤。它作用在表达于b细胞表面的cd20抗原,90%以上的b细胞非霍奇金淋巴瘤均有表达。rituxan与cd20结合通过cdc和adcc引发b细胞溶解,同时也可使药物抵抗性的人体淋巴细胞对一些化疗药的细胞毒性敏感。
herceptin(trastuzumab,曲妥珠单抗)是人源化的单抗,作用在人表皮生长因子受体her2的胞外区域,25%-30%的乳腺癌有表达。herceptin抗肿瘤作用认为是1)使her2受体的表达下调,抑制her2的胞内信号转道通路,诱导细胞凋亡。2)与免疫机制有关,通过依赖抗体的adcc和cdc杀伤肿瘤细胞。
erbitux(cetuximab,西妥昔单抗)是人鼠嵌合抗体,作用在表皮生长因子受体(egfr)。erbitux与egfr结合可抑制其信号转道通路,影响细胞增殖、侵袭转移以及血管生成。抑制egfr信号转道通路可增强化疗药物和放射治疗的疗效。
avastin(bevacizumab,贝伐单抗)是人源化的单抗,其作用靶点是血管皮生长因子(vegf)。它与vegf结合抑制vegfr的信号转导,结果导致抑制肿瘤的新血管生成。
1.3.其它抗体
目前在研发的针对肿瘤靶点的治疗性抗体药物有血液系统疾病肿瘤方面的抗cd19,cd20,cd22,cd33,cd37,cd40,cd52,cd70,cd79单克隆抗体;有用于治疗实体肿瘤的抗syndecan-1,lewis,muc1,muc16,psma,cripto,epha2,epha3,ephb2,avintegrin,mesothelin,tag-72,caix,5t4,folatereceptor1,bt-062,slc44a4,nectin-4,gd2,ed-b,fap,gpnmb,gpa33,met,igf1r,trailr1,trailr2,rankl,fap,tenascin抗体等。(scottam,wolchokjd,oldlj.antibodytherapyofcancer.natrevcancer.2012mar22;12(4):278-87)
下表列举了以肿瘤抗原分类的各种正在研发的治疗性抗体:
1.4.抗体片段或变体
下表列举了可用于肿瘤抗原抗体结合的各种抗体形式以及正在研究的肿瘤靶点:
可结合抗原的抗体片断或衍生物:afab,fab’,f(ab′)2,singledomainantibody,tandabsdimer,fv,scfv,dsfv,ds-scfv,fd,单域抗体(linearantibody),小分子抗体(minibody),双特异抗体(diabody),双特异抗体片断(bispecificantibodyfragment),bibody,tribody,sc-diabody,kappa(lamda)body,bite,dvd-ig,sip,smip,dart,或含有一个或多个cdr的抗体类似物(asmallantibodymimeticcomprisingoneormorecdrs)。
1.5.其它可特异性结合肿瘤的分子
研究发现许多多肽类分子较特异性的作用在肿瘤血管方面和细胞表面激素受体上。如肿瘤血管方面的有vegfr的atwlppr多肽片段,作用在cd36的thrombospondin-1mimetics,在integrinsavb3andavb5的acdcrgdcfcg(cyclic)多肽和sch221153片段,作用在aminopeptidase上的ncngrc(cyclic)多肽;作用在mmp-2andmmp-9的ctthwgftlc和lymphaticvessels的cgnkrtrgc多肽(lyp-1);在细胞表面激素受体上有omatostatinreceptors的octreotide,vapreotide和lanreotide;bombesin/grpreceptor的c-3940多肽,hrh受体的decapeptyl,lupron,zoladex,cetrorelix。
近年来,folicacid的研究进展引人注目,叶酸是一种小分子维生素,是细胞分裂所必须的。肿瘤细胞分裂异常,其表面存在着高表达的叶酸受体(fr,folatereceptor)以便捕捉足够的叶酸来支持细胞分裂。
数据表明fr在肿瘤细胞的表达比正常细胞高出20-200倍以上,各种恶性肿瘤fr表达率分别是卵巢癌82%,非小细胞肺癌66%,肾癌64%,结肠癌34%,乳腺癌29%,(xiaw,lowps.late-targetedtherapiesforcancer.jmedchem.2010;14;53(19):6811-24)且与上皮肿瘤组织的恶性程度及转移侵袭程度呈正相关。fa可以通过细胞表面的fr介导内吞作用将fa吞入胞内,而fa通过其羧基与药物形成fa复合物进入细胞内仍然保持高度亲和力,并在酸性条件下(ph值为5)fr与fa脱离,fa并将药物释放在细胞质内。
临床上可以利用这个传递药物系统来达到选择性攻击肿瘤细胞。叶酸分子量小,无免疫原性,稳定性强,合成价格低廉,重要的是与药物或载体之间的化学键偶联简单易行,以fa为靶向分子构建药物传递系统成为治疗肿瘤的研究热点之一。目前在临床试验阶段的ec145(fa化疗药物偶联复合物)能有效的攻击癌细胞(pribblepandedelmanmj.ec145:anoveltargetedagentforadenocarcinomaofthelung.expertopin.investig.drugs(2012)21:755-761)。
2.免疫调节剂
2.1.tlr配体
tolllikereceptor(toll样受体,tlr)是树突细胞重要的模式识别受体并在其分化和功能成熟中发挥重要作用,tlr通过识别细菌、虫体、真菌和病毒等保守的病原相关分子模式(pamp)而捕获病原体,刺激树突细胞分化和功能成熟。
到现在为止,一共有10个人类和13个鼠类tlr家族相继被发现。它们在细胞内均有一定的分布。tlrl、2、4、5、6表达于细胞表面,tlr3、7、8、9存在于细胞的胞内体(endosome)。它们均属i型跨膜蛋白,由胞外区(550-980个氨基酸)、跨膜段和胞内区(约130个氨基酸)3部分组成。胞外区富含亮氨酸重复序列(lrr),能识别病原体成分;胞内区有一个toll/il-1r(tir)区域,是高度保守的蛋白质相互作用区,通过与转接分子的相互作用转导信号,是信号转导的核心元件。
近年来以tlr为靶向药物的研究也有突破性的进展,如通过tlr7myd88信号途径诱导ifn、il6和tnf的生成来调节免疫抗病毒、抗肿瘤药物的tlr7/8靶向激动剂imiquimod和已通过临床二期试验的resiquimod(r848)(hemmih,kaishot,takeuchio,etal.smallantiviralcompoundsactivateimmunecellsviathetlr7myd88dependentsignalingpathway.natimmunol,2002;3:196-200;panterg,kuznika,jeralar.therapeuticapplicationsofnucleicacidsasligandsfortolllikereceptors.curropinmolther,2009;11:133-145.kronenbergerb,zeuzems.currentandfuturetreatmentoptionforhcv,annhepatol,2009;8:103-112).针对tlr9靶点的imo2134,imo205,mgn-1703,mgn-1704,cpg-odn药物agatolimod,sd-101,qax-935,dims0150等;tlr4也是人们关注的靶点之一现在临床研究药物有单磷酰酯质a成分的pollinexquattro,om-174,eritoran,tak-242,ni-0101等等
表中列举了已报道的临床前或临床研究的能通过各种途径激活tlr的分子以及其作用的tlr和临床适应症
在识别核酸的tlr家族成员中,tlr7/8具有很高的相似程度,均可被类似的ssrna配体活化(dieboldss,kaishot,hemmih,etal.innateantiviralresponsesbymeansoftlr7mediatedrecognitionofsinglestrandedrna.science.2004;303(5663):1529-1531)。tlr7缺陷型小鼠的研究证实,tlr7和tlr8在病毒识别中起非重,该受体对几个单链rna病毒的识别是必需的,如甲型流,病毒(influenzaavirus)、水泡性口膜炎病毒(vesicularstomatitisvirus,vsv)。除此之外tlr7/tlr8还可识别咪唑喹啉/咪喹莫特、咪唑醌醇/r-848、咪唑喹啉/s-27610、洛索立宾、bropirimine等等。r848是一种小分子的免疫调节剂,它可以通过tlr7-myd88依赖的信号系统来激活免疫细胞诱导细胞因子的产生,具有活化浆状树突状细胞对靶细胞的细胞毒作用以及刺激树突状细胞产生ifn-和其他免疫刺激分子如cd40,cd80,cd86,ox40-配体,4-1bb-配体,gitr-配体,cd70作用。
通过tlr8可以激活骨髓粒细胞特别是mdc产生il-12和i型干扰素,而这二种因子又可以化使mdc的功能,使之从免疫耐受/炎症th2反应到抗肿瘤的th1以及细胞毒反应。不仅如此,tlr8激活的mdc还可以将坏死的肿瘤细胞处理并提呈给肿瘤特异识别的cd4阳性t细胞和cd8阳性t细胞,tlr8还可以上调i类,ii类mhc分子以及共刺激分子如cd80和cd86的表达以增加mdc的激活肿瘤特异性t细胞的能力。tlr7能够激活pdc并在肿瘤微环境中产生大量的i型干扰素和许多免疫刺激分子,这些刺激分子亦可以进一步激活mdc。tlr7激活的pdc还可以通过i型干扰素和共刺激分子如gitr配体来活化nk细胞,激活的nk细胞能够进一步杀伤肿瘤细胞并为树突状细胞产生了大量的坏死的肿瘤细胞,可供树突状细胞提呈抗原之用。
以tlr为靶位,抑制或激活tlr表达或调控tlr信号通路,不仅是炎性疾病新的治疗策略,而且还可作为药物设计和疫苗研制的新靶点。几乎主要用于人类和动物的疫苗佐剂就是利用激发不同pamp受体以对抗微生物菌或微生物菌衍生物的。基于我们的tlr和树突细胞生物学的理解,用于肿瘤疫苗佐剂治疗癌症的原理就是引导树突细胞像识别病原菌或病毒抗原一样去识别肿瘤抗原。
2.2.其它immunemodulators
目前与tlr相同的一系列模式识别受体也被发现如tlrrna螺旋酶rig样受体(rlr)和nod样受体。与tlr不同之处在于rlr路径的活化能够引发i型ifn的表达,而不会形成il-12和il-23。目前已知的配体或称为免疫调节剂的有5’triphosphorylatedrna,shortdsrna5’triphosphatepanhandle-likerna等。而发现能够调节nod样受体的免疫调节剂有lipoproteins,pgn,ssrna,uricacid,atp,alum,asbestos,flagellin。
3.偶联链接分子(linkers)
目前常用的偶联链接分子有具有血清中的稳定性和细胞浆内酸性环境中的降解作用的腙链(hydrazone)(carterpj,senterpd.antibody-drugconjugatesforcancertherapy.cancerj.2008;14(3):154-69)。具有有被溶酶作用的多肽链(peptide)(carterpj,senterpd.antibody-drugconjugatesforcancertherapy.cancerj.2008;14(3):154-69;sandersonrj,heringma,jamessf.invivodrug-linkerstabilityofananti-cd30dipeptide-linkedauristatinimmunoconjugate.clincancerres.2005jan15;11(2pt1):843-52);以巯基和细胞氧化还原状态进行二硫交换的二硫键链(disulfde)(carterpj,senterpd.antibody-drugconjugatesforcancertherapy.cancerj.2008;14(3):154-69.chaffrv.targetedcancertherapy:conferringspecificitytocytotoxicdrugs.accchemres.2008jan;41(1):98-107);还有能够利用胞内蛋白质降解的硫醚键链(thioether)(carterpj,senterpd.antibody-drugconjugatesforcancertherapy.cancerj.2008;14(3):154-69.oflazoglue,stoneij,gordonketal.potentanticarcinomaactivityofthehumanizedanti-cd70antibodyh1f6conjugatedtothetubulininhibitorauristatinviaanuncleavablelinker.clincancerres.2008oct1;14(19):6171-80.)
4.用途
本发明还提供调节肿瘤内的免疫反应的方法。该方法包括步骤:使肿瘤细胞与本发明分子接触,实现肿瘤内的免疫反应的调节。
4.1.治疗用途
本发明的治疗分子可以用于治疗和/或调节细胞异常增殖疾病。在一个实施方案中,本发明可以用作癌症治疗或用于预防癌症。
本文中所使用的“对象”可以是任何一种哺乳动物,例如人、灵长类动物、大鼠、小鼠、狗、猫、牛、马、猪、绵羊、山羊、骆驼。在一个优选的方面,所述对象为人类。
本文中所使用的“有此需要的对象”为患细胞异常增殖疾病的对象,或相对于普通人群,患细胞异常增殖疾病的危险增加的对象。一方面,有此需要的对象有癌前期病症。在优选的方面,有此需要的对象患有癌症。
本文中所使用的术语“细胞异常增殖疾病”是指在这些病变中,细胞不受控的或异常的生长(或二者皆有)可以导致不希望的病变或疾病发生,其中的疾病可以是也可以不是癌症。在一方面,细胞异常增殖疾病包括非癌症病变。
在另一方面,细胞异常增殖疾病包括初期癌或癌前期病变。在另一方面,细胞异常增殖疾病包括癌症。多种要治疗的癌症包括但不限于乳腺癌、肺癌、结肠直肠癌、胰腺癌、卵巢癌、前列腺癌、肾癌、肝癌、脑癌、黑素瘤、多发性骨髓瘤、慢性髓细胞性白血病(chronicmyelogenousleukemia)、血液肿瘤、以及淋巴肿瘤,包括在远离原发肿瘤的其它组织或器官中的转移病灶。要治疗的肿瘤包括但不限于恶性毒瘤、癌瘤、以及腺癌。在一方面,“初期癌细胞”(precancercell)或“癌前期的细胞”(precancerouscell)为表现出初期癌或癌前期病变的异常增殖的细胞。在另一方面,“癌细胞”或“癌性细胞”为表现出癌症病变的异常增殖的细胞。在一优选方面,癌细胞或癌前期的细胞通过组织样本(例如活组织检查样本)的组织学分类或分级来确定。在另一方面,癌细胞或癌前期的细胞通过采用合适的分子标记物来确定。
本文中所使用的“正常细胞”是指不能被定为“异常增殖”部分的细胞。在一方面,正常细胞缺少失控或异常增长,或两者都缺少。失控和异常增长可以导致不希望的状况或疾病。优选地,正常细胞拥有正常工作的细胞周期关卡控制机制。
本文中所使用的“与细胞接触”是指一种化合物或其它的物质组合物与细胞直接接触,或者接近到足够在细胞内引起希望的生理反应的情况。
本文中所使用的“单一疗法”是指对有此需要的对象给药单一活性化合物或治疗化合物。优选地,单一疗法包括给药在治疗有效量的一种活性化合物。例如,使用本发明的治疗分子、或其药理学上可接受的盐、类似物、或衍生物,对有治疗癌症需要的对象给药。单一疗法和联合治疗相比,后者将多种活性化合物组合给药,优选该组合的每种化合物均为治疗上有效的量。在一优选方面,使用本发明的治疗分子的单一疗法在诱导希望的生理反应上比联合治疗更有效。
本文中所使用的“治疗”说明了为与疾病、病变、失调抗争的目的对病人的处理和照顾,并且包括将本发明的治疗分子给药以预防症状或并发症的发生,减轻症状或并发症,或消除疾病、病变或失调。
在一方面,治疗癌症的结果是肿瘤尺寸的减小。肿瘤尺寸的减小也被称为“肿瘤消退”。在另一方面,治疗癌症的结果是肿瘤体积的减小。另一方面,治疗癌症的结果是肿瘤数量的减少。在另一方面,治疗癌症的结果是在远离原发肿瘤处的其它组织或器官中的转移病灶数量的减少。
在另一方面,治疗癌症的结果是治疗后的对象的人群的平均生存时间与只接受了载体的人群相比有所增加。在另一方面,治疗癌症的结果是治疗后的对象的人群的平均生存时间与未接受治疗的人群相比有所增加。在另一方面,治疗癌症的结果是治疗后的对象的人群的平均生存时间与接受使用非本发明的化合物,或其药理学上可接受的盐、类似物、或衍生物的单一疗法的人群相比有所增加。
在另一方面,治疗癌症的结果是治疗后的对象的人群的死亡率与未接受治疗的人群相比有所下降。在另一方面,治疗癌症的结果是治疗后的对象的人群的与接受使用非本发明的化合物,或其药理学上可接受的盐、类似物、或衍生物的单一疗法的人群相比有所下降。
在另一方面,治疗癌症的结果是肿瘤生长速度降低。在另一方面,治疗或预防细胞增生性疾病的结果是细胞再生长有所降低。在另一优选方面,肿瘤再生长可表现为在治疗停止后肿瘤不再复发。
在另一方面,治疗或预防细胞增生性疾病的结果是细胞增生的速度有所降低。在另一方面,治疗或预防细胞增生性疾病的结果是增生细胞的比例有所降低。
在另一方面,治疗或预防细胞异常增殖的结果是细胞异常增殖范围或区域的尺寸的减小。在另一方面,治疗或预防细胞异常增殖的结果是有异常表现或异常形态的细胞的数量或比例有所下降。
本文中所用的术语“选择性地”的意思是倾向于在某一群体中比在另一群体中以更高的频率发生。在一方面,所对比的群体为细胞群体。在一优选方面,本发明的治疗分子,或其药理学上可接受的盐、类似物、或衍生物选择性地对癌细胞或癌前细胞起作用,而不对正常细胞起作用。优选地,如果事件在群体a中发生的频率大于在群体b中频率的两倍,则相比于群体b中该事件选择性地发生于群体a中。更优选为,如果事件在群体a中发生的频率大于5倍,则该事件选择性地发生;如果事件在群体a中发生的频率大于10倍,则该事件选择性地发生;更优选为,大于50倍;更优选为,大于100倍;最优选为,事件在群体a中发生的频率大于在群体b中频率的1000倍。例如,如果与正常细胞相比,细胞死亡发生在癌细胞中的频率多于两倍,则细胞死亡可以被称为选择性地发生于癌细胞中。
在一方面,提升是指一种物质组合物(例如蛋白质或核酸)所需的生理活性的增长。在一方面,提升可能通过一种物质组合物的浓度增加而发生。
在优选的方面,有效量的本发明的化合物,或其药理学上可接受的盐、类似物、或衍生物对正常细胞没有显著细胞毒性。如果将治疗有效量的一种化合物给药后,不诱导大于10%的正常细胞死亡,则治疗有效量的该化合物对正常细胞没有显著细胞毒性。如果将治疗有效量的一种化合物给药后,不诱导大于10%的正常细胞死亡,则治疗有效量的该化合物不显著影响正常细胞的活力。在另一方面,用凋亡导致细胞死亡。
在其他方面,本发明的治疗分子,或其药物学可接受的盐、类似物、或衍生物可以与第二种化学治疗药物联合给药。该第二种化学治疗药物可以为紫杉烷、芳香酶抑制剂、蒽环类抗生素、靶向微管的药物、拓扑异构酶毒性药、分子靶标或酶的抑制剂(例如,激酶抑制剂)、或胞苷类似物药。在优选的方面,所述化学治疗药物可以是但不限于,他莫昔芬、雷洛昔芬、阿纳托司唑、依西美坦、来曲唑、(imatanib)c、(紫杉醇)、环磷酰胺、洛伐他汀、minosine、阿糖胞苷(arac)、5-氟尿嘧啶(5-fu)、甲氨喋呤(mtx)、泰索帝(紫杉萜)、诺雷德(戈舍瑞林)、长春新碱、长春碱、诺考达唑、替尼泊苷、依托泊苷、健择(吉西他滨)、epothilone、诺维本(navelbine)、喜树碱、柔红霉素(daunonibicin)、放线菌素d、米托蒽醌、安吖啶、多柔比星(阿霉素)、表柔比星、或伊达比星或其它在www.cancer.org中所列的药物。在另一方面,所述第二种化学治疗药物可以是细胞因子,例如g-csf(粒细胞集落刺激因子)。在另一方面,本发明的治疗分子,或其药理学上可接受的盐、类似物、或衍生物可以与辐射疗法联合给药。在另一方面,本发明的治疗分子,或其药理学上可接受的盐、类似物、或衍生物可以与标准的化学疗法组合联合给药,所述化学疗法组合为例如但不限于,cmf(环磷酰胺、甲氨喋呤和5-氟尿嘧啶)、caf(环磷酰胺、阿霉素和5-氟尿嘧啶)、ac(阿霉素和环磷酰胺)、fec(5-氟尿嘧啶、表柔比星和环磷酰胺)、act或atc(阿霉素、环磷酰胺和紫杉醇)、cmfp(环磷酰胺、甲氨喋呤、5-氟尿嘧啶和泼尼松)。
在一方面,本发明的治疗分子,或其药理学上可接受的盐、类似物、或衍生物是以一种合适的剂型给药,该剂型的制备是通过将一种治疗有效量的(例如,足以通过抑制肿瘤生长、杀死肿瘤细胞、治疗或预防细胞异常增殖疾病等实现所需的治疗效果的有效水平)本发明的治疗分子,或其药理学上可接受的盐、类似物、或衍生物,(作为活性成分)与标准的药物载体或稀释剂按照常规步骤(意即,通过制备本发明的药物组合物)结合。
实施例
下文提供了实施例以进一步举例说明本发明的不同特征。这些实施例还举例说明对于实践本发明有用的方法。这些实施例对请求保护的本发明不构成限制。
本发明的申请人进行了大量的实验,采用基因工程技术将trastuzumab与tlr7/8配体进行了偶联组合,这些偶联组合的药效与trastuzumab相比具有更高,更强肿瘤杀伤效果。
实施例1
抗her2人源化抗体trastuzumab的表达载体构建是根据cas资料180288-69-1和carterp等″humanizationofananti-p185her2antibodyforhumancancertherapy″procnatlacadsciusa1992;89:4285-9公开的抗人her2单抗资料及序列进行的。抗体trastuzumab重链可变区基因(her-2vh)及轻链可变区基因(her-2vl)是全基因合成(英茂盛业公司)。trastuzumab抗体重链可变区氨基酸序列为:gluvalginleuvalgluserglyglyglyleuvalginproglyglyserleuargleusercysalaalaserglypheasnilelysaspthrtyrilehistrpvalargglnalaproglylysglyleuglutrpvalalaargiletyrprothrasnglytyrthrargtyralaaspservallysglyargphethrileseralaaspthrserlysasnthralatyrleuglnmetasnserleuargalagluaspthralavaltyrtyrcysserargtrpglyglyaspglyphetyralametasptyrtrpglyglnglythrleuvalthrvalserser。trastuzumab抗体轻链可变区氨基酸序列为:aspileglnmetthrglnserproserserleuseralaservalglyaspargvalthrilethrcysargalaserglnaspvalasnthralavalalatrptyrglnglnlysproglylysalaprolysleuleuiletyrseralaserpheleutyrserglyvalproserargpheserglyserargserglythraspphethrleuthrileserserleuglnprogluaspphealathrtyrtyrcysglnglnhistyrthrthrproprothrpheglyglnglythrlysvalgluilelys
人抗体轻、重链恒定区基因的合成是根据hieterpa等clonedhumanandmousekappaimmunoglobulinconstantandjregiongenesconservehomologyinfunctionalsegments.cell.1980;22(1pt1):197-207的文献和ellisonjw等thenucleotidesequenceofahumanimmunoglobulincgamma1gene.nucleicacidsres.1982;10:4071-9的文献从正常人外周血中分离并克隆。恒定区基因的pcr序列引物:重链恒定区hcsense:5‘-gctagcaccaagggcccatcggtcttcc-3’;hcantisense:5‘-tttaccgggagacagggagaggctcttc-3’;轻链恒定区lcsense:5‘-actgtggctgcaccatctgtcttcatct-3’;lcantisense:5‘-acactctcccctgttgaagctctttgtg-3’。
采用rt-pcr反应扩增抗体重链和轻链恒定区基因。pcr产物经琼脂糖凝胶电泳純化回收并克隆到pgem-t载体(promega公司)中,测序验证后确认获得了正确的克隆。重链恒定区氨基列为:alaserthrlysglyproservalpheproleualaproserserlysserthrserglyglythralaalaleuglycysleuvallysasptyrpheprogluprovalthrvalsertrpasnserglyalaleuthrserglyvalhisthrpheproalavalleuglnserserglyleutyrserleuserservalvalthrvalproserserserleuglythrglnthrtyrilecysasnvalasnhislysproserasnthrlysvalasplyslysvalgluprolyssercysasplysthrhisthrcysproprocysproalaprogluleuleuglyglyproservalpheleupheproprolysprolysaspthrleumetileserargthrprogluvalthrcysvalvalvalaspvalserhisgluaspprogluvallyspheasntrptyrvalaspglyvalgluvalhisasnalalysthrlysproargglugluglntyrasnserthrtyrargvalvalservalleuthrvalleuhisglnasptrpleuasnglylysglutyrlyscyslysvalserasnlysalaleuproalaproileglulysthrileserlysalalysglyglnproarggluproglnvaltyrthrleuproproserargaspgluleuthrlysasnglnvalserleuthrcysleuvallysglyphetyrproseraspilealavalglutrpgluserasnglyglnprogluasnasntyrlysthrthrproprovalleuaspseraspglyserphepheleutyrserlysleuthrvalasplysserargtrpglnglnglyasnvalphesercysservalmethisglualaleuhisasnhistyrthrglnlysserleuserleuserproglylys。轻链恒定区的氨基酸序列为:argthrvalalaalaproservalpheilepheproproseraspgluglnleulysserglythralaservalvalcysleuleuasnasnphetyrproargglualalysvalglntrplysvalaspasnalaleuglnserglyasnserglngluservalthrgluglnaspserlysaspserthrtyrserleuserserthrleuthrleuserlysalaasptyrglulyshislysvaltyralacysgluvalthrhisglnglyleuserserprovalthrlysserpheasnargglyglucys。
以her2-vh基因和ch载体为模板通过重叠pcr合成人源化抗体重链基因,反应条件为:95℃15分钟;94℃50秒,58℃50秒,72℃50秒,30个循环;72℃10分钟。并使此pcr的重链基因的5’端含有限制酶位点hindiii和信号肽基因序列,3’端含有翻译终止密码taa和限制酶位点ecori。信号肽基因序列见为:atggattttcaggtgcagattttcagcttcctgctaatcagtgcctcagtcataatatccagagga。最后琼脂糖凝胶电泳分离pcr扩增产物,回收目的条带并克隆到pgem-t载体中,筛选阳性克隆测序。挑选测序正确的克隆用hindiii和ecori酶切,经琼脂糖凝胶电泳纯化回收人源化抗体重链片段her2-vh-ch,与用hindiii和ecori酶切的质粒pcdna3.1(+)(美国invitrogen公司产品)进行连接,构建成人源化重链真核表达载体pcdna3.1(+)(her2-vh-ch)。
以her2-vl基因和cl载体为模板通过重叠pcr合成人源化抗体轻链基因,反应条件为:95℃15分钟;94℃50秒,58℃50秒,72℃50秒,30个循环;72℃10分钟,得到pcr产物her2-vl-cl,其5’端含有限制酶位点hindiii和信号肽基因序列,3’端含有翻译终止密码taa和限制酶位点ecori。信号肽基因序列为:atggattttcaggtgcagattttcagcttcctgctaatcagtgcctcagtcataatatccagagga与前相同。挑选测序正确的克隆用hindiii和ecori酶切,经琼脂糖凝胶电泳纯化回收人源化抗体轻链片段vlcl,与用hindiii和ecori酶切的质粒pcdna3.1载体(invitrogen公司产品)进行连接,构建成人源化轻链真核表达载体pcdna3.1(her2-vl-cl)。
实施例2人源化抗体的稳定表达与纯化
pcdna3.1(her2-vl-cl)质粒感染细胞是在组织培养皿中接种3×105cho-k1细胞(atcccrl-9618),细胞培养至90%-95%融合时进行转染。取混合质粒共10μg(pcdna3.1(+)(her2-vh-ch)4μg,质粒pcdna3.1(her2-vl-cl)6μg)和20μl的lipofectamine2000(invitrogen公司产品)分别溶于500μl无血清dmem培养基,室温静置5分钟,将以上2种液体混合,室温孵育20分钟以使dna-脂质体复合物形成,其间用3ml无血清的dmem培养基替换培养皿中的含血清培养基,然后将形成的dna-脂质体复合物加入到板中,co2孵箱培养4小时后补加2ml含10%血清的dmem完全培养基,置于co2孵箱中继续培养。转染进行24h后细胞换含600μg/mlg418选择培养基筛选高产量抗g418性克隆。筛选得到的高表达克隆用无血清培养基扩大培养,用proteina亲和柱(ge公司产品)分离纯化抗体,最后以紫外吸收法定量。
实施例3biacore检测抗体亲和力
运用biacoret100(biacoreab,ge公司)检测人源化抗体trastuzumab的亲和力常数。将人源化抗体trastuzumab通过氨基共价结合与cm5生物传感芯片(ge公司)上,将抗原her2蛋白在pbs/0.05%tween-20去污剂配溶液中配成不同的浓度(2倍比浓度稀释),以50μl/min的流速通过芯片。每次检查之后,用5μl50mm盐酸水溶液以3μl/min的流速洗涤,从而将残留的抗体从固定化的配体上洗脱下来。用biaevalution软件(t100evalution2.0版,gehealthcare公司),通过非线性回归法分析结合曲线。
实施例4trastuzumab-r848偶联的制备
主要试剂:n-羟基琥珀酰亚胺基-3-(2-吡基二硫)-丙酸酯(spdp)(p3415,美国sigma公司);二硫苏糖醇(dtt)(233155,merck公司);超滤离心管amiconultral(ufc90100815ml,10k,美国millipore公司);亲和层析柱ni-ntasuperflowcartvidge(qiagen公司);r848(invivogen公司)。抗体trastuzumab与r848的偶联样品处理原则具体步骤如下:
制备r848的spdp衍生物r848-pdp,取适量的r848溶于2ml的0.01mol/l磷酸缓冲液(pbsph=7.5)中,按n(r848)/n(spdp)=1/10的投料摩尔比值,计算所需要的spdp量,先将其溶于无水乙醇中,然后于25℃缓慢将溶于乙醇的spdp分别搅拌加入含有r848的磷酸缓冲液中,继续缓慢搅拌30min后,离心10000r/min30s,将r848的spdp衍生物离心后取上清放入超滤离心管,加入0.02mol/l磷酸缓冲液(含0.15mol/lnaclph=7.5),3500g,4℃,离心15min,重复三次,以去除剩余的spdp,即得r848-pdp,浓缩至2ml。用dtt法测定蛋白与spdp摩尔比,并同时留样做sds-page电泳。r848-pdp巯基衍生物的制备s是将r848-pdp沉淀分散于上述醋酸盐缓冲液中,加入dtt,使反应体系中dtt的终浓度为50mmol/l,25℃缓慢搅拌30min后用0.02mol/l磷酸缓冲液(含0.15mol/lnaclph=7.5)离心洗涤3次,以去除dtt并取代醋酸缓冲液,这一步骤得到r848-pdp巯基衍生物r848-sh。二联偶联物trastuzumab-r848的制备是将trastuzumab加入dtt使其二硫键断裂,在0.01mol/l的pbs中的r848-sh立即与处理过的trastuzumab混合,室温反应4小时。
实施例5trastuzumab-tlr配体偶联体内肿瘤试验
balb/c裸鼠40只,8周龄雌雄各半,体质量16至24克。购于上海斯莱克实验动物有限责任公司。动物严格饲养于室温22至26℃,湿度40%-60%的无特定病原体环境下。分别将0.5ml的8x106的bt-474肿瘤细胞接种于8周龄裸小鼠的背部皮下。每隔3d观察记录裸鼠体质量、精神、睡眠、活动、饮食及排便等状况,游标卡尺测量肿瘤长短径,观察成长情况。将40只雌雄各半的balb/c裸鼠癌症模型随机分为4组,对照抗体组5mg/kg;trastuzumab抗体组5mg/kg;r84830ug,和trastuzumab抗体-r848偶联药物组5mg/kg。所有药物均为鼠尾静脉注射给药。每周二次,同样剂量,以肿瘤体积作为治疗指标进行观察,随后每3天观察一次,计算公式按照:肿瘤体积mm3=(长度x宽度2)x0.5。
其他实施方案在下述权利要求内。尽管已显示且描述了几个实施方案,但无需背离本发明的精神和范围即可进行各种修饰。
- 还没有人留言评论。精彩留言会获得点赞!