调控适应性细胞与体液免疫的纳米载体的构建与应用
本发明属于制药领域,涉及一类可增敏蛋白/多肽亚单位疫苗功效、调控机体适应性细胞与体液免疫的纳米载药系统,尤其涉及能调控适应性细胞与体液免疫的纳米载体的构建,以及该纳米载体在制备抗肿瘤、抗病毒和抗寄生虫感染药物中的应用。
背景技术:
人类社会的发展多次受到肿瘤、病毒和感染的严重打击,而疫苗的出现是人工主动应对病原物质侵袭的重要转折点,具有可控性高、易于普及、能反复接种增强特异性免疫记忆从而提供长期保护等优势。出于安全性和生产成本等考虑,基于蛋白/多肽的亚单位疫苗成为了传统免疫技术的代表,也是当下主流的疫苗类型之一。通过筛选病原物特异性的抗原表位,纯化或构建包含该表位信息的蛋白/多肽,随后选择合适的递送载体和给药方式,向潜在的易感染人群(预防性疫苗)或已受病原物侵袭的个体(治疗性疫苗)进行单次或间隔式多次疫苗免疫,从而活化体内的抗原呈递细胞(apcs),启动特异性t/b淋巴细胞响应,诱导细胞和体液免疫的协同调动,放大对病原物的识别、杀伤与记忆。
树突状细胞(dcs)作为机体功能最强的apcs,具有诱导机体适应性细胞免疫和体液免疫的双潜能。抗原在dcs内经历剪切加工后与主要组织相容性复合物分子(mhc)组装,形成抗原肽-mhci类或ii类分子复合物(p-mhci或p-mhcii)。其中,内源性抗原(位于胞浆,包括被病毒感染的细胞内合成的病毒蛋白、某些细胞内的自身抗原等)通常进入mhci类呈递途径,形成的p-mhci与cd8+t细胞表面受体(tcr)特异性识别,从而诱导cd8+t细胞的活化,促进细胞毒性t淋巴细胞(ctls)的效应分化及靶细胞杀伤,启动细胞免疫;外源性抗原(吞噬获得,包括被吞噬的细胞、细菌或蛋白质抗原等)通常形成p-mhcii,后者与cd4+t细胞的tcr结合,诱导辅助性cd4+t细胞(th)的分化,促进b细胞的活化、浆细胞样分化和特异性中和抗体的产生,引发体液免疫。细胞与体液免疫在生物体内相辅相成,两者的配合发挥决定了免疫响应的有效性和持久性。
目前,蛋白/多肽类抗原的应用主要受到以下限制:1)免疫原性低,通常需要佐剂辅助;2)分子量大且多呈弱负电性,受apcs摄取少;3)作为外源性的“异己”成分,被apcs内化后大多进入mhcii类路径呈递以诱导体液免疫,对mhci依赖、cd8+t细胞主导的细胞免疫的调动不足。细胞免疫的缺乏严重影响了机体抗病毒、抗肿瘤和抗感染免疫的发挥。如,cd8+t细胞的耗竭弱化了光动力-光热疗法引发的抗肿瘤效果[nat.commun.,2019,10:3349]、限制了重组腺病毒载体疫苗对埃博拉病毒感染的保护作用[nat.med.,2011,17:1128-1131]、促进了白介素15超激动剂n-803诱导的潜伏期hiv或hsv病毒的再激活与复制[nature,2020,578:154-159]。通过提高机体细胞免疫响应来实现细胞与体液免疫的协同调动,可增强机体对病原物侵袭的抵抗力。如,thakur等人[jimmunother.,2011,34(5):457-467]通过联合粒细胞-巨噬细胞集落刺激因子(gm-csf)诱导系统性细胞和体液免疫应答,增强了经皮冷冻疗法的抗肿瘤效果;cao等人[nat.commun.,2018,9:3695]在蛋白抗原的皮下疫苗中引入无创射频来诱导局部炎症,促进皮肤和引流淋巴结处dcs的成熟,提高抗原特异性体液和细胞响应,在抗流感病毒侵袭中具有一定应用潜能;wilson等人[nat.mater.,2019,18:175-185]合成了具有dcs靶向性和活化诱导性的糖佐剂p(man-tlr7),将其与恶性疟原虫相关的抗原蛋白偶联,增加了抗原在dcs的胞浆释放,促进dcs对t细胞的抗原呈递,实现了抗疟疾细胞与体液免疫的联动。
调控mhc分子的参与类型和参与程度是决定抗原诱导的优势淋巴细胞亚群及免疫响应(细胞免疫或体液免疫)的关键。目前,增强机体对蛋白/多肽类抗原的特异性细胞免疫应答主要是通过提高dcs对这类外源性抗原的mhci类呈递来实现的,包括以下手段:1)促进抗原在dcs的胞浆释放,如,利用ph响应性材料、细胞穿膜肽或膜融合肽修饰抗原递送载体(或直接修饰抗原),促进外源性抗原在dcs的胞浆扩散以获得内源性特征,从而进入mhci类呈递途径[expertopindrugdel.,2015.13(3):373];2)延长抗原在dcs的胞内稳定性,主要是通过调控dcs的内体酸度或溶酶体酸度,限制抗原的过度降解,维持mhci类呈递所需的重要抗原表位的完整性并减少溶酶体介导的mhcii类抗原呈递[pnas,2009,106(16):6730-6735];3)添加刺激因子来诱导dcs的成熟与分化,如引入佐剂或某些细胞因子来改善dcs的数量与质量,以此提高适应性免疫响应的整体效力[acsappl.mater.interfaces.,2018,10(39):33532-33544];4)对抗原引入适宜的靶向特性,从而提高抗原的利用率和p-mhci的呈递潜能,主要包括抗原的淋巴结靶向[biomaterials,2016,98:171-183]、dcs靶向(尤其是mhci类呈递能力更优的dc亚群,如cdc1)[blood,2010,116(19):3828-3838]和dcs的内质网(er)靶向[j.immunol.,2013,191(12):6010-6021]。
在dcs中,er是mhc分子合成、抗原肽进一步加工及p-mhci组装的关键场所,将外源性抗原靶至dcs的er可利用内质网相关降解机制来促进抗原的剪切加工、p-mhci的组装与表达,从而提高抗原特异性细胞免疫应答。目前,将外源性抗原递送至dcs的内质网在提高蛋白/多肽类亚单位疫苗的免疫效应中的作用逐渐得到认可,相关的细胞分子机制也不断被揭示。然而,由于缺乏有效的靶向手段和合适的抗原递送载体,这种策略在抗肿瘤、抗病毒和抗感染中的应用十分有限。具体来说,抗原的结构对诱导特异性免疫响应至关重要,内质网趋向性分子对抗原的直接修饰容易破坏抗原的天然结构,影响免疫应答的有效性和特异性;同时,这种直接的偶联对抗原的胞内解离和释放提出较高的要求;此外,针对不同抗原,靶向修饰的方式和程度不同,制备成本高、难度大,不利于放大生产。相比之下,纳米载体具有表面修饰多样性,药物装载兼容性和药物释放可控性等优势,更适合蛋白/多肽类抗原的靶向递送。
基于以上介绍,本发明专利构建了一类内质网靶向性抗原递送载体,由生物安全性高、免疫原性弱、容易获得且生产成本低的脂质作为主要的载体材料,用内质网趋向性的小分子或多肽修饰脂质材料并暴露于载体表面,利用载体的阳离子性质和亲水亲脂性实现肿瘤、病毒或疟原虫特异性抗原蛋白/多肽的内部包裹和/或表面吸附。这类载体具有优良的抗原装载和内质网靶向能力,其制备方便、成本低廉、性质稳定,可以提高抗原的细胞摄取,改变抗原的胞内转运和呈递命运,从而调控细胞和体液免疫应答,具有良好的生产和应用前景。
技术实现要素:
本发明的目的之一是提供一种能调控适应性细胞与体液免疫的纳米载体的构建方法,通过如下方式实现。
以磷脂酰胆碱、维生素e、内质网靶向修饰脂质和阳离子脂质作为油相,抗原蛋白/多肽的水溶液作为水相,制备水包油型(o/w)阳离子纳米乳。其中,阳离子脂质占载体结构脂质总质量的1%-60%。油相中除维生素e,也可以包含或由其他油性成份替代,如大豆油、橄榄油、中链脂肪酸酯、硬脂酸甘油酯、蔗糖脂肪酸酯、角鲨烯。阳离子脂质占载体结构脂质总质量的1%-60%。阳离子脂质可以是带正电荷的脂质,如(2,3-二油酰基-丙基)三甲基氯化铵(dotap)、二甲基双十八烷基铵(dda)、1,2-二甲基-3-三甲基铵-丙烷(dmtap)、1,2-硬脂酰-3-三甲基铵-丙烷(dstap)或3β-[n-(n’,n’-二甲基胺乙基)胺基甲酰基]胆固醇(dc-chol);也可以是可电离脂质,如4-(n,n-二甲基氨基)丁酸(二亚油基)甲酯(dlin-mc3-dma,pka=6.44)。
具体步骤如下:
(1)纳米载体的构建与带电性质:
本发明所述的纳米载体具有阳离子性质。以磷脂酰胆碱、维生素e、内质网靶向修饰脂质和阳离子脂质作为油相,抗原蛋白/多肽的水溶液作为水相,制备水包油型(o/w)阳离子纳米乳。
油相中除维生素e,也可以包含或由其他油性成份替代,如大豆油、橄榄油、中链脂肪酸酯、硬脂酸甘油酯、蔗糖脂肪酸酯、角鲨烯。
阳离子脂质占载体结构脂质总质量的1%-60%。阳离子脂质可以是带正电荷的脂质,如(2,3-二油酰基-丙基)三甲基氯化铵(dotap)、二甲基双十八烷基铵(dda)、1,2-二甲基-3-三甲基铵-丙烷(dmtap)、1,2-硬脂酰-3-三甲基铵-丙烷(dstap)或3β-[n-(n’,n’-二甲基胺乙基)胺基甲酰基]胆固醇(dc-chol);也可以是可电离脂质,如4-(n,n-二甲基氨基)丁酸(二亚油基)甲酯(dlin-mc3-dma,pka=6.44)。
本发明所述的纳米载体不限于阳离子纳米乳,还可以扩展至阳离子脂质体和脂质纳米粒等,分别可通过旋转蒸发-探头超声法和微流控芯片技术制备。
(2)纳米载体的内质网靶向性表面修饰:
本发明所述的纳米载体具有内质网靶向能力。通过将具有内质网趋向性或定位能力的小分子或多肽修饰在纳米载体的表面,实现纳米粒在亚细胞结构内质网的选择性积累。
内质网靶向性的小分子或多肽包括:与内质网受体相互作用的磺酰胺或磺酰脲类合成小分子化合物、或含有内质网定位/驻留序列的多肽分子,如pardaxin多肽。
内质网靶向性表面修饰是通过在纳米载体的制备过程中掺入上述小分子或与脂质化学键合的多肽,使得在在纳米载体的组装过程中实现:有一定亲水性的靶头部分暴露于载体表面,用于载体的内质网选择性引导;亲脂性的长链烷基部分插入载体的核心结构,用于稳定载体的胶体结构。其中,内质网靶向修饰化合物占总脂质质量的1%-30%。
本发明目的之二是提供所述纳米载体在制备抗肿瘤、抗病毒和抗寄生虫感染药物中的应用。
利用所构建的纳米载体递送肿瘤相关抗原或特异性抗原,如黑色素瘤相关抗原、威尔姆斯肿瘤蛋白、前列腺癌抗原作为特异性抗原蛋白/多肽,制备抗肿瘤药物。
(1)纳米载体的抗原负载:
本发明构建的纳米载体可用于负载肿瘤、病毒或疟原虫特异性的抗原蛋白/多肽,如模型抗原鸡卵清白蛋白(ova)、黑色素瘤相关抗原(gp100或trp-2)、威尔姆斯肿瘤蛋白(wt1)、前列腺癌抗原(psa或psca)、新冠病毒sars-cov-2刺突蛋白(s蛋白)和恶性疟原虫衍生的环子孢子蛋白(csp)。
载体对抗原进行负载,如利用抗原的负电性与阳离子载体的正电性发生静电相互作用,实现对抗原蛋白/多肽的负载,可以将抗原包裹在载体的内部和/或吸附于载体的表面。
(2)调控机体细胞与体液免疫的分子基础:
本发明构建的抗原负载纳米载体具有调控机体抗原特异性的细胞免疫与体液免疫的能力。纳米载体将抗原靶向递送至树突状细胞的内质网,借助内质网相关降解机制将抗原降解并组装于主要组织相容性复合物i类分子(mhci),随后利用内质网相关分泌途径实现抗原肽-mhci分子的细胞表面呈递,用于提高cd8+细胞毒性t细胞(ctls)介导的细胞免疫;而未能成功进入内质网的抗原,在溶酶体中降解,并组装于主要组织相容性复合物ii类分子(mhcii),递呈至细胞表面,用于激活th细胞而放大体液免疫应答。
抗原负载纳米载体调控适应性细胞和体液免疫的程度主要由纳米载体的内质网靶向效率决定的。
本发明所述的纳米载体具有内质网靶向能力。通过将具有内质网趋向性或定位能力的小分子或多肽修饰在纳米载体的表面,实现纳米粒在亚细胞结构内质网的选择性积累。内质网靶向性的小分子或多肽包括:与内质网受体相互作用的磺酰胺或磺酰脲类合成小分子化合物、或含有内质网定位/驻留序列的天然多肽分子,如pardaxin多肽。内质网靶向性表面修饰是通过在纳米载体的制备过程中掺入上述小分子或与脂质化学键合的多肽,使得在在纳米载体的组装过程中实现:有一定亲水性的靶头部分暴露于载体表面,用于载体的内质网选择性引导;亲脂性的长链烷基部分插入载体的核心结构,用于稳定载体的胶体结构。其中,内质网靶向修饰化合物占总脂质质量的1%-30%。
本发明构建的纳米载体可用于负载肿瘤、病毒或疟原虫特异性的抗原蛋白/多肽,包括如模型抗原鸡卵清白蛋白(ova)、黑色素瘤相关抗原(gp100或trp-2)、威尔姆斯肿瘤蛋白(wt1)、前列腺癌抗原(psa或psca)、新冠病毒sars-cov-2刺突蛋白(s蛋白)和恶性疟原虫衍生的环子孢子蛋白(csp)等。载体对抗原进行负载,如利用抗原的弱负电性与阳离子载体的正电性发生静电相互作用,实现对抗原蛋白/多肽的负载,包括可以将抗原包裹在载体的内部包裹与和/或吸附于载体的表面外部吸附。
本发明构建的抗原负载纳米载体调控机体抗原特异性的细胞免疫与体液免疫的能力,具有如下机制特征:通过靶向修饰将纳米载体负载的外源性将抗原蛋白/多肽选择性靶向递送至树突状细胞的内质网,借助内质网相关降解机制将抗原降解并组装于主要组织相容性复合物i类分子(mhci),随后利用内质网相关分泌途径实现抗原肽-mhci分子的细胞表面呈递,用于提高cd8+细胞毒性t细胞(ctls)介导的细胞免疫;而未能成功进入内质网的抗原,在溶酶体中降解,并组装于主要组织相容性复合物ii类分子(mhcii),递呈至细胞表面,用于激活th细胞而放大体液免疫应答。抗原负载纳米载体调控适应性细胞和体液免疫的程度主要由纳米载体的内质网靶向效率决定的。
本发明所述的纳米载体是利用dcs内质网对抗原进行mhci类处理呈递的优势性,通过将具有内质网趋向性的小分子或多肽修饰于负载抗原的纳米粒子表面,改变外源性抗原在树突状细胞中的摄取总量、转运路径及加工呈递方式,从而调控机体抗原特异性的细胞免疫与体液免疫,构建了负载蛋白/多肽抗原的内质网靶向性纳米载体。本发明所述的纳米载体可以是阳离子的纳米乳、脂质体或脂质纳米粒等载药系统,抗原可涉及肿瘤、病毒或疟原虫特异性的抗原蛋白/多肽。该纳米载药系统通过提高机体适应性免疫,尤其是细胞免疫的参与度,来调动抗肿瘤、抗病毒或抗寄生虫感染的特异性免疫响应。利用本发明载体增加抗原的细胞摄取并改变抗原的胞内转运和加工呈递,从而调控机体特异性细胞免疫与体液免疫,因此可用于抗肿瘤、抗病毒和抗寄生虫感染。本发明构建方法设计思路新颖、制备方法合理简单、应用范围广。
附图说明
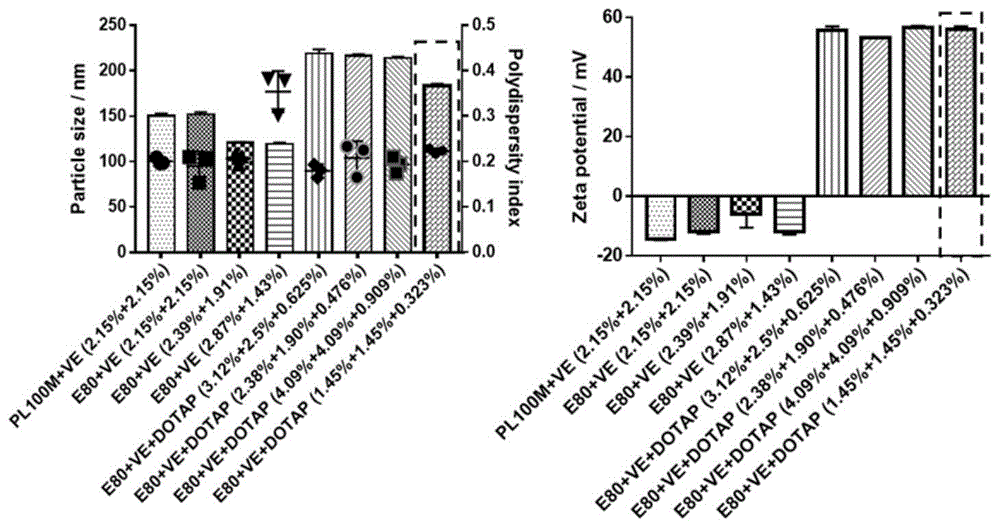
图1是空白阳离子纳米乳处方筛选过程中的乳剂的粒径、多分散系数(pdi)和表面电位(从左到右依次为处方1-8)。
图2是阳离子纳米乳(表1处方8)在透射电子显微镜(tem)下的形态。
图3是阳离子纳米乳(处方8)在4度存放两个月粒径与电位变化。
图4是不同剂量的阳离子纳米乳(处方8)处理24h对不同细胞系的细胞活力的影响,用cck-8细胞活力试剂盒检测。
图5是阳离子纳米乳(处方8)负载抗原ova前后的粒径和电位变化,包括荧光素did标记纳米乳与fitc标记的ova(cnes:阳离子纳米乳)。
图6是用10%sds-page偶联快速银染法考察阳离子乳剂对ova蛋白的包封能力(70μlova的水溶液(5mg/ml,mw:~44kda)与0、100、250或500μl阳离子乳剂共孵育制备sample1、2、3和4第一列和最后一列为蛋白上样marker)。
图7是以hek293作为模式细胞考察不同制剂对细胞摄取蛋白抗原的影响(标尺:100μm),包括利用图像处理软件imagej对图片进行荧光半定量分析。
图8是抗原(绿色)、细胞核(蓝色)和乳剂(红色)的共定位图片(标尺:200μm),用来表明抗原的确被细胞摄取入胞。
图9是载ova的阳离子乳剂在dc2.4和bmdcs中18h内的摄取情况。
图10是内质网靶向性载抗原阳离子纳米乳在dcs的胞内亚细胞结构定位(内质网:红色,脂质体:粉色,ova:绿色,细胞核:蓝色)(靶向组:target;非靶向组:non-target;对照组:control)。
图11是内质网靶向性抗原递送载体促进dcs的mhci类分子和mhcii类分子表达。
图12是内质网靶向性抗原递送载体诱导dcs刺激cd4+和cd8+t淋巴细胞的增殖。
图13是内质网靶向性抗原递送载体促进dcs进行抗原特异性mhci类呈递。
图14是内质网靶向性抗原递送载体促进dcs诱导抗原特异性t细胞的增殖。
具体实施方式
本发明结合附图和实施实例作进一步说明。
实施例1阳离子纳米乳的处方筛选、抗原负载与细胞摄取
(1)空白纳米乳的处方筛选与理化性质表征
表一:纳米乳的处方组成
首先,通过乳化超声法制备空白纳米乳,并对其进行处方筛选。通过改变pc的类型(pl100m和e-80)、各脂质成分的占比以及水相的含量,筛选出稳定性较高的处方,即处方8(e80:ve:dotap=1.45%:1.45%:0.323%,w/w),用于后续研究(见图1)。该处方下的纳米乳粒径约200nm,电位约60mv(动态光散射法检测);在透射电子显微镜(tem)下呈现典型的乳剂形态(见图2);稳定性高且易于储存,在4度存放两个月粒径与电位无明显变化(见图3);具有较好的生物安全性,在较高给药剂量处理24h下,对多数细胞仍无显著细胞毒性(见图4)。
(2)阳离子纳米乳的抗原负载
鸡卵清蛋白(ova)是探究免疫响应常用的模型抗原,具有生产成本低,免疫原性强等特点。由于种属差异性,ova接种至鼠、猴、人等个体后可引发强烈的免疫响应;且ova的组成结构已经得到完整的解析,相关的免疫检测手段和检测产品丰富。出于以上考虑,本发明首先以ova为模式蛋白抗原,并用上述处方8的阳离子纳米乳对ova进行负载。通过与ova蛋白的水溶液简单涡旋后在37度孵育30min,该阳离子乳剂可通过静电相互作用及亲疏水相互作用实现对ova蛋白的负载,粒径增大,电位降低,用did掺入乳剂的油相来荧光标记载体,或用fitc共价偶联的ova(fitc-ova)来标记抗原对制剂的基本理化性质无显著影响,可用于后续的体外研究(见图5)。10%sds-page偶联快速银染法实验结果表明,随着乳剂(处方8)与抗原的质量比的增加,阳离子乳剂对ova蛋白的包封率逐渐提高,通过图像处理软件imagej对电泳凝胶上的ova蛋白条带进行灰度值分析,半定量ova的包封率发现当乳剂与ova质量比为47.6时,抗原的包封率接近67%(见图6)。
(3)载抗原阳离子纳米乳的细胞摄取
以hek293作为模式细胞考察了不同制剂对细胞摄取蛋白抗原的影响,通过荧光倒置显微镜成像结果发现,游离的ova在18h内很少被摄取,而阳离子乳剂的引入显著提高了抗原的细胞摄取,但不改变抗原摄取量随时间变化趋势(见图7),且共定位图片表明抗原的确被细胞摄取入胞,而非简单的吸附在细胞表面(见图8)。随后考察了载ova的阳离子乳剂在永生化小鼠树突状细胞dc2.4和未成熟的小鼠髓源性树突状细胞bmdcs(取小鼠骨髓细胞,用gm-csf和白介素4(il-4)体外刺激诱导5-6天得到)中的摄取情况,发现ova可以被dcs较好地摄取入胞,且ova的摄取在8-18h左右达到高峰(见图9),说明通过引入阳离子的纳米载体可以提高抗原蛋白/多肽被apcs的摄取和利用,对提高抗原特异性细胞免疫和体液免疫具有同时放大的作用。
实施例2负载模型抗原ova、表面修饰对十二烷基苯磺酰胺的阳离子纳米乳的制备及其内质网靶向性表征
(1)载抗原阳离子纳米乳的内质网靶向表面修饰
内质网靶向性载抗原阳离子纳米乳的组成
蛋黄卵磷脂e809mg
维生素e(ve)9mg
(2,3-二油酰基-丙基)三甲基氯化铵(dotap)1mg~28mg
对十二烷基苯磺酰胺1mg~8mg
ova的水溶液(5mg/ml)0.6ml。
为了更好地实现抗原的装载与内质网靶向积累,对实施实例1中处方8进行处方的进一步调整:将ova的水溶液直接作为水相,并在阳离子纳米乳的油相中加入了具有内质网趋向性的对十二烷基苯磺酰胺。内质网靶向修饰化合物占总脂质质量的1%-30%,阳离子脂质占载体结构脂质总质量的1%-60%。通过乳化超声法制备o/w型阳离子乳剂,其中,对十二烷基苯磺酰胺的长链烷基部分插入乳剂的脂质核心,而苯磺酰胺部分暴露于乳剂表面起到载体的内质网靶向修饰作用;正电性的dotap与负电性的ova蛋白发生静电相互作用,在纳米乳的组装过程中实现抗原的内部包载与外部吸附;而ve和e80作为乳剂的组成脂质,分别起到抗脂质氧化,作为表面活性成分的作用,来稳定纳米乳的胶体结构。
(2)内质网靶向性载抗原阳离子纳米乳在dcs的胞内亚细胞结构定位
将dc2.4细胞接种于细胞爬片,待细胞稳定后给予适量内质网靶向性载抗原阳离子纳米乳,使抗原终浓度为2-5μg/ml,处理8-12h,并制备不含靶向分子的载抗原阳离子纳米乳作为非靶向对照。其中,抗原ova偶联荧光素fitc,乳剂的脂质部分用did标记,用于可视化观测及分析。制剂处理后的细胞用pbs洗涤去除游离制剂,分别用内质网荧光染料er-tracker和hochest33342对细胞内质网和细胞核进行染色处理,随后用pbs洗涤去除游离的核染料,4%的多聚甲醛溶液固定细胞,对细胞爬片进行封片并置于激光共聚焦显微镜下观察。结果见图10(靶向组(target):对十二烷基苯磺酰胺靶向修饰,占载体脂质总质量的8%;非靶向组(non-target):无对十二烷基苯磺酰胺靶向修饰,其余载体组分同靶向组;对照组(control):仅加入游离的ova)。共聚焦图片显示(内质网:红色,脂质体:粉色,ova:绿色,细胞核:蓝色),靶向组内质网荧光信号与脂质体荧光信号的重合性较好,且显示出内质网轮廓,而非靶向组脂质体与内质网的重合度较低且分布杂乱,表明这种靶向修饰的策略的确可以促进载体及其负载的抗原在内质网的靶向积累。
实施例3内质网靶向性载抗原阳离子纳米载体提高细胞免疫与体液免疫的验证
将抗原蛋白直接溶解于乳剂的水相有利于抗原在载体的组装过程中实现内部包载与外部吸附,可进一步提高抗原的载药量、促进抗原的细胞摄取,从而上调dcs介导的细胞免疫和体液免疫的整体响应度。而载体的内质网靶向特性有利于抗原在dcs的内质网选择性积累,可利用内质网相关降解等机制促进外源性抗原的mhci类呈递,从而提高细胞免疫的参与度。
为了验证这种内质网靶向性抗原递送载体在调控细胞和体液免疫中的优势,用实施实例2中的纳米载体(无荧光素标记)处理c57bl/6小鼠来源的bmdcs,8-12h后收集细胞,用pbs洗3遍后重悬于冷pbs,并加入适量荧光素标记的流式抗体,在37度或室温孵育45min-90min后用流式细胞仪分析cd11c+细胞亚群(即dcs细胞)中mhci分子和mhcii分子的表达,或分析cd11c+细胞亚群中25-d1.16阳性细胞的比例(抗体25-d1.16特异性识别结合h-2kbmhci的ova表位:ova257-264,可用于ova特异性mhci类抗原呈递情况)。结果表明靶向组显著上调dcs的mhci类分子和mhcii类分子的表达(见图11),说明这种策略对细胞免疫和体液免疫的整体强度有一定的促进作用;将制剂处理后的bmdcs与同源小鼠(c57bl/6)的淋巴细胞共孵育后流式检测cd4+t细胞和cd8+t细胞的数量和比例发现,相比对照组,靶向处理组这两类细胞都有所增加(见图12),验证了该纳米载药系统对体液和细胞免疫的促进作用;此外,靶向组处理下dcs的抗原特异性mhci类表位呈递也显著提高(见图13),表明了这种mhc分子的上调伴随着抗原呈递的增强,是抗原特异性的免疫响应,而不是由单纯的细胞非特异性活化引起的。
为了进一步验证该纳米载体处理下dcs对抗原特异性cd8+t细胞的活化情况,将制剂处理后的bmdcs与ot-i小鼠(其cd8+t细胞的tcr特异性识别ova的表位ova257-264)的淋巴细胞共孵育(bmdcs:淋巴细胞=1:5),随后流式检测淋巴细胞中cd3+cd8+t淋巴细胞的比例。结果发现(见图14),靶向处理组淋巴细胞中cd8+t淋巴细胞的比例最高,间接证实了该制剂处理诱导了最高的抗原特异性mhci类呈递,且制剂的处理下dcs活化t细胞的功能仍然良好,说明了该内质网靶向载药纳米系统促进细胞免疫的有效性与安全性。
实施例4负载黑色素瘤相关抗原gp100、表面修饰er靶向性pardaxin的阳离子脂质体的制备与应用。
内质网靶向性载抗原阳离子脂质体的组成
(2,3-二油酰基-丙基)三甲基氯化铵(dotap)0.1mg~2.5mg
二油酰磷脂酰乙醇胺(dope)1.5mg
n-二硬脂酰基磷脂酰乙醇-peg(dspe-peg2000)0.1mg
dspe-peg2000-pardaxin0.1mg~0.7mg
gp100的水溶液(1mg/ml)2ml。
黑色素瘤是一种源自黑色素细胞的高度恶性肿瘤,缺乏特效治疗且预后差,近年来的发生率和死亡率逐年升高。gp100是胚胎早期出现的分化抗原,在黑色素瘤的发生发展过程中通常过度表达,因此属于黑色素肿瘤相关抗原。由于gp100为自身分化抗原,免疫原性较弱,在作为疫苗成分单一给药时往往难以诱导有效的抗肿瘤效果。研究表明,提高cd8+t细胞对黑色素瘤的抗原特异性免疫应答可抑制肿瘤的发展、转移和复发[cancerres.,2010,70(21)],因此提高黑色素瘤患者体内肿瘤相关抗原特异性的免疫响应,尤其是细胞免疫,对治疗或预防黑色素瘤具有很高的意义。
本发明通过旋转蒸发-探头超声法制备内质网靶向性载抗原阳离子脂质体。将处方涉及的脂质充分溶解并分散于氯仿溶液中,在45℃的水浴中用减压旋转蒸发去除脂质溶液的有机溶剂,得到均匀完整的脂质薄膜。用ova的水溶液室温充分水化脂质薄膜,随后置于冰浴探头超声,以此得到粒径均一、性质稳定的内质网靶向修饰的载抗原脂质体,部分抗原在超声过程中包裹进入脂质体的内部,部分通过静电相互作用吸附在脂质体的表面。其中内质网靶向修饰化合物占总脂质质量的1%-30%,阳离子脂质占载体结构脂质总质量的1%-60%。本发明涉及的负载gp100的er靶向性阳离子脂质体具有上调机体抗原特异性细胞与体液免疫,特别是细胞免疫的能力,可用于增强黑色素瘤的防治效果。
实施例5负载黑色素瘤相关抗原(酪氨酸酶相关蛋白2,trp-2)、表面修饰er靶向性十二烷基-4-甲基苯磺酰胺的阳离子纳米乳的制备与应用。
内质网靶向性载抗原阳离子纳米乳的组成
二棕榈酰磷脂酰胆碱(dppc)9mg
大豆油9mg
二甲基双十八烷基铵(dda)1mg~28mg
十二烷基-4-甲基苯磺酰胺1mg~8mg
trp-2的水溶液(1mg/ml)0.5ml。
酪氨酸酶相关蛋白酶(跨膜的信号蛋白),参与黑色素生物合成,trp-2是常见的黑色素瘤相关抗原,且小鼠和人类的黑色素瘤反应性ctls均可识别trp-2肽(trp2蛋白的180-188位氨基酸,svydffvwl)从而发挥抗肿瘤作用。本发明通过高压均质法制备内质网靶向性载抗原阳离子纳米乳。称取处方量dppc、大豆油、dda和十二烷基-4-甲基苯磺酰胺,并按一定浓度溶解于适量乙醇作为油相,用注射器将此乙醇溶液在涡旋条件下逐滴注入含有trp-2的水相中,利用剪切力形成初乳,随后用均质机均质获得粒径均一、质量可控的内质网靶向性载trp-2的阳离子纳米乳。其中,内质网靶向修饰化合物占总脂质质量的1%-30%,阳离子脂质占载体结构脂质总质量的1%-60%。
实施例6负载sars-cov-2刺突蛋白(s蛋白)、表面修饰er靶向性十二烷基-4-甲基苯磺酰胺的阳离子脂质纳米粒的制备与应用。
内质网靶向性载抗原阳离子脂质纳米粒的组成
4-(n,n-二甲基氨基)丁酸(二亚油基)甲酯(dlin-mc3-dma)0.1mg~2.5mg
二油酰磷脂酰乙醇胺(dope)1.5mg
n-二硬脂酰基磷脂酰乙醇-peg(dspe-peg2000)0.1mg
十二烷基-4-甲基苯磺酰胺0.08mg~0.7mg
s蛋白的水溶液(0.2mg/ml)2ml。
机体抗病毒免疫包括固有免疫和适应性免疫。作为抗病毒感染的第一道防线,固有免疫主要由干扰素、巨噬细胞和nk细胞介导,其作用迅速但无特异性。而适应性免疫是清除病毒感染、预防再感染的更坚固的防线,作用高效、特异性强、且具有记忆性。因此,抗病毒疫苗免疫的首要目的是调动机体的细胞和体液免疫响应。然而,当前人们的研究重点主要在探究抗病毒体液免疫的作用机制及效果上,相关疫苗的设计和应用也主要围绕抗体依赖性的体液免疫,对细胞免疫的考察及调动不足,阻碍了疫苗的充分发展。t细胞免疫在抗人类免疫缺陷病毒(hiv)、丙型肝炎病毒(hcv)或疱疹病毒疫苗中发挥着重要作用[immunology,2012,135:19-26]。2019年末爆发的新型冠状病毒(sars-cov-2)对全球人类健康造成了严重的威胁,研究证实上调机体对新冠病毒s蛋白的特异性细胞免疫和体液免疫可以抑制病毒的感染[immunity,2020,53:724-732],其中ctl介导的细胞免疫或许在诱导高效且持久的抗病毒保护中扮演着重要角色[immunity,2020,53(6):1281-1295]。
本发明通过微流控芯片技术制备内质网靶向性阳离子脂质纳米粒,在该手段下实现抗原的载体内部包封。即:利用三阶流动聚焦型微流控芯片实现s蛋白阳离子脂质体的一步合成:在第一阶将s蛋白水溶液作为分散相,dlin-mc3-dma乙醇溶液作为连续相混合,利用s蛋白和dlin-mc3-dma的正负电荷相互作用形成反胶束,并作为分散相进入第二阶,引入去离子水作为连续相进行第二阶的流动聚焦,形成的液流作为第三阶的连续相,再引入dlin-mc3-dma、dope、dspe-peg2000以及十二烷基-4-甲基苯磺酰胺乙醇溶液作为分散相,经过充分混合后获得包载s蛋白的阳离子脂质纳米粒。其中,内质网靶向修饰化合物占总脂质质量的1%-30%,阳离子脂质占载体结构脂质总质量的1%-60%。该纳米载体可通过自身的靶向优势提高抗原的呈递效率与呈递方式,从而在抗新冠病毒感染中发挥作用。
实施例7负载恶性疟原虫衍生的环子孢子蛋白(csp)、表面修饰er靶向性十二烷基-4-甲基苯磺酰胺的阳离子纳米乳的制备与应用。
内质网靶向性载抗原纳米乳的组成
蛋黄卵磷脂e809mg
维生素e(ve)7mg
中链脂肪酸酯(mct)2mg
3β-[n-(n’,n’-二甲基胺乙基)胺基甲酰基]胆固醇(dc-chol)1mg~28mg
对十二烷基苯磺酰胺1mg~8mg
csp的水溶液(1mg/ml)0.5ml。
对复杂感染(疟疾、hiv、肺结核、丙型肝炎等)有效的疫苗必须诱导大量的抗体库来清除血源性病原体(体液免疫),同时启动cd8+t细胞响应来清除感染细胞(细胞免疫)。临床阶段的亚单位疫苗可诱导的中和抗体产生,但诱导cd8+t细胞响应的能力很弱,甚至几乎没有[vaccine,2015,33:40-43],这种细胞免疫响应的缺乏源于dcs向cd8+t细胞进行mhci类呈递的不足[nat.mater.,2011,10:243-251]。研究表明,促进恶性疟原虫衍生的环子孢子蛋白(csp)在dcs上的mhci类呈递可抑制疟原虫在人肝细胞中的侵袭与增殖,发挥较好的免疫保护作用[nat.mater.,2019,18:175-185]。
本发明通过乳化超声法制备内质网靶向性载抗原阳离子纳米乳。将处方中的脂质成分溶于少量乙醇作为油相,将csp的水溶液作为水相,通过在高速涡旋状态下向油相逐滴加入水相获得初乳,随后将初乳进行超声再分散,去除有机溶剂并获得粒径均一、质量可控的内质网靶向性载csp的阳离子纳米乳。其中,内质网靶向修饰化合物占总脂质质量的1%-30%,阳离子脂质占载体结构脂质总质量的1%-60%。该纳米载药系统可以提高机体的适应性免疫响应,特别是病原体特异性的细胞免疫,可作为疫苗用于抗恶性疟疾感染。
实施例8负载威尔姆斯肿瘤蛋白(wt1)、表面修饰er靶向性对十二烷基苯磺酰胺的阳离子纳米乳的制备与应用。
内质网靶向性载抗原纳米乳的组成
大豆卵磷脂s1009mg
角鲨烯9mg
1,2-二甲基-3-三甲基铵-丙烷(dmtap)1mg~28mg
对十二烷基苯磺酰胺1mg~8mg
wt1的水溶液(1mg/ml)0.5ml。
威尔姆斯肿瘤蛋白(wt1)是与细胞发育和存活相关的转录因子(存在核定位序列)。出生后wt1的组织分布仅限于泌尿生殖系统、中枢神经系统、血液系统,但并不会引起wt1特异性ctls攻击。部分肿瘤中会过表达wt1,这被认为与肿瘤形成有关。过表达wt1的肿瘤包括:白血病细胞、肾癌、卵巢癌、乳腺癌等。因此wt1属于广谱的肿瘤相关抗原,制备载wt1的内质网靶向纳米载体在这些肿瘤的防治过程中或许能发挥重要作用。
通过乳化超声法制备内质网靶向性载抗原阳离子纳米乳。将处方中的脂质成分溶于少量乙醇作为油相,将wt1的水溶液作为水相,通过在高速涡旋状态下向油相逐滴加入水相获得初乳,随后将初乳进行超声再分散,获得载wt1的er靶向阳离子纳米乳。其中,内质网靶向修饰化合物占总脂质质量的1%-30%,阳离子脂质占载体结构脂质总质量的1%-60%。
实施例9负载前列腺癌抗原(psa)、表面修饰er靶向性pardaxin多肽的阳离子纳米乳的制备与应用。
内质网靶向性载抗原纳米乳的组成
氢化大豆卵磷脂(hspc)9mg
胆固醇9mg
1,2-硬脂酰-3-三甲基铵-丙烷(dstap)1mg~28mg
dspe-peg2000-pardaxin1mg~8mg
psa的水溶液(1mg/ml)0.5ml。
前列腺癌是指发生在前列腺的上皮性恶性肿瘤,在男性中发病率高,对泌尿生殖系统具有很大伤害。前列腺特异抗原(丝氨酸蛋白酶psa)/前列腺干细胞抗原(psca),仅在人前列腺腺泡及导管上皮细胞胞浆中表达,在前列腺癌中高表达。psa特异性cd8+t℃细胞的数量与表达psa的细胞相关,研究表明前列腺癌的瘤内cd8+t细胞的浸润影响前列腺切除术的疗效和预后[prostate,2021,81(1):20-28]。
通过高压均质法制备内质网靶向性载psa的阳离子纳米乳。称取处方量hspc、胆固醇、dstap和dspe-peg2000-pardaxin,并按一定浓度溶解于适量乙醇作为油相,用注射器将此乙醇溶液在涡旋条件下逐滴注入含有psa的水相中,利用剪切力形成初乳,随后用均质机均质获得粒径均一、质量可控的内质网靶向性载psa的阳离子纳米乳。其中,内质网靶向修饰化合物占总脂质质量的1%-30%,阳离子脂质占载体结构脂质总质量的1%-60%。
- 还没有人留言评论。精彩留言会获得点赞!