软组织修复材料及其制备方法与流程
1.本发明涉及医用材料领域,特别是涉及一种软组织修复材料及其制备方法。
背景技术:
2.近年来,由先天性畸形、慢性疾病、感染、肿瘤切除或外伤引起的软组织损伤每年都在增加,导致医疗费用和患者发病率也随之增加。对于软组织损伤,理想的手术治疗是先完全切除缺损组织,然后通过全器官移植或自体移植来替代缺损组织并重建缺损组织的结构和功能。然而,缺乏可用性移植软组织,组织匹配相对复杂,并且供体部位存在发病率高的风险,使得全器官移植或自体移植治疗软组织缺损实施起来相对困难。脱细胞基质因其保存完好的原始组织的三维超微结构、生物相容性、机械完整性、组成以及最终的生物活性而在许多临床应用中取得了良好的临床治疗效果。许多基于脱细胞基质的移植物,包括同种异体移植物和异种移植物,已经发展成为器官移植的替代方法。
3.但是传统的脱细胞基质应用于缺损软组织修复还存在以下问题:目前软组织修复材料多为胶原海绵,由于胶原海绵抗压性差,并且降解速度快,因此不能为受损软组织愈合提供足够的时间与空间支持,愈后新生软组织形态达不到临床预期。为了改善胶原海绵支架的降解和力学强度,常用的方法为化学交联。化学交联剂的引入虽然可以改善胶原海绵的抗压性能,同时延长其降解时间,但是残留交联剂往往会引起周围组织炎症反应,并且随着材料降解,也会释放出交联剂持续刺激周围组织,不利于组织愈合。
技术实现要素:
4.基于此,有必要提供一种软组织修复材料及其制备方法,其能够为新生软组织的生长提供的足够三维空间与时间支持,又有利于早期血管化与组织长入,促进伤口愈合。
5.一种软组织修复材料,包括依次层叠的第一脱细胞基质层、多孔海绵层和第二脱细胞基质层;
6.所述第一脱细胞基质层具有致密结构,孔径<25μm;
7.所述多孔海绵层的材料包括脱细胞基质;
8.所述第二脱细胞基质层具有贯穿孔。
9.在其中一个实施例中,所述贯穿孔的直径为0.3mm~2mm,间距为1mm~10mm。
10.在其中一个实施例中,所述贯穿孔的直径为0.5mm~1mm,间距为2mm~5mm。
11.在其中一个实施例中,所述多孔海绵层的材料还包括多糖、活性蛋白、生长因子及抗菌物质中的任一种或几种。
12.在其中一个实施例中,所述多糖选自羧甲基纤维素、透明质酸钠、硫酸软骨素及壳聚糖中的任一种或几种;
13.所述活性蛋白包括弹性蛋白;
14.所述生长因子选自血小板衍生生长因子、转移生长因子、成纤维细胞生长因子、血管内皮生长因子及表皮细胞生长因子中的任一种或几种;
15.所述抗菌类物质选自phmb、纳米银、抗菌肽及抗生素中的一种。
16.在其中一个实施例中,所述多孔海绵层的孔隙率≥80%。
17.在其中一个实施例中,所述多孔海绵层的孔径为50μm~300μm。
18.在其中一个实施例中,所述软组织修复材料的厚度为3mm~6mm。
19.一种软组织修复材料的制备方法,包括如下步骤:
20.由动物组织制备第一脱细胞基质层,所述第一脱细胞基质层具有致密结构,孔径<25μm;
21.将所述第一脱细胞基质层进行打孔,制备具有贯穿孔的第二脱细胞基质层;
22.获得含有脱细胞基质的溶液,在所述含有脱细胞基质的溶液中,脱细胞基质的质量百分浓度为0.3%~2%;及
23.将所述第一脱细胞基质层置于模具中,然后在所述第一脱细胞基质层表面布满所述含有脱细胞基质的溶液,再覆盖所述第二脱细胞基质层,进行复合,制备软组织修复材料。
24.在其中一个实施例中,所述获得含有脱细胞基质的溶液的步骤包括:将脱细胞基质粉末用浓度为0.01mol/l~0.1mol/l的酸性溶液溶胀,然后匀浆,制备所述含有脱细胞基质的溶液,在所述含有脱细胞基质的溶液中,脱细胞基质的质量百分浓度为0.3%~2%;或者,
25.用浓度为0.01mol/l~0.1mol/l的酸性溶液对所述第一脱细胞基质层进行溶胀,然后粉碎匀浆,制备所述含有脱细胞基质的溶液,在所述含有脱细胞基质的溶液中,脱细胞基质的质量百分浓度为0.3%~2%。
26.在其中一个实施例中,在所述含有脱细胞基质的溶液中,还含有多糖、活性蛋白、生长因子及抗菌物质中的任一种或几种。
27.在其中一个实施例中,所述复合的步骤包括:
28.先在2℃~8℃下静置1h~4h,再在-15℃~-30℃下冷冻4h~24h;
29.然后置于2℃~8℃下待完全解冻后,再在-15℃~-30℃下再次冷冻4h~24h;
30.之后再在-40℃以下冷冻2h~24h,最后再进行冷冻干燥。
31.在其中一个实施例中,所述由动物组织制备第一脱细胞基质层的步骤包括:将所述动物组织依次进行病毒灭活处理、脱细胞处理及脱水脱脂处理。
32.在其中一个实施例中,所述贯穿孔的直径为0.3mm~2mm,间距为1mm~10mm。
33.在其中一个实施例中,所述模具的深度为3mm~6mm。
34.上述软组织修复材料包括依次层叠的第一脱细胞基质层、多孔海绵层和第二脱细胞基质层,第一脱细胞基质层表面致密,具有良好的屏障作用,起到支撑多孔海绵层的作用;多孔海绵层能够降解,起到促进缺损组织愈合的作用;第二脱细胞基质层具有贯穿孔,一方面可以允许降解的多孔海绵层通过贯通孔抵达缺损部位,另一方面贯穿孔结构有利于受损组织周围的组织与细胞长入软组织修复材料中,有利于早期血管化,此外,第二脱细胞基质层可以保护多孔海绵层,延缓多孔海绵层的降解,从而使得软组织修复材料能够为受损软组织的愈合提供充分的时间和空间支撑。
附图说明
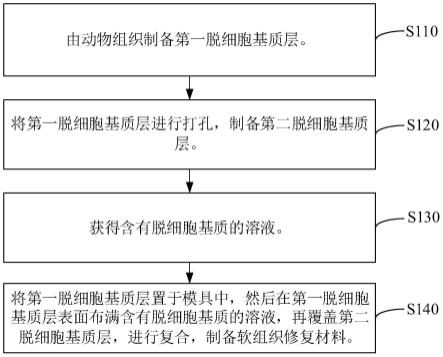
35.图1为一实施方式的软组织修复材料的制备方法的工艺流程图;
36.图2为一些实施例中模具的一种结构示意图;
37.图3为实施例1所制备的软组织修复材料的微观结构图;
38.图4为实施例2、实施例3所制备的软组织修复材料及市售的双层软组织修复膜产品在相同的体外降解条件的降解结果图;
39.图5为将成纤维细胞接种于实施例1与实施例2所制备的软组织修复材料的第二脱细胞基质层表面,体外共培养后的结果图。
具体实施方式
40.为了便于理解本发明,下面将结合具体实施方式对本发明进行更全面的描述。具体实施方式中给出了本发明的较佳的实施例。但是,本发明可以以许多不同的形式来实现,并不限于本文所描述的实施例。相反地,提供这些实施例的目的是使对本发明的公开内容的理解更加透彻全面。
41.除非另有定义,本文所使用的所有的技术和科学术语与属于本发明的技术领域的技术人员通常理解的含义相同。本文中在本发明的说明书中所使用的术语只是为了描述具体地实施例的目的,不是旨在于限制本发明。
42.在本文中,“第一”、“第二”、等仅用于描述目的,而不能理解为指示或暗示相对重要性或者隐含指明所指示的技术特征的数量。由此,限定有“第一”、“第二”、等的特征可以明示或者隐含地包括至少一个该特征。
43.在本文中,“一种(个)或几种(个)”指所列项目的任一种(个)、任两种(个)或任两种(个)以上。其中,“几种(个)”指任两种(个)或任两种(个)以上。
44.当本文中公开一个数值范围时,上述范围视为连续,且包括该范围的最小值及最大值,以及这种最小值与最大值之间的每一个值。进一步地,当范围是指整数时,包括该范围的最小值与最大值之间的每一个整数。此外,当提供多个范围描述特征或特性时,可以合并该范围。换言之,除非另有指明,否则本文中所公开之所有范围应理解为包括其中所归入的任何及所有的子范围。
45.在本文中,术语“包括”和“具有”以及它们任何变形,意图在于覆盖不排他的包含。例如包含了一系列步骤或单元的过程、方法、系统、产品或设备没有限定于已列出的步骤或单元,而是可选地还包括没有列出的步骤或单元,或可选地还包括对于这些过程、方法、产品或设备固有的其它步骤或组件。
46.在本文中提及“实施例”意味着,结合实施例描述的特定特征、结构或特性可以包含在本技术的至少一个实施例中。在说明书中的各个位置出现该短语并不一定均是指相同的实施例,也不是与其它实施例互斥的独立的或备选的实施例。本领域技术人员显式地和隐式地理解的是,本文所描述的实施例可以与其它实施例相结合。
47.一实施方式的软组织修复材料,包括:依次层叠的第一脱细胞基质层、多孔海绵层和第二脱细胞基质层;
48.第一脱细胞基质层为致密结构,孔径<25μm;
49.多孔海绵层的材料包括脱细胞基质;
50.第二脱细胞基质层具有贯穿孔。
51.在一些实施例中,第一脱细胞基质层由动物组织依次进行病毒灭活处理、脱细胞处理及脱水脱脂处理后得到。进一步地,第一脱细胞基质层的厚度为0.5mm~1mm。
52.在一些实施例中,多孔海绵层的孔隙率≥80%。例如,多孔海绵层的孔隙率为80%、82%、85%、88%、89%、89.5%、90%等。可选地,多孔海绵层的孔隙率≥85%。多孔海绵层的孔隙率≥80%时,有利于血管化。
53.在一些实施例中,多孔海绵层的孔径为50μm~300μm。例如,多孔海绵层的孔径为50μm、80μm、100μm、120μm、150μm、180μm、200μm、220μm、250μm、280μm、300μm或这些取值中任意两者所组成的范围。可选地,多孔海绵层的孔径为100μm~200μm。通过调整多孔海绵层的孔隙率和孔径,有利于调控多孔海绵层的降解。
54.在一些实施例中,多孔海绵层的材料还含有多糖、活性蛋白、生长因子及抗菌物质中的任一种或几种。上述物质利于细胞粘附与生长,能够加速受损软组织的愈合。且与第二脱细胞基质层配合,使得上述物质能够经第二脱细胞基质层的贯穿孔抵达缺损部位,实现缓释。
55.在其中一些实施例中,多糖选自羧甲基纤维素、透明质酸钠、硫酸软骨素及壳聚糖中的任一种或几种。
56.在其中一些实施例中,活性蛋白包括弹性蛋白。
57.在其中一些实施例中,生长因子选自血小板衍生生长因子、转移生长因子、成纤维细胞生长因子、血管内皮生长因子及表皮细胞生长因子中的任一种或几种。
58.在其中一些实施例中,抗菌类物质选自phmb、纳米银、抗菌肽及抗生素中的一种。
59.本实施方式的多孔海绵层的材料包括脱细胞基质,一方面可以基本保持原有组织的三维结构,另一方面,多孔海绵层的力学强度要高于纯化的胶原海绵,降解性能也会略优于纯化的胶原海绵。
60.在一些实施例中,贯穿孔的直径为0.3mm~2mm,间距为1mm~10mm。在一些实施例中,贯穿孔的直径为0.3mm、0.5mm、0.6mm、0.7mm、0.8mm、0.9mm、1mm、1.5mm、2mm或这些取值中任意两者所组成的范围。进一步地,在一些实施例中,贯穿孔的直径为0.5mm~1mm。
61.在一些实施例中,贯穿孔的间距为1mm、2mm、2.5mm、3mm、3.5mm、4mm、4.5mm、5mm、6mm、7mm、8mm、9mm、10mm或这些取值中任意两者所组成的范围。进一步地,贯穿孔的间距为2mm~5mm。
62.通过调整贯穿孔的直径和间距,有利于调控多孔海绵层的降解速率以及细胞长入速率。贯穿孔的直径过大,多孔海绵层的降解速率较快,细胞长入速率快,同时多孔海绵层的物质释放速率快。在上述贯穿孔的直径和间距范围下,多孔海绵层具有适宜的降解速率、释放速率和细胞长入速率。
63.在一些实施例中,第二脱细胞基质层的厚度与第一脱细胞基质层的厚度相同。进一步地,第二脱细胞基质层的厚度为0.5mm~1mm。
64.进一步地,软组织修复材料的厚度为3mm~6mm。例如,软组织修复材料的厚度为3mm、3.5mm、4mm、4.5mm、5mm、5.5mm、6mm或这些取值中任意两者所组成的范围。具体的软组织修复材料的厚度可以根据待修复的缺损部分进行调整。在实际过程中,通过调整多孔海绵层的厚度调整软组织修复材料的厚度以满足不同的实际需求。
65.上述软组织修复材料至少具有以下优点:
66.(1)上述软组织修复材料包括依次层叠的第一脱细胞基质层、多孔海绵层和第二脱细胞基质层,第一脱细胞基质层表面致密,具有良好的屏障作用,起到支撑多孔海绵层的作用;多孔海绵层能够降解,起到促进缺损组织愈合的作用;第二脱细胞基质层具有贯穿孔,一方面可以允许降解的多孔海绵层通过贯通孔抵达缺损部位,另一方面贯穿孔结构有利于受损组织周围的组织与细胞长入软组织修复材料中,有利于早期血管化,此外,第二脱细胞基质层可以保护多孔海绵层,延缓多孔海绵层的降解,从而使得软组织修复材料能够为受损软组织的愈合提供充分的时间和空间支撑。
67.(2)上述软组织修复材料第二脱细胞基质层贯穿孔的设置,还能够调控多孔海绵层以及多孔海绵层中多糖、生长因子等物质的释放,实现缓释作用。
68.本发明还提供一实施方式的软骨组织修复材料的制备方法,请参阅图1,包括如下步骤s110~s140:
69.步骤s110:由动物组织制备第一脱细胞基质层。
70.在一些实施例中,步骤s110包括:将动物组织依次进行病毒灭活处理、脱细胞处理、脱水脱脂处理。
71.其中,动物组织包括猪源或牛源动物组织。进一步地,动物组织包括真皮、心包膜、腹膜或小肠黏膜下层。
72.病毒灭活处理包括:向动物组织中加入质量百分浓度为0.5%~4%的碱溶液进行病毒灭活处理0.5h~12h。其中,碱溶液包括氢氧化钠溶液及氢氧化钾溶液中的任一种或几种,加入的碱溶液的体积(ml)与动物组织的单侧表面积(cm2)的比为(0.2ml~0.5ml):1cm2。进一步地,病毒灭活处理的时间优选为0.5h~4h。
73.脱细胞处理包括:将病毒灭活处理后的动物组织依次用质量百分浓度为0.25%~2.5%的碱溶液处理4h~24h、质量百分浓度为0.1%~1%的盐酸处理1h~12h、质量百分浓度为5%~10%的高渗盐溶液处理2h~6h。其中,碱溶液、盐酸、高渗盐溶液所加入的体积与动物组织的单侧表面积(cm2)的比均为(0.2ml~0.5ml):1cm2。
74.进一步地,脱细胞处理后用质量百分浓度为0.1%~2%的弱碱盐溶液进行清洗1h~24h,随后用纯水或注射水进行清洗至脱细胞组织表面ph为5~7为止。其中,弱碱盐溶液包括碳酸钠水溶液及碳酸氢钠水溶液中的任一种或几种。
75.脱水除脂处理包括:将上述清洗好的脱细胞后的动物组织依次浸泡在质量百分浓度为25%、50%、75%、90%和100%的有机物溶液中进行脱水,每次浸泡的时间为10min~60min。然后将脱水完成后的动物组织浸泡于有机除脂溶液中,浸泡12h~72h,间隔6h~24h更换一次有机除脂溶液。
76.其中,有机物溶液的溶质为乙醇、异丙醇及丙酮中的一种。在有机物溶液中每次浸泡的时间优选为20min。
77.有机除脂溶液选自乙醚、石油醚、正己烷、正庚烷、苯及四氯甲烷中的一种。在有机除脂溶液中浸泡的时间优选为24h~48h。
78.进一步地,在脱水除脂处理后,还包括干燥处理的步骤。具体地,将脱水除脂完成后的动物组织在通风设备中,自然晾干,使有机溶剂完成挥发,得到第一脱细胞基质层。
79.在一些实施例中,通过上述步骤所制备的第一脱细胞基质层具有致密结构,孔径
<25μm。
80.步骤s120:将第一脱细胞基质层进行打孔,制备第二脱细胞基质层。
81.在其中一些实施例中,通过激光打孔或机械冲孔的方式获得贯穿孔结构。
82.在其中一些实施例中,贯穿孔的直径为0.3mm~2mm。例如,贯穿孔的直径为0.3mm、0.5mm、0.6mm、0.7mm、0.8mm、0.9mm、1mm、1.5mm、2mm或这些取值中任意两者所组成的范围。进一步地,在一些实施例中,贯穿孔的直径为0.5mm~1mm。
83.在其中一些实施例中,贯穿孔的间距为1mm~10mm。例如,贯穿孔的间距为1mm、2mm、2.5mm、3mm、3.5mm、4mm、4.5mm、5mm、6mm、7mm、8mm、9mm、10mm或这些取值中任意两者所组成的范围。进一步地,贯穿孔的间距为2mm~5mm。
84.步骤s130:获得含有脱细胞基质的溶液。
85.在一些实施例中,步骤s130包括:将脱细胞基质粉末用酸性溶液溶胀匀浆,制备含有脱细胞基质的溶液。
86.其中,获得脱细胞基质粉末的步骤包括:将第一脱细胞基质层进行机械粉碎或冷冻研磨,获得脱细胞基质粉末,或者,按照专利cn201811633677.3公开的方法制备脂肪脱细胞基质粉末。
87.在其中一个实施例中,脱细胞基质粉末的粒径为0.1mm~1.0mm。
88.在其中一个实施例中,酸性溶液为醋酸溶液。进一步地,酸性溶液的浓度为0.01~0.1mol/l。例如,酸性溶液的浓度为0.01mol/l、0.02mol/l、0.03mol/l、0.04mol/l、0.05mol/l、0.06mol/l、0.07mol/l、0.08mol/l、0.09mol/l、0.1mol/l。进一步地,酸性溶液的浓度为0.01mol/l~0.05mol/l。
89.在其中一些实施例中,脱细胞基质的质量百分浓度为0.3%~2%。例如,脱细胞基质的质量百分浓度为0.3%、0.5%、0.7%、0.8%、0.9%、1%、1.1%、1.2%、1.3%、1.4%、1.5%、1.8%、2%或这些取值中任意两者所组成的范围。进一步地,脱细胞基质的质量百分浓度为0.7%~1.5%。
90.具体地,步骤s130包括:将脱细胞基质粉末用浓度为0.01mol/l~0.1mol/l的酸性溶液溶胀,然后匀浆,制备含有脱细胞基质的溶液,在含有脱细胞基质的溶液中,脱细胞基质的质量百分浓度为0.3%~2%。进一步地,酸性溶液的浓度为0.01mol/l~0.05mol/l,脱细胞基质的质量百分浓度为0.7%~1.5%,酸性溶液为醋酸溶液。
91.在另一些实施例中,步骤s130包括:用酸性溶液对第一脱细胞基质层进行溶胀,然后进行粉碎匀浆,制备含有脱细胞基质的溶液。
92.其中,酸性溶液及脱细胞基质的浓度与前述相同,不再赘述。
93.在其中一些实施例中,采用机械匀浆的方式进行粉碎匀浆。
94.具体地,步骤s130包括:用浓度为0.01mol/l~0.1mol/l的酸性溶液对第一脱细胞基质层进行溶胀,然后粉碎匀浆,制备含有脱细胞基质的溶液,在含有脱细胞基质的溶液中,脱细胞基质的质量百分浓度为0.3%~2%。进一步地,酸性溶液的浓度为0.01mol/l~0.05mol/l,脱细胞基质的质量百分浓度为0.7%~1.5%,酸性溶液为醋酸溶液。
95.在一些实施例中,在含有脱细胞基质的溶液中还含有多糖、活性蛋白、生长因子及抗菌物质中的任一种或几种。
96.在其中一些实施例中,多糖选自羧甲基纤维素、透明质酸钠、硫酸软骨素及壳聚糖
中的任一种或几种。
97.在其中一些实施例中,活性蛋白包括弹性蛋白。
98.在其中一些实施例中,生长因子选自血小板衍生生长因子pdgf、转移生长因子tgf-β、成纤维细胞生长因子fgf、血管内皮生长因子vegf、表皮细胞生长因子egf中的任一种或几种。上述生长因子能够促进组织愈合功能。
99.抗菌类物质选自phmb、纳米银、抗菌肽及抗生素中的一种。
100.步骤s140:将第一脱细胞基质层置于模具中,然后在第一脱细胞基质层表面布满含有脱细胞基质的溶液,再覆盖第二脱细胞基质层,进行复合,制备软组织修复材料。
101.在一些实施例中,复合的步骤包括:
102.先在2℃~8℃下静置1h~4h,再在-15℃~-30℃下冷冻4h~24h;
103.然后置于2~8℃下待完全解冻后,再在-15℃~-30℃下再次冷冻4h~24h;
104.之后再在-40℃以下冷冻2h~24h,最后再进行冷冻干燥。
105.通过上述反复冻融的过程,有利于提高多孔海绵层与第一脱细胞基质层和第二脱细胞基质层的结合力。可以理解,冷冻干燥在冷冻机中进行,可以为本领域常用的冷冻干燥的方式。
106.在一些实施例中,在将第一脱细胞基质层置于模具上的步骤之前,还包括:将第一脱细胞基质层用水浸泡,然后取出并挤干水分。通过该步骤有利于减少材料表面水层隔离作用,利于多孔海绵层与第一脱细胞基质层间的结合。
107.进一步地,将第一脱细胞基质层的粗糙面朝上置于模具中。
108.在一些实施例中,在覆盖第二脱细胞基质层的步骤之前,还包括将第二脱细胞基质层用水浸泡,然后取出并挤干水分。通过该步骤有利于减少材料表面水层隔离作用,利于多孔海绵层与第二脱细胞基质层间的结合。
109.在一些实施例中,模具的结构如图2所示。模具包括凹模和下模。第一脱细胞基质层置于凹模中,然后在第一脱细胞基质层表面布满含有脱细胞基质的溶液,再覆盖第二脱细胞基质层,然后盖上上模,固定螺母,进行复合。
110.进一步地,模具的深度为3mm~6mm。通过模具的深度控制软组织修复材料的厚度。
111.在一些实施例中,步骤s140包括:将第一脱细胞基质层和第二脱细胞基质层用水浸泡,然后取出并挤干水分,将第一脱细胞基质层的粗糙面朝上置于模具中,再将含有脱细胞基质的溶液倒入,使表面平整,再覆盖第二脱细胞基质层,固定模具,进行复合。
112.进一步地,在步骤s140之后,还包括:将软组织修复材料进行裁切及包装后,用环氧乙烷或辐照灭菌。
113.应该理解的是,虽然图1所示流程图中的各个步骤按照箭头的指示依次显示,但是这些步骤并不是必然按照箭头指示的顺序依次进行,除非本文中有明确的说明,这些步骤的执行并没有严格的顺序限制,其可以以其他的顺序执行,而且图1中的至少一部分步骤可以包括多个子步骤或者多个阶段,这些子步骤或者阶段并不必然是在同一时刻执行完成,而是可以在不同的时刻执行,其执行顺序也不必然是依次进行,而是可以与其他步骤或者其他子步骤或者阶段的至少一部分轮流或者交替地执行。
114.上述软组织修复材料的制备方法工艺简单,通过将第一脱细胞基质层、多孔海绵层和第二脱细胞基质层复合,第一脱细胞基质层表面致密,具有良好的屏障作用,起到支撑
多孔海绵层的作用;多孔海绵层能够负载抗生素、生长因子中的一种或几种,持续释放负载的抗菌消炎类物质与生长因子,起到促进缺损组织愈合或抗菌防感染的作用;第二脱细胞基质层具有贯穿孔,一方面可以允许多孔海绵层缓释的功能药物或生长因子能够通过贯通孔抵达缺损部位,另一方面贯穿孔结构有利于受损组织周围的组织与细胞长入软组织修复材料中,有利于早期血管化;此外第二脱细胞基质层可以保护多孔海绵层,延缓多孔海绵层的降解,从而使得软组织修复材料能够为受损软组织的愈合充分的时间和空间支撑。
115.为了使本发明的目的以及优点更加清楚,以下结合具体实施例对本发明的软组织修复材料及其效果做进一步详细的说明,应当理解,此处所描述的具体实施例仅用以解释本发明,并不得用以限定本发明。以下实施例如无特殊说明,则不包括除不可避免的杂质外的其他组分。实施例中采用药物和仪器如非特别说明,均为本领域常规选择。实施例中未注明具体条件的实验方法,按照常规条件,例如文献、书本中所述的条件或者生产厂家推荐的方法实现。
116.实施例1
117.本实施例提供一种软组织修复材料,其制备过程具体如下:
118.(1)制备第一脱细胞基质层
119.取猪源组织猪心包膜经初步清洗、预处理后去除不需要的杂质、并分割成10cm
×
10cm大小后放入适当的容器中,加入质量百分浓度为2%的氢氧化钠溶液,加入的氢氧化钠溶液的体积(ml)与动物组织单侧表面积(cm2)比为0.5ml:1cm2,进行病毒灭活处理2h。在病毒灭活处理完成后,倒出氢氧化钠溶液,按相同比例加入质量百分浓度为0.5%的氢氧化钠溶液继续浸泡处理12h,之后滤出处理氢氧化钠液,将处理后的心包膜用大量水清洗3-5遍后,随后按相同比例加入质量比百分浓度为0.1%的盐酸中浸泡处理12h,处理完成后再次用大量纯水清洗3-5遍,最后按相同比加入质量百分浓度为5%高渗盐溶液处理6h。将脱细胞处理完成后的猪心包膜用质量百分浓度为2%的碳酸氢钠溶液进行清洗2h,随后用纯水进行清洗至脱细胞组织表面ph为5-7为止。将前述清洗好的猪心胞膜依次浸泡在质量百分浓度为25%、50%、75%、90%和100%的丙酮溶液中,每次浸泡的时间为10min。完成后将猪心胞膜浸泡于乙醚中,浸泡72h,间隔24h换一次乙醚以进行除脂。除脂完成后滤出乙醚,将猪心包膜平铺,自然晾干无明显乙醚气味后,即获得第一脱细胞基质层。
120.(2)制备第二脱细胞基质层
121.将步骤(1)中获得的第一脱细胞基质层采用co2激光打孔的加工方式,制备具有贯穿孔的第二脱细胞基质层,贯穿孔的直径范围为1mm,贯穿孔的间距范围为5mm。
122.(3)制备含有脱细胞基质的溶液
123.将步骤(1)中获得的第一脱细胞基质层利用机械粉碎机制备成颗粒直径约0.5mm的粉末,然后用摩尔浓度为0.05mol/l醋酸溶液溶胀后匀浆,制备成质量分数为2%的脱细胞基质溶液。
124.(4)制备软组织修复材料
125.将步骤(1)中制备好的第一脱细胞基质层与步骤(2)中制备好的第二脱细胞基质层先用纯化水浸泡湿润,然后将第一脱细胞基质层取出并挤干多余水分,按粗糙面朝上平铺于图2所示的模具中,模具深度为5mm。将步骤(3)中制备好的含有脱细胞基质的溶液倒入装有第一脱细胞基质层的模具中,将含有脱细胞基质的溶液刮平或流延平厚,再将第二脱
细胞基质层挤干多余水分后覆盖于含有脱细胞基质的溶液上,避免在第二脱细胞基质层与含有脱细胞基质的溶液间产生气泡,之后将模具上盖并锁紧,转移至2~8℃冰箱中静置4h,再转移至-20℃冰箱中冷冻24h;冷冻后将模具取出转移至2~8℃冰箱,倒置待完全解冻再转移至-20℃冰箱中再次冷冻24h,之后再转移至-40℃以下的低温冰箱中冷冻24h,最后再进行冷冻干燥,获得软组织修复材料。所得软组织修复材料的厚度约为5mm。
126.将制备好的软组修复材料按需要规格进行裁切并采用双层吸塑托盘包装后,用环氧乙烷灭菌处理。
127.实施例2
128.本实施例提供一种软组织修复材料,其制备过程具体如下:
129.(1)制备第一脱细胞基质层
130.取牛心包膜经初步清洗、预处理后去除不需要的杂质、并分割成合适10cm
×
10cm大小后放入适当的容器中,加入质量百分浓度为4%的氢氧化钾溶液,加入的氢氧化钾溶液的体积(ml)与动物组织单侧表面积(cm2)比为0.2ml:1cm2,进行病毒灭活处理0.5h。在病毒灭活处理完成后,倒出氢氧化钾溶液,按相同比例加入质量百分浓度为0.25%的氢氧化钾溶液继续浸泡处理24h,之后滤出氢氧化钾溶液,将处理后的心包膜用大量水清洗3-5遍后,随后按相同比例加入质量百分浓度为1%的盐酸中浸泡处理1h,处理完成后再次用大量纯水清洗3-5遍,最后按相同比例加入质量百分浓度为10%的高渗盐溶液处理2h。在脱细胞处理完成后,将心包膜用质量百分浓度为1%的碳酸钠溶液进行清洗2h,随后用注射水进行清洗至脱细胞后的动物组织表面ph为5-7为止。将前述清洗好的心包膜依次浸泡在质量百分浓度为25%、50%、75%、90%和100%的异丙醇溶液中,每次浸泡的时间为30min。完成后将心包膜浸泡于苯中,浸泡24h,间隔12h换一次苯;除脂完成后滤出苯,将心包膜平铺自然晾干无明显苯气味后,即获得第一脱细胞基质层。
131.(2)制备第二脱细胞基质层
132.将步骤(1)中获得的第一脱细胞基质层采用co2激光打孔的加工方式,制备具有贯穿孔的第二脱细胞基质层,其中,贯穿孔的直径范围为0.5mm,贯穿孔的间距范围为2mm。
133.(3)制备复合液
134.按照专利cn201811633677.3公开的方法制备脂肪脱细胞基质粉末,然后用摩尔浓度为0.01mol/l的醋酸溶液溶胀后匀浆制备成质量分数为0.7%的脱细胞基质溶液。
135.取制备好的脱细胞基质溶液,加入透明质酸钠、抗菌肽以及成纤维细胞生长因子,搅拌混合均匀后真空脱泡后获得复合液。在复合液中,m(脱细胞基质粉末):m(透明质酸钠):m(抗菌肽):m(成纤维细胞生长因子)为200:100:10:1。
136.(4)制备软组织修复材料
137.将步骤(1)中制备好的第一脱细胞基质层与步骤2中制备好的第二脱细胞基质层先用纯化水浸泡湿润,然后将第一脱细胞基质层取出并挤干多余水分按粗糙面朝上平铺于模具中,模具深度为3mm。将步骤(3)中制备好的复合液倒入装有第一脱细胞基质层的模具中,将复合液刮平或流延平厚,再将第二脱细胞基质层挤干多余水分后覆盖于复合液上,避免在第二脱细胞基质层与复合液间产生气泡,之后将模具上盖盖上并锁紧,转移至2~8℃冰箱中静置1h,再转移至-20℃冰箱中冷冻12h;冷冻后将模具取出转移至2~8℃冰箱,倒置待完全解冻再转移至-20℃冰箱中再次冷冻12h,之后再转移至-40℃以下的低温冰箱中冷
冻2h,最后再进行冷冻干燥,获得软组织修复材料。所制备的软组织修复材料的厚度约为3mm。
138.将制备好的软组修复材料按需要规格进行裁切并采用双层吸塑托盘包装后,用钴60辐照灭菌。
139.实施例3
140.本实施例提供一种软组织修复材料,其制备过程具体如下:
141.(1)制备第一脱细胞基质层
142.取猪源组织猪腹膜经初步清洗、预处理后去除不需要的杂质、并分割成10cm
×
10cm大小后放入适当的容器中,加入质量百分浓度为2%的氢氧化钠溶液,加入的氢氧化钠溶液的体积(ml)与动物组织单侧表面积(cm2)比为0.4ml:1cm2,进行病毒灭活处理2h。将病毒灭活处理完成后倒出氢氧化钠溶液,按相同比例加入质量百分浓度为1%的氢氧化钠溶液继续浸泡处理12h,之后滤出氢氧化钠,将处理后的腹膜用大量水清洗3-5遍后,随后按相同比例加入质量百分浓度为0.5%的盐酸浸泡处理6h,处理完成后再次用大量纯水清洗3-5遍,最后按相同比例加入质量百分浓度为7%的高渗盐溶液处理4h。在脱细胞处理完成后,将腹膜片用质量百分浓度为1%的碳酸钠溶液进行清洗2h,随后用纯水进行清洗至脱细胞后的组织表面ph为5-7为止;将前述清洗好的腹膜片依次浸泡在质量百分浓度为25%、50%、75%、90%和100%的乙醇溶液中,每次浸泡的时间为60min。完成后将腹膜片浸泡于正己烷中,浸泡48h,间隔12h换一次液;除脂完成后滤出正己烷,将腹膜片平铺自然晾干,无明显正己烷气味后,即获得第一脱细胞基质层。
143.(2)制备第二脱细胞基质层
144.将步骤(1)中获得的第一脱细胞基质层采用机械打孔的加工方式,制备具有贯穿孔的第二脱细胞基质层,贯穿孔的直径范围为1mm,贯穿孔的间距范围为5mm。
145.(3)制备中间层复合液
146.将步骤(1)中获得的第一脱细胞基质层先用摩尔浓度为0.05mol/l醋酸溶液溶胀,然后用高速匀浆机进行搅碎匀浆,制备成质量分数为1.5%的细胞基质溶液。
147.取制备好的脱细胞基质溶液,加入硫酸软骨素与甲硝唑,搅拌混合均匀后真空脱泡,获得复合液。复合液中,脱细胞基质、硫酸软骨素和甲硝唑的质量比为20:5:1。
148.(4)制备软组织修复材料
149.将步骤(1)中制备好的第一脱细胞基质层与步骤(2)中制备好的第二脱细胞基质层先用纯化水浸泡湿润,然后将第一脱细胞基质层取出并挤干多余水分按粗糙面朝上平铺于图2所示的模具中。模具深度为4mm。将步骤(3)中制备好的复合液倒入装有第一脱细胞基质层的模具中,将复合液刮平或流延平厚,再将第二脱细胞基质层挤干多余水分后覆盖于复合液上,避免在第二脱细胞基质层与复合液间产生气泡,之后将模具上盖盖上并锁紧,转移至2~8℃冰箱中静4h,再转移至-20℃冰箱中冷冻4h,冷冻后将模具取出转移至2~8℃冰箱,倒置待完全解冻后再转移至-20℃冰箱中再次冷冻4h,之后再转移至-40℃以下的低温冰箱中冷冻12h,最后再进行冷冻干燥,获得软组织修复材料。所制备的制备软组织修复材料的厚度约为4mm。
150.将制备好的软组修复材料按需要规格进行裁切并采用双层吸塑托盘包装后,用电子束辐照灭菌。
151.以下为测试部分:
152.1、微观结构
153.图3为实施例1所制备的软组织修复材料的微观结构图,从图中可以看出,软组织修复材料具有致密的第一脱细胞基质层、中间的多孔海绵层及具有贯穿孔的第二脱细胞基质层。
154.以上实施例和对比例的软组织修复材料的各层参数如下表1所示:
155.表1
[0156][0157]
2、体外降解实验
[0158]
将实施例2、实施例3所制备的软组织修复材料及市售的双层软组织修复膜产品(专利号ep1252903b1),在相同的体外降解条件下(胶原酶浓度20u/ml,温度37℃),结果如图4所示。
[0159]
从图中可以看出,实施例2和实施例3所制备的软组织修复材料的体外降解速度显著慢于市售的双层软组织修复膜产品。另外,图4中a-1和a-2表示两个样品,在测试过程中,每个软组织修复材料均用了两个样品进行测试。
[0160]
3、细胞粘附
[0161]
将成纤维细胞接种于实施例1与实施例2所制备的软组织修复材料的第二脱细胞基质层表面,体外共培养3d、7d、14d后纵切面观察,如图5所示。图5中,a、b、c分别表示将成纤维细胞接种于实施例1的软组织修复材料的第二脱细胞基质层表面,体外共培养3d、7d和14d后的纵切面图,d、e、f分别表示将成纤维细胞接种于实施例2的软组织修复材料的第二脱细胞基质层表面,体外共培养3d、7d和14d后的纵切面图。
[0162]
从图5中可以看出,成纤维细胞沿着孔隙向软组织修复材料内部生长。
[0163]
以上所述实施例的各技术特征可以进行任意的组合,为使描述简洁,未对上述实施例中的各个技术特征所有可能的组合都进行描述,然而,只要这些技术特征的组合不存在矛盾,都应当认为是本说明书记载的范围。
[0164]
以上所述实施例仅表达了本发明的几种实施方式,便于具体和详细地理解本发明的技术方案,但并不能因此而理解为对发明专利保护范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。应当理解,本领域技术人员在本发明提供的技术方案的基础上,通过合乎逻辑的分析、推理或有限的试验得到的技术方案,均在本发明所附权利要求的保护范围内。因此,本发明专利的保护范围应以所附权利要求的内容为准,说明书及附图可以用于解释权利要求的内容。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1