一种掺59Fe纳米金棒及其制备方法与流程
本发明属于纳米生物效应与安全
技术领域:
,涉及纳米材料在生物毒理作用研究中的应用,具体涉及一种掺59Fe纳米金棒及其制备方法。
背景技术:
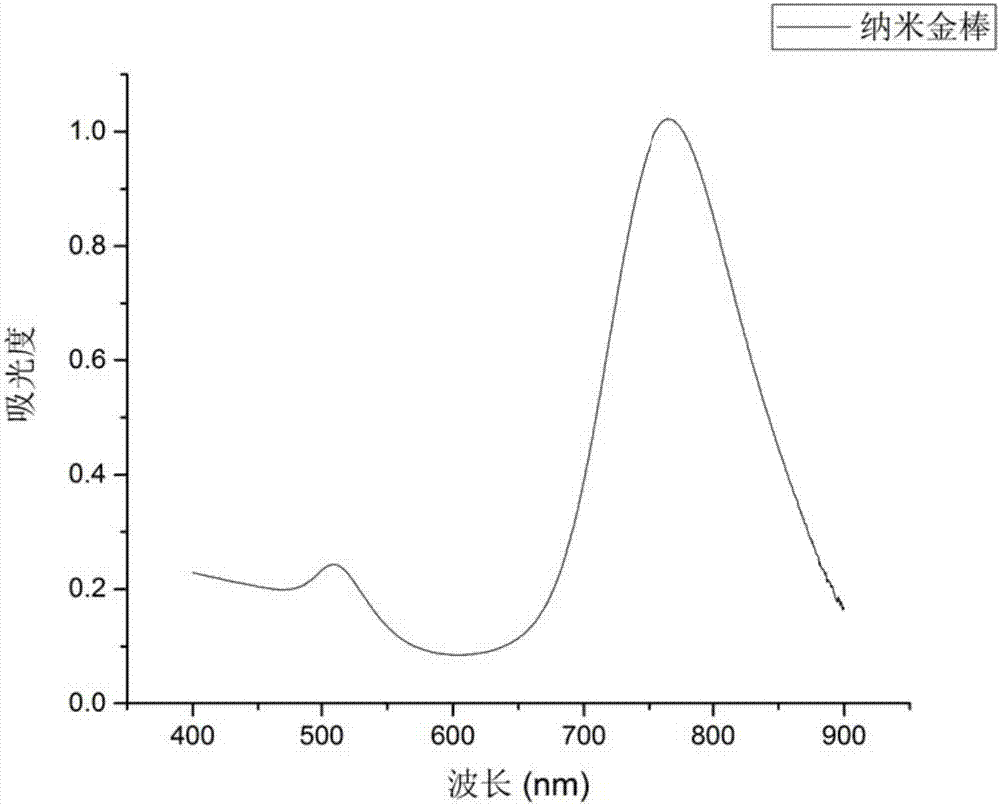
:纳米技术的发展促使一批具有独特光、电、磁等性质纳米材料的诞生,贵金属纳米材料,尤其是金纳米颗粒,其高度可调的光学特性可大大增强对可见光及近红外光的吸收,基于其良好的光学性质和表面化学能力,研究人员可借助其他成像分子探针,如核素探针64Cu和111In,光学探针ICG,磁共振探针Fe3O4等标记金纳米材料构建多功能纳米探针,实现活体成像及治疗研究。目前,利用放射性同位素作为示踪剂,标记在纳米材料上,掌握材料在生物体内的代谢过程比较常见(即同位素示踪法)。由于放射性同位素能不断地发射具有一定特征的射线(如γ射线),因此通过放射性探测方法,可以随时追踪含有放射性核素的纳米材料在体内或体外的位置及其数量的运动变化情况。同时同位素示踪法具有灵敏度高(10-14-10-18),测量方法简便易行,能准确地定量,定位及符合所研究对象的生理条件等特点。但部分材料中的放射性同位素半衰期短(例如198Au仅有2.8天的半衰期),造成很短的时间内材料的放射性强度就降到一个极低的值,这为探究材料的长期代谢途径带来了困难。技术实现要素:针对上述问题,本发明提出了一种掺59Fe纳米金棒(59Fe—GNRs)及其制备方法,实现了在GNRs中掺入半衰期较长的59Fe,对纳米金棒进行放射性标记。为了实现上述目的,本发明采用以下技术方案:一种掺59Fe纳米金棒的制备方法,包括以下步骤:1)将HAuCl4溶液与CTAB溶液混合,在搅拌下加入NaBH4,剧烈搅拌后停止,制备得到金种溶液;2)将AgNO3溶液和59FeCl3·HCl同时加入CTAB和NaOL的混合溶液中(即金棒生长溶液)并搅拌,然后加入HAuCl4溶液并剧烈搅拌至无色,再加入浓盐酸调节pH至1-2;3)向步骤2)调节pH后的溶液中加入抗坏血酸,剧烈搅拌混匀,最后加入金种溶液,搅拌均匀,在25-30℃下陈化过夜,生长得到掺59Fe纳米金棒。进一步地,步骤3)还包括将生长得到的掺59Fe纳米金棒离心分离后洗涤1-3次。优选地,进行离心分离的转速为8000-10000rpm,时间为15-20min。进一步地,步骤1)中所述金种溶液在使用前静置30min以上。进一步地,步骤1)中,CTAB溶液、HAuCl4溶液和NaBH4的摩尔比为2000∶5∶12。优选地,NaBH4的摩尔浓度为0.01-0.02M,剧烈搅拌的速度为400rpm以上,越高越好,有气泡产生为宜。进一步地,步骤2)中,混合溶液中CTAB和NaOL的摩尔比为47∶1至69∶1。进一步地,加入的AgNO3溶液在CTAB和NaOL的混合溶液中的摩尔浓度为0.48-0.9μM。进一步地,步骤2)中,可选择加入的59FeCl3·HCl的量为10-1000Bq,对应的在最终生长得到的掺59Fe纳米金棒中的放射活度可从0.2Bq至20Bq,59FeCl3·HCl的加入量越高,放射性计数越高。优选地,步骤1)和2)中,HAuCl4溶液的摩尔浓度为0.5-1mM,CTAB溶液的摩尔浓度为0.2-0.3M。进一步地,步骤3)中,每100mL步骤2)调节pH后的溶液中加入的抗坏血酸为0.32-0.48mmol,剧烈搅拌的速度为400rpm以上(无太多气泡情况下越高越好),时间为30s-1min,随后加入的金种溶液的量为80-160μL,搅拌时间为30s-1min。优选地,抗坏血酸的摩尔浓度为0.16mM。本发明还提供了一种由上述方法制备的掺59Fe纳米金棒。进一步地,59Fe的放射活度可从0.2Bq至20Bq。本发明的有益效果如下:本发明在纳米金棒的合成过程中掺入59Fe(放射性活度会随掺入量增加,可从0.2bq至20bq,见表1,根据59Fe的量的变化即可得到不同需求放射强度的GNRs),将59FeCl3同AgNO3溶液同时加入金棒生长溶液时可获得最大掺入量(59FeCl3为同一浓度时),同时不会改变金棒的形貌。由于59Fe是在合成中掺入,59Fe已经进入纳米金棒内部,与金棒交织在一起,因此利用此法在标记时较单纯的点标记更加牢靠。同时59Fe半衰期较长(45天),用其代替半衰期短的198Au(2.8天)标记纳米金棒,可用于进行长期观测,获得更多实验数据。在纳米金棒合成中加入59FeCl3需考虑其加入时间以及是否会改变纳米金棒的形貌。由于金纳米棒在生长过程及其排外,杂质离子易被排除,因此,选择不同时间点加入59FeCl3及其重要,经过我们的探索,59FeCl3在金种合成时加入,先与金种混合,与HAuCl4溶液先混合或先于硝酸银溶液加入,掺杂量均远少于在生长液阶段与硝酸银同时加入,其掺杂比例至少为其他时间段的10倍以上(详见表1)。另一方面,加入其他离子也极易改变金棒的形貌,因此,在考虑异种放射性元素标记材料时,几乎都是以点标记实现,但点标记极易脱落,造成在某个器官富集,给研究带来假象。我们在合成中让59Fe在合成中进入纳米金棒内部,最大程度上避免了标记脱落,同时发现掺杂59Fe后并未改变金棒形貌,光学性质也未改变(见图1,图2),这为进一步的动物实验观测带来了可能性。附图说明图1为不加入59Fe时合成的纳米金棒与本发明获得的掺59Fe纳米金棒(59Fe—GNRs)在电镜下的对比。图(a)为不掺入59Fe时合成的纳米金棒,图(b)为本发明获得的掺59Fe纳米金棒(59Fe—GNRs)。图2为金纳米棒的紫外吸收谱图。横坐标为吸收波长,纵坐标为吸光度值。图3为在小鼠尾静脉注射暴露材料的示意图。具体实施方式以下将结合附图对本发明的实现过程做进一步详细说明,但并不受限于此。(一)合成纳米金棒,并在合成过程中掺入少量的59Fe,获得59Fe—GNRs。合成方法如下:1.金种溶液的制备5mLCTAB(0.2M)溶液与5mLHAuCl4(0.5mM)溶液混合(摩尔比400∶1),在搅拌下加入0.6mL新制的冰浴NaBH4(0.01M)溶液,剧烈搅拌(转速尽量大,至少高于400rpm)2min后停止,制备得到金种溶液。种子溶液在使用前需静置30min以上。2.生长液的制备及金棒合成在30℃下,向含1.4gCTAB和0.246gNaOL的溶液中(50mL)同时加入3.6mLAgNO3溶液(4mM)和100μL59FeCl3(放射活度为10Bq)并搅拌15min,然后加入50mLHAuCl4溶液(1mM)并剧烈搅拌90min,再加入浓盐酸调节pH至1.5。调节pH后再搅拌15min,加入0.25mL抗坏血酸(0.064M),剧烈搅拌30s,最后加入80μL金种溶液,搅拌30s,在30℃下陈化12h以上(一般过夜即可)用于金纳米棒的生长。金纳米棒在10000rpm下离心分离,并用二次水洗涤数次。将获得的金纳米棒置于伽马谱仪(GEM-20180-P型美国ORTEC公司)中,获得放射性活度谱图,解谱后得到放射性活度,并与背底比较,其中环境背底无计数,59Fe-GNR的计数率为0.221个/秒,加入59Fe量为6.5×10-4(见表1)。表1为环境背底(BG)与59Fe-GNR计数对比编号样品核素能量(伏)计数率(个/秒)误差\BG\\\\A59Fe-Auseeds-GNRs-1FE-591099.010.018013.0%B59Fe-Auseeds-GNRs-2FE-591098.690.020520.3%C59Fe-GNRs-1FE-591100.180.2216.7%D59Fe-GNRs-2FE-591099.632.966.5%上表中,A为在金种合成时加入59FeCl3,B为59FeCl3随金种一起加入金棒生长溶液中,C,D为59FeCl3随AgNO3一起加入金棒生长溶液中,A、B、C中加入的59FeCl3放射性活度均为10Bq,D为1000Bq。由上表可见,在不同时段加入59FeCl3对59Fe的掺入量有显著影响,同一放射活度的59FeCl3随AgNO3一起加入金棒生长溶液中获得的59Fe掺入量最大,同时,59FeCl3的量增大也会提高纳米金棒中59Fe的掺入量。最终获得的掺59Fe纳米金棒的SEM图如图1所示,其长约74.08±5.31nm,宽约20.64±1.38nm,长径比约为1∶3.6,与未掺杂59Fe的普通金棒的SEM图对比,形貌未见明显变化。金纳米棒的紫外吸收谱如图2所示,其长度特征峰为760nm,其光学特性仍然存在,未改变。(二)对小鼠进行尾静脉注射59Fe—GNRs,即可实现标记材料的观测。将已合成的59Fe—GNRs加入到5%的BSA溶液中(BSA溶液过量)并置于摇床上,在180rpm至200rpm,常温下摇动一天对金棒进行修饰(表2为修饰前后电位变化),修饰后在3000rpm下离心分离,去除上层清液,沉淀重新悬浮于水中。BSA有较好的生物相容性,经BSA修饰后,金棒可更容易进入动物组织器官,方便观测。表2为经BSA修饰前后纳米金棒的电位变化由表2可见,经BSA修饰后纳米金棒的电位由22.6mV变为-11.27mV。将经BSA修饰的金棒通过尾静脉注射暴露给小鼠(如图3所示),接下来便可按照常规生理实验手段采血,取肝肾并置于伽马谱仪中观察材料的富集状况。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1