检测核酸合成和/或扩增的方法与流程
本发明涉及检测核酸合成和/或扩增的方法。
背景技术:
最知名的核酸扩增技术是基于名为聚合酶链式反应的酶促反应,通常简称为PCR。PCR再现了体外的细胞周期的合成阶段,在此期间,遗传物质被复制,以便平均分配到各子细胞中。更具体地,传统的PCR技术包括在不同的扩增循环前的核酸变性(在95至99℃下进行)步骤。此步骤是必须的,因为聚合酶,即酶使用单链核酸作为合成互补序列的模板是核酸扩增的原因。更具体地,所述聚合酶通过向那些存在于从核酸的小片段作为引物的模板链上顺序地插入互补核苷酸来合成核酸的新链。在每一周期,所述核酸在高温下变性(变性步骤)。随后,温度降至一定值以使引物结合到模板核酸的互补部分(退火步骤)。最后,发生聚合步骤,即:聚合酶开始从上述的引物合成核酸的新链。该变性-退火-聚合周期几次重复以扩展即使是很少量的模板核酸。所选择的聚合酶是耐热的,因为其需要在高温下经历很长一段时间。需要对核酸进行变性以扩增相同的使用要求,对于PCR的执行,热循环仪可使得工艺的不同步骤可在不同的温度下操作以及从某一温度快速过渡至另一温度。此限制导致PCR几乎不可用于简易检测,即,对于那些在现场需要以简单和快速的方式进行以便及时采用最恰当决定的测试。环介导等温扩增技术,简称LAMP,是一项很好的技术,可不需要热循环仪来进行核酸扩增。LAMP允许核酸等温扩增。换言之,在整个LAMP反应过程中,温度不断保持在60至65℃间。该恒温条件容许整个LAMP扩增可在恒温水浴、恒温箱或热块中进行。在这种方式下,核酸扩增技术是可行的,其完全避免了进行PCR所需的复杂的热循环仪。在这方面,LAMP显示其为可在现场并以完全独立于实验室的方式进行核酸扩增方法的可选方法。即:LAMP似乎是特别适合的分析方法,被称之为“即时检测”。事实上,此类分析,可在现场不需要要求全能以及易于实现技术的熟练工作人员即可以一种简易的方式进行。一方面,核酸扩增技术像PCR和LAMP,关于检测可能的扩增核酸的步骤,目前仍然存在问题并因此限制了特别是即时检测的进行。通常,以PCR方式或LAMP方式进行扩增的核酸可在嵌入剂的存在下通过进行凝胶而得以显现。嵌入剂是当其被UV辐射激发时能发射荧光的分子。嵌入剂,例如溴化乙锭,通过进入扩增核酸的双螺旋,可通过使用UV辐射显现。在可选实施方式中,核酸扩增可通过在荧光前驱体的存在下进行扩增反应并通过使用合适的装置测量测试样品发射的荧光来进行实时监控(实时分析)。最后,在近期,比浊法已成为广泛应用的检测核酸扩增(尤其是对于LAMP扩增核酸)的方法。随着核酸扩增反应的进行,浊度计测量反应混合物中发生的浊度增加。核酸扩增时发生的反应混合物浊度的增加与磷酸根离子(来自于核苷酸)的释放有关,而这,在镁的存在下,沉淀为焦磷酸镁并使溶液变得混浊。然而,通过嵌入剂方式的扩增核酸的可见性以及通过荧光分子的实时可视性或通过浊度计方式的可视性均是由能操作仪器并知道如何处理危害公众及环境卫生的材料,如嵌入剂的熟练工作人员将核酸扩增反应与临时需要的装置结构(实验室或设备)相结合来进行的。此外,关于使用嵌入剂的另一特别受限的方面是,此类试剂是在扩增反应结束时或在琼脂糖凝胶中加入到混合物中,如果后者是作为检测方法使用。这需要打开发生反应的试管并因此提高了扩增核酸(不管其是包含在测试样品中或是包含在阳性对照样品中)污染环境的高风险性。尽管已进行了适当的净化程序,核酸带来的环境污染仍可持续很长时间。更进一步地,该污染在不规则时间间隔下经常增加发生的假阳性,甚至是在该问题显然已经解决的情况下也会发生。在这种情况下,为了确保消除污染,唯一的解决方法是再次设计测试并再次制定其以前的组成(例如,用于扩增的引物)。很显然,这种情况,即环境污染,是绝对要避免的,尤其是在诊断试剂盒的建立过程中,因为试剂盒的验证步骤是极其昂贵的过程。近年来,为了检测LAMP-扩增DNA,Goto等人发现:通过向反应混合物中添加羟基萘酚蓝(HNB),是有可能随着核酸扩增进行比色分析的(Goto等,生物技术(2009)Vol.46:167-172)。羟基萘酚蓝(HNB)是金属离子指示剂。如上所述,在LAMP扩增反应过程中,由于镁与焦磷酸盐形成复合物并沉淀,镁浓度降低。随着核酸扩增,镁浓度的降低导致添加了HNB的反应混合物的颜色发生变化。具体地,混合物的颜色从深蓝色调转变成浅蓝色调。然而,在标准的LAMP反应条件下,难以观察到该色调的变化,尤其是当扩增为最小量时(即,样品是弱阳性)以及当评估观察者不熟练时。因此,核酸的扩增检测仍然是一有待解决的问题。
技术实现要素:
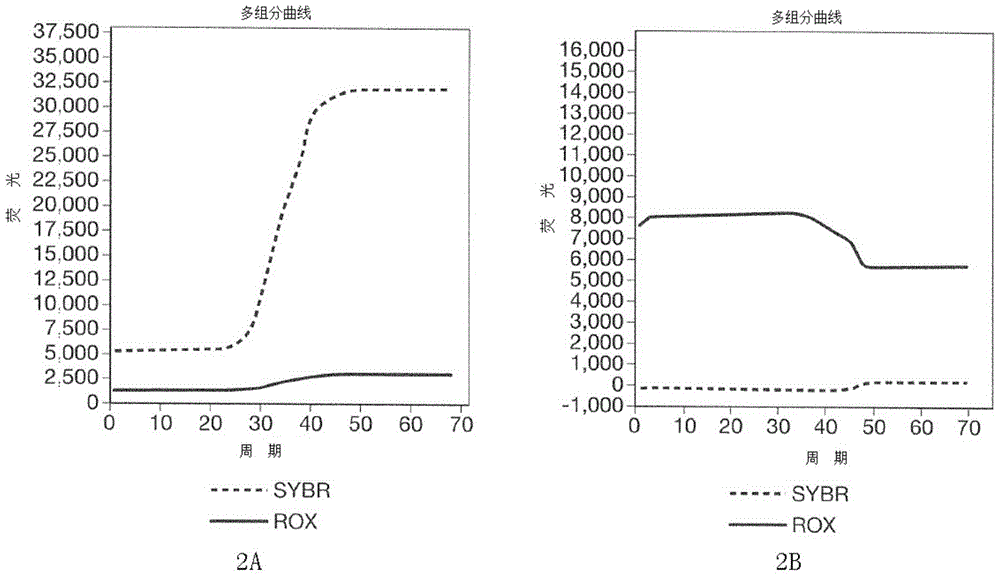
在此背景下,本发明所要解决的技术问题是提供一种灵敏的核酸合成和/或扩增的检测方法,从而相对于现有技术体系,提高了结果的灵敏性进而可提高结果的可靠性。申请人已经找到了检测核酸的合成和/或扩增的比色法中所存在的技术问题的对策,其中,至少一种比色金属指示剂以及至少一种镁螯合剂(优选一种温和的镁螯合剂)被加入到核酸扩增的反应混合物中。随后,以此得到的反应混合物与被分析的样品进行接触以使得样品中可能存在的核酸发生合成和/或扩增。最后,在扩增反应可能结束时,检测反应混合物的起始颜色是否发生了变化。在扩增步骤的终点,反应混合物的颜色从落在紫罗兰色(例如蓝紫色、淡紫色或紫红色)的颜色范围到落在蓝色(例如天蓝色)的颜色范围内的明显变化表明了所测试样品中靶核酸的存在。申请人惊奇地注意到,相对于采用现有技术方法得到的检测,采用本发明的方法显著提高了扩增核酸的色度检测。特别地,申请人实现了:采用本发明的方法,核酸扩增的检测更为灵敏,即:其可检测更低浓度的靶核酸,是稳定的,即:其不会受到方法参数小变化的影响,因此,其比现有文献中为实现这一目的的方法更为可靠。相对于现有技术方法,本发明方法的灵敏度更高是由于这样的一个事实:即可通过肉眼观察到作为阴性样品和弱阳性样品间差异的明确颜色变化,而当采用现有技术方法时,仅可获得相同颜色(从深蓝到浅蓝)的细小色调变化。事实上,当核酸以本发明的方法扩增时,如果核酸发生了扩增,扩增反应混合物的颜色从落在紫罗兰色(例如蓝紫色、淡紫色或紫红色)的颜色范围变化到落在蓝色(例如天蓝色)的颜色范围内。颜色差异是如此明显,从而即使是非技术观察者也可容易观察出。只有向扩增反应混合物中加入至少一种比色金属指示剂以及至少一种温和的镁螯合剂的组合,才可能提高扩增核酸可视性。从经济角度,也已经证实本发明的方法比现有技术方法具有更多优势。事实上,其可在比标准(众所周知,核苷酸是一种非常昂贵的起始材料,但是其是开展此类方法所必不可少的)更低的核苷酸浓度下进行。这使得在有使用本方法时,其成本的降低是不可忽视的,尤其是在大规模筛选时。最后,申请人已经证实了,向可能的核酸扩增反应混合物中加入至少一种温和的镁螯合剂,在某些情况下,可促进扩增反应。附图说明在下文中,本发明将结合附图进行详细描述,其中:图1A显示了在柠檬酸钠存在下,通过现有检测技术获得的阳性生物样品(含有扩增核酸)以及阴性生物样品(不含核酸)间的颜色差异;图1B显示了通过本发明的方法获得的阳性生物样品(含有扩增核酸)以及阴性生物样品(不含核酸)间的颜色差异;图2A以灰色突出显示了通过实时热循环仪在SYBRGREEN(其为信号读取通道)存在下进行LAMP反应的靶DNA扩增的典型曲线的增长行为;图2B以黑色突出显示了通过实时热循环仪在羟基萘酚蓝(其使用的信号读取通道与SYBRGREEN通道相对应)存在下进行LAMP反应的靶DNA扩增的典型曲线的减少行为;图3A-3C显示了柠檬酸钠对在SYBRSAFE存在下进行的LAMP反应并通过实时热循环仪在SYBRGREEN通道读取的靶DNA扩增曲线行为的影响。其中,柠檬酸钠浓度为:0.5mM(图3A),1mM(图3B)和1.5mM(图3C)。具体实施方式本发明涉及核酸合成和/或扩增的比色检测方法,其中,所述方法包括向核酸扩增的反应混合物中添加至少一种比色金属指示剂以及至少一种温和的镁螯合剂。更具体地,根据本发明,所述的检测核酸的合成和/或扩增的方法,包括以下步骤:(i)提供至少一组设计的用于以特定的方式与靶核酸的至少一个区域合成和/或扩增的引物;(ii)将步骤(i)中的一组引物与靶核酸用于扩增的反应混合物相结合,所述混合物包括至少一种比色金属指示剂以及至少一种温和的镁螯合剂;(iii)将从步骤(ii)中获得的反应混合物与生物样品相接触,以扩增样品中可能存在的靶核酸的至少一个区域;以及(iv)检测反应混合物可能的颜色改变。所述添加至少一种比色金属指示剂和至少一种温和的镁螯合剂的组合,使得反应混合物的色度对最小量的扩增核酸也是敏感的。事实上,通过采用本发明所述的方法,少量的扩增核酸同样也能引起反应混合物的颜色产生一定的变化。根据本发明的方法,混合物的颜色从落在紫罗兰色(例如蓝紫色、淡紫色或紫红色)的颜色范围到落在蓝色(例如天蓝色)的颜色范围内变化。相反,采用现有技术中的方法,核酸的扩增使得反应混合物的颜色从深蓝色变成天蓝色。本发明的方法可显著提高阳性样品(即,核酸被扩增的样品)和阴性样品(即:没有发生核酸扩增的样品)之间的色差。事实上,即使样品仅是弱阳性的(少量的扩增核酸),也可通过本发明的方法检测到。要获得这样的结果,至少一种温和的镁螯合剂和至少一种比色金属指示剂的组合是必不可少的。本发明所述方法的第一个方面涉及比色金属指示剂,所述比色金属指示剂优选自:羟基萘酚蓝、羊毛铬黑T、8-羟喹啉+丁酰胺、钛黄、二甲苯胺蓝、钙镁试剂、二甲苯胺蓝、百里酚蓝、铬菁R、茜素红S、邻甲酚酞、1,2,3-三羟基蒽醌、醌茜隐色体、醌茜素、对硝基苯-偶氮-对硝基苯-间苯二酚、丁酰胺、铬变素2B、氨+酚酞、碱性次碘酸盐、五次甲基巴比妥酸和二苯卡巴肼。所述指示剂的浓度变化范围优选0.05至0.2mM,更优选0.1至0.15mM。为了本发明的目的,所述比色金属指示剂特别优选羟基萘酚蓝。本发明所述方法的第二个方面涉及温和的镁螯合剂,所述温和的镁螯合剂优选自:柠檬酸钠、乙酸、ADP、天冬氨酸、ATP、正丁酸、柠檬酸、半胱氨酸、3,4-二羟基苯甲酸、O,O-二甲基红棓酚、EDTA、EGTA、葡萄糖酸、谷氨酸、戊二酸、甘油酸、甘氨酸、羟基乙酸、双甘氨肽、鸟苷、邻羟基苯甲酸、次黄苷三磷酸、乳酸、苹果酸、NTA、草酸、多磷酸盐、丙酸、嘌呤、水杨醛、水杨酸、琥珀酸、酒石酸、四偏磷酸盐、三偏磷酸盐、三磷酸盐、尿苷二磷酸。优选地,所述温和的镁螯合剂的浓度变化范围为0.5至2mM,更优选0.8至1.2mM。为了本发明的目的,所述温和的镁螯合剂特别优选柠檬酸钠。在一优选实施方式中,羟基萘酚蓝与柠檬酸钠结合使用。采用本发明的方法合成和/或扩增的核酸是DNA和/或RNA。假如进行扩增的核酸是RNA分子,后者优选先通过例如是逆转录酶的酶进行逆转录。根据本发明的方法,所述核酸或者cDNA先经历了逆转录,然后进行扩增。在本发明的上下文中,术语“核酸合成和/或扩增的方法”用来表示目的核酸的某一确定片段的增值所使用的方法。为了本发明的目的,所述核酸合成和/或增值的方法优选LAMP、PCR或其变形。特别优选环介导等温扩增(LAMP)。所述LAMP技术是近年来发展起来的核酸扩增技术(NotomiT等,2000)。为便于更容易理解本发明所述方法的一些优点,下面简单描述了LAMP方法的原理。所述LAMP方法是基于使用特别设计用于特定的核酸序列,例如某一DNA分子,的一组四个引物(或寡核苷酸)。此外,LAMP使用能在等温条件下通过“链置换”的方式进行靶核酸合成和扩增的耐热聚合酶。所述的一组引物包括一对外引物F3和B3以及一对内引物FIP和BIP。这些引物是特定的,因此它们能检测和绑定靶DNA序列的六个不同侧翼区来进行扩增。从靶DNA的5'-末端开始,所述侧翼区为F3、F2、F1、B1c、B2c和B3c(“c”代表互补)。所述引物如此设计以在反应的初始步骤中促进发夹环结构的形成,因此,随着反应的进行,从此类结构合成了大量的自引发DNA。具体地,外引物F3和B3是普通的单域引物,并能扩增整个靶DNA序列。所述内引物(FIP和BIP)是混合(双域)引物,且分别由区F1c和F2(FIP)和区B1c和B2(BIP)组成。内引物对的每个引物能识别靶DNA六个区中的两个,且该内引物对在LAMP反应中执行主任务(事实上,它们使用了比外引物对更高(过量)的浓度)。LAMP反应,其本质包括两个步骤:第一步形成实际扩增步骤,即第二步的启动结构。在第一步中,内引物先反应。具体地,FIP中的F1c区绑定至靶DNA的互补区(F2c)上,并通过聚合酶开始新合成DNA链的扩增。此时,外引物F3绑定至靶DNA的互补区(F3c)上,并从FIP开始替换新合成DNA链,释放新合成DNA链。由于F1c区(来源于FIP)与新合成链的F1区杂交,从而在此类DNA链的3'-末端形成一环状结构。引物BIP和B3在另一末端以类似的方式反应。在此步骤结束时,获得了靶DNA,其具有在末端自杂交从而形成环的结构(定义为“自身结构”)特性。此类DNA将开始实际扩增步骤。该自身结构是新的靶DNA,在LAMP的扩增步骤中,从引物FIP和BIP开始扩增。扩增步骤从自身结构的游离3'末端开始扩增,并从绑定到环区F2c的FIP开始扩增。以这种方式,和与其互补的结构一起,再次形成如第一步中所形成的相同的自身结构。所述扩增反应总是从FIP和BIP持续开始,直到形成高扩增结构。另一对引物,定义为环前(LF)和环后(LB)引物,可加入到LAMP反应混合物中。此类引物的目的在于显著加速反应,可减少甚至50%的反应时间。在利用LAMP方法进行核酸合成和/或扩增的实施例中,本发明的方法包括以下步骤:(i)提供至少一组设计的用于以LAMP方式对靶核酸序列的至少一个区进行扩增的引物;(ii)将所述引物组与反应混合物相结合以通过LAMP的方式对靶核酸进行扩增,所述反应混合物包括至少一种比色金属指示剂以及至少一种(温和的)镁螯合剂;(iii)将生物样品与从步骤(ii)中获得的反应混合物相接触,以扩增所述样品中可能存在的靶核酸序列的至少一个区;以及(iv)检测该反应混合物可能的颜色改变。在刚才所描述的步骤(i)至(iv)前可选择性地进行核酸的变性步骤。优选地,所述变性步骤在温度为90-100℃,时间为1至10分钟,优选4至8分钟下进行。同样根据本实施例,添加至少一种比色金属指示剂和至少一种温和的镁螯合剂的组合使得反应混合物的色度对扩增核酸的最小量也是敏感的,其中扩增核酸能引起反应混合物颜色的明确变化。以LAMP的方式进行的合成和/或扩增反应优选在温度为50至80℃,更优选在55至70℃下进行。所述扩增反应可在恒温浴和/或炉和/或热块中进行。进行所述扩增反应的时间优选30至90分钟,更优选40至75分钟。本发明所述方法的另一方面涉及核酸扩增的反应混合物。所述混合物优选包括:至少一种聚合酶、含有镁盐的缓冲溶液、核苷酸三磷酸盐混合物、和/或至少一种解链温度调节剂。在本发明的上下文中,术语“解链温度”指的是核酸的一半是双螺旋(或双链)状态以及一半是变性(单链)状态时的温度。一般而言,本发明所述方法中所使用的聚合酶优选在等温条件下通过链置换活性的方式能扩增靶核酸(优选,DNA)。在本发明的上下文中,术语“链置换活性”指的是聚合酶替换核酸链的能力,例如,在合成反应中发现DNA分子向下,而离开它整体(即,该术语表示的是不能水解的核酸链)。具体地,所述聚合酶是DNA聚合酶,优选耐热NDA聚合酶。为实现本发明的目的,特别优选嗜热脂肪芽胞杆菌(Bacillusstearothermophilus)的耐热DNA聚合酶的大部分片段。关于缓冲溶液,其优选包括镁盐、KCl、Tris-HCl、NH4SO4、TritonX-100和/或吐温20。优选地,所述镁盐为MgSO4。所述镁盐所使用的浓度优选1至8mM,更优选1.5至7mM。在本发明的具体实施例中,还可在反应混合物种引入镁,例如,以镁离子(Mg2+)的形式,优选以添加MgCl2的方式。在此方面,申请人已注意到镁的使用,以氯化盐的形式,增强了发生扩增反应前的起始反应混合物的紫色。关于脱氧核苷酸三磷酸盐混合物,其包括dATP、dGTP、dCTP、dTTP的混合物,浓度范围优选1000μM至3000μM。关于解链温度调节剂,其选自:甜菜碱、三甲胺N-氧化物、脯氨酸、二甲基亚砜以及甲酰胺。为实现本发明的目的,所述解链温度调节剂优选甜菜碱,其浓度优选0.6M至1.6M。关于引物组,其包括至少一对能识别并绑定靶核酸序列的引物。所述引物对优选包括与靶核酸的5'区序列互补的正向引物以及与靶核酸的3'区序列互补的反向引物。在使用LAMP进行核酸的合成和/或扩增的实施例中,步骤(i)中的引物组包括至少一对内引物以及至少一对外引物。可选地,还可使用提供的另一对引物,定义为环状引物。每对内引物包括至少一正向内引物(FIP)和至少一反向内引物(BIP);每对外引物包括至少一与F3c互补的正向外引物(F3)以及至少一反向外引物(B3);每对环状引物包括至少一内环状引物(LF)和至少一外环状引物(LB)。组中的每一引物如此设计以便于在LAMP反应的第一步中优选形成定义为“发卡环”的结构。每一内引物均是任意选择的核酸序列。为设计所述序列,其优先考虑的是:-所述序列的长度优选35至60个核苷酸,更优选40至60个核苷酸;-所述序列的解链温度优选55至70℃,更优选52至63℃;-GC百分比(即序列中鸟嘌呤+胞嘧啶含量占总核酸含量的百分比)优选30至65%,更优选35至55%;-所述序列(即,每个内引物)使用的浓度优选0.2至2mM,更优选0.6至1.6mM。每一外引物均是任意选择的核酸序列。为设计所述序列,其优先考虑的是:-F1c或B1c的长度优选20是30个核苷酸,更优选17至22个核苷酸;F2和B2的长度优选20至30个核苷酸,更优选17至22个核苷酸;-F1c或B1c的解链温度优选63至68℃,更优选52至63摄氏度;F2或B2的解链温度优选56至65℃,更优选58至63℃;-GC百分比(即序列中鸟嘌呤+胞嘧啶含量占总核酸含量的百分比)优选30至65%,更优选35至55%;以及-每个外引物使用的浓度优选0.1至2mM,更优选0.1至1mM。每个环状引物均是任意选自与F2和F1c以及B2和B1c序列互补的序列中的任意核酸序列。为设计所述序列,其优先考虑的是:-所述序列优选12至36个核苷酸,更优选17至22个核苷酸;-所述序列的解链温度优选55至70℃,更优选52至63℃;-GC百分比(即序列中鸟嘌呤+胞嘧啶含量占总核酸含量的百分比)优选30至65%,更优选35至55%;以及-所述序列(即:每个环状引物)所使用的浓度优选0.2至2mM,更优选0.3至1mM。本发明的另一方面涉及本发明所述方法在健康领域,特别是在人类健康方面的使用。此外,本发明的方法还可应用于农业以及食品领域和/或兽医领域。本发明的目的特别适用于使用上述的方法来检测样品中病原体的存在。在此实施例中,合成和/或扩增的是属于(特定)病原体的核酸(DNA和/或RNA)。具体地,至少一种病原体选自:支原体属(Mycoplasma)、李斯特菌属(Listeria)、细螺旋体属(Leptospira)、假单胞菌属(Pseudomonas)或细小病毒属(Parvovirus)。属于支原体属的病原体优选亲血的支原体。更优选地,所述亲血的支原体选自:血巴尔通氏体(CandidatusMycoplasmahaemominutum)、猫血巴尔通体(CandidatusMycoplasmaturicensis)、猫血支原体(Mycoplasmahaemofelis)、犬嗜血支原体(Mycoplasmahaemocanis)和Mycoplasmahaematoparvum。属于李斯特菌属(Listeria)的病原体优选单核细胞增生李斯特菌(Listeriamonocytogenes)。属于细螺旋体属(Leptospira)的病原体优选钩端螺旋体(Leptospirainterrogans)。属于假单胞菌属(Pseudomonas)的病原体优选荧光假单胞菌(Pseudomonasfluorescens)。病毒性病原体优选选自:犬细小病毒(CPV)以及猫细小病毒(FPV)。如上所述,在本实施例的上下文中,术语“检测至少一种病原体的存在”指的是合成和/或扩增目的病原体特定核酸的至少一个片段。换言之,本发明的方法包括这种情况:通过使用特定的引物合成和/或扩增目的病原体的基因组区域。所述的合成和/或扩增可通过LAMP、PCR或它们的变形来进行。优选地,所述合成和/或扩增LAMP的方式进行。另外,在本实施例中,如上所述,通过LAMP的方式进行合成和/或扩增反应,温度优选50至80℃,更优选55至70℃。所述扩增反应可在恒温浴和/或箱和/或热块中进行。进行所述扩增反应的持续时间优选30至90分钟,更优选40至75分钟。在以LAMP的方式合成和/或扩增所关注病原体的至少一个核酸片段的情况下,通过考虑上述以LAMP的方式进行核酸合成和/或扩增来设计步骤(i)的每个引物。具体地,在本实施例的上下文中:-所述至少一种正向内引物优选选自SEQIDNO:3、9、15、21、27、33和39;-所述至少一种反向内引物优选选自SEQIDNO:4、10、16、22、28、34和40;-所述至少一种正向外引物优选选自SEQIDNO:1、7、13、19、25、31和37;-所述至少一种反向外引物优选选自SEQIDNO:2、8、14、20、26、32和38。优选地,所述内引物对包括SEQIDNO:3和4或SEQIDNO:9和10或SEQIDNO:15和16,并且是特定于检测猫和狗中亲血型支原体。优选地,所述内引物对包括用于检测血巴尔通氏体(CandidatusMycoplasmahaemominutum)的SEQIDNO:3和4;用于检测猫血巴尔通氏体(CandidatusMycoplasmaturicensi)的SEQIDNO:9和10;用于检测猫血支原体(Mycoplasmahaemofelis)的SEQIDNO:15和16。优选地,所述内引物对包括SEQIDNO:21和22,并且是特定用于检测李斯特菌属(Listeria),优选用于检测单核细胞增生李斯特菌(Listeriamonocytogenes)样品。优选地,所述内引物对包括SEQIDNO:39和40,并且是特定用于检测细螺旋体属(Leptospira),优选用于检测钩端螺旋体(Leptospirainterrogans)样品。优选地,所述内引物对包括SEQIDNO:33和34,并且是特定用于检测假单胞菌属(Pseudomonas),优选用于检测荧光假单胞菌属(Pseudomonasfluorescens)样品。优选地,所述内引物对包括SEQIDNO:27和28,并且是特定用于检测细小病毒属(Parvovirus),优选用于检测犬细小病毒(CPV)和/或用于检测猫泛白细胞减少症病毒(FPV)。优选地,所述外引物对包括SEQIDNO:1和2或SEQIDNO:7和8或SEQIDNO:13和14,并且特定用于检测支原体属。优选地,所述外引物对包括用于检测血巴尔通氏体(CandidatusMycoplasmahaemominutum)的SEQIDNO:1和2;用于检测猫血巴尔通氏体(CandidatusMycoplasmaturicensis)的SEQIDNO:7和8;用于检测猫血支原体(Mycoplasmahaemofelis)的SEQIDNO:13和14。优选地,所述外引物对包括SEQIDNO:19和20,并且特定用于检测李斯特菌属(Listeria),优选用于检测单核细胞增生李斯特菌(Listeriamonocytogenes)样品。优选地,所述外引物对包括SEQIDNO:37和38,并且是特定用于检测细螺旋体属(Leptospira),优选用于检测钩端螺旋体(Leptospirainterrogans)样品。优选地,所述外引物对包括SEQIDNO:31和32,并且是特定用于检测假单胞菌属(Pseudomonas),优选用于检测荧光假单胞菌属(Pseudomonasfluorescens)样品。优选地,所述外引物对包括SEQIDNO:25和26,并且是特定用于检测细小病毒属,优选用于检测犬细小病毒(CPV)和/或用于检测猫泛白细胞减少症病毒(FPV)。在具体实施例中,本发明所涉及的引物组还包括一对环状引物。优选地,所述环状引物对包括:SEQIDNO:5和6、SEQIDNO:11和12、SEQIDNO:17和18、SEQIDNO:23和24、SEQIDNO:29和30、SEQIDNO:35和36、或SEQIDNO:41和42。在优选实施例中,所述环状引物对包括:SEQIDNO:5和6、SEQIDNO:11和12、或SEQIDNO:17和18,且特定用于检测支原体属。优选地,所述环状引物对包括:用于检测血巴尔通氏体(CandidatusMycoplasmahaemominutum)的SEQIDNO:5和6;用于检测猫血巴尔通氏体(CandidatusMycoplasmaturicensi)的SEQIDNO:11和12;用于检测猫血支原体(Mycoplasmahaemofelis)的SEQIDNO:17和18。在优选实施例中,所述环状引物对包括SEQIDNO:23和24,并且特定用于检测检测李斯特菌属(Listeria),优选用于检测单核细胞增生李斯特菌(Listeriamonocytogenes)样品。在优选实施例中,所述外引物对包括SEQIDNO:41和42,并且特定用于检测检测细螺旋体属(Leptospira),优选用于检测钩端螺旋体(Leptospirainterrogans)样品。在优选实施例中,所述外引物对包括SEQIDNO:35和36,并且特定用于检测检测假单胞菌属(Pseudomonas),优选用于检测荧光假单胞菌(Pseudomonasfluorescens)样品。优选地,所述外引物对包括SEQIDNO:29和30,并且特定用于检测细小病毒属,优选用于检测犬细小病毒(CPV)和/或用于检测猫泛白细胞减少症病毒(FPV)。表I列出了本发明优选实施例中所涉及的序列。表I与上述所列序列具有80-85%同源性的核苷酸序列均可考虑用于本发明所述的方法中。本发明所述方法中所采用的样品可以是任何来源的核酸(DNA和/或RNA)。在优选实施例中,所述样品为任何来源的至少一种病原体或至少一种病原体的基因组,例如食物、水或土壤。所述样品优选生物样品,例如血液及其衍生物(血浆、血清等)、尿液或任何生物液、组织片段、毛发、粪便或细胞。所述样品可如此使用,或其经过溶解。溶解的样品中含有目的核酸。为了将核酸分子从样品的其它组分中分离出来,还可对该溶解产物进行进一步纯化。如上所述,将上述核酸扩增的反应混合物与样品进行接触的步骤是启动可能存在于样品中的靶核酸序列的合成和/或扩增反应必不可少的。在可能存在于样品中的靶核酸序列的扩增反应结束时,只有在已经发生所述序列的合成和/或扩增时,才能明显观察到该反应混合物的颜色变化。在实施本发明所述方法时,反应混合物的颜色变化比现有技术中的方法更为明确以及明显,事实上,反应混合物的颜色从落在紫罗兰色(例如蓝紫色、淡紫色或紫红色)的颜色范围变成落在蓝色(例如天蓝色)的颜色范围,然而,采用现有技术的方法,混合物的颜色从深蓝色(扩增前)变成天蓝色(扩增后)或者从紫红色-蓝紫色变成紫罗兰色。如上所述,按照本发明的方法向反应混合物中添加至少一种比色金属指示剂以及至少一种温和的镁螯合剂来进行核酸扩增,可观察到反应混合物明显的颜色变化。混合使用至少一种比色金属指示剂以及至少一种温和的镁螯合剂还具有以下优点:其所使用的核苷酸三磷酸盐浓度低于现有技术方法中通常所使用的浓度。例如,核苷酸的浓度范围为500至3000μM,优选1500至2000μM。因此,本发明的方法可随着反应混合物的颜色变化,通过肉眼(目视)观察和/或监控核酸的扩增。由于即使是最小量的序列被扩增时,反应混合物的颜色变化也是明确及明显的,因此,几乎没操作过或非技术观察者也可在反应结束后确定目的核酸序列是否发生了扩增。如前所述,本发明中所使用的核苷酸的浓度低于现有技术方法中通常所使用的浓度,从而显著减小了实施本方法的成本,因为核苷酸三磷酸盐十分昂贵。因此,从经济角度来看,本发明的方法也是十分具有优势的。通常,为监控反应质量,也就是,例如,为了核实反应是否正确地发生,或者反应物是否起作用,或者反应物是否发生污染,采用了一个或多个阳性对照和/或一个活多个阴性对照。因此,在本发明方法的上下文中,样品可以是阳性对照或阴性对照。所述阳性对照是,例如,目的核酸(靶核酸)序列的至少一个区域。此区域本身可以是靶核酸的区域的序列(单独),例如,该区域的双链DNA序列。在另一实施方式中,此序列可插入到任何克隆载体中。所述克隆载体含有本发明所述方法中可作为阳性对照的靶核酸的至少一个区域的序列。在特定实施方式中,该区域可被认为,不论是以其本身的核苷酸序列形式还是以插入到克隆载体上的区域的核苷酸序列形式,都可以是病原体基因组的一个区域,特别是本发明所述方法的作为靶的病原体的核酸序列的一个区域。采用本发明的方法,阳性对照样品将在扩增反应(无论是PCR还是LAMP)结束时显示出天蓝色。因此,样品将从落在紫罗兰色(扩增前)范围内的颜色变化至落在蓝色范围内的颜色,例如,天蓝色(扩增后),这反映了本发明的积极结果,即反应物的质量和实验条件。阴性对照可以是存在进行该方法所需要的所有反应物,但不存在将被扩增的核酸。因此,样品在扩增前后具有相同的颜色,即,假使方法已正常发生(例如,没有污染),其也仅具有紫罗兰色。换言之,通过使用至少一组阳性对照和至少一组阴性对照,可以监控该方法的可靠性。为了以快速及简单的方式证实和/或确认通过本发明所述方法得到的结果,本领域任何技术人员可使用通常的核酸可视化技术来进行:例如,由于插入剂或由UV-射线或适当波长的光激发的荧光物质的结合而导致的浊度、凝胶和紫外线的增加,荧光增加。本发明的另一方面涉及实施本发明所述方法的试剂盒。所述试剂盒优选包括以下试剂:-如本发明所述的至少一组引物;-至少一种含有镁盐的缓冲液;-至少一种核苷酸三磷酸盐混合物;-至少一种聚合酶;-至少一种解链温度调节剂;-至少一种比色金属指示剂;-至少一种温和的镁螯合剂;-至少一组阳性对照;-至少一组阴性对照。如上所列出的试剂盒组分,和本发明所述方法中所描述的一致。此外,本发明所述的试剂盒还可包括不同的反应离心管,优选塑料材质的埃普多夫型离心管。更优选的是,所述离心管的容量为0.2至0.5ml。所述反应离心管中含有反应物,所述反应物优选冷冻干燥以使得它们可以在环境温度下保存。具体地,根据本发明,所述试剂盒是用于检测生物样品中亲血支原体的存在,所述亲血支原体优选选自:血巴尔通氏体(CandidatusMycoplasmahaemominutum)、猫血巴尔通氏体(CandidatusMycoplasmaturicensis)、猫血支原体(Mycoplasmahaemofelis)、犬嗜血支原体(Mycoplasmahaemofelis)和Mycoplasmahaemofelis。本发明的试剂盒还可用于检测生物样品中属于李斯特菌属(Listeria)、优选单核细胞增生李斯特菌(Listeriamonocytogenes)的病原体。本发明的试剂盒还可用于检测生物样品中属于细螺旋体属(Leptospira),优选钩端螺旋体(Leptospirainterrogans)的病原体。本发明的试剂盒还可用于检测生物样品中属于假单细胞菌属(Pseudomonas),优选荧光假单胞菌(Pseudomonasfluorescens)的病原体。本发明的试剂盒还可用于检测生物样品中病毒性病原体,优选选自犬细小病毒(CPV)以及猫细小病毒(FPV)。在上述优选实施例下,本发明的试剂盒包括本发明的方法说明书中所公开的引物组。实施例1为了遵循本领域已知方法的扩增反应,在LAMP方法中使用了羟基萘酚蓝(GotoM等,生物技术,2009;MaXJ等,病毒学,2010,CardosoTC等,分子细胞探针,2010)。申请人在实施现有技术的方法时,在LAMP扩增前,得到了蓝色的反应混合物,随着目的核酸扩增反应的进行,反应混合物的并不是总能观察到变色。这是因为,采用现有技术的方法,在核酸扩增前的扩增反应液为深蓝色,在目的核酸可能扩增结束时为浅蓝色,很难与起始混合物的颜色明确区分开来。图1A显示了当采用Goto等人的方法时的阳性样品和阴性样品。我们提示,阳性样品提供的关于样品何处的核酸被扩增的信息,因此其提供了当核酸扩增发生时,在扩增结束后的反应混合物颜色的信息。阴性样品提供了关于样品何处的核酸未被扩增的信息,因此其提供了反应混合物起始、即扩增前的颜色信息。为了增强核酸扩增前后的色度差,即使是非技术人员也能简便及快速地监控同样的扩增,故向混合物中加入了温和的镁螯合剂。所述温和的镁螯合剂采用的柠檬酸钠。其采用以下浓度:0.25、0.5、0.75、1、1.25、1.50、1.75、2、2.5、3、4.5mM。LAMP扩增的反应混合物中柠檬酸钠和羟基萘酚蓝的加入,使得扩增前,混合物的颜色为紫罗兰色。在核酸可能的扩增结束时,混合物为天蓝色,这可与反应混合物的起始颜色(扩增前)中清楚区分开来。图1B显示了采用本发明所述方法时的阳性样品以及阴性样品。结果表明,与文献中已知的方法相比,本发明的方法明显提高了反应起始和结束时的颜色差。为了验证柠檬酸钠在提高阴性样品的紫罗兰色和阳性样品的天蓝色间对比性方面的实际功能,使用了实时热循环仪。使用SYBRGREEN来读取通道。事实上,申请人已惊奇地发现,在这些实验条件下,热循环仪能读取传统LAMP扩增的结果以及反应混合物中添加有羟基萘酚蓝的LAMP的结果。在羟基萘酚蓝的存在下,随着反应混合物中的着色剂从紫罗兰色变成天蓝色,对应于靶DNA扩增的曲线具有降低的表现(见图2B),取代了传统LAMP中的增加表现(见图2A)。实验工作被分为两步,第一步为验证如上所述的读取方法,以及第二步为评估向LAMP反应混合物中加入柠檬酸钠的效果。关于第一步,通过实时热循环仪来验证结果的读取方法,制备了10个含有羟基萘酚蓝(在10个不同的离心管中)的LAMP反应混合物样品,以及10个含有SYBRSAFE的LAMP反应混合物样品。相同量的阳性对照(5μl,对应于约90,0000靶)以相同的稀释液的量添加到样品中。所述样品在65℃下温育1小时。比较了两个样品池(即:含有以及不含羟基萘酚蓝的反应混合物)的曲线。在相同循环量的扩增曲线中,所述的两种样品显示出了增加表现(在具有SYBRSAFE的LAMP曲线中)以及减弱表现(在具有萘酚羟基蓝的LAMP曲线中)(见图2A-B)。两种样品的曲线的表现也是相同的(两种曲线均在相同的循环量处进入平稳状态)。此结果可确定实时热循环仪可作为读取添加有羟基萘酚蓝的LAMP反应混合物颜色的“非标准”仪器。所述第二步包括验证柠檬酸钠对LAMP反应混合物的颜色变化的影响。具体地,制备了三种LAMP反应混合物,其中,所述三种LAMP反应混合物种添加有羟基萘酚蓝以及浓度依次增加的柠檬酸钠。进行分析的柠檬酸钠的浓度依次为:0.5mM(图3-A)、1mM(图3-B)和1.5mM(图3-C)。三种混合物中添加了相同量的阳性对照(9,000靶)。样品于65℃下温育1小时。三种不同柠檬酸钠浓度的扩增曲线的行为(图3A、3B、3C)表明:混合物中柠檬酸钠的浓度越高,扩增反应开始时测得的信号与扩增结束时的信号间的差距越大。在5mM浓度下反应被抑制。这些结果表明:柠檬酸钠在阳性样品中(即:在核酸被扩增的离心管中),能有效使得反应混合物结束时的颜色趋向天蓝色。此外,已经证实向含有羟基萘酚蓝的LAMP反应混合物中添加柠檬酸钠能提高阴性样品(即:由于核酸未发生扩增,颜色仍为紫罗兰色的样品)和阳性样品(即:由于核酸被扩增,颜色为天蓝色的样品)间的反差。实际上,采用本发明的方法,阳性和阴性样品间的色差[紫罗兰色(阴性)-蓝色(阳性)]比Goto等人不添加柠檬酸钠的方法[深蓝色(阴性)-天蓝色(阳性)更为明确以及易于检测。图1中已经显示了视觉结果,其中,图1A显示出了采用现有技术比色方法的样品,其不包括向LAMP反应混合物中添加羟基萘酚蓝和柠檬酸钠组合物的步骤,而图1B显示了采用本发明方法的样品。显然,当采用Goto等人的方法时(图1A),阳性样品和阴性样品间的色差没有采用本发明的方法(图1B)时明显。实施例2为了证明柠檬酸钠没有抑制LAMP扩增反应,申请人使含有阳性对照(猫血支原体(Mycoplasmahaemofelis)、血巴尔通氏体(CandidatusMycoplasmahaemominutum)、猫血巴尔通氏体(CandidatusMycoplasmaturicensis)、单核细胞增生李斯特菌(Listeriamonocytogene)、钩端螺旋体(Leptospirainterrogans)、荧光假单胞菌(Pseudomonasfluorescens)、细小病毒(Parvovirus)作为对照,已经进行了测试)的样品进行了使用和不使用柠檬酸钠的LAMP扩增反应。具体地,制备了含有4mM和6mM镁以及分别含有和不含1.5mM柠檬酸钠的4个样品。具体地,这些样品是:样品1:LAMP反应混合物含有4mM镁;样品2:LAMP反应混合物含有4mM镁,1.5mM柠檬酸钠;样品3:LAMP反应混合含有6mM镁;样品4:LAMP反应混合物含有6mM镁,1.5mM柠檬酸钠;LAMP于65℃下持续了70分钟,所得到的结果(单位为:分钟)已列于下表中。每一样品都按1:10和1:20稀释进行了测试。从所得到的时间值可知,含有柠檬酸钠的样品具有较低的时间值,也就是说,它们加快了反应。因此,可以推测:柠檬酸钠的加入不会抑制LAMP扩增反应,相反,在某些情况下,这样的加入有利于反应。实施例3支原体属(Mycoplasma)污染的检测为了验证本发明的有效性,通过本发明的方法扩增了从猫全血中提取的DNA样品以验证是否被下述病原体污染:猫血支原体(Mycoplasmahaemofelis)、血巴尔通氏体(CandidatusMycoplasmahaemominutum)和猫血巴尔通氏体(CandidatusMycoplasmaturicensis)。通过商业试剂盒(Macherey-Nagel)从血液样品中提取了DNA。通过本发明的方法以及通过采用PCR已经证实可以检测样品可能的污染。验证了20个样品,且所获得的结果如下所示:采用PCR得到的结果:-血巴尔通氏体(CandidatusMycoplasmahaemominutum):9个阳性样品(其中2个阳性样品也是猫血支原体(Mycoplasmahaemofelis),2个样品也是猫血巴尔通氏体(CandidatusMycoplasmaturicensis));-猫血巴尔通氏体(CandidatusMycoplasmaturicensis):2个阳性样品(其中该2个阳性样品也是血巴尔通氏体(CandidatusMycoplasmahaemominutum));-猫血支原体(Mycoplasmahaemofelis):3个阳性样品(其中2个也是血巴尔通氏体(CandidatusMycoplasmahaemominutum));-阴性样品:10个。采用本发明的方法获得的结果:-血巴尔通氏体(CandidatusMycoplasmahaemominutum):9个阳性样品(其中2个阳性样品也是猫血支原体(Mycoplasmahaemofelis),2个样品也是猫血巴尔通氏体(CandidatusMycoplasmaturicensis));-猫血巴尔通氏体(CandidatusMycoplasmaturicensis):2个阳性样品(其中该2个阳性样品也是血巴尔通氏体(CandidatusMycoplasmahaemominutum));-猫血支原体(Mycoplasmahaemofelis):3个阳性样品(其中2个也是血巴尔通氏体(CandidatusMycoplasmahaemominutum));-阴性样品:10个。采用下述方法对比检测了本发明所获得的结果:a)在热循环仪上实时监控;b)含有和不含柠檬酸钠的羟基萘酚蓝的颜色变化。共进行了20组对照测试。根据本发明的方法,只有当向反应混合物中加入羟基萘酚蓝和柠檬酸钠的组合时,两种检测方法的结果才表现出了100%的一致。单核细胞增生李斯特菌(Listeriamonocytogenes)的污染检测为了检测单核细胞增生李斯特菌(Listeriamonocytogenes),测试了19个从单核细胞增生李斯特菌的细胞培养物种提取的DNA样品。通过商业试剂盒(Macherey-Nagel)从血液样品中提取了DNA。采用下述方法对比检测了本发明所获得的结果:a)在热循环仪上实时监控;b)含有和不含柠檬酸钠的羟基萘酚蓝的颜色变化。共进行了20组对照测试。根据本发明的方法,只有当向反应混合物中加入羟基萘酚蓝和柠檬酸钠的组合时,两种检测方法的结果才表现出了100%的一致。此外,在质粒(具体为pCRTM4-载体作为质粒)上进行了测试,其中,所述质粒中已经引入了被扩增的李斯特基因组的相同区相对应的DNA片段。测试通过一系列不同稀释浓度(以10为基数)的质粒发生LAMP反应的方式进行,并且检测到了2靶/μl(对应于起始质粒以10为基数的第九次稀释)的LAMP测试敏感度。荧光假单胞菌(Pseudomonasfluorescens)的污染检测为了检测荧光假单胞菌的污染,用商业试剂盒(Macherey-Nagel)测试了从荧光假单胞菌的细菌培养物中提取的18个DNA样品。所述样品经过本发明方法的处理,且采用实时监控和颜色变化的方式对发生的扩增进行了检验。结果明确表明:只有本发明的方法能检测所有DNA样品中荧光假单胞菌(Pseudomonasfluorescens)的存在。钩端螺旋体(Leptospira)污染的检测为了检测钩端螺旋体(Leptospira),测试了以商业试剂盒(Macherey-Nagel)从尿液(其阳性已知)中提取的11个DNA样品。以本发明的方法和PCR对所述样品进行了二联检测。结果表明:本发明的方法能检测11种样品中的11种阳性。参考的PCR方法已检测到了11中样品中的11中阳性。本发明的方法可通过肉眼观察使用实时监控以及反应混合物颜色变化的结果。两种可视化方法显示出了100%的结果一致性。细小病毒(Parvovirus)的污染检测为了检测细小病毒(Parvovirus),分析了以商业试剂盒(Macherey-Nagel)从标本(其阳性已知)中提取的9种DNA样品。以PCR以及本发明的方法对样品进行了分析,且结果的重合性得到了验证。最后,以实时监控以及使用混合物颜色的变化对通过本发明的方法扩增后得到的产物进行了检测。结果表明,采用两种不同方法得到的结果显示了100%的一致性。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1