阿法替尼酸加成盐及其晶型、其制备方法及药物组合物与流程
本发明属于药物化学结晶技术领域,具体而言,涉及阿法替尼酸加成盐及其晶型、其制备方法,以及其药物组合物和用途。
背景技术:
阿法替尼的化学名称为N-[4-[(3-氯-4-氟苯基)氨基]-7-[[(3S)-四氢-3-呋喃基]氧基]-6-喹唑啉基]-4-(二甲基氨基)-2-丁烯酰胺,英文名称为AFATINIB,又称为BIBW2992,分子式C24H25ClFN5O3,其结构式如下所示:阿法替尼由德国勃林格殷格翰公司研发,适用于晚期非小细胞肺癌(NSCLC)及HER2阳性的晚期乳腺癌患者,口服片剂,标准剂量为每日一次40mg。现勃林格殷格翰公司正向欧洲药品管理局提交上市许可申请,有望以Tovok上市。阿法替尼为表皮生长因子受体(EGFR亦称ErbBl)和人表皮生长因子受体-2(HER2/neu亦称ErbB2)酪氨酸激酶的强效且选择性双重抑制剂。不同于第一代酪氨酸激酶抑制剂的是,阿法替尼设计为与EGFR及HER2共价结合,从而使其结合的受体分子不可逆失活。专利文献WO2002/50043A1公开了阿法替尼化合物,WO2007/054550A1及WO2007/054551A1公开了阿法替尼的适应症。专利文献WO2005/037824A2(同族专利文献CN1867564B)公开了晶态的阿法替尼二马来酸盐的制备方法。WO2012121764A1公开了阿法替尼二马来酸盐晶型B,DSC图显示其在125.9℃即有放热峰,说明该晶型对热不稳定,会发生转晶甚至分解。WO2013052157A1公开了阿法替尼二马来酸盐晶型C、D、E,该文献称晶型C、D可能是无水物,但无直接证据;晶型C的DSC图显示在40℃-95℃有吸热峰,很可能为溶剂化物;晶型E为水合物,含水5.9%-8.1%,较高的水含量对湿度敏感。经本发明人研究显示,上述阿法替尼二马来酸盐晶型B、C、D、E均有较为严重的吸湿性,不适于储存和制剂应用。专利文献WO2009/147238A1公开了WO2005/037824A2中所述的阿法替尼二马来酸盐是细针状形态,这样会使其流动性较差,不同批次间的差异较大,可加工性也较差,且容易粘冲,不可直压。故专利文献WO2009/147238A1采用辊压法来改善由于原料的针状形貌而带来的难以加工的问题,但采用辊压法会增加辊压粉碎的单元操作,从而增加生产成本。为了方便,在本申请中将WO2005/037824A2中所述的阿法替尼二马来酸盐称为“阿法替尼二马来酸盐现有技术晶型”。专利文献WO2012121764A1公开了固态形式的阿法替尼酸加成盐的制备方法,包括阿法替尼的二马来酸盐、二苯磺酸盐、富马酸盐、二硫酸盐、二盐酸盐、二草酸盐、甲磺酸盐、二磷酸盐、二L-苹果酸盐、柠檬酸盐、二丁二酸盐、L-天冬氨酸盐和二反丁烯二酸盐。该文献只是泛泛提及上述阿法替尼酸加成盐具有适合片剂应用的一些有益性质,但没有提供具体数据。专利文献CN1867564B公开了阿法替尼二马来酸盐现有技术晶型有一定的吸湿性,但没有具体数据,经本发明人的研究显示,阿法替尼二马来酸盐现有技术晶型晶型在10%-80%相对湿度范围内重量变化为2.6%。较佳地,医药活性物质应该仅具有有限的吸湿性,较高的吸湿性往往带来不利的影响。例如,在制造期间,水分的吸收降低了药物活性物质的含量,影响制剂工艺,影响制剂的均一性;在储藏时必须采取防潮措施,例如加入干燥剂或者储存在防潮环境中,增加了成本,还有长期储存稳定性变差的风险。因此,需开发具有更多优越性能的,尤其是可采用粉末直压法和不易吸湿的阿法替尼酸加成盐及其晶型。
技术实现要素:
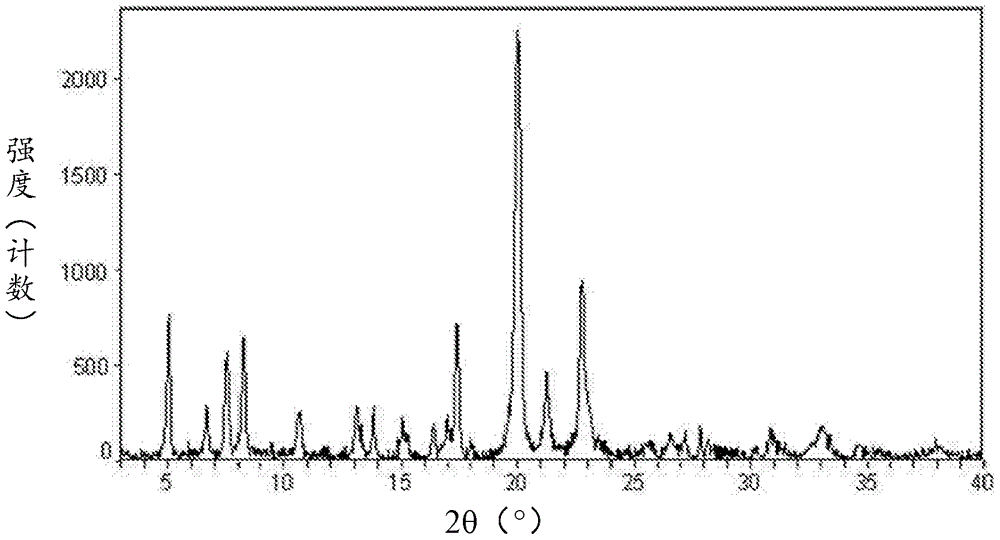
针对现有技术的不足,本发明提供了可药用的阿法替尼酸加成盐及其晶型,包括其乙二磺酸盐、1,5-萘二磺酸盐、丙二酸盐、二丙二酸盐、二2-萘磺酸盐、二氨基磺酸盐、二D-葡萄糖酸盐、甘醇酸盐、二环己烷氨基磺酸盐、二4-氨基苯磺酸盐、以及上述新型的盐的晶型,还包括了阿法替尼二马来酸盐的一种新晶型。与现有技术的阿法替尼酸加成盐或其晶型相比,本发明的阿法替尼酸加成盐及其晶型具有一种或多种的改进性能。本发明进一步提供了本发明的阿法替尼酸加成盐及其晶型的制备方法、其药物组合物和用途。本发明的内容之一是提供阿法替尼乙二磺酸盐及其晶型、以及它们的制备方法。经HPLC检测,所述阿法替尼乙二磺酸盐中阿法替尼游离碱的实际含量为71.4%(不计溶剂的量),阿法替尼和乙二磺酸以1:1摩尔比形成的化合物中阿法替尼的理论含量71.9%,因此本发明所述阿法替尼乙二磺酸盐中阿法替尼和乙二磺酸以1:1摩尔比成盐,其结构式如下:所述阿法替尼乙二磺酸盐的制备方法,包括以下步骤:分别形成阿法替尼和乙二磺酸在可溶溶剂中的溶液体系,阿法替尼和乙二磺酸的摩尔比1:1-1:2,混合两个体系形成浆液,然后除去可溶溶剂。优选所述可溶溶剂为腈类、醇类、酮类、酯类、烷烃类、醚类或其混合物;所述可溶溶剂进一步优选为乙腈、甲醇、丙酮、乙酸乙酯、正庚烷或甲基叔丁基醚。优选采用旋干法除去可溶溶剂。优选地,所述阿法替尼乙二磺酸盐为E1晶型阿法替尼乙二磺酸盐,使用Cu-Kα辐射,其X射线粉末衍射图谱在衍射角2θ为6.3±0.2°、7.0±0.2°、17.6±0.2°、17.8±0.2°、21.7±0.2°、22.8±0.2°和24.6±0.2°处具有特征峰。进一步地,所述E1晶型阿法替尼乙二磺酸盐,其X射线粉末衍射图谱在衍射角2θ为6.3±0.2°、7.0±0.2°、12.6±0.2°、14.5±0.2°、17.6±0.2°、17.8±0.2°、18.3±0.2°、19.0±0.2°、21.7±0.2°、22.8±0.2°、24.6±0.2°、26.3±0.2°和28.6±0.2°处具有特征峰。更进一步地,所述E1晶型阿法替尼乙二磺酸盐,其X射线粉末衍射图的衍射角2θ特征峰及其相对强度如下:。非限制性地,所述E1晶型阿法替尼乙二磺酸盐的一个典型实例具有如图6所示的X射线粉末衍射图谱。所述E1晶型阿法替尼乙二磺酸盐,其傅里叶红外光谱在波数为1501、1454、1227、1206、1168、1023和767cm-1处具有特征峰。所述E1晶型阿法替尼乙二磺酸盐,其拉曼光谱在波数为1661、1610、1551、1406、1379、1297和1207cm-1处具有特征峰。所述E1晶型阿法替尼乙二磺酸盐的一种制备方法,包括以下步骤:分别形成阿法替尼和乙二磺酸在可溶溶剂中的溶液体系,阿法替尼和乙二磺酸的摩尔比1:1-1:2,混合两个体系形成浆液并搅拌,在-10-50℃下保持1-48小时,然后除去溶剂,其中所述可溶溶剂选自C2-C4腈、C1-C4醇、C3-C5酮、C4-C5酯、C6-C9烷烃、C4-C6醚或其混合物。所述C2-C4腈包括但不限于乙腈,所述C1-C4醇包括但不限于甲醇、乙醇、正丙醇、异丙醇、正丁醇和仲丁醇,所述C3-C5酮包括但不限于丙酮和丁酮,所述C4-C5酯包括但不限于乙酸乙酯和乙酸异丙酯,所述C6-C9烷烃包括但不限于正己烷、正庚烷和甲基环己烷,所述C4-C6醚包括但不限于乙醚、甲基叔丁基醚和异丙醚;优选所述可溶溶剂为乙腈、甲醇、丙酮、乙酸乙酯、正庚烷、甲基叔丁基醚或其混合物,更优选为乙腈。优选阿法替尼在可溶溶剂中的浓度为10毫克/毫升至该溶剂下阿法替尼的饱和溶液。优选阿法替尼和乙二磺酸的摩尔为1:1-1:2。优选所述制备方法的操作温度为室温。所述E1晶型阿法替尼乙二磺酸盐的另一种制备方法,包括以下步骤:将前述方法制备得到的阿法替尼乙二磺酸盐在有机溶剂中形成浆液并搅拌,浆液在-10-50℃下保持1~72小时,进而除去溶剂,其中所述有机溶剂选自乙腈、甲醇、丙酮、乙酸乙酯、正庚烷、甲基叔丁基醚或其混合物。优选所述制备方法的操作温度为室温。与现有技术比较,尤其与现有技术的阿法替尼二马来酸盐或其晶型比较,阿法替尼乙二磺酸盐或E1晶型阿法替尼乙二磺酸盐具有一种或多种改进的特性,例如:更高的结晶度、较好的溶解度、溶解速度、较佳的结晶形态、较好的热稳定性和贮存稳定性、较低的吸湿性、较好的可流动性和有利的加工与处理特性。特别是E1晶型阿法替尼乙二磺酸盐具有以下有益性质:1)室温下水中溶解度为55.7mg/ml,相对于阿法替尼二马来酸盐现有技术晶型在相同条件下的溶解度7.5mg/ml,具有更高的溶解性;2)室温下10%-80%相对湿度范围内吸湿1.4%,相对于阿法替尼二马来酸盐现有技术晶型在相同条件下吸湿2.6%,具有更小的吸湿性;3)分解温度为261.8℃,相对于阿法替尼二马来酸盐现有技术晶型的分解温度164.1℃,具有更高的热稳定性;4)为颗粒状晶体,相对于阿法替尼二马来酸盐现有技术晶型为针状晶体,具有更好的流动性、可压性和可加工性。上述有益性质表明,与现有技术的阿法替尼二马来酸盐或其晶型相比,本发明的阿法替尼乙二磺酸盐或E1晶型阿法替尼乙二磺酸盐具有多种优势性能,应用效果可更好,适合作为药物制剂的活性成分。活性成分更高的溶解性有利于提高药物的生物利用度,进而对药效产生积极影响;活性成分的结晶形貌佳,具有更好的流动性、可压性和可加工性,对制剂工艺的适宜性好;活性成分具有更低的吸湿性和更高的热稳定性,能够更好地对抗药物制造和/或存储等过程中由环境温度、湿度等因素引起的活性成分含量不均匀、纯度降低和杂质增加等问题,降低由此带来的疗效下降风险和安全风险,并有利于药物制造中的准确定量、提高制剂均一性以及后期的储存和运输。本发明的内容之二是提供阿法替尼1,5-萘二磺酸盐及其晶型、以及它们的制备方法。经HPLC检测,所述阿法替尼1,5-萘二磺酸盐中阿法替尼游离碱的实际含量为63.3%(不计溶剂的量),阿法替尼和1,5-萘二磺酸以1:1摩尔比形成的化合物中阿法替尼的理论含量为62.8%,因此本发明所述阿法替尼1,5-萘二磺酸盐中阿法替尼和1,5-萘二磺酸以1:1摩尔比成盐,其结构式如下:所述阿法替尼1,5-萘二磺酸盐的制备方法,包括以下步骤:分别形成阿法替尼和1,5-萘二磺酸在可溶溶剂中的溶液体系,阿法替尼和1,5-萘二磺酸的摩尔比为1:1-1:2,混合两个体系形成浆液,然后除去可溶溶剂。优选所述可溶溶剂为腈类、醇类、酮类、酯类、烷烃类、醚类或其混合物;所述可溶溶剂进一步优选为乙腈、甲醇、丙酮、乙酸乙酯、正庚烷或甲基叔丁基醚。优选采用旋干法除去可溶溶剂。优选地,所述阿法替尼1,5-萘二磺酸盐为N1晶型阿法替尼1,5-萘二磺酸盐,使用Cu-Kα辐射,其X射线粉末衍射图谱在衍射角2θ为6.6±0.2°、13.4±0.2°、16.6±0.2°、17.5±0.2°、20.8±0.2°和24.2±0.2°处具有特征峰。进一步地,所述N1晶型阿法替尼1,5-萘二磺酸盐,其X射线粉末衍射图谱在衍射角2θ为6.6±0.2°、8.1±0.2°、13.4±0.2°、14.8±0.2°、16.3±0.2°、16.6±0.2°、17.5±0.2°、18.3±0.2°、20.8±0.2°、22.0±0.2°、22.7±0.2°和24.2±0.2°处具有特征峰。更进一步地,所述N1晶型阿法替尼1,5-萘二磺酸盐,其X射线粉末衍射图的衍射角2θ特征峰及其相对强度如下:。非限制性地,所述N1晶型阿法替尼1,5-萘二磺酸盐的一个典型实例具有如图13所示的X射线粉末衍射图谱。所述N1晶型阿法替尼1,5-萘二磺酸盐,其傅里叶红外光谱在波数为1639、1577、1524、1500、1452、1216、1155、1028和765cm-1处具有特征峰。所述N1晶型阿法替尼1,5-萘二磺酸盐,其拉曼光谱在波数为1704、1661、1613、1543、1403、1365、1205、1068、999和780cm-1处具有特征峰。所述N1晶型阿法替尼1,5-萘二磺酸盐的一种制备方法,包括以下步骤:分别形成阿法替尼和1,5-萘二磺酸在可溶溶剂中的溶液体系,阿法替尼和1,5-萘二磺酸的摩尔比为1:1-1:2,混合两个体系形成浆液并搅拌,在-10-50℃下保持1-48小时,然后除去溶剂,其中所述可溶溶剂选自C2-C4腈、C1-C4醇、C3-C5酮、C4-C5酯、C6-C9烷烃、C4-C6醚或其混合物。所述C2-C4腈包括但不限于乙腈,所述C1-C4醇包括但不限于甲醇、乙醇、正丙醇、异丙醇、正丁醇和仲丁醇,所述C3-C5酮包括但不限于丙酮和丁酮,所述C4-C5酯包括但不限于乙酸乙酯和乙酸异丙酯,所述C6-C9烷烃包括但不限于正己烷、正庚烷和甲基环己烷,所述C4-C6醚包括但不限于乙醚、甲基叔丁基醚和异丙醚;优选所述可溶溶剂为乙腈、甲醇、乙醇、丙酮、乙酸乙酯、正庚烷、甲基叔丁基醚或其混合物;更优选分别形成阿法替尼的乙腈溶液和1,5-萘二磺酸的乙醇溶液。优选阿法替尼在可溶溶剂中的浓度为10毫克/毫升至该溶剂下阿法替尼的饱和溶液。优选阿法替尼和1,5-萘二磺酸的摩尔比为1:1-1:1.5。优选所述制备方法的操作温度为室温。所述N1晶型阿法替尼1,5-萘二磺酸盐的另一种制备方法,包括以下步骤:将按照前述制备方法制得的阿法替尼1,5-萘二磺酸盐在有机溶剂中形成浆液并搅拌,该浆液在-10-50℃下保持1~72小时,进而除去溶剂,其中所述有机溶剂选自甲醇、乙醇、乙腈、丙酮、乙酸乙酯、正庚烷、甲基叔丁基醚或其混合物。优选所述制备方法的操作温度为室温。优选地,所述阿法替尼1,5-萘二磺酸盐为N2晶型阿法替尼1,5-萘二磺酸盐水合物。使用Cu-Kα辐射,所述N2晶型阿法替尼1,5-萘二磺酸盐水合物的X射线粉末衍射图谱在衍射角2θ为6.7±0.2°、8.1±0.2°、9.3±0.2°、14.9±0.2°、20.9±0.2°和23.0±0.2°处具有特征峰。进一步地,所述N2晶型阿法替尼1,5-萘二磺酸盐水合物,其X射线粉末衍射图谱在衍射角2θ为6.7±0.2°、8.1±0.2°、9.3±0.2°、13.9±0.2°、14.9±0.2°、15.8±0.2°、16.7±0.2°、17.5±0.2°、20.5±0.2°、20.9±0.2°、21.7±0.2°、23.0±0.2°、24.1±0.2°和24.3±0.2°处具有特征峰。更进一步地,所述N2晶型阿法替尼1,5-萘二磺酸盐水合物,其X射线粉末衍射图的衍射角2θ特征峰及其相对强度如下:。非限制性地,所述N2晶型阿法替尼1,5-萘二磺酸盐水合物的一个典型实例具有如图20所示的X射线粉末衍射图谱。所述N2晶型阿法替尼1,5-萘二磺酸盐水合物,其热重分析(TGA)图谱显示100℃之前有5.97%的失重,约合为三水合物。所述N2晶型阿法替尼1,5-萘二磺酸盐水合物,其傅里叶红外光谱在波数为1641、1578、1500、1451、1219、1155、1028和764cm-1处具有特征峰。所述N2晶型阿法替尼1,5-萘二磺酸盐水合物,其拉曼光谱在波数为1654、1610、1549、1400、1371、1297、1216、997和781cm-1处具有特征峰。所述N2晶型阿法替尼1,5-萘二磺酸盐水合物的制备方法,包括以下步骤:将N1型阿法替尼1,5-萘二磺酸盐放置在75%-100%相对湿度的室温环境中,放置时间1~7天。优选放置在75%-85%相对湿度的室温环境中,放置时间1~3天。与现有技术比较,尤其是与现有技术的阿法替尼二马来酸盐或其晶型比较,阿法替尼1,5-萘二磺酸盐或N1晶型阿法替尼1,5-萘二磺酸盐或N2晶型阿法替尼1,5-萘二磺酸盐水合物具有一种或多种改进的特性,例如:更高的结晶度、较好的溶解度、溶解速度、较佳的结晶形态、较好的热稳定性和贮存稳定性、较低的吸湿性、较好的可流动性和有利的加工与处理特性。特别是N1晶型阿法替尼1,5-萘二磺酸盐具有以下有益性质:1)分解温度为276.3℃,相对于阿法替尼二马来酸盐现有技术晶型的分解温度164.1℃,具有更高的热稳定性;2)为较为规则的颗粒状晶体,相对于阿法替尼二马来酸盐现有技术晶型的针状晶体,具有更好的流动性、可压性和可加工性;特别是N2晶型阿法替尼1,5-萘二磺酸盐水合物具有以下有益性质:1)室温下在30-80%相对湿度下吸湿1.80%,相对于阿法替尼二马来酸盐现有技术晶型在相同条件下吸湿2.2%,具有更低的吸湿性;2)分解温度为275.4℃,相对于阿法替尼二马来酸盐现有技术晶型的分解温度164.1℃,具有更高的热稳定性;3)为较为规则的颗粒状晶体,相对于阿法替尼二马来酸盐现有技术晶型的针状晶体,具有更好的流动性、可压性和可加工性。上述有益性质表明,与现有技术的阿法替尼二马来酸盐或其晶型相比,本发明的阿法替尼1,5-萘二磺酸盐或N1晶型阿法替尼1,5-萘二磺酸盐或N2晶型阿法替尼1,5-萘二磺酸盐水合物具有多种优势性能,应用效果可更好,适合作为药物制剂的活性成分。活性成分的结晶形貌佳,具有更好的流动性、可压性和可加工性,对制剂工艺的适宜性好;活性成分具有更低的吸湿性和更高的热稳定性,能够更好地对抗药物制造和/或存储等过程中由环境温度、湿度等因素引起的活性成分含量不均匀、纯度降低和杂质增加等问题,降低由此带来的疗效下降风险和安全风险,并有利于药物制造中的准确定量、提高制剂均一性以及后期的储存和运输。本发明的内容之三是提供阿法替尼一丙二酸盐及其晶型、以及它们的制备方法。经HPLC检测,所述阿法替尼一丙二酸盐中阿法替尼游离碱的实际含量为83.0%(不计溶剂的量),阿法替尼和丙二酸以1:1摩尔比形成的化合物中阿法替尼的理论含量为82.4%,因此本发明所述阿法替尼一丙二酸盐中阿法替尼和丙二酸是以1:1摩尔比成盐,其结构式如下:所述阿法替尼一丙二酸盐的制备方法,包括以下步骤:分别形成阿法替尼和丙二酸在可溶溶剂中的溶液体系,阿法替尼和丙二酸的摩尔比1:1-1:1.5,混合两个体系形成浆液,然后除去溶剂。优选所述可溶溶剂为醚类溶剂;更优选为C4-C5醚,所述C4-C5醚包括但不限于乙醚、甲基叔丁基醚和异丙醚;最优选为甲基叔丁基醚。优选采用旋干法除去溶剂。优选地,所述阿法替尼一丙二酸盐为M1晶型阿法替尼一丙二酸盐,使用Cu-Kα辐射,其X射线粉末衍射图谱在衍射角2θ为6.6±0.2°、7.2±0.2°、13.2±0.2°、13.4±0.2°、17.3±0.2°、20.8±0.2°和25.1±0.2°处具有特征峰。进一步地,所述M1晶型阿法替尼一丙二酸盐,其X射线粉末衍射图谱在衍射角2θ为6.6±0.2°、7.2±0.2°、8.7±0.2°、13.2±0.2°、13.4±0.2°、14.3±0.2°、17.3±0.2°、18.0±0.2°、19.7±0.2°、20.8±0.2°、21.4±0.2°、25.1±0.2°和26.1±0.2°处具有特征峰。更进一步地,所述M1晶型阿法替尼一丙二酸盐,其X射线粉末衍射图的衍射角2θ特征峰及其相对强度如下:。非限制性地,所述M1晶型阿法替尼一丙二酸盐的一个典型实例具有如图25所示的X射线粉末衍射图谱。所述M1晶型阿法替尼一丙二酸盐,其傅里叶红外光谱在波数为1693、1628、1499、1454、1363、1213、1155、1063和749cm-1处具有特征峰。所述M1晶型阿法替尼一丙二酸盐,其拉曼光谱在波数为1657、1609、1544、1397、1369、1343、1301、1204和780cm-1处具有特征峰。所述M1晶型阿法替尼一丙二酸盐的一种制备方法,包括以下步骤:分别形成阿法替尼和丙二酸在C4-C5醚中的溶液体系,阿法替尼和丙二酸的摩尔比1:1-1:1.5,混合两个体系形成浆液并搅拌,在-10-50℃下保持1-48小时,然后除去溶剂。所述C4-C5醚包括但不限于乙醚、甲基叔丁基醚和异丙醚,优选为甲基叔丁基醚。优选阿法替尼在C4-C5醚中的浓度为10毫克/毫升至该溶剂下阿法替尼的饱和溶液。优选所述制备方法的操作温度为室温,所述M1晶型阿法替尼一丙二酸盐的另一种制备方法,包括以下步骤:将前述方法制成的阿法替尼一丙二酸盐在有机溶剂中形成浆液并搅拌,该浆液在-10-50℃下保持1~72小时,进而除去该溶剂,其中所述有机溶剂选自甲醇、丙酮、乙腈、甲基叔丁基醚、乙酸乙酯、正庚烷或其混合物。优选所述制备方法的操作温度为室温。与现有技术比较,尤其是与已知的阿法替尼二马来酸盐或其晶型比较,阿法替尼一丙二酸盐或M1晶型阿法替尼一丙二酸盐具有一种或多种改进的特性,例如:更高的结晶度、较好的溶解度、溶解速度、较佳的结晶形态、较好的热稳定性和贮存稳定性、较低的吸湿性、较好的可流动性和有利的加工与处理特性。特别是M1晶型阿法替尼一丙二酸盐具有以下有益性质:1)室温下水中的溶解度为40.8mg/ml,相对于阿法替尼二马来酸盐现有技术晶型在相同条件下的溶解度7.5mg/ml,具有更高的溶解性;2)为较为规则的颗粒状,相对于阿法替尼二马来酸盐现有技术晶型的针状晶体,具有更好的流动性、可压性和可加工性。上述有益性质表明,与现有技术的阿法替尼二马来酸盐或其晶型相比,本发明的阿法替尼一丙二酸盐或M1晶型阿法替尼一丙二酸盐具有多种优势性能,应用效果可更好,适合作为药物制剂的活性成分。活性成分更高的溶解性有利于提高药物的生物利用度,进而对药效产生积极影响;活性成分的结晶形貌佳,具有更好的流动性、可压性和可加工性,对制剂工艺的适宜性好。本发明的内容之四是提供阿法替尼二丙二酸盐及其晶型、以及它们的制备方法。经HPLC检测,所述阿法替尼二丙二酸盐中阿法替尼游离碱的实际含量为70.2%(不计溶剂的量),阿法替尼和丙二酸以1:2摩尔比形成的化合物中阿法替尼的理论含量为70.0%,因此本发明所述阿法替尼二丙二酸盐中阿法替尼和丙二酸以1:2摩尔比成盐,其结构式如下:所述阿法替尼二丙二酸盐的制备方法,包括以下步骤:分别形成阿法替尼和丙二酸在可溶溶剂中的溶液体系,阿法替尼和丙二酸的摩尔比1:2-1:4,混合两个体系形成浆液,然后除去溶剂。优选所述可溶溶剂为酯类溶剂;进一步优选所述可溶溶剂为C4-C5酯,所述C4-C5酯包括但不限于乙酸乙酯、乙酸异丙酯;更优选为乙酸乙酯。优选采用旋干法除去溶剂。优选地,所述阿法替尼二丙二酸盐为M2晶型阿法替尼二丙二酸盐,使用Cu-Kα辐射,其X射线粉末衍射图谱在衍射角2θ为6.5±0.2°、8.1±0.2°、13.1±0.2°、16.1±0.2°、20.8±0.2°和25.8±0.2°处具有特征峰。进一步地,所述M2晶型阿法替尼二丙二酸盐,其X射线粉末衍射图谱在衍射角2θ为6.5±0.2°、8.1±0.2°、9.7±0.2°、10.9±0.2°、13.1±0.2°、14.0±0.2°、16.1±0.2°、18.3±0.2°、19.0±0.2°、20.8±0.2°、25.8±0.2°和27.0±0.2°处具有特征峰。更进一步地,所述M2晶型阿法替尼二丙二酸盐,其X射线粉末衍射图的衍射角2θ特征峰及其相对强度如下:。非限制性地,所述M2晶型阿法替尼二丙二酸盐的一个典型实例具有如图31所示的X射线粉末衍射图谱。所述M2晶型阿法替尼二丙二酸盐,其傅里叶红外光谱在波数为1694、1630、1501、1455、1364、1262、1214、1064、892和749cm-1处具有特征峰。所述M2晶型阿法替尼二丙二酸盐,其拉曼光谱在波数为1658、1621、1607、1545、1491、1397、1301、1205和781cm-1处具有特征峰。所述M2晶型阿法替尼二丙二酸盐的一种制备方法,包括以下步骤:分别形成阿法替尼和丙二酸在C4-C5酯中的溶液体系,阿法替尼和丙二酸的摩尔比1:2-1:4,混合两个体系形成浆液并搅拌,在-10-50℃下保持1-48小时,然后除去溶剂;或者,分别形成阿法替尼一丙二酸盐在C4-C5酯中的混悬液体系和丙二酸在C4-C5酯中的溶液体系,阿法替尼一丙二酸盐和丙二酸的摩尔比为1:1-1:2,混合两个体系形成浆液并搅拌,在-10-50℃下保持1-48小时,然后除去溶剂。所述C4-C5酯包括但不限于乙酸乙酯、乙酸异丙酯,优选所述C4-C5酯为乙酸乙酯。优选阿法替尼在C4-C5酯中的浓度10毫克/毫升至该溶剂下阿法替尼的饱和溶液。优选阿法替尼和丙二酸的摩尔比为1:2-1:3。优选阿法替尼一丙二酸盐和丙二酸的摩尔比为1:1-1:1.5。优选所述制备方法的操作温度为室温。所述M2晶型阿法替尼二丙二酸盐的另一种制备方法,包括以下步骤:将前述制备方法得到的阿法替尼二丙二酸酸盐在有机溶剂形成浆液并搅拌,该浆液在-10-50℃下保持1~72小时,进而除去溶剂,所述有机溶剂选自甲醇、丙酮、乙腈、甲基叔丁基醚、乙酸乙酯、正庚烷或其混合物。优选所述制备方法的操作温度为室温。与现有技术比较,尤其是与现有技术的阿法替尼二马来酸盐或其晶型比较,阿法替尼二丙二酸盐或M2晶型阿法替尼二丙二酸盐具有一种或多种改进的特性,例如:更高的结晶度、较好的溶解度、溶解速度、较佳的结晶形态、较好的热稳定性和贮存稳定性、较低的吸湿性、较好的可流动性和有利的加工与处理特性。特别是M2晶型阿法替尼二丙二酸盐具有以下有益性质:1)室温下水中的溶解度为26.2mg/ml,相对于阿法替尼二马来酸盐现有技术晶型在相同条件下的溶解度7.5mg/ml,具有更高的溶解性。2)室温、10-80%相对湿度下的吸湿为1.1%,相对于阿法替尼二马来酸盐现有技术晶型在相同条件下吸湿2.6%,具有更低的吸湿性。上述有益性质表明,与现有技术的阿法替尼二马来酸盐或其晶型相比,本发明的阿法替尼二丙二酸盐或M2晶型阿法替尼二丙二酸盐具有多种优势性能,应用效果可更好,适合作为药物制剂的活性成分。活性成分更高的溶解性有利于提高药物的生物利用度,进而对药效产生积极影响;活性成分具有更低的吸湿性,能够更好地对抗药物制造和/或存储等过程中由环境湿度引起的活性成分含量不均匀、纯度降低和杂质增加等问题,降低由此带来的疗效下降风险和安全风险,并有利于药物制造中的准确定量、提高制剂均一性以及后期的储存和运输。本发明的内容之五是提供阿法替尼二2-萘磺酸盐及其晶型、以及它们的制备方法。经HPLC检测,所述阿法替尼二2-萘磺酸盐中阿法替尼游离碱的实际含量为55.0%(不计溶剂的量),阿法替尼和2-萘磺酸以1:2摩尔比形成的化合物中阿法替尼的理论含量为53.9%,因此本发明所述阿法替尼二2-萘磺酸盐中阿法替尼和2-萘磺酸以1:2摩尔比成盐,其结构式如下:所述阿法替尼二2-萘磺酸盐的制备方法,包括以下步骤:分别形成阿法替尼和2-萘磺酸在可溶溶剂中的溶液体系,阿法替尼和2-萘磺酸的摩尔比为1:2-1:4,混合两个体系形成浆液,然后除去溶剂。优选所述可溶溶剂为醇类、酮类、酯类、烷烃类、醚类或其混合物;进一步优选为甲醇、丙酮、乙酸乙酯、正庚烷或甲基叔丁基醚。优选采用旋干法除去溶剂。优选地,所述阿法替尼二2-萘磺酸盐为Ns1晶型阿法替尼二2-萘磺酸盐,使用Cu-Kα辐射,其X射线粉末衍射图谱在衍射角2θ为5.6±0.2°、24.0±0.2°和26.8±0.2°处具有特征峰。进一步地,所述Ns1晶型阿法替尼二2-萘磺酸盐,其X射线粉末衍射图的衍射角2θ特征峰及其相对强度如下:。非限制性地,所述Ns1晶型阿法替尼二2-萘磺酸盐的一个典型实例具有如图37所示的X射线粉末衍射图谱。所述Ns1晶型阿法替尼二2-萘磺酸盐,其傅里叶红外光谱在波数为1627、1536、1498、1427、1211、1090、1030和675cm-1处具有特征峰。所述Ns1晶型阿法替尼二2-萘磺酸盐,其拉曼光谱在波数为1650、1628、1610、1581、1501、1386、1355、1211、1021和771cm-1处具有特征峰。所述Ns1晶型阿法替尼二2-萘磺酸盐的一种制备方法,包括以下步骤:分别形成阿法替尼和2-萘磺酸在可溶溶剂中的溶液体系,阿法替尼和2-萘磺酸的摩尔比为1:2-1:4,混合两个体系形成浆液并搅拌,在-10-50℃下保持1-48小时,然后除去溶剂,其中所述可溶溶剂选自C1-C4醇、C3-C5酮、C4-C5酯、C6-C9烷烃、C4-C6醚或其混合物。所述C1-C4醇包括但不限于甲醇、乙醇、正丙醇、异丙醇、正丁醇和仲丁醇,所述C3-C5酮包括但不限于丙酮和丁酮,所述C4-C5酯包括但不限于乙酸乙酯和乙酸异丙酯,所述C6-C9烷烃包括但不限于正己烷、正庚烷和甲基环己烷,所述C4-C6醚包括但不限于乙醚、异丙醚和甲基叔丁基醚;优选所述可溶溶剂为甲醇、丙酮、乙酸乙酯、正庚烷、甲基叔丁基醚或其混合物;更优选为乙酸乙酯。优选阿法替尼在可溶溶剂中的浓度为10毫克/毫升至该溶剂下阿法替尼的饱和溶液。优选阿法替尼和2-萘磺酸的摩尔比为1:2-1:3。优选所述制备方法的操作温度为室温。所述Ns1晶型阿法替尼二2-萘磺酸盐的另一种制备方法,包括以下步骤:将前述制备方法得到的阿法替尼二2-萘磺酸盐在有机溶剂中形成浆液并搅拌,该浆液在-10-50℃下保持1~72小时,进而除去溶剂,其中所述有机溶剂选自甲醇、丙酮、乙腈、乙酸乙酯、正庚烷、甲基叔丁基醚或其混合物。优选所述制备方法的操作温度为室温。与现有技术比较,尤其是与现有技术的阿法替尼二马来酸盐或其晶型比较,阿法替尼二2-萘磺酸盐或Ns1晶型阿法替尼二2-萘磺酸盐具有一种或多种改进的特性,例如:更高的结晶度、较好的溶解度、溶解速度、较佳的结晶形态、较好的热稳定性和贮存稳定性、较低的吸湿性、较好的可流动性和有利的加工与处理特性。特别是Ns1晶型阿法替尼二2-萘磺酸具有以下有益性质:其分解温度为249.1℃,相对于阿法替尼二马来酸盐现有技术晶型的分解温度164.1℃,具有更高的热稳定性。上述有益性质表明,与现有技术的阿法替尼二马来酸盐或其晶型相比,本发明的阿法替尼二2-萘磺酸或Ns1晶型阿法替尼二2-萘磺酸具有多种优势性能,应用效果可更好,适合作为药物制剂的活性成分。活性成分具有更高的热稳定性,能够更好地对抗药物制造和/或存储等过程中由环境温度等因素引起的活性成分含量不均匀、纯度降低和杂质增加等问题,降低由此带来的疗效下降风险和安全风险,并有利于药物制造中的准确定量、提高制剂均一性以及后期的储存和运输。本发明的内容之六是提供阿法替尼二氨基磺酸盐及其晶型、以及它们的制备方法。经HPLC检测,所述阿法替尼二氨基磺酸盐中阿法替尼游离碱的实际含量为70.9%(不计溶剂的量),阿法替尼和氨基磺酸以1:2摩尔比形成的化合物中阿法替尼的理论含量为71.5%,因此本发明所述阿法替尼二氨基磺酸盐中阿法替尼和氨基磺酸以1:2摩尔比成盐,其结构式如下:所述阿法替尼二氨基磺酸盐的制备方法,包括以下步骤:分别形成阿法替尼可溶溶剂中的溶液体系和氨基磺酸在有机溶剂中的混悬液体系,阿法替尼和氨基磺酸的摩尔比为1:2-1:4,混合两个体系形成浆液,然后除去溶剂。优选所述可溶溶剂或有机溶剂为腈类、醇类、酮类、酯类、烷烃类、醚类或其混合物;进一步优选为乙腈、甲醇、丙酮、乙酸乙酯、正庚烷或甲基叔丁基醚。优选采用旋干法除去溶剂。优选地,所述阿法替尼二氨基磺酸盐为S1晶型的阿法替尼二氨基磺酸盐,使用Cu-Kα辐射,其X射线粉末衍射图谱在衍射角2θ为5.3±0.2°、10.7±0.2°、13.2±0.2°、21.5±0.2°、22.3±0.2°、25.5±0.2°和26.1±0.2°处具有特征峰。进一步地,所述S1晶型阿法替尼二氨基磺酸盐,其X射线粉末衍射图谱在衍射角2θ为5.3±0.2°、10.7±0.2°、11.0±0.2°、12.3±0.2°、13.2±0.2°、13.6±0.2°、17.1±0.2°、20.2±0.2°、21.5±0.2°、22.3±0.2°、25.5±0.2°和26.1±0.2°处具有特征峰。更进一步地,所述S1晶型阿法替尼二氨基磺酸盐,其X射线粉末衍射图的衍射角2θ特征峰及其相对强度如下:。非限制性地,所述S1晶型阿法替尼二氨基磺酸盐的一个典型实例具有如图42所示的X射线粉末衍射图谱。所述S1晶型阿法替尼二氨基磺酸盐,其傅里叶红外光谱在波数为1640、1575、1528、1497、1450、1233、1159、1042和776cm-1处具有特征峰。所述S1晶型阿法替尼二氨基磺酸盐,其拉曼光谱在波数为1656、1606、1548、1490、1401、1374、1297、1215和782cm-1处具有特征峰。所述S1晶型阿法替尼二氨基磺酸盐的一种制备方法,包括以下步骤:分别形成阿法替尼在可溶溶剂中的溶液体系和氨基磺酸在有机溶剂中的混悬液体系,阿法替尼和氨基磺酸的摩尔比为1:2-1:4,混合两个体系形成浆液并搅拌,在-10-50℃下保持1-48小时,进而除去溶剂,其中所述可溶溶剂或有机溶剂选自C2-C4腈、C1-C4醇、C3-C5酮、C4-C5酯、C6-C9烷烃、C4-C6醚或其混合物。所述C2-C4腈包括但不限于乙腈,所述C1-C4醇包括但不限于甲醇、乙醇、正丙醇、异丙醇、正丁醇和仲丁醇,所述C3-C5酮包括但不限于丙酮和丁酮,所述C4-C5酯包括但不限于乙酸乙酯和乙酸异丙酯,所述C6-C9烷烃包括但不限于正己烷、正庚烷和甲基环己烷,所述C4-C6醚包括但不限于乙醚、异丙醚和甲基叔丁基醚;优选所述可溶溶剂或有机溶剂为乙腈、甲醇、丙酮、乙酸乙酯、正庚烷、甲基叔丁基醚或其混合物;更优选为乙腈或乙酸乙酯。优选阿法替尼在可溶溶剂中的浓度为10毫克/毫升至该溶剂下阿法替尼的饱和溶液。优选阿法替尼和氨基磺酸的摩尔比为1:2-1:3。优选所述制备方法的操作温度为室温。所述S1晶型阿法替尼二氨基磺酸盐的另一种制备方法,包括以下步骤:将前述方法制成的阿法替尼二氨基磺酸盐在有机溶剂中形成浆液并搅拌,该浆液在-10-50℃下保持1~72小时,进而除去溶剂,其中所述有机溶剂选自甲醇、丙酮、乙腈、乙酸乙酯、正庚烷、甲基叔丁基醚或其混合物。优选所述制备方法的操作温度为室温。与现有技术比较,尤其是与已知的阿法替尼二马来酸盐或其晶型比较,阿法替尼二氨基磺酸盐或S1晶型阿法替尼二氨基磺酸盐具有一种或多种改进的特性,例如:更高的结晶度、较好的溶解度、溶解速度、较佳的结晶形态、较好的热稳定性和贮存稳定性、较低的吸湿性、较好的可流动性和有利的加工与处理特性。特别是S1晶型阿法替尼二氨基磺酸盐具有以下有益性质:1)室温下水中的溶解度为138.3mg/ml,相对于阿法替尼二马来酸盐现有技术晶型在相同条件下的溶解度7.5mg/ml,具有更高的溶解性;2)分解温度为246.3℃,相对于阿法替尼二马来酸盐现有技术晶型的分解温度164.1℃,具有更好的热稳定性。上述有益性质表明,与现有技术阿法替尼二马来酸盐或其晶型相比,本发明的阿法替尼二氨基磺酸盐或S1晶型阿法替尼二氨基磺酸盐具有多种优势性能,应用效果可更好,适合作为药物制剂的活性成分。活性成分更高的溶解性有利于提高药物的生物利用度,进而对药效产生积极影响;活性成分具有更高的热稳定性,能够更好地对抗药物制造和/或存储等过程中由环境温度等因素引起的活性成分含量不均匀、纯度降低和杂质增加等问题,降低由此带来的疗效下降风险和安全风险,并有利于药物制造中的准确定量、提高制剂均一性以及后期的储存和运输。本发明的内容之七是提供阿法替尼二D-葡萄糖酸盐及其晶型、以及它们的制备方法。经HPLC检测,所述阿法替尼二D-葡萄糖酸盐中阿法替尼游离碱的实际含量为54.4%(不计溶剂的量),阿法替尼和D-葡萄糖酸以1:2摩尔比形成的化合物中阿法替尼的理论含量为55.3%,因此本发明所述阿法替尼二D-葡萄糖酸盐中阿法替尼和D-葡萄糖酸以1:2摩尔比成盐,其结构式如下:所述阿法替尼二D-葡萄糖酸盐的制备方法,包括以下步骤:形成阿法替尼在可溶溶剂中的溶液,阿法替尼和D-葡萄糖酸的摩尔比为1:2-1:4,将阿法替尼在可溶溶剂中的溶液和D-葡萄糖酸水溶液混合形成浆液,然后除去溶剂。优选所述可溶溶剂为腈类、醇类、酮类、酯类、烷烃类、醚类或其混合物;进一步优选为乙腈、甲醇、丙酮、乙酸乙酯、正庚烷或甲基叔丁基醚。优选采用旋干法除去溶剂。优选D-葡萄糖酸水溶液的浓度为50%。优选地,所述阿法替尼二D-葡萄糖酸盐为G1晶型的阿法替尼二D-葡萄糖酸盐,使用Cu-Kα辐射,其X射线粉末衍射图谱在衍射角2θ为4.9±0.2°、5.5±0.2°、10.0±0.2°、13.0±0.2°、25.3±0.2°和25.9±0.2°处具有特征峰。进一步地,所述G1晶型阿法替尼二D-葡萄糖酸盐,其X射线粉末衍射图谱在衍射角2θ为4.9±0.2°、5.5±0.2°、6.1±0.2°、9.6±0.2°、10.0±0.2°、13.0±0.2°、17.1±0.2°、19.6±0.2°、20.0±0.2°、20.3±0.2°、25.3±0.2°和25.9±0.2°处具有特征峰。更进一步地,所述G1晶型阿法替尼二D-葡萄糖酸盐,其X射线粉末衍射图的衍射角2θ特征峰及其相对强度如下:。非限制性地,所述G1晶型阿法替尼二D-葡萄糖酸盐的一个典型实例具有如图47所示的X射线粉末衍射图谱。所述G1晶型阿法替尼二D-葡萄糖酸盐,其傅里叶红外光谱在波数为1626、1578、1538、1497、1453、1237、1209、1050和777cm-1处具有特征峰。所述G1晶型阿法替尼二D-葡萄糖酸盐,其拉曼光谱在波数为1656、1608、1546、1400、1370、1300、1215和781cm-1处具有特征峰。所述G1晶型阿法替尼二D-葡萄糖酸盐的一种制备方法,包括以下步骤:形成阿法替尼在可溶溶剂中的溶液,阿法替尼和D-葡萄糖酸的摩尔比为1:2-1:4,将阿法替尼在可溶溶剂中的溶液和D-葡萄糖酸水溶液混合形成浆液并搅拌,在-10-50℃下保持1-48小时,进而除去溶剂,其中所述可溶溶剂选自C2-C4腈、C1-C4醇、C3-C5酮、C4-C5酯、C6-C9烷烃、硝基取代的C1-C3烷烃、C4-C6醚或其混合物。所述C2-C4腈包括但不限于乙腈,所述C1-C4醇包括但不限于甲醇、乙醇、正丙醇、异丙醇、正丁醇和仲丁醇,所述C3-C5酮包括但不限于丙酮和丁酮,所述C4-C5酯包括但不限于乙酸乙酯和乙酸异丙酯,所述C6-C9烷烃包括但不限于正己烷、正庚烷和甲基环己烷,所述硝基取代的C1-C3烷烃包括但不限于硝基甲烷,所述C4-C6醚包括但不限于乙醚、异丙醚和甲基叔丁基醚;优选所述可溶溶剂为乙酸乙酯、乙腈、硝基甲烷、甲醇、丙酮、正庚烷、甲基叔丁基醚或其混合物;更优选为乙酸乙酯。优选阿法替尼在可溶溶剂中的浓度为10毫克/毫升至该溶剂下阿法替尼的饱和溶液。优选阿法替尼和D-葡萄糖酸的摩尔比为1:2-1:3。优选所述制备方法的操作温度为室温。优选D-葡萄糖酸水溶液的浓度为50%。所述G1晶型阿法替尼二D-葡萄糖酸盐的另一种制备方法,包括以下步骤:将前述制备方法得到的阿法替尼二D-葡萄糖酸盐在有机溶剂中形成浆液并搅拌,该浆液在-10-50℃下保持1~72小时,进而除去溶剂,其中所述有机溶剂选自甲醇、乙腈、乙酸乙酯、硝基甲烷、丙酮、正庚烷、甲基叔丁基醚或其混合物。优选所述制备方法的操作温度为室温。与现有技术比较,尤其是与现有技术的阿法替尼二马来酸盐或其晶型比较,阿法替尼二D-葡萄糖酸盐或G1晶型阿法替尼二D-葡萄糖酸盐具有一种或多种改进的特性,例如:更高的结晶度、较好的溶解度、溶解速度、较佳的结晶形态、较好的热稳定性和贮存稳定性、较低的吸湿性、较好的可流动性和有利的加工与处理特性。特别是G1晶型阿法替尼二D-葡萄糖酸盐具有以下有益性质:1)其熔点为101.3℃,低于阿法替尼二马来酸盐现有技术晶型的熔点166.2℃,可在很低的温度下制备无定形物,而无定形物有着较好的溶解性;2)根据文献《HandbookofPharmaceuticalSaltsproperties,Selection,anduse》介绍,D-葡萄糖酸与马来酸相比有着更低的毒性。上述有益性质表明,与现有技术的阿法替尼二马来酸盐或其晶型相比,本发明的阿法替尼二D-葡萄糖酸盐或G1晶型阿法替尼二D-葡萄糖酸盐具有多种优势性能,应用效果可更好,适合作为药物制剂的活性成分。活性成分更高的溶解性有利于提高药物的生物利用度,进而对药效产生积极影响;活性成分具有更低的毒性,使得制剂的制造过程和药物的临床应用更安全。本发明的内容之八是提供阿法替尼二环己烷氨基磺酸盐及其晶型、以及它们的制备方法。经HPLC检测,所述阿法替尼二环己烷氨基磺酸盐中阿法替尼游离碱的实际含量为58.3%(不计溶剂的量),阿法替尼和环己烷氨基磺酸以1:2摩尔比形成的化合物中阿法替尼的理论含量为57.6%,因此本发明所述阿法替尼二环己烷氨基磺酸盐中阿法替尼和环己烷氨基磺酸以1:2摩尔比成盐,其结构式如下:所述阿法替尼二环己烷氨基磺酸盐的制备方法,包括以下步骤:分别形成阿法替尼在可溶溶剂中的溶液体系和环己烷氨基磺酸在有机溶剂中的悬浮液体系,阿法替尼和环己烷氨基磺酸的摩尔比为1:2-1:4,混合两个体系形成浆液,然后除去溶剂。优选所述可溶溶剂或有机溶剂为腈类、醇类、酮类、酯类、烷烃类、醚类或其混合物;进一步优选为乙腈、甲醇、丙酮、乙酸乙酯、正庚烷或甲基叔丁基醚。优选采用旋干法除去溶剂。优选地,所述阿法替尼二环己烷氨基磺酸盐为C1晶型的阿法替尼二环己烷氨基磺酸盐,使用Cu-Kα辐射,其X射线粉末衍射图谱在衍射角2θ为5.0±0.2°、6.0±0.2°、16.5±0.2°、17.9±0.2°、18.6±0.2°和20.2±0.2°处具有特征峰。进一步地,所述C1晶型阿法替尼二环己烷氨基磺酸盐,其X射线粉末衍射图谱在衍射角2θ为5.0±0.2°、6.0±0.2°、12.5±0.2°、14.9±0.2°、16.5±0.2°、17.9±0.2°、18.4±0.2°、18.6±0.2°、20.2±0.2°、21.3±0.2°、21.6±0.2°和24.2±0.2°处具有特征峰。更进一步地,所述C1晶型阿法替尼二环己烷氨基磺酸盐,其X射线粉末衍射图的衍射角2θ特征峰及其相对强度如下:。非限制性地,所述C1晶型阿法替尼二环己烷氨基磺酸盐的一个典型实例具有如图53所示的X射线粉末衍射图谱。所述C1晶型阿法替尼二环己烷氨基磺酸盐,其傅里叶红外光谱在波数为1637、1577、1540、1498、1453、1204、1157、1029、866和775cm-1处具有特征峰。所述C1晶型阿法替尼二环己烷氨基磺酸盐,其拉曼光谱在波数为1662、1609、1543、1401、1372、1291、1209和778cm-1处具有特征峰。所述C1晶型阿法替尼二环己烷氨基磺酸盐的一种制备方法,包括以下步骤:分别形成阿法替尼在可溶溶剂中的溶液体系和环己烷氨基磺酸在有机溶剂的悬浮液体系,阿法替尼和环己烷氨基磺酸的摩尔比为1:2-1:4,混合两个体系形成浆液并搅拌,在-10-50℃下保持1-48小时,然后除去溶剂,其中所述可溶溶剂或有机溶剂选自C2-C4腈、C1-C4醇、C3-C5酮、C4-C5酯、C6-C9烷烃、C4-C6醚或其混合物。所述C2-C4腈包括但不限于乙腈,所述C1-C4醇包括但不限于甲醇、乙醇、正丙醇、异丙醇、正丁醇和仲丁醇,所述C3-C5酮包括但不限于丙酮和丁酮,所述C4-C5酯包括但不限于乙酸乙酯和乙酸异丙酯,所述C6-C9烷烃包括但不限于正己烷、正庚烷和甲基环己烷,所述C4-C6醚包括但不限于乙醚、异丙醚和甲基叔丁基醚;优选所述可溶溶剂或有机溶剂为乙腈、甲醇、丙酮、乙酸乙酯、正庚烷、甲基叔丁基醚或其混合物;更优选为乙腈。优选阿法替尼在可溶溶剂中的浓度为10毫克/毫升至该溶剂下阿法替尼的饱和溶液。优选阿法替尼和环己烷氨基磺酸的摩尔比为1:2-1:3。优选所述制备方法的操作温度为室温。所述C1晶型阿法替尼二环己烷氨基磺酸盐的另一种制备方法,包括以下步骤:将前述制备方法得到的阿法替尼二环己烷氨基磺酸盐在有机溶剂中形成浆液并搅拌,该浆液在-10-50℃下保持1~72小时,进而除去溶剂,其中所述有机溶剂选自甲醇、丙酮、乙腈、乙酸乙酯、正庚烷、甲基叔丁基醚或其混合物。优选所述制备方法的操作温度为室温。与现有技术比较,尤其是与现有技术的阿法替尼二马来酸盐或其晶型比较,阿法替尼二环己烷氨基磺酸盐或C1晶型阿法替尼二环己烷氨基磺酸盐具有一种或多种改进的特性,例如:更高的结晶度、较好的溶解度、溶解速度、较佳的结晶形态、较好的热稳定性和贮存稳定性、较低的吸湿性、较好的可流动性和有利的加工与处理特性。特别是C1晶型阿法替尼二环己烷氨基磺酸盐具有以下有益性质:1)在室温下水中的溶解度为63.1mg/ml,相对于阿法替尼二马来酸盐现有技术晶型在相同条件下的溶解度7.5mg/ml,具有更高的溶解性;2)分解温度为246.1℃,相对于阿法替尼二马来酸盐现有技术晶型的分解温度164.1℃,具有更高的热稳定性。上述有益性质表明,与现有技术阿法替尼二马来酸盐或其晶型相比,本发明的阿法替尼二环己烷氨基磺酸盐或C1晶型阿法替尼二环己烷氨基磺酸盐具有多种优势性能,应用效果可更好,适合作为药物制剂的活性成分。活性成分更高的溶解性有利于提高药物的生物利用度,进而对药效产生积极影响;活性成分具有更高的热稳定性,能够更好地对抗药物制造和/或存储等过程中由环境温度等因素引起的活性成分含量不均匀、纯度降低和杂质增加等问题,降低由此带来的疗效下降风险和安全风险,并有利于药物制造中的准确定量、提高制剂均一性以及后期的储存和运输。本发明的内容之九是提供阿法替尼二4-氨基苯磺酸盐及其晶型、以及它们的制备方法。经HPLC检测,所述阿法替尼二4-氨基苯磺酸盐中阿法替尼游离碱的实际含量为59.1%(不计溶剂的量),阿法替尼和4-氨基苯磺酸以1:2摩尔比形成的化合物中阿法替尼的理论含量为58.4%,因此本发明所述阿法替尼二4-氨基苯磺酸盐中阿法替尼和4-氨基苯磺酸以1:2摩尔比成盐,其结构式如下:所述阿法替尼二4-氨基苯磺酸盐的制备方法,包括以下步骤:分别形成阿法替尼在可溶溶剂中的溶液体系和4-氨基苯磺酸在有机溶剂中的悬浮液体系,阿法替尼和4-氨基苯磺酸的摩尔比为1:2-1:4,混合两个体系形成浆液,然后除去溶剂。优选所述可溶溶剂或有机溶剂为腈类、醇类、酮类、烷烃类、醚类或其混合物;进一步优选为乙腈、甲醇、丙酮、乙酸乙酯、正庚烷或甲基叔丁基醚。优选采用旋干法除去溶剂。优选地,所述阿法替尼二4-氨基苯磺酸盐为A1晶型阿法替尼二4-氨基苯磺酸盐,使用Cu-Kα辐射,其X射线粉末衍射图谱在衍射角2θ为12.9±0.2°、17.1±0.2°、18.2±0.2°、23.8±0.2°、24.5±0.2°和25.7±0.2°处具有特征峰。进一步地,所述A1晶型阿法替尼二4-氨基苯磺酸盐,其X射线粉末衍射图谱在衍射角2θ为5.6±0.2°、12.9±0.2°、17.1±0.2°、18.2±0.2°、21.3±0.2°、23.8±0.2°、24.5±0.2°、25.7±0.2°、27.6±0.2°和34.3±0.2°处具有特征峰。更进一步地,所述A1晶型阿法替尼二4-氨基苯磺酸盐,其X射线粉末衍射图的衍射角2θ特征峰及其相对强度如下:。非限制性地,所述A1晶型阿法替尼二4-氨基苯磺酸盐的一个典型实例具有如图58所示的X射线粉末衍射图谱。所述A1晶型阿法替尼二4-氨基苯磺酸盐,其傅里叶红外光谱在波数为1637、1599、1525、1498、1451、1206、1158、1118、1027和694cm-1处具有特征峰。所述A1晶型阿法替尼二4-氨基苯磺酸盐,其拉曼光谱在波数为1657、1644、1546、1499、1400、1371、1297、1208、1122和781cm-1处具有特征峰。所述A1晶型阿法替尼二4-氨基苯磺酸盐的一种制备方法,包括以下步骤:分别形成阿法替尼在可溶溶剂中的溶液体系和4-氨基苯磺酸在有机溶剂中的悬浮液体系,阿法替尼和4-氨基苯磺酸的摩尔比为1:2-1:4,混合两个体系形成浆液并搅拌,在-10-50℃下保持1-48小时,然后除去溶剂,其中所述可溶溶剂或有机溶剂选自C2-C4腈、C1-C4醇、C3-C5酮、C6-C9烷烃、C4-C6醚或其混合物。所述C2-C4腈包括但不限于乙腈,所述C1-C4醇包括但不限于甲醇、乙醇、正丙醇、异丙醇、正丁醇和仲丁醇,所述C3-C5酮包括但不限于丙酮和丁酮,所述C6-C9烷烃包括但不限于正己烷、正庚烷和甲基环己烷,所述C4-C6醚包括但不限于乙醚、异丙醚和甲基叔丁基醚;优选所述可溶溶剂或有机溶剂为乙腈、甲醇、丙酮、正庚烷、甲基叔丁基醚或其混合物;更优选为乙腈。优选阿法替尼在可溶溶剂中的浓度为10毫克/毫升至该溶剂下阿法替尼的饱和溶液。优选阿法替尼和4-氨基苯磺酸的摩尔比为1:2-1:3。优选所述制备方法的操作温度为室温。所述A1晶型阿法替尼二4-氨基苯磺酸盐的另一种制备方法,包括以下步骤:将前述制备方法得到的阿法替尼二4-氨基苯磺酸盐在有机溶剂中形成浆液并搅拌,该浆液在-10-50℃下保持1~72小时,进而除去溶剂,其中所述有机溶剂选自甲醇、丙酮、乙腈、乙酸乙酯、正庚烷、甲基叔丁基醚或其混合物。优选所述制备方法的操作温度为室温。与现有技术比较,尤其是与现有技术阿法替尼二马来酸盐或其晶型比较,阿法替尼二4-氨基苯磺酸盐或A1晶型阿法替尼二4-氨基苯磺酸盐具有一种或多种改进的特性,例如:更高的结晶度、较好的溶解度、溶解速度、较佳的结晶形态、较好的热稳定性和贮存稳定性、较低的吸湿性、较好的可流动性和有利的加工与处理特性。特别是A1晶型阿法替尼二4-氨基苯磺酸盐具有以下有益性质:1)在室温下水中的溶解度为123.8mg/ml,相对于阿法替尼二马来酸盐现有技术晶型在相同条件下的溶解度7.5mg/ml,具有更高的溶解性。2)分解温度为261.7℃,相对于阿法替尼二马来酸盐现有技术晶型的分解温度164.1℃,具有更高的热稳定性。上述有益性质表明,与现有技术阿法替尼二马来酸盐或其晶型相比,本发明的阿法替尼二环己烷氨基磺酸盐或C1晶型阿法替尼二环己烷氨基磺酸盐具有多种优势性能,应用效果可更好,适合作为药物制剂的活性成分。活性成分更高的溶解性有利于提高药物的生物利用度,进而对药效产生积极影响;活性成分具有更高的热稳定性,能够更好地对抗药物制造和/或存储等过程中由环境温度等因素引起的活性成分含量不均匀、纯度降低和杂质增加等问题,降低由此带来的疗效下降风险和安全风险,并有利于药物制造中的准确定量、提高制剂均一性以及后期的储存和运输。本发明的内容之十是提供阿法替尼甘醇酸盐及其晶型、以及它们的制备方法。经HPLC检测,所述阿法替尼甘醇酸盐中阿法替尼游离碱的实际含量为85.4%(不计溶剂的量),阿法替尼和甘醇酸以1:1摩尔比形成的化合物中阿法替尼的理论含量为86.5%,因此所述阿法替尼甘醇酸盐中阿法替尼和甘醇酸以1:1摩尔比成盐,其结构式如下:所述阿法替尼甘醇酸盐的制备方法,包括以下步骤:分别形成阿法替尼和甘醇酸在可溶溶剂中的溶液体系,阿法替尼和甘醇酸的摩尔比为1:1-1:2,混合两个体系形成浆液,然后除去溶剂。优选所述可溶溶剂为醇类、酮类、酯类、烷烃类、醚类或其混合物;进一步优选为甲醇、丙酮、乙酸乙酯、正庚烷或甲基叔丁基醚。优选采用旋干法除去溶剂。优选地,所述阿法替尼甘醇酸盐为Gl-1晶型的阿法替尼甘醇酸盐,使用Cu-Kα辐射,其X射线粉末衍射图谱在衍射角2θ为5.1±0.2°、6.4±0.2°、13.0±0.2°、13.3±0.2°、20.8±0.2°和25.0±0.2°处具有特征峰。进一步地,所述Gl-1晶型阿法替尼甘醇酸盐,其X射线粉末衍射图谱在衍射角2θ为5.1±0.2°、6.4±0.2°、7.0±0.2°、13.0±0.2°、13.3±0.2°、17.2±0.2°、17.9±0.2°、19.7±0.2°、20.8±0.2°、22.4±0.2°、25.0±0.2°和25.9±0.2°处具有特征峰。更进一步地,所述Gl-1晶型阿法替尼甘醇酸盐,其X射线粉末衍射图的衍射角2θ特征峰及其相对强度如下:。非限制性地,所述Gl-1晶型阿法替尼甘醇酸盐的一个典型实例具有如图63所示的X射线粉末衍射图谱。所述Gl-1晶型阿法替尼甘醇酸盐,其傅里叶红外光谱在波数为1625、1577、1536、1497、1452、1427、1234、1212、1081和777cm-1处具有特征峰。所述Gl-1晶型阿法替尼甘醇酸盐,其拉曼光谱在波数为1650、1629、1610、1536、1398、1344、1304、1215和781cm-1处具有特征峰。所述Gl-1晶型阿法替尼甘醇酸盐的一种制备方法,包括以下步骤:分别形成阿法替尼和甘醇酸在可溶溶剂中的溶液体系,阿法替尼和甘醇酸的摩尔比为1:1-1:2,混合两个体系形成浆液并搅拌,在-10-50℃下保持1-48小时,进而除去溶剂,其中所述可溶溶剂选自C1-C4醇、C3-C5酮、C4-C5酯、C6-C9烷烃、硝基取代的C1-C3烷烃、C4-C6醚或其混合物。所述C1-C4醇包括但不限于甲醇、乙醇、正丙醇、异丙醇、正丁醇和仲丁醇,所述C3-C5酮包括但不限于丙酮和丁酮,所述C4-C5酯包括但不限于乙酸乙酯和乙酸异丙酯,所述C6-C9烷烃包括但不限于正己烷、正庚烷和甲基环己烷,所述硝基取代的C1-C3烷烃包括但不限于硝基甲烷,所述C4-C6醚包括但不限于乙醚、异丙醚和甲基叔丁基醚;优选所述可溶溶剂为乙酸乙酯或硝基甲烷。优选阿法替尼在可溶溶剂中的浓度为10毫克/毫升至该溶剂下阿法替尼的饱和溶液。优选阿法替尼和甘醇酸的摩尔比为1:1-1:1.5。优选所述制备方法的操作温度为室温。所述Gl-1晶型阿法替尼甘醇酸盐的另一种制备方法,包括以下步骤:将前述制备方法得到的阿法替尼甘醇酸盐在有机溶剂中形成浆液并搅拌,该浆液在-10-50℃下保持1~72小时,进而除去溶剂,其中所述有机溶剂选自甲醇、丙酮、乙腈、乙酸乙酯、硝基甲烷、正庚烷、甲基叔丁基醚或其混合物。优选所述制备方法的操作温度为室温。与现有技术比较,尤其是与现有技术的阿法替尼二马来酸盐或其晶型比较,阿法替尼甘醇酸盐或Gl-1晶型阿法替尼甘醇酸盐具有一种或多种改进的特性,例如:更高的结晶度、较好的溶解度、溶解速度、较佳的结晶形态、较好的热稳定性和贮存稳定性、较低的吸湿性、较好的可流动性和有利的加工与处理特性。特别是Gl-1晶型阿法替尼甘醇酸盐具有以下有益性质:1)熔点为83.5℃,低于阿法替尼二马来酸盐现有技术晶型的熔点166.2℃,可在很低的温度下制备无定形物,而无定形物有着较好的溶解性。2)根据文献《HandbookofPharmaceuticalSaltsproperties,selection,anduse》介绍,甘醇酸与马来酸相比有着更低的毒性。上述有益性质表明,与现有技术的阿法替尼二马来酸盐或其晶型相比,本发明的阿法替尼甘醇酸盐或Gl-1晶型阿法替尼甘醇酸盐具有多种优势性能,应用效果可更好,适合作为药物制剂的活性成分。活性成分更高的溶解性有利于提高药物的生物利用度,进而对药效产生积极影响;活性成分具有更低的毒性,使得制剂的制造过程和药物的临床应用更安全。本发明的内容之十一是提供一种新型的阿法替尼二马来酸盐晶型N及其制备方法。使用Cu-Kα辐射,所述阿法替尼二马来酸盐晶型N的X射线粉末衍射图谱在衍射角2θ为4.8±0.2°、9.7±0.2°、14.5±0.2°、17.0±0.2°、19.5±0.2°、20.1±0.2、25.6±0.2°处具有特征峰。进一步地,所述阿法替尼二马来酸盐晶型N,其X射线粉末衍射图的衍射角2θ特征峰及其相对强度如下:。非限制性地,所述阿法替尼二马来酸盐晶型N的一个典型实例具有如图69所示的X射线粉末衍射图谱。所述阿法替尼二马来酸盐晶型N,其傅里叶红外光谱在波数为1684、1576、1542、1496、1449、1351、1088、891和859cm-1处具有特征峰。所述阿法替尼二马来酸盐晶型N,其拉曼光谱在波数为1657、1607、1546、1494、1404、1374、1302、1217和783cm-1处具有特征峰。所述阿法替尼二马来酸盐晶型N的制备方法,包括以下步骤:分别形成阿法替尼和马来酸在硝基甲烷中的溶液体系,阿法替尼和马来酸的摩尔比为1:2-1:4,混合两个体系形成浆液并搅拌,在-10-50℃下保持1-48小时,然后除去溶剂。优选阿法替尼在硝基甲烷中的浓度为10毫克/毫升至阿法替尼在硝基甲烷中的饱和溶液;优选阿法替尼和马来酸的摩尔比为1:2-1:3;优选所述制备方法的操作温度为室温。与现有技术比较,尤其是与阿法替尼二马来酸盐现有技术晶型比较,本发明的阿法替尼二马来酸盐晶型N具有一种或多种改进的特性,例如:更高的结晶度、较好的溶解度、溶解速度、较佳的结晶形态、较好的热稳定性和贮存稳定性、较低的吸湿性、较好的可流动性和有利的加工与处理特性。特别是阿法替尼二马来酸盐晶型N具有以下有益性质:其在室温下水中的溶解度为12.7mg/ml,相对于阿法替尼二马来酸盐现有技术晶型在相同条件下的溶解度7.5mg/ml,具有更高的溶解性。上述有益性质表明,与阿法替尼二马来酸盐现有技术晶型相比,本发明的阿法替尼二马来酸盐晶型N具有优势性能,应用效果可更好,适合作为药物制剂的活性成分。活性成分更高的溶解性有利于提高药物的生物利用度,进而对药效产生积极影响。本发明上述任何制备方法中,可选地,所述阿法替尼的溶液体系与酸的溶液体系或悬浮液体系的混合方式为:i)将阿法替尼的溶液体系向酸的溶液体系或悬浮液体系中添加;或ii)向阿法替尼的溶液体系中添加酸的溶液体系或悬浮液体系;或iii)将阿法替尼的溶液体系与酸的溶液体系或悬浮液体系同时向反应容器中添加。本发明上述任何制备方法中描述的“搅拌”可用常规技术完成,例如磁力搅拌和机械搅拌。搅拌速度为50~1800转/分,优选300~900转/分。本发明上述任何制备方法中描述的“去除溶剂”步骤可以用常规技术完成,例如过滤、离心、干燥或蒸发。旋蒸的具体操作为:将装有溶液的容器置于旋蒸仪中,在室温至溶剂沸点的水浴温度下(优选30~50℃),小于大气压的压力下(优选压力小于0.08MPa),以10~180转/分的旋转速度(优选50~100转/分),将溶剂除尽。本发明上述任何制备方法得到的阿法替尼酸加成盐及其晶型,可以采用常规技术进一步干燥。干燥在减压或不减压下进行,优选压力小于0.09MPa,干燥温度约30-50℃,干燥时间10-72小时,优选10-48小时,更优选10-24小时。干燥可以在通风橱、鼓风烘箱或真空烘箱里进行。本发明中,起始原料阿法替尼可按照文献CN1867564B中实施例1公开的方法制备得到,该文献通过引用其全文的方式并入到本申请中。本发明中,“室温”指10-25℃。根据本发明的目的,本发明提供一种药物组合物,所述药物组合物包含治疗和/或预防有效量的一种或多种本发明所述的阿法替尼酸加成盐或其晶型或者由本发明方法制备得到的阿法替尼酸加成盐或其晶型,以及至少一种药学上可接受的赋形剂。其中,本发明所述的阿法替尼酸加成盐或其晶型选自阿法替尼的乙二磺酸盐、E1晶型乙二磺酸盐、1,5-萘二磺酸盐、N1晶型1,5-萘二磺酸盐、N2晶型1,5-萘二磺酸盐水合物、丙二酸盐、M1晶型丙二酸盐、二丙二酸盐、M2晶型二丙二酸盐、二2-萘磺酸盐、Ns1晶型二2-萘磺酸盐、二氨基磺酸盐、S1晶型二氨基磺酸盐、二D-葡萄糖酸盐、G1晶型二D-葡萄糖酸盐、二环己烷氨基磺酸盐、C1晶型二环己烷氨基磺酸盐、二4-氨基苯磺酸盐、A1晶型二4-氨基苯磺酸盐、甘醇酸盐、Gl-1晶型甘醇酸盐或二马来酸盐晶型N,此外,所述药物组合物还可以包含阿法替尼或其可药用的其它盐、以及它们的晶型或无定形物。所述药物组合物中的赋形剂包括糖类,纤维素及其衍生物,淀粉或改性淀粉,固体无机物如磷酸钙、磷酸氢二钙、羟基磷灰石、硫酸钙、碳酸钙,半固体如脂质或石蜡,粘合剂如微晶纤维素、乙基纤维素、羟甲基纤维素、羟丙基甲基纤维素、羟乙基纤维素,助流剂如胶态二氧化硅、轻质无水硅酸、结晶纤维素、滑石粉或硬脂酸镁,崩解剂如乙醇酸淀粉钠、交聚维酮、交联羧甲基纤维素、羧甲基纤维素钠、干玉米淀粉,润滑剂如硬脂酸、硬脂酸镁、硬脂酰富马酸钠、聚乙二醇。所述药物组合物可为固态或液态,给药途径包括口服、静脉注射、皮下注射、组织内给药、透皮给药、直肠给药、鼻内给药等。例如,固体口服剂型,包括片剂、颗粒剂、胶囊剂、散剂、丸剂和锭剂,可以是常规的、可分散的、可咀嚼的、口腔溶解的或快速熔化的制剂;液体口服剂型,包括溶液剂、糖浆剂、混悬剂、分散剂和乳剂;可注射制剂,包括溶液剂、分散剂和冻干剂;适于吸入用的气溶胶制剂;适于直肠给药的栓剂。配方可适于活性成分的速释、缓释或调节释放。所述药物组合物可以使用本领域技术人员公知的方法来制备。制备药物组合物时,本发明的阿法替尼酸加成盐或其晶型与一种或多种药学上可接受的赋形剂相混合,任选地与可药用的阿法替尼其它盐的晶型、或无定形物相混合,任选地与一种或多种其他的药物活性成分相混合。固体制剂可通过直接混合、制粒等工艺来制备。本发明的阿法替尼酸加成盐或其晶型适用于治疗良性或恶性肿瘤,用于预防和治疗呼吸道和肺部疾病,以及用于治疗胃肠道、胆管以及胆囊疾病。进一步地,本发明提供了本发明前述的阿法替尼酸加成盐或其晶型用于制备治疗和/或预防晚期非小细胞肺癌(NSCLC)及HER2阳性的晚期乳腺癌疾病的药物中的用途。进一步地,本发明提供一种治疗和/或预防晚期非小细胞肺癌(NSCLC)及HER2阳性的晚期乳腺癌的方法,所述方法包括给予需要的患者治疗和/或预防有效量的本发明前述的阿法替尼酸加成盐或其晶型或包含本发明前述的阿法替尼酸加成盐或其晶型的药物组合物。所述患者一般是温血脊椎动物,特别是人。作为医药使用的剂量为0.01~100毫克/公斤体重,优选为0.1~15毫克/公斤体重。附图说明图1是CN1867564B公开的阿法替尼二马来酸盐现有技术晶型的XRPD图图2是制备例1制备的阿法替尼二马来酸盐现有技术晶型的XRPD图图3是制备例1制备的阿法替尼二马来酸盐现有技术晶型的TGA图图4是制备例1制备的阿法替尼二马来酸盐现有技术晶型的DSC图图5是制备例1制备的阿法替尼二马来酸盐现有技术晶型的DVS图图6是实施例3制备的E1晶型阿法替尼乙二磺酸盐的XRPD图图7是实施例3制备的E1晶型阿法替尼乙二磺酸盐的PLM图图8是实施例3制备的E1晶型阿法替尼乙二磺酸盐的TGA图图9是实施例3制备的E1晶型阿法替尼乙二磺酸盐的DVS图图10是实施例3制备的E1晶型阿法替尼乙二磺酸盐的IR图图11是实施例3制备的E1晶型阿法替尼乙二磺酸盐的Raman图图12是实施例3制备的E1晶型阿法替尼乙二磺酸盐的NMR图图13是实施例12制备的N1晶型阿法替尼1,5-萘二磺酸盐的XRPD图图14是实施例12制备的N1晶型阿法替尼1,5-萘二磺酸盐的PLM图图15是实施例12制备的N1晶型阿法替尼1,5-萘二磺酸盐的TGA图图16是实施例12制备的N1晶型阿法替尼1,5-萘二磺酸盐的DVS图图17是实施例12制备的N1晶型阿法替尼1,5-萘二磺酸盐的IR图图18是实施例12制备的N1晶型阿法替尼1,5-萘二磺酸盐的Raman图图19是实施例12制备的N1晶型阿法替尼1,5-萘二磺酸盐的NMR图图20是实施例20制备的N2晶型阿法替尼1,5-萘二磺酸盐水合物的XRPD图图21是实施例20制备的N2晶型阿法替尼1,5-萘二磺酸盐水合物的PLM图图22是实施例20制备的N2晶型阿法替尼1,5-萘二磺酸盐水合物的TGA图图23是实施例20制备的N2晶型阿法替尼1,5-萘二磺酸盐水合物的IR图图24是实施例20制备的N2晶型阿法替尼1,5-萘二磺酸盐水合物的Raman图图25是实施例24制备的M1晶型阿法替尼一丙二酸盐的XRPD图图26是实施例24制备的M1晶型阿法替尼一丙二酸盐的PLM图图27是实施例24制备的M1晶型阿法替尼一丙二酸盐的TGA图图28是实施例24制备的M1晶型阿法替尼一丙二酸盐的IR图图29是实施例24制备的M1晶型阿法替尼一丙二酸盐的Raman图图30是实施例24制备的M1晶型阿法替尼一丙二酸盐的NMR图图31是实施例31制备的M2晶型阿法替尼二丙二酸盐的XRPD图图32是实施例31制备的M2晶型阿法替尼二丙二酸盐的TGA图图33是实施例31制备的M2晶型阿法替尼二丙二酸盐的DVS图图34是实施例31制备的M2晶型阿法替尼二丙二酸盐的IR图图35是实施例31制备的M2晶型阿法替尼二丙二酸盐的Raman图图36是实施例31制备的M2晶型阿法替尼二丙二酸盐的NMR图图37是实施例38制备的Ns1晶型阿法替尼二2-萘磺酸盐的XRPD图图38是实施例38制备的Ns1晶型阿法替尼二2-萘磺酸盐的TGA图图39是实施例38制备的Ns1晶型阿法替尼二2-萘磺酸盐的IR图图40是实施例38制备的Ns1晶型阿法替尼二2-萘磺酸盐的Raman图图41是实施例38制备的Ns1晶型阿法替尼二2-萘磺酸盐的NMR图图42是实施例46制备的S1晶型阿法替尼二氨基磺酸盐的XRPD图图43是实施例46制备的S1晶型阿法替尼二氨基磺酸盐的TGA图图44是实施例46制备的S1晶型阿法替尼二氨基磺酸盐的IR图图45是实施例46制备的S1晶型阿法替尼二氨基磺酸盐的Raman图图46是实施例46制备的S1晶型阿法替尼二氨基磺酸盐的NMR图图47是实施例54制备的G1晶型阿法替尼二D-葡萄糖酸盐的XRPD图图48是实施例54制备的G1晶型阿法替尼二D-葡萄糖酸的TGA图图49是实施例54制备的G1晶型阿法替尼二D-葡萄糖酸的DSC图图50是实施例54制备的G1晶型阿法替尼二D-葡萄糖酸盐的IR图图51是实施例54制备的G1晶型阿法替尼二D-葡萄糖酸盐的Raman图图52是实施例54制备的G1晶型阿法替尼二D-葡萄糖酸盐的NMR图图53是实施例63制备的C1晶型阿法替尼二环己烷氨基磺酸盐的XRPD图图54是实施例63制备的C1晶型阿法替尼二环己烷氨基磺酸盐的TGA图图55是实施例63制备的C1晶型阿法替尼二环己烷氨基磺酸盐的IR图图56是实施例63制备的C1晶型阿法替尼二环己烷氨基磺酸盐的Raman图图57是实施例63制备的C1晶型阿法替尼二环己烷氨基磺酸盐的NMR图图58是实施例72制备的A1晶型阿法替尼二4-氨基苯磺酸盐的XRPD图图59是实施例72制备的A1晶型阿法替尼二4-氨基苯磺酸盐的TGA图图60是实施例72制备的A1晶型阿法替尼二4-氨基苯磺酸盐的IR图图61是实施例72制备的A1晶型阿法替尼二4-氨基苯磺酸盐的Raman图图62是实施例72制备的A1晶型阿法替尼二4-氨基苯磺酸盐的NMR图图63是实施例81制备的Gl-1晶型阿法替尼甘醇酸盐的XRPD图图64是实施例81制备的Gl-1晶型阿法替尼甘醇酸盐的TGA图图65是实施例81制备的Gl-1晶型阿法替尼甘醇酸盐的DSC图图66是实施例81制备的Gl-1晶型阿法替尼甘醇酸盐的IR图图67是实施例81制备的Gl-1晶型阿法替尼甘醇酸盐的Raman图图68是实施例81制备的Gl-1晶型阿法替尼甘醇酸盐的NMR图图69是实施例88制备的阿法替尼二马来酸盐晶型N的XRPD图图70是实施例88制备的阿法替尼二马来酸盐晶型N的TGA图图71是实施例88制备的阿法替尼二马来酸盐晶型N的IR图图72是实施例88制备的阿法替尼二马来酸盐晶型N的Raman图具体实施方式本发明进一步参考以下实施例,所述实施例详细描述本发明的盐及晶型的制备和应用。对本领域技术人员显而易见的是,对于材料和方法两者其中的许多改变可在不脱离本发明范围的情况下实施。检测仪器及方法:X射线粉末衍射(XPRD)所用的仪器为BrukerD8Advancediffractometer,采用铜靶波长为1.54nm的KαX-射线,在40kV和40mA的操作条件下、θ-2θ测角仪、Mo单色仪、Lynxeye探测器。仪器在使用前用仪器自带的标准样品校正峰位。采集软件是DiffracPlusXRDCommander。样品在室温下测试,把样品放在有机玻片上。检测条件:角度范围:3~4°2θ;步长:0.02°2θ;速度:0.2s/步。偏正光显微镜(PLM)图谱采自于XP-500E偏振光显微镜(上海长方光学仪器有限公司)。取少量粉末样品置于载玻片上,滴加少量矿物油以更好地分散粉末样品,盖上盖玻片,然后将样品放置在XP-500E偏振光显微镜的载物台上,选择合适的放大倍数观测样品的形貌并拍照。热重分析(TGA)数据采自于TAInstrumentsQ500TGA,仪器控制软件ThermalAdvantage,分析软件UniversalAnalysis。通常取5~15mg样品置于白金坩埚内,采用分段高分辨检测方式,以10℃/min升温速度在50mL/min干燥N2的保护下将样品从室温升至300℃,同时TA软件记录样品升温过程中的重量变化。动态水份吸附分析(DVS)数据采自于TAInstrumentsQ5000TGA,仪器控制软件是ThermalAdvantage,分析软件是UniversalAnalysis。通常取1~10mg样品放置于白金坩埚内,TA软件记录样品在相对湿度从0%到80%到0%变化过程中的重量变化。根据样品的具体情况,也会对样品采用不同的吸附和脱吸附步骤。红外光谱分析(IR)数据采自于BrukerTensor27,仪器控制软件和数据分析软件都是OPUS。通常采用ATR设备,在600-4000cm-1范围内,采集红外吸收光谱,样品和空白背景的扫描时间均为16秒,仪器分辨率4cm-1。拉曼光谱分析(Raman)数据采自于尼高力DXR780,仪器控制软件和数据分析软件都是onmic8.2。通常在10倍镜下,在波数50-3400cm-1范围内,曝光次数8次,曝光时间1秒,对样品进行拉曼光谱采集。核磁分析(NMR)数据采自于BrukerAscendTm500。通常使用全频激发,谱宽30PPM,单脉冲,30°角激发,扫描16次,数字化正交检测,控温298K。高效液相分析(HPLC)数据采自于Agilent1260,仪器控制软件是Agilent化学工作站B.04版online,分析软件是Agilent化学工作站B.04版offline。采用C18色谱柱,150mm×4.6mm,柱温40℃,波长254nm,流速0.3ml/min,进样量50μl,运行时间30min。流动相A为含0.01%三氟乙酸的水,流动相B为含0.01%三氟乙酸的乙腈,梯度见表1:表1HPLC中流动相梯度表时间(min)流动相A(%)流动相B(%)09553955105951559530595片剂硬度检测数据采自于天津市新天光分析仪器技术有限公司的YD-1片剂硬度测试仪。将片剂放入测试台中,顺时针旋转转动圆盘,至药片被挤压破碎时的数值即为其硬度。制备例1阿法替尼二马来酸盐现有技术晶型的制备取100mg阿法替尼游离碱加入1.5mL乙醇搅拌溶解,加热至70℃,取50mg马来酸加入0.4mL乙醇搅拌溶解,将马来酸的乙醇溶液缓慢滴加至阿法替尼游离碱的乙醇溶液中,搅拌,析出固体后将反应液降温至室温,室温搅拌2-3h,过滤,40℃真空干燥过夜得阿法替尼二马来酸盐。XRPD分析如图2所示,显示与CN1867564B公开的阿法替尼二马来酸盐现有技术晶型一致。TGA图谱如图3所示,显示该盐的分解温度为164.1℃。DSC图谱如图4所示,显示该盐的熔点为166.2℃。DVS等温吸附曲线如图5所示,显示该盐在10%-80%相对湿度范围内重量变化为2.6%。实施例1阿法替尼乙二磺酸盐的制备取50mg阿法替尼游离碱加入1mL乙酸乙酯搅拌溶解,取19.6mg乙二磺酸加入2mL乙酸乙酯搅拌溶解,将乙二磺酸的乙酸乙酯溶液缓慢滴加至阿法替尼游离碱的乙酸乙酯溶液中形成浆液,搅拌,室温反应过夜后有固体析出,40℃真空旋干,得68mg阿法替尼乙二磺酸盐,产率97.7%。实施例2E1晶型阿法替尼乙二磺酸盐的制备取50mg阿法替尼游离碱加入1mL乙腈搅拌溶解,取19.6mg乙二磺酸加入2mL乙腈搅拌溶解,将乙二磺酸的乙腈溶液缓慢滴加至阿法替尼游离碱的乙腈溶液中形成浆液,搅拌,室温下反应过夜有固体析出,过滤,40℃真空干燥过夜得62mgE1晶型阿法替尼乙二磺酸盐,产率89%。实施例3E1晶型阿法替尼乙二磺酸盐的制备将实施例2中的“将乙二磺酸的乙腈溶液缓慢滴加至阿法替尼游离碱的乙腈溶液中”替换为“将阿法替尼游离碱的乙腈溶液缓慢滴加至乙二磺酸的乙腈溶液中”,其他操作与实施例2相同,得63.6mgE1晶型阿法替尼乙二磺酸盐,产率91.5%。XRPD分析如图6所示,PLM图谱如图7所示。显示:该盐为颗粒状晶体,和阿法替尼二马来酸盐现有技术晶型的针状晶体相比有着更好的流动性和可加工性。TGA图谱如图8所示。显示:该盐在150℃前有3.4%的失重,为水合物,含1.5摩尔水,分解温度为261.1℃,高于阿法替尼二马来酸盐现有技术晶型的分解温度164.1℃,显示出更好的热稳定性。DVS等温吸附曲线如图9所示。显示:该盐在10%-80%相对湿度范围内重量变化为1.4%,和阿法替尼二马来酸盐现有技术晶型在相同条件下2.6%的重量变化相比,有更低的吸湿性。红外光谱分析如图10所示。拉曼光谱分析如图11所示。NMR图谱如图12所示。显示:阿法替尼和乙二磺酸已经成盐。HPLC检测显示该盐中阿法替尼的含量为71.4%,与阿法替尼和乙二磺酸1:1摩尔比成盐的理论含量71.9%接近,说明阿法替尼和乙二磺酸以1:1摩尔比成盐。实施例4E1晶型阿法替尼乙二磺酸盐的制备取30mg阿法替尼游离碱加入0.5mL乙腈搅拌溶解,取19.6mg乙二磺酸加入0.5mL乙腈搅拌溶解,将乙二磺酸的乙腈溶液缓慢滴加至阿法替尼游离碱的乙腈溶液中形成浆液,搅拌,室温下反应过夜有固体析出,过滤,40℃真空干燥过夜得白色固体阿法替尼乙二磺酸盐。实施例5E1晶型阿法替尼乙二磺酸盐的制备取实施例1制备的阿法替尼乙二磺酸盐30mg,置于50ml烧瓶中,加入2ml甲醇形成浆液,室温搅拌72小时,过滤,40℃真空干燥过夜,得E1晶型阿法替尼乙二磺酸盐。实施例6E1晶型阿法替尼乙二磺酸盐的制备将实施例5中的“甲醇”替换为“甲基叔丁基醚”,其他操作同实施例5,得到晶E1型阿法替尼乙二磺酸盐。实施例7E1晶型阿法替尼乙二磺酸盐的制备将实施例5中的“甲醇”替换为“丙酮”,其他操作同实施例5,得到E1晶型阿法替尼乙二磺酸盐。实施例8E1晶型阿法替尼乙二磺酸盐的制备将实施例5中的“甲醇”替换为“正庚烷”,其他操作同实施例5,得到E1晶型阿法替尼乙二磺酸盐。实施例9E1晶型阿法替尼乙二磺酸盐的制备将实施例5中的“甲醇”替换为“乙酸乙酯”,其他操作同实施例5,得到E1晶型阿法替尼乙二磺酸盐。实施例10E1晶型阿法替尼乙二磺酸盐的制备将实施例2中的“19.6mg乙二磺酸”替换为“39.1mg乙二磺酸”,其他操作同实施例2,得到E1晶型阿法替尼乙二磺酸盐。实施例11阿法替尼1,5-萘二磺酸盐的制备取50mg阿法替尼游离碱加入1mL丙酮搅拌溶解,取37.1mg1,5-萘二磺酸四水合物加入2mL丙酮搅拌溶解,将1,5-萘二磺酸的丙酮溶液缓慢滴加至阿法替尼游离碱的丙酮溶液中形成浆液,搅拌,室温下固体析出后搅拌过夜,40℃真空旋干,得78mg阿法替尼1,5-萘二磺酸盐,产率98%。实施例12N1晶型阿法替尼1,5-萘二磺酸盐的制备取50mg阿法替尼游离碱加入1mL乙腈搅拌溶解,取37.1mg1,5-萘二磺酸四水合物加入2mL乙醇搅拌溶解,将1,5-萘二磺酸的乙醇溶液缓慢滴加至阿法替尼游离碱的乙腈溶液中形成浆液,搅拌,室温下固体析出后搅拌过夜,过滤,40℃真空干燥过夜,得71mgN1晶型阿法替尼1,5-萘二磺酸盐,产率89.2%。XRPD分析如图13所示。PLM图谱如图14所示。显示:该盐为颗粒状晶体,较为规则,和阿法替尼二马来酸盐现有技术晶型的针状晶体相比,有着更好的流动性和可加工性。TGA图谱如图15所示。显示:样品为无水物,分解温度为276.3℃,和阿法替尼二马来酸盐现有技术晶型的164.1℃分解温度相比有着更好的热稳定性。DVS等温吸附曲线如图16所示。显示:N1晶型阿法替尼1,5-萘二磺酸盐在50%相对湿度以下稳定,在50%相对湿度以上开始形成N2晶型阿法替尼1,5-萘二磺酸盐水合物,形成N2晶型阿法替尼1,5-萘二磺酸盐水合物后至80%相对湿度,吸水的重量变化为1.8%;N2晶型阿法替尼1,5-萘二磺酸盐水合物在30%相对湿度以上稳定,在30%相对湿度以下开始脱去结晶水。和阿法替尼二马来酸盐现有技术晶型在相同条件下(30%-80%相对湿度下)吸水重量变化为2.2%相比,N2晶型阿法替尼1,5-萘二磺酸盐水合物有更低的吸湿性。红外光谱分析如图17所示。拉曼光谱分析如图18所示。NMR图谱如图19所示。显示:阿法替尼和1,5-萘二磺酸已经成盐。HPLC检测显示该盐中阿法替尼含量为63.3%,与阿法替尼和1,5-萘二磺酸以1:1摩尔比成盐的理论含量62.8%接近,说明阿法替尼和1,5-萘二磺酸以1:1摩尔比成盐。实施例13N1晶型阿法替尼1,5-萘二磺酸盐的制备取15mg阿法替尼游离碱加入0.5mL乙腈搅拌溶解,取14.8mg1,5-萘二磺酸四水合物加入0.5mL乙醇搅拌溶解,将1,5萘二磺酸的乙醇溶液缓慢滴加至阿法替尼游离碱的乙腈溶液中,搅拌,固体析出后搅拌过夜,过滤,40℃真空干燥过夜得白色固体阿法替尼1,5-萘二磺酸盐。实施例14N1晶型阿法替尼1,5-萘二磺酸盐的制备取实施例11制备的阿法替尼1,5萘二磺酸盐30mg,置于50ml烧瓶中,加入2ml甲醇形成浆液,室温下搅拌72小时,过滤,40℃真空干燥得N1晶型阿法替尼1,5萘二磺酸盐。实施例15N1晶型阿法替尼1,5-萘二磺酸盐的制备将实施例14中的“甲醇”替换为“甲基叔丁基醚”,其他操作同实施例14,得到N1晶型阿法替尼1,5-萘二磺酸盐。实施例16N1晶型阿法替尼1,5-萘二磺酸盐的制备将实施例14中的“甲醇”替换为“丙酮”,其他操作同实施例14,得到N1晶型阿法替尼1,5-萘二磺酸盐。实施例17N1晶型阿法替尼1,5-萘二磺酸盐的制备将实施例14中的“甲醇”替换为“正庚烷”,其他操作同实施例14,得到N1晶型阿法替尼1,5-萘二磺酸盐。实施例18N1晶型阿法替尼1,5-萘二磺酸盐的制备将实施例14中的“甲醇”替换为“乙酸乙酯”,其他操作同实施例14,得到N1晶型阿法替尼1,5-萘二磺酸盐。实施例19N1晶型阿法替尼1,5-萘二磺酸盐的制备将实施例12中的“37.1mg1,5-萘二磺酸四水合物”替换为“74.2mg1,5-萘二磺酸四水合物”,其它操作同实施例12,得到N1晶型阿法替尼1,5-萘二磺酸盐。实施例20N2晶型阿法替尼1,5-萘二磺酸盐水合物的制备取50mg实施例12制备的N1晶型阿法替尼1,5-萘二磺酸盐,室温下放置于相对湿度75%的湿度器中24小时,得N2晶型阿法替尼1,5-萘二磺酸盐水合物。XRPD分析如图20所示。PLM图谱如图21所示。显示:该盐为颗粒状晶体,较为规则,和阿法替尼二马来酸盐现有技术晶型的针状晶体相比有着更好的流动性和可加工性。TGA图谱如图22所示。显示:该样品100℃之前有5.97%的失重,为三水合物,分解温度为275.4℃,和阿法替尼二马来酸盐现有技术晶型的164.1℃分解温度相比有着更好的热稳定性。DVS等温吸附曲线如图16所示。显示:N1晶型阿法替尼1,5-萘二磺酸盐在50%相对湿度以上开始形成N2晶型阿法替尼1,5-萘二磺酸盐水合物,形成N2晶型阿法替尼1,5-萘二磺酸盐水合物后至80%相对湿度,吸水的重量变化为1.8%,N2晶型阿法替尼1,5-萘二磺酸盐水合物在30%相对湿度以上稳定,在30%相对湿度以下开始脱去结晶水。和阿法替尼二马来酸盐现有技术晶型在相同条件下(30%-80%相对湿度下)吸水重量变化为2.2%相比,N2晶型阿法替尼1,5-萘二磺酸盐水合物有着更低的吸湿性。红外光谱分析如图23所示。拉曼光谱分析如图24所示。实施例21N2晶型阿法替尼1,5-萘二磺酸盐水合物的制备将实施例20中的“相对湿度75%的湿度器”替换为“相对湿度85%的湿度器”,其它操作同实施例20,得到N2晶型阿法替尼1,5-萘二磺酸盐水合物。实施例22N2晶型阿法替尼1,5-萘二磺酸盐水合物的制备将实施例20中的“24小时”替换为“3天”,其它操作同实施例20,得到N2晶型阿法替尼1,5-萘二磺酸盐水合物。实施例23阿法替尼一丙二酸盐的制备取50mg阿法替尼游离碱加入4mL乙醇搅拌溶解,取15.9mg丙二酸加入4mL乙醇搅拌溶解,将丙二酸的乙醇液缓慢滴加至阿法替尼游离碱的乙醇溶液中形成浆液并搅拌,室温下搅拌过夜有固体析出,40℃真空旋干,得阿法替尼一丙二酸盐59.1mg,产率97.3%。实施例24M1晶型阿法替尼一丙二酸盐的制备取50mg阿法替尼游离碱加入4mL甲基叔丁基醚搅拌溶解,取15.9mg丙二酸加入4mL甲基叔丁基醚搅拌溶解,将丙二酸的甲基叔丁基醚溶液缓慢滴加至阿法替尼游离碱的甲基叔丁基醚溶液中形成浆液并搅拌,室温下搅拌过夜有固体析出,过滤,40℃真空干燥过夜,得M1晶型阿法替尼一丙二酸盐55mg,产率90.6%。XRPD分析如图25所示。PLM图谱如图26所示。显示:该盐为颗粒状晶体,较为规则,和阿法替尼二马来酸盐现有技术晶型的针状晶体相比有着更好的流动性和可加工性。TGA图谱如图27所示。显示:该盐的分解温度为108.3℃。红外光谱分析如图28所示。拉曼光谱分析如图29所示。NMR图谱如图30所示。显示:阿法替尼和丙二酸已经成盐。HPLC检测显示该盐中阿法替尼含量为83.0%,与阿法替尼和丙二酸以1:1摩尔比成盐的理论含量82.4%接近,说明阿法替尼和丙二酸以1:1摩尔比成盐。实施例25M1晶型阿法替尼一丙二酸盐的制备取实施例19制备的阿法替尼一丙二酸盐30mg,置于50ml烧瓶中,加入2ml甲醇形成浆液,室温下搅拌72小时,过滤,40℃真空干燥得M1晶型阿法替尼一丙二酸盐。实施例26M1晶型阿法替尼一丙二酸盐的制备将实施例25中的“甲醇”替换为“乙酸乙酯”,其他操作同实施例25,得到M1晶型阿法替尼一丙二酸盐。实施例27M1晶型阿法替尼一丙二酸盐的制备将实施例25中的“甲醇”替换为“丙酮”,其他操作同实施例25,得到M1晶型阿法替尼一丙二酸盐。实施例28M1晶型阿法替尼一丙二酸盐的制备将实施例25中的“甲醇”替换为“正庚烷”,其他操作同实施例25,得到M1晶型阿法替尼一丙二酸盐。实施例29阿法替尼二丙二酸盐的制备取50mg阿法替尼游离碱加入1.5mL乙腈中搅拌溶解,取21.4mg丙二酸加入4mL乙腈搅拌溶解,将阿法替尼游离碱的乙腈溶液缓慢滴加至丙二酸的乙腈溶液中形成浆液,搅拌,室温下固体析出后搅拌过夜,40℃真空旋干,得阿法替尼二丙二酸盐69mg,产率96.6%。实施例30M2晶型阿法替尼二丙二酸盐的制备取实施例23制备的50mg阿法替尼一丙二酸盐加入1mL乙酸乙酯中配成混悬液并搅拌,取8.81mg丙二酸加入2mL乙酸乙酯搅拌溶解,将丙二酸的乙酸乙酯溶液缓慢滴加至阿法替尼一丙二酸盐的乙酸乙酯混悬液中形成浆液,室温下搅拌过夜,过滤,40℃真空干燥过夜得M2晶型阿法替尼二丙二酸盐52.5mg,产率89.3%。实施例31M2晶型阿法替尼二丙二酸盐的制备取50mg阿法替尼游离碱加入1.5mL乙酸乙酯中搅拌溶解,取21.4mg丙二酸加入4mL乙酸乙酯搅拌溶解,将阿法替尼游离碱的乙酸乙酯溶液缓慢滴加至丙二酸的乙酸乙酯溶液中形成浆液并搅拌,室温下固体析出后搅拌过夜,过滤,40℃真空干燥过夜,得M2晶型阿法替尼二丙二酸盐66mg,产率92.4%。XRPD分析如图31所示。TGA图谱如图32所示。显示:该盐的分解温度为105.7℃。DVS等温吸附曲线如图33所示。显示:该盐在10%-80%相对湿度范围内重量变化为1.1%,和阿法替尼二马来酸盐现有技术晶型2.6%的重量变化相比有着更低的吸湿性。红外光谱分析如图34所示。拉曼光谱分析如图35所示。NMR图谱如图36所示。显示:阿法替尼和丙二酸已经成盐。HPLC检测显示该盐中阿法替尼含量为70.2%,与阿法替尼和丙二酸以1:2摩尔比成盐的理论含量70.0%接近,说明阿法替尼和丙二酸以1:2摩尔比成盐。实施例32M2晶型阿法替尼二丙二酸盐的制备取实施例29制备的阿法替尼二丙二酸盐30mg,置于50ml烧瓶中,加入2ml甲醇形成浆液,室温下搅拌72小时,过滤,40℃真空干燥得M2晶型阿法替尼二丙二酸盐。实施例33M2晶型阿法替尼二丙二酸盐的制备将实施例32中的“甲醇”替换为“乙酸乙酯”,其他操作同实施例32,得到M2晶型阿法替尼二丙二酸盐。实施例34M2晶型阿法替尼二丙二酸盐的制备将实施例32中的“甲醇”替换为“丙酮”,其他操作同实施例32,得到M2晶型阿法替尼二丙二酸盐。实施例35M2晶型阿法替尼二丙二酸盐的制备将实施例32中的“甲醇”替换为“正庚烷”,其他操作同实施例32,得到M2晶型阿法替尼二丙二酸盐。实施例36M2晶型阿法替尼二丙二酸盐的制备将实施例31中的“21.4mg丙二酸”替换为“42.8mg丙二酸”,其他操作同实施例31,得到M2晶型阿法替尼二丙二酸盐。实施例37阿法替尼二2-萘磺酸盐的制备取50mg阿法替尼游离碱加入1.5mL丙酮搅拌溶解,取42.8mg2-萘磺酸加入3mL丙酮搅拌溶解,将2-萘磺酸的丙酮溶液缓慢滴加至阿法替尼游离碱的丙酮溶液中形成浆液,搅拌,室温下有固体析出后搅拌过夜,40℃真空旋干,得阿法替尼二2-萘磺酸盐90mg,产率97.0%。实施例38Ns1晶型阿法替尼二2-萘磺酸盐的制备取50mg阿法替尼游离碱加入1.5mL乙酸乙酯,取42.8mg2-萘磺酸加入3mL乙酸乙酯搅拌溶解,将2-萘磺酸的乙酸乙酯溶液缓慢滴加至阿法替尼游离碱的乙酸乙酯溶液中形成浆液,搅拌,室温下有固体析出后搅拌过夜,过滤40℃真空干燥过夜,得Ns1晶型阿法替尼二2-萘磺酸盐85mg,产率91.7%。XRPD分析如图37所示。TGA图谱如图38所示。显示:该盐的分解温度为249.1℃,和阿法替尼二马来酸盐现有技术晶型的164.1℃分解温度相比有着更好的热稳定性。红外光谱分析如图39所示。拉曼光谱分析如图40所示。NMR图谱如图41所示。显示:阿法替尼和2-萘磺酸已经成盐。HPLC检测显示该盐中阿法替尼含量为55.0%,与阿法替尼和2-萘磺酸以1:2摩尔比成盐的理论含量53.9%接近,说明阿法替尼和2-萘磺酸以1:2摩尔比成盐。实施例39阿法替尼一2-萘磺酸盐的制备取10mg阿法替尼游离碱加入0.5mL乙酸乙酯搅拌溶解,取4.3mg2-萘磺酸加入0.5mL乙酸乙酯搅拌溶解,将2-萘磺酸的乙酸乙酯溶液缓慢滴加至阿法替尼游离碱的乙酸乙酯溶液中,搅拌,室温下有固体析出后搅拌过夜,过滤40℃真空干燥过夜,得白色固体阿法替尼一2-萘磺酸盐。实施例40Ns1晶型阿法替尼二2-萘磺酸盐的制备取实施例37制备的阿法替尼二2-萘磺酸盐30mg,置于50ml烧瓶中,加入0.2ml甲醇形成浆液,室温下搅拌72小时,过滤,40℃真空干燥得Ns1晶型阿法替尼二2-萘磺酸盐。实施例41Ns1晶型阿法替尼二2-萘磺酸盐的制备将实施例40中的“甲醇”替换为“甲基叔丁基醚”,其他操作同实施例40,得到Ns1晶型阿法替尼二2-萘磺酸盐。实施例42Ns1晶型阿法替尼二2-萘磺酸盐的制备将实施例40中的“甲醇”替换为“丙酮”,其他操作同实施例40,得到Ns1晶型阿法替尼二2-萘磺酸盐。实施例43Ns1晶型阿法替尼二2-萘磺酸盐的制备将实施例40中的“甲醇”替换为“正庚烷”,其他操作同实施例40,得到Ns1晶型阿法替尼二2-萘磺酸盐。实施例44Ns1晶型阿法替尼二2-萘磺酸盐的制备将实施例38中的“42.8mg2-萘磺酸”替换为“64.2mg2-萘磺酸”,其他操作同实施例38,得到Ns1晶型阿法替尼二2-萘磺酸盐。实施例45阿法替尼二氨基磺酸盐的制备取50mg阿法替尼游离碱加入1.5mL乙酸乙酯溶解,取20mg氨基磺酸加入2mL乙酸乙酯配成混悬液并搅拌,将阿法替尼游离碱的乙酸乙酯溶液缓慢滴加至氨基磺酸的乙酸乙酯混悬液中形成浆液,室温下搅拌4小时,40℃真空旋干,得阿法替尼二氨基磺酸盐67.5mg,产率96.4%。实施例46S1晶型阿法替尼二氨基磺酸盐的制备取50mg阿法替尼游离碱加入1mL乙腈溶解,取20mg氨基磺酸加入2mL乙腈配成混悬液并搅拌,将阿法替尼游离碱的乙腈溶液缓慢滴加至氨基磺酸的乙腈的混悬液中形成浆液,室温下搅拌4小时,过滤,40℃真空干燥过夜得S1晶型阿法替尼二氨基磺酸盐62mg,产率88.6%。XRPD分析如图42所示。TGA图谱如图43所示。显示:该盐的分解温度为246.3℃,和阿法替尼二马来酸盐现有技术晶型的164.1℃分解温度相比有着更好的热稳定性。红外光谱分析如图44所示。拉曼光谱分析如图45所示。NMR图谱如图46所示。显示:阿法替尼和氨基磺酸已经成盐。HPLC检测显示该盐中阿法替尼含量为70.9%,与阿法替尼和氨基磺酸以1:2摩尔比成盐的理论含量71.5%接近,说明阿法替尼和氨基磺酸以1:2摩尔比成盐。实施例47阿法替尼一氨基磺酸盐的制备取10mg阿法替尼游离碱加入0.5mL乙酸乙酯溶解,取2mg氨基磺酸加入0.5mL乙酸乙酯配成混悬液并搅拌,将阿法替尼游离碱的乙酸乙酯溶液缓慢滴加至氨基磺酸的乙酸乙酯混悬液中,室温下搅拌4小时,过滤40℃真空干燥过夜得白色固体阿法替尼一氨基磺酸盐。实施例48S1晶型阿法替尼二氨基磺酸盐的制备取实施例45制备的阿法替尼二氨基磺酸盐30mg,置于50ml烧瓶中,加入2ml甲醇形成浆液,室温下搅拌72小时,过滤,40℃真空干燥得S1晶型阿法替尼二氨基磺酸盐。实施例49S1晶型阿法替尼二氨基磺酸盐的制备将实施例48中的“甲醇”替换为“甲基叔丁基醚”,其他操作同实施例48,得到S1晶型阿法替尼二氨基磺酸盐。实施例50S1晶型阿法替尼二氨基磺酸盐的制备将实施例48中的“甲醇”替换为“丙酮”,其他操作同实施例48,得到S1晶型阿法替尼二氨基磺酸盐。实施例51S1晶型阿法替尼二氨基磺酸盐的制备将实施例48中的“甲醇”替换为“正庚烷”,其他操作同实施例48,得到S1晶型阿法替尼二氨基磺酸盐。实施例52S1晶型阿法替尼二氨基磺酸盐的制备将实施例46中的“20mg氨基磺酸”替换为“40mg氨基磺酸”,其他操作同实施例46,得到S1晶型阿法替尼二氨基磺酸盐。实施例53阿法替尼二D-葡萄糖酸盐的制备取50mg阿法替尼游离碱加入1.5mL硝基甲烷溶解,取50%的D-葡萄糖酸水溶液88mg直接滴加至阿法替尼游离碱的硝基甲烷溶液中并搅拌,有油状物析出后将上层清液取出,向油状物加入1mL乙腈,室温下搅拌过夜,得到阿法替尼二D-葡萄糖酸盐固体,40℃真空旋干,得88mg,产率97.4%。实施例54G1晶型阿法替尼二D-葡萄糖酸盐的制备取50mg阿法替尼游离碱加入1.5mL乙酸乙酯溶解,取50%的D-葡萄糖酸水溶液88mg直接滴加至阿法替尼游离碱的乙酸乙酯溶液中并搅拌,有油状物析出后将上层清液取出,向油状物加入1mL乙腈,室温下搅拌过夜,过滤,40℃真空干燥过夜,得G1晶型阿法替尼二D-葡萄糖酸盐59mg,产率65.3%。XRPD分析如图47所示。TGA图谱如图48所示。显示:该盐的分解温度为129.4℃。DSC图谱如图49所示。显示:该盐的熔点为101.3℃。红外光谱分析如图50所示。拉曼光谱分析如图51所示。NMR图谱如图52所示。显示:阿法替尼和D-葡萄糖酸已经成盐。HPLC检测显示该盐中阿法替尼含量为54.4%,与阿法替尼和D-葡萄糖酸以1:2摩尔比成盐的理论含量55.3%接近,说明阿法替尼和D-葡萄糖酸以1:2摩尔比成盐。实施例55阿法替尼一D-葡萄糖酸盐的制备取10mg阿法替尼游离碱加入0.5mL硝基甲烷溶解,取50%的D-葡萄糖酸水溶液8.1mg直接滴加至阿法替尼游离碱的硝基甲烷溶液中并搅拌,有油状物析出后将上层清液取出,向油状物加入1mL乙腈,搅拌过夜,得到白色固体阿法替尼一D-葡萄糖酸盐。实施例56G1晶型阿法替尼二D-葡萄糖酸盐的制备取实施例53制备的阿法替尼二D-葡萄糖酸盐30mg,置于50ml烧瓶中,加入2ml甲醇形成浆液,室温下搅拌72小时,过滤,40℃真空干燥得G1晶型阿法替尼二D-葡萄糖酸盐。实施例57G1晶型阿法替尼二D-葡萄糖酸盐的制备将实施例56中的“甲醇”替换为“甲基叔丁基醚”,其他操作同实施例56,得到G1晶型阿法替尼二D-葡萄糖酸盐。实施例58G1晶型阿法替尼二D-葡萄糖酸盐的制备将实施例56中的“甲醇”替换为“乙酸乙酯”,其他操作同实施例56,得到G1晶型阿法替尼二D-葡萄糖酸盐。实施例59G1晶型阿法替尼二D-葡萄糖酸盐的制备将实施例56中的“甲醇”替换为“丙酮”,其他操作同实施例56,得到G1晶型阿法替尼二D-葡萄糖酸盐。实施例60G1晶型阿法替尼二D-葡萄糖酸盐的制备将实施例56中的“甲醇”替换为“正庚烷”,其他操作同实施例56,得到G1晶型阿法替尼二D-葡萄糖酸盐。实施例61G1晶型阿法替尼二D-葡萄糖酸盐的制备将实施例54中的“D-葡萄糖酸水溶液88mg”替换为“D-葡萄糖酸水溶液160mg”,其他操作同实施例54,得到G1晶型阿法替尼二D-葡萄糖酸盐。实施例62阿法替尼二环己烷氨基磺酸盐的制备取50mg阿法替尼游离碱加入1mL乙酸乙酯溶解,取40.6mg环己烷氨基磺酸加入3mL乙酸乙酯配成混悬液并搅拌,将阿法替尼游离碱的乙酸乙酯溶液缓慢滴加至环己烷氨基磺酸的乙酸乙酯的混悬液中,室温下搅拌过夜,40℃真空旋干,得阿法替尼二环己烷氨基磺酸盐80mg,产率92.2%。实施例63C1晶型阿法替尼二环己烷氨基磺酸盐的制备取50mg阿法替尼游离碱加入1mL乙腈溶解,取40.6mg环己烷氨基磺酸加入3mL乙腈配成混悬液并搅拌,将阿法替尼游离碱的乙腈溶液缓慢滴加至环己烷氨基磺酸的乙腈的混悬液中,室温下搅拌过夜,过滤40℃真空干燥过夜,得C1晶型阿法替尼二环己烷氨基磺酸盐74.6mg,产率85.9%。XRPD分析如图53所示。TGA图谱如图54所示。显示:该盐的分解温度为246.1℃,和阿法替尼二马来酸盐现有技术晶型的164.1℃分解温度相比有着更好的热稳定性。红外光谱分析如图55所示。拉曼光谱分析如图56所示。NMR图谱如图57所示。显示:阿法替尼和环己烷氨基磺酸已经成盐。HPLC检测显示该盐中阿法替尼含量为58.3%,与阿法替尼和环己烷氨基磺酸以1:2摩尔比成盐的理论含量57.6%接近,说明阿法替尼和环己烷氨基磺酸以1:2摩尔比成盐。实施例64阿法替尼一环己烷氨基磺酸盐的制备取10mg阿法替尼游离碱加入0.5mL乙腈溶解,取4.1mg环己烷氨基磺酸加入1mL乙腈配成混悬液并搅拌,将阿法替尼游离碱的乙腈溶液缓慢滴加至环己烷氨基磺酸的乙腈的混悬液中,室温下搅拌过夜,过滤,40℃真空干燥过夜得白色固体阿法替尼一环己烷氨基磺酸盐。实施例65C1晶型阿法替尼二环己烷氨基磺酸盐的制备取实施例62制备的阿法替尼二环己烷氨基磺酸盐30mg,置于50ml烧瓶中,加入2ml甲醇形成浆液,室温下搅拌72小时,过滤,40℃真空干燥得C1晶型阿法替尼二环己烷氨基磺酸盐。实施例66C1晶型阿法替尼二环己烷氨基磺酸盐的制备将实施例65中的“甲醇”替换为“乙酸乙酯”,其他操作同实施例65,得到C1晶型阿法替尼二环己烷氨基磺酸盐。实施例67C1晶型阿法替尼二环己烷氨基磺酸盐的制备将实施例65中的“甲醇”替换为“甲基叔丁基醚”,其他操作同实施例65,得到C1晶型阿法替尼二环己烷氨基磺酸盐。实施例68C1晶型阿法替尼二环己烷氨基磺酸盐的制备将实施例65中的“甲醇”替换为“丙酮”,其他操作同实施例65,得到C1晶型阿法替尼二环己烷氨基磺酸盐。实施例69C1晶型阿法替尼二环己烷氨基磺酸盐的制备将实施例65中的“甲醇”替换为“正庚烷”,其他操作同实施例65,得到C1晶型阿法替尼二环己烷氨基磺酸盐。实施例70C1晶型阿法替尼二环己烷氨基磺酸盐的制备将实施例63中的“40.6mg环己烷氨基磺酸”替换为“73mg环己烷氨基磺酸”,其他操作同实施例63,得到C1晶型阿法替尼二环己烷氨基磺酸盐。实施例71阿法替尼二4-氨基苯磺酸盐的制备取50mg阿法替尼游离碱加入1mL丙酮溶解,取39.2mg4-氨基苯磺酸加入3mL丙酮配成混悬液并搅拌,将阿法替尼游离碱的丙酮溶液缓慢滴加至4-氨基苯磺酸的丙酮混悬液中,室温下搅拌过夜,40℃真空旋干,得阿法替尼二4-氨基苯磺酸盐78mg,产率91.1%。实施例72A1晶型阿法替尼二4-氨基苯磺酸盐的制备取50mg阿法替尼游离碱加入1mL乙腈溶解,取39.2mg4-氨基苯磺酸加入3mL乙腈配成混悬液并搅拌,将阿法替尼游离碱的乙腈溶液缓慢滴加至4-氨基苯磺酸的乙腈混悬液中,室温下搅拌过夜,过滤并40℃干燥过夜,得A1晶型阿法替尼二4-氨基苯磺酸盐65mg,产率75.9%。XRPD分析如图58所示。TGA图谱如图59所示。显示:该盐的分解温度为261.7℃,和阿法替尼二马来酸盐现有技术晶型的164.1℃分解温度相比有着更好的热稳定性。红外光谱分析如图60所示。拉曼光谱分析如图61所示。NMR图谱如图62所示。显示:阿法替尼和4-氨基苯磺酸已经成盐。HPLC检测显示该盐中阿法替尼含量为59.1%,与阿法替尼和4-氨基苯磺酸以1:2摩尔比成盐的理论含量58.4%接近,说明阿法替尼和4-氨基苯磺酸以1:2摩尔比成盐。实施例73阿法替尼一4-氨基苯磺酸盐的制备取10mg阿法替尼游离碱加入0.5mL乙腈溶解,取3.9mg4-氨基苯磺酸加入1mL乙腈配成混悬液并搅拌,将阿法替尼游离碱的乙腈溶液缓慢滴加至4-氨基苯磺酸的乙腈混悬液中,室温下搅拌过夜,过滤并40℃干燥过夜得白色固体阿法替尼一4-氨基苯磺酸盐。实施例74A1晶型阿法替尼二4-氨基苯磺酸盐的制备取实施例71制备的阿法替尼二4-氨基苯磺酸盐30mg,置于50ml烧瓶中,加入2ml甲醇形成浆液,室温下搅拌72小时,过滤,40℃真空干燥得A1晶型阿法替尼二4-氨基苯磺酸盐。实施例75A1晶型阿法替尼二4-氨基苯磺酸盐的制备将实施例74中的“甲醇”替换为“乙酸乙酯”,其他操作同实施例74,得到A1晶型阿法替尼二4-氨基苯磺酸盐。实施例76A1晶型阿法替尼二4-氨基苯磺酸盐的制备将实施例74中的“甲醇”替换为“甲基叔丁基醚”,其他操作同实施例74,得到A1晶型阿法替尼二4-氨基苯磺酸盐。实施例77A1晶型阿法替尼二4-氨基苯磺酸盐的制备将实施例74中的“甲醇”替换为“丙酮”,其他操作同实施例74,得到A1晶型阿法替尼二4-氨基苯磺酸盐。实施例78A1晶型阿法替尼二4-氨基苯磺酸盐的制备将实施例74中的“甲醇”替换为“正庚烷”,其他操作同实施例74,得到A1晶型阿法替尼二4-氨基苯磺酸盐。实施例79A1晶型阿法替尼二4-氨基苯磺酸盐的制备将实施例72中的“39.2mg4-氨基苯磺酸”替换为“70mg4-氨基苯磺酸”,其他操作同实施例72,得到A1晶型阿法替尼二4-氨基苯磺酸盐。实施例80阿法替尼甘醇酸盐的制备取50mg阿法替尼游离碱加入1.5mL乙酸乙酯搅拌溶解,取8.6mg甘醇酸加入1.5mL乙酸乙酯搅拌溶解,将甘醇酸的乙酸乙酯溶液缓慢滴加至阿法替尼游离碱的乙酸乙酯溶液中形成浆液并搅拌,滴加过程中有固体析出,室温下搅拌过夜,40℃真空旋干,得阿法替尼甘醇酸盐54.4mg,产率94.1%。实施例81Gl-1晶型阿法替尼甘醇酸盐的制备取50mg阿法替尼游离碱加入1.5mL硝基甲烷搅拌溶解,取8.6mg甘醇酸加入3mL硝基甲烷搅拌溶解,将甘醇酸的硝基甲烷溶液缓慢滴加至阿法替尼游离碱的硝基甲烷溶液中形成浆液并搅拌,室温下搅拌过夜后有固体析出,过滤并40℃真空干燥过夜得Gl-1晶型阿法替尼甘醇酸盐50mg,产率86.5%。XRPD分析如图63所示。TGA图谱如图64所示。显示:该盐的分解温度为112.4℃。DSC图谱如图65所示。显示:该盐的熔点为83.5℃。红外光谱分析如图66所示。拉曼光谱分析如图67所示。NMR图谱如图68所示。显示:阿法替尼和甘醇酸已经成盐。HPLC检测显示该盐中阿法替尼含量为85.4%,与阿法替尼和甘醇酸以1:1摩尔比成盐理论含量86.5%接近,说明阿法替尼和甘醇酸以1:1摩尔比成盐。实施例82阿法替尼二甘醇酸盐的制备取10mg阿法替尼游离碱加入0.5mL乙酸乙酯溶解,取3.4mg甘醇酸加入1mL乙酸乙酯搅拌溶解,将甘醇酸的乙酸乙酯溶液缓慢滴加至阿法替尼游离碱的乙酸乙酯溶液中并搅拌,滴加过程中有固体析出,室温下搅拌过夜后过滤,40℃真空干燥过夜得白色固体阿法替尼二甘醇酸盐。实施例83Gl-1晶型阿法替尼甘醇酸盐的制备取实施例80制备的阿法替尼甘醇酸盐30mg,置于50ml烧瓶中,加入2ml甲醇形成浆液,室温下搅拌72小时,过滤,40℃真空干燥得Gl-1晶型阿法替尼甘醇酸盐。实施例84Gl-1晶型阿法替尼甘醇酸盐的制备将实施例83中的“甲醇”替换为“甲基叔丁基醚”,其他操作同实施例83,得到Gl-1晶型阿法替尼甘醇酸盐。实施例85Gl-1晶型阿法替尼甘醇酸盐的制备将实施例83中的“甲醇”替换为“丙酮”,其他操作同实施例83,得到Gl-1晶型阿法替尼甘醇酸盐。实施例86Gl-1晶型阿法替尼甘醇酸盐的制备将实施例83中的“甲醇”替换为“正庚烷”,其他操作同实施例83,得到Gl-1晶型阿法替尼甘醇酸盐。实施例87Gl-1晶型阿法替尼甘醇酸盐的制备将实施例81中的“8.6mg甘醇酸”替换为“15.5mg甘醇酸”,其他操作同实施例81,得到Gl-1晶型阿法替尼甘醇酸盐。实施例88阿法替尼二马来酸盐晶型N的制备取50mg阿法替尼游离碱加入2mL硝基甲烷搅拌溶解,取26.5mg马来酸加入1mL硝基甲烷搅拌溶解,将马来酸的硝基甲烷溶液缓慢滴加至阿法替尼游离碱的硝基甲烷溶液中形成浆液并搅拌,滴加过程中有固体析出,室温下搅拌过夜后过滤,40℃真空干燥过夜得63mg阿法替尼二马来酸盐晶型N,产率85.3%。XRPD分析如图69所示。TGA图谱如图70所示。显示:该盐的分解温度为133.7℃。红外光谱分析如图71所示。拉曼光谱分析如图72所示。HPLC检测显示该盐中阿法替尼含量为68.1%,与阿法替尼和马来酸以1:2摩尔比成盐的理论含量67.7%接近,说明阿法替尼和马来酸以1:2摩尔比成盐。实施例89阿法替尼二马来酸盐晶型N的制备将实施例88中的“26.5mg马来酸”替换为“39.8mg马来酸”,其它操作同实施例88,得到阿法替尼二马来酸盐晶型N。实施例90按照表2处方制备包含不同剂量的本发明阿法替尼二马来酸盐晶型N(实施例88)的A、B、C、D和E五种片剂。表2A、B、C、D、E五种片剂处方片剂的制备方法是:使微晶纤维素、交聚维酮、未研磨的实施例88制得的阿法替尼二马来酸盐晶型N通过#30目筛(约430μ到约655μ)。将过筛后的交聚维酮装入3立方英尺双壳翻滚搅拌机中,加入过筛后的微晶纤维素和乳糖一水合物,混合约5分钟;加入过筛后的阿法替尼二马来酸盐晶型N,再混合25分钟。该预混物通过排放处附有锤式粉碎机的滚筒压实机,并移回翻滚搅拌机中。硬脂酸镁和无水胶体二氧化硅加入到翻滚搅拌机中,混合约3分钟。最终混合物在旋转式压片机上压制,生产批量200,000片。实施例91-101按照表2处方及实施例90的制备方法,将实施例90中的阿法替尼二马来酸盐晶型N(实施例88)分别替换为阿法替尼的E1晶型乙二磺酸盐(实施例3)、N1晶型1,5-萘二磺酸盐(实施例12)、N2晶型1,5-萘二磺酸盐水合物(实施例20)、M1晶型一丙二酸盐(实施例24)、M2晶型二丙二酸盐(实施例31)、Ns1晶型二2-萘磺酸盐(实施例38)、S1晶型二氨基磺酸盐(实施例46)、G1晶型二D-葡萄糖酸盐(实施例54)、C1晶型二环己烷氨基磺酸盐(实施例63)、A1晶型二4-氨基苯磺酸盐(实施例72)和Gl-1晶型甘醇酸盐(实施例81),分别得到实施例91-101的片剂。实施例102制备包含本发明阿法替尼二马来酸盐晶型N(实施例88)的胶囊,表3列出了其单一剂量配方和批量配方。表3包含阿法替尼二马来酸盐晶型N的胶囊配方胶囊的制备方法是:使乳糖一水合物、微晶纤维素和实施例88制得的阿法替尼二马来酸盐晶型N通过710μm筛,然后装入带挡板插入的扩散混合器中,混合15分钟。使硬脂酸镁通过210μm筛,添加到扩散混合器中。然后使用Dosator型胶囊充填机将混合物装入0#号胶囊中,500mg/胶囊,生产批量84000粒胶囊。实施例103-113按照表3配方及实施例102的制备方法,将实施例102中的阿法替尼二马来酸盐晶型N(实施例88)分别替换为阿法替尼的E1晶型阿法替尼乙二磺酸盐(实施例3)、N1晶型1,5-萘二磺酸盐(实施例12)、N2晶型1,5萘二磺酸盐水合物(实施例20)、M1晶型一丙二酸盐(实施例24)、M2晶型二丙二酸盐(实施例31)、Ns1晶型二2-萘磺酸盐(实施例38)、S1晶型二氨基磺酸盐(实施例46)、G1晶型二D-葡萄糖酸盐(实施例54)、C1晶型二环己烷氨基磺酸盐(实施例63)、A1晶型二4-氨基苯磺酸盐(实施例72)和Gl-1晶型甘醇酸盐(实施例81),分别得到实施例103-113的胶囊。对比例1将制备例1、实施例3、12、20、24、31、38、46、54、63、72、81和88的阿法替尼的酸加成盐各取5mg,25℃下逐步向每份样品中添加纯水直至样品全部溶清,根据样品的实际重量和水的量计算得样品的溶解度。结果见表4,平行试验表明样品在该检测过程中未发生转晶。表4阿法替尼酸加成盐的溶解度测试结果阿法替尼的盐溶解度(mg/ml)二马来酸盐晶型(现有技术)(制备例1)7.5E1晶型乙二磺酸盐(实施例3)55.7N1晶型1,5-萘二磺酸盐(实施例12)1.4N2晶型1,5-萘二磺酸盐水合物(实施例20)1.4M1晶型一丙二酸盐(实施例24)40.8M2晶型二丙二酸盐(实施例31)26.2Ns1晶型二2-萘磺酸盐(实施例38)2.0S1晶型二氨基磺酸盐(实施例46)138.3G1晶型二D-葡萄糖酸盐(实施例54)5.4C1晶型二环己烷氨基磺酸盐(实施例63)63.1A1晶型二4-氨基苯磺酸盐(实施例72)123.8Gl-1晶型甘醇酸盐(实施例81)小于0.1二马来酸晶型N(实施例88)12.7对比例2按照实施例90、实施例91-101中的片剂配方和制备方法,制备阿法替尼二马来酸盐现有技术晶型的片剂以及本发明的E1晶型阿法替尼乙二磺酸盐、N1晶型阿法替尼1,5-萘二磺酸盐、N2晶型1,5-萘二磺酸盐水合物、M1晶型阿法替尼一丙二酸盐的片剂各100片,观察压片过程及片型。结果显示:现有技术阿法替尼二马来酸盐晶型的片剂23%有粘冲现象,而其余片剂则没有。说明:在片剂的可加工性方面,上述本发明阿法替尼酸加成盐晶型的颗粒状晶体均优于现有技术阿法替尼二马来酸盐晶型的针状晶体。对比例3取对比例2制备的阿法替尼二马来酸盐现有技术晶型的完好片剂以及E1晶型阿法替尼乙二磺酸盐、N1晶型阿法替尼1,5-萘二磺酸盐、N2晶型1,5-萘二磺酸盐水合物、M1晶型阿法替尼一丙二酸盐的完好片剂各20片,进行硬度测试。结果显示:E1晶型阿法替尼乙二磺酸盐片剂的硬度平均值(9.54Kg)、N1晶型阿法替尼1,5-萘二磺酸盐片剂的硬度平均值(9.01Kg)、N2晶型阿法替尼1,5-萘二磺酸盐水合物片剂的硬度平均值(8.55Kg)、M1晶型阿法替尼一丙二酸盐片剂的硬度平均值(8.71Kg)均高于现有技术阿法替尼二马来酸盐晶型片剂的硬度平均值(7.10Kg)。说明:在片剂的可压性方面,上述本发明阿法替尼酸加成盐晶型的颗粒状晶体均优于现有技术阿法替尼二马来酸盐晶型的针状晶体。以上所述,仅为本发明的具体实施方式,但本发明的保护范围并不局限于此,任何熟悉本领域的技术人员在本发明所揭露的技术范围内,可不经过创造性劳动想到的变化或替换,都应涵盖在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1