棉花的一个DREB1类转录因子及其编码基因与应用的制作方法与工艺
本发明涉及植物转录因子及其编码基因与应用,特别是涉及一个来源于棉花的DREB1类转录因子GhCBF3及其编码基因,以及其在培育耐逆性提高的转基因植物中的应用。
背景技术:
非生物胁迫,如干旱、盐渍、极端温度、化学污染和氧损伤等能够对植物的生长发育造成严重的危害,对作物产量造成极大损失,其中干旱对作物产量的影响,在诸多自然逆境中占首位,其危害相当于其它灾害之和,是许多地区是农业发展的瓶颈。据统计,世界干早、半干早地区占陆地面积的34%;我国干早、半干旱地区约占国土面积的52%,年受早面积达20~270万公顷,全国灌溉区每年缺水约30亿立方米,因缺水而少收粮食350~40亿公斤;特别是我国主要产粮区如华北、东北和西北,是我国缺水最严重的地区,春旱频繁达到十年九遇。由于植物的耐胁迫性大多属于数量性状,现有可利用的种质资源匮乏,采用常规育种技术改良植物胁迫耐性的难度相当大,培育出真正的耐胁迫品种就尤为困难。近年来,随着对植物抗逆分子机理研究的不断深入和分子生物学技术的迅猛发展,抗逆研究已经从生理水平深入到分子水平,促进了植物抗逆基因工程的发展。当植物在受到胁迫时会产生相应的应答反应,来降低或消除给植株带来的危害。植物的这种应答反应是一个涉及多基因、多信号途径、多基因产物的复杂过程。这些基因及其表达产物可以分为3类:(1)参与信号级联放大系统和转录控制的基因及产物;(2)直接对保护生物膜和蛋白质起作用的基因及其表达产物;(3)与水和离子的摄入和转运相关的蛋白质。近年来,通过转基因技术提高植物对胁迫耐受能力的研究,以及对胁迫具有耐受能力的农作物、旱生植物和盐生植物的研究都取得了显著的成果,对胁迫相关基因和信号转导系统也有了更进一步的了解(LiuQ.1998.Twotranscriptionfactors,DREB1andDREB2,withanEREBP/AP2DNAbindingdomain,separatetwocellularsignaltransductionpathwaysindrought-andlowtemperature-responsivegeneexpression,respectively,inArabidopsis.PlantCell,10:1391-1406;KANGJY.2002.Arabidopsisbasicleucinezipperproteinsthatmediatestress2responsiveabscisicacidsignaling。PlantCell,14:343-357;ABEH.2003.ArabidopsisAtMYC2(bHLH)andAtMYB2(MYB)functionastranscriptionalactivatorsinabscisicacidsignaling.PlantCell,15:63-78.)。但就目前的研究状况而言,由于其机制十分复杂,许多植物对逆境下的生物化学和生理学上的响应机制仍有待深入研究。在抗逆应答基因的功能及表达调控方面的研究占多数,但抗逆相关的信号传递途径之间的联系以及整个信号传递网络系统的机理还有待进一步研究。虽然许多研究机构通过现代生物技术,获得了各类具有一定抗逆能力的转基因植物,但还未达到产业化的标准。因此在提高植物抗逆性方面,还有许多工作需要做。
技术实现要素:
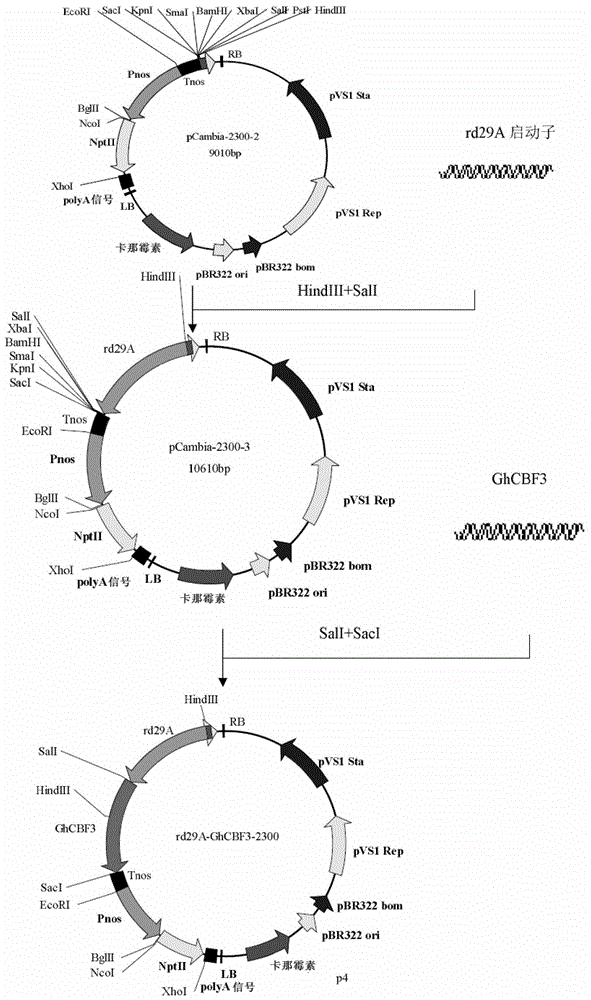
本发明人利用SSH与RACE相结合的方法克隆出了棉花的一个DREB(脱水应答元件结合蛋白,dehydrationresponsiveelementbindingprotein)类转录因子(本文命名为GhCBF3)的编码基因的DNA序列。并发现将其导入转基因植株后,可明显改善转基因植株的抗寒性和抗旱性,而且这些性状可稳定遗传。本发明第一方面提供棉花的一个DREB类转录因子GhCBF3,其序列为SEQIDNO:1。本发明第二方面提供编码本发明第一方面所述的转录因子的核苷酸序列。优选地,所述核苷酸序列具有SEQIDNO:2所示的核苷酸序列。本发明第三方面提供一种重组表达载体,其含有本发明第二方面所述的核苷酸序列并且所述核苷酸序列与所述表达载体的表达控制序列可操作地连接;优选地,所述载体为附图2所示的rd29A-GhCBF3-2300载体。本发明第四方面提供一种重组细胞,其含有本发明第二方面所述的核苷酸序列或者本发明第三方面所述的重组表达载体;优选地,所述重组细胞为重组农杆菌细胞。本发明第五方面一种改善植物耐寒性和/或抗旱性的方法,包括:将本发明第二方面所述的核苷酸序列或者本发明第三方面所述的重组表达载体导入植物或植物组织并使所述基因表达;优选地,所述植物是烟草。本发明第六方面一种制备转基因植物的方法,包括:在有效产生植物的条件下培养含有本发明第二方面所述的核苷酸序列、本发明第三方面所述的重组表达载体的植物或植物组织;优选地,所述植物是烟草。本发明第七方面提供本发明第一方面所述的转录因子、本发明第二方面所述的核苷酸序列、本发明第三方面所述的重组表达载体或者本发明第四方面所述的重组细胞用于改善植物耐寒性和/或抗旱性以及用于植物育种的用途;优选地,所述植物是烟草。附图说明图1是GhCBF3的植物表达载体(rd29A-GhCBF3-2300)的构建流程。图2是GhCBF3的植物表达载体(rd29A-GhCBF3-2300)的质粒图。图3是转基因烟草抗寒性的实验结果。图左为转基因植株(T1I1-2);图右为非转基因植株(对照)。图4是转基因烟草抗旱性的实验结果。图左为转基因植株(T1I4-13);图右为非转基因植株(对照)。具体实施方式实施例下面结合非限制性实施例对本发明进行进一步说明。下面实施例中提到的限制性内切酶均购自NewEnglandBiolabs公司实施例1冷胁迫下棉花SSH文库构建:具体方法为:利用Clontech公司的PCR-selectTMcDNASubtractionKit,按照产品说明书所示的方法通过抑制消减杂交方法构建消减文库。在实验过程中以低温处理6h的棉花幼苗叶片的mRNA作为样本(tester),以未处理的棉花幼苗叶片的mRNA作为对照(driver)。(1)供试材料:冀棉14(国家棉花中期库,获取单位中国棉花研究所,统一编号:ZM-30270)播种到灭过菌的蛭石上,在25℃、光周期16h/8h条件下培养,每周浇1/2MS培养基(9.39mMKNO3,0.625mMKH2PO4,10.3mMNH4NO3,0.75mMMgSO4,1.5mMCaCl2,50μMKI,100μMH3BO3,100μMMnSO4,30μMZnSO4,1μMNa2MoO4,0.1μMCoCl2,100μMNa2EDTA,100μMFeSO4)一次。当苗株高达25-30cm时用于实验。(2)材料处理:将供试幼苗分为2组,每组4盆,每盆1株。第一组为对照组,在25℃、光照培养,第二组为低温处理组,在4℃低温中处理6h,光照培养。处理完毕后及时剪取两组幼苗顶端1/3的叶片,用液氮迅速冷冻后,于-70℃冰箱中保存。(3)总RNA提取:分别取对照和低温处理的棉花叶子0.5g,用植物RNA提取试剂盒(invitrogen)提取棉花的总RNA。用HITACHI公司的紫外分光光度计U-2001测定总RNA在260nm和280nm的吸光度值,OD260/OD280比值为1.8-2.0,表明总RNA纯度较高,用1.0%的琼脂糖凝胶电泳检测总RNA的完整性,28S条带的亮度约为18S条带的2倍,表明RNA的完整性良好。使用Qiagen公司的OligotexmRNA纯化试剂盒(purificationofpolyA+RNAfromtotalRNA)分离mRNA。(4)抑制消减杂交:为了增加获得EST(unigene)的有效性,避免基因无酶切位点及所获得序列在非翻译区,本实验室使用Clontech公司的PCR-selectTMcDNASubtractionKit,按照商品说明书用RsaI,HaeIII分别对来自上述分离mRNA的双链cDNA进行消化,做两组抑制消减杂交,其他步骤及方法严格按Clontech公司的PCR-selectTMcDNASubtractionKit产品说明书所示的方法进行抑制消减杂交,最后合并两组正向消减杂交cDNA片段的第二次PCR产物。(5)cDNA消减文库的构建与初步筛选、克隆、鉴定合并的正向消减杂交cDNA片段的第二次PCR产物(QIAquickPCRPurificationKit纯化,购自Qiagen)与pGEM-TEasy载体(购自Promega)连接,依照pGEM-TEasy试剂盒产品说明书所示的方法,具体步骤如下:用200ulPCR管依次加入下列成分:纯化cDNA片段的第二次PCR产物3ul,T4连接酶缓冲液5ul,pGEM-TEasy载体1ul,T4DNA连接酶1ul,于4℃连接过夜。取10μL连接反应产物,加入到100μL感受态大肠杆菌JM109(购自TAKARA)中,冰浴30min、热休克60s、冰浴2min,另加250μLLB培养液(1%Tryptone购自OXOID,0.5%YeastExtract购自OXOID,1%NaCl购自国药)置37℃摇床中,225r/min摇菌30min,取200μL菌液种植于含50ug/mL氨苄青霉素、40ug/mLX-gal、24ug/mLIPTG(X-gal/IPTG购自TAKARA)的LB(同上)固体培养平板上,37℃培育18h。计数培养板中直径>1mm的清晰白色及蓝色菌落数,随机挑取200个白色菌落(编号:Gh-C001至Gh-C200)于含有50ug/mL氨苄青霉素的LB液体培养基的96孔细胞培养板(CORNING)中,37℃培养过夜后加甘油至终浓度20%,于-80℃保存备用。以巢式PCR引物Primer1(PCR-selectTMcDNASubtractionKit试剂盒自带)和Primer2R(PCR-selectTMcDNASubtractionKit试剂盒自带)进行菌液PCR扩增,得到152个阳性克隆,对所有阳性克隆在送英潍捷基(上海)贸易有限公司测序。(6)差异克隆的cDNA测序分析:将DNA测序结果去除载体和不明确序列及多余的cDNA后,共得到112个EST(unigene)。经BlastN发现其中52条unigene在GenBank中有同源序列(相似50%以上),25条EST功能未知或者为假定蛋白,另有35条未获得同源匹配,推测可能是处于3’、5’末端非翻译区的较短序列。实施例2GhCBF3编码基因的克隆在实施例1有同源序列的unigene中,克隆子Gh-C098序列如SEQIDNO:3所示:1ACCAGCTTCTACCGATCCGAAAGACATCCAGAAAGCGGCGGCGGAGGCAGCGGAAGCTTT61CCGACCTGTTGATTCCGCCGGAGATGGCTCAAAGACAGCTGAAAAAACGGCGGTGGAGGG121AACTAAAGAGTCGGAAGAAGTGTTTTATTTGGACGAAGAAGCAGTGTTTGGGAGAGAAAA181GTTTCTGGCAAACATGGCGGCGGGGATGATGATGTCTCCGCCTCACAGTGGATATGAAAA241AGATGAACAAGAATTTGAGTTTGCCGATGGTTATGT序列分析表明该序列的编码的氨基酸序列属于DREB1类蛋白,本文将该蛋白命名为GhCBF3。(1)GhCBF3的全长基因的克隆根据已经获得的GhCBF3的基因片段,设计两条特异性引物,作为3’RACE的5’端特异性引物:GhCBF3GSP1:SEQIDNO:4:AAGACATCCAGAAAGCGGCGGCGhCBF3GSP2:SEQIDNO:5:CCGACCTGTTGATTCCGCCGGA实验步骤按试剂盒说明书操作(3’RACESystemforRapidAmplificationofcDNAEnds试剂盒,购自invitrogen公司)用SEQIDNO:4与3’端引物AUAP(试剂盒自带),以mRNA逆转录的cDNA为模板进行第一轮PCR扩增。具体步骤如下:ExTaq购自TAKARA,50μlPCR反应体系:5μl10×ExBuffer,3μl2.5mM的dNTP,2.0μlmRNA反转录的cDNA,1.0μlExTaq、10μM的引物SEQIDNO:4和AUAP各2.0μl,以及35μl的双蒸水。PCR反应条件:94℃预变性5min;94℃变性30s,58℃退火30s,72℃延伸1min,33个循环;72℃延伸10min。所得的PCR产物用双馏水稀释50倍后取1μl作为模板,用SEQIDNO:5与3’端引物AUAP进行第二轮PCR扩增,具体步骤如下:50μlPCR反应体系:5μl10×ExBuffer,3μl2.5mM的dNTP,2.0μl第一轮稀释的PCR产物,1.0μlExTaq、10μM的引物SEQIDNO:5和AUAP各2.0μl,以及35μl的双蒸水。PCR反应条件:94℃预变性5min;94℃变性30s,58℃退火30s,72℃延伸1min,33个循环;72℃延伸10min。第二次PCR产物(QIAquickPCRPurificationKit纯化,购自Qiagen)3ul连接于pGEM-TEasyVector,转化到大肠杆菌JM109(具体方法同上),随机挑取10个白色菌落于含有50ug/mL氨苄青霉素的LB液体培养基中培养,37℃培养过夜后加甘油至终浓度20%,-80℃保存备用。SEQIDNO:5与3’端引物AUAP进行菌液PCR扩增(体系及条件同上),得到4个阳性克隆,送英潍捷基(上海)贸易有限公司测序,获得该基因的cDNA的3’端。根据已经获得的GhCBF3的基因片段,设计三条特异性引物,分别作为mRNA的反转录引物(SEQIDNO:6)和5’RACE的3’端特异性引物(SEQIDNO:7和8)。GhCBF3GSP3:SEQIDNO:6:ACTCAAATTCTTGTTCATCTGhCBF3GSP4:SEQIDNO:7:CACTGTGAGGCGGAGACATCATGhCBF3GSP5:SEQIDNO:8:GCCGCCATGTTTGCCAGAAAC实验步骤按试剂盒说明书操作(5’RACESystemforRapidAmplificationofcDNAEnds试剂盒,购自invitrogen公司)。SEQIDNO:6作为mRNA反转录成cDNA的引物。用SEQIDNO:7与5’通用引物AAP(试剂盒自带),以mRNA逆转录的cDNA(反转录引物SEQIDNO:6)为模板进行第一轮PCR扩增,具体步骤如下:ExTaq购自TAKARA,50μlPCR反应体系:5μl10×ExBuffer,3μl2.5mM的dNTP,2.0μl总RNA反转录的cDNA,1.0μlExTaq、10μM的引物SEQIDNO:7和AAP各2.0μl,以及35μl的双蒸水。PCR反应条件:94℃预变性5min;94℃变性30s,55℃退火30s,72℃延伸1min,33个循环;72℃延伸10min。所得的PCR产物用双蒸水稀释50倍后取1μl作为模板,用SEQIDNO:8与3’端引物AUAP进行第二轮PCR扩增,具体步骤如下:50μlPCR反应体系:5μl10×ExBuffer,3μl2.5mM的dNTP,2.0μl第一轮稀释的PCR产物,1.0μlExTaq、10μM的引物SEQIDNO:8和AUAP各2.0μl,以及35μl的双蒸水。PCR反应条件:94℃预变性5min;94℃变性30s,58℃退火30s,72℃延伸1min,33个循环;72℃延伸10min。第二次PCR产物(QIAquickPCRPurificationKit纯化,购自Qiagen)3ul连接于pGEM-TEasyVector,转化到JM109(具体方法同上),随机挑取10个白色菌落于含有50ug/mL氨苄青霉素的LB液体培养基中培养,37℃培养过夜后加甘油至终浓度20%,-80℃保存备用。SEQIDNO:8与3’端引物AUAP进行菌液PCR扩增(反应体系及反应条件同上),得到6个阳性克隆,送广州英潍捷基(上海)贸易有限公司测序,获得该基因的cDNA的5’端。所得的5’RACE产物克隆测序后,与3’RACE产物测序结果拼接。获得GhCBF3的全长cDNA序列。根据GhCBF3的全长cDNA序列设计一对引物如下:GhCBF3F:SEQIDNO:9:ATGGTTTCGTCACCGATGTCGGATAGhCBF3R:SEQIDNO:10:TTAAATAGAATAGCTCCACAGCCGTA通过SEQIDNO:9和SEQIDNO:10来克隆GhCBF3编码基因的全长。采用TaKaRa的PrimeSTARHSDNA聚合酶,以棉花的cDNA为模板进行PCR反应。50μlPCR反应体系:10μl5×PSBuffer,3μl2.5mM的dNTP,2.0μlcDNA,1.0μlPrimeSTAR,10μM的引物SEQIDNO:9和SEQIDNO:10各2.0μl,30μl的双蒸水。PCR反应条件:94℃预变性5min;94℃变性30s,58℃退火30s,72℃延伸60s,33个循环;72℃延伸10min。PCR扩增产物加A:PCR产物加2.5倍的无水乙醇,-20℃放置10分钟,离心,去上清,晾干,用21μl双蒸水溶解。加入2.5ul10×ExBuffer,0.5ul5mM的dATP,2.5ul10×ExTaq。反应条件:70℃反应30分钟。将得到约600bp的DNA片段回收(Omega回收试剂盒),克隆至pGEMT-easy载体上,转化JM109(方法同上)。随机挑取10个白色菌落于含有50ug/mL氨苄青霉素的LB液体培养基中培养,37℃培养过夜后加甘油至终浓度20%,-80℃保存备用。SEQIDNO:9与SEQIDNO:10进行菌液PCR扩增(反应体系及反应条件同上),得到4个阳性克隆,送英潍捷基(上海)贸易有限公司测序,序列为SEQIDNO:2。其蛋白表达序列为SEQIDNO:1。GhCBF3的氨基酸序列:SEQIDNO:11MVSSPMSDSGSGNGASRPPN21FSDEDVMLASCYPKKRAGRK41KFRETRHPVFRGVRRRNSGK61WVCEVREPYKKSRIWLGTFP81TEEMAARAHDVAALALRGRL101ACLNFADSAWRLPVPASTDP121KDIQKAAAEAAEAFRPVDSA141GDGSKTAEKTAVEGTKESEE161VFYLDEEAVFGREKFLANMA181AGMMMSPPHSGYEKDEQEFE201FADGYVRLWSYSI*GhCBF3编码基因的核苷酸序列:SEQIDNO:21ATGGTTTCGTCACCGATGTCGGATAGTGGGAGTGGAAATGGAGCTTCTCGTCCGCCGAAT61TTTTCCGATGAAGACGTGATGTTAGCTTCGTGTTACCCCAAGAAGCGAGCGGGAAGGAAG121AAATTCCGGGAGACTCGACACCCGGTGTTCCGAGGAGTTCGCCGGAGGAACTCCGGAAAA181TGGGTTTGTGAAGTAAGGGAACCTTACAAAAAGTCAAGGATTTGGCTCGGGACTTTTCCG241ACAGAAGAGATGGCGGCGCGTGCCCACGACGTGGCGGCGTTAGCTCTGAGAGGAAGGTTG301GCTTGTTTGAACTTCGCTGACTCTGCTTGGAGACTCCCTGTACCAGCTTCTACCGATCCG361AAAGACATCCAGAAAGCGGCGGCGGAGGCAGCGGAAGCTTTCCGACCTGTTGATTCCGCC421GGAGATGGCTCAAAGACAGCTGAAAAAACGGCGGTGGAGGGAACTAAAGAGTCGGAAGAA481GTGTTTTATTTGGACGAAGAAGCAGTGTTTGGGAGAGAAAAGTTTCTGGCAAACATGGCG541GCGGGGATGATGATGTCTCCGCCTCACAGTGGATATGAAAAAGATGAACAAGAATTTGAG601TTTGCCGATGGTTATGTACGGCTGTGGAGCTATTCTATTTAA实施例3GhCBF3植物表达载体构建植物表达载体rd29A-GhCBF3-2300构建流程如附图1所示。选择植物双元表达载体pCAMBIA2300(购自北京鼎国昌盛生物技术有限责任公司)作为植物表达载体,用Pnos启动子替换NPTII基因含双增强子的35S启动子,以降低NPTII蛋白在植物中的表达。选择诱导型启动子rd29A及Tnos作为GhCBF3基因的启动子和终止子。具体步骤如下:使用SEQIDNO:11和SEQIDNO:12以植物表达载体PBI121(购自北京华夏远洋科技有限公司)为模板扩增Pnos,采用TaKaRa的PrimeSTARHSDNA聚合酶。50μlPCR反应体系:10μl5×PSBuffer,3μl2.5mM的dNTP,1.0μlPBI121,1.0μlPrimeSTAR、10μM的引物SEQIDNO:11和SEQIDNO:12各2.0μl,以及31μl的双蒸水。PCR反应条件:94℃预变性5min;94℃变性30s,56℃退火30s,72℃延伸30s,33个循环;72℃延伸10min,产物通过EcoRI、BglII酶切连接到pCAMBIA2300(promegaT4连接酶盒)获得pCAMBIA2300-1。SEQIDNO:11:GCACGAATTCATACAAATGGACGAACGGATSEQIDNO:12:ATCCAGATCTAGATCCGGTGCAGATTATTTG使用SEQIDNO:13和SEQIDNO:14以PBI121为模板扩增Tnos,采用TaKaRa的PrimeSTARHSDNA聚合酶。50μlPCR反应体系:10μl5×PSBuffer,3μl2.5mM的dNTP,1.0μlPBI121,1.0μlPrimeSTAR、10μM的引物SEQIDNO:13和SEQIDNO:14各2.0μl,以及31μl的双蒸水。PCR反应条件:94℃预变性5min;94℃变性30s,58℃退火30s,72℃延伸30s,33个循环;72℃延伸10min。产物通过SacI、EcoRI酶切连接到pCAMBIA2300-1,获得pCAMBIA2300-2。SEQIDNO:13:AAGGAGCTCGAATTTCCCCGATCGTTCAAASEQIDNO:14:TCAGAATTCCCAGTGAATTCCCGATCTAGTA使用SEQIDNO:15和SEQIDNO:16以拟南芥(哥伦比亚型,购自www.arabidopsis.org)基因组DNA为模板扩增拟南芥rd29A启动子(参考ZengJ.,etL.2002,PreparationoftotalDNAfrom“recalcitrantplanttaxa”,ActaBot.Sin.,44(6):694-697中的方法提取拟南芥DNA)。采用TaKaRa的PrimeSTARHSDNA聚合酶。50μlPCR反应体系:10μl5×PSBuffer,3μl2.5mM的dNTP,1.0μl拟南芥DNA,1.0μlPrimeSTAR、10μM的引物SEQIDNO:15和SEQIDNO:16各2.0μl,以及31μl的双蒸水。PCR反应条件:94℃预变性5min;94℃变性30s,58℃退火30s,72℃延伸30s,33个循环;72℃延伸10min,PCR产物通过HindIII、SalI酶切连接到pCAMBIA2300-2,获得pCAMBIA2300-3。SEQIDNO:15:ACTAAGCTTCCTTCTTGACATCATTCAATTTTASEQIDNO:16:TGAGTCGACTCCAAAGATTTTTTTCTTTCCAATAG使用SEQIDNO:17和SEQIDNO:18扩增GhCBF3基因(模板是实施例2所获得含有GhCBF3基因的pGEMT-easy重组载体),采用TaKaRa的PrimeSTARHSDNA聚合酶。50μlPCR反应体系:10μl5×PSBuffer,3μl2.5mM的dNTP,1.0μlGhCBF3-pGEM,1.0μlPrimeSTAR、10μM的引物SEQIDNO:17和SEQIDNO:18各2.0μl,以及31μl的双蒸水。PCR反应条件:94℃预变性5min;94℃变性30s,58℃退火30s,72℃延伸1min,33个循环;72℃延伸10min。通过SalI、SacI酶切连接到pCAMBIA2300-3,获得植物表达载体,rd29A-GhCBF3-2300。SEQIDNO:17:TGAGTCGACATGGTTTCGTCACCGATGTCGGATASEQIDNO:18:AAGGAGCTCTTAAATAGAATAGCTCCACAGCCGTA实施例4rd29A-GhCBF3-2300表达载体转化农杆菌农杆菌LBA4404(购自BiovectorScienceLab,Inc)感受态制备:提前1-2d将农杆菌LBA4404在含50μg/ml利福平和50μg/ml链霉素的LB固体培养基上划单斑接种,28℃培养1至2d。挑取单菌落接种于5ml含50μg/ml利福平和50μg/ml链霉素的LB液体培养基中,28℃下摇动培养过夜(约12-16h)至OD600值为0.4,形成种子菌液。取5ml活化后的菌液(1∶20的比例)接种于100ml同样浓度抗生素的LB液体培养基中,28℃摇动培养2-2.5h至OD600=0.8。冰浴菌液10min,每隔3min摇匀一次,令细菌均匀进入休眠状态。于4℃下4000g离心10min,弃上清液;加入一定量预冷10%甘油重悬浮菌体,4℃下4000g离心10min,收集沉淀;用10%甘油重复洗3-4次;加入适量冰浴预冷的10%甘油重新悬浮细菌沉淀,以40μl/管将其分装,于-70℃保存备用。转化农杆菌:在冰上融化感受态细胞,往40μl的感受态细胞中加入1μl的rd29A-GhCBF3-2300质粒,混匀后冰浴约10min。将感受态和DNA的混合物用枪转移到预冷的电击杯中,轻敲使悬浮液到达底部,注意不要有气泡。将电击杯(购自bio-rad)放到电击室的滑道上,推动滑道将电击杯放至电击室基座电极处。使用0.1cm的电击杯的时候,MicroPulser(购自bio-rad)的程序设置为“Agr”,电击一次。立即取出电击杯,加入28℃预热的LB培养基。快速而轻柔的用枪将细胞打匀。将悬浮液转入1.5ml的离心管,28℃,225rpm培养1h。取100~200μl的菌液涂布与相应的抗性筛选培养基(LB固体培养基,含50μg/ml利福平、50μg/ml链霉素、50μg/ml卡那霉素)平板上,28℃培养。实施例5利用农杆菌介导的转化法获得转基因烟草用75%酒精浸泡烟草种子(国家烟草中期库,获取单位中国农科院烟草所,库编号I5A00660)30s,再用0.1%升汞浸泡8min,进行表面消毒。将消过毒的烟草种子置于MS固体培养基(18.78mMKNO3,1.25mMKH2PO4,20.6mMNH4NO3,1.5mMMgSO4,3.0mMCaCl2,50μMKI,100μMH3BO3,100μMMnSO4,30μMZnSO4,1μMNa2MoO4,0.1μMCoCl2,100μMNa2EDTA,100μMFeSO4,7.4g/L琼脂,蔗糖30g/L)上无菌发芽,制备无菌苗。取无菌苗叶片剪成5mm×5mm大小的叶盘,用处于对数生长期的含表达载体的农杆菌浸染叶盘10min,吸干菌液,在黑暗条件下共培养2天(MS培养基)。将叶片转到分化培养基(MS+1mg/LBA+0.1mg/LNAA+50mg/L卡那霉素+500mg/L头孢霉素)上,光照条件下培养45天左右,待芽长大后切下转移到生根培养基(MS+50mg/L卡那霉素+500mg/L头孢霉素)中培养30天左右,待根系发达后将小苗转入仅加有500mg/L头孢霉素的MS培养基上进行编号保存。取获得的转基因烟草叶片,提取基因组DNA(同实施例3中拟南芥DNA提取方法),用引物SEQIDNO:17和SEQIDNO:18进行PCR鉴定(50μlPCR反应体系:5μl10×ExBuffer,3μl2.5mM的dNTP,2.0μlDNA,1.0μlExTaq、10μM的引物SEQIDNO:17和SEQIDNO:18各2.0μl,以及35μ1的双蒸水。PCR反应条件:94℃预变性5min;94℃变性30s,58℃退火30s,72℃延伸1min,33个循环;72℃延伸10min),保存阳性植株,分别编号为T0I1至T0I20。选取T0I1-T0I5的种子进行。实施例6过表达GhCBF3的转基因烟草T1代的抗寒模拟实验及功能鉴定将灭过菌的蛭石用1/2MS培养基浸透。将T0代转基因烟草T0I1、T0I2、T0I3、T0I4和T0I5的种子以及野生型非转基因对照烟草种子分别播种在蛭石上,25℃、10小时光培养/14小时暗培养循环,每5天浇一次1/2MS培养基,培养25天之后,摘取最下端一片叶子,提取基因组DNA(同实施例3中拟南芥DNA提取方法),利用引物SEQIDNO:17和SEQIDNO:18做PCR鉴定(反应及条件同上),剔除阴性植株(对照烟草也同样摘取一片叶子)。挑取大小一致的转基因烟草(T1I1、T1I2、T1I3、T1I4和T1I5各10株,编号分别是T1I1-1至T1I1-10、T1I2-1至T1I2-10、T1I3-1至T1I3-10、T1I4-1至T1I4-10和T1I5-1至T1I5-10)、对照烟草(10株)做耐寒实验。转基因烟草、对照烟草,4℃胁迫72小时。再经过14天恢复培养。然后取出植株对植株进行称重。上述T1代转基因植株的抗寒性鉴定表明,对照植株不能恢复正常生长,生长明显受到抑制,而转基因植株生长明显高于对照植株,显现出明显的抗寒性(附图3及表1)。在图3中,选取转基因植株T1I1-2和一株对照烟草示例性显示,其他烟草的结果与它们类似。实施例7过表达GhCBF3的转基因烟草T1代的抗旱模拟实验及功能鉴定灭过菌的蛭石用1/2MS培养基浸透。将T0代转基因烟草T0I1、T0I2、T0I3、T0I4和T0I5的种子以及对照烟草种子分别播种在蛭石上,25℃、10小时光培养/14小时暗培养循环,每5天浇一次1/2MS,培养25天之后,摘取最下端一片叶子,提取基因组DNA(同实施例3中拟南芥DNA提取方法),利用引物SEQIDNO:17和SEQIDNO:18做PCR鉴定,剔除阴性植株(对照烟草也同样摘取一片叶子)。挑取大小一致的转基因烟草(T1I1、T1I2、T1I3、T1I4和T1I5各10株,编号分别是T1I1-11至T1I1-20、T1I2-11至T1I2-20、T1I3-11至T1I3-20、T1I4-11至T1I4-20和T1I5-11至T1I5-20)、对照烟草(10株)做耐旱实验。转基因烟草、对照烟草干旱14天(不浇水),25℃、10小时光培养/14小时暗培养循环。然后取出植株对植株进行称重。上述T1代转基因植株的抗旱性鉴定表明,对照植株萎蔫严重,而转基因植株能够正常生长,显示出明显的抗旱性(附图4及表1)。图4中,选取转基因植株T1I4-13和一株对照烟草示例性显示,其他烟草的结果与它们类似。表1
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1
- 一种调控植物开花的棉花WRKY转录因子GarWRKY9及应用
- 棉花GhWRKY51转录因子及其编码基因与应用
- 水稻OsSTAP1基因在增强植物耐盐性中应用
- 小麦耐盐、抗旱基因TaWRKY80及其应用的制作方法
- 一种调控植物耐盐性的棉花WRKY转录因子GarWRKY22及应用的制作方法
- 水稻WRKY转录因子基因OsWRKY21在培育植物抗病品种中的应用的制作方法
- 一种紫花苜蓿MsWRKY33转录因子及其编码蛋白、制备方法和应用的制作方法
- 金柑FcWRKY70基因及其在提高植物耐旱中的应用的制作方法
- 一种玉米WRKY类转录因子ZmWRKY58及其编码基因与应用的制作方法
- 一个与耐旱相关的水稻wrky基因的克隆及应用的制作方法