非天然氨基酸标记的新型抗体-药物偶联物及其制备的制作方法
本发明属于生物制药领域,涉及蛋白质的非天然氨基酸的定点插入及小分子药物的定点偶联方法。所述方法包括基于基因密码子扩展技术将非天然氨基酸定点引入蛋白质,以及借助非天然氨基酸与效应性小分子的定点连接。
背景技术:
下面以利妥昔单抗为例说明本发明的背景技术,但是下述内容无论如何都不能理解为其是现有技术的承认,也无论无何都不能认为本发明的仅仅适用于利妥昔单抗。
(1)利妥昔单抗
B淋巴细胞抗原CD20分子表达于从晚期前B细胞到成熟B细胞的所有B细胞表面(Loken et al.,1987,Blood 70,1316-1324)它在90%以上的B细胞淋巴瘤中稳定表达,所以非常适合作为靶向治疗的靶点(McLaughlin et al.,1998,Journal of clinical oncology:official journal of the American Society of Clinical Oncology 16,2825-2833)。CD20单克隆抗体在治疗B细胞淋巴瘤以及慢性淋巴细胞白血病中取得了令人满意效果。美国IDEC针对B细胞淋巴瘤制备的抗CD20单克隆抗体Rituximab(C2B8)-利妥昔单抗,即美罗华,是FDA批准的第一个用于治疗B细胞淋巴瘤的抗体,是第一个上市的靶向淋巴瘤和白血 病B细胞表面CD20的人鼠嵌合单克隆抗体。它是IgG1κ免疫球蛋白,轻链及重链的可变区为鼠源,恒定区部分为人源(DrugBank DB0073)。利妥昔单抗的重链由451个氨基酸组成,轻链由213个氨基酸组成,其轻链序列如SEQ ID NO:1,其核苷酸序列如SEQ ID NO:2所示;重链序列如SEQ ID NO:3所示,其核苷酸序列如SEQ ID NO:4所示。其主要作用机制包括抗体介导的细胞杀伤作用,补体介导的细胞杀伤作用以及诱导肿瘤细胞的凋亡作用。
尽管美罗华在临床治疗中已经显现出了很好的疗效,但总反应率都在50%左右,完全治愈率不超过20%,复发及耐药现象常有发生(McLaughlin et al.,1998,Journal of clinical oncology:official journal of the American Society of Clinical Oncology 16,2825-2833;Coiffier et al.,2002,The New England journal of medicine 346,235-242;Maloney et al.,1997,Blood 90,2188-2195)。因此,以CD20为靶点,研发更有效的抗体药物有着很大的市场价值。
(2)抗体偶联药物
放疗化疗作为肿瘤治疗的主要手段在临床应用十分广泛,其主要通过造成DNA双链断裂,抑制细胞有丝分裂,抑制DNA及相关蛋白的合成来杀灭肿瘤细胞。然而,传统的放化疗对正常细胞有较大杀伤作用,因此通过将同位素或者化疗药物与靶向性抗体偶联来提高药物疗效并减少副作用的研究一直得到广泛的关注。
抗体偶联药物是蛋白质药物中新兴的一部分,也称为免疫偶联物。免疫偶联药物由具有靶向性的单抗组分与细胞杀伤组分两部分构 成,根据细胞杀伤组分的不同,主要分为放射免疫治疗药物(偶联同位素)、抗体药物偶联物(偶联小分子药物)、免疫毒素(偶联细菌毒素)和酶联抗体的前药治疗药物(偶联酶)四类(Weiner et al.,2012,Cell 148,1081-1084)。将治疗药物与单抗偶联,利用抗体的靶向性将治疗药物精确的运送到靶细胞,可以有效的提高靶细胞局部的药物浓度,减少药物在体内正常细胞分布,从而实现药物高效低毒的治疗效果。
以放射免疫偶联药物为例,其目前在临床应用广泛。放射免疫显像药物(radioimmunoimaging,RII)利用单抗将诊断性核素运至靶部位,通过ECT进行断层显像以及计算机三维重构,用以显示该部位瘤体的大小,位置等;放射性免疫治疗药物(radiommunotherapy,RIT),即利用抗体作为载体,将治疗性核素引导到肿瘤部位进行内照射的治疗方法,在淋巴瘤方面取得突出的临床效果。其中有两个放射免疫治疗药物通过了FDA的药物审批。这两个药物都是靶向CD20治疗复发或耐药的滤泡性淋巴瘤:一个是90Y-ibritumomab tiuxetan(Zevalin),另一个是131I-tositumomab(Bexxar 2014年因和90Y-ibritumomab tiuxetan作用相同而撤市)。其中患者对于Zevalin的总反应率达到了80%,完全治愈率约为30%(Goldsmith et al.,2010,Seminars in nuclear medicine 40,122-135)。
(3)抗体药物偶联技术
传统的抗体偶联物通常以抗体上赖氨酸侧链的氨基,或者二硫键还原后的巯基为功能基团偶联小分子。抗体表面有80个左右的赖氨 酸以及30个左右的半光氨酸,所以传统的修饰方法是非定点非定量的。而抗体小分子的偶联物缺少有效的分离手段,故传统的偶联方法并不适合大规模生产制备的质量控制。抗体表面有很多的功能区域,甚至破坏抗体的二硫键,随机的偶联可能会影响到抗体抗原的结合,降低抗体在体内的半衰期,影响抗体介导的细胞杀伤作用以及补体介导的细胞杀伤作用,偶联过多的小分子还会增加抗体药物的免疫原性。
(4)基因密码子扩展技术
近年来遗传密码扩展技术发展迅速,利用琥珀终止密码子为有义编码子,通过引入相应的正交tRNA及氨酰tRNA合成酶,最终可以将设计好的非天然氨基酸引入蛋白质中。根据非天然氨基酸的性质,可以赋予蛋白质特殊的功能。到目前为止,这一技术已经将几十种非天然氨基酸成功地定点表达在蛋白质表面,涉及的非天然氨基酸中带有炔基和叠氮等,利用这些生物正交基团,就可以特异性地对蛋白质进行定点修饰。
面对现有抗体小分子偶联药物不定点不定量修饰的问题,将基因密码子扩展技术应用到现有的抗体偶联物制备中,将有效的促进抗体偶联物的发展。
技术实现要素:
:
发明人经过对现有技术的思考和研究,利用古甲烷球菌的tRNA(tRNAPyl)和吡咯赖氨酰-tRNA合成酶(tRNAPyl/PylRS)的蛋白质翻译系统使非天然氨基酸定点插入到蛋白表面,从而得 到定点突变的目的蛋白。然后将所述定点突变的蛋白作为可被进一步定点偶联的原料,与连接臂或效应小分子偶联,得到的偶联物进一步与效应小分子,例如放射性核素,偶联,进而得到单一位点定点偶联的产物,特别地,所述蛋白是利妥昔单抗。
相比于其它方法,本发明的优点可体现在如下的一个或几个方面:
1.可以在蛋白质任意位点引入非天然氨基酸,从而创造可以仅对该位点进行特异性修饰的原料蛋白;
2.利用非天然氨基酸上特有的活性基团,可以实现高效,特异性的修饰目的;
3.特定位点的定点偶联可以带来更好的药效。选择偶联在非功能区,可以有效的减少药物偶联对蛋白质活性、稳定性、半衰期带来的影响;选择偶联在非暴露区,固定小分子的修饰数量,可以降低潜在的免疫原性,减少体内的酶解作用,从而降低偶联物脱靶的可能;
4.通过修饰条件的优化,利用环辛炔介导的无铜Click反应,可以实现高效,对蛋白无害,简单易行的偶联反应。
具体地,在本发明的一个具体的实施方案中,提供了引入非天然氨基酸的目的蛋白,例如利妥昔单抗,主要通过两个步骤:(1)构建含有在选定的位点上具有琥珀密码子突变的编码目的蛋白,例如利妥昔单抗基因的载体,(2)构建并获得pXH-N3质粒,将步骤(1)与(2)在合适的宿主细胞中共表达,且在培养基中加入非天然氨基酸,获得引入突变的目的蛋白,例如利妥昔单抗。
该突变系统的原理在于:突变型的tRNAPyl/PylRS满足下列关系:(1):突变型的tRNAPyl不能利用宿主细胞的赖氨酰tRNA合成酶,只能被突变型的PylRS酰化;(2):突变型的PylRS只能酰化tRNAPyl,不能酰化其它tRNA,因此,突变型tRNAPyl和PylRS之间的关系是正交性的,即突变型的PylRS只能酰化突变型tRNAPyl,同时突变型的tRNAPyl只能被突变型的PylRS酰化,也就是说同一质粒中的突变型的tRNAPyl和PylRS是绝对的相互专一的。这种正交性的酶并且是只有这种酶可以把非天然氨基酸酰化到这种正交的tRNA上,并且只能酰化这种tRNA,而不能酰化其它的tRNA。获得的正交赖氨酰tRNA合酶/tRNA系统,使非20种常见氨基酸的Lys-azido,也可称为:NAEK,与琥珀密码子相对应,从而将非天然氨基酸定点引入到目的蛋白,例如利妥昔单抗中。
在本发明的一个具体的实施方案中,通过将带有琥珀密码子的利妥昔单抗基因插入到载体例如pEF-1b中,将插入后得到的载体和所述的pXH-N3一起瞬时转染Freestyle293F细胞系,然后可通过在培养基中添加非天然氨基酸例如NAEK,最后从培养基上清液中获得定点突变的目的蛋白,例如突变型利妥昔单抗。
在本发明的一个具体的实施方案中,本发明提供了一种在哺乳动物细胞中定点引入非天然氨基酸的突变重组蛋白或肽,如在特定位点引入非天然氨基酸NAEK,其特有的叠氮基团可以特异性地和偶联物,例如双功能连接臂,发生Click反应,从而将目的小分子定点偶联在目的蛋白上。
在本发明的另外的实施方案中,提供了一种双功能连接臂DIBO-DOTA。该连接臂一端带有环辛炔(DIBO),可供特异性识别叠氮基团并与之偶联;另一端带有螯合基团1,4,7,10-tetraazacyclododecane-1,4,7,10-tetraacetic acid(DOTA),该基团可以牢固螯合Y90,Lu177等金属同位素。例如突变型利妥昔单抗及其定点偶联小分子,
在本发明的另外的实施方案中,将纯化的NAEK定点突变目的蛋白或肽,例如利妥昔单抗与DIBO-DOTA进行无铜催化的Click反应,使得DIBO-DOTA通过利妥昔单抗上的含有叠氮基团的非天然氨基酸而实行定点且定量的偶联,由于反应的高效性,经过简单的除盐操作即可得到定点定量偶联小分子,例如DIBO-DOTA的目的蛋白或肽。经体外实验初步证明,经非天然氨基酸替换以及定点偶联小分子的利妥昔单抗仍然具有生物学活性。
在本发明的一个实施方案中,将偶联有连接臂DIBO-DOTA的目的蛋白或肽,例如利妥昔单抗,与放射性同位素反应,进而将放射性同位素定点定量的偶联到目的蛋白或肽中,例如利妥昔单抗。所得到的定点偶联有放射性同位素的抗体,可以更有效的进行放射性显像,放射性靶向治疗等。
在本发明的一个实施方案中,本发明选取了哺乳动物细胞悬浮表达体系,该体系所用细胞经过悬浮驯化,既可以瞬时大量表达目的蛋白,又可通过构建稳定系,进行大规模的发酵培养。
更为具体地,本发明提供了:
1.突变的多肽,其至少1个位点上的氨基酸被突变为非天然氨基酸,所述非天然氨基酸为:
所示的Lys-azido(NAEK),或其它含有叠氮结构的非天然氨基酸。
2.如项1所述的突变的多肽,所述多肽是利妥昔单抗。
3.如项2所述的突变的多肽,所述突变位于SEQ ID NO:2和/或SEQ ID NO:4中的任意的一个或多个位点。
4.如项3所述的突变的多肽,所述突变位点选自:示于SEQ ID NO:2第K168位,SEQ ID NO:4的第A122位,或SEQ ID NO:2或SEQ ID NO:4上对其他对活性影响较小的位点中的一个或多个。
5.如项1所述的突变的多肽,其突变氨基酸是第N位氨基酸,所述突变氨基酸在所述多肽中的连接方式如下式所示:
其中,由R1到R2的方向为氨基酸序列的N末端到C末端方向,R1为多肽中的第1至第N-1位氨基酸残基,
R2为多肽中的第N+1位至C末端的氨基酸残基,R4为
6.如项5所述的突变的多肽,所述突变的多肽是突变的利妥昔单抗。
7.如项6所述的突变的多肽,所述第N位氨基酸是SEQ ID NO:2或SEQ ID NO:4中任意一个或多个位点上的氨基酸。
8.如项7所述的突变的多肽,所述突变位点选自:示于SEQ ID NO:2第K168位,SEQ ID NO:4的第A122位,或SEQ ID NO:2或SEQ ID NO:4上其他对活性影响较小的位点中的一个或多个。
9.如项1所述的突变的多肽,其包含可供偶联叠氮及金属同位素的双功能连接臂,所述连接臂一端含有环辛炔(DIBO)基团,另一端含有DOTA,所述双功能连接臂结构如下式所示:
10.如项9所述的突变的多肽,其中所述的突变的多肽是突变的利妥昔单抗。
11.前述任一项中的突变的多肽,其重链氨基酸序列是SEQ ID NO:10。
12.前述任一项中的突变的多肽,其轻链氨基酸序列是SEQ ID NO:8。
13.经过定点偶联后的如项1所述的突变的多肽,其结构如下式所示:
其中,其中第N个氨基酸发生突变,R1为第1至第N-1位氨基酸残基,R2为第N+1位至C末端的氨基酸残基,R3为DOTA或其他直接或间接提供功能的小分子。
14.如项13所述的经过定点偶联后的突变的多肽,其中突变前的多肽包含氨基酸序列为SEQ ID NO:2的重链和/或序列为SEQ ID NO:4的轻链。
15.如项14所述的经过定点偶联后的突变的多肽,其中的R3为DOTA,其螯合放射性同位素。
16.如项15所述的经过定点偶联后的突变的多肽,所述放射性同位素选自Lu177,Cu64或Y90。
17.如项13-16中任一项所述的经过定点偶联后的突变的多肽,所述偶联物中的R3选自阿霉素(doxorubicin)、一甲基澳瑞他汀(Monomethyl auristatin E,MMAE)。
18.编码项1-12中的突变的多肽的核酸分子。
19.包含项18所述的核酸分子的载体。
20.一种载体,其是pXH-N3。
21.一种药物组合物,其含有有效量的项1-12中任一项的所述的突变的多肽,或者项13-17所述的经过定点偶联后的突变的多肽。
22.如项21所述的药物组合物,在制备用于放射性显像、治疗顽固性恶性肿瘤或肿瘤复发的药物中的用途。
23.一种微生物,其含有项19或20的载体。
24.如项23所述的微生物,其是大肠杆菌。
25.一种动物细胞,其含有项19或20的载体。
26.如项25所述的动物细胞,其是Freestyle293细胞系。
附图说明:
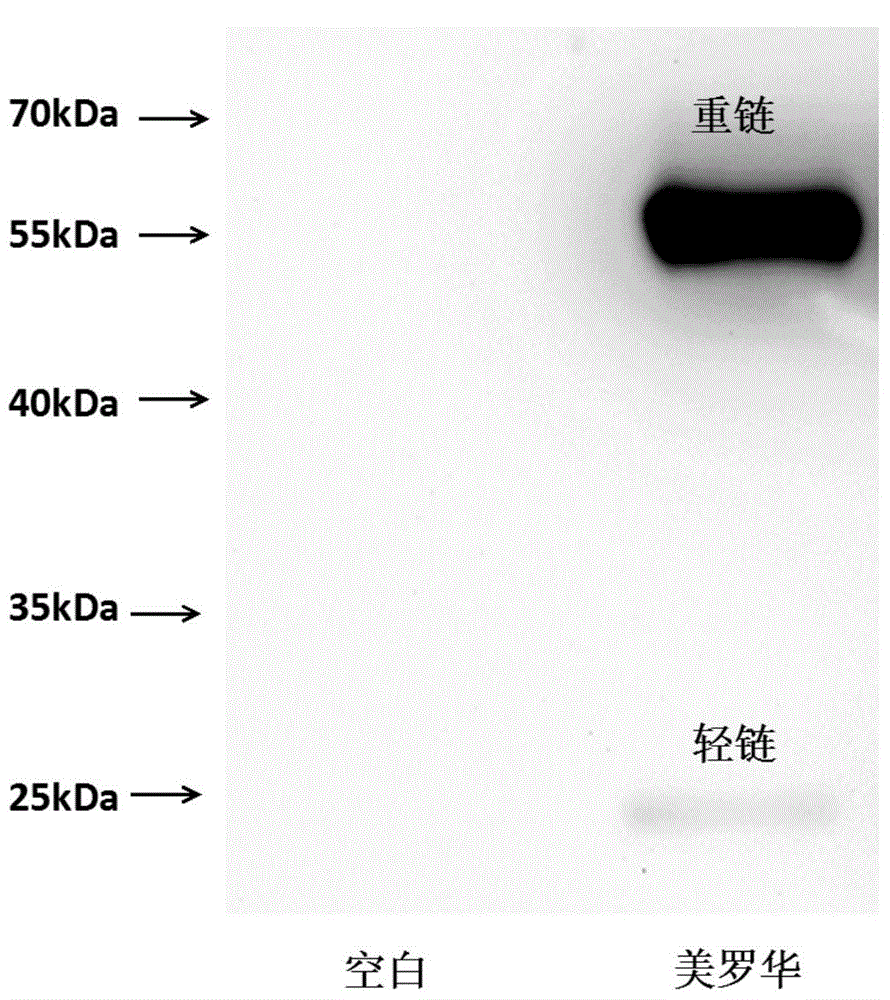
图1:美罗华的哺乳动物细胞表达及活性验证
A:Western Blot验证抗体表达:第一道为空载体转化对照,第二道为插入美罗华基因的载体表达。图示抗体成功进行了表达;
B:不同表达载体对表达量的影响:从左至右分别为pcDNA3.1,pEF-1b,pBudce4.1;图示pEF-1b载体最有利于抗体的表达;
C:荧光共聚焦验证表达抗体活性:从左至右,抗体分别作用Jurket,Raji,Ramos RA1细胞,其中Jurkat细胞为CD20阴性细胞,作为阴性对照,Raji和Ramos RA1细胞为CD20阳性细胞;
D:流式细胞术分析验证表达抗体活性:M1区域内为CD20 阴性细胞Jurket的抗体结合响应值,M2区域内为CD20阳性细胞Raji和Ramos RA细胞的抗体结合相应值;
图2:pXH-N3载体的优化及构建
A:pXH-N3载体示意图;
B:Western Blot验证各类型启动子启动tRNA对非天然氨基酸插入效率的影响,从左至右启动子名称分别为:U1,mu6,H1,hu6,7sk;图示7sk启动子相对其余启动子非天然氨基插入型蛋白表达效率最高;
C:细胞水平上,绿色荧光蛋白验证各启动子非天然氨基酸插入效率;与图2B结果相符合;
D:不同启动子对终止密码子TAG通读效率影响,从左至右分别为U1,mu6,H1,hu6,7sk启动子,通读效率高等价于非天然氨基酸插入效率的高效;
E:7sk启动子串联不同个数tRNA对终止密码子TAG通读效率的影响,从左至右分别为1、2、3、4以及5个7sk-tRNA串联单位,由图可知在7sk启动子下,串联4个tRNA的非天然氨基酸插入效率最高;
图3:突变型美罗华的表达
A.美罗华可变区与CD20结合短肽晶体结构示意图(Ding Jianping et al.J.Biol.Chem.2007,282:15073-15080);由图所示,选择有一定表面暴露程度,以及不影响与受体结合的三个位点LC-P15,LC-K168以及HC-A122作为潜在的非天然氨基酸插入位点;
B.Western Blot验证突变型蛋白表达,从左至右分别为WT美罗华(无非天然氨基酸插入型美罗华);LC-P15位点突变美罗华不加非天然氨基酸(UAA),加UAA;HC-A122位点突变美罗华不加UAA,加UAA;LC-K168位点突变美罗华不加UAA,加UAA;由图可知HC-A122以及LC-K168位点成功插入非天然氨基酸;
图4:突变型美罗华表达的条件优化
A.不同细胞系对及转染试剂对表达条件的影响:从左至右分 别为Freestyle293细胞系25kDa直链PEI转染,Freestyle293细胞系40kDa分枝链PEI转染,Freestyle CHO细胞系25kDa直链PEI转染,Freestyle CHO细胞系40kDa分枝链PEI转染;由图可见瞬转情况下293细胞系较CHO细胞系表达量有显著提高,而40kDa分枝链PEI较25kDa直链PEI有更好的表达效果;
B.转染DNA总量与PEI比例(质量比)对转染效率影响,由图可见DNA:PEI=1:4时,表达效率较高;
C.固定DNA总量,在HC-A122突变型蛋白的表达过程中,转染质粒轻链,重链以及pXH-N3的比例对表达效率的影响;
D:添加剂(VPA以及NaBut)添加与否以及表达时间对表达效率的影响;
图5:突变型美罗华定点偶联DIBO-DOTA
A.完整抗体定点定量偶联2个DIBO-DOTA的ESI-MS图谱;
B.还原处理抗体样品后,定点定量在重链偶联1个DIBO-DOTA的ESI-MS图谱;
C.完整抗体非定点偶联DOTA-SCN的ESI-MS图谱;
D.还原处理抗体样品后,非定点、非定量在轻链和/或重链偶联1个或数个DOTA-SCN的ESI-MS图谱;
图6:定点偶联DIBO-DOTA美罗华定点标记放射性同位素
A:纸薄层层析检验野生型美罗华(RTX-WT)非定点偶联Cu64产率,左:过PD-10柱前;右:过PD-10柱除剩余小分子后;
B:纸薄层层析检验重链A122位突变型美罗华(RTX-122)定点偶联Cu64产率,左:过PD-10柱前;右:过PD-10柱除剩余小分子后;图示中,通过PD-10柱处理,得到了较纯净(>98%)的放射性免疫偶联物;
C:放射性自显影确认放射性同位素的定点偶联,左图为考马斯亮蓝染色,右图为放射性伽马射线自显影,两图对应位置从左至右依次为RTX-WT-DTT,RTX-WT+DTT,RTX-122-DTT,RTX-122+DTT,(DTT 为二硫苏糖醇,为蛋白还原剂);图示表明,两样品均成功偶联放射性同位素Cu64,RTX-WT样品为非定点偶联,其在重链及轻链位置均有放射性射线显影,而RTX-122为定点偶联,突变及偶联位点在重链A122位置,故仅有重链有放射性射线显影;
图7:定点标记64Cu抗体的Micro-PET显像
美罗华定点偶联Cu64荷瘤小鼠的Micro-PET成像结果:
A:18小时Micro-PET成像结果,左为注射500uCi RTX-122-Cu64荷瘤小鼠,右图为注射500uCi RTX-122-Cu64以及4倍剂量冷抗体(未偶联放射性同位素)作为封闭的荷瘤小鼠;
B:60小时Micro-PET成像结果;
图示表明随时间延长,放射性免疫物保留了肿瘤的靶向性,较高水平的富集到肿瘤部位。
为了更好地理解本发明,发明人用实施例对具体试验进行阐述和说明,其中所述实施例仅用于说明,并不限定本发明的保护范围。任何与本发明等价的变体或者实施方案都包括在本发明中。
实施例1:包含定点突变的美罗华的基因载体的构建
(1)辅助质粒的构建及获得
通过条件的优化及尝试,确定4个tRNA由7sk启动子(其序列如SEQ ID NO:6所示)串联表达为最优,构建并获得pXH-N3辅助载体:该载体以pUC19为模板,通过利用BamHI酶切位点,引入4个串联的7sk启动子及tRNA;再引入CMV强启动子控制下的tRNA合成酶及其poly A终止信号;利用EcorI酶切位点,引入真核复制原件f1 ori及SV40;该质粒可以表达特异识别非天然氨基酸NAEK的tRNA和tRNA合成酶。
(2)含美罗华的质粒的获得
经全基因合成,获得美罗华的基因(SEQ ID NO:1和3)。然后将其连接在pEF-1b(Life Technologies)真核表达载体中,获得野生型美罗华的表达质粒(pEF-RTX-HC-WT和 pEF-RTX-LC-WT,其分别表达美罗华的重链及轻链部分)。
(3)定点突变位点的选择
根据美罗华的晶体结构,美罗华与其受体的结合位点,并综合考虑抗原表位,酶解位点等信息[Ding Jianping et al.J.Biol.Chem.2007,282:15073-15080],选取了几个适合位点进行修饰,其主要基于以下因素:1.氨基酸暴露于蛋白表面以方便偶联;2.不影响抗体与受体的正常结合;3.不影响抗体本身的性质,例如稳定性等;
通过更详细的文献资料查阅[Sondermann et al.Nature,2000,406:267-273;Mulkerrin et al.J.Immunol.2000,164:4178-4184;Sun et al.J.Biol.Chem.2001,276:16469-16477],发明人选取重链的A122位(HC-A122),轻链的K168(LC-K168)位,P15(LC-P15)为特定位点进行点突变,以此突变型美罗华为原料并对其进行定点小分子的偶联。
(4)定点突变的引物设计以及突变载体构建
针对美罗华重链的第A122位,轻链的K168位和P15位,设计能够使编码所述氨基酸的密码子突变为琥珀密码子的引物,具体引物如下表所示。
表1:突变引物列表
利用定点突变试剂盒( Lightning Site-Directed Mutagenesis Kits,Catalog #210518),按说明书操作以上述步骤(2) 中获得的野生型美罗华表达载体pEF-RTX-HC-WT和pEF-RTX-LC-WT为模板将美罗华重链的第A122位,轻链的第K168位和第P15位这几个位点的氨基酸密码子突变为琥珀终止密码子,构建得到表达质粒(pEF-RTX-HC122、pEF-RTX-LC168、pEF-RTX-LC15),经测序验证突变成功。
实施例2:定点突变的美罗华的表达和纯化
本发明中构建pXH-N3质粒中含有源自古甲烷球菌的tRNA(tRNAPyl)和吡咯赖氨酰-tRNA合成酶(pheRS),在表达细胞中,以琥珀终止密码子(TAG)为有义编码子,能够使非天然氨基酸NAEK掺入到蛋白中,从而造成美罗华的定点突变。下面,发明人对NAEK的掺入可能性和突变蛋白质的生产性能进行了检测。
1:非天然氨基酸NAEK的合成和鉴定
非天然氨基酸Lys-azido的化学合成反应式如下
如上式所述,将原料1(2-溴乙醇)2.3mL溶于90mL丙酮以及15mL水的混合溶液,加入NaN33.12g,60℃油浴加热回流反应20h。冷却至室温,旋蒸除去丙酮,无水乙醚萃取(30mL×8),无水Na2SO4干燥,旋蒸除去溶剂得2.62g无色液体产物2。
将产物2(500mg,5.74mmol)加入到三光气(1.70g,5.74mmol)的THF(10ml)溶液中。0℃搅拌反应8h,溶剂蒸干。剩余物在真空下干燥1h,得到无色油状产物3。
将3溶解在1.5ml的THF中并缓慢加入Boc-Lys-OH(1.7g,6.88mmol)的1M NaOH(20ml)/THF(5ml)的溶液中。0℃搅拌反 应12h并逐渐升温到室温。重新将反应液冷却到0℃并用0℃的1M的盐酸溶液将反应液pH值调整至2~3。反应液用EtOAc萃取(30mL×5),有机层用2×100ml的饱和食盐水洗涤。无水Na2SO4干燥有机层、过滤、旋蒸除去溶剂得到1.65g无色粘稠液体产物4不用进一步纯化。
将4溶于15mL CH2Cl2中,搅拌下缓慢滴加15mL TFA,室温下反应30min后蒸出溶剂,剩余液体产物用5mL甲醇溶解,加入100mL乙醚,析出大量白色固体沉淀,过滤干燥得到1.38g白色固体终产物5。1H NMR(D2O):δ=1.22-1.45(m,4H),1.67-1.73(m,2H),2.99(m,2H),3.38(m,2H),3.70(m,1H),4.09(m,2H).13C NMR(D2O):δ=21.4,28.4,29.6,39.5,53.4,56.2,57.8,116.0(TFA),153.1,162.3(TFA),172.9.HRMS:m/z calcd for C9H17N5O4[M]+:259.1281;found:259.1283,证明得到的Lys-azido结构正确。2:pXH-N3的构建
通过文献资料的调研,tRNAPyl的高效表达是非天然氨基酸有效插入的关键因素之一,而过高的表达量又会对宿主细胞产生明显的细胞毒效应,因此合理的优化tRNAPyl表达,可以有助于突变型蛋白的大量表达。
(1)首先固定tRNA的个数(1个),通过更换尝试不同的启动子,包括U1、mu6、H1、hu6以及7sk启动子,以第39位氨基酸为非天然氨基酸的绿色荧光蛋白(GFP39TAG)为报告蛋白,验证不同启动子对非天然氨基酸插入效率的影响,如图2-B,C所示;结果表明7sk(SEQ ID NO:6)启动子在选择的启动子中,能够最有效的插入非天然氨基酸;
(2)固定启动子为7sk启动子,通过改变tRNA串联个数,包括1、2、3、4和5个,以萤火虫荧光素酶为报告基因,海肾荧光素酶为参比基因,两基因间包含有含有TAG终止密码子的连接臂,通过TAG通读效率来检测不同tRNA串联个数对非天然氨基酸插入效率的影响,如图2-E所示;图示表明当串联4个tRNA的时候, 非天然氨基酸的插入效率较最高;
(3)通过将tRNA合成酶pheRS,4个启动子7sk-tRNApyl通过基因亚克隆方法克隆进同一载体pUC19(利用BamHI酶切位点)如图2-A所示,构建成辅助载体pXH-N3,其序列如SEQ ID NO:5所示。
3:突变美罗华的NAEK掺入表达及纯化
(1)以表达重链A122位置的突变型(RTX-H122)为例:将实施例1的步骤2和4获得的pEF-RTX-LC-WT(其表达美罗华抗体的轻链氨基酸)以及pEF-RTX-HC122(其表达美罗华抗体的重链氨基酸,并在第122号位点含有点突变),以及实施例2的步骤3的pXH-N3以一定比例混合,再与转染试剂PEI按一定比例混合,共同加入哺乳动物细胞,同时加入NAEK至终浓度1mM,100rpm,37℃,8%CO2表达若干天后收集培养上清;
(2)随后对表达细胞系,转染试剂,各载体比例,载体与转染试剂比例,添加剂种类等对突变型表达条件进行优化,如图4所示,最终确定表达条件为Freestyle293细胞系,40kDa枝链PEI转染,载体与PEI比例为1:4(质量比),三种载体比例pEF-RTX-LC-WT:pEF-RTX-HC122:pXH-N3=1:1:3,添加VPA,表达7天;
(3)将收集的培养上清9000rpm,4℃高速离心10min,除细胞及细胞碎片,经过中空纤维过滤系统进行微滤及超滤进一步处理浓缩(40倍以上),并进行Ni-NTA-Bind缓冲液的交换,再次离心去除细胞碎片,经过Ni-NTA金属螯合亲和层析,用Ni-NTA-Wash缓冲液充分洗涤,最后用Ni-NTA-Elute缓冲液洗脱,得到初步纯化的美罗华样品,纯度约为95%。将初步纯化后的蛋白样品经过4-5次超滤换液,换至小分子偶联缓冲液中(20mM Tris-HCl pH=8.0,200mM NaCl,经Chelex100 5×20cm处理三遍,彻底清洗残余金属离子)。
4:突变美罗华的鉴定
(1)设计对照组,将未加NAEK的表达细胞作为对照,做相同转 染处理;
(2)收集培养上清,直接加入SDS-PAGE上样缓冲液煮样处理,并做SDS-PAGE电泳及Western Blot分析,对比目的位置蛋白质条带,可明显观察到加入NAEK组表达出全长美罗华,如图3所示。
实施例3:突变体与双功能连接臂(DIBO-DOTA)的定点偶联
1:双功能连接臂DIBO-DOTA的合成和鉴定:
将化合物1(2.88g,14.0mmol)溶于20mL无水CH2Cl2中,N2保护,缓慢加入BF3·OEt2(2.59mL,21.0mmol),之后将体系移至-10℃冷井中,搅拌下缓慢滴加三甲基硅烷化重氮甲烷(2.0mol/Lin hexanes)的CH2Cl2溶液(10.5mL三甲基硅烷化重氮甲烷溶于20mL无水CH2Cl2),1小时滴加完毕。-10℃下继续反应2-4小时后,将反应液倾入50mL冰水中淬灭反应,分离出有机相,水相用CH2Cl2萃取(2×50mL)。有机相合并后用饱和食盐水洗涤(2×40mL),无水硫酸钠干燥后过滤浓缩,硅胶柱分离(石油醚:CH2Cl2,v/v,2/1)得到淡黄色产物2(2.22g,72%).1H NMR(300MHz,CDCl3):δ8.26(1H,q,J=1.4,6.6Hz),7.13-7.43(7H,m),7.05(2H,q,J=3.8,12.9Hz),4.06(2H,s).13C NMR(75MHz,CDCl3):δ 196.6,136.9,136.3,135.4,133.8,133.1,132.4,131.4,130.6,129.3,128.8,128.0,127.3,126.9,48.4.MALDI HRMS:m/z 243.0767[M+Na+].Calcd for C16H12NaO+:243.0780.
将化合物2(2.20g,10mmol)溶于EtOH和THF的混合溶剂中(1/1,v/v,80mL),搅拌下缓慢加入硼氢化钠(0.76g,20mmol),室温反应隔夜。TLC检测反应完全后,向体系中缓慢滴加1mL醋酸淬灭反应。旋蒸除去溶剂后加入80mL CH2Cl2混悬,饱和食盐水洗涤(3×80mL),无水硫酸钠干燥后过滤浓缩,硅胶柱分离(石油醚:乙酸乙酯,v/v,8/1;梯度洗脱效果不好)得到白色固体产物3(2.00g,91%).1H NMR(300MHz,CDCl3):δ7.50(1H,m),7.14-7.30(7H,m),6.90(2H,q,J=2.7,12.0Hz),5.31(1H,q,J=6.3,10.0Hz),3.41(2H,m).13C NMR(75MHz,CDCl3):δ141.7,136.7,136.2,134.5,131.7,131.5,130.1,129.9,129.3,128.7,127.4,127.2,126.9,125.9,74.4,42.7.MALDI HRMS:m/z 245.0949[M+Na+].Calcd for C16H14NaO+:245.0937.
将化合物3(1.11g,5mmol)溶于25mL CHCl3中,搅拌下缓慢滴加溴素(0.26mL,5mmol)。室温下反应0.5h,TLC检测原料反应完全后,旋蒸除去溶剂,硅胶柱分离(石油醚:CH2Cl2,v/v,2/1,或者梯度洗脱)得到黄色粘稠液体产物4(1.11g,58%)。1H NMR(300MHz,CDCl3):δ7.54-7.47(2H,aromatics),7.31-6.72(6H,aromatics),5.77(1H,d,J=5.4Hz,CHBr),5.22(1H,dd,J=3.6,15.9Hz,CHOH),5.19(1H,d,J=5.4Hz,CHBr),3.50(1H,dd,J=3.6,15.9Hz,CH2),2.75(1H,dd,J=3.6,15.9Hz,CH2).13C NMR(75MHz,CDCl3):δ141.3,140.0,137.2,134.0,133.4,131.5,131.3,130.9,127.8,126.2,123.7,121.3,76.5,70.0,62.3,32.2.MALDI HRMS:m/z402.9313[M+Na+].Calcd for C16H14Br2NaO+:402.9304.
将化合物4(0.77g,2mmol)溶于20mL干燥的THF中,N2保护,搅拌下缓慢滴加2.0M LDA的THF溶液(4mL,8mmol)。室温反应0.5h,向反应体系中缓慢滴加0.5mL蒸馏水淬灭反应。旋 蒸除去溶剂,用80mlDCM溶解,用饱和食盐水洗涤两次,油相干燥拌样,硅胶柱分离(石油醚:乙酸乙酯,v/v,8/1,或者梯度洗脱)得到白色固体产物5(0.25g,57%)。1H NMR(300MHz,CDCl3):δ7.67(1H,aromatics),7.37-7.18(7H,aromatics),4.57(1H,dd,J=2.1,14.7Hz,CHOH),3.04(1H,dd,J=2.1,14.7Hz,CH2),2.86(1H,dd,J=2.1,14.7Hz,CH2).13C NMR(75MHz,CDCl3):δ154.5,150.6,128.6,127.1,1127.0,126.0,125.8,125.1,124.7,123.0,122.7,121.7,111.9,109.6,74.2,47.7
将化合物5(0.22g,1mmol)溶于30mLCH2Cl2中,加入0.4mL吡啶及对硝基氯甲酸苯酯(0.4g,2mmol)。室温下反应过夜,TLC检测原料5反应完全后,反应液用饱和食盐水洗涤(2×40mL),无水硫酸钠干燥后过滤浓缩,硅胶柱分离(石油醚:CH2Cl2,v/v,2/1)得到白色固体产物6(0.34g,72%)。1H NMR(300MHz,CDCl3):δ8.23-8.18(2H,aromatics),7.56-7.54(2H,aromatics),7.46-7.18(8H,aromatics),5.52(1H,dd,J=3.9,15.3Hz,CHOH),3.26(1H,dd,J=3.9,15.3Hz,CH2),2.97(1H,dd,J=3.9,15.3Hz,CH2);13C NMR(75MHz,CDCl3):δ154.5,150.7,149.1,148.7,129.0,127.4,127.3,126.7,126.5,125.5,125.2,124.3,124.0,122.6,122.4,120.8,120.6,120.2,112.2,108.5,80.6,44.8;MALDI HRMS:m/z 408.0852[M+Na+].Calcd for C23H15NNaO5+:408.0842.
将乙二胺(30mg,0.5mmol)溶于10mL(无水)CH2Cl2中,加入300μL三乙胺,N2保护,搅拌下加入化合物6(38mg,0.1mmol)。用二氯甲烷甲醇体系冲柱(30:1-5:1)。得到化合物7.1HNMR(300MHz,CDCl3):δ7.51-7.50(2H,aromatics),7.35-7.28(6H,aromatics),5.50(1H,s,CHOH),3.26-3.15(3H),2.93-2.85(3H);13CNMR(75MHz,CDCl3):δ155.6,152.0,150.9,129.8,127.9,127.8,126.9,126.1,125.8,123.7,123.6,121.2,112.8,109.9,46.1,43.6,41.5.
2:NAEK定点突变蛋白的双功能连接臂定点定量偶联(见图5)
含有NAEK的定点突变蛋白,借助NAEK上的叠氮基团,与DIBO-DOTA(含有环辛炔结构的化合物)通过环辛炔的环张力实现无铜催化的Click连接反应。无铜催化连接反应体系如下:
RTX-122-NAEK(其是实施例2制备的) 1ug/ul
DIBO-DOTA 1mM
反应条件:4℃,垂直混悬12小时。
结果验证双功能连接臂DIBO-DOTA定点定量的偶联到美罗华上(见图5-A,B),经过上述反应条件能够在12小时内将95%以上的美罗华定点偶联双功能连接臂,反应后的复合物经过超滤除盐,溶液交换至同位素偶联缓冲液中(20mM乙酸铵-乙酸pH=5.5,Chelex100处理3遍),得到的连接产物可用作定点标记同位素用。
实施例4:突变体放射性同位素的定点偶联及鉴定
正电子成像术(Positron emission tomography,PET)已经越来越成为肿瘤治疗中的关键性技术,而Cu64由于其半衰期短(~12小时),对人体危害小,其与DOTA较易形成稳定的络合物,因此适合研究进行PET的现象治疗;而Lu177由于其半衰期适中(~6天),主要释放beta射线,辐射半径短,从而较适宜进行治疗性放射免疫偶联物的研发。
1:美罗华-Cu64的定点偶联:
双功能连接臂(DIBO-DOTA)的一端DIBO通过八元环辛炔与突变型抗体的叠氮基团进行无铜Click反应,另一端DOTA通过螯合作用与放射性金属同位素反应。放射性同位素Cu64由北京大学肿瘤医院核医学科生产制备,美罗华-Cu64连接反应体系如下:
RTX-122-DIBO-DOTA 100ug(1mg/ml)
Cu64 2mCi
反应条件:42℃静置1小时。
结果依次进行Radio-TLC,以及SDS-PAGE分析(如图6-A、 B、C所示),确认同位素进行偶联后,经过PD-10柱简单除盐,能够获得放免纯度>98%的放射免疫偶联物;
2:荷瘤小鼠的美罗华-Cu64的Micro-PET成像
将CD20表达阳性细胞Ramos A1细胞以1×107/只右侧腋下注射严重免疫缺陷(Severe Combined Immune-deficiency,SCID)小鼠,约两周后,尾静脉注射300-350uCi美罗华-Cu64偶联物,另作封闭组,同时注射500ug未偶联放射性物质美罗华作为封闭剂。于注射后18小时,60小时,以1.5%异氟烷麻醉小鼠,进行Micro-PET显像,如图7所示。
由显像结果可见,随时间推移,放射性物质明显富集于肿瘤部位,PET可见到清晰的瘤体图像。
虽然用上述实施方式描述了本发明,应当理解的是,在不背离本发明的精神的前提下,本发明可进行进一步的修饰和变动,且这些修饰和变动均属于本发明的保护范围之内。例如,本申请虽然以美罗华偶联Cu64为例进行了说明,但是很显然,本发明不应当仅仅限于美罗华偶联Cu64,本领域技术人可将本发明适用于任何目的蛋白偶联任何小分子。
- 还没有人留言评论。精彩留言会获得点赞!