一种波赛链霉菌及其生产表柔红霉素的方法与流程
本发明属于生物医药领域,涉及一种波赛链霉菌及其应用。
背景技术:
蒽环类抗生素是应用最广泛的抗肿瘤抗生素。其中表柔红霉素是重要的抗肿瘤药物,同时也是工业生产表阿霉素的重要前体。表阿霉素与阿霉素相比较,抗肿瘤活性相当,但是心脏毒性和骨髓毒性比阿霉素低,并且随着新剂型的发展、同其它抗肿瘤药物新组合的应用使得表阿霉素在临床上的应用越来越广泛。工业生产表阿霉素一般以柔红霉素为原料,采用化学半合成的方法生产。专利US5874550披露了一种表阿霉素的合成方法,首先通过发酵得到柔红霉素,然后将柔红霉素4号位的羟基氧化成酮基,再将这个酮基立体特异性地还原得到表柔红霉素,通过表柔红霉素最终合成得到表阿霉素。从柔红霉素到表柔红霉素再到表阿霉素,需要经过多步条件要求苛刻的反应过程,工艺复杂,技术难度大,环保成本高。如果采用微生物发酵方法直接生产表柔红霉素可简化表阿霉素的合成步骤,大大节约成本,提高效率。
表柔红霉素结构如下:
目前已有报道表柔红霉素的产生菌种。国际专利申请WO 2006111561中公开了通过对链霉菌属中波赛链霉菌的菌株进行诱变处理,获得一株表柔红霉素生产菌株,其发酵液中表柔红霉素产量在100mg/L以上。德国的W.C.贺利氏有限公司在美国专利申请US20100143977中公开了一种由波赛链霉菌经遗传修饰的基因工程菌株,其发酵液中表柔红霉素产量在500mg/L以上。但这些菌株大多为通过基因工程手段构建的新菌种,对实验条件和技术人员的水平要求高, 菌种不够稳定,而且菌种发酵产量普遍较低,基本上还停留在实验室阶段,不利于形成产业化。因此,寻找能够产生表柔红霉素的新微生物菌种和新的制备方法的工作仍在继续进行中。
技术实现要素:
本发明的目的是提供一种生产表柔红霉素的新菌株,以解决上述问题。
本发明的一个方面在于提供一种能生产表柔红霉素的微生物菌株。该菌株为波赛链霉菌(Streptomyces peucetius)HS1402001,于2014年12月11日保存于中国微生物菌种保藏管理委员会普通微生物中心(地址:北京市朝阳区北辰西路1号院,中国科学院微生物研究所),保藏号为CGMCC NO.10159,并登记入册,证明存活。
本发明的另一方面是提供波赛链霉菌HS1402001在生产表柔红霉素或含有表柔红霉素的药物组合物中的应用。
本发明的另一方面是提供一种利用波赛链霉菌HS1402001生产表柔红霉素的方法,该方法包括将波赛链霉菌HS1402001在含有可同化的碳源、氮源的营养培养基里进行有氧发酵。
优选地,上述可同化的碳源为淀粉、糊精、葡萄糖、工业糖蜜、甘油、蔗糖、乳糖、麦芽糖、海藻糖、木聚糖、甘露醇、山梨醇中的一种或几种;其中,所述糊精为麦芽糊精和玉米糊精中的一种或几种,所述淀粉为玉米淀粉、土豆淀粉和红薯淀粉中的一种或几种,所述淀粉可以制成可溶性淀粉。
优选地,上述可同化的氮源为酵母抽提物、酵母粉、牛肉浸膏、蛋白胨(如胰蛋白胨)、黄豆饼粉、棉籽饼粉、花生饼粉、麸质粉、玉米浆干粉、麸皮、尿素、铵盐、硝酸盐中的一种或几种;其中,所述酵母抽提物包括酵母抽提粉和/或酵母膏。
优选地,所述发酵培养的温度为20℃-40℃,优选为25℃-30℃;pH为6.5-7.5,优选为6.8左右;培养时间为120-240小时;通气量为0.5-1.0vvm。
所述发酵方式为液体深层发酵。
本发明中,表柔红霉素可通过以下HPLC方法进行检测:
色谱柱为C18柱,5μm,4.6×250mm;
流动相为,缓冲液∶乙腈∶甲醇=500∶500∶60;
缓冲液:取十二烷基硫酸钠1.44g和磷酸0.68ml溶于500ml超纯水中制备得到;
流速:1.35ml/min;
检测波长:254nm;
进样量:10μl。
本发明与现有技术相比具有以下优点:
1、简化生产工艺。本发明所述菌种能够通过直接发酵方法生产表柔红霉素或其类似物,简化了从柔红霉素经化学合成得到表阿霉素的工艺,有利于降低生产成本和减少环境污染。
2、提高发酵单位。跟现有技术中的表柔红霉素生产菌相比,利用本发明的波赛链霉菌生产表柔红霉素的产量有了大幅度提高,达到了工业化生产的要求。
3、发酵产量高且菌种稳定。现有表柔红霉素生产菌种多为基因工程菌,本发明所述菌为通过等离子体诱变而来,发酵产量高,较基因工程菌更为稳定,且操作简便、安全无毒。
附图说明
图1显示了本发明的波赛链霉菌HS1402001在ISP2培养基上的菌落形态;
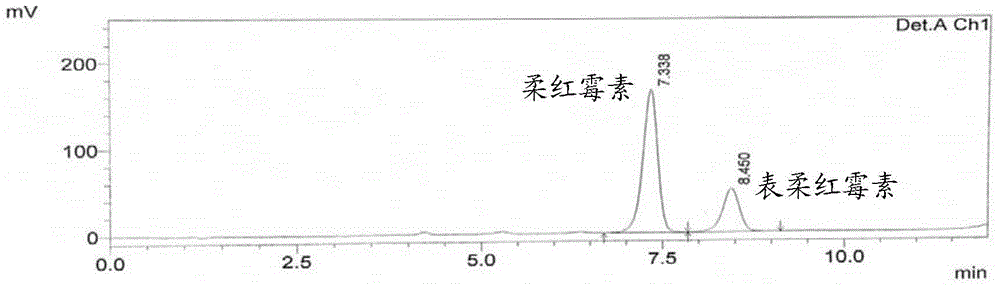
图2为柔红霉素与表柔红霉素标准品混合物的HPLC图谱;
图3为本发明的波赛链霉菌HS1402001在实施例1中产生的发酵液的HPLC图谱;
图4为本发明的波赛链霉菌HS1402001在实施例1中产生的表柔红霉素的MS图谱;
图5为本发明的波赛链霉菌HS1402001在实施例1中产生的表柔红霉素的1H-NMR图谱;
图6为本发明的波赛链霉菌HS1402001在实施例1中产生的表柔红霉素的13C-NMR图谱。
具体实施方式
在本发明中,波赛链霉菌HS1402001、菌株HS1402001以及HS1402001均表示本发明提供的表柔红霉素生产菌,即,保存于中国微生物菌种保藏管理委员会普通微生物中心的保藏号为CGMCC NO.10159的菌株。
如未有特殊说明,以下实施例中涉及的培养基、制备方法、培养方法、检测方法等均为本领域公知的,使用的各种试剂均可以从普通生化试剂商店或供应商处购得。
本申请中,“通气量”表示通入经过滤除菌的无菌空气的量。
实施例1:菌株制备和筛选
本发明的菌株HS1402001为将购自美国菌种保藏中心(ATCC)的柔红霉素生产菌Streptomyces peucetius ATCC29050通过等离子体诱变而得到的表柔红霉素生产菌株。
将柔红霉素的生产菌Streptomyces peucetius ATCC29050涂布于ISP2平皿培养基上,置于30℃培养8-10天,用接种铲挑取菌落,制得孢子悬液,供等离子体诱变处理。
取待处理的菌悬液10μL均匀涂布在载片表面,用无菌镊子将载片放到等离子诱变托盘的对应孔位。调节旋转定位台旋钮,使载片与等离子体发生器(无锡源清天木生物科技有限公司;型号:ARTP-II)射流出口间距约为2mm,并固定升降台。保持气体流量为10SLM,入射功率为120W,设置处理时间为50s。处理完毕后,将载片放入盛有1mL生理盐水的EP管中震荡洗脱1min。
将洗脱后的菌悬液经适当稀释后涂布于ISP2平板,并以未经诱变处理的菌悬液同样经适当稀释后涂布于ISP2平板作为对照。置于30℃培养8-10天后,检查菌落数,并计算致死率。
随机挑选经过等离子体诱变后的单菌落25000株,进行摇瓶发酵,HPLC检测是否产表柔红霉素以及产生的表柔红霉素的量。从而筛选出突变菌株HS1402001,此突变菌株发酵产物的HPLC分析结果见图3,以图2的柔红霉素和表柔红霉素标准品混合物的HPLC图谱作为对照,可见,此突变菌株只产表柔红霉素,不产柔红霉素。
进一步做该表柔红霉素的MS、1H-NMR和13C-NMR图谱,结果分别见图4-图6。
实施例2:菌株HS1402001的生物学和培养学特征
该菌株的主要生物学特征为:此菌株菌落形态相对出发菌株(即柔红霉素生产菌Streptomyces peucetius ATCC29050)发生了明显改变:本发明的菌株HS1402001不产孢子,菌落大致呈圆形,皱褶状,紫红色,中间凸起,边缘不平整,具体菌落形态如图1所示。
采用ISP1、ISP2、ISP3、ISP4、ISP5、高氏一号、苹果酸钙、营养琼脂、YMS和查氏培养基10种固体培养基表征菌株的培养学特征。28℃培养7~10天后,观察菌丝体的颜色及色素情况,结果见表1。
表1:菌株HS1402001在10种固体培养基上的培养特征
实施例3:菌株HS1402001的生理生化特征
生理生化试验1-4:除温度实验外,均为28℃培养7~10天。
1、碳源的利用:采用ISP9作为基础培养基,各种碳源的浓度均为1.0%(质量百分浓度),结果见表2。
2、无机氮源的利用:采用ISP9作为基础培养基,硝酸钾和硫酸铵的浓度均为0.1%(质量百分浓度),结果见表2。
3、降解试验和NaCl耐受实验采用基础培养基GYEA(pH6.8),其中,降解试验结果见表3,NaCl耐受试验结果见表4。
4、其它生理生化特征试验(结果见表5)、pH试验和温度试验(结果分别见表6和表7)均采用YMS培养基。
表2:菌株HS1402001的碳源和氮源的利用情况
表3:菌株HS1402001的降解试验结果
表4:菌株HS1402001对NaCl的耐受性
表5:菌株HS1402001的其它生理生化特征
表6:菌株HS1402001生长的pH试验
表7:菌株HS1402001生长的温度试验
注:表1-7中各试验结果所表示的数字和符号分别代表:0,无生长;1,生长很弱;2,能生长;3,生长良好;4,生长最好;+,阳性;-,阴性。
实施例4:16S rDNA序列分析及菌种鉴定
收集待测菌株HS1402001的新鲜菌体,采用溶液菌酶法改进的Pitcher法(Pitcher等,1989)提取总DNA作为模板,采用通用引物(27F(序列为:
GAGAGTTTGATCCTGGCTCAG)和1495R(序列为:
CTACGGCTACCTTGTTACGA))进行16S rRNA基因扩增,PCR产物经检测纯化后,直接进行序列测定,PCR产物测序由南京金斯瑞生物科技有限公司进行。所测的16S rDNA序列经校对后与GenBank数据库中相关种、属的序列进行同源序列BLAST比较,以确定该菌株的分类地位。
菌株HS1402001的16S rDNA序列与GenBank中相关序列进行BLAST比较,结果见表8(表中只列出同源性较高的菌株)。
通过对菌株HS1402001表观特征的试验发现该菌株和波赛链霉菌(Streptomyces peucetius)分类相关参数非常接近,同时对菌株HS1402001的16S rDNA测序结果比较,发现其和Streptomyces peucetius strain NBRC 100596的同源性达到了99.8%,故将菌株HS1402001鉴定为波赛链霉菌(Streptomyces peucetius)的菌株。
表8:菌株HS1402001和相关菌株的同源性比较
菌株HS1402001的16S rDNA的部分序列:
TTACGCCAAGCTTGCATGCCTGCAGGTCGACGATTCTACGGCTACCTTGTT
ACGACTTCGTCCCAATCGCCAGTCCCACCTTCGACAGCTCCCTCCCACAAG
GGGTTGGGCCACCGGCTTCGGGTGTTACCGACTTTCGTGACGTGACGGGC
GGTGTGTACAAGGCCCGGGAACGTATTCACCGCAGCAATGCTGATCTGCG
ATTACTAGCAACTCCGACTTCATGGGGTCGAGTTGCAGACCCCAATCCGA
ACTGAGACCGGCTTTTTGAGATTCGCTCCGCCTCACGGCTTCGCAGCTCTT
TGTACCGGCCATTGTAGCACGTGTGCAGCCCAAGACATAAGGGGCATGAT
GACTTGACGTCGTCCCCACCTTCCTCCGAGTTGACCCCGGCAGTCTCCTGT
GAGTCCCCATCACCCCGAAGGGCATGCTGGCAACACAGAACAAGGGTTGC
GCTCGTTGCGGGACTTAACCCAACATCTCACGACACGAGCTGACGACAGC
CATGCACCACCTGTATACCGACCACAAGGGGGGCACCATCTCTGATGCTT
TCCGGTATATGTCAAGCCTTGGTAAGGTTCTTCGCGTTGCGTCGAATTAAG
CCACATGCTCCGCTGCTTGTGCGGGCCCCCGTCAATTCCTTTGAGTTTTAG
CCTTGCGGCCGTACTCCCCAGGCGGGGAACTTAATGCGTTAGCTGCGGCA
CCGACGACGTGGAATGTCGCCAACACCTAGTTTCCAACGTTTACGGCGTG
GACTACCAGGGTATCTAATCCTGTTCGCTCCCCACGCTTTCGCTCCTCAGC
GTCAGTAATGGCCCAGAGATCCGCCTTCGCCACCGGTGTTCCTCCTGATAT
CTGCGCATCTCACCGCTACACCAGGAATTCCGATCTCCCCTACCACACTCT
AGCCTGCCCGTATCGAATGCAGACCCGGGGTTAAGCCCCGGGCTTTCACA
TCCGACGCGACAAGCCGCCTACGAGCTCTTTACGCCCAATAATTCCGGAC
AACGCTTGCGCCCTACGTATTACCGCGGCTGCTGGCACGTAGTTAGCCGG
CGCTTCTTCTGCAGGTACCGTCACTTTCGCTTCTTCCCTGCTGAAAGAGGT
TTACAACCCGAAGGCCGTCATCCCTCACGCGGCGTCGCTGCATCAGGCTTT
CGCCCACTGTGCAATATTCCCCACTGCTGCCTCCCGTAGGAGTCTGGGCCG
TGTCTCAGTCCCAGTGTGGCCGGTCGCCCTCTCAGGCCGGCTACCCGTCGT
CGCCTTGGTAGGCCATCACCCCACCAACAAGCTGATAGGCCGCGGGCTCA
TCCTTCACCGCCGGAGCTTTCAACCGCAGACCATGCGATCCGCAGTGTTAT
CCGGTATTAGACCCCGTTTCCAGGGCTTGTCCCAGAGTGAAGGGCAGATT
GCCCACGTGTTACTCACCCGTTCGCCACTAATCCCCTCCCGAAGGAGGTTC
ATCGTTCGACTTGCATGTGTTAAGCACGCCGCCAGCGTTCGTCCTGAGCCA
GGATCAAACTCTCAATCTCTAGAGGATCCCCGGGTACCGAGCTCGAATTCA
菌株HS1402001与Streptomyces peucetius strain NBRC 100596(GenBank登录号:NR_112574.1)的16S rDNA序列的比较(Query=菌株HS1402001,sbjct=Streptomyces peucetius strain NBRC 100596):
实施例5:制备表柔红霉素1
(1)斜面菌丝体的制备与培养:
斜面孢子培养基配方(g/L):蔗糖10,酵母抽提粉10,KH2PO40.2,MgCl20.2,琼脂20,消前pH6.5-7.0,试管30×200mm,装量20mL,经121℃灭菌20分钟后,冷却到50-60℃摆斜面,接入一环HS1402001的菌丝体经28±1℃培养10天后,菌丝成熟。
(2)种子液的制备与培养:
种子培养基配方(g/L):可溶性淀粉20,葡萄糖10,酵母抽提粉15,CaCO34,消前pH7.0,摇瓶(250mL三角瓶)装液量为25mL,经121℃灭菌20分钟。菌体接种量为105-106c.f.u./mL,培养温度28±1℃,250rpm,摇床振荡培养40小时,这时培养液pH7.0-7.5,菌丝浓度为15-20%(体积百分比)。
(3)表柔红霉素发酵培养基的制备与培养:
发酵培养基配方(g/L):可溶性淀粉50,乳糖30,葡萄糖20,麸质粉10,花生饼粉20,玉米浆干粉10,CaCO33,消前pH7.0,摇瓶(250mL三角瓶)装液量为25mL,经121℃灭菌20分钟。将种子液以5-10%(体积百分比)的接种量接入,在28±1℃,250rpm摇床振荡培养8天,发酵结束后HPLC测表柔红霉素的发酵单位,测得发酵单位为700mg/L。
实施例6:制备表柔红霉素2
(1)种子罐种子液的制备:
在20L种子罐中投入15L的种子培养基(种子培养基的配比为在实施例5的种子培养基基础上,再添加0.3%的豆油作消泡剂),采用蒸汽灭菌,在121℃条件下灭菌30分钟,待冷却后,接入200mL摇瓶种子液中,培养温度28±1℃,搅拌转速200rpm,通气量1vvm,培养24小时,此时pH7.0-7.5,菌丝浓度为15-25%(体积百分比)。
(2)发酵罐培养基的配制与培养:
发酵培养基的配方与前述实施例5的发酵培养基配方相同,但要添加0.05%聚丙二醇(PPG)作为消泡剂。发酵罐50L,投料体积为35L,消前pH6.8,消后pH7.0,于121℃下蒸汽灭菌30分钟,冷却后,接入约3.5L种子罐培养液,发酵温度28±1℃,搅拌桨转速150-200rpm,通气量为0.8-1.0vvm,发酵培养8天,放罐,测得表柔红霉素发酵单位为800mg/L。
实施例7:制备表柔红霉素3
(1)种子培养:
种子培养基(g/L):玉米淀粉20,葡萄糖10,麦芽糊精20,酵母抽提粉15,黄豆饼粉10,CaCO34,MgSO4·7H2O 1,pH7.0,摇瓶(250mL三角瓶)装液量为25mL,经121℃灭菌20分钟。从实施例5的斜面挖一块菌丝体接入种子培养基,置于摇床上28±1℃培养40小时。
(2)表柔红霉素的制备:
将2.5mL步骤(1)得到的种子培养液接入发酵培养基(g/L):麦芽糊精100,工业糖蜜20,蔗糖10,酵母粉10,蛋白胨20,棉籽饼粉10,CaCO33,CaCl23,pH7.0。发酵培养基装量为25mL/250mL三角瓶,121℃灭菌20分钟,置于摇床上28℃培养8天。HPLC检测,发酵单位为800mg/L。
实施例8:制备表柔红霉素4
种子培养液的制备按照实施例7步骤(1)进行。然后2.5mL的种子培养液接入发酵培养基(g/L):麦芽糊精120,玉米淀粉20,麦芽糖10,酵母粉10,黄豆饼粉20,麸质粉10,棉籽饼粉10,CaCO33,CaCl23,CuSO4·5H2O 0.01,pH7.0。发酵培养基装量为25mL/250mL三角瓶,121℃灭菌20分钟,置于摇床上28℃培养9天。HPLC检测,发酵单位为1000mg/L。
- 还没有人留言评论。精彩留言会获得点赞!