一种对硝基苯胺修饰多肽C端的固相合成方法与流程
本发明涉及药物合成领域,具体涉及对硝基苯胺修饰的多肽的合成方法。
背景技术:
含有对硝基苯胺修饰的多肽是一类具有药物活性的多肽类分子,是多种氨肽酶家族成员活性测试的一个重要的合成底物。氨肽酶(aminopeptidases)作为一种蛋白质水解酶,能从多肽链的游离n端(氨基末端)由外向内逐个水解氨基酸。这些氨肽酶不仅在调节人体正常的生理功能方面起重要作用,而且已成为疾病诊断和治疗的靶标,在生物医学研究领域具有广泛应用。在药物研究领域,对硝基苯胺修饰的多肽对恶性肿瘤细胞的增殖、分化、侵袭以及血管生成过程中起重要作用,是研究抗肿瘤药物的一个重要靶标。
随着医学技术的发展和研究的深入,发展合成c端被对硝基苯胺修饰的多肽方法具有十分重要的意义。目前较少有文献和专利报道合成对硝基苯胺修饰多肽c端的方法。
对硝基苯胺分子中硝基具有很强的吸电子能力,且硝基和氨基处于苯环的对位,在形成酰胺键的过程十分缓慢,导致反应收率降低。很少有相关文献报道关于l-天冬氨pna、l-谷氨酸pna等的合成。实验过程中发现多肽分子直接与对硝基苯胺反应的收率一般都比较低。在多肽修饰过程中,随着多肽分子的增大,修饰的困难程度也随着加大,发展高效合成pna修饰多肽的方法具有重要的意义。
文献(化学试剂,2012,34(3),269—271)报道合成pna氨基酸常采用光气法合成,该方法首先将光气与氨基酸作用得到相应的nca中间体,然后将nca中间体与pna反应得到pna修饰的氨基酸;由于光气的毒性大,该工艺经过改进,采用毒性较小的三光气进行反应也可以得到相应的pna修饰氨基酸。尽管工艺对收率有所提高,但无论三光气还是光气都具有较大的的毒性,且对设备、环境、操作人员都有剧烈的伤害。对于多肽分子直接用三光气进行pna修饰的文献未见报道。采用常规的全保护多肽片段进行pna修饰收率十分低下不易于纯化,最后导致成本急剧上升,给医学的进一步研究带来了困难。
技术实现要素:
为了克服上述问题,本发明采用固相合成法、以便宜的fmoc保护氨基酸为原料,首先选用液相反应制备得到相应的fmoc-glu(oh)-pna、fmoc-asp(oh)-pna、fmoc-ser(oh)-pna、fmoc-thr(oh)-pna,经重结晶的方 法得到纯度在95%以上的pna氨基酸原料,然后采用固相合成的方法进行氨基酸缩合,最后经裂解得到目标粗肽。采用该方法得到的粗肽纯度较高,便于液相纯化,该方法大大的降低了生产成本。
本发明包括以下步骤:
1)pna氨基酸单体的制备
2)氨基酸侧链与树脂的偶联;
3)固相合成方法逐一偶联;
4)肽树脂的裂解;
5)反相高效液相色谱纯化;
所述步骤1)pna修饰的氨基酸采用fmoc保护的氨基酸经缩合反应、去保护反应两个步骤合成;
所述步骤a)缩合反应步骤得到的全保护pna氨基酸无需采用重结晶纯化,只需要简单的酸洗、碱洗即可直接进行去保护反应;
所述步骤a)去保护反应步骤中,得到的粗品进行重结晶即可得到纯度在95%以上的侧链裸露的pna修饰氨基酸;
所述步骤b)中采用氨基酸侧链接树脂的方法进行偶联;
所述步骤b)中针对fmoc-glu(oh)-pna、fmoc-asp(oh)-pna接树脂可以选择wang树脂和2-ctc氯树脂;
所述步骤b)中针对fmoc-ser(oh)-pna、fmoc-thr(oh)-pna接树脂选择2-ctc氯树脂;
所述步骤b)中fmoc-ser(oh)-pna、fmoc-thr(oh)-pna连接树脂选择2-ctc氯树脂采用dipea+csco3的方法,氮气氛围的条件反应24小时;
所述步骤2)中fmoc-glu(oh)-pna、fmoc-asp(cooh)-pna接树脂采用常规的偶联方法;连接wang树脂采用dic+a或b+a+c,其中a为hobt或hoat,b为hbtu、hatu、tbtu、pyaop或pybop,c为dipea或tmp;连接2-ctc氯树脂采用dipea法;
所述步骤3)中偶联采用dic+a或b+a+c的方法缩合,反应至茚三酮检测树脂透明;其中a为hobt或hoat,b为hbtu、hatu、tbtu、pyaop或pybop,c为dipea或tmp;
所述步骤4)中裂解采用不同配比的tfa:phsme:edt:phome:h2o溶液。
具体工艺流程如下:
本发首先采用液相合成的方法制备对硝基苯胺修饰的fmoc氨基酸,通过重结晶的方法可以很好的控制然后将氨基酸的侧链连接至树脂上,顺序偶联,最后裂解、纯化得到对硝基苯胺修饰的长肽分子。采用该方法解决了对硝基苯胺修饰长肽的技术问题,fmoc固相法合成对硝基苯胺修饰的长肽具有成本低、便于纯化,其中pna修饰的短肽产品纯度可以达到99%以上。
合成工艺路线:以fmoc-asp(otbu)-oh为例:
本发明的一个方面提供了一种对硝基苯胺修饰α羧基的氨基酸的制备方法,
1)将氨基酸的α氨基和侧链活性基团进行保护,
2)将步骤1)所得保护的氨基酸与对硝基苯胺在缩合剂的作用下进行缩合,得到粗产品,所得粗产品以酸性和/或碱性水溶液以及中性水溶液进行洗涤,而不进行其他纯化步骤即进入步骤3),
3)将步骤2)所得的粗产品脱去侧链保护,
4)将步骤3)所得的脱去侧链保护的粗产品溶解,调节ph值为酸性,并进行重结晶纯化。
进一步地,所述侧链活性基团为羟基或羧基,侧链保护选自-tbu。
进一步地,步骤2)中的缩合方法选用dic+a或b+a+c,其中a为hobt或hoat,b为hbtu、hatu、tbtu、pyaop或pybop,c为dipea或tmp的方法。其中dic+a组合摩尔比1-1.5:1-1.5、b+a+c组合摩尔比1-1.5:1-1.5:1.5-2、;优选地dic+hoat、dipea+hoat+hatu体系,所述保护的氨基酸与对硝基苯胺的摩尔比为1:1-1.5(1:1.1),更优选地,先以缩合剂催化氨基酸,然后再加入对硝基苯胺;后处理过程中采用酸性溶液为盐酸水溶液、碱性溶液为饱和碳酸氢钠或碳酸钠溶液、中性溶液为饱和食盐水溶液。
进一步地,其中步骤3)是以tfa/ch2cl2溶液进行脱去侧链保护的反应,反应停止后去除有机溶剂,将剩余溶液倒入冰水中进行过滤得到脱去侧链保护的粗产品;优选地,反应温度为20-30℃(室温),反应时间为1-3小时(2小时)。
进一步地,其中步骤4)中的ph值调节至5-6,并以乙酸乙酯、甲基叔丁基醚、丙酮、二氯甲烷、甲醇、乙醇等溶剂或其混合溶剂进行重结晶。
本发明的另一个方面提供了一种对硝基苯胺修饰多肽c端的固相合成方法,其包括如下步骤:
a)根据权利要求1-5任一项所述的方法制备对硝基苯胺修饰α羧基的氨基酸;
b)将氨基酸侧链与树脂的偶联;
c)固相合成方法逐一偶联氨基酸,形成肽树脂;
d)肽树脂的裂解;
e)反相高效液相色谱纯化。
进一步地,根据权利要求6所述的对硝基苯胺修饰多肽c端的固相合成方法,其中,
步骤b)中针对fmoc-glu(oh)-pna、fmoc-asp(oh)-pna接树脂选择wang树脂或2-ctc氯树脂;优选地,连接wang树脂采用dic+a或b+a+c,其中a为hobt或hoat,b为hbtu、hatu、tbtu、pyaop或pybop,c为dipea或tmp;连接2-ctc氯树脂采用dipea法;
针对fmoc-ser(oh)-pna、fmoc-thr(oh)-pna接树脂选择2-ctc氯树脂;优选采用dipea+csco3的方法,氮气氛围的条件反应24小时;
进一步地,步骤3)中偶联采用dic+a或b+a+c的方法缩合,反应至茚三酮检测树脂透明;其中a为hobt或hoat,b为hbtu、hatu、tbtu、pyaop或pybop,c为dipea或tmp。
进一步地,步骤4)中裂解采用不同配比的tfa:phsme:edt:phome:h2o溶液。
附图说明
图1为实施例2所得产物的质谱图。
图2为实施例5所得产物的质谱图。
图3为实施例8所得产物的质谱图。
图4为实施例11所得产物的质谱图。
具体实施方式
下面给出实施例以对本发明进行具体描述,有必要在此指出的是以下实施例只用于对本发明作进一步的说明,不能理解为对本发明保护范围的限制,该领域的技术熟练人员根据本发明内容对本发明作出的一些非本质的改进和调整,仍属于本发明的保护范围。
实施例1:侧链保护,主链被pna修饰的asp的合成
于1l反应瓶中加入400ml二氯甲烷、fmoc-asp(otbu)42.2g(102mmol),搅拌使原料全部溶解;溶液澄清后向反应瓶中加入hoat16.7g(122mmol)和dic19ml(123mmol)继续搅拌30min,然后向溶液中加入对硝基苯胺(pna)15.5g(115mmol)室温反应24小时;反应停止后向反应瓶中加水淬灭反应,依次用2mol/l盐酸溶液洗涤两遍、饱和碳酸钠溶液洗涤两遍和饱和食盐水洗涤一遍;有机相用无水硫酸钠干燥,减压浓缩得到fmoc-asp(otbu)-pna粗产物。
实施例2:侧链裸露,主链被pna修饰的asp的合成
实施例1中得到的fmoc-asp(otbu)-pna粗产物用400ml浓度为80%tfa/ch2cl2(体积比)溶液进行脱去tbu反应。室温反应两小时,反应停止后减压除去大部分二氯甲烷溶液,将剩余溶液倒入500ml冰水中,过滤得到fmoc-asp(oh)-pna粗品;用二氯甲烷溶解粗品,饱和碳酸氢钠洗涤粗品溶液直到无明显气泡产生,用1mol/l盐酸调节水相ph至5-6,分出有机相采用无水硫酸钠干燥,减压浓缩得fmoc-asp(oh)-pna,乙酸乙酯对粗品进行重结晶得产品30.1g,反应收率62%。产物结果通过质谱和核磁确认重结晶后产物为fmoc-asp(oh)-pna;ms:[m+h]=476.17:;1h-nmr(dmso-d6,400m)ppm,δ7.69(d,j=3.9hz,2h),7.56(d,j=8.8hz,4h),7.40(d,j=8.8hz,4h),7.18(d,j=4.0hz,2h),4.84(d,j=5.6hz,2h),3.85(d,j=6.3hz,2h),3.70(t,j=5.6hz,1h),3.61(t,j=6.3hz,1h)
13cnmr(100mhz,dmso-d6)δ165.94,160.79,154.07,138.43,137.05,136.47(2c),133.25(2c),128.42(2c),128.10(4c),125.90(4c),118.32(2c), 71.30,67.71,63.45,48.99.
实施例3:fmoc-asp(oh)-pna与树脂的反应
称取41.2g替代度为0.485mmol/g的2-ctc氯树脂,适量dmf洗涤3遍、溶胀30min待用;加入实施例2中得到的28.5g(60mmol)fmoc-asp(oh)-pna、dipea15.5g(120mmol),适量dmf反应3小时,反应结束后加入甲醇15ml、dipea7.8g(60mmol)继续反应30分钟,反应结束后dmf洗涤3遍,即得到fmoc-asp(-2-ctcresin)-pna。
实施例4:肽树脂的合成
将实施例3中得到的fmoc-asp(-2-ctcresin)-pna树脂继续用于合成pna修饰的多肽。在后续氨基酸的偶联中均可按照下列方法进行偶联,直至树脂采用茚三酮检测透明即可。后续氨基酸的活化剂为dic+a或b+a+c,其中a为hobt或hoat,b为hbtu、hatu、tbtu、pyaop或pybop,c为dipea或tmp。按照该方法一次偶联fmoc-val-oh、fmoc-glu(otbu)-oh和fmoc-asp(otbu)-oh,偶联完成后采用20%哌啶dmf溶液脱除fmoc,dmf洗涤6遍以上,甲醇收缩,真空干燥得到肽树脂53g,待裂解。
实施例5:肽树脂的裂解
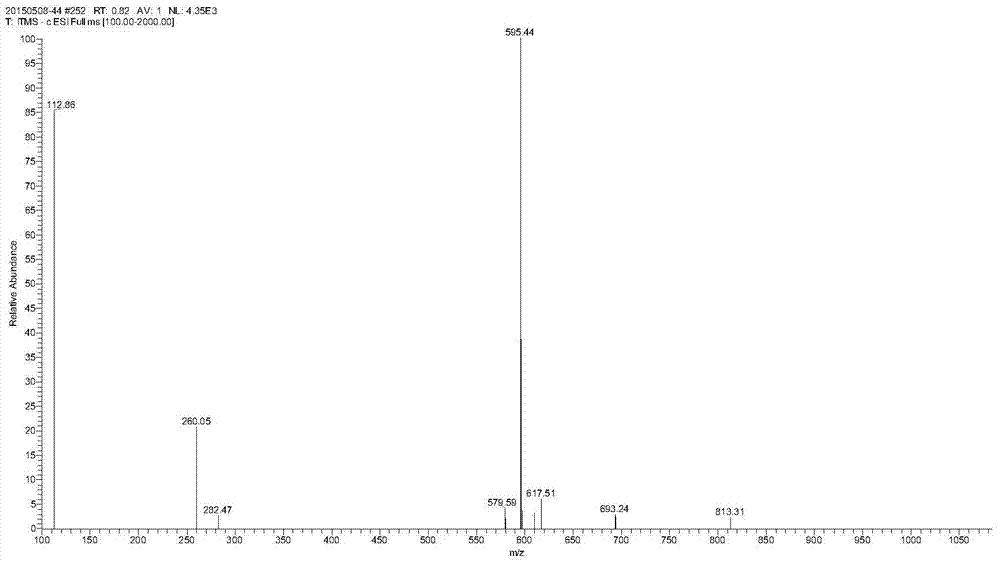
pna修饰肽树脂的裂解可以采用的裂解试剂为tfa:phsme:phome:edt:h2o:tis=80~90:0~5:0~3:0~5:0~5:0~2(v:v),实验中选择tfa:phsme:phome:edt:h2o=85:5:3:5:2。向实施例4中的得到的53g肽树脂中加入现配的裂解液530ml,室温搅拌反应2.5小时,反应结束后过滤除去树脂,滤液采用5l冰冻乙醚沉降、离心、减压干燥得到pna粗肽12.1g,粗肽纯度接近90%,产物结果通过质谱ms:[m-h]=595.44。
实施例6:含pna粗肽的hplc纯化
取实施例5中氧化得到的pna修饰粗肽,减压过滤除去不溶物,采用waters2545rp-hplc系统,波长210nm,色谱柱为50×250mm反相c18柱,柱温为38℃,常规0.1%tfa/水/乙腈流动相纯化,收集目的峰组分、减压浓缩、冷冻干燥得到纯度大于98.5%精肽9.8g。
实施例7:侧链保护,主链被pna修饰的asp合成
于1l反应瓶中加入380ml二氯甲烷、fmoc-asp(otbu)37.3g(90mmol),搅拌使原料全部溶解;溶液澄清后向反应瓶中加入hoat14.7g(108mmol)、hatu40.3g(106mmol),保持溶液温度在0-5℃,然后慢慢向溶液中慢慢加入die29.2ml(180mmol),30min后向溶液中加入对硝基苯胺(pna)13.7g(100mmol) 室温反应24小时;反应停止后向反应瓶中加水淬灭反应,依次用2mol/l盐酸溶液洗涤两遍、饱和碳酸钠溶液洗涤两遍和饱和食盐水洗涤一遍;有机相用无水硫酸钠干燥,减压浓缩得到fmoc-asp(otbu)-pna粗产物。
实施例8:侧链裸露,主链被pna修饰的asp合成
实施例7中得到的fmoc-asp(otbu)-pna粗产物用400ml浓度为80%tfa/ch2cl2(体积比v/v)溶液进行脱去tbu反应。室温反应两小时,反应停止后减压除去大部分二氯甲烷溶液,将剩余溶液倒入500ml冰水中,过滤得到fmoc-asp(oh)-pna粗品;用二氯甲烷溶解粗品,饱和碳酸氢钠洗涤粗品溶液直到无明显气泡产生,用1mol/l盐酸调节水相ph至5-6,分出有机相采用无水硫酸钠干燥,减压浓缩得fmoc-asp(oh)-pna,乙酸乙酯对粗品进行重结晶得产品27.5g,反应收率64%。产物结果通过质谱和核磁确认重结晶后产物为fmoc-asp(oh)-pna;ms:[m-h]=474.42:;1h-nmr(dmso-d6,400m)ppm,δ7.72(d,j=3.9hz,2h),7.61(d,j=8.8hz,4h),7.43(d,j=8.8hz,4h),7.22(d,j=4.0hz,2h),4.89(d,j=8.1,5.6hz,2h),3.89(d,j=6.3hz,2h),3.75(t,j=6.0hz,1h),3.65(t,j=5.3hz,1h)
13cnmr(100mhz,dmso-d6)δ166.04,160.89,154.27,138.49,137.16,136.66(2c),133.32(2c),128.49(2c),128.18(4c),125.99(4c),118.39(2c),71.39,67.81,63.55,48.97.
实施例9:fmoc-asp(oh)-pna与树脂的反应
称取35.2g替代度为0.512mmol/g的wang脂,适量dmf洗涤3遍、溶胀30min待用;用适量的dmf溶解fmoc-asp(oh)-pna25.7g(54mmol)、hobt7.3g(54mmol),冰浴冷却反应体系,保持溶液温度在0-5℃,然后慢慢加入dic8.5g(65mmol),活化3min后倒入反应柱中继续反应3小时,反应停止后用适量dmf洗涤3遍,加入适量的乙酸酐和吡啶混合溶液(体积比7:6)继续反应3小时,反应结束后dmf洗涤6遍,即得到fmoc-asp(-wangresin)-pna。
实施例10:肽树脂的合成
将实施例9中得到的fmoc-asp(-wangresin)-pna树脂继续用于合成pna 修饰的多肽。在后续氨基酸的偶联中均可按照下列方法进行偶联,直至树脂采用茚三酮检测透明即可。后续氨基酸的活化剂为dic+a或b+a+c,其中a为hobt或hoat,b为hbtu、hatu、tbtu、pyaop或pybop,c为dipea或tmp。按照该方法一次偶联fmoc-thr(tbu)-oh、fmoc-glu(otbu)-oh和fmoc-ile-oh,偶联完成后采用20%哌啶dmf溶液脱除fmoc,dmf洗涤6遍以上,甲醇收缩,真空干燥得到肽树脂48g,待裂解。
实施例11:肽树脂的裂解
pna修饰肽树脂的裂解可以采用的裂解试剂为tfa:phsme:phome:edt:h2o:tis=80~90:0~5:0~3:0~5:0~5:0~2(v:v),实验中选择tfa:phsme:phome:edt:h2o=85:5:3:5:2。向实施例4中的得到的53g肽树脂中加入现配的裂解液530ml,室温搅拌反应2.5小时,反应结束后过滤除去树脂,滤液采用5l冰冻乙醚沉降、离心、减压干燥得到pna粗肽9.5g,粗肽纯度接近90%;产物结果通过质谱ms:[m-h]=595.54。
实施例12:含pna粗肽的hplc纯化
取实施例5中氧化得到的pna修饰粗肽,减压过滤除去不溶物,采用waters2545rp-hplc系统,波长210nm,色谱柱为50×250mm反相c18柱,柱温为38℃,常规0.1%tfa/水/乙腈流动相纯化,收集目的峰组分、减压浓缩、冷冻干燥得到纯度大于98.5%精肽7.4g。
实施例13:boc-asp(otbu)-glu(otbu)-val-asp(otbu)-oh的合成
称取57.5g替代度为0.525mmol/g的2-ctc氯树脂,适量dmf洗涤3遍、溶胀30min待用;加入37.1g(90mmol)fmoc-asp(otbu)-oh、dipea23.5g(180mmol),适量dmf反应3小时,反应结束后加入甲醇20ml、dipea12.4g继续反应30分钟,反应结束后dmf洗涤3遍,即得到fmoc-asp(otbu)-2-ctcresin。
后续氨基酸的活化剂为dic+a或b+a+c,其中a为hobt或hoat,b为hbtu、hatu、tbtu、pyaop或pybop,c为dipea或tmp。按照该方法一次偶联fmoc-val-oh、fmoc-glu(otbu)-oh和boc-asp(otbu)-oh,偶联完成后dmf洗涤3遍,甲醇收缩,真空干燥得到肽树脂81g,采用1%tfa/ch2cl2(v/v)裂解树脂得全保护肽23.7g。
实施例14:boc-asp(otbu)-glu(otbu)-val-asp(otbu)-oh与pna的偶联
将实施例13中得到的全保护肽用230ml二氯甲烷溶解,加入hoat4.12g(30mmol)室温搅拌溶解后,慢慢加入dic3.88g(30mmol),搅拌30min后 再加入pna4.26g(30mmol)室温反应24小时。反应结束后减压除去溶剂,适量乙酸乙酯溶解,依次用1mol/lhcl溶液、饱和nahco3溶液和氯化钠溶液洗涤、无水硫酸钠干燥,检验浓缩得到粗肽24.9g。质谱可以发现目标峰,hplc检测粗肽中主要为全保护肽和pna。
将粗肽采用hplc纯化得到asp-glu-val-asp-pna精肽0.585g,收率约3.3%。
说明书和权利要求书中所使用的缩写的含义列于下表中:
- 还没有人留言评论。精彩留言会获得点赞!