用IL‑20拮抗剂治疗炎性疼痛的制作方法
本申请要求2014年4月1日提交的美国专利申请号14/242,574的优先权,其内容通过引用全文纳入本文。
发明背景
产生疼痛的刺激通过初级感觉神经元的神经末端被检测到,其细胞体在感觉神经节例如背根神经节(DRG)中发现。信号,以动作电位的形式,沿初级感觉神经纤维被传送到脊髓的背角,并从那里被传递到更高级的大脑中心,在大脑中心它被解释为疼痛。初级感觉神经元能被广泛的热、机械和化学刺激所激活。损伤或炎症释放一系列的炎症介质,其增加了感觉神经元对有害的热或机械刺激的敏感性。
白细胞介素IL-20(IL-20)是IL-10家族成员之一,IL-10家族成员包括IL-10、IL-19、IL-20、IL-22、IL-24、和IL-26。Blumberg等人,2001,细胞,104:9-19;Pestka等人,2004,免疫学年度评论22:929-979。IL-20在单核细胞、上皮细胞和内皮细胞中表达,并通过激活异源二聚体受体复合物的IL-20R1/IL20R2或IL-22R1/IL20R2而作用于多种细胞类型。Dumoutier等人,2001,免疫学杂志167:3545-3549。已发现IL-20参与各种炎性疾病,如牛皮癣(Blumberg等人,2001;Sa等人,2007,J Immunol 178:2229-2240和Wei等人,2005,Clin Immunol 117:65-72)、类风湿性关节炎(Hsu等人,2006,Arthritis Rheum 54:2722-2733)、动脉粥样硬化(Caligiuri等人,2006,Arterioscler Thromb Vasc Biol 26:1929-1930和Chen等人,2006,Arterioscler Thromb Vasc Biol 26:2090-2095)、缺血性中风(Chen等人,2009,J Immunol 182:5003-5012)和肾衰竭(Li等人,2008,Genes Immun 9:395-404)。还可参见Wei等人,2006,J Biomed Sci 13:601-612。
发明概述
本
技术实现要素:
是基于意外的发现,即IL-20可能参与炎性疼痛的敏化,并且抑制IL-20信号通路的抗体可成功地在具有诱导的炎症疼痛的小鼠中抑制机械性痛觉超敏。
因此,本发明的一个方面涉及用于缓解对象疼痛例如炎性疼痛的方法,它包括给予有需要的对象缓解疼痛有效剂量的IL-20拮抗剂。在一些实施方式中,IL-20拮抗剂是抑制IL-20介导的信号转导通路的抗体,如结合于IL-20蛋白(如,人IL-20)的抗体或结合于IL-20受体(如,人IL-20受体)的抗体。用于本文描述方法中的任何抗体,可以是全长抗体或其抗原结合片段。或者,抗体可以是人抗体、人源化抗体、嵌合抗体或单链抗体。
在一些实施方案中,在本文所述任何方法中使用的抗体可以是单克隆抗体mAb7E,或其抗原结合片段,或它们的功能性变体。在一实施例中,mAb7E的功能性变体含有与mAb7E相同的互补决定区(CDR)。在另一实施例中,功能性变体是mAb7E的人源化抗体。该人源化抗体可包括重链可变区(VH),其包括SEQ ID NO:8的氨基酸序列;和轻链可变区(VL),其包括SEQ ID NO:12或SEQ ID NO:13的氨基酸序列。
在其他实施方案中,用于本文所述任何方法中的IL-20拮抗剂,可以是结合于人IL-20受体,例如结合于IL-20R1亚基、IL-20R2亚基、IL-20R1/R2复合物、IL-22R1亚基、或IL-22R1/IL-20R2复合物的抗体。在一些实施方式中,抗体结合于人IL-20受体的亚基R1。这种抗体可以是全长抗体或其抗原结合片段。它也可以是人抗体、人源化抗体、嵌合抗体、或单链抗体。在一实施例中,结合于人IL-20受体亚基R1的抗体,是含有与单克隆抗体mAb51D或mAb7GW、或mAb51D或mAb7GW的功能性变体相同的VH和VL的抗体。功能性变体可以含有与mAb51D或mAb7GW相同的互补决定区(CDRs)。或者,功能性变体可以是mAb51D或mAb7GW的人源化抗体。
本文描述的方法(如使用抑制IL-20信号转导通路的抗体的方法)中待治疗的对象可以是患者(如,人类患者),该患者患有疼痛、炎症性疼痛,这些疼痛可以与急性炎症(例如响应于组织损伤或免疫应答激活的直接炎症)或慢性炎症(例如,长时间炎症所引起的疼痛)相关。炎性疼痛包括但不限于:与急性或慢性炎症相关的神经病疼痛(例如,神经疾病引起的疼痛),急性或慢性炎症引起的缺血性疼痛,关节炎疼痛,急性或慢性炎症诱发的肌肉疼痛,急性、慢性炎症、或化疗引起的神经痛。在一些实例中,对象是人类癌症患者,该患者被联合施用可引起外周神经病变的化疗剂(例如,本文描述的那些化疗剂)。
本发明的范围内还包括:(a)用于缓解对象疼痛(例如炎性疼痛)的药物组合物,该药物组合物含有本文描述的一种或多种IL-20拮抗剂(例如,抑制IL-20信号转导通路的抗体,如结合于人IL-20或人IL-20受体(R1、R2或它们的复合物)的抗体);和(b)刚才描述的药物组合物在制备用于缓解疼痛例如炎性疼痛和由例如化疗剂引起的周围神经病变的药物中的应用。
在以下说明书中阐述本发明一个或多个实施方式的细节。基于以下附图、数个实施方式的详细描述和所附权利要求,本发明的其他特征或优点是显而易见的。
附图说明
首先描述附图。
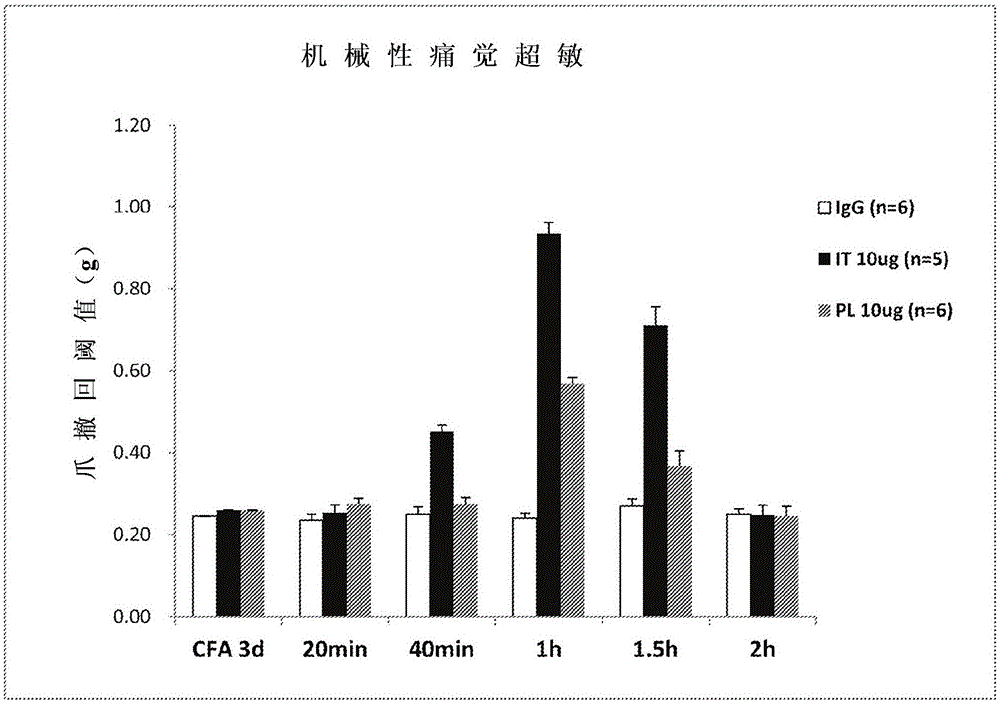
图1表示抗IL-20抗体(mAb7E)对由完全弗氏佐剂(CFA)诱导的炎症性疼痛的抑制效果的图。CFA诱导的机械性痛觉超敏,通过鞘内(IT)或爪(PL)注射抗IL-20抗体(10微克)而被显著抑制,而对照IgG(10微克)无抑制。*P<0.05,相对于IgG对照;#P<0.05,相对于IT组。数据表示5-6只小鼠的平均值±SEM。
图2表示抗IL-20抗体mAb7E通过鞘内注射在不同剂量下的镇痛效果图。*P<0.05,相对于基线对照(CFA3d);#P<0.05,相对于12μg组。数据表示5-6只小鼠的平均值±SEM。
图3为实施例2中详述的研究的实验方案的示意图。紫杉醇组:紫杉醇引起的神经病变是由隔日注射、共给予四次紫杉醇(4.5mg/kg)引起的。抗IL-20抗体/紫杉醇组:在每次注射紫杉醇前6h,给予抗IL-20抗体(“IL-20抗体”;为5mg/kg)。IL-20抗体组:在每次注射生理盐水前6h,给予抗IL-20抗体(5mg/kg)。生理盐水的注射体积与紫杉醇注射体积相等。对照组:四次生理盐水分别隔日注射。每一神经试验的基线测量,在给予紫杉醇或载体之前进行,并且在治疗之后,在1个月内,每个星期对4个额外的测试进行记录。
图4表示抗IL-20抗体对化疗引起的机械性痛觉超敏的神经保护作用的图。Y轴表示归一化的缩爪的时间(除以每组的基线水平)。每个点表示来自6只小鼠的平均值±SE。
图5表示化疗诱导的机械性痛觉超敏测试中,在处理后第4周评估的缩爪时间。每个数据表示来自6只小鼠的平均值±SE。*,p<0.05;**,P<0.01,通过非配对t检验。
图6表示抗IL-20抗体对化疗诱导的热异常性疼痛的神经保护作用的图。Y轴表示归一化的热反应潜伏期(除以每组的基线水平)。每个点表示6只小鼠的平均值±SE。*,P<0.05;**P<0.01,通过非配对t检验。
图7表示化疗诱导的热异常性疼痛测试中,在处理后第4周评估的热反应潜伏期。每个数据表示6只小鼠的平均值±SE。*,p<0.05;**,P<0.01通过非配对t检验。
序列简要说明
SEQ ID NO:1是编码单克隆抗体mAb7E重链可变区的核苷酸序列。
SEQ ID NO:2是单克隆抗体mAb7E的重链可变区的氨基酸序列。
SEQ ID NO:3是编码单克隆抗体mAb7E轻链可变区的核苷酸序列。
SEQ ID NO:4是单克隆抗体mAb7E的轻链可变区的氨基酸序列。
SEQ ID NO:5是编码衍生自mAb7E的人源化抗体HL1和HL2(前体形式,其包括信号肽)的重链可变区的核苷酸序列。
SEQ ID NO:6是衍生自mAb7E的人源化抗体HL1和HL2(前体形式,其包括信号肽)的重链可变区的氨基酸序列。
SEQ ID NO:7是编码衍生自mAb7E的人源化抗体HL1和HL2(成熟形式,缺乏信号肽)的重链可变区的核苷酸序列。
SEQ ID NO:8是衍生自mAb7E的人源化抗体HL1和HL2(成熟形式,缺乏信号肽)的重链可变区的氨基酸序列。
SEQ ID NO:9是编码人源化抗体HL2(前体形式,其包括信号肽)的轻链可变区的核苷酸序列。
SEQ ID NO:10是人源化抗体HL2(前体形式,其包括信号肽)的轻链可变区的氨基酸序列。
SEQ ID NO:11是编码人源化抗体HL2(成熟形式,缺乏信号肽)的轻链可变区的核苷酸序列。
SEQ ID NO:12是人源化抗体HL2(成熟形式,缺乏信号肽)的轻链可变区的氨基酸序列。
SEQ ID NO:13是人源化抗体HL1(成熟形式,缺乏信号肽)的轻链可变区的氨基酸序列。
SEQ ID NO:14是单克隆抗体mAb7GW的重链的氨基酸序列。
SEQ ID NO:15是编码单克隆抗体mAb7GW的重链的核苷酸序列。
SEQ ID NO:16是单克隆抗体mAb7GW的轻链的氨基酸序列。
SEQ ID NO:17是编码单克隆抗体mAb7GW的轻链的核苷酸序列。
SEQ ID NO:18是单克隆抗体mAb51D的重链的氨基酸序列。
SEQ ID NO:19是编码单克隆抗体mAb51D的重链的核苷酸序列。
SEQ ID NO:20是单克隆抗体mAb51D的轻链的氨基酸序列。
SEQ ID NO:21是编码单克隆抗体mAb51D的轻链的核苷酸序列。
发明详述
炎症引发一连串的生化反应,其中包括引发神经系统的疼痛感。此外,长期的(慢性的)炎症可以促进神经系统中的自适应变化,这会导致痛觉被增强或提高。例如,发炎组织(例如,关节炎膝盖)可能会过于脆弱,甚至轻轻一碰可能会引起疼痛,这种现象称为机械性痛觉超敏。
本公开内容报道了意想不到的发现:(i)IL-20可能参与敏化和/或引起炎性疼痛;(ii)能够干扰IL-20信号通路的抗体(例如,mAb7E)成功地在炎性疼痛的动物模型上抑制了机械性痛觉超敏。因此,本公开内容涉及使用有效量的IL-20拮抗剂治疗对象的炎性疼痛(例如,减轻炎性疼痛或延迟炎性疼痛的发病)的方法,所述IL-20拮抗剂可以是能干扰IL-20信号通路的抗体。
通用技术
除非另有说明,本发明的实践将使用分子生物学(包括重组技术)、微生物学、细胞生物学、生物化学和免疫学的传统技术,这些技术都在本领域的技术范围内。在文献中充分解释了这些技术,如分子克隆:实验手册,第二版(Sambrook等,1989)冷泉港出版社;寡核苷酸合成(M.J.Gait编辑,1984);分子生物学方法,胡马纳(Humana)出版社;细胞生物学:实验手册(J.E.Cellis编辑,1998)学术出版社;动物细胞培养(R.I.Freshney编辑,1987);细胞和组织培养介绍(J.P.Mather和P.E.Roberts,1998)纳姆(Plenum)出版社;细胞和组织培养:实验规程(A.Doyle,J.B.Griffiths和D.G.Newell编辑,1993-8)约翰·威利父子出版公司(J.Wiley and Sons);酶学方法(学术出版社有限公司);实验免疫学手册(D.M.Weir和C.C.Blackwell编辑);哺乳动物细胞基因转移载体(J.M.Miller和M.P.Calos编辑,1987);分子生物学实验室指南(F.M.Ausubel等人编辑,1987);PCR:聚合酶链式反应(Mullis等人编辑,1994);免疫学实验室手册(J.E.Coligan等人编辑,1991);分子生物学简明手册(威利父子Wiley and Sons,1999);免疫学(C.A.Janeway和P.Travers,1997);抗体(P.Finch,1997);抗体:实用方法(D.Catty编辑,IRL出版社,1988-1989);单克隆抗体:实用方法(P.Shepherd和C.Dean编辑,牛津大学出版社,2000);使用抗体:实验手册(E.Harlow和D.Lane(冷泉港实验室出版社,1999);抗体(M.Zanetti和J.D.Capra编辑,哈伍德学术出版社(Harwood Academic Publishers),1995)。
IL-20拮抗剂以及包含该拮抗剂的药物组合物
IL-20是属于IL-10细胞因子家族的促炎细胞因子。本文描述的IL-20是指白细胞介素20和其保留至少部分IL-20活性的变体。如本文所用,IL-20包括所有哺乳动物物种的天然序列IL-20,包括人、犬、猫、马或牛。在一实施例中,IL-20是人IL-20(GenBank登录号NP_061194.2)。
IL-20通过结合于IL-20受体激活IL-20信号转导通路,IL-20受体是包含亚基IL-20R1和IL-20R2(也称为RA和RB)的二聚体复合物。该IL-20受体由三种功能不同的细胞因子即IL-19、IL-20和IL-24共享,这表明该受体根据其结合于特定的细胞因子而介导不同的信号转导通路。IL-20也能结合于包含IL-20R2和IL-22R1的二聚体复合物。本文描述的IL-20受体是指能结合于IL-20且被其激活的一种或多种多肽。本文描述的IL-20受体包括所有哺乳动物物种的IL-20R1、IL-20R2和IL-22R1,其中包括但不限于:人、犬、猫、马、灵长类动物或牛。人IL-20受体的例子包括:hIL-20R1(GenBank登录号NM_014432.2)、hIL-20R2(GenBank登录号NM_144717.2)和hIL-22R1(NM_181309.1)。人IL-20受体的序列已有描述,例如,在美国专利号6,610,286、7,122,632、7,393,684和7,537,761;以及美国专利申请公开号2006/0263850A1、2006/0263851A1、2008/0247945A1和2009/0074661A1中。
本文描述的方法中使用的IL-20拮抗剂,是阻断、抑制或降低(包括显著地)IL-20生物活性的分子,其中包括由IL-20信号转导(例如受体结合和/或激发对IL-20的细胞应答反应)介导的下游通路。参见US2011/0064731,其通过引用全部并入本文。术语“拮抗剂”不意味任何特定机制的生物作用,并认为其明确包括和涵盖直接或间接地与IL-20的所有可能的药理学、生理学和生物化学的相互作用。为本公开内容的目的,将明确地理解,术语“拮抗剂”涵盖所有先前确定的术语、标题和功能状态以及特征,其中IL-20本身(例如,人IL-20)、IL-20生物活性(包括但不限于其介导任何方面的炎性疼痛的能力)或生物活性的后果,在任何有意义的程度被实质上废除(nullified)、降低或中和,例如至少20%、50%、70%、85%、90%、100%、150%、200%、300%或500%,或10倍、20倍、50倍、100倍、1000倍或104倍。
示例性IL-20拮抗剂包括但不限于:中和IL-20活性的抗体(例如,抗IL-20抗体诸如mAb7E),或结合于IL-20受体并抑制IL-20介导的信号传导通路的抗体(例如结合至IL-20受体亚基R1的抗体如mAb51D和mAb7GW)、针对IL-20的反义核酸(包括针对编码IL-20的核酸的反义核酸)、针对IL-20核酸的小干扰RNA(siRNA)、针对IL-20核酸的微小RNA(microRNA)、IL-20抑制性化合物、抗IL-20R抗体(如,特异结合IL-20R1、IL-20R2或由此形成的二聚体复合物的抗体)、针对IL-20受体亚基的反义核酸分子、针对编码IL-20受体亚基的核酸的siRNA或微小RNA、或IL-20R抑制性化合物。在一些实施方式中,IL-20拮抗剂结合于IL-20或IL-20受体并抑制IL-20-IL-20R复合物形成,从而抑制IL-20信号转导通路。在其他实施方式中,IL-20拮抗剂抑制或减少IL-20合成和/或产生(释放)。这种拮抗剂包括反义分子、siRNA和微小RNA。
能够干扰IL-20信号传导通路的抗体
抗体(可以复数形式互换使用)是免疫球蛋白分子,其能够通过位于免疫球蛋白分子可变区内的至少一个抗原识别位点特异性结合诸如碳水化合物、多核苷酸、脂质、多肽等的靶标。如本文所用,术语“抗体”不仅涵盖完整的(即全长)多克隆或单克隆抗体,而且包含其抗原结合片段(如Fab、Fab’、F(ab’)2、Fv)、单链(scFv)、其突变体、包含抗体部分的融合蛋白、人源化抗体、嵌合抗体、双抗体(diabodies)、线性抗体、单链抗体、多特异性抗体(如,双特异性抗体)和包含所需要特异性的抗原识别位点的任何其他修饰构型的免疫球蛋白分子,包括抗体的糖基化变体、抗体的氨基酸序列变体和共价修饰的抗体。抗体包括任何类型的抗体,如IgD、IgE、IgG、IgA或IgM(或其亚类),且抗体不必是任何特定类型。取决于其重链恒定区的抗体氨基酸序列,免疫球蛋白可归为不同类型。有五大类免疫球蛋白:IgA、IgD、IgE、IgG和IgM,其中一些可进一步分成亚类(同种型),如IgG1、IgG2、IgG3、IgG4、IgA1和IgA2。对应于不同类型免疫球蛋白的重链恒定区,分别称为α、δ、ε、γ和μ。不同类型免疫球蛋白的亚基结构和三维构型是公知的。
用于本文描述方法的抗体可以是鼠科、大鼠、人或任何其他来源(包括嵌合或人源化抗体)。在一些实施例中,抗体包括修饰的恒定区,如免疫惰性的恒定区,例如不触发补体介导的裂解,或不刺激抗体依赖性细胞介导的细胞毒性(ADCC)。可以使用美国专利号5,500,362公开的方法评价ADCC活性。在其他实施方式中,如Eur.J.Immunol.(1999)29:2613-2624、PCT申请号PCT/GB99/01441和/或UK专利申请号9809951.8中所描述,对恒定区进行修饰。
任何本文描述的抗体可以是单克隆或多克隆的。“单克隆抗体”是指同源抗体群,“多克隆抗体”是指异源抗体群。这两个术语不限制抗体的来源或者制备抗体的方式。
在一实施例中,用于本文描述方法中的抗体是人源化抗体。人源化抗体是指非人(例如鼠科)抗体形式,其为特异性嵌合免疫球蛋白、免疫球蛋白链、或其抗原结合片段,包含来自非人免疫球蛋白的最小序列。在大多数情况下,人源化抗体是人免疫球蛋白(受体抗体),其中来自受体互补决定区(CDR)的残基被来自非人物种(供体抗体)诸如小鼠、大鼠或兔的具有所需特异性、亲和力和能力的CDR的残基取代。在一些实例中,人免疫球蛋白的Fv框架区(FR)残基被相应非人残基取代。此外,人源化抗体可以包括既不存在于受体抗体也不存在于引入的CDR或框架序列的残基,但是包括这些残基以进一步完善和优化抗体性能。通常,人源化抗体将包含基本上全部的至少一个和通常两个可变区,其中全部或基本全部CDR区对应于非人免疫球蛋白的CDR区,全部或基本全部FR区是人免疫球蛋白共有序列的FR区。最佳地,人源化抗体还将包含至少部分的免疫球蛋白恒定区或结构域(Fc),典型地是至少部分的人免疫球蛋白恒定区或结构域(Fc)。抗体可以具有如WO99/58572中描述的修饰的Fc区。其他形式的人源化抗体具有一或多个CDR(一,二,三,四,五,六个),其相对于原始抗体被改变,其也称为“衍生自”原始抗体的一个或多个CDR的一个或多个CDR。人源化抗体也可以涉及亲和力成熟。
在另一实施例中,本文描述的抗体是嵌合抗体,其可以包括衍生自人抗体的重链恒定区和轻链恒定区。嵌合抗体是指具有衍生自第一物种的可变区或部分可变区和衍生自第二物种的恒定区的抗体。通常,在这些嵌合抗体中,轻链和重链的可变区均模拟衍生自一种哺乳动物(如,非人哺乳动物,如小鼠、兔和大鼠)的抗体的可变区,而不变部分与衍生自另一哺乳动物诸如人的抗体序列同源。在一些实施方式中,可以在可变区和/或恒定区进行氨基酸修饰。
在一些实施例中,本文描述的抗体特异性结合靶抗原,如人IL-20或人IL-20受体的两亚基之一(如,IL-20R1)。“特异性结合”到靶标或表位的抗体是本领域公知的术语,检测该特异性结合的方法也是本领域公知的。如果与其他靶标相比,分子与特定靶抗原反应或结合得更频繁,更迅速,具有更长的持续时间和/或具有更大的亲和力,则该分子被认为显示出“特异性结合”。如果与其结合于其他物质相比,抗体以更大的亲和力(affinity)、亲合力(avidity),更容易和/或以更长的持续时间结合于靶抗原,则抗体是特异性结合于靶抗原。例如,特异性(或优先)结合于IL-20表位的抗体,是与其结合于其他IL-20表位或非IL-20表位相比,以更大的亲和力、亲合力,更容易和/或以更长的持续时间结合该IL-20表位的抗体。通过阅读该定义,应理解,例如,特异性结合第一靶抗原的抗体可以或可以不特异性或优先结合第二靶抗原。因此,“特异性结合”或“优先结合”不一定需要(虽然其可包括)专一结合。通常,但不必须,提及结合就意味着优先结合。
能干扰IL-20信号转导通路的抗体可以是结合IL-20(如人IL-20)并抑制IL-20生物活性和/或IL-20介导的下游通路的抗体。或者,该抗体可以是结合IL-20受体(IL-20R)的抗体,如结合于IL-20受体亚基之一或两者,并抑制IL-20触发的受体介导的下游信号转导通路。
抗IL-20抗体
抗IL-20抗体是能结合于IL-20并抑制IL-20生物活性和/或IL-20信号转导介导的下游通路的抗体。在一些实施例中,用于本文描述方法中的抗IL-20抗体,抑制IL-20信号转导通路至少20%、至少40%、至少50%、至少75%、至少90%、至少100%、或至少2倍、至少5倍、至少10倍、至少20倍、至少50倍、至少100倍或至少1000倍。抗IL-20抗体的实例包括但不限于:美国专利号7,435,800、7,115,714、7,119,175、7,151,166和7,393,684以及PCT公开号WO2007/081465、WO99/27103、WO2004/085475和WO2005052000中公开的那些。
抗IL-20抗体与IL-20(如人IL-20)的结合亲和力可以小于约100nM、约50nM、约10nM、约1nM、约500pM、约100pM或约50pM中任一到任何约2pM。结合亲和力可以用KD或解离常数表示,增加的结合亲和力对应减少的KD。检测抗体与IL-20结合亲和力的一种方法是通过测定该抗体的单功能Fab片段的结合亲和力。为获得单功能Fab片段,抗体(例如IgG)可用木瓜蛋白酶切割或重组表达。抗体的抗IL-20Fab片段的亲和力,可以通过表面等离子共振(BIAcore3000TM表面等离子体共振(SPR)系统,BIAcore,INC,PiscawayNJ)确定。获得动力学结合速率(kon)和解离速率(koff)(通常在25℃检测),并通过koff/kon计算平衡解离常数(KD)值。
在一些实施方式中,抗体结合人IL-20,不显著结合衍生自另一哺乳动物物种的IL-20。在一些实施方式中,抗体结合人IL-20以及衍生自另一哺乳动物物种的一或多个IL-20。在还有的其他实施方式中,抗体结合IL-20,不显著与其他细胞因子(如相关细胞因子IL-10、IL-17A、IL-19、IL-22、IL-24和IL-26)交叉反应。抗体结合的表位可以是连续的或不连续的。
在一些实施方式中,本文描述的抗IL-20抗体是抗IL-20抗体7E,其是指单克隆抗体mAb7E和它的功能性变体。MAb7E由保藏在美国典型培养物保藏中心(10801大学大道,马纳萨斯,VA.20110-2209,USA)且保藏编号为PTA-8687的杂交瘤细胞系产生。在本申请被授予美国专利后,该杂交瘤细胞系将不可撤销地且没有限制/条件地对公众公开,且对于专利可实施期将从保藏之日起在ATCC保存至少30年,或在最近日期之后保存为期5年。
如下制备mAb7E重链可变区(VH)和轻链可变区(VL)的氨基酸序列和编码核苷酸序列。
mAb7E重链可变区的核苷酸序列(SEQ ID NO:1)和氨基酸序列(SEQ ID NO:2)
mAb7E轻链可变区的核苷酸序列(SEQ ID NO:3)和氨基酸序列(SEQ ID NO:4)
mAb7E的功能性变体(等价物)具有与mAb7E基本相同的表位结合特异性,表现出相对于mAb7E至少20%(如30%、40%、50%、60%、70%、80%、90%或更多)的中和IL-20介导的信号转导通路的活性。在一些实施方式中,mAb7E的功能性变体包含与mAb7E相同的负责抗原结合的区域/残基,如在CDR中决定特异性的相同的残基或整个CDR。可以通过本领域已知的方法,从mAb7GW或mAb51D的重链/轻链序列的氨基酸序列(如上所示)来鉴定负责抗原结合的区域/残基。参见,如,www.bioinf.org.uk/abs;Almagro,J.Mol.Recognit.17:132-143(2004)和Chothia等人,J.Mol.Biol.227:799-817(1987)。
此外,抗体中CDR区的确定也是本领域已知的。参见,如,www.bioinf.org.uk/abs;Almagro,J.Mol.Recognit.17:132-143(2004)和Chothia等人,J.Mol.Biol.227:799-817(1987)。至少有两种技术用于确定CDR:(1)基于跨物种序列变异的方法(即Kabat等人,免疫学感兴趣的蛋白序列“Sequences of proteins of Immunological Interest”(第5版,1991,美国国立卫生研究院,马里兰州贝塞斯达));和(2)基于抗原抗体复合物的结晶研究方法(Chothia等人(1989)Nature 342:877;Al-lazikani等人(1997)J.Molec.Biol.273:927-948))。如本文所用,CDR可以指通过任一方法或通过两种方法的组合来定义的CDR。
在一些实施例中,mAb7E的功能性变体包括VH链和VL链,VH链包括VHCDR1、VHCDR2和VHCDR3,其与相应的mAb7E的VHCDR至少75%(如80%、85%、90%、95%或98%)相同;VL链包括VLCDR1、VLCDR2和VLCDR3,其与相应的mAb7E的VHCDR至少75%(如80%、85%、90%、95%或98%)相同。
或者,mAb7E的功能性变体包括VH链和VL链,所述VH链与mAb7E的VH链(成熟或前体)至少75%(如80%、85%、90%、95%或98%)相同,所述VL链与mAb7E的VL链(成熟或前体)至少75%(如80%、85%、90%、95%或98%)相同。
使用由Karlin和Altschul改进(Proc.Natl.Acad.Sci.USA90:5873-77,1993)的Karlin和Altschul(Proc.Natl.Acad.Sci.USA87:2264-68,1990)的算法,检测两个氨基酸序列的“百分比相同度”。该算法并入Altschul等人,J.Mol.Biol.215:403-10,1990的NBLAST和XBLAST程序(2.0版)。可以采用XBLAST程序开展BLAST蛋白研究,设定分数=50,字长=3,从而获得与感兴趣的蛋白分子同源的氨基酸序列。当两序列间存在间隙时,可以采用Altschul等人,核酸研究(Nucleic Acids Res.)25(17):3389-3402,1997中描述的Gapped BLAST。当使用BLAST和Gapped BLAST程序时,可以使用各程序(如XBLAST和NBLAST)的默认参数。
在其他实施例中,mAb7E的功能性变体包括VH链和/或VL链,与mAb7E的VHCDR相比,VH链在VHCDR区(VHCDR1、CDR2和/或CDR3)包括至多5(如1、2、3、4或5)个氨基酸残基变异;与mAb7E的VHCDR相比,VL链在VLCDR区(VLCDR1、CDR2和/或CDR3)包括至多5(如1、2、3、4或5)个氨基酸残基变异。
mAb7E的功能性变体也在美国专利号7,611,705和US2011/0064731中被披露,两者通过引用并入本文。
在一实施例中,mAb7E的功能性变体是衍生自mAb7E的人源化抗体。以下提供的示例性人源化mAb7E抗体HL1和HL2,也参见美国专利号8,597,647。
人源化抗IL-20抗体HL1和HL2的VH链的氨基酸序列及编码核苷酸序列
下划线的区域表示信号肽,粗体/斜体区域是CDR。SEQ ID NOs:8和7分别表示成熟VH氨基酸序列(缺乏信号肽)和它的编码核苷酸序列。
人源化抗IL-20抗体HL2的VL链(VL2)的氨基酸序列和编码核苷酸序列
下划线的区域表示信号肽,粗体/斜体区域是CDR。SEQ ID NOs:12和11分别表示成熟VL氨基酸序列(缺乏信号肽)和它的编码核苷酸序列。
人源化抗体HL1包括与HL2相同的VH链和与HL2的VL相同的VL链(SEQ ID NO:13;成熟形式),不同点在于:HL2的成熟VL的位置2的I残基被F取代。
本文还公开了上述人源化抗体HL1和HL2的功能性变体。这些功能性变体可以包括VH链和VL链,VH链包括与HL1和HL2的VH的氨基酸序列(前体或成熟形式;分别为SEQ ID NO:6和SEQ ID NO:8)有至少85%(如,90%、92%、94%、95%、96%、97%、98%或99%)相同的氨基酸序列,VL链具有与HL2的VL的氨基酸序列(前体或成熟形式;分别为SEQ ID NO:10和SEQ ID NO:12)有至少85%(如,90%、92%、94%、95%、96%、97%、98%或99%)相同的氨基酸序列。这些变体能够结合于IL-20分子,特别是人IL-20分子。在一些实施例中,相对于上述示例性人源化抗体,变体具有类似的抗原-结合亲和力(如,Kd<4x10-9)。
抗IL-20R抗体
抗IL-20R抗体是能结合IL-20R(如,结合于它的两亚基的任一或两者,或结合于二聚体复合物)的抗体,并特异性抑制IL-20R生物活性和/或IL-20介导的其下游通路。在一些实施例中,用于本文描述方法中的抗IL-20抗体,抑制IL-20信号转导通路至少20%、至少40%、至少50%、至少75%、至少90%、至少100%或至少2倍、至少5倍、至少10倍、至少20倍、至少50倍、至少100倍或至少1000倍。在一些实施例中,抗IL-20R抗体特异性结合IL-20R1,如人IL-20R1。该抗体可以对IL-20R2或IL-20R1/IL-20R2复合物具有低亲和力,或不结合IL-20R2或IL-20R1/IL-20R2复合物。在其他实施例中,抗IL-20R抗体特异性结合IL-20R2,如人IL-20R2。该抗体可以对IL-20R1或IL-20R1/IL-20R2复合物具有低亲和力,或不结合IL-20R1或IL-20R1/IL-20R2复合物。在还有的其他实施例中,本文描述的抗IL-20R抗体特异性结合IL-20R1/IL-20R2复合物。
抗IL-20R抗体与IL-20R或其亚基(如人IL-20R或人IL-20R1)的结合亲和力,可以小于约100nM、约50nM、约10nM、约1nM、约500pM、约100pM或约50pM任一个值到约2pM。结合亲和力可以用KD或解离常数表示,增加的结合亲和力对应减少的KD。检测抗体到IL-20R结合亲和力的一种方法是通过测定该抗体的单功能Fab片段的结合亲和力。为获得单功能Fab片段,抗体(例如IgG)可用木瓜蛋白酶切割或重组表达。抗体的抗IL-20R Fab片段的亲和力可以通过表面等离子共振(BIAcore3000TM表面等离子体共振(SPR)系统,BIAcore,INC,PiscawayNJ)确定。获得动力学结合速率(kon)和解离速率(koff)(通常在25℃检测);并通过koff/kon计算平衡解离常数(KD)值。
在一些实施方式中,抗体结合人IL-20R或其亚基(如,人IL-20R1),不特异性结合衍生自另一哺乳动物物种的IL-20R。在一些实施方式中,抗体结合人IL-20R以及来自另一哺乳动物物种的一个或多个IL-20R。在还有的其他实施方式中,抗体结合IL-20R,不显著与其他细胞因子受体交叉反应。抗体结合的表位可以是连续的或不连续的。
在一些实施方式中,用于本文描述方法中的抗体是具有与单克隆抗体mAb7GW或mAb51D相同的重链和轻链可变区(VH和VL)的抗体、单克隆抗体、其抗原结合片段、或mAb7GW或mAb51D的功能等价物。US2011/0256093,其通过引用全部并入本文。以下示出的是mAb7GW和mAb51D的重链和轻链的氨基酸序列,连同它们的编码核苷酸序列。
mAb7GW重链:
氨基酸序列(SEQ ID NO:14)
(斜体区域是指重链恒定区)
核苷酸序列(SEQ ID NO:15)
(斜体区域编码重链恒定区)
mAb7GW轻链
氨基酸序列(SEQ ID NO:16)
(斜体区域是指轻链恒定区)
核苷酸序列(SEQ ID NO:17)
(斜体区域编码轻链恒定区)
mAb51D重链
氨基酸序列(SEQ ID NO:18)
(斜体区域是指重链恒定区)
核苷酸序列(SEQ ID NO:19)
(斜体区域编码重链恒定区)
mAb51D轻链
氨基酸序列(SEQ ID NO:20)
(斜体区域是指轻链恒定区)
核苷酸序列(SEQ ID NO:21)
(斜体区域编码轻链恒定区)
mAb7GW或mAb51D的功能性变体具有与mAb7GW或mAb51D相同的表位结合特异性,表现出相对于mAb7GW或mAb51D至少20%(如30%、40%、50%、60%、70%、80%、90%或更多)的中和IL-20R1介导的信号转导通路的活性。在一些实施方式中,mAb7GW或mAb51D的功能性变体包含与mAb7GW或mAb51D相同的负责抗原结合的区域/残基,如CDR中决定特异性的相同的残基或整个CDR。可以通过本领域已知方法,由mAb7GW或mAb51D的重链/轻链序列的氨基酸序列(如上所示)来鉴定负责抗原结合的区域/残基。参见,如,www.bioinf.org.uk/abs;Almagro,J.Mol.Recognit.17:132-143(2004)和Chothia等人,J.Mol.Biol.227:799-817(1987)。
在一些实施例中,mAb7GW或mAb51D的功能等价物(变体)包括VH链和VL链,VH-链包括VH CDR1、VH CDR2和VH CDR3,其与相应的mAb7GW或mAb51D的VH CDR至少75%(如80%、85%、90%、95%或98%)相同;VL链包括VL CDR1、VL CDR2和VL CDR3,其与相应的mAb7GW或mAb51D的VH CDR至少75%(如80%、85%、90%、95%或98%)相同。
或者,mAb7GW或mAb51D的功能等价物包括VH链和VL链,所述VH链与mAb7GW或mAb51D的VH链(成熟或前体)至少75%(如80%、85%、90%、95%或98%)相同,所述VL链与mAb7GW或mAb51D的VL链(成熟或前体)至少75%(如80%、85%、90%、95%或98%)相同。
在其他实施例中,mAb7GW或mAb51D的功能等价物包括VH链和/或VL链,与mAb7GW或mAb51D的VH CDR相比,所述VH链在VH CDR区(VH CDR1、CDR2和/或CDR3)包括至多5(如1、2、3、4或5)个氨基酸残基变异;与mAb7GW或mAb51D的VH CDR相比,VL链在VL CDR区(VLCDR1、CDR2和/或CDR3)包括至多5(如1、2、3、4或5)个氨基酸残基变异。
(c)抗体制备
可以通过本领域已知的任何方法,制备本文描述的能干扰IL-20信号转导通路的抗体。参见,例如Harlow和Lane,(1988)抗体:实验手册,冷泉港实验室,纽约。
在一些实施方式中,可以采用常规杂交瘤技术制备对靶抗原(如,人IL-20或IL-20R1)特异性的抗体。全长靶抗原或其片段,任选地连接到载体蛋白如KLH,可以用于免疫宿主动物以产生结合该抗原的抗体。免疫接种宿主动物的通路和时间安排一般是符合刺激和生产抗体的既定和常规技术,如本文进一步描述。生产小鼠、人源化和人抗体的一般技术是本领域已知的并在本文中描述。考虑任何哺乳动物对象包括人类或其中的抗体生产细胞可以被操纵从而作为生产哺乳动物包括人的杂交瘤细胞系的基础。典型地,宿主动物腹腔内、肌内、口服、皮下、足跖和/或皮内接种一定量的免疫原,包括如本文描述的。
采用Kohler,B.和Milstein,C.(1975)Nature 256:495-497的一般体细胞杂交技术或Buck,D.W.,等人,In Vitro,18:377-381(1982)改进的技术,可以从淋巴细胞和永生化骨髓瘤细胞制备杂交瘤。有用的骨髓瘤细胞系,包括但不限于:X63-Ag8.653以及来自索尔克研究所细胞配送中心(圣迭戈,加利福尼亚州,美国)(Salk Institute,Cell Distribution Center,San Diego,Calif.,USA,)的那些细胞系,可以用于杂交。通常,技术涉及使用融合剂如聚乙二醇或使用本领域技术人员公知的电方式,融合骨髓瘤细胞和淋巴细胞。融合后,将细胞从融合培养基中分离,并在选择生长培养基如次黄嘌呤-氨基喋呤-胸苷(HAT)培养基中生长,以消除未杂交的亲本细胞。本文描述的任何培养基(补加或未补加血清),可用于培养分泌单克隆抗体的杂交瘤。作为细胞融合技术的另一替代,EBV永生化B细胞可用于产生本发明的抗IL-20单克隆抗体。如果需要的话,扩增杂交瘤并亚克隆,并且通过常规免疫检测程序(如,放射免疫法、酶联免疫法或荧光免疫法)检测上清液的抗免疫原活性。
可以用作抗体来源的杂交瘤,包括产生能干扰IL-20信号转导通路的单克隆抗体的母体杂交瘤的所有衍生细胞、后代细胞。产生这些抗体的杂交瘤可以使用已知程序在体外或体内生长。如果需要的话,可以通过常规免疫球蛋白纯化程序,如硫酸铵沉淀,凝胶电泳,透析,色谱和超滤从培养基或体液中分离单克隆抗体。如果存在不需要的活性,可以去除,例如通过将制备物流过由免疫原附着于固相而制备的吸附剂,并从免疫原洗脱或释放所需抗体。用利用双官能或衍生剂(例如马来酰亚胺苯甲酰磺基琥珀酰亚胺酯(通过半胱氨酸残基偶联),N-羟基琥珀酰亚胺(通过赖氨酸残基),戊二醛,琥珀酸酐,SOC1,或R1N=C=NR(其中R和Rl是不同的烷基)偶联到蛋白(在待免疫物种中具有免疫原性,如钥孔血蓝蛋白、血清白蛋白、牛甲状腺球蛋白或大豆胰蛋白酶抑制剂),将靶抗原或含有靶氨基酸序列的片段来免疫宿主动物,可以产生抗体(如单克隆抗体)群。
如果需要的话,感兴趣的抗体(单克隆或多克隆的)(如通过杂交瘤产生)可以被测序,然后多核苷酸序列可以克隆到用于表达或繁殖的载体。编码感兴趣的抗体的序列可被保持在宿主细胞载体内,然后可以扩增宿主细胞并冷冻供将来使用。或者,多核苷酸序列可用于基因操做以“人源化”抗体或改善亲和力(亲和力成熟)或抗体的其他特征。例如,如果抗体用于人类临床试验和治疗,恒定区可以工程化以更类似于人恒定区以避免免疫应答。可能需要遗传操作抗体序列,以获得与靶抗原的更强亲和力和抑制由IL-20介导的信号通路的更大功效。对本领域技术人员来说,显而易见的是可对抗体进行一个或多个多核苷酸改变并仍然保持其对靶抗原的结合特异性。
在其他实施方式中,可以通过使用已经被工程化以表达特定的人免疫球蛋白的市售小鼠获得全人的抗体。为产生更可取(如完全人抗体)或更强健的免疫应答而设计的转基因动物,也可用于产生人源化或人抗体。该类技术的实例为Amgen,Inc.(弗里蒙特,加利福尼亚州)的XenomouseRTM,以及Medarex,Inc.(普林斯顿,新泽西州)的HuMAb-mouseRTM和TCmouseTM。在另一个替代方案中,可以通过噬菌体展示技术重组生产抗体。参见,例如美国专利号5,565,332、5,580,717、5,733,743和6,265,150;以及Winter等人,(1994)Annu.Rev.Immunol.12:433-455。或者,噬菌体展示技术(McCafferty等人,(1990)Nature 348:552-553)可以用于从来自未免疫的供体的免疫球蛋白可变(V)区基因库,在体外产生人抗体和抗体片段。
可以通过常规方法制备完整抗体(全长抗体)的抗原结合片段。例如,通过胃蛋白酶消化抗体分子可以产生F(ab’)2片段,通过还原F(ab’)2片段的二硫键能产生Fab片段。
遗传工程抗体,如人源化抗体、嵌合抗体、单链抗体和双特异性抗体,可以通过如常规重组技术生产。在一实施例中,可用常规程序(如通过采用能特异结合于编码单克隆抗体重链和轻链的寡核苷酸探针)容易地分离和测序编码对靶抗原特异性的单克隆抗体的DNA。杂交瘤细胞作为此类DNA的优选来源。一旦分离,DNA可放入一个或多个表达载体中,然后转染入原本不产生免疫球蛋白的宿主细胞,诸如大肠杆菌细胞、猿猴COS细胞、中国仓鼠卵巢(CHO)细胞、或骨髓瘤细胞,从而在重组宿主细胞中实现单克隆抗体的合成。参见如,PCT公开号WO 87/04462。然后,可以修饰DNA,例如通过采用人重链和轻链恒定区的编码序列取代同源鼠序列,Morrison等人,(1984)Proc.Nat.Acad.Sc i.81:6851,或通过将非免疫球蛋白多肽的全部或部分编码序列,共价接合到免疫球蛋白编码序列。以这种方式,可以制备具有靶抗原结合特异性的基因工程抗体,如“嵌合”或“杂交”抗体。
用于生产“嵌合抗体”开发的技术是本领域众所周知的。参见如,Morrison等人.(1984)Proc.Natl.Acad.Sci.USA 81,6851;Neuberger等人.(1984)Nature 312,604和Takeda等.(1984)Nature 314:452。
用于构建人源化抗体的方法也是本领域众所周知的。参见如,Queen等人,Proc.Na tl.Acad.Sci.USA,86:10029-10033(1989)。在一实施例中,按照本领域中已知的方法,对非人的亲本抗体VH和VL的可变区进行三维分子建模分析。接着,使用相同的分子建模分析来鉴定被预测对正确CDR结构的形成重要的框架氨基酸残基。平行地,使用亲本VH和VL序列作为搜索查询,从任何抗体基因数据库来识别具有与那些非人的亲本抗体同源的氨基酸序列的人VH和VL链。然后选择人VH和VL受体基因。
所选择的人受体基因内的CDR区可以替换为来自非人的亲本抗体或其功能性变体的CDR区。必要时,被预测在与CDR区相互作用中重要的母链的框架区域内的残基(见上文描述),可以用于代替人受体基因内的相应残基。
可以通过重组技术连接编码重链可变区的核苷酸序列和编码轻链可变区的核苷酸序列,来制备单链抗体。优选地,在两可变区之间加入柔性接头。或者,可以采用用于生产单链抗体描述的技术(U.S专利号4,946,778和4,704,692),从而生产噬菌体scFv文库,可以采用常规程序从所述文库识别出对IL-20R1或IL-20R2特异性的scFv克隆。进一步筛选阳性克隆从而鉴定抑制IL-20受体活性的那些克隆。
本领域已知和本文描述方法获得的抗体,可以采用本领域公知的方法来表征。例如,一种方法是识别抗原结合的表位,即“表位定位”。本领域有很多方法用于定位和表征蛋白上表位的位置,包括解析抗体-抗原复合物的晶体结构、竞争测定、基因片段表达测定、以及合成肽测定,这在以下文献中有描述,例如,在Harlow和Lane,“使用抗体,实验手册”,冷泉港实验室出版社,冷泉港,N.Y.,1999的第11章。在另一个实施例中,表位定位可以用于检测抗体结合的序列。表位可以是线性表位,即包含在单段氨基酸中,或由不一定包含在单段(一级结构线性序列)内的氨基酸三维相互作用形成的构象表位。可以分离或合成(例如,重组地)不同长度(如,至少4-6个氨基酸长)的肽,并用于与抗体的结合测定。在另一实施例中,可以在系统筛选中使用衍生自靶抗原序列的重叠肽并检测抗体结合来确定抗体结合的表位。根据基因片段表达测定,编码靶抗原的开放阅读框被随机或通过特定的遗传构建而分段,从而确定抗原的表达片段与待测试抗体的反应性。基因片段可以,例如,通过PCR产生,然后在体外转录,并在放射性氨基酸的存在下翻译成蛋白。然后通过免疫沉淀和凝胶电泳确定抗体与放射性标记的抗原片段的结合。某些表位还可以通过利用噬菌体颗粒(噬菌体文库)的表面上展示的随机肽序列的大文库来鉴定。或者,可以在简单的结合测定中,测试明确的重叠肽片段文库与测试抗体的结合。在另外的实施例中,可以进行抗原结合域诱变、结构域交换实验和丙氨酸扫描诱变,从而识别表位定位所需的、足够的和/必须的残基。例如,可以使用靶抗原突变体进行结构域交换实验,靶抗原突变体中IL-20多肽的多个片段已被衍生自密切相关的但抗原性不同的蛋白(如神经营养因子蛋白家族另一成员)的序列所取代(交换)。通过评估抗体与突变IL-20的结合,可以评价特定抗原片段对于抗体结合的重要性。
或者,可以使用已知结合于相同抗原的其他抗体进行竞争试验,从而测定抗体是否如其他抗体那样结合于相同表位。竞争试验是本领域技术人员公知的。
其他IL-20拮抗剂
除了上述能干扰IL-20信号转导通路的抗体之外的IL-20拮抗剂,可以用于本文描述的方法。
在本发明的一些实施方式中,IL-20拮抗剂包括至少一反义核酸分子,该反义核酸分子能阻断或减少功能性IL-20(如人IL-20)或IL-20受体亚基(如IL-20R1)的表达。IL-20和IL-20受体亚基的核苷酸序列是已知的且容易从公开的数据库获得。参见上文公开内容。制备特异性结合靶mRNA而不与其他多核苷酸交叉反应的反义寡核苷酸分子是常规的。示例性的靶位包括但不限于,起始密码子,5’调节区,编码序列和3’非翻译区。在一些实施方式中,寡核苷酸约10-100个核苷酸长,约15至50个核苷酸长,约18至25个核苷酸长,或更长。寡核苷酸可以包括骨架修饰,如,例如,本领域公知的硫代磷酸酯键,和2’-0糖修饰。
或者可以采用基因敲除、吗啉代寡核苷酸、小干扰RNA(siRNA或RNAi)、微小RNA或核糖酶,来降低IL-20/IL-20R表达和/或释放,这些方法是本领域公知的。RNA干扰(RNAi)是一种方法,其中dsRNA指导信使RNA的同源序列特异性降解。在哺乳动物细胞中,可通过小干扰RNA(siRNA)的21-核苷酸双链体引发RNAi,而不激活宿主的干扰素响应。用于本文公开方法中的dsRNA可以是siRNA(包含两个独立和互补的RNA链)或短发夹RNA(即,形成紧密发夹结构的RNA链),可以基于靶基因序列来设计这两者。或者,它可以是微小RNA。
任选地,如上述本文描述方法中待用的核酸分子(如,反义核酸,小干扰RNA或微小RNA),可包含非天然存在的核糖碱基、糖、或核苷间共价键(骨架)。这样修饰的寡核苷酸,可赋予期望的性质,例如增强的细胞吸收,改进的与靶核酸的亲和力,和增加的体内稳定性。
在一实施例中,核酸具有修饰的骨架,包括保留磷原子的那些骨架(参见如,美国专利3,687,808、4,469,863、5,321,131、5,399,676和5,625,050)和不具有磷原子的那些骨架(参见如,美国专利5,034,506、5,166,315和5,792,608)。含磷修饰骨架的实例包括但不限于:具有3’-5’连接键或2’-5’连接键的硫代磷酸酯、手性硫代磷酸酯、二硫代磷酸酯、磷酸三酯、氨基烷基磷酸三酯、甲基和其他烷基膦酸酯(包括3’-亚烷基膦酸酯、5’-亚烷基膦酸酯和手性膦酸酯)、次膦酸酯、氨基磷酸酯(包括3’-氨基氨基磷酸酯和氨基烷基氨基磷酸酯)、硫羰氨基磷酸酯、硫羰烷基膦酸酯、硫羰烷基磷酸三酯、硒磷酸酯(selenophosphates)和硼磷酸酯(boranophosphates)。这些骨架也包括具有相反极性即3’-3’、5’-5’或2’-2’连接键的那些。不包括磷原子的修饰骨架由短链烷基或环烷基核苷间键、混合杂原子和烷基或环烷基核苷间键、或一个或多个短链杂原子或杂环核苷间键形成。这样的骨架包括:具有吗啉代键(部分从核苷的糖部分形成)的那些骨架;硅氧烷骨架;硫化物、亚砜和砜的骨架;富马酰(formacetyl)和硫代富马酰(thioformacetyl)骨架;亚甲基富马酰和硫代富马酰骨架;核糖乙酰(riboacetyl)骨架;含烯烃的骨架;氨基磺酸酯骨架;亚甲基亚氨和亚甲基肼骨架;磺酸酯和磺酰胺骨架;酰胺骨架和具有混合的N、O、S和CH2组成部分的其他骨架。
在另一实施例中,在公开方法中使用的核酸包括一种或多种取代的糖部分。该取代的糖部分在它们的2’位可以包括以下基团之一:OH、F、O-烷基、S-烷基、N-烷基、O-烯基、S-烯基、N-烯基、O-炔基、S-炔基、N-炔基和O-烷基-O-烷基。在这些基团中,烷基、烯基和炔基可以是取代或未取代的C1-C10烷基或C2-C10-烯基和炔基。它们在它们的2’位还可以包括杂环烷基、杂环烷芳基、氨基烷基氨基、多烷基氨基、取代的甲硅烷基、RNA裂解基团、报告基团、嵌入剂、用于改善寡核苷酸药代动力学性质的基团、或用于改善寡核苷酸药效性质的基团。优选的取代的糖部分包括具有2’-甲氧基乙氧基、2’-二甲基氨氧乙氧基和2’-二甲基氨乙氧基乙氧基的那些。参见Martin等人,Helv.Chim.Acta,1995,78,486-504。
在又一实施例中,核酸包括一个或多个修饰的天然核酸碱基(即腺嘌呤、鸟嘌呤、胸腺嘧啶、胞嘧啶和尿嘧啶)。修饰的核酸碱基包括在以下文献中描述的那些:美国专利3,687,808;聚合物科学和工程简明百科,第858-859页,Kroschwitz,J.I.编辑,约翰威利父子公司,1990;Englisch等人,应用化学,国际版,1991,30,613和Sanghvi,Y.S.,第15章,反义研究和应用,第289-302页,CRC出版社,1993。这些核酸碱基中的某些对增加反义寡核苷酸与其靶核酸的结合亲和力是特别有用的。这些包括5-取代嘧啶,6-氮杂嘧啶和N-2、N-6和O-6取代嘌呤(例如,2-氨基丙基腺嘌呤,5-丙炔基尿嘧啶和5-丙炔基胞嘧啶)。参见Sanghvi,等人,eds.,反义研究和应用,CRC出版社,Boca Raton,1993,第276-278页。
可以通过本领域中已知的方法合成任何核酸。参见如,Caruthers等人,1992,酶学方法211,3-19,Wincott等人,1995,核酸研究.23,2677-2684,Wincott等人,1997,分子生物学方法.74,59,Brennan等人,1998,生物技术生物工程,61,33-45和Brennan,美国专利号6,001,311。也可以用标准技术从表达载体转录并分离。
在其他实施方式中,IL-20拮抗剂包括至少一种IL-20或IL-20R抑制性化合物。如本文所用,“IL-20抑制性化合物”或“IL-20R抑制性化合物”是指除抗IL-20或抗IL-20R抗体之外的直接或间接地降低、抑制、中和、或消除IL-20/IL-20R生物活性的化合物。IL-20/IL-20R抑制性化合物应该表现出以下任何一个或多个特征:(a)结合IL-20或IL-20R并抑制它的生物活性和/或IL-20信号转导功能介导的下游通路;(b)预防、改善或治疗炎性疼痛的任何方面;(c)阻断或降低IL-20受体活化;(d)增加IL-20或IL-20R的清除;(e)抑制(减少)IL-20或IL-20R合成、产生或释放。本领域技术人员可以制备其它小分子抑制化合物。
在一些实施方式中,IL-20或IL-20R抑制性化合物是IL-20突变体、IL-19突变体或IL-24突变体,其可以结合IL-20受体但不诱发信号转导。这种突变体可以阻断野生型IL-20结合至IL-20受体,从而阻止IL-20信号转导。
在其他实施方式中,本文描述的IL-20或IL-20R抑制化合物是小分子,其分子量可以为约100至20,000道尔顿、500至15,000道尔顿、或1000至10000道尔顿中任一种。小分子库是市售的。可以使用本领域已知的任何方式施用小分子,包括吸入、腹膜内、静脉内、肌肉内、皮下、鞘内、心室内、口服、肠内、肠胃外、鼻内或经皮。通常,当本发明的IL-20-拮抗剂是小分子时,它将以0.1至300毫克/千克患者体重的比率分为一到三个或更多剂量施用。对于正常体重的成年患者,可以施用每剂1毫克至5克的剂量。
以上提及的小分子可以从化合物库中获得。该库可以是空间可寻址(spatially addressable)的平行固相或溶液相库。参见如,Zuckermann等人.J.Med.Chem.37,2678-2685,1994和Lam Anticancer Drug Des.12:145,1997。合成化合物库的方法是本领域公知的,如,DeWitt等人.PNAS USA90:6909,1993;Erb等人.PNAS USA 91:11422,1994;Zuckermann等人.J.Med.Chem.37:2678,1994;Cho等人.科学261:1303,1993;Carrell等人.Angew Chem.Int.Ed.Engl.33:2059,1994;Carell等人.Angew Chem.Int.Ed.Engl.33:2061,1994和Gallop等人.J.Med.Chem.37:1233,1994。化合物库可存在于溶液中(如,Houghten Biotechniques 13:412-421,1992),或在珠(Lam Nature 354:82-84,1991)、芯片(Fodor Nature 364:555-556,1993)、细菌(美国专利号5,223,409)、孢子(美国专利号5,223,409)、质粒(Cull等.PNAS USA 89:1865-1869,1992),或噬菌体(Scott和Smith科学249:386-390,1990;Devlin科学249:404-406,1990;Cwirla等.PNAS USA 87:6378-6382,1990;Felici,J.Mol.Biol.222:301-310,1991和美国专利号5,223,409)上。
在其他实施方式中,IL-20拮抗剂可以是包含IL-20受体(如IL-20R1、IL-20R2或IL-22R1)的胞外部分的多肽,其中多肽特异性结合于IL-20并阻断它和一个或多个IL-20受体的相互作用。在一些实施方式中,IL-20受体的胞外部分融合到抗体的Fc结构域。PCT WO 01/46232中描述了可溶性受体的实例。
IL-20拮抗剂的鉴定
可以使用本领域已知的方法,通过检测和/或测量IL-20生物活性的降低、改善或中和,来鉴定或表征IL-20拮抗剂。例如,ELISA型试验适合用于通过检测通过IL-20级联活化的蛋白的磷酸化,来定性或定量检测IL-20介导的激酶激活。实例包括JNK、ERK、AKT、p38、STAT3和TRAF6。
也可以通过孵育候选试剂和IL-20或IL-20R并监测以下任何一个或多个特征来鉴定IL-20拮抗剂:(a)结合于IL-20或IL-20R并抑制它的生物活性和/或IL-20信号转导功能介导的下游通路;(b)预防、改善或治疗炎性疼痛的任何方面;(c)阻断或降低IL-20受体的活化;(d)增加IL-20或IL-20R的清除;(e)抑制(减少)IL-20或IL-20R合成、产生或释放。在一些实施方式中,通过孵育候选试剂和IL-20或IL-20R并监测结合以及伴随的IL-20或IL-20R生物活性的下降或中和,来鉴定IL-20拮抗剂。可以采用纯化的IL-20或IL-20R多肽、或用天然表达的或转染并表达的细胞,进行结合试验。在一实施方式中,结合试验是竞争结合试验,其中对候选抗体与已知IL-20拮抗剂竞争结合IL-20或IL-20R的能力进行评估。可以以各种形式,包括ELISA形式进行该测定。在其他实施方式中,通过孵育候选试剂和IL-20或IL-20R(如,IL-20R1),并监测伴随的IL-20R1/IL-20R2复合物形成或IL-20R2/IL-22R1复合物形成的抑制,来鉴定IL-20拮抗剂。在初步鉴定后,可以通过已知测试靶标生物活性的生物试验来进一步确定并完善候选IL-20拮抗剂的活性。或者,可以采用生物试验直接筛选候选物。
以下提供的实施例提供可以用于筛选候选IL-20拮抗剂的一些方法。生物试验包括但不限于:在候选IL-20拮抗剂存在下,用流式细胞术检测IL-20到细胞的竞争结合,以及肾上皮细胞内L-20诱导的细胞凋亡的抑制。此外,RT-PCR或实时PCR可以用于直接检测IL-20表达或检测IL-20上调的基因如TNFα、MCP-1、IL-1β、IL-6和VEGF的表达。
药物组合物
一种或多种上述IL-20拮抗剂可以与药学上可接受的载体(赋形剂)(包括缓冲液)混合,从而形成用于缓解炎性疼痛的药物组合物。“可接受的”是指载体必须与组合物的活性组分相容(优选地,能够稳定活性组分)并对于待治疗的对象无害。包括缓冲液的药学上可接受的赋形剂(载体)是本领域已知的。参见如,Remington:药剂学科学和实践(The Science and Practice of Pharmacy),第20版.(2000)Lippincott Williams和Wilkins,Ed.K.E.Hoover。在一实施例中,本文描述的药物组合物包含一种以上识别靶抗原不同表位的抗IL-20或抗IL-20R抗体。在另一实施例中,药物组合物包括至少两种不同类型的IL-20拮抗剂(如,一抗体和一小分子)。
用于本发明的药物组合物可以包括这些在本领域公知冻干制剂或水性溶液形式中的药学上可接受的载体、赋形剂或稳定剂。(Remington:药剂学科学和实践(The Science and Practice of Pharmacy),第20版.(2000)Lippincott Williams和Wilkins,Ed.K.E.Hoover)。可接受的载体、赋形剂或稳定剂在所使用的剂量和浓度下对接受者是无毒的,可以包含缓冲液,如磷酸盐、柠檬酸盐和其他有机酸;抗氧化剂,包括抗坏血酸和蛋氨酸;防腐剂(如十八烷基二甲苄基氯化铵;氯化六甲双铵(hexamethonium chloride);苯扎氯铵;苄索氯铵;苯酚,丁基或苄基醇;对羟基苯甲酸烷基酯,如对羟基苯甲酸甲酯或对羟基苯甲酸丙酯;儿茶酚;间苯二酚;环己醇;3-戊醇,和间甲酚);低分子量(少于约10个残基)多肽;蛋白,如血清白蛋白、明胶或免疫球蛋白;亲水性聚合物如聚乙烯吡咯烷酮;氨基酸,如甘氨酸、谷氨酰胺、天冬酰胺、组氨酸、精氨酸、或赖氨酸;单糖,二糖和其它碳水化合物,包括葡萄糖,甘露糖或右旋糖酐;螯合剂,如EDTA;糖,如蔗糖,甘露醇,海藻糖或山梨醇;成盐抗衡离子,如钠;金属配合物(如Zn-蛋白复合物);和/或非离子表面活性剂如TWEENTM,PLURONICSTM或聚乙二醇(PEG)。本文进一步描述药学上可接受的赋形剂。
在一些实施例中,本文描述的药物组合物包括:包含IL-20拮抗剂(如抗体)的脂质体,可以通过本领域已知的如Epstein,等人,Proc.Natl.Acad.Sci.USA 82:3688(1985);Hwang,等人,Proc.Natl.Acad.Sci.USA 77:4030(1980)和美国专利号4,485,045和4,544,545中描述的方法制备。具有增强的循环时间的脂质体,在美国专利号5,013,556中被公开。可以通过反相蒸发法,采用包括磷脂酰胆碱、胆固醇和PEG衍生化磷脂酰乙醇胺(PEG-PE)的脂质组合物,来生成特别有用的脂质体。通过特定孔径的滤器挤出脂质体,从而获得具有所需直径的脂质体。
活性组分(如,IL-20拮抗剂,例如本文描述的抗IL-20抗体或抗IL-20R抗体)也可以包封在微囊(例如,通过凝聚技术或通过界面聚合制备的微囊,分别例如羟甲基纤维素或明胶微囊和聚(甲基丙烯酸甲酯)微囊)中、胶体药物递送系统(例如脂质体、白蛋白微球、微乳剂、纳米颗粒和纳米胶囊)中或微乳液中。这些技术是本领域已知的,参见如,Remington,药剂学科学和实践(The Science and Practice of Pharmacy),第20版,麦克出版社(Mack Publishing)(2000)。
在其他实施例中,本文描述的药物组合物可以配制成持续释放形式。合适的持续释放制剂包括:包含抗体的固态疏水性聚合物的半透性基质,其中基质是定型产品形式,例如,薄膜或微囊。持续释放基质的实例包括聚酯,水凝胶(例如,聚(2-羟乙基-甲基丙烯酸酯)或聚(乙烯醇)),聚交酯(美国专利号3,773,919),L-谷氨酸和7-乙基-L-谷氨酸酯的共聚物,不可降解的乙烯-乙酸乙烯酯,可降解的乳酸-乙醇酸共聚物,如LUPRON DEPOTTM(由乳酸-乙醇酸共聚物和醋酸亮丙瑞林组成的可注射微球),乙酸异丁酸蔗糖酯和聚-D-(-)-3-羟基丁酸。
要用于体内施用的药物组合物必须是无菌的。这可容易地通过例如无菌过滤膜过滤完成。治疗性抗体组合物通常置于具有无菌存取口的容器中,例如,静脉内溶液袋或具有皮下注射针头可刺穿的塞子的小瓶。
本文描述的药物组合物可以是单位剂型,如片剂、丸剂、胶囊、粉剂、颗粒剂、溶液或悬浮液、或栓剂,用于口服,肠胃外或直肠给药,或通过吸入或吹入施用。
为了制备固体组合物如片剂,主要的活性组分可以与药物载体混合,所述药物载体如常规的片剂成分,如玉米淀粉、乳糖、蔗糖、山梨醇、滑石、硬脂酸、硬脂酸镁、磷酸二钙或树胶(gums)、和其它药物稀释剂,例如水,以形成含有本发明化合物或其无毒的药学上可接受的盐的均匀混合物的固体预制剂组合物。当提及这些预制剂组合物为均匀时,是指活性组分在整个组合物中均匀分散,使得组合物可以容易地再分成等效的单位剂型,如片剂、丸剂和胶囊剂。然后将这种固体预制剂组合物再分成含有0.1至500毫克本发明活性组分的上述类型的单位剂型。新型组合物的片剂或丸剂可以被包衣或者另外复合以提供具有延长作用优点的剂型。例如,片剂或丸剂可以包括内剂量和外剂量组分,后者是包裹前者的形式。两组分可以通过肠溶层分开,肠溶层用于抵抗胃内崩解并使内组分完整进入十二指肠或被延迟释放。多种材料可用于这样的肠溶层或包衣,此类材料包括许多聚合酸和聚合酸与诸如虫胶、鲸蜡醇和醋酸纤维素等材料的混合物。
合适的表面活性剂包括,特别是,非离子表面活性剂,如聚乙二醇山梨聚糖(例如TweenTM.20、40、60、80或85)和其它山梨聚糖(例如SpanTM.20、40、60、80或85)。具有表面活性剂的组合物可常规地包括0.05-5%的表面活性剂,可以为0.1-2.5%。应理解,可以加入其它成分,例如甘露醇或其它药学上可接受的载体,如果需要的话。
合适的乳液可使用市售的脂肪乳剂,例如IntralipidTM、LiposynTM、InfonutrolTM、LipofundinTM和LipiphysanTM来制备。活性组分可以或者溶解在预混合乳液组合物中,或者也可以溶解在油(如大豆油,红花油,棉籽油,芝麻油,玉米油或杏仁油)以及与磷脂(如卵磷脂,大豆磷脂或大豆卵磷脂)和水混合就可形成的乳液中。应理解,可以加入其它成分,例如甘油或葡萄糖,以调整该乳液的张力。合适的乳液通常含有至多20%的油,例如,5至20%。脂肪乳剂可包含0.1-1.0.im,特别是0.1-0.5.im的脂肪滴,pH为5.5-8.0的范围。
乳液组合物可以是通过将IL-20拮抗剂与IntralipidTM或其成分(大豆油、卵磷脂、甘油和水)混合而制备的那些。
用于吸入或吹入的药物组合物,包括在药学上可接受的水性或有机溶剂或它们的混合溶剂中的溶液和悬浮液,以及粉剂。液体或固体组合物可含有合适的上述药学上可接受的赋形剂。在一些实施方式中,通过口服或鼻吸途径施用组合物以达到局部或全身效果。
在优选无菌的药学上可接受的溶剂中的组合物,可以通过使用气体来雾化。雾化的溶液可以直接从雾化设备吸入,或雾化设备可以接到面罩、帐幕或间歇正压呼吸机。可以从以适当的方式递送制剂的设备施用溶液、悬浮液或粉末组合物,优选口服或经鼻。
IL-20拮抗剂用于治疗炎性疼痛
为了实施本文公开的方法,将有效量的上述药物组合物通过合适的途径施用于需要治疗的对象(如人),如静脉内给药,如作为大药丸,或通过连续输注一段时间,通过肌内,腹膜内,脑脊髓内,皮下,关节内,滑膜内,鞘内,口服,吸入或局部途径。市售的液体制剂喷雾器,包括喷射喷雾器和超声喷雾器对于给药是有用的。液体制剂可以直接雾化,冻干粉可重构后进行雾化。或者,可以使用氟碳制剂和计量剂量吸入器来气雾化IL-20拮抗剂,或作为冻干和研磨的粉末吸入。
待用本发明方法治疗的对象可以是哺乳动物,更优选是人。哺乳动物包括,但不限于:农场动物,运动动物,宠物,灵长类动物,马,狗,猫,小鼠和大鼠。需要治疗的人类对象是患有疼痛的人。疼痛是与实际或潜在的组织损伤相关的不愉快的感觉和情绪体验。它是许多疾病的主要症状,可以显著影响一个人的生活质量。疼痛包括急性或伤害性疼痛和慢性疼痛,急性或伤害性疼痛是通过物理伤害对周围神经纤维的刺激引起的;慢性疼痛包括炎症性疼痛、神经性疼痛、和病理性疼痛。
在一些实施例中,如本文所述的任何方法的治疗对象是患有炎性疼痛(也被称为炎性伤害性疼痛)的病人。炎性疼痛与免疫细胞浸润引起的组织损伤有关。炎性疼痛包括,但不限于:急性炎症或慢性炎症引起的神经疾病疼痛,急性炎症或慢性炎症引起的缺血性疼痛,与关节炎相关的炎性疼痛,急性炎症或慢性炎症引起的肌肉疼痛,急性炎症、慢性炎症或化疗引起的神经痛。
在其它实施例中,如本文所述的任何方法的治疗对象是患有神经性疼痛的病人,所述神经性疼痛是由神经系统(包括外周和中枢神经系统)中神经元的损伤引起的。在某些情况下,神经性疼痛也可以由慢性或急性炎症引起。或者,所述对象也可以患有病理性疼痛,这是一种由神经系统损伤或功能异常如功能失调所导致的疾病状态,例如纤维肌痛、肠易激综合症、紧张型头痛、与神经病相关的疼痛等。
如本文所用,“有效量”是指赋予对象治疗效果所需的各活性剂的量,所述各活性剂或者单独使用或者与一种或多种其它活性剂组合使用。如本领域技术人员所熟知的,根据治疗的具体病况,病况的严重程度,个体患者参数包括年龄、身体状况、身高、性别和体重,治疗的持续时间,并行治疗的性质(如果有的话),给药的具体途径和保健医生知识和经验范围内的类似因素,有效量可以改变。这些因素对本领域一般技术人员来说是公知的,可以用不超过常规的实验来解决。通常优选的是使用最大剂量的各组分或它们的组合,也就是基于合理医学判断的最高安全剂量。但本领域一般技术人员将会理解,出于医学原因、心理原因或实际上任何其他原因,患者可能坚持要求较低剂量或可耐受的剂量。
经验的考虑,如半衰期,通常将有助于剂量的确定。例如,与人免疫系统相容的抗体,如人源化抗体或完全人抗体,可以用于延长抗体的半衰期并防止抗体被人免疫系统攻击。可以确定给药频率并在治疗期间,通常但不必须,根据炎性疼痛的治疗和/或抑制和/或改善和/或延迟进行调整。或者,IL-20拮抗剂的持续释放制剂可能是合适的。实现持续释放的各种制剂和装置是本领域已知的。
在一实施例中,对于已经给予一次或多次的IL-20拮抗剂施用的个体,可以经验性地确定本文描述的IL-20拮抗剂的剂量。可给予个体递增剂量的拮抗剂。为评价拮抗剂的效力,可以关注炎性疼痛的指标(如痛觉超敏)。
通常,为施用本文描述的任何抗体,初始候选剂量可以是约2mg/kg。出于本公开内容的目的,典型的日剂量可以是从约0.1μg/kg至3μg/kg至30μg/kg至300μg/kg至3mg/kg至30mg/kg至100mg/kg或更高的范围,取决于上文提及的因素。对于在几天或更长时间中的反复给药,取决于病情,治疗是持续的直到出现所需的症状被抑制或直到获得足够的治疗水平从而减轻炎性疼痛,或其症状。典型的剂量方案包括:施用初始剂量为约2mg/kg,随后每周抗体维持剂量为约1mg/kg,或随后每隔一周抗体维持剂量为约1mg/kg。但是,其他剂量方案可以是有用的,取决于医生希望获得的药代动力学衰减模式。例如,计划一周1-4次的剂量。在一些实施方式中,可以使用约3μg/mg-约2mg/kg(如约3μg/mg、约10μg/mg、约30μg/mg、约100μg/mg、约300μg/mg、约1mg/kg和约2mg/kg)的剂量范围。在一些实施方式中,给药剂量频率是每天、每周、每2周、每4周、每8周、每2月或每3月或更长时间一次。通过常规技术和分析,容易监测该治疗进程。剂量方案(包括使用的抗体)可以随时间改变。
当IL-20拮抗剂不是抗体时,可以以约0.1-300mg/kg患者体重的比率分为1-3个剂量施用,或如本文所公开的。在一些实施方式中,对于正常体重的成年患者,可以施用的剂量范围为约0.3-5.00mg/kg。特定的剂量方案,即剂量、时间设置和重复,将取决于特定的个体、个体的医疗史以及个别药剂的性质(如药剂的半衰期和本领域已知的其他考虑因素)。
出于本公开的目的,IL-20拮抗剂的适当剂量将取决于采用的具体IL-20拮抗剂(或其组合物)、炎性疼痛的类型和严重程度、施用拮抗剂是否用于预防或治疗目的、先前的疗法、患者的临床史和对拮抗剂的响应、以及主治医师的判断。通常临床医师会施用IL-20拮抗剂,例如抗IL-20或抗IL-20R抗体,直至达到实现期望结果的剂量。IL-20拮抗剂的施用可以是连续的或间歇性的,这取决于,例如,接受者的生理条件,施用目的是治疗性还是预防性,和本领域技术从业者所知的其他因素。IL-20拮抗剂(例如如果IL-20拮抗剂是抗IL-20抗体)的施用,可以是在一段预选的时间中基本上连续或可以是一系列间隔剂量,如,在发生炎性疼痛之前、期间或之后。
如本文所用,术语“治疗”是指将包括一种或多种活性剂的组合物应用或施用于对象,其中所述对象患有炎性疼痛、有炎性疼痛症状或易感该疾病,从而治病、治愈、缓解、减轻、改变、矫正、缓解、改善或影响炎性疼痛、炎性疼痛的症状或对炎性疼痛的易感性。
在一些实施方式中,本文描述的IL-20拮抗剂(如,抗IL-20抗体或抗IL-20R抗体,如抗IL-20R1抗体),以足以缓解疼痛的量被施用于需要治疗的对象。
医学领域一般技术人员所知的常规方法,根据要治疗的疾病/病情类型或疾病/病情的部位,可用于将药物组合物给予对象。该组合物也可以通过其他常规途径给药,如通过口服、肠胃外给药、通过吸入喷雾、局部、直肠、经鼻、颊、阴道或通过植入的容器给药。术语“肠胃外”用于本文包括皮下、皮内、静脉内、肌内、关节内、动脉内、滑膜内、胸骨内、鞘内、病灶内和颅内注射或输注技术。此外,它可以通过可注射的储器(depot)途径来给予对象,例如使用1、3或6个月的可注射或可生物降解的材料和方法。
可注射组合物可包含各种载体,如植物油、二甲基乙酰胺、二甲基甲酰胺、乳酸乙酯、碳酸乙酯、肉豆蔻酸异丙酯、乙醇和多元醇(甘油、丙二醇,液态聚乙二醇等)。对于静脉内注射,水溶性抗体可以通过滴注方法给药,由此输注含有抗体和生理学上可接受的赋形剂的药物制剂。生理学上可接受的赋形剂可包括,例如,5%葡萄糖、0.9%生理盐水、林格氏溶液或其他合适的赋形剂。肌内制剂,例如,抗体的合适的可溶盐形式的无菌制剂,可以溶解在药用赋形剂如注射用水、0.9%生理盐水、或5%葡萄糖溶液中,并进行给药。
在一实施方式中,IL-20拮抗剂通过位点特异性或靶向局部递送技术进行给药。位点特异性或靶向局部递送技术的实例包括:IL-20拮抗剂的各种可植入的储器源(depot sources)或局部输送导管、如输液导管、留置导管、或针导管、合成移植物、外膜包裹、分流器和支架或其他可植入装置、位点特异性载体、直接注射、或直接应用。参见如,PCT公开号WO 00/53211和美国专利号5,981,568。
也可以使用包含反义多核苷酸、表达载体、或亚基因组多核苷酸的治疗组合物的靶向递送。受体介导的DNA递送技术在例如以下文献中有描述:Findeis等人,Trends Biotechnol.(1993)11:202;Chiou等人,“基因疗法:直接基因转移的方法的应用(Gene Therapeutics:Methods And Applications Of Direct Gene Transfer)”(J.A.Wolff,编辑)(1994);Wu等人,J.Biol.Chem.(1988)263:621;Wu等,J.Biol.Chem.(1994)269:542;Zenke等人,Proc.Natl.Acad.Sci.USA(1990)87:3655;Wu等人,J.Biol.Chem.(1991)266:338。包含多核苷酸的治疗组合物在基因治疗方案中以约100ng到约200mgDNA的量用于局部给药。在一些实施方式中,在基因治疗方案期间,也可以使用约500ng-约50mg、约1μg-约2mg,约5μg-约500μg和约20μg-约100μgDNA或更高的浓度范围。
可以使用基因递送载体递送本文描述的治疗性多核苷酸和多肽。基因递送载体可以是病毒或非病毒来源的(通常参见Jolly,癌症基因治疗(1994)1:51;Kimura,人基因治疗(1994)5:845;Connelly,人基因治疗(1995)1:185和Kaplitt,自然遗传学(1994)6:148)。可以使用内源哺乳动物或异源启动子和/或增强子诱导这样的编码序列的表达。编码序列的表达可以是组成型或调控型。
用于递送所需多核苷酸并在所需细胞内表达的病毒基载体是本领域已知的。示例性的病毒基载体包括但不限于:重组逆转录病毒(参见如,PCT公开号WO 90/07936、WO 94/03622、WO 93/25698、WO 93/25234、WO 93/11230、WO 93/10218、WO 91/02805、U.S专利号5,219,740和4,777,127、GB专利号2,200,651和EP专利号0345242),甲病毒基载体(如,辛德毕斯(Sindbis)病毒载体,塞姆利基(Semliki)森林病毒(ATCC VR-67,ATCC VR-1247),罗斯河(Ross River)病毒(ATCC VR-373,ATCC VR-1246)和委内瑞拉马脑炎病毒(ATCC VR-923,ATCC VR-1250,ATCC VR 1249,ATCC VR-532))和腺相关病毒(AAV)载体(参见如,PCT公开号WO 94/12649,WO 93/03769,WO 93/19191,WO 94/28938,WO 95/11984和WO 95/00655)。也可以使用如Curiel,Hum.Gene Ther.(1992)3:147中描述的连接到灭活腺病毒的DNA进行给药。
也可以使用非病毒递送载体和方法,包括但不限于:连接或未连接到单独的灭活腺病毒的聚阳离子缩合DNA(参见如,Curiel,Hum.Gene Ther.(1992)3:147),配体连接的DNA(参见如,Wu,J.Biol.Chem.(1989)264:16985),真核细胞递送载体细胞(参见如,美国专利号5,814,482,PCT公开号WO 95/07994,WO 96/17072,WO 95/30763和WO 97/42338)和核电荷中和或与细胞膜融合。也可以采用裸DNA。典型的裸DNA导入方法在PCT公开号WO 90/11092和美国专利号5,580,859中有描述。可以作为基因递送载体的脂质体在美国专利号5,422,120,PCT公开号WO 95/13796,WO 94/23697,WO 91/14445和EP专利号0524968中有描述。其他方法在Philip,Mol.Cell.Biol.(1994)14:2411和Woffendin,Proc.Natl.Acad.Sci.(1994)91:1581中有描述。
显然,表达载体可用于指导本文描述的任何蛋白类的IL-20拮抗剂(如,抗IL-20抗体或抗IL-20R抗体)的表达。例如,能阻断(从部分到完全阻断)IL-20和/或IL-20生物活性的其他IL-20受体片段是本领域已知的。
本文描述方法中使用的具体的给药方案,即剂量、时间设置和重复,将取决于具体的对象和对象的医疗史。
在一些实施方式中,多于一种IL-20拮抗剂,如抗体和小分子IL-20抑制化合物,可以给予需要治疗的对象。拮抗剂可以是相同类型或彼此不同。至少一、至少二、至少三、至少四、至少五种不同的IL-20拮抗剂可以共同给药。通常,这些IL-20拮抗剂具有不会产生不利相互影响的互补活性。IL-20拮抗剂也可以与用于增强和/或补足药剂有效性的其他药剂联用。
在一些实施方式中,IL-20拮抗剂例如抗IL-20抗体或抗IL20R1抗体,可以与治疗剂(例如化疗剂)联用,以缓解由治疗剂引起的疼痛(如化疗引起的外周神经病变)。有效量的所述IL-20拮抗剂和有效量的治疗剂可共同给予需要所述治疗的人类癌症患者。可能引起外周神经病的化疗剂包括,但不限于:铂药物如顺铂、卡铂和奥沙利铂;紫杉烷类,包括紫杉醇,多西紫杉醇,和卡巴他赛;埃坡霉素,如伊沙匹隆;植物生物碱,如长春碱,长春新碱,长春瑞滨,和依托泊苷(VP-16);沙利度胺,来那度胺和泊马度胺;硼替佐米和卡非佐米;和艾日布林(Eribulin)。因此,本文所述的任一IL-20拮抗剂(例如抗IL-20抗体或抗IL20-R1抗体)可以与那些化疗剂联用,以缓解由其引起的外周神经病。
“共同施用”或“联合给药”是指以在时间上相关联的方式,将两种或多种药施用于受试者/治疗对象,联合给药可以通过在相同的剂型中提供两种或多种药物,从而进行合用。或者,联合用药包含以不同的剂型服用两种或多种药物,但是在指定的周期内,例如在1周内,1天内,或在1小时内。在一些实施方式中,IL-20拮抗剂可以被施用到人类癌症患者,在其被观察到发展中的由化疗剂引起的神经病之后。
可以通过本领域公知的方法评价治疗功效,如监控治疗中的患者所经历的疼痛水平,和/或治疗中的患者体内的炎性细胞因子水平。
用于缓解疼痛的试剂盒
本发明还提供用于缓解疼痛例如炎性疼痛的试剂盒。该试剂盒可以包括包含IL-20拮抗剂(如抗体,如mAb7E或其功能性变体,mAb7GW或其功能性变体,或mAb51D或其功能性变体)的一个或多个容器。在一些实施方式中,IL-20拮抗剂是本文描述的能干扰IL-20信号转导通路的任何抗体。在其他实施方式中,试剂盒包含IL-20拮抗剂,所述拮抗剂是除了刚刚提到的抗体之外的拮抗剂。
在一些实施方式中,试剂盒可以包括用于根据本文描述的任何方法的说明书。所包括的说明书可包括:对根据本文所述任何方法给予IL-20拮抗剂以治疗、延迟发作或缓解疼痛的描述。试剂盒还可包括基于鉴别个体是否患有疼痛例如炎性疼痛来选择适合治疗的个体的描述。
关于IL-20拮抗剂应用的说明书通常包括信息,如用于所需治疗的剂量、给药时间安排和给药途径。容器可以是单位剂量,大包装(bulk package)(如,多剂量包装)或亚单位剂量。本发明试剂盒内提供的说明书通常是写在标签或包装插页(如试剂盒内包含的纸页)上的说明,但机器可读的说明(例如,载入磁或光存储盘上的说明)也是可以接受的。
标签或包装插页表明,该组合物用于治疗、延迟发作和/或缓解炎性疼痛。可以为实施本文所述任何方法提供说明书。
本发明的试剂盒在合适的包装中。合适的包装包括但不限于:小瓶,瓶,广口瓶,软包装(例如密封的聚脂薄膜或塑料袋)和类似包装。还包括在本发明内的是将包装与特定设备组合使用,例如吸入器,经鼻给药装置(例如,雾化器)或输液设备,诸如微型泵。试剂盒可以具有无菌存取口(例如所述容器可以是静脉内溶液袋或具有皮下注射针可刺穿的塞子的小瓶)。容器也可以具有无菌存取口(例如所述容器可以是静脉内溶液袋或具有皮下注射针可刺穿的塞子的小瓶)。组合物中至少一种活性试剂是IL-20拮抗剂,例如抗IL-20抗体。
试剂盒可任选地提供额外的组分,例如缓冲液和解释性信息。通常,试剂盒包括容器和在容器上或与容器相连的标签或包装插页。在一些实施方式中,本发明提供包括上述试剂盒内容的制品。
无需进一步详尽说明,据信本领域技术人员可根据上面的描述,利用本发明至其最大限度。因此,以下具体实施方式应解释为仅仅是说明性的,并不以任何方式限制本公开内容的其余部分。本文引用的所有出版物为提及的目的或内容而通过引用并入本文。
实施例1:在CFA诱导的炎性疼痛小鼠模型上用抗IL-20抗体抑制炎性疼痛
该研究中,使用IRC小鼠(7-10周龄)。在这些小鼠中,炎性疼痛是通过左爪注射10μl完全弗氏佐剂(CFA)诱导产生。机械异常性疼痛采用冯·弗雷微丝进行测试。用一系列冯弗雷微丝之一,以垂直于足底表面方式按压爪子,所述一系列冯弗雷微丝具有呈对数递增(0.02-2.56g;立体定位仪(Stoelting))的刚度。每个微丝在老鼠上按压1秒。50%撤回(回缩)阈值,是由迪克森的上下法进行确定。
抗IL-20抗体mAb7E(10微克)或对照IgG抗体(10微克),通过鞘内(IT)或爪(PL)注射至用CFA处理的小鼠。如图1所示,mAb7E能够,但IgG对照不能够,显著增加CFA处理小鼠的爪的撤回阈值,这表明CFA诱导的机械异常性疼痛被抗IL-20抗体mAb7E显著抑制。另外,如图2所示,通过鞘内注射的抗IL-20抗体mAb7E(从12微克到24微克),观察到了剂量依赖性效应。
总之,从本研究获得的结果证明了抗IL-20抗体的镇痛效果,这表明IL-20信号传导通路的抑制可有效缓解疼痛,如炎性疼痛。
实施例2:在化疗诱导的神经病小鼠模型中抗IL-20抗体的神经保护作用
在该研究中使用C57BL/6小鼠(6周龄,14-15克)。研究方案在图3中示意性地概述。化学疗法引起的神经病变是由给予四次紫杉醇注射(4.5mg/kg)(隔日给药)引起的。为了测试体内抗IL-20抗体(IL-20抗体)的神经保护效果,在每次注射紫杉醇6h之前,通过腹腔内注射抗IL-20抗体(mAb7E;5mg/kg)。在注射紫杉醇或载体前,进行每种神经测试的基线测量,并且在治疗后一个月内的每个星期,记录4次额外的测试。机械异常性疼痛通过电子式的冯弗雷(von Frey)毛进行评估(ALMEMO,德国)。小鼠置于具有丝网平台的单个有机玻璃容器,每次测试之前要求驯化30分钟。钝端的冯弗雷长丝被用于向上压到后爪的表面中间足底5秒钟或直到发生撤回(回缩)反应,对左和右后爪分别四次记录最大压力响应。撤回力是一只老鼠的每次的平均值,并且代表为每次处理中后爪的机械阈值。尾热超敏是由尾浸泡法测定。手持每一只老鼠,将大约1cm尾巴尖浸泡在维持48度的水浴,为鼠撤回它的尾巴的等待时间进行评分(截止的响应是10秒)。
在完成四次注射后,紫杉醇处理的小鼠表现出机械阈值的急剧下降,即发展为异常性疼痛(图4)。研究发现,这种紫杉醇诱导的机械性痛觉超敏的过敏症,可以通过抗IL-20抗体预处理得到缓解(图4)。第4周得到的数据分析表明,抗IL-20抗体处理对缓解异常性疼痛(图5)有显著效果。
关于尾部浸渍试验,一段时间之后,由于学习效应,小鼠对热刺激变得更加敏感。然而,相比于对照组,紫杉醇处理的小鼠表现出增加的热响应等待时间,这表明紫杉醇处理诱导了热阈值的增加(图6)。用抗IL-20抗体预处理小鼠表现出与对照组类似的热响应,这说明抗IL-20抗体拯救了紫杉醇所引起的热不敏感性(图6)。对第四个星期获得的数据的分析也支持这一观点(图7)。
总之,从本研究获得的结果表明,抗IL-20抗体针对由化疗剂如紫杉醇引起的神经病是具有保护作用的。
其他实施方式
本说明书中披露的全部特征可以任何组合方式进行组合。在本说明书中公开的每个特征可由起到相同、等同或类似目的的替代特征所代替。因此,除非另外明确说明,否则公开的每个特征仅是一般系列的等同或类似特征的一个例子。
本领域技术人员从以上描述中容易确定本发明的基本特征,并在不脱离本发明精神和范围的情况下可以对本发明作出各种变化和修改以使其适应各种用途和条件。因此其他实施方式也可在权利要求范围内。
- 还没有人留言评论。精彩留言会获得点赞!