生物素变体、链霉亲和素突变体以及它们的应用的制作方法
本发明涉及由生物素变体的二聚体构成的化合物、链霉亲和素突变体、以及它们的应用。
背景技术:
抗生物素蛋白与生物素、或者链霉亲和素与生物素之间的亲和性非常高(Kd=10-15~10-14M),作为生物体的双分子间的相互作用,是最强的相互作用之一。目前,抗生物素蛋白/链霉亲和素-生物素相互作用在生物化学、分子生物学或医学领域广泛应用(Green, (1975), Adv. Protein Chem., 29: 85-133; Green, (1990), Methods Enzymol., 184: 51-67)。抗生物素蛋白是来自蛋清的碱性糖蛋白,其等电点超过10。另一方面,链霉亲和素来自放线菌(Streptomyces avidinii),其等电点在中性附近,不含糖链。两种蛋白均形成四聚体,每一个亚单位与一分子的生物素结合。分子量为60kDa左右。
近年来,考察了将该抗生物素蛋白/链霉亲和素与生物素的高结合能力和抗体分子组合的药物递送方法、预靶向法(Hnatowich, (1987), J. Nucl. Med., 28, 1294-1302)。然而,由于来自鸡的抗生物素蛋白或来自微生物的链霉亲和素对人体显示出高免疫原性,因此在对人体给药后早期会产生抗抗生物素蛋白/链霉亲和素抗体,这已成为问题,并成为妨碍预靶向法实用化的原因之一(Paganelli, (1991), Cancer Res., 51, 5960-5966)。有人报道了用于解决上述问题的低免疫原性链霉亲和素(国际公开WO2010/095455)。
并且,还报道了使用双生物素(两分子的生物素经接头连接而成的化合物)和链霉亲和素突变体的预靶向法(Park等人, Clin Cancer Res; 17(23); 7373-82, 2011)。在该方法中提倡通过使用具有S45A或Y43A的氨基酸突变的链霉亲和素突变体来解决内源性生物素的问题。即,具有S45A或Y43A的链霉亲和素突变体与生物素的结合虽然较野生型链霉亲和素差,但通过成对化,链霉亲和素突变体与双生物素牢固地结合。
现有技术文献
专利文献
专利文献1:国际公开WO2010/095455;
非专利文献
非专利文献1:Green, (1975), Adv. Protein Chem., 29: 85-133;
非专利文献2:Green, (1990), Methods Enzymol., 184: 51-67;
非专利文献3:Hnatowich, (1987), J. Nucl. Med., 28, 1294-1302;
非专利文献4:Paganelli, (1991), Cancer Res., 51, 5960-5966);
非专利文献5:Park等人, Clin Cancer Res; 17(23); 7373-82, 2011。
技术实现要素:
发明所要解决的课题
如上所述的低免疫原性链霉亲和素虽然具有对人体的免疫原性降低的特征,但因其对人体内源性生物素具有亲和性,所以担心在诊断用途中会存在本底(background)变高的问题、或者在治疗用途中也有可能无法对疾病特异性地发挥药效。因此,本发明应该解决的问题在于:提供对天然生物素的亲和性有所降低的链霉亲和素突变体;以及提供对与该天然生物素的亲和性低的链霉亲和素突变体具有高亲和性的生物素变体。本发明应该解决的课题还在于:提供使用了上述链霉亲和素突变体与生物素变体的组合的诊断药、治疗药;以及使用了上述链霉亲和素突变体与生物素变体的组合的诊断试剂盒、治疗试剂盒。
用于解决课题的手段
本发明人为了解决上述课题进行了深入研究,通过向国际公开WO2010/095455所记载的低免疫原性链霉亲和素突变体中进一步导入规定的氨基酸突变,成功获得了对天然生物素的亲和性有所降低的链霉亲和素突变体。同时合成了生物素的一部分结构有所改变的生物素变体的二聚体化合物。随后研究了上述链霉亲和素突变体与上述生物素变体的二聚体化合物的亲和性,结果发现了彼此具有亲和性的组合,从而完成了本发明。
即,根据本发明,提供以下的发明。
[1] 下述式(1)所示的化合物。
[化学式1]
(1)
(式中,X1a、X1b、X2a和X2b分别独立表示O或NH,Y1和Y2分别独立表示C或S,Z1和Z2分别独立表示O、S或NH,V1和V2分别独立表示S或S+-O-,n1和n2分别独立表示0或1的整数,m1和m2分别独立表示1~10的整数,L表示连接基。)
[2] [1]所述的化合物,该化合物如下述式(2)所示,其中,n1和n2为0。
[化学式2]
(2)
(式中,X1a、X1b、X2a、X2b、Y1、Y2、Z1、Z2、V1、V2、m1、m2和L与[1]同义)
[3] [1]或[2]所述的化合物,其中,L为-CONH-、-NHCO-、-O-、碳原子数1~10的亚烷基、可具有取代基的亚苯基、或它们的组合。
[4] [1]~[3]中任一项所述的化合物,其中,L为-CONH-(CH2)p-CONH-(CH2)q-O-(CH2)r-NHCO-(CH2)s-NH-CO-、-CONH-(CH2)p-CONH-(CH2)q-NHCO-(CH2)s-NH-CO-、-CONH-(CH2)p- CONH-(可具有取代基的亚苯基)-NHCO-(CH2)s-NH-CO-、-CONH-CH(COOCH3)-(CH2)p-NHCO-(可具有取代基的亚苯基)-CONH-(CH2)s-CH(COOCH3)-NH-CO-、或-CONH-(CH2)p-O-(CH2)t- NHCO-(可具有取代基的亚苯基)-CONH-(CH2)s-O-(CH2)u-NH-CO-(式中,p、q、r、s、t和u分别独立表示1~10的整数)。
[5] 下述的任一种化合物。
[化学式3]
[6] 化合物,该化合物是在[1]~[5]中任一项所述的化合物上结合有螯合基的化合物,所述螯合基捕捉放射性同位素。
[7] 化合物,该化合物是在[1]~[5]中任一项所述的化合物上结合有荧光化合物或药物化合物的化合物。
[8] 下述的任一种化合物。
[化学式4]
[9] 链霉亲和素突变体,其由在SEQ ID NO: 3所记载的氨基酸序列中第37位氨基酸残基即Asn被取代成了其他氨基酸残基的氨基酸序列构成。
[10] 链霉亲和素突变体,其包含SEQ ID NO: 4所记载的氨基酸序列。
[11] DNA,其编码[9]或[10]所述的链霉亲和素突变体。
[12] 链霉亲和素突变体-分子探针结合物,其是通过使分子探针与[9]或[10]所述的链霉亲和素突变体结合而得到的。
[13] [12]所述的链霉亲和素突变体-分子探针结合物,其中,分子探针为抗人CD20抗体。
[14] [12]所述的链霉亲和素突变体-分子探针结合物,其中,分子探针为利妥昔单抗(Rituximab)。
[15] [12]所述的链霉亲和素突变体-分子探针结合物,其中,分子探针为抗上皮调节蛋白(epiregulin)单链抗体。
[16] 治疗药或者体内或体外诊断药,其包含[12]~[15]中任一项所述的链霉亲和素突变体-分子探针结合物。
[17] 治疗或者体内或体外诊断试剂盒,其包含:(a) [12]~[15]中任一项所述的链霉亲和素突变体-分子探针结合物;以及(b) 用[1]~[5]中任一项所述的化合物标记的体内或体外诊断用或者治疗用物质。
发明效果
根据本发明,提供链霉亲和素突变体与对上述链霉亲和素突变体具有高亲和性的生物素变体的二聚体化合物的组合,所述链霉亲和素突变体在免疫原性降低的同时对天然生物素的亲和性也有所降低。本发明的链霉亲和素突变体与生物素变体二聚体化合物的组合在基于预靶向法的诊断方法、治疗方法中有效。
附图说明
图1显示晶体结构分析的结果。
图2显示晶体结构分析的结果。
图3显示稀释法的解链效率的测定结果。
图4显示由V2122与各化合物的ITC产生的相互作用。
图5显示使用了食蟹猴的免疫原性试验的结果。
图6显示晶体结构分析的结果。图6的第3幅图显示V2122与化合物C的复合体的晶体结构。
图7显示晶体结构分析的结果。
图8显示利用流式细胞仪进行的RAMOS细胞上CD20的识别分析的结果。
图9显示与野生型链霉亲和素突变体Y43A和S45A的性能比较。
图10显示与野生型链霉亲和素突变体Y43A和S45A的性能比较。
图11显示所表达的抗上皮调节蛋白scFv经凝胶过滤纯化后进行SDS-PAGE的结果。
图12显示抗上皮调节蛋白scFv与上皮调节蛋白的复合体的结构分析结果。
图13显示抗上皮调节蛋白scFv-V2122蛋白的纯化结果。
图14显示通过SPR (Biacore T200)确认抗上皮调节蛋白scFv-V2122-FITC的抗原结合性的结果。
图15显示使用了抗上皮调节蛋白scFv-V2122-FITC的细胞染色和内源化分析的结果。
图16显示使用了抗上皮调节蛋白scFv-V2122-FITC的FACS分析的结果。
图17显示利妥昔单抗-scFv-V2122蛋白经蛋白L柱纯化的结果。
图18显示使用了利妥昔单抗-scFv-V2122的流式细胞仪的结果。
图19显示使用了利妥昔单抗-scFv-V2122的生物体内成像的结果。
图20显示抗上皮调节蛋白scFv-V2122经蛋白L柱纯化的结果。
图21显示使用了抗上皮调节蛋白scFv-V2122的生物体内成像的结果。
具体实施方式
以下,对本发明进行更详细地说明。
(1) 生物素变体二聚体化合物
本发明的生物素变体二聚体化合物是下述式(1)所示的化合物,优选为式(1)中的n1和n2为0时的式(2)所示的化合物。
[化学式5]
(1)
[化学式6]
(2)
(式中,X1a、X1b、X2a和X2b分别独立表示O或NH,Y1和Y2分别独立表示C或S,Z1和Z2分别独立表示O、S或NH,V1和V2分别独立表示S或S+-O-,n1和n2分别独立表示0或1的整数,m1和m2分别独立表示1~10的整数,L表示连接基。)
在式(1)和式(2)中,下述结构:
[化学式7]
所示的部分优选为以下的任一种,但并不限于这些。
[化学式8]
m1和m2表示1~10的整数,优选表示2~10的整数,更优选表示2~8的整数,进一步优选表示2~6的整数。
L优选为由-CONH-、-NHCO-、-O-、碳原子数1~10的亚烷基、可具有取代基的亚苯基、或它们的组合构成的连接基。进一步优选L为-CONH-(CH2)p-CONH-(CH2)q-O-(CH2)r-NHCO-(CH2)s-NH-CO-、-CONH-(CH2)p-CONH-(CH2)q-NHCO-(CH2)s-NH-CO-、-CONH-(CH2)p- CONH-(可具有取代基的亚苯基)-NHCO-(CH2)s-NH-CO-、-CONH-CH(COOCH3)-(CH2)p-NHCO-(可具有取代基的亚苯基)- CONH-(CH2)s-CH(COOCH3)-NH-CO-、或-CONH-(CH2)p-O-(CH2)t- NHCO-(可具有取代基的亚苯基)-CONH-(CH2)s-O-(CH2)u-NH-CO- (式中,p、q、r、s、t和u分别独立表示1~10的整数)。更优选p、q、r和s分别独立表示2~8的整数,进一步优选表示2~6的整数。更优选t和u分别独立表示1~4的整数。作为亚苯基上的取代基,可以列举-COOH、-CONH2、可被取代的酰胺基、-CO-NH2等。
本发明的式(1)或式(2)的化合物可利用下述实施例1中记载的合成方法进行合成。实施例1中的化合物5、7、11、13、15、22、24、36和50为本发明的式(1)或式(2)的化合物。
化合物5的合成方法
向化合物1的乙酸乙酯溶液中加入1-乙基-3-(3-二甲基氨基丙基)碳化二亚胺盐酸盐,再加入N,N-二甲基甲酰胺,向反应混合物中加入溶解于氯仿和N,N-二甲基甲酰胺的混合溶剂中的2,2’-氧代双(乙胺),之后在室温下反应,从而得到叔丁基6,6’-[2,2’-氧代双(乙烷-2,1-二基)双(氮烷二基)]双(6-氧代己烷-6,1-二基)二碳酸酯(化合物2)。向二氨基甲酸酯体2的二氯甲烷溶液中加入三氟乙酸,在室温下反应30分钟,从而得到N,N’-[2,2’-氧代双(乙烷-2,1-二基)]双(6-氨基己酰胺) (化合物3)。向二胺3的N,N-二甲基甲酰胺和吡啶混合溶液中加入EZ-LinkR NHS-亚氨基生物素,在室温下反应。将粗产物溶解于二噁烷与水的混合溶剂中,加入25%的氨水溶液,在室温下反应,从而得到(3aS,3a’S,4S,4’S,6aR,6a’R)-4,4’-(5,12,20,27-四氧代-16-氧杂-6,13,19,26-四氮杂三十一烷-1,311-二基)双[四氢-1H-噻吩并[3,4-d]咪唑-2(3H)-亚胺鎓]二(2,2,2-三氟乙酸盐) (化合物5)。
化合物7的合成方法
向二胺6的N,N-二甲基甲酰胺和吡啶的混合溶液中加入EZ-LinkR NHS-亚氨基生物素,在室温下反应。减压馏去溶剂后溶解于二噁烷中,加入25%的氨水溶液,在室温下进行反应,从而得到(3aS,3a’S,4S,4’S,6aR,6a’R)-4,4’-(5,12,18,25-四氧代-6,13,17,24-四氮杂二十九烷-1,29-二基)双[四氢-1H-噻吩并[3,4-d]咪唑-2(3H)-亚胺鎓]二(2,2,2-三氟乙酸盐) (化合物7)。
化合物11的合成方法
向化合物1的N,N-二甲基甲酰胺中加入1-乙基-3-(3-二甲基氨基丙基)碳化二亚胺盐酸盐,之后加入溶解于N,N-二甲基甲酰胺中的3,5-二氨基苯甲酸乙酯(化合物8),在室温下反应,从而得到3,5-双[6-(叔丁氧基羰基氨基)己酰胺]苯甲酸乙酯(化合物9)。向二氨基甲酸酯体9的二噁烷溶液中加入4当量的氯化氢二噁烷溶液,在室温下反应,从而得到6,6’-[5-(乙氧基羰基)-1,3-亚苯基]双(氮烷二基)双(6-氧代己烷-1-铵)二氯化物(化合物10)。向铵盐10中加入N,N-二甲基甲酰胺,然后加入三乙胺而使其溶解。加入EZ-LinkR NHS-亚氨基生物素,在室温下反应。将粗产物溶解于甲醇中,加入2当量的氢氧化钠水溶液,在室温下搅拌22小时。由此得到3aS,3a’S,4S,4’S,6aR,6a’R)-4,4’-{5,5’-[6,6’-(5-羧基-1,3-亚苯基)双(氮烷二基)双(6-氧代己烷-6,1-二基)]双(氮烷二基)双(5-氧代戊烷-5,1-二基)}双(四氢-1H-噻吩并[3,4-d]咪唑-2(3H)-亚胺鎓)二(2,2,2-三氟乙酸盐(化合物11)。
化合物13的合成方法
向双亚氨基生物素11的N,N-二甲基甲酰胺溶液中加入N,N’-二异丙基碳化二亚胺和1-羟基苯并三唑一水合物,之后加入胺12的N,N-二甲基甲酰胺溶液,在60℃下反应。由此得到(3aS,3a’S,4S,4’S,6aR,6a’R)-4,4’-{5,5’-[6,6’-(5-(2-(2-(2-氨基乙氧基)乙氧基)乙基羰基)-1,3-亚苯基)双(氮烷二基)双(6-氧代己烷-6,1-二基)]双(氮烷二基)双(5-氧代戊烷-5,1-二基)}双(四氢-1H-噻吩并[3,4-d]咪唑-2(3H)-亚胺鎓)三(2,2,2-三氟乙酸盐) (化合物13)。
化合物15的合成方法
向二胺10中加入二噁烷和吡啶,然后加入EZ-LinkR NHS-亚氨基生物素,在室温下反应。减压馏去溶剂,之后将粗产物溶解于二噁烷、水中,加入28%的氨水溶液,在室温下反应,从而得到(3aS,3a’S,4S,4’S,6aR,6a’R)-4,4’-{5,5’-[6,6’-(5-氨基甲酰基-1,3-亚苯基)双(氮烷二基)双(6-氧代己烷-6,1-二基)]双(氮烷二基)双(5-氧代戊烷-5,1-二基)}双[四氢-1H-噻吩并[3,4-d]咪唑-2(3H)-亚胺鎓]二(2,2,2-三氟乙酸盐) (化合物15)。
化合物22的合成方法
向5-(4-碘苯甲酰胺)间苯二甲酸的N,N-二甲基甲酰胺溶液中加入1-乙基-3-(3-二甲基氨基丙基)碳化二亚胺盐酸盐和1-羟基苯并三唑一水合物,之后加入胺12的N,N-二甲基甲酰胺溶液,在室温下反应,从而得到N1,N3-双{2-[2-(2-(叔丁氧基羰基氨基)乙氧基)乙氧基]乙基}-5-(4-碘苯甲酰胺)间苯二甲酰胺(化合物17)。
向二氨基甲酸酯体17的二氯甲烷溶液中加入三氟乙酸,在室温下反应,从而得到N1,N3-双{2-[2-(2-氨基乙氧基)乙氧基]乙基}-5-(4-碘苯甲酰胺)间苯二甲酰胺(化合物18)。
向Boc-Asp(OtBu)-OH (化合物19a)和N-羟基琥珀酰亚胺的N,N-二甲基甲酰胺溶液中加入1-乙基-3-(3-二甲基氨基丙基)碳化二亚胺盐酸盐,在室温下反应,从而得到(S)-1-叔丁基-4-(2,5-二氧代吡咯烷-1-基) 2-(叔丁氧基羰基氨基)琥珀酸酯(化合物19)。
向二胺化合物18的二噁烷和吡啶的混合溶液中加入活性酯19,在室温下反应,再加入化合物19,使之在室温下反应,从而得到(14S,14’S)-1,1’-[5-(4-碘苯甲酰胺)-1,3-亚苯基]双[14-(叔丁氧基羰基氨基)-1,12-二氧代-5,8-二氧杂-2,11-二氮杂十五烷酸]叔丁酯(化合物20)。
向化合物20中加入三氟乙酸,使之在室温下反应,从而得到(14S,14’S)-1,1’-[5-(4-碘苯甲酰胺)-1,3-亚苯基]双(14-羧基-1,12-二氧代-5,8-二氧杂-2,11-二氮杂十四烷-14-铵)二(2,2,2-三氟乙酸盐) (化合物21)。
将双氨基酸21悬浮于二噁烷和水的混合溶剂中,然后加入1当量的氢氧化钠水溶液,在室温下搅拌、溶解,之后加入EZ-LinkR NHS-亚氨基生物素,在室温下反应。加入2当量的氢氧化钠水溶液,再于室温下反应,从而得到(3aS,3a’S,4S,4’S,6aR,6a’R)-4,4’-{(14S,14’S)- 1,1’-[5-(4-碘苯甲酰胺)-1,3-亚苯基]双(14-羧基-1,12,16-三氧代-5,8-二氧杂-2,11,15-三氮杂二十碳烷-20,1-二基)}双(四氢-1H-噻吩并[3,4-d]咪唑-2(3H)-亚胺鎓)二(2,2,2-三氟乙酸盐) (化合物22)。
化合物24的合成方法
向二胺3的N,N-二甲基甲酰胺溶液中加入生物素N-羟基琥珀酰亚胺酯(化合物23),在室温下反应,从而得到N,N’-[2,2’-氧代双(乙烷-2,1-二基)]双{6-[5-((3aS,4S,6aR)-2-氧代六氢-1H-噻吩并[3,4-d]咪唑-4-基)戊酰胺]己酰胺} (化合物24)。
化合物36的合成方法
向2-亚氨基生物素39中加入三氟乙酸,搅拌后减压馏去过剩的三氟乙酸。在所得的白色固体的乙腈溶液中加入吡啶、二琥珀酰亚胺40,在30℃下搅拌,减压馏去溶剂后在真空下干燥,从而得到化合物41。向二胺34的N,N-二甲基甲酰胺和三乙胺的混合溶液中加入由2-亚氨基生物素39调制的酯41,在室温下搅拌,减压馏去溶剂,得到的粗产物通过反相硅胶柱色谱(水/甲醇=2:1→1:2)进行纯化,从而得到化合物35。在双亚氨基生物素35的水溶液中加入三氟乙酸,在50℃下搅拌4小时,减压馏去溶剂,所得粗产物通过反相硅胶柱色谱(水/甲醇=2:1→1:2)进行纯化,得到化合物36。
化合物50的合成方法
向二琥珀酰亚胺体30的N,N-二甲基甲酰胺溶液中加入胺45的N,N-二甲基甲酰胺溶液,在室温下搅拌。再加入胺45的N,N-二甲基甲酰胺溶液,在室温下搅拌。减压馏去溶剂后加入乙酸乙酯,用1M的氢氧化钠水溶液、1M的盐酸、饱和食盐水进行清洗,用硫酸钠干燥后减压馏去溶剂,所得粗产物通过硅胶柱色谱(二氯甲烷/己烷=1:30→1:20→1:10→1:5)进行纯化,从而得到化合物46。在冰冷下向上述得到的二氨基甲酸酯体47的水溶液中加入三氟乙酸进行搅拌,之后升至室温,再进行搅拌。减压馏去溶剂后在真空下干燥,从而得到包含化合物48的粗产物。向准备有由2-亚氨基生物素39调制的化合物41的试管中加入二胺48的N,N-二甲基甲酰胺溶液、二异丙基乙胺,在室温下搅拌。减压馏去溶剂,所得粗产物通过反相硅胶柱色谱(甲醇/水=2:1, 0.3%的TFA)进行纯化,从而得到化合物49。在双亚氨基生物素49中加入三氟乙酸和水的混合溶液,升温至50℃进行搅拌。减压馏去溶剂后在真空下干燥,从而得到化合物50。
根据本发明,还提供一种在上述本发明的生物素变体二聚体化合物上结合有捕捉放射性同位素的螯合基的化合物。作为本发明中可以使用的螯合基,可以列举:DOTA (1,4,7,10-四氮杂环十二烷-N,N’,N’’,N’’’-四乙酸)、DTPA (二亚乙基三胺五乙酸)、TETA (1,4,8,11-四氮杂环十四烷-N,N’,N’’,N’’’-四乙酸)、N2S2、MAG3、CHX-A-DTPA等。
根据本发明,还提供一种在上述结合有螯合基的化合物上捕捉有放射性同位素的化合物。在被螯合基捕捉的放射性同位素中,作为成像用放射性同位素,可以使用γ射线核素(67Ga、99mTc、111In、123I)、正电子发射核素(18F、62Cu、64Cu、66Ga、68Ga、76Br、86Y、89Zr、4Tc、124I)。作为治疗用放射性同位素,可以使用β射线核素(32P、67Cu、89Sr、90Y、114mIn、117mSn、131I、153Sm、166Ho、177,Lu、186,Re、188Re等)、α射线核素(211At、212Bi、212,Pb、213Bi、223Ra、225Ac等)、俄歇电子射线核素(125I、165Er等)。即使在上述放射性同位素中,也可以优选使用64Cu、124I、76Br、 68Ga、99mTc、123I、131I、90Y。
根据本发明,还提供一种在上述本发明的生物素变体二聚体化合物上结合有荧光化合物或药物化合物(例如抗癌药)的化合物。
作为本发明中可以使用的荧光化合物,可以列举荧光素5-异硫氰酸酯(FITC)、IR Dye (注册商标) 800、或荧光素等。作为本发明中可以使用的药物(例如抗癌药),可以列举:PBD (吡咯并苯并二吖庚因)类(例如SJG-136、SG2202等)、美登素(maytansine)类似物(例如DM1、DM4等)、多拉司他汀(dolastatin)类似物(例如一甲基阿里他汀E (Monomethyl auristatin E, MMAE)、一甲基阿里他汀F (Monomethyl auristatin F, MMAF)、多拉司他汀10、tubulysin等)、倍癌霉素(duocarmycin)类似物(例如DC1、DC4、DC44等)、喜树碱(camptothecin)类似物(例如SN-38等)、其他(例如甲氨蝶呤(methotrexate)、长春碱(vinblastine)、卡奇霉素(calicheamicin)、α-鹅膏蕈碱(α-amanitin)、阿霉素(doxorubicin)、美法仑(melphalan))等。
作为在本发明的式(1)或式(2)的化合物上结合有捕捉放射性同位素的螯合基的化合物、以及在本发明的式(1)或式(2)的化合物上结合有荧光化合物或药物化合物的化合物的具体例子,可以列举实施例1中的化合物14、42、44、51、52和59,可以利用下述实施例1中记载的合成方法进行合成。
化合物14的合成方法
向双亚氨基生物素13的甲醇溶液中加入三乙胺和荧光素5-异硫氰酸酯,使之在室温下反应,从而得到(3aS,3a’S,4S,4’S,6aR,6a’R)- 4,4’-{5,5’-[6,6’-(5-(2-(2-(2-(3-(3’,6’-二羟基-3-氧代-3H-螺[异苯并呋喃-1,9’-呫吨]-5-基)硫脲基)乙氧基)乙氧基)乙基氨基甲酰基)-1,3-亚苯基)双(氮烷二基)双(6-氧代己烷-6,1-二基)]双(氮烷二基)双(5-氧代戊烷-5,1-二基)}双(四氢-1H-噻吩并[3,4-d]咪唑-2(3H)-亚胺鎓)二(2,2,2-三氟乙酸盐) (化合物14)。
化合物42的合成方法
向双亚氨基生物素36的甲醇、三乙胺混合溶液中加入DOTA-NHS-酯37,在室温下搅拌。减压馏去溶剂,所得粗产物通过反相HPLC (0.0-20.0-20.5-60.5-61.0-75.0分钟;5.0-5.0-17.5-57.5-100.0-100.0% CH3CN的0.1% HCOOH MQ,斜坡时间(ramp time)为40分钟 (17.5-57.5%),tR=31.5分钟)进行纯化,从而得到化合物42。
化合物44的合成方法
向双亚氨基生物素36的N,N-二甲基甲酰胺、三乙胺混合溶液中加入IRDyeR 800CW NHS酯,在室温下搅拌。减压馏去溶剂,所得粗产物通过反相HPLC (0.0-20.0-20.5-60.5-61.0-75.0分钟;5.0-5.0-17.5- 57.5-100.0-100.0% CH3CN的0.1% TFA MQ,斜坡时间为40分钟(17.5-57.5%),tR=40.9分钟)进行纯化,从而得到化合物44。
化合物51的合成方法
向双亚氨基生物素50的甲醇、三乙胺混合溶液中加入3.5mg (4.6μ mol)的DOTA-NHS-酯37,在室温下搅拌。减压馏去溶剂,所得粗产物通过反相HPLC (0.0-20.0-20.5-60.5-61.0-75.0分钟;5.0-5.0-17.5- 57.5-100.0-100.0% CH3CN的0.1% TFA MQ,斜坡时间为40分钟(17.5-57.5%),tR=32.6分钟)进行纯化,从而得到化合物51。
化合物52的合成方法
向双亚氨基生物素50的甲醇、三乙胺混合溶液中加入5(6)-羧基荧光素N-羟基琥珀酰亚胺酯51,在室温下搅拌。减压馏去溶剂,所得粗产物通过反相柱色谱(甲醇/水=1:1→2:1, 0.5%的TFA)进行纯化,再用Sephadex 20LH (甲醇,1%的TFA)进行纯化,从而得到化合物52。
化合物59的合成方法
在冰冷下向SN38 Boc保护体53、Cbz-Ala-OH 54的二氯甲烷溶液中加入1-乙基-3-(3-二甲基氨基丙基)碳化二亚胺盐酸盐、二甲基氨基吡啶,缓慢升至室温,进行搅拌。加入二氯甲烷,用碳酸氢钠水溶液、水、0.1M的盐酸和饱和食盐水清洗,再用硫酸钠干燥,之后减压馏去溶剂,所得粗产物通过硅胶柱色谱(二氯甲烷/甲醇=30:1)进行纯化,从而得到化合物55。向化合物55的乙酸乙酯溶液中加入Pd/C,将容器内置换成氢气氛,之后在室温下搅拌,然后在40℃下搅拌,进行硅藻土过滤。减压馏去溶剂,所得粗产物通过薄层色谱法(二氯甲烷/甲醇=30:1)进行纯化,从而得到化合物56。在冰冷下向化合物56的二氯甲烷溶液中加入三光气、吡啶,升至室温并进行搅拌,减压馏去溶剂后在真空下干燥,从而得到包含化合物57的粗产物(褐色液体)。向双亚氨基生物素50和包含化合物57的粗产物的甲醇溶液中加入三乙胺,在室温下搅拌。减压馏去溶剂,所得粗产物通过反相薄层色谱法(甲醇/水=3:1,1%的TFA)进行纯化,从而得到化合物58。向双亚氨基生物素58的水溶液中加入三氟乙酸,在室温下搅拌。减压馏去溶剂,所得粗产物通过反相薄层色谱法(甲醇/水=3:1,1%的TFA)进行纯化,从而得到化合物59。
(2) 链霉亲和素突变体
本发明的链霉亲和素突变体的特征在于:在SEQ ID NO: 2所记载的核心链霉亲和素的氨基酸序列中具有规定的氨基酸突变,与野生型链霉亲和素相比免疫原性降低,同时与天然生物素或生物胞素的亲和性也有所降低。
野生型(天然)核心链霉亲和素的氨基酸序列见序列表的SEQ ID NO: 2,编码该氨基酸序列的核苷酸序列见序列表的SEQ ID NO: 1。
作为本发明的链霉亲和素突变体,具体而言,可以列举由SEQ ID NO: 3所记载的氨基酸序列中第37位的氨基酸残基即Asn被取代成了其他氨基酸残基的氨基酸序列构成的链霉亲和素突变体。特别优选为包含SEQ ID NO: 4所记载的氨基酸序列的链霉亲和素突变体。
SEQ ID NO: 3所记载的氨基酸序列是在具有SEQ ID NO: 2所记载的氨基酸序列的链霉亲和素中具有下述突变的氨基酸序列:
(1) 第10位氨基酸残基的酪氨酸取代成了丝氨酸的突变;
(2) 第71位氨基酸残基的酪氨酸取代成了丝氨酸的突变;
(3) 第72位氨基酸残基的精氨酸取代成了赖氨酸的突变;
(4) 第89位氨基酸残基的谷氨酸取代成了天冬氨酸的突变;
(5) 第91位氨基酸残基的精氨酸取代成了赖氨酸的突变;
(6) 第104位氨基酸残基的谷氨酸取代成了天冬酰胺的突变;
(7) 第11位氨基酸残基的天冬酰胺取代成了天冬氨酸的突变;
(8) 第15位氨基酸残基的丝氨酸取代成了天冬氨酸的突变;
(9) 第33位氨基酸残基的丝氨酸取代成了天冬酰胺的突变。
SEQ ID NO: 4所记载的氨基酸序列是在SEQ ID NO: 3所记载的氨基酸序列中还具有下述突变的氨基酸序列:
(10) 第37位氨基酸残基的天冬酰胺取代成了甘氨酸的突变。
本发明中所说的与野生型链霉亲和素相比免疫原性降低是指在对人等哺乳动物给予链霉亲和素突变体时免疫原性降低。免疫原性降低例如可以通过以下的方法来确认。即,关于本发明的链霉亲和素突变体,分析其对抗链霉亲和素抗血清的反应性,所述抗链霉亲和素抗血清是用野生型链霉亲和素对食蟹猴进行免疫而获得的,当上述的对抗链霉亲和素抗血清的反应性较野生型链霉亲和素有所降低时,可以判断为与野生型链霉亲和素相比免疫原性降低。当利用上述方法判断免疫原性的降低时,与野生型链霉亲和素相比,本发明的链霉亲和素突变体的免疫原性优选降低至80%以下、进一步优选降低至60%以下、进一步优选降低至20%以下、进一步优选降低至15%以下、进一步优选降低至10%以下、特别优选降低至5%以下。
本发明中所说的与天然生物素或生物胞素的亲和性有所降低是指链霉亲和素突变体与天然生物素或生物胞素的结合性较链霉亲和素与天然生物素或生物胞素的结合性有所降低。链霉亲和素突变体与天然生物素或生物胞素的亲和性、结合性可以通过SPR分析等进行评价。与野生型链霉亲和素相比,本发明的链霉亲和素突变体与天然生物素或生物胞素的亲和性优选降低至80%以下、进一步优选降低至70%以下、进一步优选降低至60%以下、进一步优选降低至50%以下、进一步优选降低至40%以下。
根据本发明,还提供编码上述本发明的链霉亲和素突变体的DNA。本发明的DNA可以通过对编码野生型(天然)链霉亲和素的DNA进行位点定向诱变来制作。
上述的编码本发明的链霉亲和素突变体的DNA可以插入载体中使用。特别是,为了制备本发明的链霉亲和素突变体,可以将编码本发明的链霉亲和素突变体的DNA插入表达载体中,将该表达载体转化成宿主,从而使本发明的链霉亲和素突变体表达。
当以大肠杆菌作为宿主时,作为本发明中使用的载体,优选具有复制起点(ori),而且还具有用于选择所转化的宿主的基因(例如对氨苄青霉素、四环素、卡那霉素或氯霉素等药物的耐药性基因等)。另外,当为表达载体时,优选具有可以使本发明的链霉亲和素突变体在宿主中高效率地表达的启动子、例如lacZ启动子或T7启动子等。作为这样的载体,载体的例子可以列举M13系载体、pUC系载体、pBR322、pBluescript、pCR-Script、pGEX-5X-1(Pharmacia)、“QIAexpress system”(Qiagen)、pEGFP或pET(这种情况下,宿主优选使用表达T7 RNA聚合酶的BL21)等。另外,还可以在载体上添加用于提高本发明的链霉亲和素突变体的收率的信号序列等。
向宿主细胞中导入载体例如可以通过氯化钙法、电穿孔法进行。另外,还可以添加用于提高可溶性的标志物(tag)、例如谷胱甘肽S-转移酶或硫氧还蛋白、编码麦芽糖结合蛋白的序列。另外,还可以添加为了容易进行纯化而设计的标志物、例如聚组氨酸标志物、Myc表位、血凝素(HA)表位、T7表位、Xpress标志物或FLAG肽标志物、其他的编码已知标志物序列的序列。
除大肠杆菌以外,还可以列举来自哺乳动物的表达载体(例如pcDNA3 (Invitrogen公司制造)或pEGF-BOS (Nucleic Acids. Res.1990, 18(17), 第5322页)、pEF、pCDM8)、来自昆虫细胞的表达载体(例如“Bac-to-BAC杆状病毒表达系统”(ギブコBRL公司制造)、pBacPAK8)、来自植物的表达载体(例如pMH1、pMH2)、来自动物病毒的表达载体(例如pHSV、pMV、pAdexLcw)、来自逆转录病毒的表达载体(例如pZIPneo)、来自酵母的表达载体(例如“毕赤酵母表达试剂盒”(Invitrogen公司制造)、pNV11、SP-Q01)、来自枯草杆菌的表达载体(例如pPL608、pKTH50)。
为了在CHO细胞、COS细胞、NIH3T3细胞等动物细胞中表达时,具有在细胞内进行表达所必需的启动子、例如SV40启动子(Mulligan等人, Nature (1979) 277, 108)、MMLV-LTR启动子、EF1α启动子(Mizushima等人, Nucleic Acids Res. (1990) 18, 5322)、CMV启动子等是不可或缺的,进一步优选具有用于选择向细胞中转化的基因(例如通过药物(新霉素、G418等)可以判别的耐药性基因)。作为具有这种特性的载体,例如可以列举pMAM、pDR2、pBK-RSV、pBK-CMV、pOPRSV、pOP13等。
对导入载体的宿主细胞没有特别限定,可以是原核生物和真核生物中的任一种。例如可以使用大肠杆菌或各种动物细胞等。
当使用真核细胞时,例如可以在宿主中使用动物细胞、植物细胞、真菌细胞。作为动物细胞,可以使用哺乳类细胞、例如CHO细胞、COS细胞、3T3细胞、HeLa细胞、Vero细胞、或者昆虫细胞、例如Sf9、Sf21、Tn5等。在动物细胞中,为了大量表达时,特别优选CHO细胞。向宿主细胞中导入载体例如可以通过磷酸钙法、DEAE葡聚糖法、使用了阳离子性核糖体DOTAP(ベーリンガーマンハイム公司制造)的方法、电穿孔法、脂质转染等方法来进行。
作为植物细胞,例如来自烟草(Nicotiana tabacum)的细胞作为蛋白生产系统而已知,只要对其进行愈伤组织培养即可。作为真菌细胞,已知有:酵母、例如酵母(Saccharomyces)属、例如酿酒酵母(Saccharomyces cerevisiae);丝状菌、例如曲霉(Aspergillus)属、例如黑曲霉(Aspergillus niger)。
当使用原核细胞时,可以列举大肠杆菌(E.coli)、例如JM109、DH5α、HB101等,此外还已知枯草杆菌。
利用本发明的DNA转化这些细胞,并在体外培养所转化的细胞,从而得到本发明的链霉亲和素突变体。培养可以按照公知的方法进行。例如,作为动物细胞的培养液,例如可以使用DMEM、MEM、RPMI1640、IMDM。此时,还可以结合使用胎牛血清(FCS)等血清补液,也可以进行无血清培养。培养时的pH值优选为约6~8。培养通常是在约30~40℃下进行约15~200小时,根据需要进行培养基的交换、通气、搅拌。另外,还可以添加用于促进细胞增殖的生长因子。
(3) 链霉亲和素突变体和生物素变体的应用
根据本发明,还提供一种通过使分子探针与本发明的链霉亲和素突变体结合得到的链霉亲和素突变体-分子探针结合物、以及包含链霉亲和素突变体-分子探针结合物的治疗药或诊断药。而且,上述的链霉亲和素突变体-分子探针结合物可以与诊断用或治疗用物质组合,以治疗或诊断试剂盒的形式提供,所述诊断用或治疗用物质已用对本发明的链霉亲和素突变体具有亲和性的生物素变体进行标记。作为分子探针,例如可以列举抗体、肽、核酸、适配体等,具体而言,可以使用以在癌症中特异性表达的下述抗原为靶的抗体、肽、核酸、适配体等。
上皮调节蛋白、ROBO1、ROBO2、ROBO3、ROBO4、1-40-β-淀粉状蛋白、4-1BB、5AC、5T4、ACVR2B、腺癌抗原、α-胎蛋白、血管生成素-2、炭疽毒素、AOC3 (VAP-1)、B-淋巴瘤细胞、B7-H3、BAFF、β-淀粉状蛋白、C242抗原、C5、CA-125、碳酸酐酶9 (CA-IX)、心肌肌球蛋白、CCL11 (eotaxin-1, 嗜酸细胞活化趋化因子-1)、CCR4、CCR5、CD11、CD18、CD125、CD140a、CD147 (basigin)、CD147 (basigin)、CD15、CD152、CD154 (CD40L)、CD154、CD19、CD2、CD20、CD200、CD22、CD221、CD23 (IgE受体)、CD25 (IL-2受体的α链)、CD28、CD3、CD30 (TNFRSF8)、CD33、CD37、CD38 (环腺苷二磷酸核糖水解酶)、CD4、CD40、CD41 (整联蛋白α-IIb)、CD44 v6、CD5、CD51、CD52、CD56、CD6、CD70、CD74、CD79B、CD80、CEA、CFD、ch4D5、CLDN18.2、艰难梭菌(Clostridium difficile)、聚集因子A、CSF2、CTLA-4、巨细胞病毒、巨细胞病毒糖蛋白B、DLL4、DR5、大肠杆菌志贺毒素1型、大肠杆菌志贺毒素2型、EGFL7、EGFR、内毒素、EpCAM、上皮唾液蛋白(episialin)、ERBB3、大肠杆菌(Escherichia coli)、呼吸道合胞病毒(respiratory syncytial virus)的F蛋白、FAP、血纤蛋白IIβ链、纤连蛋白额外结构域-B、叶酸受体1、Frizzled受体、GD2、GD3神经节苷脂、GMCSF受体α链、GPNMB、乙型肝炎表面抗原、乙型肝炎病毒、HER1、HER2/neu、HER3、HGF、HIV-1、HLA-DRβ、HNGF、Hsp90、人β淀粉状蛋白、人离散因子(scatter factor)受体激酶、人TNF、ICAM-1 (CD54)、IFN-α、IFN-γ、IgE、IgE Fc区、IGF-1受体、IGF-I、IgG4、IGHE、IL-1β、IL-12、IL-13、IL-17、IL-17A、IL-22、IL-23、IL-4、IL-5、IL-6、IL-6受体、IL-9、ILGF2、A型流感病毒血凝素、胰岛素样生长因子I受体、整联蛋白α4、整联蛋白α4β7、整联蛋白α5β1、整联蛋白α7β7、整联蛋白αIIbβ3、整联蛋白αvβ3、整联蛋白γ诱导蛋白、干扰素受体、干扰素α/β受体、ITGA2、ITGB2 (CD18)、KIR2D、L-选择蛋白(CD62L)、Lewis-Y抗原、LFA-1 (CD11a)、脂磷壁酸、LOXL2、LTA、MCP-1、间皮素、MS4A1、MUC1、粘蛋白癌抗原、肌肉生长抑制素、N-羟乙酰神经氨酸、NARP-1、NCA-90 (粒细胞抗原)、NGF、NOGO-A、NRP1、Oryctolagus cuniculus、OX-40、oxLDL、PCSK9、PD-1、PDCD1、PDGF-R α、磷脂酰丝氨酸、前列腺癌细胞、绿脓杆菌(Pseudomonas aeruginosa)、狂犬病病毒糖蛋白、RANKL、呼吸道合胞病毒、RHD、Rh(猕猴,Rhesus)因子、RON、RTN4、骨硬化蛋白、SDC1、选择蛋白P、SLAMF7、SOST、鞘氨醇-1-磷酸酯、TAG-72、TEM1、生腱蛋白C、TFPI、TGFβ1、TGFβ2、TGF-β、TNF-α、TRAIL-R1、TRAIL-R2、肿瘤抗原CTAA16.88、MUC1的肿瘤特异性糖基化、TWEAK受体、TYRP1(糖蛋白75)、VEGF-A、VEGFR-1、VEGFR2、波形蛋白、VWF。
作为分子探针的优选的具体例子,有抗人CD20抗体(例如,利妥昔单抗)、或抗上皮调节蛋白单链抗体。
利妥昔单抗是抗人CD20抗体,人CD20只在人B细胞中表达。在小鼠型抗CD20单克隆抗体上标记有放射性同位素90Y的细胞性非霍奇金淋巴瘤、套细胞淋巴瘤治疗药作为ゼヴァリン(注册商标)在销售。该药品是在抗CD20抗体上直接标记有RI,体内给药后至肿瘤聚集需要数天的时间。因此会发生由RI引起的骨髓抑制等严重的副作用。作为解决这些问题的对策,提倡预靶向法(非专利文献3)。Pagneli等人正在对使用了抗CD20抗体-scfv与链霉亲和素突变体的融合蛋白和RI标记生物素或双生物素的预靶向法进行研究(非专利文献5)。
已知上皮调节蛋白(Epiregulin)是上皮细胞生长因子(epidermal growth factor)的成员,其起到诱导Hela细胞形态变化的癌细胞增殖抑制因子的作用。油谷等人制作了抗上皮调节蛋白抗体(WO2008/047723)。另外,Lee等人进行了抗上皮调节蛋白抗体的人源化及其评价(Biochemical and Biophysical Research communications 444 (2013) 1011-1017)。
即,在本发明中,通过调制癌抗原特异性抗体分子等的分子探针与本发明的链霉亲和素突变体的融合体并将其给予患者,可以使本发明的链霉亲和素突变体特异性地聚集在癌细胞处。接下来,通过对患者给予对上述链霉亲和素突变体具有亲和性的生物素变体所结合的诊断用或者治疗用物质(荧光色素、化学发光剂、放射性同位素、由金属化合物等构成的敏化剂、由金属化合物等构成的中子捕捉剂、药物等低分子化合物、微泡或纳米泡、蛋白等),可以使物质确实向癌细胞聚集。在本发明中,通过降低免疫原性抑制了抗体的产生,可以防止由抗体引起的早期从体内清除、以及过敏反应等休克。另外,在本发明中,通过以使用了由患者采集的组织、血清等的体外诊断药、临床检查药的形式使用,来自存在于组织、血清等中的生物素或生物素结合蛋白的噪音减小,可以实现S/N比更高的诊断、检查。
或者,在本发明中,还可以调制使癌抗原特异性抗体分子等的分子探针与本发明的链霉亲和素突变体的融合体和对上述链霉亲和素突变体具有亲和性的生物素变体所结合的诊断用或者治疗用物质(荧光色素、化学发光剂、放射性同位素、由金属化合物等构成的敏化剂、由金属化合物等构成的中子捕捉剂、药物等低分子化合物、微泡或纳米泡、蛋白等)结合而成的结合体,并对患者给予上述结合体。
与链霉亲和素突变体结合的抗体可以使用各种分子。多克隆抗体和单克隆抗体均可使用。对抗体的亚类没有特别限定,但优选适当使用IgG、特别是IgG1。另外,“抗体”包括所有的修饰抗体和抗体片段。可以列举人源化抗体、人型抗体、人抗体、来自小鼠、兔、大鼠、豚鼠、猴等各种动物的抗体、人抗体与来自各种动物的抗体的嵌合抗体、双抗体、scFv、Fd、Fab、Fab’、F(ab)’2,但并不限于这些。
链霉亲和素突变体与抗体的结合物可以利用本领域技术人员所公知的方法来获得。例如,既可以通过化学键合方法(US5,608,060)获得,也可以连接编码链霉亲和素突变体的DNA和编码抗体的DNA、并利用表达载体等使其在宿主细胞中表达,从而以融合蛋白的形式获得。编码链霉亲和素突变体的DNA与编码抗体的DNA的连接可以经由被称作接头的编码适当的肽的DNA来进行。链霉亲和素突变体-抗体结合物优选保留着抗体与靶分子的特异性结合力来制作。
通过以下的实施例来进一步具体说明本发明,但本发明并不受实施例的限定。
实施例
实施例1A:生物素变体二聚体化合物的合成
常规方法
使用JEOL ECX500 (1H NMR: 500MHz)或JEOL ECS400 (1H NMR: 400MHz)分光计测定了核磁共振(NMR)图谱。化学位移采用了相对于作为内部参照的重溶剂中的残留溶剂峰的值的形式,以ppm记载(CDCl3:δ=7.26ppm, CD3OD:δ=3.31ppm)。利用Waters ZQ4000分光计,使用ESI-MS测定了低分解能质谱(LHMS)。柱色谱使用硅胶Merk 60 (230-400 mesh ASTM)来进行。通过薄层色谱法(TLC)、或者低分解能质量分析(LRMS)来追踪反应。
使用JASCO-HPLC系统进行了反相高效液相色谱法(HPLC)。利用210nm或254nm的紫外光进行检测,流动相使用了梯度溶剂系统(乙腈/0.1%的三氟乙酸MQ溶液)。分析则使用YMC-Pack ODS-AM (150×4.6 mL)或YMC-Triart-C18 (150×4.6mL)柱,以1mL/分钟的流速进行。分离收集(分取)是使用YMC-Pack ODS-AM (250×20 mL)或YMC-Triart-C18 (250×10mL)柱,前者以8-10mL/分钟的流速进行,后者以3mL/分钟的流速进行。
EZ-Link (注册商标) NHS-亚氨基生物素从サーモサイエンティフィック公司购入。其他试剂从Aldrich、东京化成工业株式会社(TCI)、关东化学株式会社(Kanto)、和光纯药工业株式会社、渡边化学工业株式会社购入。只要没有特别指明,则所有的试剂和溶剂均直接使用了市售品。
叔丁基6,6’-[2,2’-氧代双(乙烷-2,1-二基)双(氮烷二基)]双(6-氧代己烷-6,1-二基)二碳酸酯(2)
[化学式9]
向利用已知方法(Carlescu等人, Carbohydr. Res. (2010) 345, 33)合成的1.40g (6.05mmol)的1的12mL乙酸乙酯溶液中加入1.22g (6.34mmol)的1-乙基-3-(3-二甲基氨基丙基)碳化二亚胺盐酸盐(WSC•HCl),再加入6mL的N,N-二甲基甲酰胺,之后在冰浴中冷却。向反应混合物中加入溶解于24mL氯仿和6mL N,N-二甲基甲酰胺的混合溶剂中的0.30g (2.88mmol)的2,2’-氧代双(乙胺),之后在室温下搅拌了17小时。加入饱和食盐水,用乙酸乙酯提取,之后将有机层用0.5当量的盐酸清洗2次、用饱和碳酸氢钠水溶液清洗2次、再用饱和食盐水清洗。经硫酸钠干燥后,减压馏去溶剂,所得粗产物通过硅胶柱色谱(二氯甲烷/甲醇=20:1)进行纯化,从而得到了0.982g标题化合物2 (收率为64%, 黄色高粘性油状)。
N,N’-[2,2’-氧代双(乙烷-2,1-二基)]双(6-氨基己酰胺) (3)
[化学式10]
向0.917g (1.73mmol)二氨基甲酸酯体2的6mL二氯甲烷溶液中加入12mL三氟乙酸,在室温下搅拌了30分钟。减压馏去溶剂,之后溶解于1mL的甲醇中,通过Amberlite® IRA-400柱(碱性树脂、20mm× 200mm),用甲醇洗脱。减压馏去溶剂,之后在真空下干燥,从而得到了0.57 g标题化合物3 (quant.(定量的),淡黄白色固体)。
(3aS,3a’S,4S,4’S,6aR,6a’R)-4,4’-(5,12,20,27-四氧代-16-氧杂-6,13,19,26-四氮杂正三十一烷-1,311-二基)双[四氢-1H-噻吩并[3,4-d]咪唑-2(3H)-亚胺鎓]二(2,2,2-三氟乙酸盐) (5)
[化学式11]
向7.0mg (0.0212mmol)二胺3的0.4mL N,N-二甲基甲酰胺、0.1mL吡啶的混合溶液中加入18.4mg (0.0424mmol)的EZ-LinkR NHS-亚氨基生物素(4),在室温下搅拌了7小时。减压馏去溶剂后,加入丙酮和二乙醚的混合溶剂(1:1),用超声波进行了清洗。过滤已生成的固体,用相同的溶剂清洗,之后在减压下干燥固体。将粗产物溶解于1.2mL二噁烷和0.8mL水的混合溶剂中,加入4.8mL 25%的氨水溶液,在室温下搅拌了6小时。用二乙醚清洗水层,之后减压馏去溶剂。所得粗产物通过反相HPLC (0-10-11-41-42-55分钟;0-0-22-52-100-100% CH3CN的0.1% TFA MQ,斜坡时间为30分钟(22-52%),tR=22.0分钟)进行纯化,从而得到了10.8mg标题化合物5 (两个阶段的收率为65%,无色无定形)。
(3aS,3a’S,4S,4’S,6aR,6a’R)-4,4’-(5,12,17,24-四氧代-6,13,16,23-四氮杂二十八烷-1,28-二基)双[四氢-1H-噻吩并[3,4-d]咪唑-2(3H)-亚胺鎓]二(2,2,2-三氟乙酸盐) (7)
[化学式12]
向利用已知方法合成的3.3mg (0.0115mmol)二胺6的0.4mL N,N-二甲基甲酰胺、0.1mL吡啶的混合溶液中加入10mg (0.0230mmol)的EZ-LinkR NHS-亚氨基生物素(4),在室温下搅拌了6小时。减压馏去溶剂后溶解于0.5mL的二噁烷中,加入2.0mL 25%的氨水溶液,在室温下搅拌了6小时。用二乙醚清洗水层,之后减压馏去溶剂。所得粗产物通过反相HPLC (YMC-Pack ODS-AM,梯度:0-10-11-36-37-50分钟;0-0-17-42-100-100% CH3CN的0.1% TFA MQ,斜坡时间为25分钟(17-42%),tR=26.7分钟)进行纯化,从而得到了7.9mg标题化合物7 (两个阶段的收率为71%,无色无定形)。
3,5-双[6-(叔丁氧基羰基氨基)己酰胺]苯甲酸乙酯(9)
[化学式13]
向利用已知方法(Carlescu等人, Carbohydr. Res. (2010) 345, 33)合成的2.82g (11.2mmol)的1的25mL N,N-二甲基甲酰胺溶液中加入2.66g (12.8mmol)的1-乙基-3-(3-二甲基氨基丙基)碳化二亚胺盐酸盐(WSC•HCl),之后加入0.96 g (5.33mmol)溶解于10mL N,N-二甲基甲酰胺中的3,5-二氨基苯甲酸乙酯8,在室温下搅拌了2小时。加入饱和食盐水和1当量的盐酸,用乙酸乙酯提取,之后将有机层用0.5当量的盐酸清洗2次、用饱和碳酸氢钠水溶液清洗2次、再用饱和食盐水清洗。经硫酸钠干燥后减压馏去溶剂,所得粗产物通过硅胶柱色谱(己烷/乙酸乙酯=1:1→1:3)进行纯化,从而得到了2.27g标题化合物9 (收率为59%,黄色油状)。
6,6’-[5-(乙氧基羰基)-1,3-亚苯基]双(氮烷二基)双(6-氧代己烷-1-铵)二氯化物(10)
[化学式14]
向2.27g (3.74mmol)二氨基甲酸酯体9的20mL二噁烷溶液中加入20mL 4当量的氯化氢二噁烷溶液,在室温下搅拌了2小时。已生成的固体用二乙醚清洗,并在真空下干燥,从而定量得到了铵盐10。再将其溶解于少量的二氯甲烷中,过滤在加入二乙醚时生成的固体,用二乙醚清洗,从而得到了1.47g高纯度的为白色固体的23 (收率为82%)。
(3aS,3a’S,4S,4’S,6aR,6a’R)-4,4’-{5,5’-[6,6’-(5-羧基-1,3-亚苯基)双(氮烷二基)双(6-氧代己烷-6,1-二基)]双(氮烷二基)双(5-氧代戊烷-5,1-二基)}双(四氢-1H-噻吩并[3,4-d]咪唑-2(3H)-亚胺鎓)二(2,2,2-三氟乙酸盐) (11)
[化学式15]
向16.6mg (0.0346mmol)铵盐10中加入0.6mL的N,N-二甲基甲酰胺,然后加入14μ L (0.104mmol)的三乙胺使其溶解。加入30mg (0.0691mmol)的EZ-LinkR NHS-亚氨基生物素(4),在室温下搅拌了14小时。减压馏去溶剂,之后将粗产物溶解于0.5mL的甲醇中,加入138μ L (0.276mmol) 2当量的氢氧化钠水溶液,在室温下搅拌了22小时。在所生成的白色悬浮液中加入0.5mL水,用二乙醚清洗后过滤固体,用过剩的二乙醚清洗。所得粗产物通过反相HPLC (YMC-Pack ODS-AM, 梯度:0-10-11-36-37-50分钟;0-0-20-45-100-100% CH3CN的0.1% TFA MQ,斜坡时间为25分钟(20-45%),tR=24.9分钟)进行纯化,从而得到了26.0mg标题化合物11 (收率为71%,淡黄色无定形)。
(3aS,3a’S,4S,4’S,6aR,6a’R)-4,4’-{5,5’-[6,6’-(5-(2-(2-(2-氨基乙氧基)乙氧基)乙基羰基)-1,3-亚苯基)双(氮烷二基)双(6-氧代己烷-6,1-二基)]双(氮烷二基)双(5-氧代戊烷-5,1-二基)}双(四氢-1H-噻吩并[3,4-d]咪唑-2(3H)-亚胺鎓)三(2,2,2-三氟乙酸盐) (13)
[化学式16]
向17mg (0.0161mmol)双亚氨基生物素11的0.3mL N,N-二甲基甲酰胺溶液中加入5.0μL (0.0322mmol) N,N’-二异丙基碳化二亚胺 (DIC)和4.9mg (0.0322mmol) 1-羟基苯并三唑一水合物(HOBt·H2O),之后加入利用已知方法(Wilbur等人, Bioconjugate. Chem. (2010) 21, 1225)合成的8.0mg (0.0322mmol)胺12的0.15mL N,N-二甲基甲酰胺溶液,在60℃下搅拌了10小时。减压馏去溶剂后加入1mL水,水层用乙酸乙酯和二乙醚的混合溶剂(1:1)清洗,减压馏去溶剂。加入1mL 2当量的盐酸,进行超声将粗产物溶解。加入1mL水,水层用二乙醚和乙酸乙酯清洗,减压馏去溶剂。所得粗产物通过反相HPLC (YMC-Pack ODS-AM, 梯度:0-10-50-51-65分钟;10-10-30-100-100% CH3CN的0.1% TFA MQ,斜坡时间为40分钟(10-30%),tR=43.5分钟)进行纯化,从而得到了11.2mg标题化合物13 (收率为53%,淡黄色无定形)。
(3aS,3a’S,4S,4’S,6aR,6a’R)-4,4’-{5,5’-[6,6’-(5-(2-(2-(2-(3-(3’,6’-二羟基-3-氧代-3H-螺[异苯并呋喃-1,9’-呫吨]-5-基)硫脲基)乙氧基)乙氧基)乙基氨基甲酰基)-1,3-亚苯基)双(氮烷二基)双(6-氧代己烷-6,1-二基)]双(氮烷二基)双(5-氧代戊烷-5,1-二基)}双(四氢-1H-噻吩并[3,4-d]咪唑-2(3H)-亚胺鎓)二(2,2,2-三氟乙酸盐) (14)
[化学式17]
向5mg (3.84μ mol)双亚氨基生物素13的0.2mL甲醇溶液中加入4.3μ L (30.7μ mol)三乙胺和1.6mg (4.03μ mol)荧光素5-异硫氰酸酯 (FITC)。有红茶色固体析出,直接在室温下搅拌了10小时。加入1mL的甲醇进行超声,吸引过滤固体,用甲醇清洗。将固体溶解于含10%三氟乙酸的甲醇溶液中。减压馏去溶剂,所得的黄色粗产物通过反相HPLC (YMC-Triart-C18,检测波长为270nm,梯度:0-10-11-41-42-55分钟;20-20-30-60-100-100% CH3CN的0.1% TFA MQ,斜坡时间为30分钟(30-60%),tR=25.7分钟)进行纯化,从而得到了4.8mg标题化合物14 (收率为79%,淡黄色无定形)。
(3aS,3a’S,4S,4’S,6aR,6a’R)-4,4’-{5,5’-[6,6’-(5-氨基甲酰基-1,3-亚苯基)双(氮烷二基)双(6-氧代己烷-6,1-二基)]双(氮烷二基)双(5-氧代戊烷-5,1-二基)}双[四氢-1H-噻吩并[3,4-d]咪唑-2(3H)-亚胺鎓]二(2,2,2-三氟乙酸盐) (15)
[化学式18]
向5.5mg (0.011XXmmol)二胺10中加入0.23mL N,N-二甲基甲酰胺、4.8μ L (0.034mmol)三乙胺,然后加入10mg (0.023mmol)的EZ-LinkR NHS-亚氨基生物素4,在室温下搅拌了6小时。减压馏去溶剂,之后将粗产物溶解于0.5mL甲醇中,加入2mL 25%的氨水溶液,在35℃下搅拌了12小时。减压馏去溶剂后,所得粗产物通过反相HPLC (YMC-Pack ODS-AM,梯度:0-10-11-36-37-50分钟;0-0-20-45-100-100% CH3CN的0.1% TFA MQ,斜坡时间为25分钟(20-45%),tR=23.1分钟)进行纯化,从而得到了5.9mg标题化合物15 (收率为49%)。
N1,N3-双{2-[2-(2-(叔丁氧基羰基氨基)乙氧基)乙氧基]乙基}-5-(4-碘苯甲酰胺)间苯二甲酰胺(17)
[化学式19]
向利用已知方法(Wilbur等人, Bioconjugate. Chem. (1997) 8, 161)合成的0.50g (1.21mmol) 5-(4-碘苯甲酰胺)间苯二甲酸16的5mL N,N-二甲基甲酰胺溶液中加入0.556g (2.90mmol) 1-乙基-3-(3-二甲基氨基丙基)碳化二亚胺盐酸盐(WSC·HCl)和0.444g (2.90mmol) 1-羟基苯并三唑一水合物(HOBt·H2O),之后加入利用已知方法(Wilbur等人, Bioconjugate. Chem. (2010) 21, 1225)合成的0.663g (2.67mmol)胺12的1mL N,N-二甲基甲酰胺溶液,在室温下搅拌了18小时。减压馏去溶剂,之后加入乙酸乙酯和0.5当量的盐酸,用乙酸乙酯提取,有机层用0.5当量的盐酸、饱和碳酸氢钠水溶液、饱和食盐水清洗。经硫酸钠干燥后减压馏去溶剂,所得粗产物通过硅胶柱色谱(乙酸乙酯→二氯甲烷/甲醇=10:1)进行纯化,从而得到了380mg标题化合物17 (收率为36%, 黄色高粘性油状)。
N1,N3-双{2-[2-(2-氨基乙氧基)乙氧基]乙基}-5-(4-碘苯甲酰胺)间苯二甲酰胺(18)
[化学式20]
向0.350g (0.401mmol)二氨基甲酸酯体17的1mL二氯甲烷溶液中加入2mL三氟乙酸,在室温下搅拌了1小时。减压馏去溶剂,用二乙醚清洗。将其溶解于1mL的甲醇中,再通过Amberlite® IRA-400柱(碱性树脂、20mm×200mm),用甲醇洗脱。减压馏去溶剂,之后在真空下干燥,从而得到了0.258g标题化合物18 (收率为96%, 黄色无定形)。
(S)-1-叔丁基4-(2,5-二氧代吡咯烷-1-基) 2-(叔丁氧基羰基氨基)琥珀酸酯(19)
[化学式21]
向0.50g (1.73mmol) Boc-Asp(OtBu)-OH 19a和0.343g (2.08mmol) N-羟基琥珀酰亚胺的17mL N,N-二甲基甲酰胺溶液中加入0.399g (2.08mmol) 1-乙基-3-(3-二甲基氨基丙基)碳化二亚胺盐酸盐(WSC·HCl),在室温下搅拌了11小时。减压馏去溶剂,之后加入乙酸乙酯和0.5当量的盐酸,用乙酸乙酯提取,有机层用0.5当量的盐酸、饱和碳酸氢钠水溶液、饱和食盐水清洗。经硫酸钠干燥后减压馏去溶剂,从而得到了0.431g标题化合物19 (收率为63%,白色固体)。所得产物没有进行进一步的纯化操作即用于之后的反应。
(14S,14’S)-1,1’-[5-(4-碘苯甲酰胺)-1,3-亚苯基]双[14-(叔丁氧基羰基氨基)-1,12-二氧代-5,8-二氧杂-2,11-二氮杂十五烷酸]叔丁酯(20)
[化学式22]
向35.9mg (0.0412mmol)二胺18的0.8mL二噁烷和0.1mL吡啶的混合溶液中加入33.4mg (0.0865mmol)的活性酯19。在室温下搅拌了14小时,之后再加入10mg (0.0259mmol)的19,在室温下搅拌了6小时。减压馏去溶剂,之后加入乙酸乙酯和0.5当量的盐酸,用乙酸乙酯提取,有机层用0.5当量的盐酸、饱和碳酸氢钠水溶液、饱和食盐水清洗。经硫酸钠干燥后减压馏去溶剂,所得粗产物通过硅胶柱色谱(二氯甲烷/甲醇=25:1→15:1)进行纯化,从而得到了47.9mg标题化合物20 (收率为90%,黄色无定形)。
(14S,14’S)-1,1’-[5-(4-碘苯甲酰胺)-1,3-亚苯基]双(14-羧基-1,12-二氧代-5,8-二氧杂-2,11-二氮杂十四烷-14-铵)二(2,2,2-三氟乙酸盐) (21)
[化学式23]
向41mg (0.0338mmol)化合物20中加入2.0mL三氟乙酸进行溶解,在室温下搅拌了30分钟。减压馏去溶剂后加入二乙醚,从而析出了白色固体。吸引过滤固体,用二乙醚清洗,之后在真空下干燥,从而得到了30.4mg标题化合物21 (收率为80%,白色固体)。
(3aS,3a’S,4S,4’S,6aR,6a’R)-4,4’-{(14S,14’S)-1,1’-[5-(4-碘苯甲酰胺)-1,3-亚苯基]双(14-羧基-1,12,16-三氧代-5,8-二氧杂-2,11,15-三氮杂二十碳烷-20,1-二基)}双(四氢-1H-噻吩并[3,4-d]咪唑-2(3H)-亚胺鎓)二(2,2,2-三氟乙酸盐) (22)
[化学式24]
将5mg (4.43μ mol)双氨基酸21悬浮于0.2mL二噁烷和0.1mL水的混合溶剂中,然后加入18μ L (177μ mol) 1当量的氢氧化钠水溶液。在室温下搅拌了5分钟进行溶解,之后加入4.0mg (9.07μ mol)的EZ-LinkR NHS-亚氨基生物素(4)。在室温下搅拌了19小时,之后加入150μ L 2当量的氢氧化钠水溶液,再于室温下搅拌了4小时。水层用二乙醚清洗,之后减压馏去溶剂。所得粗产物通过反相HPLC (YMC-Pack ODS-AM,梯度:0-10-11-36-37-50分钟;0-0-24-49-100-100% CH3CN的0.1% TFA MQ,斜坡时间为25分钟(24-49%),tR=27.2分钟)进行纯化,从而得到了2.3mg标题化合物22 (收率为33%,白色固体)。
N,N’-[2,2’-氧代双(乙烷-2,1-二基)]双{6-[5-((3aS, 4S, 6aR)-2-氧代六氢-1H-噻吩并[3,4-d]咪唑-4-基)戊酰胺]己酰胺} (24)
[化学式25]
向21.8mg (0.0659mmol)二胺3的1.6mL N,N-二甲基甲酰胺溶液中加入23,45mg (0.132mmol)生物素N-羟基琥珀酰亚胺酯,在室温下搅拌了6小时。加入二乙醚,过滤所生成的固体。固体用1当量的盐酸、饱和碳酸钠水溶液、水、已冷却的丙酮、二乙醚清洗,在真空下干燥固体,从而得到了46.2mg标题化合物24 (收率为90%,白色固体)。
实施例2以后使用的化合物的列表:
[化学式26]
需要说明的是,亚氨基生物素长尾可以按照下述方法来合成。
[化学式27]
向3mg (0.023mmol) 6-氨基己烷酸的500μ L二噁烷和500μ L H2O的混合溶液中加入氢氧化钠水溶液,调节pH值使达到9左右。加入10mg (0.023mmol)化合物101 (市售品),搅拌了12小时,之后加入乙醚,除去了有机层。水层用盐酸进行中和、过滤。残余物用丙酮清洗,减压下馏去了溶剂。将所得固体溶解于500μ L二噁烷和500μ L H2O中,加入29%的氨水,搅拌了3小时。减压下馏去溶剂,所得晶体用二氯甲烷-甲醇的混合溶剂清洗,从而得到了4mg亚氨基生物素长尾(收率为49%,白色固体)。MS (ESI) m/z 357 (M+H)+
实施例1B:结合有螯合基的生物素变体二聚体化合物的合成
常规方法
使用JEOL ECX500 (1H NMR: 500MHz)、或JEOL ECS400 (1H NMR: 400MHz)分光计测定了核磁共振(NMR)图谱。化学位移采用相对于作为内部参照的重溶剂中的残留溶剂峰的值的形式,以ppm记载(CDCl3:δ=7.26ppm, CD3OD:δ=3.31ppm, 丙酮-d6:δ=2.05ppm, D2O: δ=4.79ppm)。使用Waters ZQ4000分光计或者连接在Agilent Technologies 1290 Infinity LC上的Agilent 6120 Quadrupole LC/MS (ESI)测定了低分解能质谱(ESI)。柱色谱使用硅胶Merk 60 (230-400 mesh ASTM)来进行。凝胶过滤色谱则使用Sephadex LH-20 lab Packs载体来进行。根据薄层色谱法(TLC)、或者低分解能质量分析来追踪反应。
反相高效液相色谱法(HPLC)使用JASCO-HPLC系统来进行。使用210nm或254nm的紫外光进行检测,流动相使用了梯度溶剂系统(乙腈/0.1%的三氟乙酸MQ溶液)。分析中使用YMC-Triart-C18 (150×4.6mL)的柱,以1mL/分钟的流速进行。分离收集则使用YMC-Triart-C18 (250×10mL)的柱,以3.5mL/分钟的流速进行。
EZ-Link (注册商标) NHS-亚氨基生物素从サーモサイエンティフィック公司购入。DOTA-NHS-酯从Macrocyclics公司购入。其他试剂从Aldrich、东京化成工业株式会社(TCI)、关东化学株式会社(Kanto)、和光纯药工业株式会社、渡边化学工业株式会社购入。只要没有特别指明,则所有的试剂和溶剂均直接使用市售品。
5-(3-(3-氧代-1-苯基-2,7,10-三氧杂-4-氮杂十二烷-12-基)脲基)间苯二甲酸二甲酯(28)
[化学式28]
向1.00g (4.78mmol) 5-氨基间苯二甲酸二甲酯(25)的20mL甲苯溶液中加入1.48g (4.99mmol)三光气,边回流边搅拌3小时。之后加入吡啶,边回流边搅拌1小时。减压馏去溶剂,在所得的粗产物26的25mL二氯甲烷、728μ L (5.24mmol)三乙胺的混合溶液中加入1.84g (6.52mmol)胺(27),室温下搅拌了1小时。减压馏去溶剂,之后加入1M的盐酸,用乙酸乙酯提取,有机层用1当量的盐酸清洗3次、用饱和食盐水清洗1次。经硫酸钠干燥后减压馏去溶剂,所得粗产物通过硅胶柱色谱(二氯甲烷/甲醇=20:1→4:1)进行纯化,从而得到了1.06g标题化合物28 (收率为43%,黄白色固体)。
5-(3-(3-氧代-1-苯基-2,7,10-三氧杂-4-氮杂十二烷-12-基)脲基)间苯二甲酸(29)
[化学式29]
向1.06g (2.05mmol)二酯体28的11.7mL四氢呋喃溶液中加入1.15g (10.5mmol)氢氧化钾的2.07mL水溶液,在室温下搅拌了8小时。加入水直至所产生的沉淀溶解,用二乙醚清洗1次。加入2M的盐酸,用乙酸乙酯提取,有机层用饱和食盐水清洗1次。经硫酸钠干燥后减压馏去溶剂,从而得到了含标题化合物29的粗产物(白色固体)。所得粗产物没有进行进一步的纯化操作即用于以后的反应。
双(2,5-二氧代吡咯烷-1-基) 5-(3-(3-氧代-1-苯基-2,7,10-三氧杂-4-氮杂十二烷-12-基)脲基)间苯二甲酸酯(30)
[化学式30]
向1.09g (2.23mmol)二羧酸29的11.1mL N,N-二甲基甲酰胺溶液中加入0.615g (5.34mmol)的N-羟基琥珀酰亚胺、1.03g (5.34mmol)的1-乙基-3-(3-二甲基氨基丙基)碳化二亚胺盐酸盐(WSC·HCl),在氩气氛中、在室温下搅拌了24小时。减压馏去溶剂,之后加入0.5M的盐酸,用乙酸乙酯提取,有机层用0.5M的盐酸清洗3次、用饱和碳酸氢钠水溶液清洗1次、用饱和食盐水清洗1次。经硫酸钠干燥后减压馏去溶剂,得到了1.2g标题化合物30 (收率为79%,白色固体)。
(2S,2’S)-6,6’-((5-(3-(3-氧代-1-苯基-2,7,10-三氧杂-4-氮杂十二烷-12-基)脲基)甲苯二甲酰基)双(氮烷二基))双(2-((叔丁氧基羰基)氨基)己烷酸) (32)
[化学式31]
向1.21g (1.76mmol)二琥珀酰亚胺体30的18.1mL N,N-二甲基甲酰胺、1.48mL (10.6mmol)三乙胺的混合溶液中加入974mg (3.52mmol)的Nα-Boc-L-赖氨酸(31),在室温下搅拌了10小时。减压馏去溶剂,之后加入水、1M的盐酸,用乙酸乙酯提取,有机层用饱和食盐水清洗1次。经硫酸钠干燥后减压馏去溶剂,将所得粗产物溶解于少量的二氯甲烷中,吸引过滤通过二乙醚而析出的沉淀,从而得到了1.68g标题化合物32 (收率为quant.(定量的),白色固体)。
(2S,2’S)-二甲基 6,6’-((5-(3-(3-氧代-1-苯基-2,7,10-三氧杂-4-氮杂十二烷-12-基)脲基)甲苯二甲酰基)双(氮烷二基))双(2-((叔丁氧基羰基)氨基)己酸酯) (33)
[化学式32]
用冰浴冷却100mg (106μ mol)二氨基甲酸酯体32的530μ L甲醇溶液,加入350μ L (700μ mol)的重氮甲烷(2.0M的二乙醚溶液),在冰浴上搅拌了5分钟。加入乙酸,减压馏去溶剂,所得粗产物通过硅胶柱色谱(二氯甲烷/甲醇=20:1→10:1)进行纯化,从而得到了91.8mg标题化合物33 (收率为89%,黄色高粘性油状)。
(2S,2’S)-二甲基 6,6’-((5-(3-(3-氧代-1-苯基-2,7,10-三氧杂-4-氮杂十二烷-12-基)脲基)甲苯二甲酰基)双(氮烷二基))双(2-氨基己酸酯)二(2,2,2-三氟乙酸盐) (34)
[化学式33]
向89.9mg (92.3 μ mol)二氨基甲酸酯体33的2mL水溶液中加入2mL三氟乙酸,在室温下搅拌了1.5小时。减压馏去溶剂,之后在真空下干燥,从而得到了含标题化合物34的粗产物(黄色高粘性油状)。所得粗产物没有进行进一步的纯化操作即用于以后的反应。
(R,S,S,2S,2’S)-二甲基 6,6’-((5-(3-(3-氧代-1-苯基-2,7,10-三氧杂-4-氮杂十二烷-12-基)脲基)甲苯二甲酰基)双(氮烷二基))双(2-(5-((3aS,4S,6aR)-2-亚氨基六氢-1H-噻吩并[3,4-d]咪唑-4-基)戊酰胺)己酸酯)二(2,2,2-三氟乙酸盐) (35)
[化学式34]
向10.0mg (10.3 μ mol)二胺34的200μ L N,N-二甲基甲酰胺、14.4μ L (10.3μ mol)三乙胺的混合溶液中加入9.0mg (20.7μ mol)的EZ-LinkR NHS-亚氨基生物素(4),在室温下搅拌了21小时。减压馏去溶剂,所得粗产物通过凝胶过滤色谱(甲醇)进行纯化,从而得到了5.6mg标题化合物35 (收率为39%,黄色高粘性油状)。
(R,S,S,2S,2’S)-二甲基 6,6’-((5-(3-(2-(2-(2-氨基乙氧基)乙氧基)乙基)脲基)甲苯二甲酰基)双(氮烷二基))双(2-(5-((3aS,4S,6aR)-2-亚氨基六氢-1H-噻吩并[3,4-d]咪唑-4-基)戊酰胺)己酸酯)三(2,2,2-三氟乙酸盐) (36)
[化学式35]
向5.8mg (4.1μ mol)双亚氨基生物素35的50μ L水溶液中加入1mL三氟乙酸,在50℃下搅拌了2小时。减压馏去溶剂,所得粗产物通过反相HPLC (0.0-20.0-20.5-60.5-61.0-75.0分钟;5.0-5.0-17.5-57.5-100.0- 100.0% CH3CN的0.1% TFA MQ,斜坡时间为40分钟(17.5-57.5%),tR=36.5分钟)进行纯化,从而得到了2.5mg标题化合物36 (收率为45%,黄色高粘性油状)。
2,2’,2’’-(10-(1-((3,5-双(((S)-5-(5-((3aS,4S,6aR)-2-亚氨基六氢-1H-噻吩并[3,4-d]咪唑-4-基)戊酰胺)-6-甲氧基-6-氧代己基)氨基甲酰基)苯基)氨基)-1,12-二氧代-5,8-二氧杂-2,11-二氮杂十三烷-13-基)-1,4,7,10-四氮杂环十二烷-1,4,7-三基)三乙酸三(2,2,2-三氟乙酸盐) (38)
[化学式36]
向10.0mg (7.24 μ mol)双亚氨基生物素36的100μ L N,N-二甲基甲酰胺、15.1μ L (10.9μ mol)三乙胺的混合溶液中加入6.1mg (7.96μ mol)的DOTA-NHS-酯(37),在室温下搅拌了20小时。减压馏去溶剂,所得粗产物通过反相HPLC (0.0-20.0-20.5-60.5-61.0-75.0分钟;5.0-5.0-17.5-57.5-100.0-100.0% CH3CN的0.1% TFA MQ,斜坡时间为40分钟(17.5-57.5%),tR=35.2分钟)进行纯化,从而得到了2.0mg标题化合物38 (收率为16%,黄色高粘性油状)。
实施例1C:结合有色素、螯合基或药物的生物素变体二聚体化合物的合成
使用JEOL ECX500 (1H NMR: 500MHz)、或JEOL ECS400 (1H NMR: 400MHz)分光计测定了核磁共振(NMR)图谱。化学位移采用相对于作为内部参照的重溶剂中的残留溶剂峰的值的形式,以ppm记载(CDCl3:δ= 7.26 ppm, CD3OD:δ= 3.31 ppm)。低分解能质谱(ESI)使用Waters ZQ4000分光计或者连接在Agilent Technologies 1290 Infinity LC上的Agilent 6120 Quadrupole LC/MS (ESI)来测定。柱色谱使用硅胶Merk 60 (230-400 mesh ASTM)来进行,反相柱色谱使用ワコーシルR 40C18 (30~50μ m 70%以上)来进行,凝胶过滤柱色谱则使用Sephadex LH-20 lab Packs载体来进行。根据薄层色谱法(TLC)、或者低分解能质量分析来追踪反应。
反相高效液相色谱法(HPLC)使用JASCO-HPLC系统来进行。利用210nm或254nm的紫外光进行检测,流动相使用了梯度溶剂系统(乙腈/0.1%的三氟乙酸MQ溶液、或0.1%的甲酸MQ溶液)。分析中使用YMC-Triart-C18 (150×4.6mL)柱,以1mL/分钟的流速进行。分离收集则使用YMC-Triart-C18 (250×10mL)柱,以3.5mL/分钟的流速进行。
DOTA-NHS-酯从Macrocyclics公司购入。IRDyeR 800CW NHS酯从LI-COR公司购入。其他试剂从Aldrich、东京化成工业株式会社(TCI)、关东化学株式会社(Kanto)、和光纯药工业株式会社、渡边化学工业株式会社购入。只要没有特别指明,则所有的试剂和溶剂均直接使用市售品。
(3aS,4S,6aR)-4-(5-((2,5-二氧代吡咯烷-1-基)氧基)-5-氧代戊基)四氢-1H-噻吩并[3,4-d]咪唑-2(3H)-亚胺鎓2,2,2-三氟乙酸盐(41)
[化学式37]
向88.0mg (0.36mmol)的2-亚氨基生物素39中加入三氟乙酸,搅拌后减压馏去过剩的三氟乙酸。在得到的白色固体的3.4mL乙腈溶液中加入82.5μ L (0.72mmol)吡啶、175mg (1.08mmol)二琥珀酰亚胺40,在30℃下搅拌了11小时。减压馏去溶剂,之后在真空下干燥,从而得到了含标题化合物41的粗产物(黄色高粘性油状)。所得粗产物没有进行进一步的纯化操作即用于以后的反应。
(R,S,S,2S,2’S)-二甲基 6,6’-((5-(3-(3-氧代-1-苯基-2,7,10-三氧杂-4-氮杂十二烷-12-基)脲基)甲苯二甲酰基)双(氮烷二基))双(2-(5-((3aS,4S,6aR)-2-亚氨基六氢-1H-噻吩并[3,4-d]咪唑-4-基)戊酰胺)己酸酯)二(2,2,2-三氟乙酸盐) (35)
[化学式38]
向78.5mg (81.1μ mol)二胺34的5.0mL N,N-二甲基甲酰胺、339μ L (2.43mmol)三乙胺的混合溶液中加入由88.0mg (0.36mmol)的2-亚氨基生物素39调制的酯41,在室温下搅拌了21小时。减压馏去溶剂,所得粗产物通过反相硅胶柱色谱(水/甲醇=2:1→1:2)进行纯化,从而得到了59.3mg标题化合物35(收率为52%,黄色高粘性油状)。
(R,S,S,2S,2’S)-二甲基 6,6’-((5-(3-(2-(2-(2-氨基乙氧基)乙氧基)乙基)脲基)甲苯二甲酰基)双(氮烷二基))双(2-(5-((3aS,4S,6aR)-2-亚氨基六氢-1H-噻吩并[3,4-d]咪唑-4-基)戊酰胺)己酸酯)三(2,2,2-三氟乙酸盐) (36)
[化学式39]
向59.3mg (41.8μ mol)双亚氨基生物素35的400μ L水溶液中加入8.0mL三氟乙酸,在50℃下搅拌了4小时。减压馏去溶剂,所得粗产物通过反相硅胶柱色谱(水/甲醇=2:1→1:2)进行纯化,从而得到了37.1mg标题化合物36 (收率为64%,黄色高粘性油状)。
2,2’,2’’-(10-(1-((3,5-双(((S)-5-(5-((3aS,4S,6aR)-2-亚氨基六氢-1H-噻吩并[3,4-d]咪唑-4-基)戊酰胺)-6-甲氧基-6-氧代己基)氨基甲酰基)苯基)氨基)-1,12-二氧代-5,8-二氧杂-2,11-二氮杂十三烷-13-基)-1,4,7,10-四氮杂环十二烷-1,4,7-三基)三乙酸三甲酸(42)
[化学式40]
向23.4mg (16.9μ mol)双亚氨基生物素36的234μ L甲醇、35.4μ L (253μ mol)三乙胺的混合溶液中加入25.8mg (24.9μ mol)的DOTA-NHS-酯37,在室温下搅拌了13小时。减压馏去溶剂,所得粗产物通过反相HPLC (0.0-20.0-20.5-60.5-61.0-75.0分钟;5.0-5.0-17.5-57.5-100.0- 100.0% CH3CN的0.1% HCOOHMQ,斜坡时间为40分钟(17.5-57.5%),tR=31.5分钟)进行纯化,从而得到了3.55mg标题化合物42 (收率为13%,黄色高粘性油状)。
1-(1-((3,5-双(((S)-5-(5-((3aS,4S,6aR)-2-亚氨基六氢-1H-噻吩并[3,4-d]咪唑-4-基)戊酰胺)-6-甲氧基-6-氧代己基)氨基甲酰基)苯基)氨基)-1,12-二氧代-5,8-二氧杂-2,11-二氮杂十七烷-17-基)-2-((E)-2-((E)-3-(2-((E)-3,3-二甲基-5-磺基-1-(4-磺丁基)二氢吲哚-2-亚基)亚乙基)-2-(4-磺基苯氧基)环己-1-烯-1-基)乙烯基)-3,3-二甲基-3H-吲哚-1-鎓-5-磺酸盐(44)
[化学式41]
向1.13mg (0.82μ mol)双亚氨基生物素36的200μ L N,N-二甲基甲酰胺、2.17μ L (15.6μ mol)三乙胺的混合溶液中加入2.41mg (2.06μ mol)的IRDyeR 800CW NHS酯(43),在室温下搅拌了17小时。减压馏去溶剂,所得粗产物通过反相HPLC (0.0-20.0-20.5-60.5-61.0-75.0分钟;5.0-5.0-17.5-57.5-100.0-100.0% CH3CN的0.1% TFA MQ,斜坡时间为40分钟(17.5-57.5%),tR=40.9分钟)进行纯化,从而得到了0.65mg标题化合物44 (收率为34%,绿色高粘性油状)。
(2-(2-(2-(3-(3,5-双((2-(2-((叔丁氧基羰基)酰胺)乙氧基)乙基)氨基甲酰基)苯基)脲基)乙氧基)乙氧基)乙基)氨基甲酸苄酯(46)
[化学式42]
向198mg (0.290mmol)二琥珀酰亚胺体30的1.9mL N,N-二甲基甲酰胺溶液中加入按照已知方法(Arano等人, Bioorg. Med. Chem. (2012) 20, 978)合成的118mg (0.580mmol)胺45 (1mL的N,N-二甲基甲酰胺溶液),在室温下搅拌了6小时30分钟。再加入59mg (0.290mmol)胺45 (0.5mL的N,N-二甲基甲酰胺溶液),在室温下搅拌了13小时。减压馏去溶剂后加入乙酸乙酯,用1M的氢氧化钠水溶液、1M的盐酸、饱和食盐水清洗。经硫酸钠干燥后减压馏去溶剂,所得粗产物通过硅胶柱色谱(二氯甲烷/己烷=1:30→1:20→1:10→1:5)进行纯化,从而得到了83.7mg标题化合物46 (收率为33%,白色固体)。
(2-(2-(2-(3-(3,5-双((2-(2-氨基乙氧基)乙基)氨基甲酰基)苯基)脲基)乙氧基)乙氧基)乙基)氨基甲酸苄酯 二(2,2,2-三氟乙酸盐) (48)
[化学式43]
冰冷下向26.6mg (31μ mol)二氨基甲酸酯体47的400μ L水溶液中加入200μ L三氟乙酸,搅拌30分钟后升至室温,再搅拌1.5小时。减压馏去溶剂,之后在真空下干燥,从而得到了34.0mg含标题化合物48的粗产物(无色液体)。所得粗产物没有进行进一步的纯化操作即用于以后的反应。
(2-(2-(2-(3-(3,5-双((2-(2-(5-((3aS,4S,6aR)-2-亚氨基六氢-1H-噻吩并[3,4-d]咪唑-4-基)戊酰胺)乙氧基)乙基)氨基甲酰基)苯基)脲基)乙氧基)乙氧基)乙基)氨基甲酸苄酯 二(2,2,2-三氟乙酸盐) (49)
[化学式44]
向准备有由16.6mg (68μ mol) 2-亚氨基生物素39调制的41的试管中加入25.2mg二胺48的420μ L的N,N-二甲基甲酰胺溶液和40.1μ L (23μ mol)的二异丙基乙胺,在室温下搅拌了12小时。减压馏去溶剂,所得粗产物通过反相硅胶柱色谱(甲醇/水=2:1,0.3%的TFA)进行纯化,从而得到了28.8mg标题化合物49 (无色液体)。
5-(3-(2-(2-(2-氨基乙氧基)乙氧基)乙基)脲基)-N1,N3-双(2-(2-(5-((3aS,4S,6aR)-2-亚氨基六氢-1H-噻吩并[3,4-d]咪唑-4-基)戊酰胺)乙氧基)乙基)间苯二甲酰胺 三(2,2,2-三氟乙酸盐) (50)
[化学式45]
向6.9mg (5.3μ mol)双亚氨基生物素49中加入1mL三氟乙酸和50μ L水的混合溶液,升温至50℃,搅拌了1小时30分钟。减压馏去溶剂,之后在真空下干燥,从而得到了5.3mg含标题化合物50的粗产物(无色液体)。所得粗产物没有进行进一步的纯化操作即用于以后的反应。
2,2’,2’’-(10-(1-((3,5-双((2-(2-(5-((3aS,4S,6aR)-2-亚氨基六氢-1H-噻吩并[3,4-d]咪唑-4-基)戊酰胺)乙氧基)乙基)氨基甲酰基)苯基)氨基)-1,12-二氧代-5,8-二氧杂-2,11-二氮杂十三烷-13-基)-1,4,7,10-四氮杂环十二烷-1,4,7-三基)三乙酸 三(2,2,2-三氟乙酸盐) (51)
[化学式46]
向2.4mg (1.9μ mol)双亚氨基生物素50的100μ L甲醇和10μ L (72μ mol)三乙胺的混合溶液中加入3.5mg (4.6μ mol) DOTA-NHS-酯37,在室温下搅拌了21小时。减压馏去溶剂,所得粗产物通过反相HPLC (0.0-20.0-20.5-60.5-61.0-75.0分钟;5.0-5.0-17.5-57.5-100.0-100.0% CH3CN的0.1% TFA MQ,斜坡时间为40分钟(17.5-57.5%),tR=32.6分钟)进行纯化,从而得到了标题化合物51 (黄色高粘性油状)。
5-(3-(2-(2-(2-(3’,6’-二羟基-3-氧代-3H-螺[异苯并呋喃-1,9’-呫吨]-5(6)-基甲酰胺)乙氧基)乙氧基)乙基)脲基)-N1,N3-双(2-(2-(5-((3aS,4S,6aR)-2-亚氨基六氢-1H-噻吩并[3,4-d]咪唑-4-基)戊酰胺)乙氧基)乙基)间苯二甲酰胺(52)
[化学式47]
向4.3mg (3.4μ mol)双亚氨基生物素50的100μ L甲醇和9.5μ L (68μ mol)三乙胺的混合溶液中加入4.8mg (10μ mol)的5(6)-羧基荧光素N-羟基琥珀酰亚胺酯51,在室温下搅拌了16小时。减压馏去溶剂,所得粗产物通过反相柱色谱(甲醇/水=1:1→2:1,0.5%的TFA)进行纯化,再通过Sephadex 20LH (甲醇,1%的TFA)进行纯化,从而得到了2.2mg标题化合物52 (收率为49%)。
(S)-(S)-9-((叔丁氧基羰基)氧基)-4,11-二乙基-3,14-二氧代-3,4,12,14-四氢-1H-吡喃并[3’,4’:6,7]吲嗪并[1,2-b]喹啉-4-基 2-(((苄基氧基)羰基)氨基)丙酸酯(55)
[化学式48]
冰冷下向按照已知方法(Bioconjugate Chem. (2008) 19, 849.)合成的20.0mg (41μmol) SN38 Boc保护体53和12.7mg (57μ mol) Cbz-Ala-OH 54的480μ L二氯甲烷溶液中加入12.7mg (66μ mol)的1-乙基-3-(3-二甲基氨基丙基)碳化二亚胺盐酸盐(WSC·HCl)、1.5mg (12μ mol)的二甲基氨基吡啶,缓慢升至室温,搅拌了11小时30分钟。加入二氯甲烷,用碳酸氢钠水溶液、水、0.1M的盐酸、饱和食盐水清洗。经硫酸钠干燥后减压馏去溶剂,所得粗产物通过硅胶柱色谱(二氯甲烷/甲醇=30:1)进行纯化,从而得到了26.8mg标题化合物55 (收率为95%,淡黄色固体)。
(S)-(S)-9-((叔丁氧基羰基)氧基)-4,11-二乙基-3,14-二氧代-3,4,12,14-四氢-1H-吡喃并[3’,4’:6,7]吲嗪并[1,2-b]喹啉-4-基 2-氨基丙酸酯(56)
[化学式49]
向11.3mg (16μ mol) 55的320μ L乙酸乙酯溶液中加入1.7mg Pd/C,将容器内置换成氢气氛,之后在室温下搅拌16小时、在40℃下搅拌1小时,进行了硅藻土(Celite)过滤。减压馏去溶剂,所得粗产物通过薄层色谱法(二氯甲烷/甲醇=30:1)进行纯化,从而得到了2.3mg标题化合物56 (收率为26%)。
(S)-(S)-9-((叔丁氧基羰基)氧基)-4,11-二乙基-3,14-二氧代-3,4,12,14-四氢-1H-吡喃并[3’,4’:6,7]吲嗪并[1,2-b]喹啉-4-基 2-异氰酸酯丙酸酯(57)
[化学式50]
在冰冷下向2.3mg (4.1μ mol) 56的100μ L二氯甲烷溶液中加入3.3mg (11μ mol)三光气、5.0μ L (62μ mol)吡啶,升至室温,搅拌了2小时。减压馏去溶剂,之后在真空下干燥,从而得到了含标题化合物57的粗产物(褐色液体)。所得粗产物没有进行进一步的纯化操作即用于以后的反应。
(S)-(S)-9-((叔丁氧基羰基)氧基)-4,11-二乙基-3,14-二氧代-3,4,12,14-四氢-1H-吡喃并[3’,4’:6,7]吲嗪并[1,2-b]喹啉-4-基 1-((3,5-双((2-(2-(5-((3aS,4S,6aR)-2-亚氨基六氢-1H-噻吩并[3,4-d]咪唑-4-基)戊酰胺)乙氧基)乙基)氨基甲酰基)苯基)氨基)-14-甲基-1,12-二氧代-5,8-二氧杂-2,11,13-三氮杂十五烷-15-酸酯 三(2,2,2-三氟乙酸盐) (58)
[化学式51]
向3.4mg (2.7μ mol)双亚氨基生物素50和含57的粗产物的200μ L甲醇溶液中加入10μL (72μ mol)的三乙胺,在室温下搅拌了15小时。减压馏去溶剂,所得粗产物通过反相薄层色谱法(甲醇/水=3:1,1%的TFA)进行纯化,从而得到了1.5mg标题化合物58 (收率为30%)。
(S)-(S)-4,11-二乙基-9-羟基-3,14-二氧代-3,4,12,14-四氢-1H-吡喃并[3’,4’:6,7]吲嗪并[1,2-b]喹啉-4-基 1-((3,5-双((2-(2-(5-((3aS,4S,6aR)-2-亚氨基六氢-1H-噻吩并[3,4-d]咪唑-4-基)戊酰胺)乙氧基)乙基)氨基甲酰基)苯基)氨基)-14-甲基-1,12-二氧代-5,8-二氧杂-2,11,13-三氮杂十五烷-15-酸酯 二(2,2,2-三氟乙酸盐) (59)
[化学式52]
向1.5mg (0.8μ mol)双亚氨基生物素58的100μ L水溶液中加入100μ L三氟乙酸,在室温下搅拌了1小时30分钟。减压馏去溶剂,所得粗产物通过反相薄层色谱法(甲醇/水=3:1,1%的TFA)进行纯化,从而得到了0.4mg标题化合物59 (收率为29%)。
实施例2:LISA314的突变体V21和V212的表达和晶体结构分析
编码野生型核心链霉亲和素的基因的核苷酸序列见序列表的SEQ ID NO: 1。在本发明中,作为低免疫原性(变体)链霉亲和素,使用了国际公开WO2010/09455中记载的mcSA314 (在本说明书中还称作LISA314WT或LISA314)。mcSA314是在SEQ ID NO: 2所记载的核心链霉亲和素的氨基酸序列中具有以下的所有突变的链霉亲和素突变体。
(1) 第10位氨基酸残基的酪氨酸取代成了丝氨酸的突变;
(2) 第71位氨基酸残基的酪氨酸取代成了丝氨酸的突变;
(3) 第72位氨基酸残基的精氨酸取代成了赖氨酸的突变;
(4) 第89位氨基酸残基的谷氨酸取代成了天冬氨酸的突变;
(5) 第91位氨基酸残基的精氨酸取代成了赖氨酸的突变;以及
(6) 第104位氨基酸残基的谷氨酸取代成了天冬酰胺的突变。
依照PrimerSTAR Mutagenesis Basal试剂盒(タカラバイオ)的说明书,将用于制作各突变体的寡DNA设计成了在5’侧有15个核苷酸重叠。使用下述引物,以插入有LISA314的pCold TF载体为模板,利用位点定向诱变法通过取代核苷酸序列来变更密码子序列,进行了氨基酸序列的变换。之后,用限制酶DpnI切断模板质粒,进行了大肠杆菌的转化。
引物:
LISA314 V21 Fw: TGGAGCgatCAGCTGGGCgatACCTTT (SEQ ID NO: 5);
LISA314 V21 Rv: CAGCTGatcGCTCCAGGTGCCGGTAAT (SEQ ID NO: 6)。
作为LISA314突变体的LISA314 V21 (以下还称作V21)相对于LISA314还具有N23D、S27D的突变。N23D是指在SEQ ID NO: 2所记载的核心链霉亲和素的氨基酸序列中第11位氨基酸残基的天冬酰胺(N)取代成了天冬氨酸(D)的突变。S27D是指在SEQ ID NO: 2所记载的核心链霉亲和素的氨基酸序列中第15位氨基酸残基的丝氨酸(S)取代成了天冬氨酸(D)的突变。
即,V21是在SEQ ID NO: 2所记载的核心链霉亲和素的氨基酸序列中具有下述突变的突变体链霉亲和素:
(1) 第10位氨基酸残基的酪氨酸取代成了丝氨酸的突变;
(2) 第71位氨基酸残基的酪氨酸取代成了丝氨酸的突变;
(3) 第72位氨基酸残基的精氨酸取代成了赖氨酸的突变;
(4) 第89位氨基酸残基的谷氨酸取代成了天冬氨酸的突变;
(5) 第91位氨基酸残基的精氨酸取代成了赖氨酸的突变;
(6) 第104位氨基酸残基的谷氨酸取代成了天冬酰胺的突变;
(7) 第11位氨基酸残基的天冬酰胺取代成了天冬氨酸的突变;
(8) 第15位氨基酸残基的丝氨酸取代成了天冬氨酸的突变。
依照PrimerSTAR Mutagenesis Basal试剂盒(タカラバイオ)的说明书,将用于制作V21的进一步的突变体的寡DNA设计成了在5’侧有15个核苷酸重叠。使用下述引物,以插入有上述的V21的载体为模板,利用位点定向诱变法通过取代核苷酸序列来变更密码子序列,进行了氨基酸序列的变换。之后,用限制酶DpnI切断模板质粒,进行了大肠杆菌的转化。
引物
S45N Fw: TATGAAAACGCCGTGGGTAATGCGGAA(SEQ ID NO:7);
S45N Rv: CACGGCGTTTTCATAGGTGCCGGTCAG (SEQ ID NO: 8)。
S45N表示在SEQ ID NO: 2记载的核心链霉亲和素的氨基酸序列中第33位氨基酸残基的丝氨酸取代成了天冬酰胺(N)。即,制备了向V21中进一步导入了S45N的氨基酸突变的突变体LISA314 V212 (以下还称作V212)。该突变体的氨基酸序列见序列表的SEQ ID NO: 3。
[2] V212蛋白的表达、纯化
V212蛋白通过大肠杆菌(BL21(DE3)株)表达后以内含体的形式回收,通过稀释法进行解链,再进行亲和纯化和凝胶过滤纯化,从而得到了四聚体形成组分。具体而言,将已纯化的内含体用变性缓冲液(6M的盐酸胍、50mM的Tris-HCl、200mM的NaCl、1mM的EDTA、在4℃下pH8.0)溶解一晚。在吸光度n=280下测定已溶解的溶液时浓度为50mg/mL,因此将100微升(相当于5mg)的溶解液边搅拌边滴入50mL的重折叠缓冲液(50mM的Tris-HCl、300mM的NaCl、1mM的EDTA、400mM的精氨酸-HCl,在4℃下pH8.0)中,在4℃下静置保存。为了进行稳定的解链,保存时间设为2天。保存2天后,使用Ni-NTA树脂(cOmplete His-Tag纯化树脂;Roche)进行了亲和纯化。之后,通过凝胶过滤纯化(HiLoad 16/60 Superdex 200pg GE Healthcare公司制造)分馏了四聚体组分。
[3] V21和V212的结晶化方法
蛋白与化合物的复合体的纯化如下进行。将通过稀释法解链后的蛋白经Ni-NTA树脂的亲和纯化进行浓缩,将溶剂置换成PBS后,以1:8的摩尔比添加化合物C,培养1小时,之后通过凝胶过滤柱得到了四聚体组分。将这些纯化物通过超滤柱(VIVASPIN20)进行浓缩,直至达到10mg/mL的浓度。
结晶化通过坐滴式蒸气扩散法来实施。结晶化在温度20℃下进行。使用蛋白与储存溶液(0.2M的氟化钠、20%的PEG 3350)以0.5微升:0.5微升的比例混合的液滴对60微升的储存溶液进行了平衡化。另外,使用6%的甘油溶液作为防冻剂。
[4] 晶体的分析方法
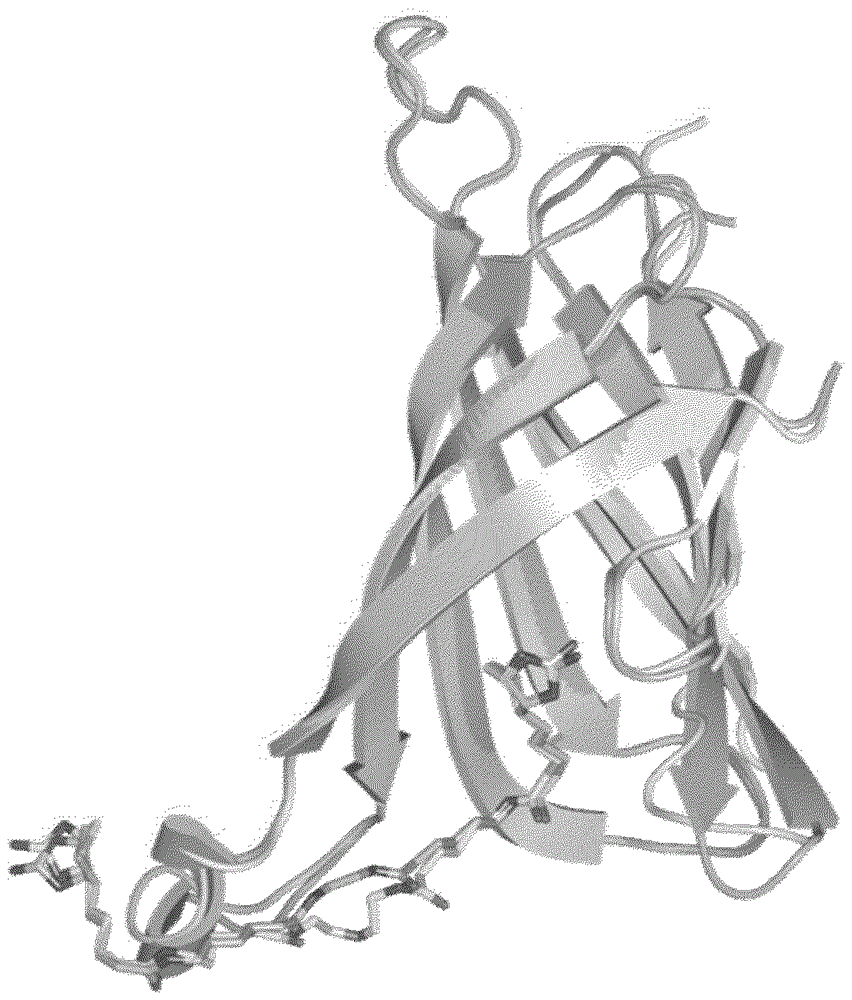
回收的强度数据通过Spring 8 BL44XU来收集。关于所收集的数据,使用Phaser (分子置换程序),利用以之前实施了结构分析的V21与亚氨基生物素长尾的共结晶数据(图1)作为模型分子的分子置换法确定了V212的晶体结构的位相。使用REFMAC5进行了精密化。
[5] 晶体结构的分析结果
在分析V212与化合物C的共结晶结构时,如图2所示,形成了环结构已开环的状态。作为其原因,暗示了N45与N49 (序列表3的第33位和第37位)形成的氢键关系较大(图2)。
实施例3:V2122的设计、表达和纯化
为了将开环状态的环结构形成闭环结构,认为需要抑制N45与N49 (序列表3的第33位和第37位的氨基酸)形成的氢键。因此,将SEQ ID NO: 3所记载的氨基酸序列的相当于第37位的天冬酰胺(N)改变成了丙氨酸(A)、甘氨酸(G)、丝氨酸(S)。将这些突变记作N49A、N49G、N49S。表达方法与上述的方法相同,使用下述的引物组,利用位点定向诱变法通过期释放进行了突变体表达载体的构建。
引物组:
N49A Fw: GTGGGTgcgGCGGAAAGCCGTTATGTT (SEQ ID NO: 9);
N49A Rv: TTCCGCcgcACCCACGGCattTTCATA (SEQ ID NO: 10);
N49G Fw: GTGGGTggtGCGGAAAGCCGTTATGTT(SEQ ID NO: 11);
N49G Rv: TTCCGCaccACCCACGGCattTTCATA (SEQ ID NO: 12);
N49S Fw: GTGGGTagcGCGGAAAGCCGTTATGTT(SEQ ID NO: 13);
N49S Rv: TTCCGCgctACCCACGGCattTTCATA (SEQ ID NO: 14)。
关于突变体蛋白的表达和纯化,按照与上述相同的方式将内含体改性,经稀释法解链来进行。在通过SDS-PAGE分析已进行了解链的纯化蛋白的四聚体形成时,如图3所示,已知甘氨酸突变体的四聚体形成率最高,而其他的丙氨酸、丝氨酸突变体的四聚体形成率低。因此,今后决定使用甘氨酸突变体(N49G),并将该突变体作为LISA314-V2122 (以下记作V2122)。V2122的氨基酸序列记载在序列表的SEQ ID NO: 4中。
实施例4:V2122和化合物的ITC结合分析
使用Microcal iTC200 (MicroCal, Northampton, MA)进行了测定。已纯化的V2122用PBS在4℃下透析一夜,使用透析外液调制了化合物C和生物素、母液。进行测定时,调整母液浓度使达到将要测定的V2122的10倍浓度后再使用。向量热计的小池(Cell)内导入25μ M的V2122,在1000rpm的搅拌速度下、在25℃下滴加各溶液。所得数据用ORIGIN进行分析,滴定曲线通过单点结合等温线(one-site binding isotherm)进行拟合。
结果见图4。
由ITC的结果可以确认:V2122与化合物C的相互作用显示出放热反应,两者进行了强结合。另一方面,V2122和生物素既没有显示出放热反应、也没有显示出吸热反应,由此确认两者没有发生相互作用。
实施例5:免疫原性试验
(1) 蛋白的调制
免疫原性试验用蛋白的表达载体使用了下述表达载体:使用以下的引物组,通过位点定向诱变法对上述的表达载体实施改变使附加在N末端的T7-tag不表达而获得的表达载体。
引物组
T7tagRemove Fw: tacatatgGCCGAAGCAGGTATTACC (SEQ ID NO: 15);
T7tagRemove Rv: CTTCGGCcatatgtatatctccttc (SEQ ID NO: 16)。
目标蛋白经大肠杆菌(BL21(DE3)株)表达后以内含体的形式回收,通过稀释法进行解链,再进行亲和纯化和凝胶过滤纯化,从而得到了四聚体形成组分。具体而言,将已纯化了的内含体用变性缓冲液(6M的盐酸胍、50mM的Tris-HCl、200mM的NaCl、1mM的EDTA、在4℃下pH8.0)溶解一晚。测定溶液的吸光度280,将5mg份的溶解液边搅拌边滴加到50mL的重折叠缓冲液(50mM的Tris-HCl、300mM的NaCl、1mM的EDTA、400mM的精氨酸-HCl、在4℃下pH8.0)中,在4℃下静置保存。为了进行稳定的解链,保存时间设定为2天。保存2天后,使用Ni-NTA树脂(cOmplete His-Tag纯化树脂;Roche)进行了亲和纯化。之后,使用生理盐水作为缓冲液,通过凝胶过滤纯化(HiLoad 16/60 Superdex 200pg GE Healthcare公司制造)分馏了四聚体组分。
(2) 免疫原性试验
使用4只食蟹猴进行免疫原性试验。给予3次1mg的纯化蛋白。在给药前进行采血以制备阴性对照血清,给予3次1mg的纯化蛋白。具体而言,以初次给药日作为第0天时,第2次给药日为第21天、第3次给药日为第42天。另外,V2122是在第7、14、28、35天进行采血并调制血清样品,而除此以外的样品是在第7、14、28、35、49、56天进行采血,并调制了血清样品。
血清样品中的抗V2122抗体的分析通过表面等离子体共振(SPR)来进行。具体而言,利用测定仪在使用Biacore T200 (GE Healthcare)免疫原性软件包(Immunogenicity Package)的模式下进行了测定。传感器芯片使用CM5,按照操作手册使用胺偶联试剂盒将10µ g/mL的V2122蛋白固定在CM5传感器芯片上。血清经运行缓冲液(HBS-EP、GE Healthcare Bioscience)稀释10倍,进行了相互作用分析。具体而言,用5分钟将稀释了10倍的血清以10µ L/分钟加载到运行缓冲液中。得到的传感图通过分析软件Biacore T200评估软件进行了分析。
结果见图5。结果显示:与野生型链霉亲和素和LISA314的免疫原性相比,V2122的免疫原性低。
实施例6:V2122与化合物的亲和力分析
使用通过上述方法纯化的LISA314变体蛋白V2122,通过表面等离子体共振(SPR)分析了其与化合物C的相互作用。具体而言,使用Biacore T200 (GE Healthcare)作为测定仪,传感器芯片使用传感器芯片NTA(GE Healthcare),利用与核蛋白融合了的His-Tag将蛋白固定在传感器芯片上。运行缓冲液使用HBS-P(+),如操作手册所记载,调制了缓冲液。关于化合物的稀释系列,使用运行缓冲液从1600nM起调整了2倍稀释的9个系列。在亲和力的测定中利用动力学模型获得了数据。使用Biacore T200评估软件进行了所得数据的平行值分析,算出了亲和力。
V2122与生物素的解离常数(M)未检出,V2122与双亚氨基生物素(化合物7)的解离常数(M)为3.15×10-9。
实施例7:V2122与化合物的共结晶结构分析
在晶体结构分析中,使用了与免疫原性试验相同的除去了T7-Tag的蛋白。蛋白的表达使用大肠杆菌BL21-codonplus RIL,用2xYT培养基进行培养,回收了内含体。所回收的内含体用6M的GdnHCl (pH1.5)溶解,使用重折叠缓冲液(50mM的Tris-HCl、300mM的NaCl、1mM的EDTA、400mM的精氨酸-HCl、在4℃下pH8.0),按照上述的稀释法进行解链,在4℃下静置、保存。为了进行稳定的解链,保存时间设为2天。保存2天后,使用Ni-NTA树脂(cOmplete His-Tag纯化树脂; Roche)进行了亲和纯化。之后,使用PBS作为缓冲液,通过凝胶过滤纯化(HiLoad 16/60 Superdex 200pg GE Healthcare公司制造)分馏了四聚体组分。
对于已纯化的四聚体组分以1:8的摩尔比添加化合物C或化合物D,培养1小时。之后,使用超滤柱(VIVASPIN20)将缓冲液置换成20mM的tris-HCl (pH7.5)、200mM的NaCl,同时进行浓缩直至浓度为10mg/mL。
(1) V2122和化合物C的共结晶化
结晶化利用坐滴式蒸气扩散法来实施。结晶化在温度20℃下进行。使用蛋白与储存溶液(0.2M的柠檬酸钠三元脱水物、20% (w/v)的PEG 3350)以0.1微升:0.1微升的比例混合的液滴对60微升的储存溶液进行了平衡化。另外,使用25%的甘油溶液作为防冻剂。
(2) V2122和化合物D的共结晶化
结晶化利用坐滴式蒸气扩散法来实施。结晶化在温度20℃下进行。使用蛋白与储存溶液(0.2M的柠檬酸钠三元脱水物、20% (w/v)的PEG 3350)以0.5微升:0.5微升的比例混合的液滴对60微升的储存溶液进行了平衡化。另外,使用油作为防冻剂。
(3) 晶体的分析方法
回收的强度数据通过Spring 8 BL44XU进行收集。对于所收集的数据,利用Phaser (分子置换程序),通过以之前进行了结构分析的V21和亚氨基生物素长尾的共结晶数据作为模型分子的分子置换法确定了位相。使用REFMAC5进行了精密化。
晶体结构的分析结果见图6、图7。
由图确认:与结合有化合物C的V212的晶体相比,结合有化合物C的V2122的晶体结构如同设计的一样,氨基酸编号第45位和第49位(序列表4的氨基酸序列中的第33位和第37位)的相互作用消失,环结构发生了较大的结构变化,像V21一样形成了封闭的形状,显示出了突变N49G的有效性。另外,在图7所示的结合有化合物C或化合物D的V2122的结构的比较中,在上述环部分确认到了结构上的不同,结果确认了由化合物C和D的长度引起的结构变化。
实施例8:利用流式细胞术进行RAMOS细胞上的CD20的识别分析
关于利妥昔单抗-scFv-V2122的基因序列,通过进行人工基因合成(ライフテクノロジーズ公司)而获得。具体而言,从注册在DrugBank数据库(www.drugbank.ca)中的利妥昔单抗的氨基酸序列中抽取轻链(VL)和重链(VH)的氨基酸序列,通过接头(GGGS×4)将VL和VH以VL-VH的顺序彼此连接。再将LV-LH和V2122通过接头(SSGSGSA)结合而成的序列最优化成大肠杆菌的密码子序列,进行了人工合成。利妥昔单抗-scFv-V2122的核苷酸序列和氨基酸序列见SEQ ID NO: 27和SEQ ID NO: 28。SEQ ID NO: 28的氨基酸序列中的各序列的位置如下所示。
pelB信号序列:氨基酸编号1-23;
VL序列:氨基酸编号24-130;
接头序列1:氨基酸编号131-148;
VH序列:氨基酸编号149-269;
接头序列2:氨基酸编号270-276;
V2122序列:氨基酸编号277-405;
6xHis-Tag序列:氨基酸编号406-411。
将以上述方式人工合成的基因插入pET21a(+)中,使用大肠杆菌BL21(DE3)进行蛋白表达,通过内含体回收了蛋白。按照非专利文献(Yumura等人, 2013, Protein Science)对所回收的内含体实施了解链纯化。
对于进行了解链纯化的利妥昔单抗-scFv-V2122,使用作为CD20阳性细胞的RAMOS (人伯基特淋巴瘤)细胞(JCRB细胞库)进行了结合性的评价。具体而言,用PBS稀释利妥昔单抗-scFv-V2122,准备了3种浓度(0.05、0.5和5µ g/mL)。将1×106个细胞分离收集到1.5mL的管中,以400×g离心4分钟,舍弃上清,回收了细胞。向所回收的细胞中添加100µ L已稀释的利妥昔单抗-scFv-V2122,充分混和,在冰上培养30分钟。再次进行离心,舍弃上清,添加1mL的PBS进行细胞的清洗,回收了细胞。接下来,向细胞中添加100µ L 13nM或1.3nM的FITC-Psyche或、0.5µ g/mL(3.3nM)的抗-His-tag mAb-Alexa Flour 488 (株式会社 医学生物学研究所)进行混和,之后在冰上培养30分钟。培养后再次进行离心,舍弃上清,添加1mL的PBS进行细胞的清洗,回收了细胞。将所回收的细胞悬浮在500µ L的PBS中,使用流式细胞仪(guava easyCyte单一系统;Merck Millipore)进行了测定。
结果见图8。
首先,根据使用了Alexa Flour 488标记抗His标志物抗体(3.3nM)的测定结果A,观察到了利妥昔单抗-scFv-V2122的浓度依赖性的荧光强度位移,确认到了此次制作的利妥昔单抗-scFv-V2122识别RAMOS细胞表面上的CD20。接下来,根据使用了FITC标记的FITC标记化合物B的测定结果B,与标记抗His标志物抗体一样,确认到了利妥昔单抗-scFv-V2122的浓度依赖性的荧光强度位移。而且在化合物的浓度(3nM、10nM、30nM)下还确认到了浓度依赖性的荧光强度位移,由此首次证明了FITC标记化合物B与利妥昔单抗-scFv-V2122结合。
比较例1:与野生型链霉亲和素突变体Y43A和S45A的性能比较1 (生物素结合性的比较)
起初,使用位于pET21a(+)载体中的限制酶NdeI和XhoI位点,制作了导入有野生型核心链霉亲和素序列(专利文献1、序列表2的氨基酸序列)的载体。然后,使用下述的引物组作为其模板,通过位点定向诱变法制作了Y43A或S45A (在序列表2的氨基酸序列中分别取代第31位和第33位的氨基酸)的突变体。目标蛋白通过大肠杆菌(BL21 (DE3)株)表达后以内含体的形式回收,利用稀释法进行解链,再进行亲和纯化和凝胶过滤纯化,从而得到了四聚体形成组分。具体而言,将已纯化的内含体用变性缓冲液(6M的盐酸胍、50mM的Tris-HCl、200mM的NaCl、1mM的EDTA、在4℃下pH8.0)溶解一晚。测定溶液的吸光度280,将5mg份的溶解液边搅拌边滴加到50mL的重折叠缓冲液(50mM的Tris-HCl、300mM的NaCl、1mM的EDTA、400mM的精氨酸-HCl、在4℃下pH8.0)中,在4℃下静置、保存。为了进行稳定的解链,保存时间设为2天。保存2天后,使用Ni-NTA树脂(cOmplete His-Tag纯化树脂;Roche)进行了亲和纯化。之后,使用PBS作为缓冲液,通过凝胶过滤纯化(HiLoad 16/60 Superdex 200pg GE Healthcare公司制造)分馏了四聚体组分。
使用已纯化的两种野生型核心链霉亲和素突变体(cSA-Y43A、cSA-S45A)和已纯化的LISA314、以及V2122蛋白,通过表面等离子体共振(SPR)测定了与生物素(シグマアルドリッチ)的相互作用。具体而言,使用Biacore T200 (GE Healthcare)作为测定仪,传感器芯片使用传感器芯片NTA (GE Healthcare),利用与核蛋白融合了的His-Tag将蛋白固定在传感器芯片上。运行缓冲液使用HBS-P(+),如操作手册所记载调制了缓冲液。关于化合物的稀释系列,使用运行缓冲液调整了1.8nM、9nM、18nM、90nM、180nM、900nM、1800nM这7个系列,获取了数据。
引物组
Y43A Fw: GGCACCGCCGAAAGCGCCGTGGGTAAT (SEQ ID NO: 17);
Y43A Rv: GCTTTCGGCGGTGCCGGTCAGCGCACC (SEQ ID NO: 18);
S45A Fw: TATGAAGCCGCCGTGGGTAATGCGGAA (SEQ ID NO: 19);
S45A Rv: CACGGCGGCTTCATAGGTGCCGGTCAG (SEQ ID NO: 20)。
结果见图9。
由所得传感图确认到:野生型链霉亲和素突变体cSA-Y43A、cSA-S45A显示出生物素浓度依赖性的相互作用,显示出与解离非常缓慢的LISA314同等的与生物素的强特异性结合。另一方面,在V2122中没有发现生物素浓度依赖性的相互作用,确认不存在特异性的结合。由该结果确认:野生型链霉亲和素突变体cSA-Y43A、cSA-S45A、以及LISA314和V2122是对生物素具有完全不同的性质的蛋白。
比较例2:与野生型链霉亲和素突变体Y43A和S45A的性能比较2
(化合物C与V2122的特异结合性的证明)
使用上述的已纯化的两种野生型核心链霉亲和素突变体(cSA-Y43A、cSA-S45A)和已纯化的V2122蛋白,通过表面等离子体共振(SPR)测定了与化合物C的相互作用。具体而言,使用Biacore T200 (GE Healthcare)作为测定仪,传感器芯片使用传感器芯片NTA (GE Healthcare),利用与核蛋白融合了的His-Tag将蛋白固定在传感器芯片上。运行缓冲液使用HBS-P(+),如操作手册所记载调制了缓冲液。关于化合物的稀释系列,使用运行缓冲液调整了1.8nM、9nM、18nM、90nM、180nM、900nM、1800nM这7个系列,获取了数据。
结果见图10。
由测定结果确认了:野生型链霉亲和素突变体cSA-Y43A与化合物C虽然显示出浓度依赖性的相互作用但解离快,而野生型链霉亲和素突变体cSA-S45A与化合物C显示出极弱的浓度依赖性的相互作用。另一方面,确认到了V2122和双亚氨基生物素具有浓度依赖性的相互作用,显示出了解离极慢的特异性结合。由该结果确认了:野生型链霉亲和素突变体cSA-Y43A、cSA-S45A和V2122是对化合物C具有完全不同的性质的蛋白。另外,还确认了化合物C和V2122显示出了极具特异性的牢固的结合。
实施例9:上皮调节蛋白(epiregulin)抗原和抗上皮调节蛋白scFv抗体的晶体结构分析
(1) 抗上皮调节蛋白scFv的表达培养和纯化
将编码抗上皮调节蛋白scFv的质粒转化到大肠杆菌中。使用LB液体培养基对大肠杆菌的集落进行前培养,之后使用2×YT培养基进行该培养,添加IPTG,诱导了抗上皮调节蛋白scFv的表达。将所回收的菌体在Tris缓冲液中破碎,回收进行了离心处理的上清。将其依次通过Ni柱、阴离子交换柱、凝胶过滤柱进行了纯化。凝胶过滤后的SDS-PAGE的结果见图11。
在20℃下通过坐滴式蒸气扩散法进行结晶化。将已纯化的蛋白溶液(15mg/mL的抗上皮调节蛋白scFv)、20mM的Tris-HCl (pH7.5)、300mM的NaCl)与储存溶液(2% Tacsimate (pH7.0)、5%的2-丙醇、0.1M的咪唑(pH7.0)、11%的PEG 3350)混合制成液滴,从而得到了优质的晶体。
所得晶体通过SPring-8 BL44XU束线进行X射线衍射实验,得到了2.4Å分解能的衍射数据。使用程序HKL2000来处理该数据,利用Phaser通过分子置换法确定了位相,通过Refmac5将结构精密化。
(2) 抗上皮调节蛋白scFv与上皮调节蛋白的复合体的调制、结晶化和结构分析
将各5.0mg的抗上皮调节蛋白scFv和上皮调节蛋白(胞外结构域)混合,在25℃下培养1小时。将其通过凝胶过滤柱进行纯化,回收了复合体组分。
在20℃下通过悬滴式蒸气扩散法进行了结晶化。将复合体样品(15mg/mL, 20mM的Tris-HCl (pH7.5)、300mM的NaCl)与储存溶液(0.1M的氯化镁、0.1M的乙酸钠(pH5.1), 10%的PEG 6,000)混合制成液滴,从而得到了优质的晶体。
对于得到的晶体,利用SPring-8 BL32XU束线进行X射线衍射实验,收集了1.8Å分解能的衍射数据。使用程序HKL2000来处理该数据,利用Phaser通过分子置换法确定了位相,通过Refmac5将结构精密化。
(3) 抗上皮调节蛋白scFv抗体识别上皮调节蛋白的机理
由抗上皮调节蛋白scFv单体和上皮调节蛋白复合体的晶体结构明确了以下事实。抗上皮调节蛋白scFv与上皮调节蛋白的相互作用区主要有3处,大致分为上皮调节蛋白的N末端区与抗上皮调节蛋白scFv轻链的CDR1和CDR3的相互作用(相互作用1)、上皮调节蛋白的C末端区与抗上皮调节蛋白scFv重链的CDR2的相互作用(相互作用2)、上皮调节蛋白的β-折叠区与抗上皮调节蛋白scFv重链的CDR3的相互作用(相互作用3)。在相互作用1和2中,上皮调节蛋白的环结构发生变化,在HM(scFv)的CDR中没有看到这种程度的结构变化。另一方面,在相互作用3区中,上皮调节蛋白的结构反而没有变化,在抗上皮调节蛋白scFv重链的CDR3中发现了伴有P103残基的顺式-反式异构化的结构变化,通过诱导契合实现了抗原识别(图12)。
实施例10:
(1) 抗上皮调节蛋白scFv-V2122表达载体的制作
已知使单链可变区抗体与链霉亲和素的融合蛋白(scFv-SA)在大肠杆菌中表达时,往往因聚集或形成内含体而难以以可溶性的状态进行回收。因此,为了得到scFv-SA蛋白,使内含体变性的蛋白解链方法被视为基础。但是,通过解链生产蛋白费时且麻烦。此次采用了下述方法:使具有蛋白伴侣功能的蛋白skp和抗上皮调节蛋白scFv-V2122同时在大肠杆菌中表达,从而利用可溶性组分进行回收。
具体而言,蛋白伴侣skp的基因序列根据蛋白序列(SEQ ID NO: 24)实施了与大肠杆菌使用密码子相一致的序列设计(SEQ ID NO: 23)。另一方面,关于抗上皮调节蛋白抗体的单链可变区抗体(抗上皮调节蛋白scFv)与V2122的融合蛋白(抗上皮调节蛋白scFv-V2122)的基因序列,进行了如下的蛋白序列的设计:抗上皮调节蛋白抗体的可变区通过接头(GGGGS)×4 (SEQ ID NO: 35)以VH、VL的顺序结合、而VL和V2122通过接头(GGGGSGGGG) (SEQ ID NO: 36)结合,该设计本身也和skp一样设计成了与大肠杆菌使用密码子相一致的基因序列。这2个基因序列是使用人工基因合成辅助装置(ライフテクノロジーズ公司)进行人工合成而制得。需要说明的是,可变区VH、VL参照Lee YH等人, Biochem Biophys Res Commun. 2013 Nov 29; 441(4): 1011-7. doi: 10. 1016/j. bbrc. 2013. 11. 014. Epub 2013 Nov 12. PubMed PMID: 24239549。
抗上皮调节蛋白抗体的单链可变区抗体(抗上皮调节蛋白scFv)的核苷酸序列和氨基酸序列见SEQ ID NO: 21和SEQ ID NO: 22。
SEQ ID NO: 22的氨基酸序列中的各序列的位置如下所示。
pelB信号序列:氨基酸编号1-22;
VH序列:氨基酸编号23-140;
接头序列1:氨基酸编号141-164;
VL序列:氨基酸编号165-273;
6xHis-Tag序列:氨基酸编号274-279。
抗上皮调节蛋白scFv与V2122的融合蛋白(抗上皮调节蛋白scFv-V2122)的核苷酸序列和氨基酸序列见SEQ ID NO: 29和30。
SEQ ID NO: 30的氨基酸序列中的各序列的位置如下所示。
pelB信号序列:氨基酸编号1-22;
VH序列:氨基酸编号23-140;
接头序列1: 氨基酸编号141-164;
VL序列:氨基酸编号165-272;
接头序列2:氨基酸编号273-282;
V2122序列:氨基酸编号283-409;
6xHis-Tag序列:氨基酸编号410-415。
接下来,对于人工合成的2个基因,在pETDuet-1载体(Novagen公司)的多克隆位点1(MSC1)插入skp的基因序列,在MCS2中插入抗上皮调节蛋白scFv-V2122的基因序列。具体而言,首次利用限制酶NcoI进行载体的直链化,通过使用了根据融合HD克隆试剂盒(Clontech公司)的操作手册设计的引物(MCS1_skp_Fw: AGGAGATATACCATG ATGAAAAAATGGCTGCTGGC (SEQ ID NO: 37), MCS1_skp_Rv: CGCCGAGCTCGAATT TTATTTCACTTGTTTCAGAACG (SEQ ID NO: 38))的PCR扩增skp基因序列,在凝胶切取纯化后,通过融合HD克隆试剂盒与直链化载体进行连接,进行克隆操作,对所克隆的质粒进行序列分析,选出了目标克隆。接下来,通过限制酶NdeI进行插入有skp基因的质粒载体的直链化,按照与上述相同的方式,通过使用了根据融合HD克隆试剂盒(Clontech公司)的操作手册设计的引物(MCS2_scFvV2122_Fw; AAGGAGATATACATAATGAAATACCTAT TGCCTACGGCAG (SEQ ID NO: 39), MCS2_scFvV2122_Rv; TTGAGATCTGCCATATCA GTGGTGGTGGTGGTGGTGGCTG (SEQ ID NO: 40))的PCR扩增抗上皮调节蛋白scFv-V2122基因序列,在凝胶切取纯化后,通过融合HD克隆试剂盒与直链化载体进行连接,实施克隆操作,对克隆的质粒进行序列分析,选出了目标克隆。由此,可同时表达skp蛋白和抗上皮调节蛋白scFv-V2122蛋白的载体(pETDuet-epiregulin-scFvV2122_skp)得以完成。
(2) 抗上皮调节蛋白scFv-V2122蛋白的表达
将pETDuet-上皮调节蛋白-scFvV2122_skp转化到BL21(DE3)(ニッポン・ジーン公司)中,使用2xYT培养基(SIGMA-ADLRICH公司)在37℃下进行一夜的前培养。将进行了前培养的培养基添加到新的培养基中使其稀释100倍,在37℃下进行培养直至OD (600nm)=0.5~2.0。接下来,添加最终浓度为1mM的IPTG、1%的Triton X-100,在16℃下培养4小时,回收培养上清,之后在4℃下保存。
(3) 抗上皮调节蛋白scFv-V2122蛋白的纯化
对于抗上皮调节蛋白scFv-V2122蛋白,利用添加在C末端的6xHis-Tag按照分批法进行粗制。具体而言,向在4℃下保存的培养上清中添加经缓冲液A (50mM的TrisHCl, 0.2M的NaCl, 1mM的EDTA, 5mM的咪唑, pH8.0)平衡化的cOmplete His-Tag纯化树脂,在4℃下搅拌2小时~一夜,与树脂进行了蛋白结合处理。接下来,将树脂回收到柱上,使用缓冲液A进行了20柱容量的清洗操作。之后,用缓冲液B (50mM的TrisHCl, 0.2M的NaCl, 1mM的EDTA, 400mM的咪唑, pH8.0)进行洗脱,回收了抗上皮调节蛋白scFv-V2122的粗产物。
接下来,使用羟基磷灰石柱(Bio-Scale CHT2-I) (Bio-Rad公司)进行了纯化。具体而言,将抗上皮调节蛋白scFv-V2122的粗产物用Vivaspin Turbo15 (分组分子量:30,000)柱进行了浓缩,之后使用PD10柱将粗产物的缓冲液置换成起始缓冲液(5mM的Na2PO4、pH7.0)。使用起始缓冲液将羟基磷灰石柱充分平衡化,之后将置换了缓冲液的粗产物加载到柱上。进行20柱容量的清洗后,以15柱容量进行洗脱缓冲液(400mM的Na2PO4、pH7.0)的0%~60%的梯度洗脱,调制成了目标纯化物(图13)。
(4) 上皮调节蛋白IgG的表达和纯化
参考Lee等人的非专利文献,对上皮调节蛋白IgG进行了表达纯化。具体而言,人工合成了文献中记载的VL与人轻链恒定区结合、而VH与人重链恒定区结合的基因序列,分别作为上皮调节蛋白IgG的轻链、重链。上皮调节蛋白IgG的重链的核苷酸序列和氨基酸序列见SEQ ID NO: 31和SEQ ID NO: 32,上皮调节蛋白IgG的轻链的核苷酸序列和氨基酸序列见SEQ ID NO: 33和SEQ ID NO: 34。
接下来,使用pcDNA3.4 TOPO TA克隆试剂盒(ライフテクノロジーズ公司)将轻链、重链插入pcDNA3.4载体中,进行了表达载体的调制。在蛋白表达时,利用ExpiFectamine 293转染试剂盒对Expi293F细胞(ライフテクノロジーズ公司)进行基因导入,使轻链、重链的载体达到2:1。培养细胞时,按照Expi293表达系统试剂盒的操作手册的用法容量,CO2浓度为8%、振荡转数为125rpm,使用1L的三角烧瓶(コーニング公司),通过哺乳类细胞用高温振荡培养机CO2-BR-43FL (タイテック公司)来进行。培养5天后,通过离心除去细胞,回收上清,在4℃下保存。接下来,使用Bio-Scale Mini UNOspher SUPrA亲和筒(Bio-Rad公司),按照操作手册的用法容量,由在4℃下保存的培养上清纯化上皮调节蛋白IgG。
Pro-EPR-mFc的表达和纯化
进行了使上皮调节蛋白的胞外结构域与小鼠IgG1抗体重链Fc区融合而获得的蛋白(Pro-EPR-mFc)的表达和纯化。Pro-EPR-mFc的核苷酸序列和氨基酸序列见SEQ ID NO: 25和SEQ ID NO: 26。具体而言,将上皮调节蛋白的胞外结构域与小鼠IgG1抗体重链Fc区融合而获得的基因导入pcDNA3.4载体中,利用与“上皮调节蛋白IgG的表达和纯化”相同的方法,进行了蛋白的表达纯化。
(5) 纯化物的FITC标记和标记体的鉴定
关于所纯化的抗上皮调节蛋白scFv-V2122的FITC标记体(抗上皮调节蛋白scFv-V2122-FITC)的制作,使用荧光素标记试剂盒-NH2 (同仁化学),按照试剂盒的用法容量来进行。另外,上皮调节蛋白IgG、抗上皮调节蛋白scFv蛋白的标记也按照相同的方法进行。
接下来,为了确认标记是否会导致结合性降低,利用SPR (Biacore T200)进行了抗上皮调节蛋白scFv-V2122-FITC的抗原结合性的确认。具体而言,将作为配体的上皮调节蛋白细胞膜外区与小鼠Fc区融合而获得的蛋白(Pro-EPR-mFc)捕捉到固定有抗-小鼠IgG抗体的传感器芯片CM5上,使用作为分析物的抗上皮调节蛋白scFv-V2122-FITC的稀释系列、即从20nM起2倍稀释的9个系列进行了动力学测定(图14)。其结果,确认到了抗上皮调节蛋白scFv-V2122-FITC在标记后对抗原的结合性以其亲和力计为2.3E-10。另外,关于上皮调节蛋白IgG、抗上皮调节蛋白scFv蛋白的结合确认,也准备了从300nM起2倍稀释的9个系列,按照相同的方法来进行(图14)。利用Biacore评估软件进行数据分析,其结果,确认到了上皮调节蛋白IgG-FITC、抗上皮调节蛋白scFv-FITC在标记后也均具有结合性,各自的亲和力分别为3.4E-08、1.2E-07,确认到了抗上皮调节蛋白scFv-V2122-FITC具有上皮调节蛋白IgG-FITC、抗上皮调节蛋白scFv-FITC的约100倍~1,000倍的亲和力。
(6) 使用抗上皮调节蛋白scFv-V2122-FITC进行细胞染色和内源化分析
将细胞染色中使用的来自人大肠癌的DLD1细胞用完全培养基RPNI1640 (含10%的FBS)进行培养,在测定的2天前将细胞以1×104细胞/孔的细胞密度接种在uClear 96孔板(グライナー公司)上。进行细胞染色时,首先,将培养基置换成起初以达到1µ M的方式添加有Hoechst 33342的完全培养基,15分钟后向各孔中添加抗上皮调节蛋白scFv-V2122-FITC、上皮调节蛋白IgG-FITC、抗上皮调节蛋白scFv-FITC,使浓度分别达到25nM、50nM、100nM。
在与细胞表面的抗体结合和内源化的分析中,使用了IN Cell分析仪6000 (GE Healthcare Bioscience)。以5分钟的间隔通过慢速拍摄获取图像。
其结果,在抗上皮调节蛋白scFv-V2122-FITC、上皮调节蛋白IgG-FITC、抗上皮调节蛋白scFv-FITC中均确认到了细胞膜表面的染色。另外,特别是在抗上皮调节蛋白scFv-V2122-FITC中,明显观察到了内源化,在添加抗体约10分钟后起开始观察到内源化,在65分钟后确认到大部分的荧光转移到了细胞质内(图15)。
(7) 使用抗上皮调节蛋白scFv-V2122-FITC进行FACS分析
通过使用了作为标记抗体的抗上皮调节蛋白scFv-V2122-FITC、上皮调节蛋白IgG-FITC、抗上皮调节蛋白scFv-FITC的FACS,进行了细胞表面结合性的确认。具体而言,使0nM、0.5nM、5nM、50nM的标记抗体稀释液和表达上皮调节蛋白的DLD1细胞(1×106细胞/mL, 500mL)在冰上反应30分钟,使用流式细胞仪guava easyCyte 5进行了测定。测定方法遵照装置的说明书的用法容量。
其结果,确认到标记抗体抗上皮调节蛋白scFv-V2122-FITC和上皮调节蛋白IgG-FITC显示出了同等的结合性,但与这两者相比,抗上皮调节蛋白scFv-FITC的结合性弱(图16)。
实施例11:利妥昔单抗-scFv-V2122生物体成像
(1) 表达载体的构建
对利妥昔单抗单链抗体(单链可变片段;scFv)设计如下:使轻链可变区VL和重链可变区VH通过接头(GGGGS)×4以VL、VH的顺序结合。在VL上添加作为分泌信号的PelB序列,形成了序列PelB-VL-(GGGGS)4-VH。还进行了如下的设计:使scFv通过接头(GGGGSGGGG)与V2122结合(以下记作利妥昔单抗-scFv-V2122) (氨基酸序列:SEQ ID NO: 42)。蛋白表达用的基因序列利用人工基因合成辅助装置来制作(基因序列:SEQ ID NO: 41)。关于表达载体,与制作实施例10的(1)抗上皮调节蛋白scFv-V2122表达载体时一样,在pETDuet-1的多克隆位点2 (MCS2)插入了利妥昔单抗-scFv-V2122。
利妥昔单抗-scFv-V2122的氨基酸序列和核苷酸序列如下所示。
利妥昔单抗-scFv-V2122的基因序列(SEQ ID NO: 41):
利妥昔单抗-scFv-V2122的氨基酸序列(SEQ ID NO: 42):
(2) 蛋白的表达和粗制
利妥昔单抗-scFv-V2122蛋白的表达利用大肠杆菌来进行。具体而言,向BL21 (DE3) (ニッポンジーン公司)中导入质粒载体pETDuet-1 (skp)利妥昔单抗-scFv-V2122并进行了转化。已转化的大肠杆菌在100mL的2xYT培养基中、在37度下培养一夜。接下来,向1L的2xYT培养基中添加20mL前培养液,在37℃下进行培养,在OD600 nm=2.0的时间点添加终浓度为1mM的IPTG和终浓度为1%的Triton X-100,在20℃下培养了18小时~24小时。之后,通过离心回收培养上清,以4L份的上清为池。接下来,利用Ni-NTA树脂进行了粗制。具体而言,向4L的池中添加相当于5mL的cOmplete His-Tag纯化树脂(Roche公司),边用搅拌器搅拌边在4℃下进行了一夜的结合处理。之后,将树脂回收到柱中,用50mL的清洗缓冲液(50mM的TrisHCl、0.2M的NaCl、1mM的EDTA、5mM的咪唑、pH8.0)进行清洗,用40mL的洗脱缓冲液(50mM的TrisHCl、0.2M的NaCl、1mM的EDTA、400mM的咪唑、pH8.0)进行洗脱。洗脱液通过VIVASPIN Turbo 15 30,000 MWCO (ザルトリウス公司)浓缩至1~3mL,在冷冻(-80℃)下保存(图17)。
(3) 使用蛋白L柱纯化利妥昔单抗-scFv-V2122蛋白
使用1mL的蛋白L柱(HiTrap L (GE Healthcare公司))进行进一步的纯化。具体而言,用10 CV的PBS进行柱的平衡化,加载用PBS稀释了2倍的样品。接下来,用10 CV的PBS进行清洗,再用10 CV的10mM的甘氨酸-HCl (pH2.5)缓冲液进行了洗脱。立即使用PD10将洗脱液置换成PBS。之后,通过VIVASPIN Turbo 15 MWCO100,000 (ザルトリウス社)浓缩至0.3mL~1mL,在冷藏下保存(图17)。
(4) 荧光标记
将所纯化的利妥昔单抗-scFv-V2122与事先溶解于DMSO中的Psyche F-IRDye 800 (上述实施例的化合物44) (最终浓度为10倍摩尔浓度)混合,在冰上培养10分钟。之后,使用Zeba旋转脱盐柱(Thermo SCIENTIFIC)对日本药局方生理盐水(大塚制药株式会社)进行了缓冲液置换。
(5) 流式细胞仪
通过离心回收了高度表达人CD20抗原的Ramos细胞(来自人伯基特淋巴瘤的细胞) (JCR细胞库)。将细胞悬浮于PBS中(1×106个细胞/mL),与试验抗体(0nM、0.5nM、5nM、50nM、100nM)一起在室温下培养30分钟。用PBS清洗2次,之后在细胞中加入0.1mL 500ng/mL的抗6×His-tag抗体Alexa Flour 488,在室温下培养30分钟。用PBS清洗2次,之后使用guava easyCyte (Merck Millipore),按照制造商的使用说明书评价了试验抗体的结合方式和特异性(图18)。
(6) 异种移植模型
使用将Ramos细胞悬浮液与Matrigel Matrix (コーニング)以1:1混合(5×106个细胞/0.1mL)的0.1mL液体对5~6周龄的雌性裸鼠(三协ラボサービス)的左肋腹进行了皮下接种。饲养这些小鼠达数周,使产生了肿瘤。在摄像的1周前改用低荧光饲料(iVid #1、オリエンタル酵母工业株式会社)进行了饲养。在荧光成像试验中使用了平均肿瘤容积达到100~600mm3的小鼠。
(7) 生物体内成像
对于所建立的具有人伯基特淋巴瘤Ramos的裸鼠,静脉内注射了25µ g、50µ g、100µ g的利妥昔单抗-scFv-V2122抗体,该抗体预先通过与Psyche F-IRDye 800 (上述实施例的化合物44)反应而进行了荧光标记。在向肿瘤聚集的研究中,在给药后2、24和48小时后使用体内光成像装置Clairvivo OPT plus (株式会社岛津制作所)评价了IRDye800向肿瘤的聚集(图19)。
(8) 结果
第一,由图18显示:利妥昔单抗-scFv-V2122抗体浓度依赖性地与靶细胞结合。第二,如图19所示,利妥昔单抗-scFv-V2122抗体在给药2小时后确认到模型小鼠的肿瘤聚集。总而言之,利妥昔单抗-scFv-V2122抗体与Psyche F-IRDye 800 (上述实施例的化合物44)即使在生物体内也会结合,可以特异性地快速向肿瘤部位聚集。即,利妥昔单抗-scFv-V2122抗体可以快速地将诊断用药物或治疗用药物递送到肿瘤部位,成为有效的诊断、治疗药的候选。
实施例12:使用抗上皮调节蛋白scFv-V2122进行的生物体成像
(1) 蛋白的表达和粗制
使用实施例10之(1)中记载的抗上皮调节蛋白scFv-V2122表达载体,进行了抗上皮调节蛋白scFv-V2122蛋白的表达。具体而言,向BL21 (DE3) (ニッポンジーン公司)中导入质粒载体pETDuet-上皮调节蛋白-scFvV2122_skp并进行了转化。将所转化的大肠杆菌在100mL的2xYT培养基(Difco Laboratories)中、在37℃下培养一夜。接下来,在1L的2xYT培养基中添加20mL的前培养液,在37℃下进行培养,在OD600nm=2.0的时间点添加终浓度为1mM的IPTG和终浓度为1%的Triton X-100,在20℃下培养了18小时~24小时。之后,通过离心回收培养上清,以4L份的上清为池。
接下来,利用Ni-NTA树脂进行了粗制。具体而言,在4L的池样品中添加5mL cOmplete His-Tag纯化树脂(Roche公司),边用搅拌器搅拌,边在4℃下进行了一夜的结合处理。之后,将树脂回收到柱中,用50mL清洗缓冲液(50mM的TrisHCl、0.2M的NaCl、1mM的EDTA、5mM的咪唑、pH8.0)进行清洗,再用40mL的洗脱缓冲液(50mM的TrisHCl、0.2M的NaCl、1mM的EDTA、400mM的咪唑、pH8.0)进行了洗脱。洗脱液通过VIVASPIN Turbo 15 30,000 MWCO (ザルトリウス公司)浓缩至1~3mL,在冷冻(-80℃)下保存。
(2) 使用蛋白L柱进行纯化
使用1mL的蛋白L柱(HiTrap L (GE Healthcare公司))进行了进一步的纯化。具体而言,使用10 CV的PBS进行柱的平衡化,加载用PBS稀释了2倍的样品。接下来,用10 CV的PBS进行清洗,用10 CV 10mM的甘氨酸-HCl (pH2.5)缓冲液进行了洗脱。对于洗脱液立即用PD-10柱(GE Healthcare公司)将缓冲液置换成PBS。之后,使用VIVASPIN Turbo 15 MWCO100,000 (ザルトリウス公司)浓缩至0.3mL~1mL,在冷藏下保存(图20)。
(3) 荧光标记
将所纯化的抗上皮调节蛋白scFv-V2122和事先溶解于DMSO中的Psyche F-IRDye 800 (上述实施例的化合物44) (最终浓度为10倍摩尔浓度)混合,在冰上培养了10分钟。之后,使用Zeba旋转脱盐柱(Thermo SCIENTIFIC)对日本药局方生理盐水(大塚制药株式会社)进行了缓冲液置换,在冷藏下保存。另外,上皮调节蛋白IgG的标记使用ICG标记试剂盒-NH2 (株式会社同仁化学)来进行。
(4) 异种移植模型
使用将来自人大肠癌的DLD1细胞悬浮液和Matrigel Matrix (コーニング公司)以1:1混合(5×106个细胞/0.1mL)的0.1mL液体对5~6周龄的雌性裸鼠(三协ラボサービス)的左肋腹进行了皮下接种。饲养这些小鼠达数周,使产生了肿瘤。在摄像的1周前改用低荧光饲料(iVid #1、オリエンタル酵母工业株式会社)进行了饲养。在荧光成像试验中使用了平均肿瘤容积达到100~600mm3的小鼠。
(5) 生物体内成像
对于所建立的具有DLD1肿瘤的裸鼠,静脉内注射了25µ g、50µ g、100µ g预先通过与Psyche F-IRDye 800 (上述实施例的化合物44)反应而被荧光标记的抗上皮调节蛋白scFv-V2122抗体或者50µ g被荧光标记的上皮调节蛋白IgG。在向肿瘤聚集的研究中,在给药后2、24和48小时后使用体内光成像装置Clairvivo OPT plus (株式会社岛津制作所)评价了IRDye800在肿瘤处的聚集(图21)。
(6) 结果
第一,由图21显示:由于描绘出了肿瘤部,所以抗上皮调节蛋白scFv-V2122抗体和Psyche F-IRDye 800 (上述实施例的化合物44)即使在生物体内也会结合。第二,如图21所示,与IgG标记体相比,抗上皮调节蛋白scFv-V2122抗体标记体在早期(给药2小时后)即确认到模型小鼠的肿瘤聚集。总而言之,抗上皮调节蛋白scFv-V2122抗体和Psyche F-IRDye 800 (上述实施例的化合物44)即使在生物体内也会结合,可以特异性地快速向肿瘤部位聚集。即,抗上皮调节蛋白scFv-V2122抗体可以将诊断用药物或治疗用药物快速递送到肿瘤部位,成为有效的诊断、治疗药的候选。
- 还没有人留言评论。精彩留言会获得点赞!