降低蛋白质和肽的免疫原性的方法与流程
本发明涉及通过位点特异性地将载体结合至蛋白质或肽来增加蛋白质或肽的血清半衰期并降低其免疫原性的方法,并且涉及其用途。
背景技术:
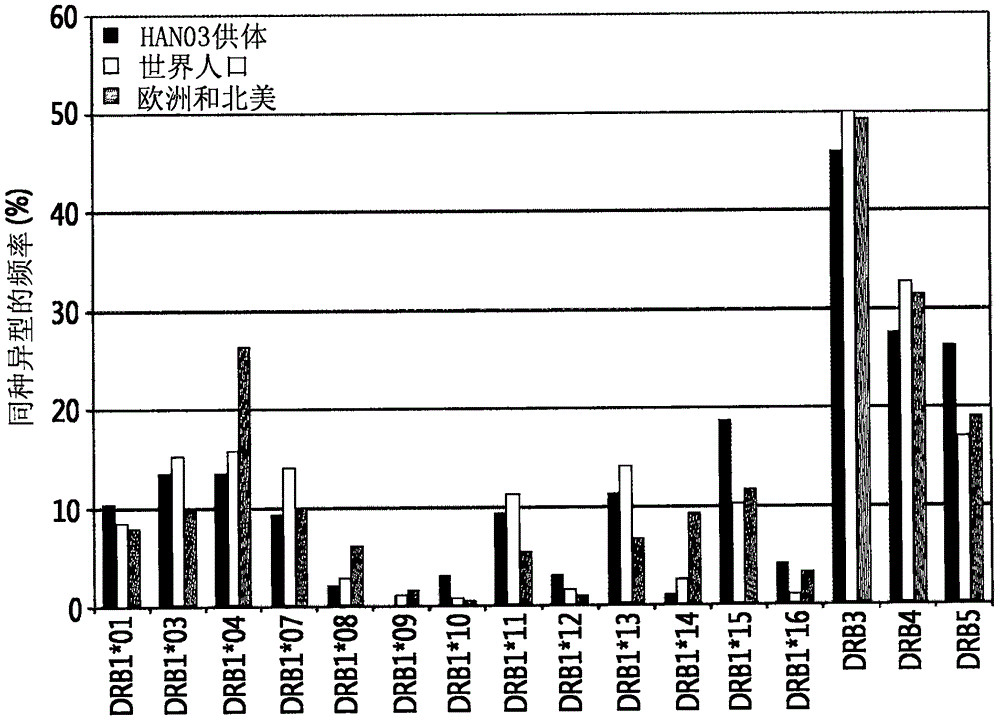
:对生物治疗剂的免疫应答可以广泛地被诱导用于非人源蛋白和人源蛋白二者。这些应答可以减弱临床疗效,限制效力,并且有时导致病理性疾病或者甚至引起患者的死亡。具体而言,靶向重组自身蛋白(self-protein)的中和抗体的产生可以诱导与患者体内固有的蛋白质的交叉反应,并且因而导致严重的后果(参见,LimLC.Hematology200510(3):255-9)。生物药物比如单克隆抗体的问题随着分子生物学的发展大大降低。但是,许多重组蛋白药物与在体内表达的蛋白序列相同,并且因而仍存在引起中和免疫应答的可能性(参见,NamakaM等,CurrMedResOpin200622(2):223-39)。虽然可能诱导免疫原性的机制没有完全清楚,但是已知的是对自身蛋白的抗性可以被施用至患者的产品和患者的各种因素破坏(在Chester,K,Baker,MP和MayerA.ExpertRevClinImmunol20051(4):549-559,BakerMP和JonesTD.Curr.Opin.DrugDiscDev200710(2):219-227中综述)。免疫原性的因素包括施用的剂量、频率和途径,蛋白药物、其制品等的免疫调节能力。诱导免疫应答的最重要的因素是是否存在可以有效地刺激CD4+T细胞应答的抗原识别位点(表位)(在BakerMP和JonesTD.Curr.Opin.DrugDiscDev200710(2):219-227中综述)。在另一方面,毒蜥外泌肽-4是在毒蜥蜥蜴的唾液腺中发现的天然肽并且与人GLP-1(胰高血糖素样肽-1)具有52%序列相似性。毒蜥外泌肽-4和GLP-1具有相似的胰岛素分泌功能。但是,GLP-1迅速地被二肽基肽酶-IV(DPP-IV)去活化,因而具有非常短的半衰期,而通过在第二氨基酸序列中存在甘氨酸而不是丙氨酸,毒蜥外泌肽-4保持对DPP-IV的抗性,并且因而可以更有效地作为II型糖尿病的治疗剂。此外,胰岛素或其类似物和GLP-1/胰高血糖素的双重激动剂也被用作糖尿病和肥胖的治疗剂。但是,这些非人氨基酸序列的存在可以用作T细胞的抗原识别位点。作为合成的毒蜥外泌肽-4的已经被批准作为II型糖尿病的治疗剂的艾塞那肽(Exenatide)(百泌达(Byetta))已经对在临床试验中接受艾塞那肽施用持续一年的超过30%的患者产生了抗体。最近被批准的利西拉来(Lixisenatide)已经对大约60-71%的患者产生了抗体(参见,Zinman,B.等,AnnalsofInternalMedicines.2007146(7):477-486;SchnabelCA等,Peptides200627:1902-1910;DeFronzo,R.A.等,DiabetesCare200528:1092-1100;Buse,J.B.等,DiabetesCare200427:2628-2635)。即,艾塞那肽被公认为待处理的体内外来物质并且产生了抗体。出于该原因,难以可靠地预期治疗效果的问题越来越普遍。因此,在出于治疗或预防持续长时间段的目的在体内已经施用生理活性蛋白质或肽的情况下,控制免疫原性是重要的。具体而言,与成人疾病有关的生理活性蛋白质或肽比如胰岛素或促胰岛素释放肽和抗肥胖蛋白常常被开发为在施用之后能够在体内持续的长效制剂。此外,即使它们不是长效制剂,存在它们必须被施用多次以持续长时间段的许多情况。因此,不诱导免疫应答是重要的问题。在这些情况下,本发明人已经进行了许多研究和实验来开发不诱导免疫应答的蛋白质或肽的药物制剂。结果,本发明人已经发现,与不结合至载体的蛋白质或肽的免疫原性相比,当载体位点特异性地结合至蛋白质或肽时,免疫原性可以降低,因而完成本发明。技术实现要素:技术问题本发明的一个目标是提供降低生理活性蛋白质或肽的免疫原性的方法。本发明的另一个目标是提供包含生理活性蛋白质或肽的缀合物的组合物,其中载体经由非肽基连接体结合至生理活性蛋白质或肽的非末端内部残基。本发明的另一个目标是提供制备生理活性蛋白质或肽的缀合物的方法,其中载体结合至生理活性蛋白质或肽的非末端内部残基。解决问题的方案在一方面,本发明提供了与不结合至载体的生理活性蛋白质或肽的免疫原性相比,降低生理活性蛋白质或肽的免疫原性的方法,其包括将载体结合至生理活性蛋白质或肽的非末端内部残基。在本发明的一个具体实施方式中,上述载体的特征在于其选自聚乙二醇、脂肪酸、胆固醇、白蛋白或其片段、白蛋白结合物质、具有特定氨基酸序列的重复单元的聚合物、抗体、抗体片段、FcRn结合物质、体内结缔组织或其衍生物、核苷酸、纤连蛋白、运铁蛋白、弹性蛋白样多肽(ELP)、XTEN多肽、羧基末端肽(CTP)、结构诱导探针(SIP)、糖类和高分子量聚合物。在本发明的另一个具体实施方式中,FcRn结合物质的特征在于其包括免疫球蛋白Fc区。在本发明的另一个具体实施方式中,生理活性蛋白质或肽和载体的特征在于它们经由在其间插入的连接体结合。在本发明的另一个具体实施方式中,连接体的特征在于其是非肽基连接体。在本发明的另一个具体实施方式中,非肽基连接体的特征在于其选自聚乙二醇、聚丙二醇、乙二醇-丙二醇共聚物、聚氧乙烯化多元醇、聚乙烯醇、多糖、葡聚糖、聚乙烯乙醚、生物可降解聚合物、脂质聚合物、几丁质、透明质酸和其组合。在本发明的另一个具体实施方式中,其特征在于生理活性蛋白质或肽经由选自如下的非肽基聚合物结合至免疫球蛋白Fc区:聚乙二醇、聚丙二醇、乙二醇-丙二醇共聚物、聚氧乙烯化多元醇、聚乙烯醇、多糖、葡聚糖、聚乙烯乙醚、生物可降解聚合物、脂质聚合物、几丁质、透明质酸和其组合。在本发明的另一个具体实施方式中,生理活性蛋白质或肽的特征在于其选自抗肥胖肽、促胰岛素释放肽或其类似物、瘦蛋白、胰岛素、胰岛素类似物、胰高血糖素、人生长激素、生长激素释放激素、生长激素释放肽、干扰素、干扰素受体、菌落刺激因子、胰高血糖素样肽比如GLP-1、GLP-1/胰高血糖素双重激动剂、肠抑胃肽(GIP)、G蛋白偶联受体、白介素、白介素受体、酶、白介素结合蛋白、细胞因子结合蛋白、巨噬细胞激活因子、巨噬细胞肽、B细胞因子、T细胞因子、蛋白A、过敏抑制因子、细胞坏死糖蛋白、免疫毒素、淋巴毒素、肿瘤坏死因子、肿瘤抑制因子、转移生长因子、α-1抗胰蛋白酶、白蛋白、α-乳白蛋白、脱脂载脂蛋白-E、红细胞生成因子、高度糖基化的红细胞生成因子、血管生成素、血红蛋白、凝血酶、凝血酶受体激活肽、血栓调节蛋白、血液因子VII、VIIa、VIII、IX和XIII、纤溶酶激活因子、纤连蛋白结合肽、尿素酶、链激酶、蛭素(hirudine)、蛋白C、C反应蛋白、肾素抑制剂、胶原酶抑制剂、超氧化物歧化酶、血小板衍生生长因子、上皮细胞生长因子、表皮生长因子、制管张素、血管紧张肽、骨生长因子、骨刺激蛋白、降钙素、心钠素、软骨诱导因子、依降钙素、结缔组织活化因子、组织因子途径抑制剂、促卵泡激素、黄体生成素、黄体生成素释放激素、神经生长因子、甲状旁腺素、松弛肽、胰泌素、生长调节素、胰岛素样生长因子、肾上皮质激素、胰高血糖素、缩胆囊素、胰多肽、胃泌素释放激素、促肾上腺皮质素释放因子(cortincotropinreleasingfactor)、促甲状腺激素、白毒素(autotaxin)、乳铁蛋白、肌肉生长抑制素(myostatin)、受体、受体拮抗剂、细胞表面抗原、病毒衍生的疫苗抗原(virus-derivedvaccineantigen)、单克隆抗体、多克隆抗体和抗体片段。在本发明的另一个具体实施方式中,生理活性蛋白质或肽的特征在于其选自毒蜥外泌肽-4、毒蜥外泌肽-4衍生物、GLP-1激动剂、胰岛素和GLP-1/胰高血糖素双重激动剂。在本发明的另一个具体实施方式中,毒蜥外泌肽-4衍生物的特征在于其是毒蜥外泌肽-4的N末端上的电荷被修饰的毒蜥外泌肽-4衍生物,其选自毒蜥外泌肽-4的N末端胺基缺失的毒蜥外泌肽-4衍生物、毒蜥外泌肽-4的N末端胺基被羟基(hydroxlgroup)置换的毒蜥外泌肽-4衍生物、毒蜥外泌肽-4的N末端胺基被羧基(carboxlygroup)置换的毒蜥外泌肽-4衍生物、毒蜥外泌肽-4的N末端胺基用二甲基修饰的毒蜥外泌肽-4衍生物和毒蜥外泌肽-4的N末端组氨酸残基的α碳缺失的毒蜥外泌肽-4衍生物。在本发明的另一个具体实施方式中,上述的内部残基的特征在于其是毒蜥外泌肽-4的N末端电荷被修饰的毒蜥外泌肽-4衍生物的12或27位的赖氨酸残基。在本发明的另一个具体实施方式中,上述的内部残基的特征在于其是毒蜥外泌肽-4的N末端电荷被修饰的毒蜥外泌肽-4衍生物的27位的赖氨酸残基。在本发明的另一个具体实施方式中,毒蜥外泌肽-4的N末端上的电荷被改变的毒蜥外泌肽-4衍生物的特征在于其是毒蜥外泌肽-4的N末端组氨酸残基的α碳缺失的毒蜥外泌肽-4衍生物。另一方面,本发明提供了包含生理活性蛋白质或肽的缀合物的组合物,其中载体经由非肽基连接体结合至生理活性蛋白质或肽的非末端内部残基,其中与不结合至载体的生理活性蛋白质或肽的免疫原性相比,该缀合物展示了降低的免疫原性。在本发明的一个具体实施方式中,上述的缀合物的特征在于其具有降低的为长效制品的副作用的免疫原性。在本发明的另一个具体实施方式中,非肽基连接体的特征在于其是聚乙二醇。另一方面,本发明提供了制备生理活性蛋白质或肽的缀合物的方法,其中载体结合至生理活性蛋白质或肽的非末端内部残基。本发明的有益效果本发明的生理活性蛋白质或肽缀合物可以显著地降低人体内的免疫原性并且因而降低针对蛋白质或肽的抗体生产率。因此,本缀合物具有优势,其在于生理活性蛋白质或肽的降低的临床效果的现象是低的,并且其可以有效地用于针对免疫应答开发具有高安全性的长效制剂。附图说明图1是显示体外T细胞活性测试中供体的HLA-DR基因型频率与世界、欧洲和北美人口的HLA-DR基因型频率的比较的图。具体实施方式本发明涉及与不结合至载体的蛋白质或肽的免疫原性相比,降低生理活性蛋白质或肽的免疫原性的方法,其包括将载体结合至生理活性蛋白质或肽的非末端内部残基的步骤。在本发明中,本发明人已经发现了降低生理活性蛋白质或肽的免疫原性的方法,其中非肽连接体和Fc片段结合至生理活性蛋白质或肽的内部残基而不是末端,因而抑制期望的蛋白质或肽担当抗原的机制。本发明人已经确定,在使用上面描述的方法的情况下,与通过在肽的其他位点比如N末端处进行修饰来制备缀合物的方法相比,动物中T细胞的活化和抗体产生反应被显著地抑制。结果,本发明人已经发现,被用作常规蛋白药物制品的生理活性蛋白质或肽缀合物具有新用途,该新用途为降低生理活性蛋白质或肽的免疫原性的组合物和方法。体内免疫原性的降低可以通过已知方法测量而没有限制。例如,免疫原性的差别可以通过T细胞的离体活性测量方法确认,该方法包括将载体中的每个偶联至N末端或除了N末端之外的包括C末端的位点。醛反应性基团在低pH下选择性地与N末端进行反应,并且其还可以在高pH例如pH9.0的条件下与赖氨酸残基形成共价键。聚乙二醇化(pegylation)反应在改变反应pH的同时进行,然后可以使用离子交换柱从反应混合物中分离位置异构体。当在除了N末端——其是体内蛋白质或肽的活性的重要位点——之外的位置处进行偶联时,反应性硫醇基可以被引入将要被修饰的氨基酸残基位置,从而在蛋白质或肽与非肽基聚合物的马来酰亚胺基团之间形成共价键。当在除了N末端——其是体内蛋白质或肽的活性的重要位点——之外的位置处进行偶联时,胺基被引入将要被修饰的氨基酸残基位置,从而在蛋白质或肽与非肽基聚合物的醛基之间形成共价键。保护N末端的方法除了二甲基化之外还包括甲基化、脱氨基或乙酰化,但是不限于此。在本发明中,“生理活性蛋白质或肽”指的是可以控制基因表达或者生理功能的蛋白质或肽。生理活性蛋白质或肽可以没有限制地包含在本发明的范围内,只要载体结合至根据本发明的生理活性蛋白质或肽的非末端内部残基,从而与不结合至载体的蛋白质或肽的免疫原性相比展示降低的免疫原性。如下面所描述,载体可以经由连接体——具体地非肽基连接体——结合至生理活性蛋白质或肽。另外,除了天然生物活性蛋白质或肽之外,生理活性蛋白质或肽还包括其衍生物、变体或片段。生理活性蛋白质或肽的实例包括但不限于抗肥胖肽、促胰岛素释放肽或其类似物、瘦蛋白、胰岛素、胰岛素类似物、胰高血糖素、人生长激素、生长激素释放激素、生长激素释放肽、干扰素、干扰素受体、菌落刺激因子、胰高血糖素样肽(GLP-1等)、GLP-1/胰高血糖素双重激动剂、肠抑胃肽(GIP)、G蛋白偶联受体、白介素、白介素受体、酶、白介素结合蛋白、细胞因子结合蛋白、巨噬细胞激活因子、巨噬细胞肽、B细胞因子、T细胞因子、蛋白A、过敏抑制因子、细胞坏死糖蛋白、免疫毒素、淋巴毒素、肿瘤坏死因子、肿瘤抑制因子、转移生长因子、α-1抗胰蛋白酶、白蛋白、α-乳白蛋白、脱脂载脂蛋白-E、红细胞生成因子、高度糖基化的红细胞生成因子、血管生成素、血红蛋白、凝血酶、凝血酶受体激活肽、血栓调节蛋白、血液因子VII、VIIa、VIII、IX和XIII、纤溶酶激活因子、纤连蛋白结合肽、尿素酶、链激酶、蛭素、蛋白C、C反应蛋白、肾素抑制剂、胶原酶抑制剂、超氧化物歧化酶、血小板衍生生长因子、上皮细胞生长因子、表皮细胞生长因子、制管张素、血管紧张肽、骨生长因子、骨刺激蛋白、降钙素、心钠素(atripeptin)、软骨诱导因子、依降钙素、结缔组织活化因子、组织因子途径抑制剂、促卵泡激素、黄体生成素、黄体生成素释放激素、神经生长因子、甲状旁腺素、松弛肽、胰泌素、生长调节素、胰岛素样生长因子、上皮质激素、胰高血糖素、缩胆囊素、胰多肽、胃泌素释放激素、促肾上腺皮质素释放因子、促甲状腺激素、白毒素、乳铁蛋白、肌肉生长抑制素、受体、受体拮抗剂、细胞表面抗原、病毒衍生的疫苗抗原、单克隆抗体、多克隆抗体和抗体片段。更具体地,生理活性蛋白质或肽可以包括胰岛素、促胰岛素释放肽或GLP-1/胰高血糖素双重激动剂,但是不限于此。在本发明中,术语“胰岛素”包括对于胰岛素受体具有刺激作用的所有肽或修饰的肽。胰岛素可以是,例如,天然胰岛素、速效胰岛素、基础胰岛素、胰岛素类似物——其中天然胰岛素的任何氨基酸通过选自置换、添加、缺失和修饰的任何一种方法或这些方法的组合改变,或者可以是其片段。而且,在本发明中使用的胰岛素可以是长效技术应用至其以解决短半衰期的长效胰岛素。具体而言,胰岛素可以是每周可以被施用一次的长效胰岛素或长效胰岛素类似物,但不限于此。根据本发明的胰岛素的一些具体实例包括胰岛素或胰岛素类似物和其长效类型,如在韩国专利号10-1058290(或国际公开号WO2008-082274)或韩国专利申请公开号2014-0106452(或国际公开号WO2014-133324)中公开的,其全部内容通过引用被并入本文,但是不限于此。如本文所使用,术语“胰岛素类似物”指的是保留与天然胰岛素相同的控制体内血糖水平功能的物质。具体地,胰岛素类似物包括天然胰岛素序列中一个或多个氨基酸已经被修饰的那些。胰岛素类似物可以是天然胰岛素的A链或B链氨基酸被改变的胰岛素类似物。天然胰岛素氨基酸序列如下。A链:Gly-Ile-Val-Glu-Gln-Cys-Cys-Thr-Ser-Ile-Cys-Ser-Leu-Tyr-Gln-Leu-Glu-Asn-Tyr-Cys-Asn(SEQIDNO:1)B链:Phe-Val-Asn-Gln-His-Leu-Cys-Gly-Ser-His-Leu-Val-Glu-Ala-Leu-Tyr-Leu-Val-Cys-Gly-Glu-Arg-Gly-Phe-Phe-Tyr-Thr-Pro-Lys-Thr(SEQIDNO:2)具体地,天然胰岛素中至少一个氨基酸可以具有选自如下的修饰:置换、添加、缺失、修饰和其组合,但是不限于此。在氨基酸的置换或添加中,可以使用正常地存在于人蛋白中的20种氨基酸以及非典型的(atyhpical)或非自然存在的氨基酸。非典型氨基酸的商业来源可以包括Sigma-Aldrich、ChemPep和Genzymepharmaceuticals。包含这些氨基酸和典型肽序列的肽可以由商业肽合成公司合成或者从其购买,这些公司例如AmericanpeptidecompanyInc.和Bachem(美国)或Anygen(韩国)。具体地,上述的胰岛素类似物包括倒置胰岛素(invertedinsulin)、胰岛素变体、胰岛素片段、胰岛素激动剂、胰岛素衍生物等,并且其制备方法包括基因重组以及固相法,但是不限于此。术语“胰岛素衍生物”显示了与天然胰岛素的A链和B链的氨基酸序列同源性(homolgy),同时保留控制体内血糖水平的功能,并且包括如此肽形式:其氨基酸残基上的一些基团可以被化学地置换(例如,α-甲基化、α-羟基化)、缺失(例如,脱氨基)或修饰(例如,N-甲基化)。此外,胰岛素衍生物包括肽模拟和低分子或高分子化合物,其可以与胰岛素受体结合以控制体内的血糖水平,即使与天然胰岛素和氨基酸序列没有同源性。如本文所使用,术语“胰岛素片段”指的是在胰岛素中添加或缺失一个或多个氨基酸的片段。添加的氨基酸可以是不以天然状态存在的氨基酸(例如,D型氨基酸)。这种胰岛素片段保留控制体内血糖水平的功能。如本文所使用,术语“胰岛素变体”是如此肽:其与胰岛素相比具有一个或多个不同的氨基酸序列,并且保留了控制体内血糖水平的功能。制备本发明的胰岛素激动剂、衍生物、片段和变体的方法分别地可以单独使用和以其组合使用。例如,本发明包括如此肽:其与天然胰岛素相比具有一个或多个不同的氨基酸序列,在末端氨基酸残基具有脱氨基作用,并且保留了控制体内血糖水平的功能。激动剂、衍生物、片段和变体的描述甚至可以应用至其他类型的蛋白质或肽。具体地,胰岛素类似物可以是其中选自B链中1位的氨基酸、2位的氨基酸、3位的氨基酸、5位的氨基酸、8位的氨基酸、10位的氨基酸、12位的氨基酸、16位的氨基酸、23位的氨基酸、24位的氨基酸、25位的氨基酸、26位的氨基酸、27位的氨基酸、28位的氨基酸、29位的氨基酸、30位的氨基酸;A链中1位的氨基酸、2位的氨基酸、5位的氨基酸、8位的氨基酸、10位的氨基酸、12位的氨基酸、14位的氨基酸、16位的氨基酸、17位的氨基酸、18位的氨基酸、19位的氨基酸和21位的氨基酸的一个或多个氨基酸已经被其他氨基酸置换的那些,和更具体地是其中选自B链中8位的氨基酸、23位的氨基酸、24位的氨基酸、25位的氨基酸;A链中1位的氨基酸、2位的氨基酸、14位的氨基酸和19位的氨基酸的一个或多个氨基酸已经被其他氨基酸置换的那些。具体地,在前述氨基酸中,可以使用其中一个或多个、两个或更多个、三个或更多个、四个或更多个、五个或更多个、六个或更多个、七个或更多个、八个或更多个、九个或更多个、十个或更多个、11个或更多个、12个或更多个、13个或更多个、14个或更多个、多于15个、16个或更多个、17个或更多个、18个或更多个、19个或更多个、20个或更多个、21个或更多个、22个或更多个、23个或更多个、24个或更多个、25个或更多个、26个或更多个、或27个或更多个氨基酸已经被其他氨基酸置换的那些,但是不限于此。在上述的位置处的氨基酸残基可以被丙氨酸、谷氨酸、天冬酰胺、异亮氨酸、缬氨酸、谷氨酰胺、甘氨酸、赖氨酸、组氨酸、半胱氨酸、苯丙氨酸、色氨酸、脯氨酸、丝氨酸、苏氨酸和/或天冬氨酸置换。在本发明中,“促胰岛素释放肽”指的是保留了分泌胰岛素功能的肽。促胰岛素释放肽可以刺激胰腺的β细胞中胰岛素的合成或表达。具体地,促胰岛素释放肽是GLP(胰高血糖素样肽)-1、毒蜥外泌肽-3或毒蜥外泌肽-4,但是不限于此。促胰岛素释放肽包括天然促胰岛素释放肽、其前体、其激动剂、其衍生物、其片段和其变体。进一步,可以包括如先前所述的其组合。GLP-1是由小肠分泌的激素,并且通常促进胰岛素的生物合成和分泌,抑制胰高血糖素分泌,和促进细胞摄取葡萄糖。在小肠中,胰高血糖素前体被分解为三种肽,即,胰高血糖素、GLP-1和GLP-2。在此,GLP-1表示GLP-1(1-37),其最初为不具有促胰岛素功能的形式,但是然后被加工并被转化为激活的GLP-1(7-37)形式。毒蜥外泌肽-4指的是具有39个氨基酸的肽,其显示了与GLP-1的53%氨基酸序列同源性。毒蜥外泌肽-4可以具有如下序列,但是不限于此:毒蜥外泌肽-4:HisGlyGluGlyThrPheThrSerAspLeuSerLysGlnMetGluGluGluAlaValArgLeuPheIleGluTrpLeuLysAsnGlyGlyProSerSerGlyAlaProProProSer(SEQIDNO:3)同时,毒蜥外泌肽-3是与毒蜥外泌肽-4相比在2位和3位具有不同氨基酸的多肽。毒蜥外泌肽-3是毒蜥外泌肽-4的2位和3位的氨基酸分别被丝氨酸和天冬氨酸置换的那种,并且其可以被表示为Ser2Asp3-毒蜥外泌肽-4(1-39)。具体地,毒蜥外泌肽-3可以具有如下序列,但是不限于此:毒蜥外泌肽-3:HisSerAspGlyThrPheThrSerAspLeuSerLysGlnMetGluGluGluAlaValArgLeuPheIleGluTrpLeuLysAsnGlyGlyProSerSerGlyAlaProProProSer(SEQIDNO:4)上述的促胰岛素释放肽衍生物可以是促胰岛素释放肽的N末端已经被修饰的那种。更具体地,促胰岛素释放肽衍生物可以通过改变N末端上的电荷引起受体的快速解离,并且其可以是其中N末端上的正电荷被改变为中性或净负电荷的衍生物。本发明的促胰岛素释放肽衍生物可以包括其中促胰岛素释放肽的N末端氨基(或胺)基团缺失的脱氨基-组氨酰基衍生物、其中氨基被羟基置换的β-羟基咪唑并丙酰基衍生物、其中氨基被两个甲基修饰的二甲基-组氨酰基衍生物、其中N末端氨基被羧基取代的β-羧基咪唑并丙酰基衍生物或其中N末端组氨酸残基的α碳缺失以仅保留咪唑并乙酰基并且因而氨基的正电荷被去除的咪唑并乙酰基衍生物,并且其他N末端氨基被修饰的衍生物包含在本发明的范围内。举例而言,促胰岛素释放肽衍生物可以是其中毒蜥外泌肽-4的N末端氨基(或胺)基团或氨基酸残基被化学地修饰的衍生物。具体而言,其是通过置换或去除毒蜥外泌肽-4的N末端组氨酸残基(第一氨基酸)的α碳中存在的α氨基制备的毒蜥外泌肽-4衍生物。更具体地,其可以包括去除N末端氨基的脱氨基-组氨酰基-毒蜥外泌肽-4(DA-毒蜥外泌肽-4)、通过用羟基置换N末端氨基制备的β-羟基咪唑并丙基-毒蜥外泌肽-4(HY-毒蜥外泌肽-4)、通过用羧基置换N末端氨基制备的β-羧基咪唑并丙基-毒蜥外泌肽-4(CX-毒蜥外泌肽-4)、通过用两个甲基残基修饰N末端氨基制备的二甲基-组氨酰基-毒蜥外泌肽-4(DM-毒蜥外泌肽-4)或去除N末端组氨酸残基的α碳的咪唑并乙酰基-毒蜥外泌肽-4(CA-毒蜥外泌肽-4)等。显而易见的是,韩国专利申请公开号10-2012-0135123(或国际公开号WO2012/165915)或国际公开号WO2014/107035中公开的促胰岛素释放肽也包含在本发明的范围内。这些出版物的全部内容通过引用并入本文。在本发明中,“GLP-1/胰高血糖素双重激动剂”包括具有GLP-1/胰高血糖素双重活性的肽或其片段、前体、变体或衍生物,比如泌酸调节肽——一种天然GLP-1/胰高血糖素双重激动剂。在本发明中,GLP-1/胰高血糖素双重激动剂可以是长效技术应用至其以克服短半衰期的GLP-1/胰高血糖素双重激动剂,并且优选地是可以每周施用一次的长效GLP-1/胰高血糖素双重激动剂,但是不限于此。GLP-1/胰高血糖素双重激动剂包括泌酸调节肽。“泌酸调节肽”指的是由前胰高血糖素(pre-glucagon)——胰高血糖素的前体——产生的肽。在本发明中,泌酸调节肽包括天然泌酸调节肽、其前体、其衍生物、其片段、其变体等,如前面所描述的。泌酸调节肽具体地可以具有氨基酸序列HSQGTFTSDYSKYLDSRRAQDFVQWLMNTKRNRNNIA(SEQIDNO:5),但是不限于此。泌酸调节肽衍生物包括通过泌酸调节肽的序列中任何氨基酸的添加、缺失或置换制备的肽、肽衍生物或肽模拟,并且可以激活GLP-1受体和胰高血糖素受体二者,并且具体地,与通过天然泌酸调节肽激活的水平相比,可以以更高水平激活每种受体。根据本发明的GLP-1/胰高血糖素双重激动剂的一些具体的实例包括如在韩国专利公开号10-20125-01372771(或国际公开号WO2012-169798)和10-2012-01639579(或国际公开号WO2012-173422)中公开的GLP-1/胰高血糖素双重激动剂和其衍生物或其长效类型,其全部内容通过引用被并入本文。在本发明中,与生理活性蛋白质或肽结合的载体可以是可以增加生理活性蛋白质或肽的体内半衰期的材料。生理活性蛋白质或肽的实例包括能够降低生理活性蛋白质或肽的肾清除率的各种物质,例如,聚乙二醇、脂肪酸、胆固醇、白蛋白或其片段、白蛋白结合物质、特定氨基酸序列的重复单元的聚合物、抗体、抗体片段、FcRn结合物质、体内结缔组织或其衍生物、核苷酸、纤连蛋白、运铁蛋白、弹性蛋白样多肽(ELP)、XTEN多肽、羧基末端肽(CTP)、结构诱导探针(SIP)、糖类、高分子聚合物、特定氨基酸序列、特定氨基酸序列的重复单元的聚合物等。另外,生理活性蛋白质或肽与载体之间的连接包括基因重组和体外连接,但是不限于此。载体可以共价地或非共价地连接至生理活性蛋白质或肽。上述的FcRn结合物质可以是免疫球蛋白Fc区,例如IgGFc。当聚乙二醇被用作载体时,可以使用AmbrxInc.的再编码技术(Recodetechnique),其能够使得位点特异性结合至聚乙二醇。再者,可以使用Neose公司的糖聚乙二醇化(glycopegylation)技术,其能够使得特异性结合至糖基化部分。而且,可以使用其中聚乙二醇在体内缓慢地缺失的可释放的PEG技术,但是不限于此。再者,可以在本发明中使用的技术包括使用PEG增加生物利用度的技术。此外,也可以使用上面描述的技术将非肽基聚合物结合至生理活性蛋白质或肽,这些非肽基聚合物比如聚乙二醇、聚丙二醇、乙二醇-丙二醇共聚物、聚氧乙烯化多元醇、聚乙烯醇、多糖、葡聚糖、聚乙烯乙醚、生物可降解聚合物、脂质聚合物、几丁质或透明质酸。当白蛋白被用作载体时,可以在本发明中使用的技术包括其中白蛋白或白蛋白片段可以直接地共价连接至生理活性蛋白质或肽以增加体内稳定性的技术。即使白蛋白不被直接地连接,可以使用其中白蛋白结合材料——例如,白蛋白特异性结合抗体或抗体片段——结合至生理活性蛋白质或肽以从而结合至白蛋白的技术,以及可以使用其中将对白蛋白具有结合亲和力的某种肽/蛋白质结合至生理活性蛋白质或肽的技术。此外,可以使用其中将对白蛋白具有结合亲和力的脂肪酸结合至生理活性蛋白质或肽的技术,但是不限于此。在此,可以包含使用白蛋白的可以增加体内稳定性的任何技术或结合方法。通过使用抗体或抗体片段作为载体结合至生理活性蛋白质或肽从而增加体内半衰期的技术也可以包含在本发明中。可以使用具有FcRn结合位点的抗体或抗体片段,并且可以使用不包含FcRn结合位点的任何抗体片段,比如Fab。在本文中可以包含使用催化抗体的CovX公司的CovX-body技术,并且在本发明中可以包含使用免疫球蛋白Fc区增加体内半衰期的技术。当使用免疫球蛋白Fc区时,结合至Fc区和生理活性蛋白质或肽的连接体和其结合方法可以包括肽键或聚乙二醇等,但是不限于此,并且任何化学结合方法可以是可利用的。另外,Fc区和胰岛素类似物的结合比率可以是1∶1或1∶2,但是不限于此。免疫球蛋白恒定区——其包括Fc区——是可以在体内代谢的生物可降解的多肽,使得其可以安全地被用作药物载体。另外,就复合物的产生、纯化和产品产率而言,免疫球蛋白Fc区与整个免疫球蛋白分子相比是更有优势的,这是因为其相对低的分子量。进一步,由于其缺乏Fab,其展示了高的非同质性,这是因为一种抗体与另一种抗体在氨基酸序列方面的区别,免疫球蛋白Fc单独地提供了具有显著增强的同质性的复合物,并且降低诱导血液抗原性的可能性。而且,前述的PEG非特异性地结合至靶肽的特异性位点或各个位点并且因而增加肽的分子量。因此,PEG在抑制肾清除率和阻止水解作用中是有效的,并且进一步,其不引起特别的副作用。此外,当PEG结合至外源肽时,其可以通过免疫细胞抑制外源肽中存在的抗原位点的识别。具体地,PEG可以抑制肽被抗原呈递细胞吞噬并且被蛋白水解。因此,能够降低肽担当抗原的可能。尤其对于刺激CD4+T细胞激活的外源蛋白——其作为抗原——而言,结合至II类MHC形式的大约14-24个短肽必须在抗原呈递细胞上呈现。取决于PEG的结合位点,这可以在被降解为适合大小的过程中被抑制。在本发明的一个实施方式中,载体和生理活性蛋白质或肽经由连接体——具体而言,非肽基连接体——连接。在本发明中,非肽基连接体指的是包含两个或更多个重复单元的生物相容性聚合物,该重复单元通过除了肽键之外的任何共价键彼此结合。非肽基连接体可以与非肽基聚合物可交换地使用。用于本发明的非肽基连接体可以选自生物可降解聚合物、脂质聚合物、几丁质、透明质酸和其组合。本文中使用的生物可降解聚合物可以是聚乙二醇、聚丙二醇、乙二醇-丙二醇共聚物、聚氧乙烯化多元醇、聚乙烯醇、多糖、葡聚糖、聚乙烯乙醚、聚乳酸(PLA)或聚乳酸-乙醇酸(PLGA)。在本发明的一个具体实施方式中,非肽基聚合物是聚乙二醇。此外,本领域中已知的其衍生物和通过本领域中已知的方法容易制备的衍生物可以包含在本发明的范围内。在通过常规符合读框的融合方法获得的融合蛋白中使用的肽连接体具有缺点,在于其容易在体内被蛋白水解酶裂解,并且因而通过载体增加活性药物的血清半衰期的充分效果不能如预期的获得。但是,由于本发明的非肽基聚合物是不具有肽键的物质,因此其可以具有主要地对蛋白水解酶的抗性,因而增加肽的血清半衰期。可以在本发明中使用的非肽基聚合物的分子量的范围具体地为从1到100kDa,并且更具体地从1到20kDa。连接至免疫球蛋白Fc区的本发明的非肽基聚合物可以是一种类型的聚合物或不同类型聚合物的组合。在本发明中,载体的特征在于其结合至生理活性蛋白质或肽的非末端内部残基。在这种情况下,如上面所描述,载体可以经由连接体结合至生理活性蛋白质或肽的非末端内部残基。生理活性蛋白质或肽的非末端内部残基可以包括但不限于任何残基,条件是当载体与生理活性蛋白质或肽结合时,与不结合至载体的蛋白质或肽的免疫原性或其中载体与蛋白质或肽的末端位点结合的蛋白质或肽的免疫原性相比,其可以降低其免疫原性。生理活性蛋白质或肽的非末端内部氨基酸可以是赖氨酸、半胱氨酸等。更具体地,当生理活性蛋白质或肽是促胰岛素释放肽,具体地毒蜥外泌肽-4或毒蜥外泌肽-4的衍生物时,其内部残基可以是12或27位的赖氨酸残基,但是不限于此。此外,当使用醛连接体作为非肽基聚合物时,N末端与赖氨酸残基中的胺基反应,并且促胰岛素释放肽的修饰形式可以被用于提高反应产率。例如,可以使用阻断N末端的方法、置换赖氨酸残基的方法、引入胺基的方法在期望的位置维持反应胺基,并且可以进一步提高聚乙二醇化和偶联产率。在本发明的优选实施方式中,其中载体结合至本发明的促胰岛素释放肽的非末端内部残基的促胰岛素释放肽缀合物指的是其中免疫球蛋白Fc区特异性地与除了促胰岛素释放肽的N末端之外的胺基结合的促胰岛素释放肽缀合物。在一个具体实施方式中,本发明人已经进行了一系列实验;即,在选择性地将PEG结合至促胰岛素释放肽的赖氨酸残基的方法中,当将PEG结合至天然毒蜥外泌肽-4时,反应在pH9.0下进行,因而诱导赖氨酸残基的聚乙二醇化;而在其它方法中,当将PEG结合至毒蜥外泌肽-4衍生物的去除N末端的形式或保护形式时,反应在pH7.5下进行,因而诱导赖氨酸残基的聚乙二醇化。结果,已经确认,与N末端结合相反,当结合至赖氨酸残基时,离体T细胞活性显著地被抑制(表2到4)。进一步,如本文所使用的术语“免疫球蛋白Fc区”指的是不包括重链和轻链的可变区的免疫球蛋白的重链恒定区2(CH2)和重链恒定区3(CH3),免疫球蛋白的重链恒定区1(CH1)和轻链恒定区1(CL1)。其可以进一步包括在重链恒定区处的铰链区。而且,本发明的免疫球蛋白Fc区可以包括Fc区的部分或全部——其包括除了免疫球蛋白的重链和轻链的可变区之外的重链恒定区1(CH1)和轻链恒定区1(CL1),只要其与天然蛋白质的生理作用相比具有基本上类似的或更好的生理作用。而且,免疫球蛋白Fc区可以是在CH2和/或CH3的氨基酸序列的相对长的部分中具有缺失的片段。即,本发明的免疫球蛋白Fc区可以包括:1)CH1结构域、CH2结构域、CH3结构域和CH4结构域,2)CH1结构域和CH2结构域,3)CH1结构域和CH3结构域,4)CH2结构域和CH3结构域,5)一个或多个结构域的组合以及免疫球蛋白铰链区(或铰链区的部分),和6)重链恒定区和轻链恒定区的每个结构域的二聚体。进一步,本发明的免疫球蛋白Fc区包括天然氨基酸序列以及其序列衍生物(突变体)。氨基酸序列衍生物具有不同序列,这是由于天然氨基酸序列的一个或多个氨基酸残基的缺失、插入、非保守或保守置换或其组合。例如,在IgGFc中,在结合中已知为重要的214到238、297到299、318到322或327到331位的氨基酸残基可以被用作修饰的适合靶点。进一步,各种衍生物是可能的,包括其中能够形成二硫键的区缺失,或天然Fc形式的N末端处的某些氨基酸残基被去除或甲硫氨酸残基被添加至其的那种。进一步,为了去除效应子功能,缺失可以发生在补体结合位点中,比如Clq结合位点和抗体依赖性细胞介导细胞毒性(ADCC)位点。制备免疫球蛋白Fc区的这些序列衍生物的技术在国际公开WO97/34631、WO96/32478等中公开。蛋白质和肽的氨基酸交换——其不完全地改变分子的活性——在本领域中是已知的(H.Neurath,R.LHill,TheProteins,AcademicPress,纽约,1979)。最常发生的交换是氨基酸残基Ala/Ser、Val/Ile、Asp/Glu、Thr/Ser、Ala/Gly、Ala/Thr、Ser/Asn、Ala/Val、Ser/Gly、Thy/Phe、Ala/Pro、Lys/Arg、Asp/Asn、Leu/Ile、Leu/Val、Ala/Glu和Asp/Gly之间的交换。另外,必要时,Fc区可以通过磷酸化、硫酸化、丙烯酰化(acrylation)、糖基化、甲基化、法尼基化、乙酰化、酰胺化等修饰。上面描述的Fc衍生物可以是与本发明的Fc区展示相同的生物活性的衍生物或者可以是改善Fc区针对热、pH等的结构稳定性的衍生物。而且,这些Fc区可以从分离自人和其它动物——包括牛、羊、猪、小鼠、兔、仓鼠、大鼠或豚鼠——的天然形式获得,或者可以是获得自转化的动物细胞或微生物的重组体或其衍生物。在本文中,从天然免疫球蛋白的获得方法包括从人或动物器官分离全部免疫球蛋白,然后用蛋白水解酶处理它们。木瓜蛋白酶处理导致天然免疫球蛋白消化为Fab和Fc,和胃蛋白酶处理导致pFc′和F(ab)2片段的产生。这些片段可以经历尺寸排阻色谱法等以分离Fc或pFc′片段。具体地,人源Fc区是获得自微生物的重组免疫球蛋白Fc区。另外,处于具有天然糖链形式的免疫球蛋白Fc区与天然形式相比增加糖链,或与天然形式相比减少糖链,或者可以处于去糖基化形式。免疫球蛋白Fc糖链的增加、减少或去除可通过本领域中的常规方法实现,比如化学方法、酶方法和使用微生物的基因工程方法。从免疫球蛋白Fc区去除糖链导致与补体成分的C1q部分的结合亲和力急剧降低和抗体依赖性细胞介导细胞毒性或补体依赖性细胞毒性的降低或去除,从而不诱导体内的不需要免疫应答。在这方面,去糖基化或无糖基化(aglycosylated)形式的免疫球蛋白Fc区作为药物载体可以更加适合于本发明的对象。如本文所使用,术语“去糖基化”指的是酶促地从Fc区去除糖部分,并且术语“无糖基化”的意思是通过原核生物——具体地大肠杆菌——以非糖基化(unglycosylated)形式产生Fc区。同时,免疫球蛋白Fc区可以源自人或其他动物,包括牛、羊、猪、小鼠、兔、仓鼠、大鼠和豚鼠,并且优选地源自人。再者,免疫球蛋白Fc区可以是源自IgG、IgA、IgD、IgE和IgM的Fc区,或者是通过其组合或其杂种制备的Fc区。具体地,其源自为在人血液中最丰富蛋白的IgG或IgM,并且最具体地源自已知增强配体结合蛋白的半衰期的IgG,但是不限于此。另一方面,如本文所使用,术语“组合”的意思是编码相同起源的单链免疫球蛋白Fc区的多肽结合至不同起源的单链多肽以形成二聚体或多聚体。也就是说,二聚体或多聚体可以由选自以下的两个或更多个片段形成:IgGFc、IgAFc、IgMFc、IgDFc和IgEFc片段。在本发明中,术语“杂种”的意思是与不同起源的至少两个Fc片段对应的序列存在于单链免疫球蛋白Fc区中。在本发明中,各种类型的杂种是可利用的。也就是说,由选自IgGFc、IgMFc、IgAFc、IgEFc和IgDFc的CH1、CH2、CH3和CH4的1到4个结构域组成的杂种是可利用的,并且可以包含铰链。在另一方面,IgG也可以被分为IgG1、IgG2、IgG3和IgG4的亚类,并且在本发明中,其组合或杂交是可能的。其具体地是IgG2和IgG4的亚类,并且更具体地是仅具有效应子功能——比如补体依赖性细胞毒性(CDC)——的IgG4的Fc区。也就是说,本发明的药物的载体的免疫球蛋白Fc区可以是,例如,人IgG4源无糖基化的Fc区,但是不限于此。与可以引起不期望的免疫应答,例如,可以担当人体内抗原以产生新抗体的非人源Fc区相比,人源Fc区是优选的。在本发明的一个具体实施方式中使用的非肽基聚合物具有能够结合至免疫球蛋白Fc区和生理活性蛋白质或肽的反应性基团。在进一步的具体实施方式中,该反应性基团位于两个末端处。非肽基聚合物的两个末端反应性基团优选地选自反应性醛基、丙醛基、丁醛基、马来酰亚胺基和琥珀酰亚胺衍生物。琥珀酰亚胺衍生物可以是丙酸琥珀酰亚胺酯、碳酸羟基琥珀酰亚胺基酯、碳酸琥珀酰亚胺基羧甲基酯或碳酸琥珀酰亚胺酯。具体而言,当非肽基聚合物在其两个末端具有反应性醛基的反应性基团时,在最小的非特异性反应的情况下,在两个末端与生理活性多肽和免疫球蛋白连接是有效的。通过将醛连接还原烷基化产生的最终产物比通过酰胺键结合的最终产物更稳定。醛反应性基团选择性地在低pH下在N末端反应,并且在高pH比如pH9.0下与赖氨酸残基形成共价键。非肽基聚合物的两个末端反应性基团可以彼此相同或不同。例如,非肽基聚合物可以在一个末端具有马来酰亚胺基,和在另一个末端具有醛基、丙醛基或丁醛基。当在其两个末端具有反应性羟基的聚乙二醇被用作非肽基聚合物时,羟基可以通过已知的化学反应被活化为不同的反应性基团,或者具有商业可得的修饰的反应性基团的聚乙二醇可以从而被用于制备根据本发明的生理活性蛋白质或肽缀合物,具体地促胰岛素释放肽缀合物。本发明的促胰岛素释放肽缀合物不仅可以维持常规促胰岛素释放肽的体内活性,比如促进胰岛素合成和分泌、食欲抑制、体重减轻、β细胞的血糖敏感性的增加、促进β细胞增殖、或胃排空延迟,而且其可以显著地增加促胰岛素释放肽的血清半衰期并且因而增加肽的体内持续效果。因此,该促胰岛素释放肽缀合物在治疗糖尿病、肥胖、急性冠脉综合征或多囊卵巢综合征中是有用的。在另一个实施方式中,本发明提供了包含生理活性蛋白质或肽的缀合物的组合物,其中载体经由非肽基连接体结合至生理活性蛋白质或肽的非末端内部残基,其中与不结合至载体的生理活性蛋白质或肽的免疫原性相比,该缀合物展示了降低的免疫原性。具体地,上面描述的缀合物的特征在于其降低免疫原性——其是长效制品的副作用。而且,非肽基连接体可以是聚乙二醇。生理活性蛋白质或肽、连接体和缀合物如上面所描述。在另一方面,本发明提供了制备生理活性蛋白质或肽的缀合物的方法。具体地,本发明提供了制备生理活性蛋白质或肽的缀合物的方法,其包括下列步骤:(1)将在两个末端具有醛、马来酰亚胺或琥珀酰亚胺反应性基团的非肽基聚合物共价地结合至生理活性蛋白质或肽的胺或硫醇基;(2)将生理活性蛋白质或肽——其通过生理蛋白质或肽的除了N末端之外的位点共价地结合至非肽基聚合物——与步骤(1)的反应混合物分离;和(3)将免疫球蛋白Fc区共价地结合至与生理活性蛋白质或肽共价地结合的非肽基聚合物的其他末端以产生生理活性蛋白质或肽的缀合物,其中非肽基聚合物的两个末端分别与免疫球蛋白Fc区和生理活性蛋白质或肽结合。在优选的方面,本发明提供了制备蛋白质缀合物的方法,其包括如下步骤:(1)将在两个末端具有醛反应性基团的非肽基聚合物共价地结合至生理活性蛋白质或肽的赖氨酸残基;(2)将通过生理活性蛋白质或肽的赖氨酸残基共价地结合至非肽基聚合物的生理活性蛋白质或肽与步骤(1)的反应混合物分离;和(3)将免疫球蛋白Fc区共价地连接至与生理活性蛋白质或肽共价地结合的非肽基聚合物的其他末端以产生缀合物,其中非肽基聚合物的两个末端分别与免疫球蛋白Fc区和生理活性蛋白质或肽结合。更具体地,步骤(1)的非肽基聚合物和为生理活性蛋白质或肽的促胰岛素释放肽的赖氨酸残基在pH7.5或更高下结合。实施例在下文中,将通过下面的实施例更加详细地描述本发明。但是,下面的实施例意欲阐明本发明并且不意欲将本发明的范围限于其。实施例1:毒蜥外泌肽-4的聚乙二醇化和聚乙二醇化的毒蜥外泌肽-4的位置异构体的分离为了利用3.4KPropionALD(2)PEG(具有两个丙醛基的PEG,分子量为3.4kDa,IDBInc.,韩国)对天然毒蜥外泌肽-4(AmericanPeptides)的N末端进行聚乙二醇化,肽和PEG以1∶15的摩尔比在3mg/ml的肽浓度下在4℃下反应90分钟。此时,反应在100mMNaOAc缓冲液(pH4.0)中进行,并将20mMSCB(NaCNBH3)还原剂加入其中。而且,为了利用3.4KPropionALD(2)PEG对毒蜥外泌肽-4的赖氨酸(Lys)进行聚乙二醇化,肽和PEG以1∶30的摩尔比在3mg/ml的肽浓度下在4℃下反应3小时。此时,反应在100mM磷酸钠缓冲液(pH9.0)中进行,并且将20mMSCB还原剂加入其中。单聚乙二醇化肽主要地通过SOURCEQ(XK16ml,AmershamBiosciences)从反应溶液纯化,并且异构体通过SOURCES(XK16ml,AmershamBiosciences)分离。可见,N末端聚乙二醇化的峰出现的较早,然后两个赖氨酸(Lys)-聚乙二醇化的峰按顺序出现。聚乙二醇化的位点从洗脱峰通过肽作图方法确认。Lys12-聚乙二醇化缀合物首先被洗脱,然后Lys27-聚乙二醇化缀合物在最后部分被洗脱。在N末端位置异构体与Lys12位置异构体之间的完美峰分离是可能的。柱:SOURCEQ(XK16ml,AmershamBiosciences)58-27流速:2.0ml/min梯度:A0→40%80minB(A:20mMtrispH8.5,B:A+0.5MNaCl)柱:SOURCES(XK16ml,AmershamBiosciences)流速:2.0ml/min梯度:A0→100%50minB(A:20mM柠檬酸pH3.0,B:A+0.5MKCl)实施例2:CA毒蜥外泌肽-4赖氨酸残基的聚乙二醇化和位置异构体的分离为了利用3.4KPropionALD(2)PEG对CA毒蜥外泌肽-4(AmericanAmericanPeptides)的赖氨酸(Lys)残基进行聚乙二醇化,CA毒蜥外泌肽-4和PEG以1∶30的摩尔比在3mg/ml的CA毒蜥外泌肽-4浓度下在4℃下反应3小时。CA毒蜥外泌肽-4是N末端修饰的毒蜥外泌肽-4,其中α碳从天然毒蜥外泌肽的N末端组氨酸残基缺失并且侧链的β碳直接结合至羧基碳。此时,反应在100mM磷酸钠缓冲液(pH9.0)中进行,并且将20mMSCB还原剂添加至其中。单聚乙二醇化肽主要地通过SOURCEQ(XK16ml,AmershamBiosciences)从反应溶液纯化,并且异构体通过SOURCES(XK16ml,AmershamBiosciences)分离。可见,两个赖氨酸(Lys)-聚乙二醇化的峰出现。聚乙二醇化的位点从洗脱峰通过肽作图方法确认。Lys12-聚乙二醇化缀合物首先被洗脱,然后Lys27-聚乙二醇化缀合物在最后部分被洗脱。在N末端位置异构体与Lys12位置异构体之间的完美峰分离是可能的。柱:SOURCEQ(XK16ml,AmershamBiosciences)流速:2.0ml/min梯度:A0→40%80minB(A:20mMtrispH8.5,B:A+0.5MNaCl)柱:SOURCES(XK16ml,AmershamBiosciences)流速:2.0ml/min梯度:A0→100%50minB(A:20mM柠檬酸pH3.0,B:A+0.5MKCl)实施例3:咪唑并乙酰基毒蜥外泌肽-4(Lys27)-免疫球蛋白Fc缀合物的制备以与实施例2中相同的方式使用咪唑并乙酰基毒蜥外泌肽-4(CA毒蜥外泌肽-4,AP,美国)将3.4KPropionALD(2)PEG与CA毒蜥外泌肽-4的Lys反应。然后使用最后的异构体峰(Lys27的位置异构体)——其显示了大量反应性并且容易地与N末端异构体区分——在两个Lys异构体峰之间进行偶联反应。肽和免疫球蛋白Fc以1∶8的摩尔比和60mg/mL的总蛋白质浓度在4℃下反应20小时。反应在100mMK-P(pH6.0)的溶液中进行,并且将20mMSCB还原剂加入其中。在偶联反应之后,使用16ml的SOURCEQ和16ml的SOURCEISO进行的两步纯化与实施例2中相同。反相HPLC分析的结果示出了95.8%的纯度。实施例4:分离人外周血单核细胞(PBMC)用于离体测试和选择供体人外周血单核细胞(PBMC)在24小时内从收集自健康供体的血液中分离。供体血液由UKNationalBloodTransfusionService(AddenbrookeHospital,剑桥,英国)供应。外周血单核细胞从使用LymphoprepTM(Axis-shield,敦提,苏格兰)通过密度梯度离心法获得的暗黄覆盖层分离。在它们之中,使用CD8+RosetteSepTM(StemCellTechnologiesInc,伦敦,英国)去除CD8+T细胞。每个供体的外周血单核细胞被储存在液氮中直到使用前。供体的细胞的HLA-DR单倍体基因型使用基于HLASSP-PCR的组织分型试剂盒(Biotest,索利哈尔,英国)分析。T细胞的反应性使用KLH(KeyholeLimpetHaemocyanin,Pierce(Perbio),诺森伯兰郡,英国)——其是源自甲型流感病毒和爱泼斯坦-巴尔病毒的抗原肽——测试。代表世界人口的HLA-DR类型的频率的50个供体被选择并且由单一同龄组(cohort)组成。II类MHC单倍体基因型和构成同龄组的每个供体的T细胞的反应性在下面的表1中示出。将供体的基因型的频率与世界人口的频率相比较并且在图1中示出结果。下面的表1示出了HLA-DR基因型和每个供体的抗原肽KLH上的T细胞的反应性。表1在上面的表1中,加黑的部分(供体17、18、27、30和50)示出了其中与KLH的反应性在供体细胞的解冻之前和之后显著不同的情况。实施例5:EpiScreenTM离体T细胞增殖测试为了根据促胰岛素释放肽——其为代表性的生理活性蛋白质或肽——的聚乙二醇化位点确定免疫原性抑制机制,将未结合的天然毒蜥外泌肽-4和未结合的CA毒蜥外泌肽-4、在赖氨酸残基处聚乙二醇化的CA毒蜥外泌肽-4(CA毒蜥外泌肽-4-PEG(内部))和在N末端处聚乙二醇化的天然毒蜥外泌肽-4(毒蜥外泌肽-4-PEG(N末端))的T细胞增殖能力进行比较。此时,由于CA毒蜥外泌肽-4不具有可以被聚乙二醇化的N末端残基,因此N末端聚乙二醇化的CA-毒蜥外泌肽-4不是由CA毒蜥外泌肽-4制备。对于T细胞增殖测试,将供体的外周血单核细胞(PBMC)解冻以测量细胞数目和生存力。细胞在AIM-V培养基中被稀释至4-6x106个细胞/ml。在24孔培养平板中分配每个供体的细胞之后,加入测试样品以达到50μg/ml的终浓度(n=3)。放置抗原肽KLH处理的组以确定每个供体细胞的再现性(reproducility)。所有的测试组和对照组在37℃和5%CO2培养箱条件下培养8天。细胞的一部分在第5天、第6天、第7天和第8天时被取出并且被转移至96孔培养平板以测量细胞增殖速率。对于细胞增殖速率的测量,向每个孔中加入0.75μi[3H]-胸苷(PerkinElmerBuckinghamshire,英国)并且培养18小时,然后使用TomTecMachIII细胞收集装置用96孔过滤平板收集细胞。每个孔的放射性(计数/分钟,cpm)使用1450MicrobetaWallacTrilux液体闪烁计数器(PerkinElmerBuckinghamshire,英国)测量。结果已经基于模拟指数(SI)的实验阈值确定,SI为2或大于2(SI≥2,p<0.05)是阳性的。在包括与SI≥1.9对应的边界值的情况下,其单独地被指示为(P*)。结果,CA毒蜥外泌肽-4和毒蜥外泌肽-4分别在12%和10%的供体中展示阳性。但是,肽的内部残基被聚乙二醇化的CA毒蜥外泌肽-4在所有供体中展示阴性。另一方面,N末端被聚乙二醇化的毒蜥外泌肽-4在6%的供体中展示阳性。因此,如果聚乙二醇化发生在肽的内部赖氨酸残基而不是N末端,则肽的免疫原性被显著抑制(表2)。表2示出了T细胞增殖和白介素-2(IL-2)分泌。表2表3示出了T细胞增殖应答的强度和频率(包括SI≥1.9边界值)。表3上面描述的结果表明,通过生理活性蛋白质或肽的内部残基而不是末端结合至非肽基聚合物——具体地PEG——的生理活性蛋白质或肽的免疫原性被抑制。实施例6:EpiScreenTM离体白介素-2(IL-2)分泌测试为了根据促胰岛素释放肽——其为代表性的蛋白质或肽——的聚乙二醇化位点确定免疫原性抑制机制,将未结合的毒蜥外泌肽-4和实施例5的聚乙二醇化的毒蜥外泌肽-4的IL-2分泌能力进行比较并且使用供体细胞和样本——其与EpiScreenTMT细胞增殖试验中的相同——测量。抗-白介素-2抗体(R&DSystems,阿宾顿,英国)结合至ELISpot平板(Millipore,赫特福德郡,英国)。用PBS(磷酸缓冲盐溶液)洗涤平板三次,然后增补有1%牛血清白蛋白的PBS被加入并反应。在用AIM-V培养基洗涤之后,用AIM-V培养基稀释的供体细胞(4-6x106个细胞/ml)以100μl/孔分配。加入测试样品,每个50μl(n=6),使得终浓度为50μg/ml(n=6)。在培养8天之后,将生物素化的IL-2检测抗体和链酶亲和素-AP(R&DSystems,阿宾顿,英国)顺序地结合至ELISpot平板,然后将BCIP/NBT(R&DSystems,阿宾顿,英国)加入到平板以表达斑点。通过用蒸馏水洗涤完成反应,然后干燥平板。使用免疫扫描分析仪(ImmunoscanAnalyser)扫描和分析斑点/孔(spw)。基于模拟指数(SI)的实验阈值,离体T细胞的活性测量测试的结果被确定:SI为2或大于2(SI≥2,p<0.05)为阳性的。在包括与SI≥1.9对应的边界值的情况下,其单独地被指示为(P*)。结果,CA毒蜥外泌肽-4和毒蜥外泌肽-4分别在12%和10%的供体中展示阳性。但是,肽的内部残基被聚乙二醇化的CA毒蜥外泌肽-4仅在2%的供体中展示阳性。另一方面,N末端被聚乙二醇化的毒蜥外泌肽-4在6%的供体中展示阳性。因此,如果聚乙二醇化发生在肽的内部赖氨酸而不是N末端,则肽的免疫原性被显著抑制(表2至表4)。表4示出了T细胞的白介素-2(IL-2)分泌应答的强度和频率(包括SI≥1.9边界值)。表4平均值SI平均偏差应答的频率(%)CA毒蜥外泌肽-42.180.2312毒蜥外泌肽-42.220.1916PEG-CA毒蜥外泌肽-42.35N/A23.4KPEG(N末端)毒蜥外泌肽-42.090.176人源化A332.240.4330KLH3.791.8486上面描述的结果表明,通过生理蛋白质或肽的内部残基而不是末端结合至非肽基聚合物——具体地PEG——的生理活性蛋白质或肽的免疫原性被抑制。实施例7:正常大鼠中针对长效促胰岛素释放肽的抗体的产生将缀合物——其中CA毒蜥外泌肽-4经由实施例3中制备的PEG连接至免疫球蛋白Fc片段——皮下施用至正常的斯普拉-道来氏大鼠,每周一次持续26周(低、中或高剂量),然后在4周的恢复期期间放置(n=40~60/组)。在施用之前和施用期间——在第13、第19和第26周时——以及在恢复期的结尾时收集血液,从该血液中分离血清。确定是否针对促胰岛素释放肽产生抗体。结果,在施用药物的160个对象中,在13周的恢复期之后,仅在两个对象中检测到了抗体。但是,这些抗体被确认为不是药物的中和抗体(表5)。表5示出了在大鼠(SD大鼠)中在第26周施用时的抗体的产生。表5实施例8:食蟹猴(Cynomolgusmonkey)中针对持久的胰岛素分泌肽的抗体的产生测试将缀合物——其中CA毒蜥外泌肽-4经由实施例3中制备的PEG结合至免疫球蛋白Fc片段——皮下施用至食蟹猴,每周一次持续26周,然后在4周的恢复期期间放置(n=8~12/组)。在施用之前和施用期间——在第12、第19和第26周时——以及在恢复期的结尾时收集血液,从该血液中分离血清。确定是否针对促胰岛素释放肽产生抗体。结果,所有对象中都没有检测到抗体的产生(表6)。表6示出了在食蟹猴中在第26周施用时的抗体的产生。表6实施例9:血液中抗药抗体的检测和中和能力的评估为了检测实施例3的缀合物是否在大鼠或食蟹猴的体内产生抗药抗体(ADA),通过桥连ELISA方法检查缀合物。将实施例3的生物素化的缀合物结合至96孔微量培养板——其中链酶亲和素偶联至其底部,并用水洗涤。将实施例3的洋地黄毒苷(DIG)-标记的缀合物(在下文中,HM11260C)与大鼠或猴的血清样本一起添加以反应,然后用水洗涤。然后,辣根过氧化物酶-偶联的抗-DIG抗体(抗-DIG-POD抗体)被加入并且通过TMB底物(3,3′,5,5′-四甲基联苯胺底物)显影。大鼠血清中的测量敏感性为3.1ng/ml,并且猴血清中的测量敏感性为12.5ng/ml。为了评估针对检测的抗HM11260C抗体的HM11260C的中和能力,将血清样本和HM11260C加入至人GLP-1过表达的细胞系(GLP-1R/CHO),然后测量cAMP-诱导的抑制抑制率。通过160个动物中仅两个产生抗体确认了不具有中和能力。上面描述的结果表明,通过将非肽连接体和Fc片段结合至生理活性蛋白质或肽的内部残基而不是末端,降低了生理活性蛋白质或肽的免疫原性,因而抑制了其中期望的肽担当抗原的机制。结果还支持,在使用上面描述的生产方法的情况下,动物中T细胞的激活和抗体生产反应被显著地抑制。根据上面的描述,本领域技术人员可以理解,可以在不改变本发明的技术精神或基本特征的情况下以其它具体形式体现本发明。在这方面,上面描述的实施方式是出于说明性的目的,并且应当被理解为不限于此。其应当被解释为包含源自所附权利要求书而不是前述具体实施方式的含义和范围及其等价物的所有改变或修饰形式。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1