诊断方法和用于治疗成胶质细胞瘤的组合物与流程
本申请含有序列表,已经以ASCII格式电子提交且通过援引完整收入本文。2015年7月14日创建的所述ASCII拷贝命名为50474_096WO2_Sequence_Listing_7_14_15_ST25.txt,而且大小为2,488个字节。
发明领域
本发明针对用于鉴定会受益于VEGF拮抗剂(例如抗VEGF抗体)治疗的具有成胶质细胞瘤的患者的方法。
发明背景
胶质瘤占所有恶性脑和CNS肿瘤的81%。特别地,成胶质细胞瘤(多形性成胶质细胞瘤(GBM);世界卫生组织(WHO)IV级星形细胞瘤)占恶性胶质瘤的60%至70%,而且仍然是胶质瘤中最具攻击性的亚型。它大多在成人中发生(诊断时的中值年龄:64岁),而且它在美国的发病率估算是3.05/100,000。鉴于1年和5年总体存活分别为29%和3%,成胶质细胞瘤的预后仍然是特别差的(美国中枢脑肿瘤登记(2005)(CBTRUS;http://www.cbtrus.org))。
测量生物标志物的表达水平可能是鉴定会响应特定疗法(包括例如VEGF拮抗剂(诸如抗VEGF抗体)治疗)的具有成胶质细胞瘤的患者的一种有效手段。
需要确定哪些具有成胶质细胞瘤的患者会响应哪种治疗的有效手段,而且需要将此类确定并入VEGF拮抗剂疗法(无论作为单一药剂或是与其它药剂组合使用)对患者的有效治疗方案。
发明概述
本发明提供用于鉴定会很可能响应VEGF拮抗剂(例如抗VEGF抗体,例如贝伐珠单抗)治疗的具有成胶质细胞瘤的患者的方法。这些患者是基于至少一种(例如1,2,3,4,5,6,7,8,9,10,11,12,13,14,15,16,17,18,19,20,21,22,23,24,25,26,或27)下述基因的表达水平而鉴定的:AKT3,CDH1,CYP27B1,DNM3,DYNLL1,ERBB3,KLRK1,MBP,MDM2,NCAM1,PDGFRA,PRKCZ,SNCA,TNFRSF21,AXL,BCL2L1,CD36,ETS1,ICAM2,IL17A,IRS2,PDGFRB,RPL13A,TGFB1,TNFRSF4,TNFSF4,和ZBTB16。
在第一个方面,本发明提供确定具有成胶质细胞瘤的患者是否很可能响应VEGF拮抗剂治疗的方法,该方法包括:(a)检测对患者施用VEGF拮抗剂之前自患者获得的生物学样品中至少一种基因(例如1,2,3,4,5,6,7,8,9,10,11,12,13,14,15,16,17,18,19,20,21,22,23,24,25,26,或27种基因)的表达,其中该至少一种基因选自下组:AKT3,CDH1,CYP27B1,DNM3,DYNLL1,ERBB3,KLRK1,MBP,MDM2,NCAM1,PDGFRA,PRKCZ,SNCA,TNFRSF21,AXL,BCL2L1,CD36,ETS1,ICAM2,IL17A,IRS2,PDGFRB,RPL13A,TGFB1,TNFRSF4,TNFSF4,和ZBTB16;(b)将该至少一种基因的表达水平(例如均值表达水平)与该至少一种基因的参照表达水平比较,其中(i)患者样品中AKT3,CDH1,CYP27B1,DNM3,DYNLL1,ERBB3,KLRK1,MBP,MDM2,NCAM1,PDGFRA,PRKCZ,SNCA,和/或TNFRSF21的表达水平相对于参照水平的升高和/或(ii)患者样品中AXL,BCL2L1,CD36,ETS1,ICAM2,IL17A,IRS2,PDGFRB,RPL13A,TGFB1,TNFRSF4,TNFSF4,和/或ZBTB16的表达水平相对于参照水平的降低鉴定出很可能响应VEGF拮抗剂治疗的患者;并(c)告知该患者他们具有升高的可能性对VEGF拮抗剂治疗是响应性的。
在第二个方面,本发明还提供为具有成胶质细胞瘤的患者优化抗癌疗法的功效的方法,该方法包括:(a)检测对患者施用VEGF拮抗剂之前自患者获得的生物学样品中至少一种基因(例如1,2,3,4,5,6,7,8,9,10,11,12,13,14,15,16,17,18,19,20,21,22,23,24,25,26,或27种基因)的表达,其中该至少一种基因选自下组:AKT3,CDH1,CYP27B1,DNM3,DYNLL1,ERBB3,KLRK1,MBP,MDM2,NCAM1,PDGFRA,PRKCZ,SNCA,TNFRSF21,AXL,BCL2L1,CD36,ETS1,ICAM2,IL17A,IRS2,PDGFRB,RPL13A,TGFB1,TNFRSF4,TNFSF4,和ZBTB16;(b)将该至少一种基因的表达水平(例如均值表达水平)与该至少一种基因的参照表达水平比较,其中(i)患者样品中AKT3,CDH1,CYP27B1,DNM3,DYNLL1,ERBB3,KLRK1,MBP,MDM2,NCAM1,PDGFRA,PRKCZ,SNCA,和/或TNFRSF21的表达水平相对于参照水平的升高和/或(ii)患者样品中AXL,BCL2L1,CD36,ETS1,ICAM2,IL17A,IRS2,PDGFRB,RPL13A,TGFB1,TNFRSF4,TNFSF4,和/或ZBTB16的表达水平相对于参照水平的降低鉴定出很可能响应VEGF拮抗剂治疗的患者;并(c)对该患者提供抗癌疗法包括VEGF拮抗剂的推荐。
在第三个方面,本发明包括为具有成胶质细胞瘤的患者选择疗法的方法,该方法包括:(a)检测对患者施用VEGF拮抗剂之前自患者获得的生物学样品中至少一种基因(例如1,2,3,4,5,6,7,8,9,10,11,12,13,14,15,16,17,18,19,20,21,22,23,24,25,26,或27种基因)的表达,其中该至少一种基因选自下组:AKT3,CDH1,CYP27B1,DNM3,DYNLL1,ERBB3,KLRK1,MBP,MDM2,NCAM1,PDGFRA,PRKCZ,SNCA,TNFRSF21,AXL,BCL2L1,CD36,ETS1,ICAM2,IL17A,IRS2,PDGFRB,RPL13A,TGFB1,TNFRSF4,TNFSF4,和ZBTB16;(b)将该至少一种基因的表达水平(例如均值表达水平)与该至少一种基因的参照表达水平比较,其中(i)患者样品中AKT3,CDH1,CYP27B1,DNM3,DYNLL1,ERBB3,KLRK1,MBP,MDM2,NCAM1,PDGFRA,PRKCZ,SNCA,和/或TNFRSF21的表达水平相对于参照水平的升高和/或(ii)患者样品中AXL,BCL2L1,CD36,ETS1,ICAM2,IL17A,IRS2,PDGFRB,RPL13A,TGFB1,TNFRSF4,TNFSF4,和/或ZBTB16的表达水平相对于参照水平的降低鉴定出很可能响应VEGF拮抗剂治疗的患者;并(c)如果患者鉴定为很可能响应VEGF拮抗剂治疗的话,选择包括VEGF拮抗剂的疗法,并任选地对该患者推荐选择的包括VEGF拮抗剂的疗法。
在上文所述方法中,该患者可以在具有成胶质细胞瘤且正在测试对VEGF拮抗剂的响应性的患者群体中且该参照水平可以是该患者群体中该至少一种基因(例如1,2,3,4,5,6,7,8,9,10,11,12,13,14,15,16,17,18,19,20,21,22,23,24,25,26,或27种基因)的中值表达水平。在这些方法的其它实施方案中,该参照水平可以是具有成胶质细胞瘤且鉴定为不响应VEGF拮抗剂治疗的患者中该至少一种基因(例如1,2,3,4,5,6,7,8,9,10,11,12,13,14,15,16,17,18,19,20,21,22,23,24,25,26,或27种基因)的中值表达水平。
自患者获得的生物学样品中至少一种基因(例如1,2,3,4,5,6,7,8,9,10,11,12,13,14,15,16,17,18,19,20,21,22,23,24,25,26,或27种基因)的表达可以通过测量例如mRNA水平和/或血浆蛋白质水平来检测。在一些实施方案中,至少一种基因的表达水平可以是该至少一种基因的均值(平均)表达水平。在其它实施方案中,至少一种基因的表达水平可以是该至少一种基因的中值表达水平。
该生物学样品可以是例如肿瘤组织,诸如肿瘤组织活检或血浆样品。
本发明的这些方法可以进一步包括检测来自患者的生物学样品中至少两种,三种,四种,或更多种基因的表达。在一些实施方案中,本发明的方法可以包括检测来自患者的生物学样品中至少13种所述基因的表达。例如,在一些实施方案中,本发明的方法可以包括检测来自患者的生物学样品中AXL,BCL2L1,CD36,ETS1,ICAM2,IL17A,IRS2,PDGFRB,RPL13A,TGFB1,TNFRSF4,TNFSF4,和ZBTB16的表达。在一些实施方案中,本发明的方法可以包括检测来自患者的生物学样品中至少14种基因的表达。例如,在一些实施方案中,本发明的方法可以包括检测来自患者的生物学样品中AKT3,CDH1,CYP27B1,DNM3,DYNLL1,ERBB3,KLRK1,MBP,MDM2,NCAM1,PDGFRA,PRKCZ,SNCA,和TNFRSF21的表达。在其它实施方案中,本发明的方法可以包括检测来自患者的生物学样品中所有27种基因的表达。在还有其它实施方案中,该方法包括在来自患者的生物学样品中检测所有27种基因的表达并进一步检测至少一种,两种,三种,四种,或更多种不同基因的表达。
在上文所述方法中,该VEGF拮抗剂可以是抗VEGF抗体。该抗VEGF抗体可以是例如结合A4.6.1表位的抗VEGF抗体,贝伐珠单抗,或包含可变重链(VH)和可变轻链(VL)的抗VEGF抗体,其中所述VH具有SEQ ID NO:2的氨基酸序列且所述VL具有SEQ ID NO:1的氨基酸序列。
上文所述方法可以进一步包括对该患者施用VEGF拮抗剂的步骤。施用的VEGF拮抗剂可以是抗VEGF抗体,例如结合A4.6.1表位的抗VEGF抗体,贝伐珠单抗,或包含可变重链(VH)和可变轻链(VL)的抗VEGF抗体,其中所述VH具有SEQ ID NO:2的氨基酸序列且所述VL具有SEQ ID NO:1的氨基酸序列。
上文所述方法可以进一步包括对该患者施用:(i)选自抗肿瘤剂,化疗剂,生长抑制剂,和细胞毒剂的药剂,(ii)放疗,或(iii)其组合。在一些实施方案中,施用的化疗剂是替莫唑胺(TMZ)。
在上文所述方法中,对VEGF拮抗剂治疗的响应性可以是例如总体存活(OS)的延长或增长。在一些实施方案中,对VEGF拮抗剂治疗的响应性可以是例如无进展存活(PFS)的延长或增长。
在任何上文所述方法中,可使用检测选自AXL,BCL2L1,CD36,ETS1,ICAM2,IL17A,IRS2,PDGFRB,RPL13A,TGFB1,TNFRSF4,TNFSF4,和ZBTB16的至少一种基因(例如1,2,3,4,5,6,7,8,9,10,11,12,或13种基因)的表达来鉴定很可能响应VEGF拮抗剂治疗的具有非前神经型的成胶质细胞瘤的患者。在一些实施方案中,患者样品中AXL,BCL2L1,CD36,ETS1,ICAM2,IL17A,IRS2,PDGFRB,RPL13A,TGFB1,TNFRSF4,TNFSF4,和/或ZBTB16的表达水平相对于参照水平的降低鉴定出很可能响应VEGF拮抗剂(诸如抗VEGF抗体,例如贝伐珠单抗)治疗的具有非前神经型的成胶质细胞瘤的患者。
在第四个方面,本发明特征在于确定具有成胶质细胞瘤的患者是否很可能响应VEGF拮抗剂治疗的方法,该方法包括:(a)检测对患者施用VEGF拮抗剂之前自患者获得的生物学样品中至少一种基因(例如1,2,3,4,5,6,7,8,9,10,11,12,13,14,15,16,17,18,19,20,21,22,23,24,25,26,或27种基因)的表达,其中该至少一种基因选自下组:AKT3,CDH1,CYP27B1,DNM3,DYNLL1,ERBB3,KLRK1,MBP,MDM2,NCAM1,PDGFRA,PRKCZ,SNCA,TNFRSF21,AXL,BCL2L1,CD36,ETS1,ICAM2,IL17A,IRS2,PDGFRB,RPL13A,TGFB1,TNFRSF4,TNFSF4,和ZBTB16;(b)将该至少一种基因的表达水平(例如均值表达水平)与该至少一种基因的参照表达水平比较,其中(i)患者样品中AKT3,CDH1,CYP27B1,DNM3,DYNLL1,ERBB3,KLRK1,MBP,MDM2,NCAM1,PDGFRA,PRKCZ,SNCA,和/或TNFRSF21的表达水平相对于参照水平的升高和/或(ii)患者样品中AXL,BCL2L1,CD36,ETS1,ICAM2,IL17A,IRS2,PDGFRB,RPL13A,TGFB1,TNFRSF4,TNFSF4,和/或ZBTB16的表达水平相对于参照水平的降低鉴定出很可能响应VEGF拮抗剂治疗的患者。在一些实施方案中,第四个方面的方法可进一步包括告知该患者他们具有升高的可能性对VEGF拮抗剂治疗是响应性的。
在第五个方面,本发明特征在于为具有成胶质细胞瘤的患者优化抗癌疗法的治疗功效的方法,该方法包括:(a)检测对患者施用VEGF拮抗剂之前自患者获得的生物学样品中至少一种基因(例如1,2,3,4,5,6,7,8,9,10,11,12,13,14,15,16,17,18,19,20,21,22,23,24,25,26,或27种基因)的表达,其中该至少一种基因选自下组:AKT3,CDH1,CYP27B1,DNM3,DYNLL1,ERBB3,KLRK1,MBP,MDM2,NCAM1,PDGFRA,PRKCZ,SNCA,TNFRSF21,AXL,BCL2L1,CD36,ETS1,ICAM2,IL17A,IRS2,PDGFRB,RPL13A,TGFB1,TNFRSF4,TNFSF4,和ZBTB16;(b)将该至少一种基因的表达水平(例如均值表达水平)与该至少一种基因的参照表达水平比较,其中(i)患者样品中AKT3,CDH1,CYP27B1,DNM3,DYNLL1,ERBB3,KLRK1,MBP,MDM2,NCAM1,PDGFRA,PRKCZ,SNCA,和/或TNFRSF21的表达水平相对于参照水平的升高和/或(ii)患者样品中AXL,BCL2L1,CD36,ETS1,ICAM2,IL17A,IRS2,PDGFRB,RPL13A,TGFB1,TNFRSF4,TNFSF4,和/或ZBTB16的表达水平相对于参照水平的降低鉴定出很可能响应VEGF拮抗剂治疗的患者。在一些实施方案中,第五个方面的方法可进一步包括对该患者提供抗癌疗法包括VEGF拮抗剂的推荐。
在第六个方面,本发明特征在于为具有成胶质细胞瘤的患者选择疗法的方法,该方法包括:(a)检测对患者施用VEGF拮抗剂之前自患者获得的生物学样品中至少一种基因(例如1,2,3,4,5,6,7,8,9,10,11,12,13,14,15,16,17,18,19,20,21,22,23,24,25,26,或27种基因)的表达,其中该至少一种基因选自下组:AKT3,CDH1,CYP27B1,DNM3,DYNLL1,ERBB3,KLRK1,MBP,MDM2,NCAM1,PDGFRA,PRKCZ,SNCA,TNFRSF21,AXL,BCL2L1,CD36,ETS1,ICAM2,IL17A,IRS2,PDGFRB,RPL13A,TGFB1,TNFRSF4,TNFSF4,和ZBTB16;(b)将该至少一种基因的表达水平(例如均值表达水平)与该至少一种基因的参照表达水平比较,其中(i)患者样品中的AKT3,CDH1,CYP27B1,DNM3,DYNLL1,ERBB3,KLRK1,MBP,MDM2,NCAM1,PDGFRA,PRKCZ,SNCA,和/或TNFRSF21的表达水平相对于参照水平升高和/或(ii)患者样品中AXL,BCL2L1,CD36,ETS1,ICAM2,IL17A,IRS2,PDGFRB,RPL13A,TGFB1,TNFRSF4,TNFSF4,和/或ZBTB16的表达水平相对于参照水平的降低鉴定出很可能响应VEGF拮抗剂治疗的患者。在一些实施方案中,第六个方面的方法可进一步包括对该患者提供抗癌疗法包括VEGF拮抗剂的推荐。
在第四个,第五个,和第六个方面的任何方法中,该患者可以在具有成胶质细胞瘤且正在测试对VEGF拮抗剂的响应性的患者群体中且该参照水平可以是该患者群体中该至少一种基因(例如1,2,3,4,5,6,7,8,9,10,11,12,13,14,15,16,17,18,19,20,21,22,23,24,25,26,或27种基因)的中值表达水平。在这些方法的其它实施方案中,该参照水平可以是具有成胶质细胞瘤且鉴定为不响应VEGF拮抗剂治疗的患者中该至少一种基因(例如1,2,3,4,5,6,7,8,9,10,11,12,13,14,15,16,17,18,19,20,21,22,23,24,25,26,或27种基因)的中值表达水平。
自患者获得的生物学样品中至少一种基因(例如1,2,3,4,5,6,7,8,9,10,11,12,13,14,15,16,17,18,19,20,21,22,23,24,25,26,或27种基因)的表达可以通过测量例如mRNA水平和/或血浆蛋白质水平来检测。在一些实施方案中,至少一种基因的表达水平可以是该至少一种基因的均值(平均)表达水平。在其它实施方案中,至少一种基因的表达水平可以是该至少一种基因的中值表达水平。
该生物学样品可以是例如肿瘤组织,诸如肿瘤组织活检或血浆样品。
本发明的这些方法可以进一步包括检测来自患者的生物学样品中至少两种,三种,四种,或更多种基因的表达。在一些实施方案中,本发明的方法可以包括检测来自患者的生物学样品中至少13种所述基因的表达。例如,在一些实施方案中,本发明的方法可以包括检测来自患者的生物学样品中AXL,BCL2L1,CD36,ETS1,ICAM2,IL17A,IRS2,PDGFRB,RPL13A,TGFB1,TNFRSF4,TNFSF4,和ZBTB16的表达。在一些实施方案中,本发明的方法可以包括检测来自患者的生物学样品中至少14种基因的表达。例如,在一些实施方案中,本发明的方法可以包括检测来自患者的生物学样品中AKT3,CDH1,CYP27B1,DNM3,DYNLL1,ERBB3,KLRK1,MBP,MDM2,NCAM1,PDGFRA,PRKCZ,SNCA,和TNFRSF21的表达。在其它实施方案中,本发明的方法可以包括检测来自患者的生物学样品中所有27种基因的表达。在还有其它实施方案中,该方法包括在来自患者的生物学样品中检测所有27种基因的表达并进一步检测至少一种,两种,三种,四种,或更多种不同基因的表达。
在第四个,第五个,和第六个方面的任何方法中,该VEGF拮抗剂可以是抗VEGF抗体。该抗VEGF抗体可以是例如结合A4.6.1表位的抗VEGF抗体,贝伐珠单抗,或包含可变重链(VH)和可变轻链(VL)的抗VEGF抗体,其中所述VH具有SEQ ID NO:2的氨基酸序列且所述VL具有SEQ ID NO:1的氨基酸序列。
上文所述方法可以进一步包括对该患者施用VEGF拮抗剂的步骤。施用的VEGF拮抗剂可以是抗VEGF抗体,例如结合A4.6.1表位的抗VEGF抗体,贝伐珠单抗,或包含可变重链(VH)和可变轻链(VL)的抗VEGF抗体,其中所述VH具有SEQ ID NO:2的氨基酸序列且所述VL具有SEQ ID NO:1的氨基酸序列。
上文所述方法可以进一步包括对该患者施用:(i)选自抗肿瘤剂,化疗剂,生长抑制剂,和细胞毒剂的药剂,(ii)放疗,或(iii)其组合。在一些实施方案中,施用的化疗剂是替莫唑胺(TMZ)。
在上文所述方法中,对VEGF拮抗剂治疗的响应性可以是例如总体存活(OS)的延长或增长。在一些实施方案中,对VEGF拮抗剂治疗的响应性可以是例如无进展存活(PFS)的延长或增长。
在任何上文所述方法中,可使用检测选自AXL,BCL2L1,CD36,ETS1,ICAM2,IL17A,IRS2,PDGFRB,RPL13A,TGFB1,TNFRSF4,TNFSF4,和ZBTB16的至少一种基因(例如1,2,3,4,5,6,7,8,9,10,11,12,或13种基因)的表达来鉴定很可能响应VEGF拮抗剂治疗的具有非前神经型的成胶质细胞瘤的患者。在一些实施方案中,患者样品中AXL,BCL2L1,CD36,ETS1,ICAM2,IL17A,IRS2,PDGFRB,RPL13A,TGFB1,TNFRSF4,TNFSF4,和/或ZBTB16的表达水平相对于参照水平的降低鉴定出很可能响应VEGF拮抗剂(诸如抗VEGF抗体,例如贝伐珠单抗)治疗的具有非前神经型的成胶质细胞瘤的患者。
在第七个方面,本发明特征在于治疗具有成胶质细胞瘤的患者的方法,该方法包括对该患者施用VEGF拮抗剂,其中该患者已经预先测定为具有至少一种基因(例如1,2,3,4,5,6,7,8,9,10,11,12,13,14,15,16,17,18,19,20,21,22,23,24,25,26,或27种基因)的表达水平相对于该至少一种基因的参照表达水平的变化,该至少一种基因选自下组:AKT3,CDH1,CYP27B1,DNM3,DYNLL1,ERBB3,KLRK1,MBP,MDM2,NCAM1,PDGFRA,PRKCZ,SNCA,TNFRSF21,AXL,BCL2L1,CD36,ETS1,ICAM2,IL17A,IRS2,PDGFRB,RPL13A,TGFB1,TNFRSF4,TNFSF4,和ZBTB16。
在第八个方面,本发明特征在于为具有成胶质细胞瘤的患者优化抗癌疗法的治疗功效的方法,其中该患者已经预先测定为具有至少一种基因(例如1,2,3,4,5,6,7,8,9,10,11,12,13,14,15,16,17,18,19,20,21,22,23,24,25,26,或27种基因)的表达水平相对于该至少一种基因的参照表达水平的变化,其中该至少一种基因选自下组:AKT3,CDH1,CYP27B1,DNM3,DYNLL1,ERBB3,KLRK1,MBP,MDM2,NCAM1,PDGFRA,PRKCZ,SNCA,TNFRSF21,AXL,BCL2L1,CD36,ETS1,ICAM2,IL17A,IRS2,PDGFRB,RPL13A,TGFB1,TNFRSF4,TNFSF4,和ZBTB16,且该方法包括基于预先测定的至少一种基因的表达水平的变化对该患者提供抗癌疗法包括VEGF拮抗剂的推荐。
在第九个方面,本发明特征在于为具有成胶质细胞瘤的患者选择疗法的方法,其中该患者已经预先测定为具有至少一种基因(例如1,2,3,4,5,6,7,8,9,10,11,12,13,14,15,16,17,18,19,20,21,22,23,24,25,26,或27种基因)的表达水平相对于该至少一种基因的参照表达水平的变化,其中该至少一种基因选自下组:AKT3,CDH1,CYP27B1,DNM3,DYNLL1,ERBB3,KLRK1,MBP,MDM2,NCAM1,PDGFRA,PRKCZ,SNCA,TNFRSF21,AXL,BCL2L1,CD36,ETS1,ICAM2,IL17A,IRS2,PDGFRB,RPL13A,TGFB1,TNFRSF4,TNFSF4,和ZBTB16,且该方法包括基于预先测定的至少一种基因的表达水平的变化选择包含VEGF拮抗剂的疗法并对该患者推荐选择的包含VEGF拮抗剂的疗法。
在第七个,第八个,和第九个方面的任何方法中,该变化可以是至少一种基因的表达水平相对于参照水平的升高,且该至少一种基因可以是AKT3,CDH1,CYP27B1,DNM3,DYNLL1,ERBB3,KLRK1,MBP,MDM2,NCAM1,PDGFRA,PRKCZ,SNCA,和/或TNFRSF21。在一些实施方案中,该方法进一步包括基于AKT3,CDH1,CYP27B1,DNM3,DYNLL1,ERBB3,KLRK1,MBP,MDM2,NCAM1,PDGFRA,PRKCZ,SNCA,和/或TNFRSF21的表达水平的升高施用VEGF拮抗剂。
在第七个,第八个,和第九个方面的任何方法中,该变化可以是至少一种基因的表达水平相对于参照水平的降低,且该至少一种基因可以是AXL,BCL2L1,CD36,ETS1,ICAM2,IL17A,IRS2,PDGFRB,RPL13A,TGFB1,TNFRSF4,TNFSF4,和/或ZBTB16。在一些实施方案中,该方法进一步包括基于AXL,BCL2L1,CD36,ETS1,ICAM2,IL17A,IRS2,PDGFRB,RPL13A,TGFB1,TNFRSF4,TNFSF4,和/或ZBTB16的表达水平的降低施用VEGF拮抗剂。
在第七个,第八个,和第九个方面的任何方法中,该患者可以在具有成胶质细胞瘤且正在测试对VEGF拮抗剂的响应性的患者群体中且该参照水平是该患者群体中该至少一种基因的中值表达水平。
在第七个,第八个,和第九个方面的任何方法中,该参照水平可以是具有成胶质细胞瘤且鉴定为不响应VEGF拮抗剂治疗的患者中该至少一种基因的中值表达水平。
在第七个,第八个,和第九个方面的任何方法中,该方法可以进一步包括对该患者施用VEGF拮抗剂,其可以是抗VEGF抗体,例如贝伐珠单抗,结合A4.6.1表位的抗VEGF抗体,或包含可变重链(VH)和可变轻链(VL)的抗VEGF抗体,其中所述VH具有SEQ ID NO:2的氨基酸序列且所述VL具有SEQ ID NO:1的氨基酸序列。
在第七个,第八个,和第九个方面的任何方法中,该方法可以进一步包括对该患者施用:(i)选自抗肿瘤剂,化疗剂,生长抑制剂,和细胞毒剂的药剂,(ii)放疗,或(iii)其组合。在一些实施方案中,施用的化疗剂,诸如替莫唑胺(TMZ)。
在第七个,第八个,和第九个方面的任何方法中,该患者可以具有非前神经型的成胶质细胞瘤。
在第十个方面,本发明特征在于用于确定患者是否可受益于VEGF拮抗剂治疗的试剂盒,该试剂盒包含:(a)能够测定至少一种基因(例如1,2,3,4,5,6,7,8,9,10,11,12,13,14,15,16,17,18,19,20,21,22,23,24,25,26,或27种基因)的表达水平(例如均值表达水平)的多肽或多核苷酸,其中该至少一种基因选自下组:AKT3,CDH1,CYP27B1,DNM3,DYNLL1,ERBB3,KLRK1,MBP,MDM2,NCAM1,PDGFRA,PRKCZ,SNCA,TNFRSF21,AXL,BCL2L1,CD36,ETS1,ICAM2,IL17A,IRS2,PDGFRB,RPL13A,TGFB1,TNFRSF4,TNFSF4,和ZBTB16;和(b)使用该多肽或多核苷酸测定至少一种基因的表达水平的说明书,其中该至少一种基因选自下组:AKT3,CDH1,CYP27B1,DNM3,DYNLL1,ERBB3,KLRK1,MBP,MDM2,NCAM1,PDGFRA,PRKCZ,SNCA,TNFRSF21,AXL,BCL2L1,CD36,ETS1,ICAM2,IL17A,IRS2,PDGFRB,RPL13A,TGFB1,TNFRSF4,TNFSF4,和/或ZBTB16,其中该至少一种基因的表达水平相对于参照水平的变化指示患者可受益于VEGF拮抗剂治疗。
附图简述
图1是显示来自AvaGlio试验的339份野生型IDH1样品间193种免疫相关基因(行)的Nanostring数据的热图。基因(行)是依照共有聚簇的结果排序的,而样品(列)是通过Phillips GBM亚型排序的(Cancer Cell.9(3):157-73,2006)。
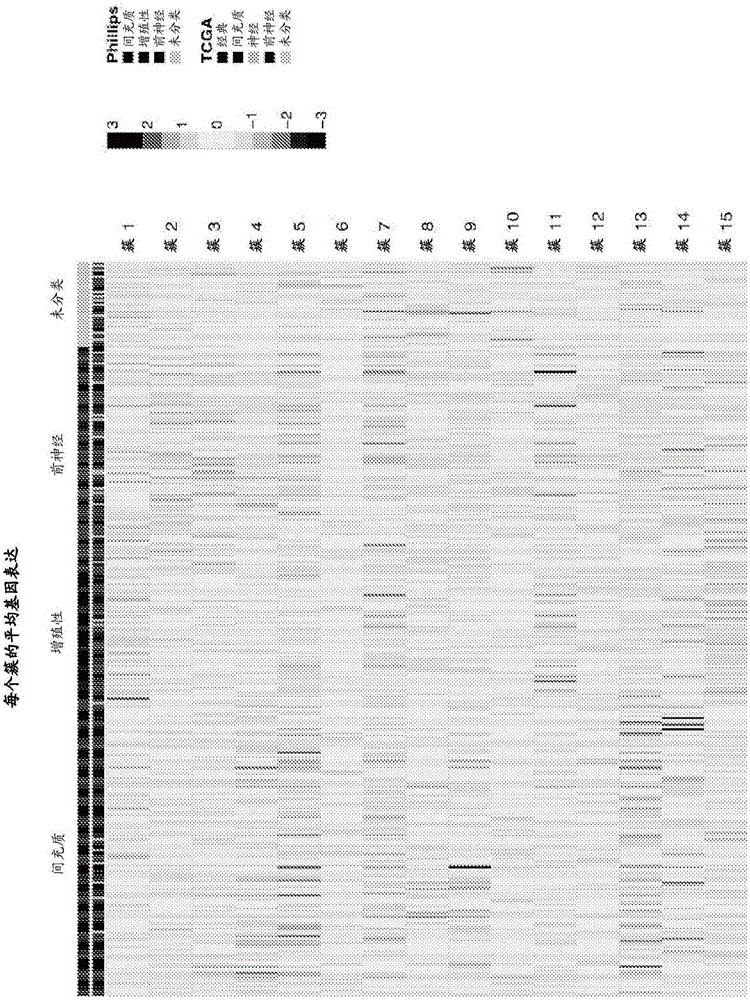
图2是显示来自AvaGlio的339份野生型IDH1样品间15个基因簇(行)中每一种的平均表达的热图。样品(列)是通过Phillips亚型标签排序的,而行是以它们的簇编号的次序显示的。
图3是显示自包括已知预后共变量和与处理分支相互作用的每一种簇的平均基因表达的多变量CoxPH模型获得的p值的图。柱的高度显示相互作用项(即,基因表达对于贝伐珠单抗处理对总体存活(OS)的预测价值)的p值。虚线指示0.05的原始p值。
图4是显示依照Phillips et al.,Cancer Cell.9(3):157-73,2006定义的GBM亚型间簇2的基因表达(z得分)的分布的箱线图。
图5是一张表,显示了当使用临床共变量和簇2的平均基因表达作为预报器将多变量CoxPH模型拟合至完全生物标志物可得AvaGlio群体的OS时簇2的平均基因表达显著地既是预后性的又是预测性的。*指示p值≤0.05;**指示p值≤0.01;而***指示p值≤0.001。
图6是一张表,显示了当使用临床共变量和簇2的平均基因表达作为预报器将多变量CoxPH模型拟合至AvaGlio群体中的仅前神经GBM患者(如通过Phillips分类的)的OS时簇2的平均基因表达既不是预后性的也不是预测性的。*指示p值≤0.05;**指示p值≤0.01;而***指示p值≤0.001。
图7是一张表,显示了当使用临床共变量和簇2的平均基因表达作为预报器将多变量CoxPH模型拟合至AvaGlio群体中的仅增殖性GBM患者(如通过Phillips分类的)的OS时簇2的平均基因表达是预后性的但不是预测性的。*指示p值≤0.05;**指示p值≤0.01;而***指示p值≤0.001。
图8是一张表,显示了当使用临床共变量和簇2的平均基因表达作为预报器将多变量CoxPH模型拟合至AvaGlio群体中的仅间充质GBM患者(如通过Phillips分类的)的OS时簇2的平均基因表达既不是预后性的也不是预测性的。*指示p值≤0.05;**指示p值≤0.01;而***指示p值≤0.001。
图9是一张表,显示了当使用临床共变量和簇2的平均基因表达作为预报器将多变量CoxPH模型拟合至AvaGlio群体中的非前神经GBM患者(如通过Phillips分类的)的OS时簇2的平均基因表达既不是预后性的也不是预测性的。*指示p值≤0.05;**指示p值≤0.01;而***指示p值≤0.001。
图10A是显示AvaGlio试验的安慰剂处理分支中簇2“生物标志物高”(带有三角形标记的线)和“生物标志物低”(带有正方形标记的线)患者的OS的Kaplan Meier曲线的图。对于簇2基因的二元化表达,AvaGlio中值以上的患者认为是“生物标志物高”,而AvaGlio中值以下的患者认为是“生物标志物低”。p值是自单变量CoxPH模型获得的,没有并入别的临床共变量,因为它们无法并入Kaplan-Meier图。p值=0.01。
图10B是显示AvaGlio试验的贝伐珠单抗处理分支中簇2“生物标志物高”(带有三角形标记的线)和“生物标志物低”(带有正方形标记的线)患者的OS的Kaplan Meier曲线的图。对于簇2基因的二元化表达,AvaGlio中值以上的患者认为是“生物标志物高”,而AvaGlio中值以下的患者认为是“生物标志物低”。p值是自单变量CoxPH模型获得的,没有并入别的临床共变量,因为它们无法并入Kaplan-Meier图。p值=0.887。
图10C是显示AvaGlio试验的安慰剂处理分支(虚线)和贝伐珠单抗处理分支(实线)中簇2“生物标志物低”患者的OS的Kaplan Meier曲线的图。对于簇2基因的二元化表达,AvaGlio中值以上的患者认为是“生物标志物高”,而AvaGlio中值以下的患者认为是“生物标志物低”。p值是自单变量CoxPH模型获得的,没有并入别的临床共变量,因为它们无法并入Kaplan-Meier图。p值=0.621。
图10D是显示AvaGlio试验的安慰剂处理分支(虚线)和贝伐珠单抗处理分支(实线)中簇2“生物标志物高”患者OS的Kaplan Meier曲线的图。对于簇2基因的二元化表达,AvaGlio中值以上的患者认为是“生物标志物高”,而AvaGlio中值以下的患者认为是“生物标志物低”。p值是自单变量CoxPH模型获得的,没有并入别的临床共变量,因为它们无法并入Kaplan-Meier图。p值=0.038。
图11是显示依照Phillips et al.,Cancer Cell.9(3):157-73,2006定义的GBM亚型间簇6的基因表达(z得分)的分布的箱线图。
图12是一张表,显示了当使用临床共变量和簇6的平均基因表达作为预报器将多变量CoxPH模型拟合至完全生物标志物可得AvaGlio群体的OS时簇6的平均基因表达显著地既是预后性的又是预测性的。*指示p值≤0.05;**指示p值≤0.01;而***指示p值≤0.001。
图13是一张表,显示了当使用临床共变量和簇6的平均基因表达作为预报器将多变量CoxPH模型拟合至AvaGlio群体中的仅前神经GBM患者(如通过Phillips分类的)的OS时簇6的平均基因表达既不是预后性的也不是预测性的。*指示p值≤0.05;**指示p值≤0.01;而***指示p值≤0.001。
图14是一张表,显示了当使用临床共变量和簇6的平均基因表达作为预报器将多变量CoxPH模型拟合至AvaGlio群体中的仅增殖性GBM患者(如通过Phillips分类的)的OS时簇6的平均基因表达是预后性的但不是预测性的。*指示p值≤0.05;**指示p值≤0.01;而***指示p值≤0.001。
图15是一张表,显示了当使用临床共变量和簇6的平均基因表达作为预报器将多变量CoxPH模型拟合至AvaGlio群体中的仅间充质GBM患者(如通过Phillips分类的)的OS时簇6的平均基因表达既不是预后性的也不是预测性的。*指示p值≤0.05;**指示p值≤0.01;而***指示p值≤0.001。
图16是一张表,显示了当使用临床共变量和簇6的平均基因表达作为预报器将多变量CoxPH模型拟合至AvaGlio群体中的非前神经GBM患者(如通过Phillips分类的)的OS时簇6的平均基因表达既是预后性的又是预测性的。*指示p值≤0.05;**指示p值≤0.01;而***指示p值≤0.001。
图17A是显示AvaGlio试验的安慰剂处理分支中簇6“生物标志物高”(带有三角形标记的线)和“生物标志物低”(带有正方形标记的线)患者的OS的Kaplan Meier曲线的图。对于簇6基因的二元化表达,AvaGlio中值以上的患者认为是“生物标志物高”,而AvaGlio中值以下的患者认为是“生物标志物低”。p值是自单变量CoxPH模型获得的,没有并入别的临床共变量,因为它们无法并入Kaplan-Meier图。p值=0.001。
图17B是显示AvaGlio试验的贝伐珠单抗处理分支中簇6“生物标志物高”(带有三角形标记的线)和“生物标志物低”(带有正方形标记的线)患者的OS的Kaplan Meier曲线的图。对于簇6基因的二元化表达,AvaGlio中值以上的患者认为是“生物标志物高”,而AvaGlio中值以下的患者认为是“生物标志物低”。p值是自单变量CoxPH模型获得的,没有并入别的临床共变量,因为它们无法并入Kaplan-Meier图。p值=0.271。
图17C是显示AvaGlio试验的安慰剂处理分支(虚线)和贝伐珠单抗处理分支(实线)中簇6“生物标志物低”患者的OS的Kaplan Meier曲线的图。对于簇6基因的二元化表达,AvaGlio中值以上的患者认为是“生物标志物高”,而AvaGlio中值以下的患者认为是“生物标志物低”。p值是自单变量CoxPH模型获得的,没有并入别的临床共变量,因为它们无法并入Kaplan-Meier图。p值=0.044。
图17D是显示AvaGlio试验的安慰剂处理分支(虚线)和贝伐珠单抗处理分支(实线)中簇6“生物标志物高”患者OS的Kaplan Meier曲线的图。对于簇6基因的二元化表达,AvaGlio中值以上的患者认为是“生物标志物高”,而AvaGlio中值以下的患者认为是“生物标志物低”。p值是自单变量CoxPH模型获得的,没有并入别的临床共变量,因为它们无法并入Kaplan-Meier图。p值=0.735。
发明详述
I.导言
本发明提供用于监测和/或鉴定对VEGF拮抗剂(例如抗VEGF抗体)治疗敏感或响应性的具有成胶质细胞瘤的患者的方法和组合物。本发明基于如下发现,即测定VEGF拮抗剂(诸如抗VEGF抗体)治疗之前选自AKT3,CDH1,CYP27B1,DNM3,DYNLL1,ERBB3,KLRK1,MBP,MDM2,NCAM1,PDGFRA,PRKCZ,SNCA,TNFRSF21,AXL,BCL2L1,CD36,ETS1,ICAM2,IL17A,IRS2,PDGFRB,RPL13A,TGFB1,TNFRSF4,TNFSF4,和ZBTB16的至少1,2,3,4,5,6,7,8,9,10,11,12,13,14,15,16,17,18,19,20,21,22,23,24,25,26,或27种基因的表达水平对于鉴定对VEGF拮抗剂(例如抗VEGF抗体)治疗敏感或响应性的患者是有用的。任选地,然后可以为患者选择VEGF拮抗剂疗法,并进一步任选地可以对该患者施用VEGF拮抗剂疗法。
II.定义
术语“抗血管发生剂”或“血管发生抑制剂”指或是直接或是间接抑制血管发生(angiogenesis),血管生成(vasculogenesis)或不想要的血管通透性的小分子量物质,多核苷酸,多肽,分离的蛋白质,重组蛋白,抗体,或其缀合物或融合蛋白。应当理解,抗血管发生剂包括那些结合血管发生性因子或其受体并阻断其血管发生活性的药剂。例如,抗血管发生剂是说明书全文定义的或本领域已知的血管发生剂的抗体或其它拮抗剂,例如但不限于VEGF-A的抗体,VEGF-A受体(例如KDR受体或Flt-1受体)的抗体,VEGF陷阱,抗PDGFR抑制剂诸如GleevecTM(Imatinib Mesylate)。抗血管发生剂还包括天然血管发生抑制剂,例如血管他丁(angiostatin),内皮他丁(endostatin)等。参见例如Klagsbrun and D′Amore,Annu.Rev.Physiol.,53:217-39(1991);Streit and Detmar,Oncogene,22:3172-3179(2003)(例如列举恶性黑素瘤中的抗血管发生疗法的表3);Ferrara&Alitalo,Nature Medicine 5:1359-1364(1999);Tonini et al.,Oncogene,22:6549-6556(2003)(例如列举已知的抗血管发生性因子的表2);及Sato.Int.J.Clin.Oncol.,8:200-206(2003)(例如列举临床试验中所使用的抗血管发生剂的表1)。
本文中的术语“抗体”以最广义使用,并且涵盖各种抗体结构,包括但不限于单克隆抗体,多克隆抗体,多特异性抗体(例如双特异性抗体),和抗体片段,只要它们展现出期望的抗原结合活性。
术语“VEGF”或“VEGF-A”用于指165个氨基酸的人血管内皮细胞生长因子及相关的121个,145个,189个和206个氨基酸的人血管内皮细胞生长因子,如例如Leung et al.,Science,246:1306(1989);及Houck et al.,Mol.Endocrin.,5:1806(1991)所述,及其天然存在的等位基因形式和加工形式。VEGF-A是包括VEGF-B,VEGF-C,VEGF-D,VEGF-E,VEGF-F和PlGF在内的基因家族的一部分。VEGF-A主要结合两种高亲和力受体酪氨酸激酶,即VEGFR-1(Flt-1)和VEGFR-2(Flk-1/KDR),后者是VEGF-A血管内皮细胞有丝分裂信号的主要递质。另外,神经毡蛋白-1已经被鉴定为肝素结合VEGF-A同等型(isoform)的受体,而且可在血管发育中发挥作用。术语“VEGF”或“VEGF-A”还指来自非人物种诸如小鼠,大鼠或灵长类动物的VEGF。有时,来自特定物种的VEGF表示如下,hVEGF表示人VEGF,mVEGF表示鼠VEGF。通常,VEGF指人VEGF。术语“VEGF”还用于指包含165个氨基酸的人血管内皮细胞生长因子的氨基酸8-109或1-109的多肽的截短形式或片段。本申请中可能通过例如“VEGF(8-109)”,“VEGF(1-109)”或“VEGF165”来鉴别任何此类形式VEGF的提述。“截短的”天然VEGF的氨基酸位置如天然VEGF序列中所示编号。例如,截短的天然VEGF中的第17位氨基酸(甲硫氨酸)也是天然VEGF中的第17位(甲硫氨酸)。截短的天然VEGF具有与天然VEGF相当的对KDR和Flt-1受体的结合亲和力。
“抗VEGF抗体”指以足够亲和力和特异性结合VEGF的抗体。所选择的抗体通常会具有对VEGF的结合亲和力,例如,该抗体可以以介于100nM-1pM之间的Kd值结合hVEGF。抗体亲和力可通过例如基于表面等离振子共振的测定法(诸如PCT申请公开文本No.WO2005/012359中所记载的BIAcore测定法);酶联免疫吸附测定法(ELISA);和竞争测定法(例如RIA)来测定。在某些实施方案中,本发明的抗VEGF抗体可用作治疗剂,用于靶向和干扰其中涉及VEGF活性的疾病或疾患。还有,可对该抗体进行其它生物学活性测定法,例如为了评估其作为治疗剂的效力。此类测定法是本领域已知的,而且取决于抗体的靶抗原和预定用途。例子包括HUVEC抑制测定法;肿瘤细胞生长抑制测定法(如例如WO 89/06692中所记载的);抗体依赖性细胞的细胞毒性(ADCC)和补体介导的细胞毒性(CDC)测定法(美国专利No.5,500,362);及激动活性或造血测定法(参见WO 95/27062)。抗VEGF抗体通常不会结合其它VEGF同系物,诸如VEGF-B或VEGF-C,也不会结合其它生长因子,诸如PlGF,PDGF或bFGF。
依照本发明的“B20系列抗体”指自B20抗体的序列衍生的抗VEGF抗体或依照PCT公开文本No.WO2005/012359的图27-29之任一的B20衍生抗体,通过述及将其整个公开内容明确收入本文。还可参见PCT公开文本No.WO2005/044853和美国专利申请60/991,302,通过述及将这些专利申请的内容明确收入本文。在一个实施方案中,B20系列抗体结合人VEGF上的功能性表位,其包含残基F17,M18,D19,Y21,Y25,Q89,I91,K101,E103,和C104。
依照本发明的“G6系列抗体”指自G6抗体的序列衍生的抗VEGF抗体或依照PCT公开文本No.WO2005/012359的图7,24-26,和34-35之任一的G6衍生抗体,通过述及将其整个公开内容明确收入本文。还可参见PCT公开文本No.WO2005/044853,通过述及将其整个公开内容明确收入本文。在一个实施方案中,G6系列抗体结合人VEGF上的功能性表位,其包含残基F17,Y21,Q22,Y25,D63,I83和Q89。
抗VEGF抗体“贝伐珠单抗”(Bevacizumab;BV或Bev)是依照Presta et al.,Cancer Res.57:4593-4599(1997)生成的重组人源化抗VEGF单克隆抗体,也称作“rhuMAb VEGF”或它包含突变的人IgG1框架区和来自鼠抗hVEGF单克隆抗体A.4.6.1(其阻断人VEGF对其受体的结合)的抗原结合互补决定区。贝伐珠单抗大约93%的氨基酸序列(包括大部分框架区)衍生自人IgG1,而约7%的序列衍生自鼠抗体A4.6.1。贝伐珠单抗具有约149,000道尔顿的分子量且是糖基化的。其它抗VEGF抗体包括美国专利No.6,884,879和WO 2005/044853中记载的抗体。
“表位A4.6.1”指受抗VEGF抗体贝伐珠单抗(参见Muller et al.,Structure 6:1153-1167,1998)识别的表位。在本发明的某些实施方案中,抗VEGF抗体包括但不限于与由杂交瘤ATCC HB 10709生成的单克隆抗VEGF抗体A4.6.1;依照Presta et al.,Cancer Res.57:4593-4599,1997生成的重组人源化抗VEGF单克隆抗体结合相同表位的单克隆抗体。
依照本发明的“功能性表位”指抗原中有力地促进抗体结合的氨基酸残基。抗原中有力贡献的残基中任一个的突变(例如,丙氨酸对野生型VEGF的突变或同系物突变)会破坏抗体的结合,使得抗体的相对亲和力比(IC50突变型VEGF/IC50野生型VEGF)会大于5(参见WO2005/012359的实施例2)。在一个实施方案中,相对亲和力比是通过溶液结合噬菌体展示ELISA测定的。简言之,将96孔Maxisorp免疫板(NUNC)用Fab形式的待测试抗体以PBS中2μg/ml的浓度于4℃包被过夜,并用PBS,0.5%BSA,和0.05%Tween20(PBT)于室温封闭2小时。首先将展示hVEGF丙氨酸点突变体(残基8-109形式)或野生型hVEGF(8-109)的噬菌体在PBT中的连续稀释液在Fab包被的板上于室温温育15分钟,并用PBS,0.05%Tween20(PBST)清洗板。用在PBT中1:5000稀释的抗M13单克隆抗体辣根过氧化物酶(Amersham Pharmacia)缀合物检测所结合的噬菌体,用3,3’,5,5’-四甲基联苯胺(TMB,Kirkegaard&Perry Labs,Gaithersburg,MD)底物显色大约5分钟,用1.0M H3PO4淬灭,并以分光光度法于450nm读数。IC50值的比(IC50,ala/IC50,wt)代表了结合亲和力的降低倍数(相对结合亲和力)。
抗VEGF抗体雷尼珠单抗(Ranibizumab)或抗体或rhuFab V2是一种人源化的亲和力成熟的抗人VEGF Fab片段。雷尼珠单抗是通过大肠杆菌表达载体中的标准重组技术方法和细菌发酵生成的。雷尼珠单抗不是糖基化的且具有约48,000道尔顿的分子量。参见WO 98/45331及US2003/0190317。
“分离的”抗体指已经鉴定且自其天然环境的成分分开和/或回收的抗体。其天然环境的污染性成分指会干扰该抗体的研究,诊断或治疗用途的物质,可包括酶,激素,和其它蛋白质性质或非蛋白质性质的溶质。在有些实施方案中,将抗体纯化至(1)根据例如Lowry法的测定,抗体重量超过95%,而在有些实施方案中,重量超过99%,(2)足以通过使用例如转杯式测序仪获得至少15个残基的N端或内部氨基酸序列的程度,或(3)根据还原性或非还原性条件下的SDS-PAGE及使用例如考马斯蓝或银染剂,达到同质。既然抗体天然环境的至少一种成分不会存在,那么分离的抗体包括重组细胞内的原位抗体。然而,分离的抗体通常会通过至少一个纯化步骤来制备。
“天然抗体”指通常由两条相同的轻(L)链和两条相同的重(H)链构成的约150,000道尔顿的异四聚体糖蛋白。每条轻链通过一个共价二硫键与重链连接,而二硫化物连接的数目在不同免疫球蛋白同种型的重链间有变化。每条重链和轻链还具有间隔规律的链内二硫桥。每条重链在一端具有一个可变域(VH),接着是多个恒定域。每条轻链在一端具有一个可变域(VL),而另一端是一个恒定域。轻链的恒定域与重链的第一恒定域排列在一起,而轻链的可变域与重链的可变域排列在一起。认为特定的氨基酸残基在轻链和重链可变域之间形成界面。
抗体的“可变区”或“可变域”指抗体重链或轻链的氨基端结构域。重链的可变域可以称为“VH”。轻链的可变域可以称为“VL”。这些结构域一般是抗体的最易变部分且包含抗原结合位点。
术语“可变的”指可变域中的某些部分在抗体间序列差异广泛且用于每种特定抗体对其特定抗原的结合和特异性的实情。然而,变异性并非均匀分布于抗体的整个可变域。它集中于轻链和重链可变域中称作高变区(HVR)的三个区段。可变域中更加高度保守的部分称作框架区(FR)。天然重链和轻链的可变域各自包含四个FR区,它们大多采取β-片层构象,通过三个HVR连接,HVR形成连接β-片层结构的环且在有些情况中形成β-片层结构的一部分。每条链中的HVR通过FR区非常接近的保持在一起,并与另一条链的HVR一起促成抗体的抗原结合位点的形成(参见Kabat et al.,Sequences of Proteins of Immunological Interest,第5版,National Institute of Health,Bethesda,MD(1991))。恒定域不直接参与抗体与抗原的结合,但展现出多种效应器功能,诸如抗体在抗体依赖性细胞的毒性中的参与。
根据其恒定域的氨基酸序列,来自任何脊椎动物物种的抗体(免疫球蛋白)的“轻链”可归入两种截然不同的型中的一种,称作卡帕(κ)和拉姆达(λ)。
根据其重链恒定域的氨基酸序列,抗体(免疫球蛋白)可归入不同的类。免疫球蛋白有五大类:IgA,IgD,IgE,IgG和IgM,其中有些可进一步分为亚类(同种型),例如IgG1,IgG2,IgG3,IgG4,IgA1和IgA2。将与不同类的免疫球蛋白对应的重链恒定域分别称作α,δ,ε,γ和μ。不同类的免疫球蛋白的亚基结构和三维构造是众所周知的,一般性描述于例如Abbas et al.,Cellular and Mol.Immunology,4th ed.(W.B.Saunders,Co.,2000)。抗体可以是抗体与一种或多种其它蛋白质或肽共价或非共价联合而形成的更大融合分子的一部分。
术语“全长抗体”,“完整抗体”和“完全抗体”在本文中可互换使用,指基本上完整形式的抗体而非下文定义的抗体片段。该术语具体指重链包含Fc区的抗体。
“抗体片段”包含完整抗体的一部分,优选包含其抗原结合区。抗体片段的例子包括Fab,Fab′,F(ab′)2和Fv片段;双抗体(diabody);线性抗体;单链抗体分子;及自抗体片段形成的多特异性抗体。
用木瓜蛋白酶消化抗体产生两个相同的抗原结合片段,称为“Fab”片段,各自具有一个抗原结合位点,及一个剩余的“Fc”片段,其名称反映了它易于结晶的能力。胃蛋白酶处理产生一个F(ab′)2片段,它具有两个抗原结合位点且仍能够交联抗原。
“Fv”是包含完整抗原结合位点的最小限度抗体片段。在一个实施方案中,双链Fv种类由紧密,非共价联合的一个重链可变域和一个轻链可变域的二聚体组成。在单链Fv(scFv)种类中,一个重链可变域和一个轻链可变域可以通过柔性肽接头共价连接,使得轻链和重链可以以与双链Fv种类类似的“二聚体”结构联合。正是在这种构造中,每个可变域的三个HVR相互作用而在VH-VL二聚体表面上限定了一个抗原结合位点。六个HVR一起赋予抗体以抗原结合特异性。然而,即使是单个可变域(或是只包含对抗原特异性的三个HVR的半个Fv)也具有识别和结合抗原的能力,只是亲和力低于完整结合位点。
Fab片段包含重链和轻链可变域,而且还包含轻链的恒定域和重链的第一恒定域(CH1)。Fab′片段与Fab片段的不同之处在于重链CH1结构域的羧基末端增加了少数残基,包括来自抗体铰链区的一个或多个半胱氨酸。Fab′-SH是本文中对其中恒定域半胱氨酸残基携带游离硫醇基团的Fab′的称谓。F(ab′)2抗体片段最初是作为在Fab′片段之间有铰链半胱氨酸的成对Fab′片段生成的。还知道抗体片段的其它化学偶联。
“单链Fv”或“scFv”抗体片段包含抗体的VH和VL结构域,其中这些结构域存在于一条多肽链上。一般而言,scFv多肽在VH与VL结构域之间进一步包含多肽接头,其使得scFv能够形成结合抗原的期望结构。关于scFv的综述参见例如Pluckthün,于The Pharmacology of Monoclonal Antibodies,第113卷,Rosenburg和Moore编,Springer-Verlag,New York,1994,第269-315页。
术语“双抗体”指具有两个抗原结合位点的抗体片段,该片段在同一条多肽链(VH-VL)中包含相连的重链可变域(VH)和轻链可变域(VL)。通过使用过短的接头使得同一条链上的两个结构域之间不能配对,迫使这些结构域与另一条链的互补结构域配对,从而产生两个抗原结合位点。双抗体可以是二价的或双特异性的。双抗体更完整的记载于例如EP 404,097;WO 1993/01161;Hudson et al.,Nat.Med.9:129-134(2003);及Hollinger et al.,PNAS USA90:6444-6448(1993)。三抗体(Triabody)和四抗体(tetrabody)也记载于Hudson et al.,Nat.Med.9:129-134(2003)。
如本文中使用的,术语“单克隆抗体”指从一群基本上同质的抗体获得的抗体,即构成群体的各个抗体相同,除了可能以极小量存在的可能的突变,例如天然存在的突变。如此,修饰语“单克隆”表明抗体不是分立的抗体的混合物的特征。在某些实施方案中,此类单克隆抗体典型地包括包含结合靶物的多肽序列的抗体,其中靶物结合多肽序列是通过包括从众多多肽序列中选择单一靶物结合多肽序列在内的过程得到的。例如,选择过程可以是从众多克隆诸如杂交瘤克隆,噬菌体克隆或重组DNA克隆的集合中选择独特克隆。应当理解,所选择的靶物结合序列可进一步改变,例如为了提高对靶物的亲和力,将靶物结合序列人源化,提高其在细胞培养物中的产量,降低其在体内的免疫原性,创建多特异性抗体等,而且包含改变后的靶物结合序列的抗体也是本发明的单克隆抗体。与典型地包含针对不同决定簇(表位)的不同抗体的多克隆抗体制备物不同,单克隆抗体制备物的每个单克隆抗体针对抗原上的单一决定簇。在它们的特异性以外,单克隆抗体制备物的优势还在于它们通常未受到其它免疫球蛋白的污染。
修饰语“单克隆”表明抗体从基本上同质的抗体群获得的特征,不应解释为要求通过任何特定方法来生产抗体。例如,要依照本发明使用的单克隆抗体可通过多种技术来生成,包括例如杂交瘤法(例如Kohler and Milstein,Nature,256:495-497(1975);Hongo et al.,Hybridoma,14(3):253-260(1995);Harlow et al.,Antibodies:A Laboratory Manual,Cold Spring Harbor Laboratory Press,2nd ed.(1988);Hammerling et al.,In:Monoclonal Antibodies and T-Cell Hybridomas,563-681(Elsevier,N.Y.,1981)),重组DNA法(参见例如美国专利No.4,816,567),噬菌体展示技术(参见例如Clackson et al.,Nature,352:624-628(1991);Marks et al.,J.Mol.Biol.222:581-597(1992);Sidhu et al.,J.Mol.Biol.338(2):299-310(2004);Lee et al.,J.Mol.Biol.340(5):1073-1093(2004);Fellouse,PNAS USA 101(34):12467-12472(2004);及Lee et al.,J.Immunol.Methods 284(1-2):119-132(2004)),及用于在具有部分或整个人免疫球蛋白基因座或编码人免疫球蛋白序列的基因的动物中生成人或人样抗体的技术(参见例如WO 1998/24893;WO 1996/34096;WO 1996/33735;WO 1991/10741;Jakobovits et al.,PNAS USA 90:2551(1993);Jakobovits et al.,Nature362:255-258(1993);Bruggemann et al.,Year in Immunol.7:33(1993);美国专利No.5,545,807;5,545,806;5,569,825;5,625,126;5,633,425;和5,661,016;Marks et al.,Bio/Technology 10:779-783(1992);Lonberg et al.,Nature368:856-859(1994);Morrison,Nature 368:812-813(1994);Fishwild et al.,Nature Biotechnol.14:845-851(1996);Neuberger,Nature Biotechnol.14:826(1996);及Lonberg and Huszar,Intern.Rev.Immunol.13:65-93(1995))。
单克隆抗体在本文中明确包括“嵌合”抗体,其中重链和/或轻链的一部分与衍生自特定物种或属于特定抗体类或亚类的抗体中的相应序列相同或同源,而链的剩余部分与衍生自另一物种或属于另一抗体类或亚类的抗体中的相应序列相同或同源,以及此类抗体的片段,只要它们展现出期望的生物学活性(例如美国专利No.4,816,567;Morrison et al.,PNAS USA 81:6851-6855(1984))。嵌合抗体包括抗体,其中抗体的抗原结合区衍生自通过例如给猕猴免疫接种感兴趣抗原而生成的抗体。
非人(例如鼠)抗体的“人源化”形式指最低限度包含衍生自非人免疫球蛋白的序列的嵌合抗体。在一个实施方案中,人源化抗体指人免疫球蛋白(受体抗体)中的HVR残基用具有期望特异性,亲和力和/或能力的非人物种(供体抗体)诸如小鼠,大鼠,家兔,或非人灵长类动物的HVR残基替换的免疫球蛋白。在有些情况中,将人免疫球蛋白的FR残基用相应的非人残基替换。此外,人源化抗体可包含在受体抗体或供体抗体中没有找到的残基。可以进行这些修饰来进一步改进抗体的性能。一般而言,人源化抗体将包含至少一个,通常两个基本上整个如下可变域,其中所有或基本上所有高变环对应于非人免疫球蛋白的高变环,且所有或基本上所有FR是人免疫球蛋白序列的FR。人源化抗体任选还将包含至少部分免疫球蛋白恒定区(Fc),通常是人免疫球蛋白的恒定区。更多细节参见例如Jones et al.,Nature 321:522-525(1986);Riechmann et al.,Nature 332:323-329(1988);及Presta,Curr.Op.Struct.Biol.2:593-596(1992)。还可参见例如Vaswani and Hamilton,Ann.Allergy,Asthma&Immunol.1:105-115(1998);Harris,Biochem.Soc.Transactions 23:1035-1038(1995);Hurle and Gross,Curr.Op.Biotech.5:428-433(1994);及美国专利No.6,982,321和7,087,409。
“人抗体”指拥有与由人生成的抗体的氨基酸序列对应的氨基酸序列和/或使用本文所公开的用于生成人抗体的任何技术生成的抗体。人抗体的这种定义明确排除包含非人抗原结合残基的人源化抗体。人抗体可使用本领域已知的多种技术来生成,包括噬菌体展示文库。Hoogenboom and Winter,J.Mol.Biol.,227:381(1991);及Marks et al.,J.Mol.Biol.,222:581(1991)。还可用于制备人单克隆抗体的是以下文献中记载的方法:Cole et al.,Monoclonal Antibodies and Cancer Therapy,Alan R.Liss,p.77(1985);Boerner et al.,J.Immunol.147(1):86-95(1991)。还可参见van Dijk and van de Winkel,Curr.Opin.Pharmacol.,5:368-374(2001)。可通过给已经修饰以应答抗原性攻击而生成人抗体但其内源基因座已经失能的转基因动物例如经过免疫的异种小鼠(xenomice)施用抗原来制备人抗体(参见例如美国专利No.6,075,181和6,150,584,关于XENOMOUSETM技术)。还可参见例如Li et al.,PNAS USA,103:3557-3562(2006),关于经人B细胞杂交瘤技术生成的人抗体。
术语“高变区”,“HVR”或“HV”在用于本文时指抗体可变域中序列上高度可变和/或形成结构上定义的环的区域。通常,抗体包含六个HVR:三个在VH中(H1,H2,H3),三个在VL中(L1,L2,L3)。在天然抗体中,H3和L3展示这六个HVR的最大多样性,而且认为特别是H3在赋予抗体以精密特异性中发挥独特作用。参见例如Xu et al.,Immunity 13:37-45(2000);Johnson and Wu,In:Methods in Molecular Biology,248:1-25(Lo,ed.,Human Press,Totowa,NJ,2003)。事实上,仅由重链组成的天然存在骆驼(camelid)抗体在缺乏轻链时是有功能的且稳定的。参见例如Hamers-Casterman et al.,Nature363:446-448(1993);及Sheriff et al.,Nature Struct.Biol.3:733-736(1996)。
本文中使用且涵盖许多HVR的叙述。作为Kabat互补决定区(CDR)的HVR是以序列变异性为基础的,而且是最常用的(Kabat et al.,Sequences of Proteins of Immunological Interest,5th ed.,Public Health Service,National Institutes of Health,Bethesda,MD(1991))。Chothia改为指结构环的位置(Chothia and Lesk,J.Mol.Biol.196:901-917(1987))。AbM HVR代表Kabat CDR与Chothia结构环之间的折衷,而且得到Oxford Molecular的AbM抗体建模软件的使用。“接触”HVR是以对可获得的复合物晶体结构的分析为基础的。下文记录了这些HVR中每一个的残基。
HVR可包括如下“延伸的HVR”:VL中的24-36或24-34(L1),46-56或50-56(L2)和89-97或89-96(L3)及VH中的26-35(H1),50-65或49-65(H2)和93-102,94-102或95-102(H3)。对于这些延伸的HVR定义中的每一个,可变域残基是依照Kabat等,见上文编号的。
“框架”或“FR”残基指可变域中除本文中所定义的HVR残基外的那些残基。
表述“依照Kabat的可变域残基编号方式”或“依照Kabat的氨基酸位置编号方式”及其变体指Kabat et al.,见上文中的抗体编辑用于重链可变域或轻链可变域的编号系统。使用此编号系统,实际的线性氨基酸序列可包含或多或少的氨基酸,对应于可变域FR或HVR的缩短或插入。例如,重链可变域可包含H2残基52后的单一氨基酸插入(依照Kabat为残基52a)及重链FR残基82后的插入残基(例如依照Kabat为残基82a,82b和82c等)。给定抗体的Kabat残基编号方式可通过将抗体序列与“标准”Kabat编号序列对比同源区来确定。
“亲和力成熟的”抗体指在抗体的一个或多个HVR中具有一处或多处改变,导致该抗体对抗原的亲和力与没有那些改变的亲本抗体相比有所改进的抗体。在一个实施方案,亲和力成熟的抗体具有纳摩尔或甚至皮摩尔量级的对靶抗原的亲和力。亲和力成熟的抗体可通过本领域已知规程来生成。例如,Marks et al.,Bio/Technology 10:779-783(1992)记载了通过VH和VL结构域改组进行的亲和力成熟。以下文献记载了HVR和/或框架残基的随机诱变,例如Barbas et al.,Proc Nat.Acad.Sci.USA 91:3809-3813(1994);Schier et al.,Gene 169:147-155(1995);Yelton et al.,J.Immunol.155:1994-2004(1995);Jackson et al.,J.Immunol.154(7):3310-3319(1995);及Hawkins et al.,J.Mol.Biol.226:889-896(1992)。
如本文中使用的,“拮抗剂”指抑制或降低它们所结合的分子的生物学活性的化合物或药剂。拮抗剂包括结合VEGF的抗体,合成或天然序列肽,免疫粘附素,和小分子拮抗剂,任选缀合有或融合至另一分子。“阻断性”抗体或“拮抗性”抗体指抑制或降低它所结合的抗原的生物学活性的抗体。
“VEGF拮抗剂”指能够中和,阻断,抑制,消除,降低或干扰VEGF活性,包括其与VEGF或一种或多种VEGF受体或编码它们的核酸结合的分子。优选的是,所述VEGF拮抗剂结合VEGF或VEGF受体。VEGF拮抗剂包括抗VEGF抗体及其抗原结合片段,结合VEGF和VEGF受体并阻断配体-受体相互作用的多肽(例如免疫粘附素,肽体),抗VEGF受体抗体和VEGF受体拮抗剂诸如VEGFR酪氨酸激酶的小分子抑制剂,结合VEGF的适体和在严格条件下与编码VEGF或VEGF受体的核酸序列杂交的核酸(例如RNAi)。依照一个优选的实施方案,所述VEGF拮抗剂在体外结合VEGF并抑制VEGF诱导的内皮细胞增殖。依照一个优选的实施方案,所述VEGF拮抗剂以大于非VEGF或非VEGF受体的亲和力结合VEGF或VEGF受体。依照一个优选的实施方案,所述VEGF拮抗剂以介于1uM和1pM之间的Kd结合VEGF或VEGF受体。依照另一个优选的实施方案,所述VEGF拮抗剂以介于500nM和1pM之间的Kd结合VEGF或VEGF受体。
依照一个优选的实施方案,所述VEGF拮抗剂选自:多肽诸如抗体,肽体,免疫粘附素,小分子或适体。在一个优选的实施方案中,所述抗体是抗VEGF抗体(诸如抗体)或抗VEGF受体抗体(诸如抗VEGFR2或抗VEGFR3抗体)。VEGF拮抗剂的其它例子包括:VEGF陷阱,Mucagen,PTK787,SU11248,AG-013736,Bay 439006(sorafenib),ZD-6474,CP632,CP-547632,AZD-2171,CDP-171,SU-14813,CHIR-258,AEE-788,SB786034,BAY579352,CDP-791,EG-3306,GW-786034,RWJ-417975/CT6758和KRN-633。
术语“抗肿瘤组合物”或“抗癌组合物”或“抗癌剂”指可用于治疗癌症的组合物,其包含至少一种活性治疗剂,例如“抗癌剂”。治疗剂(抗癌剂)的例子包括但不限于例如化疗剂,生长抑制剂,细胞毒剂,放射疗法中所使用的药剂,抗血管发生剂,凋亡剂,抗微管蛋白剂,和其它用于治疗癌症的药剂诸如抗HER-2抗体,抗CD20抗体,表皮生长因子受体(EGFR)拮抗剂(例如酪氨酸激酶抑制剂),HER1/EGFR抑制剂(例如厄洛替尼(TarcevaTM),血小板衍生生长因子抑制剂(例如GleevecTM(Imatinib Mesylate)),COX-2抑制剂(例如塞来考昔(celecoxib)),干扰素,细胞因子,能与ErbB2,ErbB3,ErbB4,PDGFR-β,BlyS,APRIL,BCMA,VEGF或VEGF受体中的一种或多种靶物结合的拮抗剂(例如中和性抗体),TRAIL/Apo2,及其它生物活性和有机化学剂等。本发明还包括它们的组合。
“化疗剂”指可用于治疗癌症的化学化合物。化疗剂的例子包括可用于治疗癌症的化学化合物。化疗剂的例子包括烷化剂类,诸如例如替莫唑胺(TMZ),即烷化剂达卡巴嗪的咪唑四嗪衍生物。化疗剂的别的例子包括例如帕利他赛或托泊替康或PEG化脂质体多柔比星(PLD)。化疗剂的其它例子包括烷化剂类(alkylating agents),诸如塞替派(thiotepa)和环磷酰胺(cyclosphosphamide);磺酸烷基酯类(alkyl sulfonates),诸如白消安(busulfan),英丙舒凡(improsulfan)和哌泊舒凡(piposulfan);氮丙啶类(aziridines),诸如苯佐替派(benzodopa),卡波醌(carboquone),美妥替派(meturedopa)和乌瑞替派(uredopa);乙撑亚胺类(ethylenimines)和甲基蜜胺类(methylamelamines),包括六甲蜜胺(altretamine),三乙撑蜜胺(triethylenemelamine),三乙撑磷酰胺(triethylenephosphoramide),三乙撑硫代磷酰胺(triethiylenethiophosphoramide)和三羟甲蜜胺(trimethylolomelamine);番荔枝内酯类(acetogenin)(尤其是布拉他辛(bullatacin)和布拉他辛酮(bullatacinone));喜树碱(camptothecin);苔藓抑素(bryostatin);callystatin;CC-1065(包括其阿多来新(adozelesin),卡折来新(carzelesin)和比折来新(bizelesin)合成类似物);隐藻素类(cryptophycins)(特别是隐藻素1和隐藻素8);多拉司他汀(dolastatin);duocarmycin(包括合成类似物,KW-2189和CB1-TM1);艾榴塞洛素(eleutherobin);pancratistatin;sarcodictyin;海绵抑素(spongistatin);氮芥类(nitrogen mustards),诸如苯丁酸氮芥(chlorambucil),萘氮芥(chlornaphazine),胆磷酰胺(cholophosphamide),雌莫司汀(estramustine),异环磷酰胺(ifosfamide),双氯乙基甲胺(mechlorethamine),盐酸氧氮芥(mechlorethamine oxide hydrochloride),美法仑(melphalan),新氮芥(novembichin),苯芥胆甾醇(phenesterine),泼尼莫司汀(prednimustine),曲磷胺(trofosfamide),尿嘧啶氮芥(uracil mustard);亚硝脲类(nitrosoureas),诸如卡莫司汀(carmustine),氯脲菌素(chlorozotocin),福莫司汀(fotemustine),洛莫司汀(lomustine),尼莫司汀(nimustine)和雷莫司汀(ranimnustine);抗生素类,诸如烯二炔类抗生素(enediyne)(如加利车霉素(calicheamicin),尤其是加利车霉素γ1I和加利车霉素ωI1(参见例如Agnew,Chem.Intl.Ed.Engl.,33:183-186(1994));蒽环类抗生素(dynemicin),包括dynemicin A;二膦酸盐类(bisphosphonates),诸如氯膦酸盐(clodronate);埃斯波霉素(esperamicin);以及新制癌素(neocarzinostatin)发色团和相关色蛋白烯二炔类抗生素发色团),阿克拉霉素(aclacinomysin),放线菌素(actinomycin),氨茴霉素(authramycin),偶氮丝氨酸(azaserine),博来霉素(bleomycin),放线菌素C(cactinomycin),carabicin,洋红霉素(caminomycin),嗜癌霉素(carzinophilin),色霉素(chromomycinis),放线菌素D(dactinomycin),柔红霉素(daunorubicin),地托比星(detorubicin),6-二氮-5-氧-L-正亮氨酸,多柔比星(doxorubicin)(包括吗啉代多柔比星,氰基吗啉代多柔比星,2-吡咯代多柔比星和脱氧多柔比星),表柔比星(epirubicin),依索比星(esorubicin),伊达比星(idarubicin),麻西罗霉素(marcellomycin),丝裂霉素类(mitomycins)诸如丝裂霉素C,霉酚酸(mycophenolic acid),诺拉霉素(nogalamycin),橄榄霉素(olivomycin),培洛霉素(peplomycin),泊非霉素(potfiromycin),嘌呤霉素(puromycin),三铁阿霉素(quelamycin),罗多比星(rodorubicin),链黑菌素(streptonigrin),链佐星(streptozocin),杀结核菌素(tubercidin),乌苯美司(ubenimex),净司他丁(zinostatin),佐柔比星(zorubicin);抗代谢物类,诸如甲氨蝶呤和5-氟尿嘧啶(5-FU);叶酸类似物,诸如二甲叶酸(denopterin),甲氨蝶呤,蝶酰三谷氨酸(pteropterin),三甲曲沙(trimetrexate);嘌呤类似物,诸如氟达拉滨(fludarabine),6-巯基嘌呤(mercaptopurine),硫咪嘌呤(thiamiprine),硫鸟嘌呤(thioguanine);嘧啶类似物,诸如安西他滨(ancitabine),阿扎胞苷(azacitidine),6-氮尿苷,卡莫氟(carmofur),阿糖胞苷(cytarabine),双脱氧尿苷(dideoxyuridine),去氧氟尿苷(doxifluridine),依诺他滨(enocitabine),氟尿苷(floxuridine);雄激素类,诸如卡鲁睾酮(calusterone),丙酸屈他雄酮(dromostanolone propionate),表硫雄醇(epitiostanol),美雄烷(mepitiostane),睾内酯(testolactone);抗肾上腺类,诸如氨鲁米特(aminoglutethimide),米托坦(mitotane),曲洛司坦(trilostane);叶酸补充剂,诸如亚叶酸(frolinic acid);醋葡醛内酯(aceglatone);醛磷酰胺糖苷(aldophosphamide glycoside);氨基乙酰丙酸(aminolevulinic acid);恩尿嘧啶(eniluracil);安吖啶(amsacrine);bestrabucil;比生群(bisantrene);依达曲沙(edatraxate);地磷酰胺(defosfamine);地美可辛(demecolcine);地吖醌(diaziquone);elformithine;依利醋铵(elliptinium acetate);埃坡霉素(epothilone);依托格鲁(etoglucid);硝酸镓;羟脲(hydroxyurea);香菇多糖(lentinan);氯尼达明(lonidamine);美登木素生物碱类(maytansinoids),诸如美登素(maytansine)和安丝菌素(ansainitocin);米托胍腙(mitoguazone);米托蒽醌(mitoxantrone);莫哌达醇(mopidanmol);二胺硝吖啶(nitraerine);喷司他丁(pentostatin);蛋氨氮芥(phenamet);吡柔比星(pirarubicin);洛索蒽醌(losoxantrone);鬼臼酸(podophyllinic acid);2-乙基酰肼(ethylhydrazide);丙卡巴肼(procarbazine);多糖复合物(JHS Natural Products,Eugene,Oreg.);雷佐生(razoxane);根霉素(rhizoxin);西索菲兰(sizofuran);螺旋锗(spirogermanium);细交链孢菌酮酸(tenuazonic acid);三亚胺醌(triaziquone);2,2′,2”-三氯三乙胺;单端孢菌素类(trichothecenes)(尤其是T-2毒素,疣孢菌素(verracurin)A,杆孢菌素(roridin)A和蛇行菌素(anguidine));乌拉坦(urethan);长春地辛(vindesine);达卡巴嗪(dacarbazine);甘露醇氮芥(mannomustine);二溴甘露醇(mitobronitol);二溴卫矛醇(mitolactol);哌泊溴烷(pipobroman);gacytosine;阿糖胞苷(arabinoside)(“Ara-C”);环磷酰胺(cyclophosphamide);塞替派(thiotepa);类紫杉烷(taxoids),例如帕利他赛(paclitaxel)(Bristol-Myers Squibb Oncology,Princeton,N.J.),不含克列莫佛(Cremophor),清蛋白改造的纳米颗粒剂型的帕利他赛(American Pharmaceutical Partners,Schaumberg,Ill.)和多西他塞(docetaxel)(Rhone-Poulenc Rorer,Antony,France);苯丁酸氮芥(chloranbucil);吉西他滨(gemcitabine);6-硫鸟嘌呤(thioguanine);巯基嘌呤(mercaptopurine);甲氨蝶呤(methotrexate);铂类似物,诸如顺铂(cisplatin),奥沙利铂(oxaliplatin)和卡铂(carboplatin);长春碱(vinblastine);铂;依托泊苷(etoposide)(VP-16);异环磷酰胺(ifosfamide);米托蒽醌(mitoxantrone);长春新碱(vincristine);长春瑞滨(vinorelbine);能灭瘤(novantrone);替尼泊苷(teniposide);依达曲沙(edatrexate);道诺霉素(daunomycin);氨基蝶呤(aminopterin);希罗达(xeloda);伊本膦酸盐(ibandronate);伊立替康(irinotecan)(Camptosar,CPT-11)(包括伊立替康及5-FU和亚叶酸(leucovorin)的治疗方案);拓扑异构酶抑制剂RFS 2000;二氟甲基鸟氨酸(DMFO);类视黄酸(retinoids),诸如视黄酸(retinoic acid);卡培他滨(capecitabine);考布他汀(combretastatin);亚叶酸(leucovorin)(LV);奥沙利铂(oxaliplatin),包括奥沙利铂治疗方案(FOLFOX);拉帕替尼(lapatinib)降低细胞增殖的PKC-α,Raf,H-Ras,EGFR(例如厄洛替尼(erlotinib))和VEGF-A抑制剂;及任何上述物质的药学可接受盐,酸或衍生物。
如本文中使用的,术语“细胞毒剂”指抑制或防止细胞的功能和/或引起细胞破坏的物质。该术语意图包括放射性同位素,例如At211,I131,I125,Y90,Re186,Re188,Sm153,Bi212,P32和Lu的放射性同位素;化疗剂,例如甲氨蝶呤(methotrexate),阿霉素(adriamicin),长春花生物碱类(vinca alkaloids)(长春新碱(vincristine),长春碱(vinblastine),依托泊苷(etoposide)),多柔比星(doxorubicin),美法仑(melphalan),丝裂霉素(mitomycin)C,苯丁酸氮芥(chlorambucil),柔红霉素(daunorubicin)或其它嵌入剂;酶及其片段,诸如溶核酶;抗生素;和毒素,诸如小分子毒素或者细菌,真菌,植物或动物起源的酶活毒素,包括其片段和/或变体;及下文披露的各种抗肿瘤剂或抗癌剂。下文记载了其它细胞毒剂。杀肿瘤剂引起肿瘤细胞的破坏。
“生长抑制剂”在用于本文时指在体外或在体内抑制细胞(例如表达Robo4的细胞)生长和/或增殖的化合物或组合物。如此,生长抑制剂可以是显著降低处于S期的表达Robo4的细胞百分比的药剂。生长抑制剂的例子包括阻断细胞周期行进(处于S期以外的位置)的药剂,诸如诱导G1停滞和M期停滞的药剂。经典的M期阻断剂包括长春药类(vincas)(长春新碱(vincristine)和长春碱(vinblastine)),紫杉烷类(taxanes),和拓扑异构酶II抑制剂诸如蒽环类抗生素多柔比星(doxorubicin)((8S-顺式)-10-[(3-氨基-2,3,6-三脱氧-α-L-来苏-吡喃己糖基)氧基]-7,8,9,10-四氢-6,8,11-三羟基-8-(羟基乙酰基)-1-甲氧基-5,12-萘二酮,即(8S-cis)-10-[(3-amino-2,3,6-trideoxy-α-L-lyxo-hexapyranosyl)oxy]-7,8,9,10-tetra hydro-6,8,11-trihydroxy-8-(hydroxyacetyl)-1-methoxy-5,12-naphthacenedione),表柔比星(epirubicin),柔红霉素(daunorubicin),依托泊苷(etoposide)和博来霉素(bleomycin)。那些阻滞G1的药剂也溢出进入S期停滞,例如DNA烷化剂类诸如他莫昔芬(tamoxifen),泼尼松(prednisone),达卡巴嗪(dacarbazine),双氯乙基甲胺(mechlorethamine),顺铂(cisplatin),甲氨蝶呤(methotrexate),5-氟尿嘧啶(5-fluorouracil)和ara-C。更多信息可参见The Molecular Basis of Cancer,Mendelsohn and Israel编,Chapter 1,题为"Cell cycle regulation,oncogenes,and anti-neoplastic drugs",Murakami et al.(WB Saunders:Philadelphia,1995),尤其是第13页。紫杉烷类(帕利他赛(paclitaxel)和多西他赛(docetaxel))是衍生自紫杉树的抗癌药。衍生自欧洲紫杉的多西他赛(Rhone-Poulenc Rorer)是帕利他赛(Bristol-Myers Squibb)的半合成类似物。帕利他赛和多西他赛促进由微管蛋白二聚体装配成微管并通过防止解聚使微管稳定,导致对细胞中有丝分裂的抑制。
术语“生物标志物”和“标志物”在本文中可互换使用,指基于DNA,RNA,蛋白质,碳水化合物,或糖脂的分子标志物,它们在受试者的或患者的样品中的表达或存在可通过标准方法(或本文中所公开的方法)来检测,而且可用于监测哺乳动物受试者对VEGF拮抗剂的响应性或敏感性。此类生物标志物包括但不限于下述基因:AKT3,CDH1,CYP27B1,DNM3,DYNLL1,ERBB3,KLRK1,MBP,MDM2,NCAM1,PDGFRA,PRKCZ,SNCA,TNFRSF21,AXL,BCL2L1,CD36,ETS1,ICAM2,IL17A,IRS2,PDGFRB,RPL13A,TGFB1,TNFRSF4,TNFSF4,和ZBTB16。此类生物标志物的表达可测定为自对VEGF拮抗剂敏感或响应性的患者获得的样品中的比参照水平(包括例如来自患者(例如具有成胶质细胞瘤且正在测试对VEGF拮抗剂的响应性的患者)组/群体的样品中生物标志物的中值表达水平;来自患者(例如具有成胶质细胞瘤且鉴定为不响应VEGF拮抗剂治疗的患者)组/群体的样品中生物标志物的中值表达水平;在在先的时间先前自个体获得的样品中的水平;或来自在原发性肿瘤设置中接受VEGF拮抗剂(诸如抗VEGF抗体)在先治疗且现在可能正在经历转移的患者的样品中的水平)要高或低。具有大于或小于至少一种基因(诸如AKT3,CDH1,CYP27B1,DNM3,DYNLL1,ERBB3,KLRK1,MBP,MDM2,NCAM1,PDGFRA,PRKCZ,SNCA,TNFRSF21,AXL,BCL2L1,CD36,ETS1,ICAM2,IL17A,IRS2,PDGFRB,RPL13A,TGFB1,TNFRSF4,TNFSF4,和/或ZBTB16)的参照表达水平(例如大于AKT3,CDH1,CYP27B1,DNM3,DYNLL1,ERBB3,KLRK1,MBP,MDM2,NCAM1,PDGFRA,PRKCZ,SNCA,和/或TNFRSF21中一种或多种的参照表达水平或小于AXL,BCL2L1,CD36,ETS1,ICAM2,IL17A,IRS2,PDGFRB,RPL13A,TGFB1,TNFRSF4,和/或TNFSF4中一种或多种的参照表达水平)的表达水平的个体可以鉴定为很可能响应VEGF拮抗剂治疗的受试者/患者。例如,此类在最极端的情况下相对于(即高于或低于)参照水平(诸如中值水平,如上所述)展现50%,45%,40%,35%,30%,25%,20%,15%,10%,或5%基因表达水平的受试者/患者可以鉴定为很可能响应VEGF拮抗剂(诸如抗VEGF抗体)治疗的受试者/患者(例如具有成胶质细胞瘤的患者)。
术语“表达的水平”或“表达水平”可互换使用,一般指生物学样品中多核苷酸或氨基酸产物或蛋白质的量。“表达”一般指基因所编码的信息转换成细胞中存在的和运行的结构的过程。因此,依照本发明,基因的“表达”可以指转录成多核苷酸,翻译成蛋白质,或甚至蛋白质的翻译后修饰。转录得到的多核苷酸的,翻译得到的蛋白质的,或翻译后修饰得到的蛋白质的片段也应视为表达的,无论它们是源自通过可变剪接生成的转录物或经过降解的转录物,或者是源自蛋白质的翻译后加工(例如通过蛋白水解)。“表达的基因”包括转录成多核苷酸(像mRNA),然后翻译成蛋白质的基因,还有转录成RNA但不翻译成蛋白质的基因(例如转运RNA或核糖体RNA)。
术语“样品”和“生物学样品”可互换使用,指任何自个体获得的生物学样品,包括体液,身体组织(例如肿瘤组织),细胞,或其它来源。体液是例如淋巴,血清,新鲜全血,外周血单个核细胞,冷冻的全血,血浆(包括新鲜的或冷冻的),尿液,唾液,精液,滑液和脊髓液。样品还包括乳房组织,肾组织,结肠组织,脑组织,肌肉组织,滑膜组织,皮肤,毛囊,骨髓,和肿瘤组织。用于自哺乳动物获得组织活检和体液的方法是本领域公知的。
如本文中使用的,“治疗”或“处理”(及其语法变型)指试图改变所治疗个体的自然进程的临床干预,可以是为了预防或在临床病理学的进程中实施的。治疗的期望效果包括但不限于预防疾病的发生或复发,缓解症状,削弱疾病的任何直接或间接病理学后果,防止转移,延长总体存活(OS),延长无进展存活(PFS),减缓疾病进展的速率,改善或减轻疾病状态,及消退或改善预后。
如本文中使用的,就治疗而言短语“告知患者”或“对患者提供推荐”指使用涉及患者的样品中AKT3,CDH1,CYP27B1,DNM3,DYNLL1,ERBB3,KLRK1,MBP,MDM2,NCAM1,PDGFRA,PRKCZ,SNCA,TNFRSF21,AXL,BCL2L1,CD36,ETS1,ICAM2,IL17A,IRS2,PDGFRB,RPL13A,TGFB1,TNFRSF4,TNFSF4,和/或ZBTB16中至少一种(例如AKT3,CDH1,CYP27B1,DNM3,DYNLL1,ERBB3,KLRK1,MBP,MDM2,NCAM1,PDGFRA,PRKCZ,SNCA,和/或TNFRSF21中一种或多种或AXL,BCL2L1,CD36,ETS1,ICAM2,IL17A,IRS2,PDGFRB,RPL13A,TGFB1,TNFRSF4,和/或TNFSF4中一种或多种)的水平或存在生成的信息或数据将患者鉴定为用某种疗法治疗是恰当的或不恰当的。在一些实施方案中,疗法可包含VEGF拮抗剂(例如抗VEGF抗体,例如贝伐珠单抗)。在一些实施方案中,推荐可包括鉴定需要调整施用的VEGF拮抗剂(例如抗VEGF抗体,例如贝伐珠单抗)的有效量的患者。在一些实施方案中,推荐治疗包括推荐调整施用的VEGF拮抗剂(例如抗VEGF抗体,例如贝伐珠单抗)的量。如本文中使用的,就治疗而言短语“告知患者”或“对患者提供推荐”还可以指使用生成的信息或数据为鉴定或选择为更加可能或不太可能响应包含VEGF拮抗剂的疗法的患者建议或选择包含VEGF拮抗剂(例如抗VEGF抗体,例如贝伐珠单抗)的疗法。使用或生成的信息或数据可以是任何形式的,书面的,口头的或电子的。在一些实施方案中,使用生成的信息或数据包括传达,呈现,报告,存储,发送,转移,供应,传输,分发,或其组合。在一些实施方案中,传达,呈现,报告,存储,发送,转移,供应,传输,分发,或其组合是由计算装置,分析单元或其组合实施的。在一些进一步的实施方案中,传达,呈现,报告,存储,发送,转移,供应,传输,分发,或其组合是由实验室或医学专业人员实施的。在一些实施方案中,信息或数据包括AKT3,CDH1,CYP27B1,DNM3,DYNLL1,ERBB3,KLRK1,MBP,MDM2,NCAM1,PDGFRA,PRKCZ,SNCA,TNFRSF21,AXL,BCL2L1,CD36,ETS1,ICAM2,IL17A,IRS2,PDGFRB,RPL13A,TGFB1,TNFRSF4,TNFSF4,和/或ZBTB16中至少一种(例如AKT3,CDH1,CYP27B1,DNM3,DYNLL1,ERBB3,KLRK1,MBP,MDM2,NCAM1,PDGFRA,PRKCZ,SNCA,和/或TNFRSF21中的一种或多种或AXL,BCL2L1,CD36,ETS1,ICAM2,IL17A,IRS2,PDGFRB,RPL13A,TGFB1,TNFRSF4,和/或TNFSF4中的一种或多种)的水平与参照水平的比较。在一些实施方案中,信息或数据包括样品中存在或缺失AKT3,CDH1,CYP27B1,DNM3,DYNLL1,ERBB3,KLRK1,MBP,MDM2,NCAM1,PDGFRA,PRKCZ,SNCA,TNFRSF21,AXL,BCL2L1,CD36,ETS1,ICAM2,IL17A,IRS2,PDGFRB,RPL13A,TGFB1,TNFRSF4,TNFSF4,和/或ZBTB16中至少一种(例如AKT3,CDH1,CYP27B1,DNM3,DYNLL1,ERBB3,KLRK1,MBP,MDM2,NCAM1,PDGFRA,PRKCZ,SNCA,和/或TNFRSF21中的一种或多种或AXL,BCL2L1,CD36,ETS1,ICAM2,IL17A,IRS2,PDGFRB,RPL13A,TGFB1,TNFRSF4,和/或TNFSF4中的一种或多种)的指示。在一些实施方案中,信息或数据包括患者用包含VEGF拮抗剂(例如抗VEGF抗体,例如贝伐珠单抗)的疗法治疗恰当或不恰当的指示。
如本文中使用的,短语“鉴定患者”指使用涉及患者的样品中AKT3,CDH1,CYP27B1,DNM3,DYNLL1,ERBB3,KLRK1,MBP,MDM2,NCAM1,PDGFRA,PRKCZ,SNCA,TNFRSF21,AXL,BCL2L1,CD36,ETS1,ICAM2,IL17A,IRS2,PDGFRB,RPL13A,TGFB1,TNFRSF4,TNFSF4,和/或ZBTB16中至少一种(例如AKT3,CDH1,CYP27B1,DNM3,DYNLL1,ERBB3,KLRK1,MBP,MDM2,NCAM1,PDGFRA,PRKCZ,SNCA,和/或TNFRSF21中的一种或多种或AXL,BCL2L1,CD36,ETS1,ICAM2,IL17A,IRS2,PDGFRB,RPL13A,TGFB1,TNFRSF4,和/或TNFSF4中的一种或多种)的水平或存在生成的信息或数据鉴定或选择更加可能或不太可能受益于包含VEGF拮抗剂(例如抗VEGF抗体,例如贝伐珠单抗)的疗法的患者。使用或生成的信息或数据可以是任何形式的,书面的,口头的或电子的。在一些实施方案中,使用生成的信息或数据包括传达,呈现,报告,存储,发送,转移,供应,传输,分发,或其组合。在一些实施方案中,传达,呈现,报告,存储,发送,转移,供应,传输,分发,或其组合是由计算装置,分析单元或其组合实施的。在一些进一步的实施方案中,传达,呈现,报告,存储,发送,转移,供应,传输,分发,或其组合是由实验室或医学专业人员实施的。在一些实施方案中,信息或数据包括AKT3,CDH1,CYP27B1,DNM3,DYNLL1,ERBB3,KLRK1,MBP,MDM2,NCAM1,PDGFRA,PRKCZ,SNCA,TNFRSF21,AXL,BCL2L1,CD36,ETS1,ICAM2,IL17A,IRS2,PDGFRB,RPL13A,TGFB1,TNFRSF4,TNFSF4,和/或ZBTB16中至少一种(例如AKT3,CDH1,CYP27B1,DNM3,DYNLL1,ERBB3,KLRK1,MBP,MDM2,NCAM1,PDGFRA,PRKCZ,SNCA,和/或TNFRSF21中的一种或多种或AXL,BCL2L1,CD36,ETS1,ICAM2,IL17A,IRS2,PDGFRB,RPL13A,TGFB1,TNFRSF4,和/或TNFSF4中的一种或多种)的水平与参照水平的比较。在一些实施方案中,信息或数据包括样品中存在或缺失AKT3,CDH1,CYP27B1,DNM3,DYNLL1,ERBB3,KLRK1,MBP,MDM2,NCAM1,PDGFRA,PRKCZ,SNCA,TNFRSF21,AXL,BCL2L1,CD36,ETS1,ICAM2,IL17A,IRS2,PDGFRB,RPL13A,TGFB1,TNFRSF4,TNFSF4,和/或ZBTB16中至少一种的指示。在一些实施方案中,信息或数据包括患者更加可能或不太可能响应包含VEGF拮抗剂(例如抗VEGF抗体,例如贝伐珠单抗)的疗法的指示。
如本文中使用的,短语“选择疗法”指使用涉及患者的样品中AKT3,CDH1,CYP27B1,DNM3,DYNLL1,ERBB3,KLRK1,MBP,MDM2,NCAM1,PDGFRA,PRKCZ,SNCA,TNFRSF21,AXL,BCL2L1,CD36,ETS1,ICAM2,IL17A,IRS2,PDGFRB,RPL13A,TGFB1,TNFRSF4,TNFSF4,和/或ZBTB16中至少一种(例如AKT3,CDH1,CYP27B1,DNM3,DYNLL1,ERBB3,KLRK1,MBP,MDM2,NCAM1,PDGFRA,PRKCZ,SNCA,和/或TNFRSF21中的一种或多种或AXL,BCL2L1,CD36,ETS1,ICAM2,IL17A,IRS2,PDGFRB,RPL13A,TGFB1,TNFRSF4,和/或TNFSF4中的一种或多种)的水平或存在生成的信息或数据为患者鉴定或选择疗法。在一些实施方案中,疗法可包含VEGF拮抗剂(例如抗VEGF抗体,例如贝伐珠单抗)。在一些实施方案中,短语“选择疗法”包括鉴定需要调整施用的VEGF拮抗剂(例如抗VEGF抗体,例如贝伐珠单抗)的有效量的患者。
“单一疗法”意指如下的治疗方案,其在治疗期的过程期间只包括单一治疗剂来治疗癌症或肿瘤。使用VEGF拮抗剂(例如抗VEGF抗体,例如贝伐珠单抗)的单一疗法意味着在治疗期期间在没有别的抗癌疗法的情况中施用所述VEGF拮抗剂。
术语“有效量”指在受试者或患者(诸如哺乳动物,例如人)中有效治疗疾病或病症(诸如成胶质细胞瘤)的药物量。在癌症的情况中,治疗有效量的药物可减少癌细胞的数目;缩小肿瘤的尺寸;抑制(即一定程度的减缓,优选阻止)癌细胞浸润入周围器官;抑制(即一定程度的减缓,优选阻止)肿瘤转移;一定程度的抑制肿瘤生长;和/或一定程度的减轻一种或多种与病症有关的症状。根据药物可阻止现有癌细胞生长和/或杀死现有癌细胞的程度,它可以是细胞抑制性的和/或细胞毒性的。对于癌症疗法,可以例如通过评估存活持续时间,无进展存活(PFS)持续时间,总体存活(OS),响应率(RR),响应持续时间,和/或生活质量来测量体内功效。
患者对VEGF拮抗剂(例如抗VEGF抗体,例如贝伐珠单抗)治疗的“有效响应”(effective response)或患者对VEGF拮抗剂治疗的“响应性”(responsiveness)或“敏感性”(sensitivity)指源自VEGF拮抗剂治疗或作为该治疗的结果,给予有成胶质细胞瘤风险或具有成胶质细胞瘤的患者的临床或治疗受益。此类受益包括源自拮抗剂治疗或作为该治疗的结果的细胞或生物学应答,完全响应,部分响应,稳定的病情(没有进展或复发),或患者响应及稍后复发。例如,有效响应可以是诊断为表达与参照水平(包括例如来自正在测试对VEGF拮抗剂的响应性的患者组/群体的样品中生物标志物的中值表达水平;来自具有成胶质细胞瘤且鉴定为不响应VEGF拮抗剂治疗的患者组/群体的样品中生物标志物的中值表达水平;在在先的时间先前自个体获得的样品中的水平;或来自在原发性肿瘤设置中接受VEGF拮抗剂(诸如抗VEGF抗体,例如贝伐珠单抗)在先治疗且现在可能正在经历转移的患者的样品中的水平)相比(a)更高水平的AKT3,CDH1,CYP27B1,DNM3,DYNLL1,ERBB3,KLRK1,MBP,MDM2,NCAM1,PDGFRA,PRKCZ,SNCA,和/或TNFRSF21中一种或多种,(b)更低水平的AXL,BCL2L1,CD36,ETS1,ICAM2,IL17A,IRS2,PDGFRB,RPL13A,TGFB1,TNFRSF4,和/或TNFSF4中一种或多种,或(c)(a)和(b)二者的患者中缩小的肿瘤尺寸,延长的无进展存活(PFS),和/或延长的总体存活(OS)。遗传生物标志物的表达有效预示,或以高灵敏度预示此类有效响应。
“存活”指受试者保持活着,包括无进展存活(PFS)和总体存活(OS)。存活可通过Kaplan-Meier方法来评估,而且存活的任何差异可使用分层时序检验(stratified log-rank test)来计算。
“总体存活”或“OS”指受试者自治疗起始或自初始诊断起保持限定时间段活着,诸如约1年,约2年,约3年,约4年,约5年,约10年,等。在本发明根本的研究中,用于存活分析的事件是任何原因的死亡。
“无进展存活”或“PFS”指自治疗(或随机化)至第一次疾病进展或死亡的时间。例如,它指如下的时间,即自治疗起始或自初始诊断起,例如限定的时间段,诸如约1个月,约2个月,约3个月,约4个月,约5个月,约6个月,约7个月,约8个月,约9个月,约1年,约2年,约3年,等,受试者仍然活着且癌症没有复发。在本发明的一个方面,可以通过MacDonald等人描述的MacDonald响应标准(MacDonald et al.,J.Clin.Oncol.8:1277-80,1990)来评估PFS。
“总体响应率”或“客观响应率”(ORR)指经历癌(例如成胶质细胞瘤)的尺寸或量降低达最小时间量的人的百分百,而且ORR可以由完全和部分响应率的和来代表。
“延长存活”或“提高存活可能性”意味着使接受治疗的受试者(例如用VEGF拮抗剂,例如抗VEGF抗体,例如贝伐珠单抗治疗的受试者)或接受治疗的受试者群体的PFS和/或OS分别相对于未接受治疗的受试者(例如未用抗VEGF抗体治疗的受试者)或未接受治疗的受试者群体,或者相对于对照治疗方案(诸如只用化疗剂的治疗,诸如成胶质细胞瘤的标准护理中使用的那些,诸如例如有或无放疗的替莫唑胺(TMZ))有延长。存活在治疗启动之后或在初始诊断之后监测至少约1个月,约2个月,约4个月,约6个月,约9个月,或至少约1年,或至少约2年,或至少约3年,或至少约4年,或至少约5年,或至少约10年,等。
危害比(HR)是事件比率的统计定义。为了本发明的目的,危害比定义为代表任何特定时间点时实验分支中的事件概率除以对照分支中的事件概率。无进展存活分析中的“危害比”是两条无进展存活曲线之间的差异的汇总,代表随访期里与对照相比治疗的死亡风险降低。
本文中的“患者”或“受试者”指适于接受治疗的任何单一动物(包括例如哺乳动物,诸如犬,猫,马,家兔,动物园动物,牛,猪,绵羊,非人灵长动物,和人),诸如人,他/它正经受或者已经经受疾病或病症(诸如成胶质细胞瘤(GBM))的一种或多种体征,症状,或其它指标。意图包括作为患者的是参与临床研究试验且未显示疾病的任何临床体征的任何患者,或参与流行病学研究的患者,或曾经用作对照的患者。所述患者可以先前用VEGF拮抗剂(例如抗VEGF抗体,例如贝伐珠单抗)或另一种药物治疗过,或者没有这样治疗过。患者可以是在开始本文中的治疗时未接触所用别的药物的,即该患者在“基线”(即在本文中治疗方法中施用第一剂VEGF拮抗剂(例如抗VEGF抗体,例如贝伐珠单抗)之前的一个设定时间点,诸如开始治疗之前筛选受试者的日子)时可以先前没有用例如除VEGF拮抗剂(例如抗VEGF抗体,例如贝伐珠单抗)以外的疗法治疗过。此类“未接触(药物)”患者或受试者一般认为是用此类别的药物进行治疗的候选。
术语“癌症”和“癌性”指或描述哺乳动物中特征通常为细胞生长不受调控的生理疾患。此定义中包括良性和恶性癌症以及休眠肿瘤或微转移。癌症的例子包括但不限于癌瘤,淋巴瘤,母细胞瘤,肉瘤,和白血病。此类癌症的更具体例子包括但不限于成胶质细胞瘤(GBM),包括例如前神经GBM,神经GBM,经典GBM,和间充质GBM。GBM可以是新诊断的,诊断的,或复发的。其它癌症包括例如乳腺癌,鳞状细胞癌,肺癌(包括小细胞肺癌,非小细胞肺癌,肺的腺癌,和肺的鳞癌),腹膜癌,肝细胞癌,胃癌(gastric or stomach cancer)(包括胃肠癌),胰腺癌,卵巢癌,宫颈癌,肝癌(liver cancer or hepatic carcinoma),膀胱癌,肝瘤(hepatoma),结肠癌,结肠直肠癌,子宫内膜癌或子宫癌,唾液腺癌,肾癌(kidney or renal cancer),前列腺癌,外阴癌,甲状腺癌,及各种类型的头和颈癌,以及B细胞淋巴瘤(包括低级/滤泡性非何杰金(Hodgkin)氏淋巴瘤(NHL),小淋巴细胞性(SL)NHL,中级/滤泡性NHL,中级弥漫性NHL,高级成免疫细胞性NHL,高级成淋巴细胞性NHL,高级小无核裂细胞性NHL,贮积病(bulky disease)NHL,套细胞淋巴瘤,AIDS相关淋巴瘤,和瓦尔登斯特伦(Waldenstrom)氏巨球蛋白血症),慢性淋巴细胞性白血病(CLL),急性成淋巴细胞性白血病(ALL),毛细胞性白血病,慢性成髓细胞性白血病,和移植后淋巴增殖性病症(PTLD),以及与瘢痣病(phakomatoses),水肿(诸如与脑瘤有关的)和梅格斯(Meigs)氏综合征有关的异常血管增殖。
如本文中使用的,“肿瘤”指所有赘生性(neoplastic)细胞生长和增殖,无论是恶性的还是良性的,及所有癌前(pre-cancerous)和癌性细胞和组织。术语“癌症”,“癌性”,“细胞增殖性病症”,“增殖性病症”和“肿瘤”在本文中提到时并不互相排斥。
术语“药物配制剂”指其形式容许药物的生物学活性是有效的,且不含对会接受该配制剂施用的受试者产生不可接受的毒性的别的成分的无菌制备物。
“药学可接受载剂”指药物配制剂中除活性组分以外的组分,它对受试者是无毒的。药学可接受载剂包括但不限于缓冲剂,赋形剂,稳定剂,或防腐剂。
“试剂盒”指包含至少一种试剂(例如用于治疗具有成胶质细胞瘤的患者的药物,或用于特异性检测本发明的生物标志物基因或蛋白质的探针)的任何制品(例如包装或容器)。所述制品优选以用于实施本发明方法的单元来宣传,分发,或销售。
如本文中所使用的,术语“协变量”指与患者有关的某些变量或信息。常常在回归模型中考虑临床终点,其中终点代表因变量,而生物标志物代表主要或目标自变量(回归量)。如果考虑来自临床数据池的别的变量,那么将它们表示为(临床)协变量。
术语“临床协变量”在本文中用于描述关于患者的所有临床信息,这一般在基线时是可得的。这些临床协变量包括人口统计信息(像性别,年龄,等),其它病历(anamnestic)信息,并发的疾病,伴随的疗法,体检的结果,得到的常用实验室参数,血管发生性病症的已知特性,临床疾病分期,预治疗的时机和结果,疾病史,以及可能与对治疗的临床响应有关的所有类似信息。
如本文中所使用的,术语“原始分析”(raw analysis)或“未调整的分析”(unadjusted analysis)指如下的回归分析,其中在所考虑的生物标志物之外,在该回归模型中不使用别的临床协变量,无论是作为独立因素还是作为分层协变量(stratifying covariate)。
如本文中所使用的,术语“经过协变量调整的”指如下的回归分析,其中在所考虑的生物标志物之外,在该回归模型中还使用别的临床协变量,或是作为独立因素或是作为分层协变量。
如本文中所使用的,术语“单变量(univariate)”指如下的回归模型或图示法,其中作为自变量,只有一项目标生物标志物是该模型的一部分。可以在有和没有别的临床协变量的情况中考虑这些单变量模型。
如本文中所使用的,术语“多变量”指如下的回归模型或图示法,其中作为自变量,超过一项目标生物标志物是该模型的一部分。可以在有和没有别的临床协变量的情况中考虑这些多变量模型。
III.鉴定响应VEGF拮抗剂的患者的方法
本发明提供用于鉴定和/或监测很可能对VEGF拮抗剂(例如抗VEGF抗体,例如贝伐珠单抗)疗法是响应性的患者的方法。该方法格外对于提高对患者施用VEGF拮抗剂(例如抗VEGF抗体,例如贝伐珠单抗)会有效的可能性是有用的。该方法包括检测来自患者的生物学样品中一种或多种遗传生物标志物的表达,其中一种或多种此类生物标志物的表达指示该患者是否对VEGF拮抗剂(诸如抗VEGF抗体)是敏感或响应性的。
更具体地,测定来自患者的样品中选自AKT3,CDH1,CYP27B1,DNM3,DYNLL1,ERBB3,KLRK1,MBP,MDM2,NCAM1,PDGFRA,PRKCZ,SNCA,TNFRSF21,AXL,BCL2L1,CD36,ETS1,ICAM2,IL17A,IRS2,PDGFRB,RPL13A,TGFB1,TNFRSF4,TNFSF4,和ZBTB16的至少一种基因(1,2,3,4,5,6,7,8,9,10,11,12,13,14,15,16,17,18,19,20,21,22,23,24,25,26,或27种基因)的表达水平对于监测该患者是否对VEGF拮抗剂(诸如抗VEGF抗体)是响应性或敏感的是有用的。对于任何本文所述方法,例如,可以测定选自AKT3,CDH1,CYP27B1,DNM3,DYNLL1,ERBB3,KLRK1,MBP,MDM2,NCAM1,PDGFRA,PRKCZ,SNCA,和TNFRSF21(“簇2基因)的1,2,3,4,5,6,7,8,9,10,11,12,13,或14种基因的表达水平。在一些情况中,对于任何本文所述方法,例如,可以测定选自AXL,BCL2L1,CD36,ETS1,ICAM2,IL17A,IRS2,PDGFRB,RPL13A,TGFB1,TNFRSF4,TNFSF4,和ZBTB16(“簇6基因)的1,2,3,4,5,6,7,8,9,10,11,12,或13种基因的表达水平。
在一些情况中,对于任何本文所述方法,可以测定簇2和簇6基因中一些或全部的组合的表达水平。在一个例子中,测定来自患者的样品中选自AKT3,CDH1,CYP27B1,DNM3,DYNLL1,ERBB3,KLRK1,MBP,MDM2,NCAM1,PDGFRA,PRKCZ,SNCA,和TNFRSF21的1,2,3,4,5,6,7,8,9,10,11,12,13,或14种基因和至少一种不同基因(例如选自AXL,BCL2L1,CD36,ETS1,ICAM2,IL17A,IRS2,PDGFRB,RPL13A,TGFB1,TNFRSF4,TNFSF4,和ZBTB16的1,2,3,4,5,6,7,8,9,10,11,12,或13种不同基因)的表达水平对于监测患者是否对VEGF拮抗剂(诸如抗VEGF抗体,诸如贝伐珠单抗)是响应性或敏感的是有用的。在一个例子中,测定来自患者的样品中所有27种基因(即AKT3,CDH1,CYP27B1,DNM3,DYNLL1,ERBB3,KLRK1,MBP,MDM2,NCAM1,PDGFRA,PRKCZ,SNCA,TNFRSF21,AXL,BCL2L1,CD36,ETS1,ICAM2,IL17A,IRS2,PDGFRB,RPL13A,TGFB1,TNFRSF4,TNFSF4,和ZBTB16)的表达水平对于监测患者是否对VEGF拮抗剂(诸如抗VEGF抗体,诸如贝伐珠单抗)是响应性或敏感的是有用的。
所公开的方法和测定法提供方便,有效,且潜在划算的手段来获得可用于评估治疗患者的适宜或有效疗法的数据和信息。例如,患者可在VEGF拮抗剂治疗之前和/或之后提供组织样品(例如肿瘤活检或血液样品),而且可通过多种体外测定法来检查样品以确定患者的细胞是否对VEGF拮抗剂(诸如抗VEGF抗体,诸如贝伐珠单抗)是敏感的。
本发明还提供用于监测患者对VEGF拮抗剂(例如抗VEGF抗体,例如贝伐珠单抗)的敏感性或响应性的方法。该方法可以多种测定法形式进行,包括检测基因或蛋白质表达的测定法(诸如PCR和酶免疫测定法)和检测适宜活性的生物化学测定法。患者样品中此类生物标志物的表达或存在的确定预示患者是否对VEGF拮抗剂(诸如抗VEGF抗体,诸如贝伐珠单抗)的生物学效应是敏感的。本文中申请人的发明在于来自具有成胶质细胞瘤的患者的样品中选自AKT3,CDH1,CYP27B1,DNM3,DYNLL1,ERBB3,KLRK1,MBP,MDM2,NCAM1,PDGFRA,PRKCZ,SNCA,TNFRSF21,AXL,BCL2L1,CD36,ETS1,ICAM2,IL17A,IRS2,PDGFRB,RPL13A,TGFB1,TNFRSF4,TNFSF4,和ZBTB16的1,2,3,4,5,6,7,8,9,10,11,12,13,14,15,16,17,18,19,20,21,22,23,24,25,26,或27种基因的表达相对于参照水平(包括例如来自正在测试对VEGF拮抗剂的响应性的患者组/群体的样品中生物标志物的中值表达水平或来自具有成胶质细胞瘤且鉴定为不响应VEGF拮抗剂治疗的患者组/群体的样品中生物标志物的中值表达水平)的差异或变化(即升高或降低)与VEGF拮抗剂(诸如抗VEGF抗体,诸如贝伐珠单抗)对此类患者的治疗有关。
实施例6显示了AKT3,CDH1,CYP27B1,DNM3,DYNLL1,ERBB3,KLRK1,MBP,MDM2,NCAM1,PDGFRA,PRKCZ,SNCA,和TNFRSF21中至少一种的表达水平相对于至少一种所评估的生物标志物的参照水平的升高鉴定出很可能响应VEGF拮抗剂(诸如抗VEGF抗体,诸如贝伐珠单抗)治疗的患者。另外,实施例7显示了AXL,BCL2L1,CD36,ETS1,ICAM2,IL17A,IRS2,PDGFRB,RPL13A,TGFB1,TNFRSF4,TNFSF4,和ZBTB16中至少一种的表达水平相对于至少一种所评估的生物标志物的参照水平的降低鉴定出很可能响应VEGF拮抗剂(诸如抗VEGF抗体,诸如贝伐珠单抗)治疗的患者。典型地,至少一种基因的表达相对于参照水平(例如来自具有成胶质细胞瘤且正在测试对VEGF拮抗剂的响应性的患者组/群体的样品中生物标志物的中值表达水平或来自具有成胶质细胞瘤且鉴定为不响应VEGF拮抗剂治疗的患者组/群体的样品中生物标志物的中值表达水平)至少约1.5倍,1.6倍,1.8倍,2倍,3倍,4倍,5倍,6倍,7倍,8倍,9倍,或10倍的差异或变化(即升高或降低)或平均对数比相对于所测量的基因的均值表达水平至少约-2,-3,-4,-5,或-6个标准偏差的差异或变化(即升高或降低)指示患者会响应VEGF拮抗剂治疗或对VEGF拮抗剂治疗是敏感的。
依照本发明的方法,特定个体(例如患者)很可能响应VEGF拮抗剂治疗的可能性可以通过检测选自AKT3,CDH1,CYP27B1,DNM3,DYNLL1,ERBB3,KLRK1,MBP,MDM2,NCAM1,PDGFRA,PRKCZ,SNCA,TNFRSF21,AXL,BCL2L1,CD36,ETS1,ICAM2,IL17A,IRS2,PDGFRB,RPL13A,TGFB1,TNFRSF4,TNFSF4,和ZBTB16的至少一种基因(例如1,2,3,4,5,6,7,8,9,10,11,12,13,14,15,16,17,18,19,20,21,22,23,24,25,26,或27种基因)的表达水平并将该基因的表达水平与参照表达水平比较来确定。在一些情况中,例如,患者样品中选自AKT3,CDH1,CYP27B1,DNM3,DYNLL1,ERBB3,KLRK1,MBP,MDM2,NCAM1,PDGFRA,PRKCZ,SNCA,和TNFRSF21的1,2,3,4,5,6,7,8,9,10,11,12,13,或14种基因的表达水平相对于参照水平的升高鉴定出很可能响应VEGF拮抗剂(诸如抗VEGF抗体,诸如贝伐珠单抗)治疗的患者。在一些情况中,例如,患者样品中选自AXL,BCL2L1,CD36,ETS1,ICAM2,IL17A,IRS2,PDGFRB,RPL13A,TGFB1,TNFRSF4,TNFSF4,和/或ZBTB16的1,2,3,4,5,6,7,8,9,10,11,12,或13种基因的表达水平相对于参照水平的降低鉴定出很可能响应VEGF拮抗剂(诸如抗VEGF抗体,诸如贝伐珠单抗)治疗的患者。例如,如上所述,参照表达水平可以是具有成胶质细胞瘤且正在测试对VEGF拮抗剂(例如抗VEGF抗体,例如贝伐珠单抗)的响应性的患者组/群体中至少一种基因的中值表达水平。在一些实施方案中,参照表达水平是具有成胶质细胞瘤且鉴定为不响应VEGF拮抗剂(例如抗VEGF抗体,例如贝伐珠单抗)治疗的患者中至少一种基因的中值表达水平。在一些实施方案中,参照表达水平是在在先的时间先前自个体获得的样品中至少一种基因的表达水平。在其它实施方案中,个体是在原发性肿瘤设置中接受在先VEGF拮抗剂治疗的患者。在一些实施方案中,个体是正在经历转移的患者。将至少一种本文所述生物标志物基因具有大于或小于参照表达水平的表达水平的个体鉴定为很可能响应VEGF拮抗剂治疗的受试者/患者。将相对于(即高于或低于)中值展现例如50%,45%,40%,35%,30%,25%,20%,15%,10%,或5%基因表达水平(例如平均/均值基因表达水平)的受试者/患者鉴定为很可能响应VEGF拮抗剂(例如抗VEGF抗体,例如贝伐珠单抗)治疗的患者。可以告知受试者/患者他们具有升高的可能性对VEGF拮抗剂治疗是响应性的和/或提供抗癌疗法包括VEGF拮抗剂的推荐。基因表达水平可以使用本领域已知的及例如Sokal,R.R.and Rholf,F.J.(1995)“Biometry:the principles and practice of statistics in biological research,”W.H.Freeman and Co.New York,NY中记载的方法使用至少一种本文所述生物标志物基因或本文所述生物标志物基因的任何线性组合(例如均值,加权均值,或中值)来测定。
在一个方面,本发明提供确定具有成胶质细胞瘤的患者是否会响应VEGF拮抗剂(诸如抗VEGF抗体,例如贝伐珠单抗)治疗的方法,包括作为生物标志物评估(i)在任何VEGF拮抗剂施用于患者之前,或(ii)在此类治疗之前和之后获得的来自患者的样品中选自AKT3,CDH1,CYP27B1,DNM3,DYNLL1,ERBB3,KLRK1,MBP,MDM2,NCAM1,PDGFRA,PRKCZ,SNCA,TNFRSF21,AXL,BCL2L1,CD36,ETS1,ICAM2,IL17A,IRS2,PDGFRB,RPL13A,TGFB1,TNFRSF4,TNFSF4,和ZBTB16的至少一种基因(例如1,2,3,4,5,6,7,8,9,10,11,12,13,14,15,16,17,18,19,20,21,22,23,24,25,26,或27种基因)的表达。至少一种基因的表达相对于参照水平(见上文)的变化(即升高或降低)指示患者会很可能响应VEGF拮抗剂(诸如抗VEGF抗体,例如贝伐珠单抗)治疗。在一些情况中,例如,患者样品中选自AKT3,CDH1,CYP27B1,DNM3,DYNLL1,ERBB3,KLRK1,MBP,MDM2,NCAM1,PDGFRA,PRKCZ,SNCA,和TNFRSF21的1,2,3,4,5,6,7,8,9,10,11,12,13,或14种基因的表达水平相对于参照水平的升高鉴定出很可能响应VEGF拮抗剂(诸如抗VEGF抗体,诸如贝伐珠单抗)治疗的患者。在一些情况中,例如,患者样品中选自AXL,BCL2L1,CD36,ETS1,ICAM2,IL17A,IRS2,PDGFRB,RPL13A,TGFB1,TNFRSF4,TNFSF4,和/或ZBTB16的1,2,3,4,5,6,7,8,9,10,11,12,或13种基因的表达水平相对于参照水平的降低鉴定出很可能响应VEGF拮抗剂(诸如抗VEGF抗体,诸如贝伐珠单抗)治疗的患者。可告知患者他们具有升高的可能性响应VEGF拮抗剂治疗和/或提供抗癌疗法包括VEGF拮抗剂的推荐。
在另一个方面,本发明提供为具有成胶质细胞瘤的患者优化抗癌疗法的治疗功效的方法,包括作为生物标志物检测(i)在任何VEGF拮抗剂施用于患者之前,或(ii)在此类治疗之前和之后获得的来自患者的样品中选自AKT3,CDH1,CYP27B1,DNM3,DYNLL1,ERBB3,KLRK1,MBP,MDM2,NCAM1,PDGFRA,PRKCZ,SNCA,TNFRSF21,AXL,BCL2L1,CD36,ETS1,ICAM2,IL17A,IRS2,PDGFRB,RPL13A,TGFB1,TNFRSF4,TNFSF4,和ZBTB16的至少一种基因(例如1,2,3,4,5,6,7,8,9,10,11,12,13,14,15,16,17,18,19,20,21,22,23,24,25,26,或27种基因)的表达。至少一种基因的表达相对于参照水平(见上文)的变化(即升高或降低)指示患者会很可能响应VEGF拮抗剂(诸如抗VEGF抗体,例如贝伐珠单抗)治疗。在一些情况中,例如,患者样品中选自AKT3,CDH1,CYP27B1,DNM3,DYNLL1,ERBB3,KLRK1,MBP,MDM2,NCAM1,PDGFRA,PRKCZ,SNCA,和TNFRSF21的1,2,3,4,5,6,7,8,9,10,11,12,13,或14种基因的表达水平相对于参照水平的升高鉴定出很可能响应VEGF拮抗剂(诸如抗VEGF抗体,诸如贝伐珠单抗)治疗的患者。在一些情况中,例如,患者样品中选自AXL,BCL2L1,CD36,ETS1,ICAM2,IL17A,IRS2,PDGFRB,RPL13A,TGFB1,TNFRSF4,TNFSF4,和/或ZBTB16的1,2,3,4,5,6,7,8,9,10,11,12,或13种基因的表达水平相对于参照水平的降低鉴定出很可能响应VEGF拮抗剂(诸如抗VEGF抗体,诸如贝伐珠单抗)治疗的患者。可告知患者他们具有升高的可能性响应VEGF拮抗剂治疗和/或提供抗癌疗法包括VEGF拮抗剂的推荐。
在另一个方面,本发明提供为具有成胶质细胞瘤的患者选择疗法的方法,包括作为生物标志物检测(i)在任何VEGF拮抗剂施用于患者之前,或(ii)在此类治疗之前和之后获得的来自患者的样品中选自AKT3,CDH1,CYP27B1,DNM3,DYNLL1,ERBB3,KLRK1,MBP,MDM2,NCAM1,PDGFRA,PRKCZ,SNCA,TNFRSF21,AXL,BCL2L1,CD36,ETS1,ICAM2,IL17A,IRS2,PDGFRB,RPL13A,TGFB1,TNFRSF4,TNFSF4,和ZBTB16的至少一种基因(例如1,2,3,4,5,6,7,8,9,10,11,12,13,14,15,16,17,18,19,20,21,22,23,24,25,26,或27种基因)的表达。至少一种基因的表达相对于参照水平(见上文)的变化(即升高或降低)指示患者会很可能响应VEGF拮抗剂(诸如抗VEGF抗体,例如贝伐珠单抗)治疗。在一些情况中,例如,患者样品中选自AKT3,CDH1,CYP27B1,DNM3,DYNLL1,ERBB3,KLRK1,MBP,MDM2,NCAM1,PDGFRA,PRKCZ,SNCA,和TNFRSF21的1,2,3,4,5,6,7,8,9,10,11,12,13,或14种基因的表达水平相对于参照水平的升高鉴定出很可能响应VEGF拮抗剂(诸如抗VEGF抗体,诸如贝伐珠单抗)治疗的患者。在一些情况中,例如,患者样品中选自AXL,BCL2L1,CD36,ETS1,ICAM2,IL17A,IRS2,PDGFRB,RPL13A,TGFB1,TNFRSF4,TNFSF4,和/或ZBTB16的1,2,3,4,5,6,7,8,9,10,11,12,或13种基因的表达水平相对于参照水平的降低鉴定出很可能响应VEGF拮抗剂(诸如抗VEGF抗体,诸如贝伐珠单抗)治疗的患者。如果患者鉴定为很可能响应VEGF拮抗剂治疗的话,可以选择包括VEGF拮抗剂(例如抗VEGF抗体,例如贝伐珠单抗)的疗法,并且可以对患者提供所选择的包括VEGF拮抗剂的疗法的推荐。
在另一个实施方案中,本发明提供监测患者对VEGF拮抗剂(诸如抗VEGF抗体)的敏感性或响应性的方法。此方法包括评估来自患者的样品中选自AKT3,CDH1,CYP27B1,DNM3,DYNLL1,ERBB3,KLRK1,MBP,MDM2,NCAM1,PDGFRA,PRKCZ,SNCA,TNFRSF21,AXL,BCL2L1,CD36,ETS1,ICAM2,IL17A,IRS2,PDGFRB,RPL13A,TGFB1,TNFRSF4,TNFSF4,和ZBTB16的至少一种基因(例如1,2,3,4,5,6,7,8,9,10,11,12,13,14,15,16,17,18,19,20,21,22,23,24,25,26,或27种基因)的基因表达,并预测患者对VEGF拮抗剂(诸如抗VEGF抗体,例如贝伐珠单抗)的敏感性或响应性,其中选自AKT3,CDH1,CYP27B1,DNM3,DYNLL1,ERBB3,KLRK1,MBP,MDM2,NCAM1,PDGFRA,PRKCZ,SNCA,TNFRSF21,AXL,BCL2L1,CD36,ETS1,ICAM2,IL17A,IRS2,PDGFRB,RPL13A,TGFB1,TNFRSF4,TNFSF4,和ZBTB16的至少一种基因的表达的变化(即升高或降低)与患者对有效VEGF拮抗剂治疗的敏感性或响应性有关。依照此方法的一个实施方案,生物学样品是在施用任何VEGF拮抗剂之前自患者获得的,并且提交评估样品中至少一种基因的表达产物的水平的测定法。如果选自AKT3,CDH1,CYP27B1,DNM3,DYNLL1,ERBB3,KLRK1,MBP,MDM2,NCAM1,PDGFRA,PRKCZ,SNCA,TNFRSF21,AXL,BCL2L1,CD36,ETS1,ICAM2,IL17A,IRS2,PDGFRB,RPL13A,TGFB1,TNFRSF4,TNFSF4,和ZBTB16的至少一种基因的表达相对于参照水平(例如见上文)有变化(即升高或降低)的话,确定患者对VEGF拮抗剂(诸如抗VEGF抗体)治疗是敏感或响应性的。在一些情况中,例如,患者样品中选自AKT3,CDH1,CYP27B1,DNM3,DYNLL1,ERBB3,KLRK1,MBP,MDM2,NCAM1,PDGFRA,PRKCZ,SNCA,和TNFRSF21的1,2,3,4,5,6,7,8,9,10,11,12,13,或14种基因的表达水平相对于参照水平的升高鉴定出很可能响应VEGF拮抗剂(诸如抗VEGF抗体,诸如贝伐珠单抗)治疗的患者。在一些情况中,例如,患者样品中选自AXL,BCL2L1,CD36,ETS1,ICAM2,IL17A,IRS2,PDGFRB,RPL13A,TGFB1,TNFRSF4,TNFSF4,和/或ZBTB16的1,2,3,4,5,6,7,8,9,10,11,12,或13种基因的表达水平相对于参照水平的降低鉴定出很可能响应VEGF拮抗剂(诸如抗VEGF抗体,诸如贝伐珠单抗)治疗的患者。可告知患者他们具有升高的可能性对VEGF拮抗剂治疗是敏感或响应性的和/或提供抗癌疗法包括VEGF拮抗剂的推荐。在此方法的另一个实施方案中,生物学样品是在施用本文所述VEGF拮抗剂之前和之后自患者获得的。
在又一个方面,本发明提供治疗具有成胶质细胞瘤的患者的方法,该方法包括对该患者施用VEGF拮抗剂,其中该患者已经预先测定为具有选自AKT3,CDH1,CYP27B1,DNM3,DYNLL1,ERBB3,KLRK1,MBP,MDM2,NCAM1,PDGFRA,PRKCZ,SNCA,TNFRSF21,AXL,BCL2L1,CD36,ETS1,ICAM2,IL17A,IRS2,PDGFRB,RPL13A,TGFB1,TNFRSF4,TNFSF4,和ZBTB16的至少一种基因(例如1,2,3,4,5,6,7,8,9,10,11,12,13,14,15,16,17,18,19,20,21,22,23,24,25,26,或27种基因)的表达水平相对于该至少一种基因的参照表达水平的变化。
在还有又一个方面,本发明提供为具有成胶质细胞瘤的患者优化抗癌疗法的治疗功效的方法,其中该患者已经预先测定为具有选自AKT3,CDH1,CYP27B1,DNM3,DYNLL1,ERBB3,KLRK1,MBP,MDM2,NCAM1,PDGFRA,PRKCZ,SNCA,TNFRSF21,AXL,BCL2L1,CD36,ETS1,ICAM2,IL17A,IRS2,PDGFRB,RPL13A,TGFB1,TNFRSF4,TNFSF4,和ZBTB16的至少一种基因(例如1,2,3,4,5,6,7,8,9,10,11,12,13,14,15,16,17,18,19,20,21,22,23,24,25,26,或27种基因)的表达水平相对于该至少一种基因的参照表达水平的变化,且该方法包括基于预先测定的至少一种基因的表达水平的变化对该患者提供抗癌疗法包括VEGF拮抗剂的推荐。在一些情况中,第八个方面的方法可进一步包括对该患者提供抗癌疗法包括VEGF拮抗剂的推荐。
在仍有又一个方面,本发明提供为具有成胶质细胞瘤的患者选择疗法的方法,其中该患者已经预先测定为具有选自AKT3,CDH1,CYP27B1,DNM3,DYNLL1,ERBB3,KLRK1,MBP,MDM2,NCAM1,PDGFRA,PRKCZ,SNCA,TNFRSF21,AXL,BCL2L1,CD36,ETS1,ICAM2,IL17A,IRS2,PDGFRB,RPL13A,TGFB1,TNFRSF4,TNFSF4,和ZBTB16的至少一种基因(例如1,2,3,4,5,6,7,8,9,10,11,12,13,14,15,16,17,18,19,20,21,22,23,24,25,26,或27种基因)的表达水平相对于该至少一种基因的参照表达水平的变化,且该方法包括基于预先测定的至少一种基因的表达水平的变化选择包含VEGF拮抗剂的疗法并对该患者推荐选择的包含VEGF拮抗剂的疗法。在一些实施方案中,第九个方面的方法可进一步包括对该患者提供抗癌疗法包括VEGF拮抗剂的推荐。
在任何前述方法中,该变化可以是至少一种基因的表达水平相对于参照水平的升高,且该至少一种基因(例如1,2,3,4,5,6,7,8,9,10,11,12,13,或14种基因)可以是AKT3,CDH1,CYP27B1,DNM3,DYNLL1,ERBB3,KLRK1,MBP,MDM2,NCAM1,PDGFRA,PRKCZ,SNCA,和/或TNFRSF21。在一些实施方案中,该方法进一步包括基于AKT3,CDH1,CYP27B1,DNM3,DYNLL1,ERBB3,KLRK1,MBP,MDM2,NCAM1,PDGFRA,PRKCZ,SNCA,和/或TNFRSF21的表达水平的升高施用VEGF拮抗剂。
在任何前述方法中,该变化可以是至少一种基因的表达水平相对于参照水平的降低,且该至少一种基因(例如1,2,3,4,5,6,7,8,9,10,11,12,或13种基因)可以是AXL,BCL2L1,CD36,ETS1,ICAM2,IL17A,IRS2,PDGFRB,RPL13A,TGFB1,TNFRSF4,TNFSF4,和/或ZBTB16。在一些实施方案中,该方法进一步包括基于AXL,BCL2L1,CD36,ETS1,ICAM2,IL17A,IRS2,PDGFRB,RPL13A,TGFB1,TNFRSF4,TNFSF4,和/或ZBTB16的表达水平的降低施用VEGF拮抗剂。
在任何前述方法的一些实施方案中,该患者可以在具有成胶质细胞瘤且正在测试对VEGF拮抗剂的响应性的患者群体中且该参照水平是该患者群体中该至少一种基因的中值表达水平。在一些情况中,该参照水平可以是具有成胶质细胞瘤且鉴定为不响应VEGF拮抗剂治疗的患者中该至少一种基因的中值表达水平。
任何前述方法可以进一步包括对该患者施用VEGF拮抗剂。在一些情况中,施用的VEGF拮抗剂可以是抗VEGF抗体,例如结合A4.6.1表位的抗VEGF抗体,贝伐珠单抗,或包含可变重链(VH)和可变轻链(VL)的抗VEGF抗体,其中所述VH具有SEQ ID NO:2的氨基酸序列且所述VL具有SEQ ID NO:1的氨基酸序列。
在任何前述方法中,该方法可以进一步包括对该患者施用:(i)选自抗肿瘤剂,化疗剂,生长抑制剂,和细胞毒剂的药剂,(ii)放疗,或(iii)其组合。在一些实施方案中,施用的化疗剂是替莫唑胺(TMZ)。
在任何前述方法中,该患者可以具有非前神经(proneural)型成胶质细胞瘤。
医学领域(特别是关于诊断测试和治疗剂治疗的应用)技术人员会认识到,生物学系统有些易变,而且并非总是全然可预测的,而且因此许多较好的诊断测试或治疗剂偶尔无效。如此,最终由主治内科医师的判断来为患者个体决定最适宜的治疗过程,这基于测试结果,患者状况和历史,及他或她自己的经验来做出。例如,甚至会有这样的情况,即使根据来自诊断测试的或来自其它标准的数据,没有预测出患者会对VEGF拮抗剂特别敏感,内科医师也会选择用VEGF拮抗剂(诸如抗VEGF抗体,例如贝伐珠单抗)来治疗患者,特别是如果所有或大多数其它明显的治疗选项已经失败,或者如果与另一种治疗一起给予时预见有一些协同性。
在进一步表述的实施方案中,本发明提供一种预测患者对VEGF拮抗剂(诸如抗VEGF抗体,例如贝伐珠单抗)治疗的敏感性或预测患者是否会有效响应VEGF拮抗剂治疗的方法,包括评估样品中表达的本文中鉴定的一种或多种遗传生物标志物的水平;并预测患者对VEGF拮抗剂所致抑制的敏感性,其中一种或多种这些遗传生物标志物的表达水平与患者有效响应VEGF拮抗剂治疗的高敏感性有关。
样品可以取自怀疑具有或诊断具有成胶质细胞瘤,因此很可能需要治疗的患者或没有怀疑具有任何病症的正常个体。为了评估标志物表达,可以在本发明的方法中使用患者样品(诸如那些含有细胞的,或由这些细胞生成的蛋白质或核酸)。在本发明的方法中,生物标志物的水平可通过评估样品(优选组织样品,例如肿瘤组织样品,诸如活检)中标志物的量(例如绝对量或浓度)来确定。另外,可以在含有可检测水平的生物标志物的体液或分泌物中评估生物标志物的水平。可用作本发明中样品的体液或分泌物包括例如血液,尿液,唾液,粪便,胸水,淋巴液,痰,腹水,前列腺液,脑脊液(CSF),或任何其它身体分泌物或其衍生物。词语“血液”意图包括全血,血浆,血清,或任何血液衍生物。此类体液或分泌物中生物标志物的评估在侵入性取样方法不适宜或不方便的情况中有时可以是优选的。然而,在样品是体液的情况中,本文中要测试的样品优选血液,滑膜组织,或滑液,最优选血液。
样品可以是冷冻的,新鲜的,固定的(例如福尔马林固定的),离心的,和/或包埋的(例如石蜡包埋的),等。当然,细胞样品可以在评估样品中标志物的量之前进行多种公知的收集后准备和保存技术(例如核酸和/或蛋白质提取,固定,保存,冷冻,超滤,浓缩,蒸发,离心,等)。同样,活检物也可进行收集后准备和保存技术,例如固定。
在本文所述任何方法中,可以告知个体(例如患者/受试者)升高的或降低的可能性对VEGF拮抗剂(例如抗VEGF抗体,例如贝伐珠单抗)治疗是敏感或响应性的;提供抗癌疗法(例如包括或不包括VEGF拮抗剂的抗癌疗法)的推荐;和/或选择合适的疗法(例如VEGF拮抗剂和/或其它抗血管发生剂)。
A.基因表达的检测
本文中描述的遗传生物标志物可以使用本领域已知的任何方法来检测。例如,可以使用Northern,点印迹,或聚合酶链式反应(PCR)分析,阵列杂交,RNA酶保护测定法,或使用商品化的DNA SNP芯片微阵列(包括DNA微阵列急射(snapshot))方便地对来自哺乳动物的组织或细胞样品测定例如来自感兴趣遗传生物标志物的mRNA或DNA。例如,实时PCR(RT-PCR)测定法(诸如定量PCR测定法)是本领域公知的。在本发明的一个例示性实施方案中,用于检测生物学样品(诸如肿瘤样品,例如成胶质细胞瘤肿瘤样品)中来自感兴趣遗传生物标志物的mRNA的方法包括使用至少一种引物通过逆转录自样品生成cDNA;扩增如此生成的cDNA;并检测扩增cDNA的存在。另外,此类方法可以包括一个或多个如下步骤,其容许测定生物学样品中mRNA的水平(例如通过同时检查“持家”基因(诸如肌动蛋白家族成员)的比较性对照mRNA序列的水平)。任选的是,可以测定扩增cDNA的序列。
1.核酸的检测
在一个具体的实施方案中,本文所述生物标志物基因的表达可通过RT-PCR技术来实施。用于PCR的探针可以用可检测标记物标记,诸如例如放射性同位素,发荧光化合物,生物发光化合物,化学发光化合物,金属螯合物,或酶。此类探针和引物可用于检测样品中选自AKT3,CDH1,CYP27B1,DNM3,DYNLL1,ERBB3,KLRK1,MBP,MDM2,NCAM1,PDGFRA,PRKCZ,SNCA,TNFRSF21,AXL,BCL2L1,CD36,ETS1,ICAM2,IL17A,IRS2,PDGFRB,RPL13A,TGFB1,TNFRSF4,TNFSF4,和ZBTB16的1,2,3,4,5,6,7,8,9,10,11,12,13,14,15,16,17,18,19,20,21,22,23,24,25,26,或27种基因的存在。正如熟练技术人员会理解的,可制备极其多种不同引物和探针,并有效用于扩增,克隆,和/或测定表达的上文所列一种或多种基因的存在和/或水平。
其它方法包括通过微阵列技术检验或检测组织(例如肿瘤组织,例如成胶质细胞瘤肿瘤组织)或细胞样品中来自选自AKT3,CDH1,CYP27B1,DNM3,DYNLL1,ERBB3,KLRK1,MBP,MDM2,NCAM1,PDGFRA,PRKCZ,SNCA,TNFRSF21,AXL,BCL2L1,CD36,ETS1,ICAM2,IL17A,IRS2,PDGFRB,RPL13A,TGFB1,TNFRSF4,TNFSF4,和/或ZBTB16的至少一种基因(例如1,2,3,4,5,6,7,8,9,10,11,12,13,14,15,16,17,18,19,20,21,22,23,24,25,26,或27种基因)的mRNA的方案。使用核酸微阵列,逆转录并标记来自测试和对照组织样品的测试和对照mRNA样品以生成cDNA探针。然后使探针杂交至在固体支持物上固定化的核酸阵列。该阵列配置成该阵列的每个成员的序列和位置是已知的。例如,可以将在某些疾病状态中潜在表达的基因选集在固体支持物上排列成阵列。经过标记的探针与特定阵列成员的杂交指示衍生该探针的样品表达该基因。疾病组织的差异基因表达分析能提供有价值的信息。微阵列技术利用核酸杂交技术和计算技术在一个实验内评估数以千计的基因的mRNA表达概况(参见例如WO 2001/75166)。关于阵列制作的讨论,参见例如美国专利No.5,700,637;美国专利No.5,445,934;和美国专利No.5,807,522;Lockart,Nature Biotechnology,14:1675-1680(1996);及Cheung et al.,Nature Genetics21(Suppl):15-19(1999)。
另外,可采用利用EP 1753878中记载的微阵列进行的DNA概况分析和检测方法。此方法利用短串联重复(STR)分析和DNA微阵列快速鉴定和区分不同DNA序列。在一个实施方案中,使经过标记的STR靶序列杂交至携带互补探针的DNA微阵列。这些探针长度不同以覆盖可能STR的范围。利用杂交后酶促消化自微阵列表面选择性去除DNA杂合物的带标记物的单链区。根据仍然杂交至微阵列的靶DNA的样式来推导未知靶物中重复的数目。
微阵列处理器的一个例子是Affymetrix系统,它是商品化的且包含通过在玻璃表面上直接合成寡核苷酸而制作的阵列。可使用本领域技术人员知道的其它系统。
在RT-PCR或其它基于PCR的方法以外,用于测定生物标志物水平的其它方法包括蛋白质组学技术,以及个性化遗传概况,这是在分子水平根据患者响应治疗血管发生性病症所必需的。本文中的专门化微阵列(例如寡核苷酸微阵列或cDNA微阵列)可包含一种或多种生物标志物,其具有与对一种或多种抗VEGF抗体的敏感性或耐药性有关的表达概况。供本发明中使用的可用于检测核酸的其它方法牵涉高通量RNA序列表达分析,包括基于RNA的基因组分析,诸如例如RNASeq。
许多参考文献是可获得的,它们提供了应用上述技术的指导(Kohler et al.,Hybridoma Techniques(Cold Spring Harbor Laboratory,New York,1980);Tijssen,Practice and Theory of Enzyme Inimunoassays(Elsevier,Amsterdam,1985);Campbell,Monoclonal Antibody Technology(Elsevier,Amsterdam,1984);Hurrell,Monoclonal Hybridoma Antibodies:Techniques and Applications(CRC Press,Boca Raton,FL,1982);及Zola,Monoclonal Antibodies:A Manual of Techniques,pp.147-158(CRC Press,Inc.,1987))。Northern印迹分析是本领域公知的一种便利的技术,记载于例如Molecular Cloning,a Laboratory Manual,第2版,1989,Sambrook,Fritch,Maniatis,Cold Spring Harbor Press,10Skyline Drive,Plainview,NY 11803-2500。用于评估基因和基因产物的状态的典型方案可见于例如Ausubel et al.编,1995,Current Protocols In Molecular Biology,单元2(Northern印迹),单元4(Southern印迹),单元15(免疫印迹)和单元18(PCR分析)。
2.蛋白质的检测
关于检测蛋白质生物标志物,诸如与选自AKT3,CDH1,CYP27B1,DNM3,DYNLL1,ERBB3,KLRK1,MBP,MDM2,NCAM1,PDGFRA,PRKCZ,SNCA,TNFRSF21,AXL,BCL2L1,CD36,ETS1,ICAM2,IL17A,IRS2,PDGFRB,RPL13A,TGFB1,TNFRSF4,TNFSF4,和ZBTB16的至少一种基因(例如1,2,3,4,5,6,7,8,9,10,11,12,13,14,15,16,17,18,19,20,21,22,23,24,25,26,或27种基因))对应的蛋白质生物标志物,例如多种蛋白质测定法是可获得的,包括例如基于抗体的方法以及质谱术和本领域已知的其它类似手段。在基于抗体的方法的情况中,例如,可以在足以形成抗体-生物标志物复合物的条件下使样品接触对所述生物标志物特异性的抗体,然后检测所述复合物。蛋白质生物标志物的存在的检测可以以许多方式来实现,诸如通过用于测定多种组织和样品(包括血浆或血清)的Western印迹(含或不含免疫沉淀),2维SDS-PAGE,免疫沉淀,荧光激活细胞分选(FACS),流式细胞术,和ELISA规程。使用此类测定法形式的一系列免疫测定技术是可获得的,参见例如美国专利No.4,016,043,4,424,279及4,018,653。这些包括非竞争类型的单个位点和两个位点或“三明治式”测定法,以及传统的竞争性结合测定法二者。这些测定法也包括经标记抗体对靶生物标志物的直接结合。
三明治式测定法是最有用且最常用的测定法之一。三明治式测定技术存在许多变化形式,本发明意图涵盖所有的变化形式。简言之,在一种典型的正向测定法(forward assay)中,将未标记的抗体固定化于固体基片上,并使待测试的样品与结合的分子接触。温育合适的一段时间后,即足以容许抗体-抗原复合体形成的一段时间,然后添加经能够产生可检测信号的报道分子标记的,对所述抗原特异性的第二抗体,并温育,容许足以形成抗体-抗原-经标记抗体的另一种复合体的时间。洗掉任何未反应的物质,并通过观察由所述报道分子产生的信号来测定所述抗原的存在。结果可以是定性的(通过对可视信号的简单观察来进行),或者可以是定量的(通过与含有已知量的生物标志物的对照样品比较来进行)。
正向测定法上的变化包括同时测定法(simultaneous assay),其中同时将样品和经标记的抗体两者添加至结合的抗体。这些技术对本领域技术人员是公知的,包括会容易明白的任何微小变化。在一种典型的正向三明治式测定法中,将具有对所述生物标志物特异性的第一抗体或是共价地或是被动地结合至固体表面。典型地,所述固体表面是玻璃或聚合物,最常用的聚合物是纤维素,聚丙烯酰胺,尼龙,聚苯乙烯,聚氯乙烯或聚丙烯。固体支持物可以采用试管,珠,微量板盘的形式,或者适于进行免疫测定法的任何其它表面。结合过程是本领域公知的,并且一般包括交联,共价结合,或物理吸附,清洗聚合物-抗体复合体,为测试样品做好准备。然后将测试样品的等分试样添加至固相复合体,并在合适的条件(例如从室温至40℃,诸如25℃和32℃之间,包括端点在内)下温育足够的一段时间(例如2-40分钟或者过夜,如果更方便的话),容许抗体中存在的任何亚基结合。温育期后,清洗抗体亚基固相,干燥,并与对生物标志物一部分特异性的第二抗体一起温育。所述第二抗体连接有用于指示第二抗体对分子标志物结合的报道分子。
一种备选的方法包括将样品中的靶生物标志物固定化,然后使固定化的靶物暴露于特异性抗体,该特异性抗体可以是或不是经报道分子标记的。根据靶物的量和报道分子信号的强度,可以通过用所述抗体直接标记,使结合的靶物变成可检测的。或者,使对第一抗体特异性的经标记第二抗体暴露于靶物-第一抗体复合体以形成靶物-第一抗体-第二抗体三元复合体。通过报道分子所发出的信号检测所述复合体。如本说明书中使用的,“报道分子”指通过其化学性质提供分析上可鉴定的信号的分子,所述信号容许结合至抗原的抗体的检测。这种类型的测定法中最常用的报道分子是酶,荧光团,或含发射性核素的分子(即放射性同位素)和化学发光分子。
在酶免疫测定法的情况中,酶是缀合至第二抗体的,一般藉由戊二醛或高碘酸盐进行。然而,会容易认可的是,存在极其多种不同的缀合技术,它们对技术人员是轻易可获得的。常用的酶包括辣根过氧化物酶,葡萄糖氧化酶,β-半乳糖苷酶,和碱性磷酸酶等。一般选择与特定酶一起使用的底物以在相应酶的水解作用后产生可检测的颜色变化。合适酶的例子包括碱性磷酸酶和过氧化物酶。还可能采用产生发荧光产物的荧光底物而不是上文所记录的显色底物。在所有情况中,将酶标记的抗体添加至第一抗体-分子标志物复合体,容许结合,然后洗掉过量的试剂。然后将含有合适底物的溶液添加至抗体-抗原-抗体复合体。底物会与连接至第二抗体的酶起反应,给出定性的视觉信号,其可以被进一步地定量(通常通过分光光度法)以给出存在于样品中的生物标志物的量的指标。或者,发荧光化合物(诸如荧光素和罗丹明)可以以化学方法偶联至抗体,而不改变所述抗体的结合能力。通过使用特定波长的光线照射来激发时,荧光染料标记的抗体吸收光能,在分子中诱导激发态,接着发出光线,其特征性颜色是用光学显微镜在视觉上可检测的。如在EIA中那样,容许荧光标记的抗体结合至第一抗体-分子标志物复合体。洗掉未结合的试剂后,然后使剩余的三元复合体暴露于适当波长的光线,观察到的荧光表明感兴趣的分子标志物的存在。免疫荧光和EIA技术在本领域中都是非常完善建立的。然而,还可以采用其它报道分子,诸如放射性同位素,化学发光或生物发光分子。
B.试剂盒
为了用于检测生物标志物,本发明还提供了试剂盒或制品。此类试剂盒可用于确定患者是否可受益于VEGF拮抗剂(例如抗VEGF抗体,例如贝伐珠单抗)的治疗。这些试剂盒可以包含能够测定选自AKT3,CDH1,CYP27B1,DNM3,DYNLL1,ERBB3,KLRK1,MBP,MDM2,NCAM1,PDGFRA,PRKCZ,SNCA,TNFRSF21,AXL,BCL2L1,CD36,ETS1,ICAM2,IL17A,IRS2,PDGFRB,RPL13A,TGFB1,TNFRSF4,TNFSF4,和ZBTB16的至少一种基因(例如1,2,3,4,5,6,7,8,9,10,11,12,13,14,15,16,17,18,19,20,21,22,23,24,25,26,或27种基因)的表达水平的多肽或多核苷酸。如果至少一种上述基因的表达相对于参照水平(例如见上文)有变化(即升高或降低)或不同于参照水平(例如见上文),那么患者可受益于VEGF拮抗剂(诸如抗VEGF抗体,例如贝伐珠单抗)治疗。随后可以告知患者他们具有升高的可能性对VEGF拮抗剂是敏感或响应性的和/或提供抗癌疗法包括VEGF拮抗剂的推荐。
这些试剂盒可包括装载装置,装载装置被分成小格以接纳紧密排列的一个或多个容器装置,诸如管形瓶,管,等,每个容器装置装有所述方法中要使用的不同化合物或成分之一。例如,所述容器装置之一可以装有可检测标记的或可以可检测标记的探针。此类探针可以是分别对蛋白质或信使(message)特异性的多肽(例如抗体)或多核苷酸。若试剂盒利用核酸杂交来检测靶核酸,则试剂盒还可具有装有用于扩增靶核酸序列的核苷酸的容器和/或装有报告手段(诸如结合至报告分子(诸如酶,荧光,或放射性同位素标记物)的生物素结合蛋白,例如亲合素或链霉亲合素)的容器。
此类试剂盒通常会包括上文所述容器和一个或多个其它容器,其中装有从商业和使用者立场看想要的材料,包括缓冲剂,稀释剂,滤器,针头,注射器,和印有使用说明的包装插页。容器上可存在标签,指示该组合物用于具体的应用,而且还可指示体内或体外使用的说明,诸如上文所描述的那些。
本发明的试剂盒有许多实施方案。一个典型的实施方案是一种试剂盒,包括容器,所述容器上的标签,和装在所述容器内的组合物,其中所述组合物包括结合蛋白质或自身抗体生物标志物的一抗,而且所述容器上的标签指示该组合物可用于评估样品中此类蛋白质或抗体的存在情况,且其中所述试剂盒包括说明书,其关于使用该抗体来评估特定样品类型中生物标志物蛋白质的存在情况。所述试剂盒可进一步包括一套用于制备样品并将抗体应用于样品的说明书和材料。所述试剂盒可以包括一抗(primary antibody)和二抗(secondary antibody)二者,其中所述二抗缀合有标记物,例如酶标记物。
另一个实施方案是一种试剂盒,包括容器,所述容器上的标签,和装在所述容器内的组合物,其中所述组合物包括一种或多种在严格条件下与本文所述生物标志物的互补物发生杂交的多核苷酸,而所述容器上的标签指示该组合物可用于评估样品中本文所述生物标志物的存在情况,且其中所述试剂盒包括说明书,其关于使用该多核苷酸来评估特定样品类型中生物标志物RNA或DNA的存在情况。
试剂盒中的其它任选成分包括一种或多种缓冲液(例如封闭缓冲液,清洗缓冲液,底物缓冲液等),其它试剂(诸如可以被酶标记物化学改变的底物,例如色原),表位修复液,对照样品(阳性和/或阴性对照),对照载玻片等。试剂盒还可包括用于解读使用该试剂盒获得的结果的说明书。
在又一些具体的实施方案中,对于基于抗体的试剂盒,所述试剂盒可包括例如:(1)第一抗体(例如附着至固体支持物的),其结合生物标志物蛋白质;和任选的(2)不同的第二抗体,其结合所述蛋白质或所述第一抗体且缀合有可检测标记物。
对于基于寡核苷酸的试剂盒,所述试剂盒可包括例如:(1)寡核苷酸,例如可检测标记的寡核苷酸,其与编码生物标志物蛋白质的核酸序列发生杂交,或(2)一对引物,其可用于扩增生物标志物核酸分子。所述试剂盒还可包括例如缓冲剂,防腐剂,和蛋白质稳定剂。所述试剂盒可进一步包括检测可检测标记物所必需的成分(例如酶或底物)。所述试剂盒还可包括对照样品或一系列对照样品,其能被测定并与测试样品进行比较。所述试剂盒的每种成分可以封装在单独的容器内,而各个容器都可与说明书(用于解读使用该试剂盒实施的测定法的结果)一起在单个包装内。
C.统计学
如本文中所使用的,一般形式的预测规则存在于一种或多种生物标志物的函数的说明中,其潜在包括临床协变量以预测响应或不响应,或更一般地,预测有益或无益(就适当定义的临床终点而言)。
最简单形式的预测规则由没有协变量的单变量模型组成,其中通过截留或阈的手段来确定预测。这可以表述成特定截留c和生物标志物测量x的Heaviside函数,若要做出二元预测A或B,则
若H(x-c)=0,则预示A;
若H(x-c)=1,则预示B。
这是在预测规则中使用单变量生物标志物测量的最简单方式。如果这样一种简单规则就足够了,那么它容许简单鉴定效果的方向,即高的还是低的表达水平对患者有益。
如果需要考虑临床协变量,和/或,如果多变量预测规则中使用多种生物标志物,那么情况会更加复杂。下面的两个假设例阐述了所涉及的问题:
协变量修正(假设例):
对于生物标志物X,在一个临床试验群体中发现高表达水平与较差的临床响应有关(单变量分析)。一项更周密的分析显示该群体中有两种类型的临床响应,其中第一组拥有比第二组差的响应,而且同时第一组的该生物标志物表达一般在施用至少一剂VEGF拮抗剂(例如抗VEGF抗体,例如贝伐珠单抗)之后较高。一项修正协变量分析揭示对于每一个组,临床受益与临床响应之间的关系被反转了,即在各组内,较低的表达水平与较好的临床响应有关。整体相反效果被协变量类型所掩盖--而且协变量修正分析(作为预测规则的一部分)反转了方向。
多变量预测(假设例):
对于生物标志物X,在一个临床试验群体中发现高表达水平与较差的临床响应微弱有关(单变量分析)。对于第二生物标志物Y,通过单变量分析进行了类似的观察。X与Y的组合揭示了,若这两种生物标志物都低,则看到好的临床响应。这使得规则在这两种生物标志物都低于一些截留时预示受益(和--Heaviside预测函数的联系)。对于组合规则,一条简单的规则不再以单变量意义适用;例如,具有低的X表达水平不会自动地预示较好的临床响应。
这些简单的例子显示了,不能根据每一种生物标志物的单变量水平来判断具有和没有协变量的预测规则。多种生物标志物的组合加上由协变量进行的潜在判断不容许给单一生物标志物指派简单关系。因为可以在潜在包括其它临床协变量的多标志物预测模型中使用多种标志物基因(特别是血清中的),所以不能以简单方式确定此类模型内单一标志物基因的有益效果的方向,而且可能与单变量分析中找到的方向矛盾,即关于单标志物基因描述的情况。
临床医师可使用本领域已知的数种方法之任一来测量VEGF拮抗剂(例如抗VEGF抗体,例如贝伐珠单抗)的特定剂量方案的有效性。例如,可使用体内成像(例如MRI)来测定肿瘤大小及鉴定任何转移以确定对该疗法的相对有效响应性。可调整剂量方案来提供最佳的期望响应(例如治疗响应)。例如,可以施用一剂,可以在一段时间里施用数个分剂,或者可以根据治疗情况的紧急事件成比例地降低或提高剂量。
IV.VEGF拮抗剂治疗
A.剂量和施用
一旦鉴定出对本文所述VEGF拮抗剂(例如抗VEGF抗体,例如贝伐珠单抗)治疗是响应性或敏感的患者,就可以进行单独的或与其它药物组合的VEGF拮抗剂的治疗。此类治疗可导致例如肿瘤尺寸(例如成胶质细胞瘤肿瘤尺寸)缩小或无进展存活(PFS)和/或总体存活(OS)延长。此外,VEGF拮抗剂(例如抗VEGF抗体,例如贝伐珠单抗)和至少一种第二药物组合的治疗优选对患者导致叠加,更优选协同(或大于叠加)的治疗受益。优选地,在这种组合方法中,本文中第二药物的至少一次施用和拮抗剂的至少一次施用之间的时机是约1个月或更少,更优选约2周或更少。
在一些实施方案中,本发明提供治疗具有成胶质细胞瘤的患者的方法,该方法包括对该患者施用VEGF拮抗剂,其中该患者已经预先测定为具有选自AKT3,CDH1,CYP27B1,DNM3,DYNLL1,ERBB3,KLRK1,MBP,MDM2,NCAM1,PDGFRA,PRKCZ,SNCA,TNFRSF21,AXL,BCL2L1,CD36,ETS1,ICAM2,IL17A,IRS2,PDGFRB,RPL13A,TGFB1,TNFRSF4,TNFSF4,和ZBTB16的至少一种基因(例如1,2,3,4,5,6,7,8,9,10,11,12,13,14,15,16,17,18,19,20,21,22,23,24,25,26,或27种基因)的表达水平相对于该至少一种基因的参照表达水平的变化。该变化可以是至少一种基因的表达水平相对于参照水平的升高,且该至少一种基因(例如1,2,3,4,5,6,7,8,9,10,11,12,13,或14种基因)可以是AKT3,CDH1,CYP27B1,DNM3,DYNLL1,ERBB3,KLRK1,MBP,MDM2,NCAM1,PDGFRA,PRKCZ,SNCA,和/或TNFRSF21。在一些实施方案中,其中该变化可以是至少一种基因的表达水平相对于参照水平的降低,且该至少一种基因(例如1,2,3,4,5,6,7,8,9,10,11,12,或13种基因)可以是AXL,BCL2L1,CD36,ETS1,ICAM2,IL17A,IRS2,PDGFRB,RPL13A,TGFB1,TNFRSF4,TNFSF4,和/或ZBTB16。
医学领域技术人员会领会,在诊断对VEGF拮抗剂的可能响应性后对患者施用治疗有效量的VEGF拮抗剂(例如抗VEGF抗体,例如贝伐珠单抗)的确切方式会由主治医师斟酌。施用的模式(包括剂量,与其它药剂的组合,施用的时机和频率,等等)可以受到患者对此类VEGF拮抗剂的可能响应性的诊断以及患者的状况和历史影响。如此,甚至预测对VEGF拮抗剂相对不敏感的具有成胶质细胞瘤的患者仍可受益于其治疗,特别是在与其它药剂(包括可改变患者对拮抗剂的响应性的药剂)的组合时。
会以与优良医学实践一致的方式配制,定剂量,和施用包含VEGF拮抗剂的组合物。在此内容中考虑的因素包括所治疗的成胶质细胞瘤的具体类型(例如新诊断的成胶质细胞瘤或复发的成胶质细胞瘤,前神经型的成胶质细胞瘤,间充质型的成胶质细胞瘤,或增殖型的成胶质细胞瘤),所治疗的具体哺乳动物(例如人),患者个体的临床状况,成胶质细胞瘤的起因,投递药剂的部位,可能的副作用,拮抗剂的类型,施用的方法,施用的日程安排,和医学从业人员知道的其它因素。要施用的VEGF拮抗剂的有效量会取决于此类考量。
根据诸如具体的拮抗剂类型等因素,具有本领域普通技能的内科医师能容易地确定所需要的药物组合物的有效量及开出这样的处方。例如,内科医师能以多剂如下VEGF拮抗剂(例如抗VEGF抗体,例如贝伐珠单抗)开始,其在药物组合物中以比实现期望的治疗效果所需水平要低的水平采用,并逐渐提高剂量,直至实现期望的效果。拮抗剂的给定剂量或治疗方案的有效性可以例如通过使用标准功效度量评估患者中的体征和症状来测定。
在某些例子中,VEGF拮抗剂(例如抗VEGF抗体,例如贝伐珠单抗)可以是施用于受试者的唯一药物(即作为单一疗法)。
在某些例子中,至少两次用相同的VEGF拮抗剂(例如抗VEGF抗体,例如贝伐珠单抗)治疗患者。如此,初始和第二VEGF拮抗剂暴露优选用相同的拮抗剂,而且更优选地,所有VEGF拮抗剂暴露用相同的VEGF拮抗剂,即头两次暴露,优选所有暴露的治疗用一种类型的VEGF拮抗剂,例如结合VEGF的拮抗剂,诸如抗VEGF抗体,例如都用贝伐珠单抗。
作为一般建议,每剂胃肠外施用的VEGF拮抗剂的有效量会在约20mg至约5000mg的范围里,通过一个或多个剂量来实现。用于抗体(诸如抗VEGF抗体,例如贝伐珠单抗)的例示性剂量方案包括每1,2,3,或4周100或400mg,或者每1,2,3,或4周施用约1,3,5,10,15,或20mg/kg的一剂。例如,可以每两周以10mg/kg施用有效量的抗VEGF抗体(例如贝伐珠单抗),任选通过静脉内(i.v.)施用。又例如,可以每三周以15mg/kg施用有效量的抗VEGF抗体,任选通过i.v.施用。该剂量可以作为单剂或作为多剂(例如2或3剂)施用,诸如输注。
在一些情况中,根据疾病的类型和严重程度,约1μg/kg至100mg/kg(例如0.1-20mg/kg)VEGF拮抗剂(例如抗VEGF抗体,例如贝伐珠单抗)作为初始候选剂量施用于受试者,无论例如通过一次或多次分开的施用或通过连续输注。在一个实施方案中,期望的剂量包括例如6mg/kg,8mg/kg,10mg/kg,和15mg/kg。对于持续数天或更久的重复施用或周期,根据状况,持续治疗直至癌症得到治疗,如通过上文所述或本领域已知方法测量的。然而,其它剂量方案可能是有用的。在一个例子中,每周,每两周,或每三周一次施用抗VEGF抗体,剂量范围为约6mg/kg至约15mg/kg,包括但不限于6mg/kg,8mg/kg,10mg/kg或15mg/kg。本发明疗法的进展易于通过常规技术和测定法来监测。在其它实施方案中,此类剂量给药方案与化疗方案在成胶质细胞瘤中组合使用。
如果提供多次VEGF拮抗剂暴露,那么每次暴露可以使用相同的或不同的施用手段来提供。在一个实施方案中,每次暴露通过静脉内施用。在另一个实施方案中,每次暴露通过皮下施用给予。在还有另一个实施方案中,所述暴露通过静脉内和皮下施用二者给予。
在一个实施方案中,以缓慢的静脉内输注而非静脉内推注或快速注射来施用VEGF拮抗剂(例如抗VEGF抗体,例如贝伐珠单抗)。例如,在抗VEGF抗体的任何输注之前约30分钟施用类固醇,诸如泼尼松龙或甲泼尼龙(例如静脉内约80-120毫克,更具体地,静脉内约100毫克)。例如,可以经由专用线路来输注抗VEGF抗体(诸如贝伐珠单抗)。
对于多剂VEGF拮抗剂(例如抗VEGF抗体,例如贝伐珠单抗)暴露的初始剂,或者对于暴露只包括一剂的情况中的单剂,此类输注优选以约50毫克/小时的速率开始。这可以例如以每约30分钟增加约50毫克/小时的速率逐步提高至约400毫克/小时的最大值。然而,如果受试者正在经历输注相关反应,那么输注速率优选降低至例如当前速率的一半,例如从100毫克/小时降低至50毫克/小时。例如,VEGF拮抗剂的此类剂量(例如约1000毫克总剂量)的输注用约255分钟(4小时15分钟)完成。任选地,受试者在开始输注前约30至60分钟通过口接受醋氨酚/对乙酰氨基酚(例如约1克)和盐酸苯海拉明(例如约50毫克或相似药剂的等效剂量)的预防性处理。
如果给予超过一次VEGF拮抗剂(例如抗VEGF抗体,例如贝伐珠单抗)输注(剂)以实现整个暴露,那么在此实施方案中以比初始输注要高的速率开始第二或后续VEGF拮抗剂输注,例如以约100毫克/小时。此速率可以例如以每约30分钟增加约100毫克/小时的速率逐步提高至约400毫克/小时的最大值。经历输注相关反应的受试者优选将输注速率降低至该速率的一半,例如从100毫克/小时降低至50毫克/小时。优选地,VEGF拮抗剂的此类第二或后续剂量(例如约1000毫克总剂量)的输注用约195分钟(3小时15分钟)完成。
在一个实施方案中,VEGF拮抗剂是抗VEGF抗体(例如贝伐珠单抗),而且以约0.4至4克的剂量施用,而且更优选的是,该抗体以约0.4至1.3克的剂量,以约1个月的时段内1至4剂的频率施用。仍然更加优选的是,剂量是约500mg至1.2g,而且在其它实施方案中,是约750mg至1.1g。在此类方面,VEGF拮抗剂优选以2至3剂施用,和/或在约2至3周的时段内施用。
疗法的持续时间会持续像医嘱指示的那样长时间或直到实现期望的治疗效果(例如本文所述那些)。在某些实施方案中,疗法持续1个月,2个月,4个月,6个月,8个月,10个月,1年,2年,3年,4年,5年,或长至受试者终身的时段。
然而,如上所述,对于VEGF拮抗剂的这些建议量要加以诸多治疗上的考量。在选择适宜剂量和日程安排中,关键的因素是获得的结果,如上文指示的。在一些实施方案中,尽可能接近成胶质细胞瘤的首次体征,诊断,表现,或出现,施用VEGF抗体拮抗剂。
1.施用的路径
VEGF拮抗剂(例如抗VEGF抗体,例如贝伐珠单抗)可以通过任何合适手段来施用,包括胃肠外,表面,皮下,腹膜内,肺内,鼻内,和/或损伤内施用。胃肠外输注包括肌肉内,静脉内,动脉内,腹膜内,或皮下施用。还涵盖鞘内施用。另外,可合适地通过脉冲输注来施用VEGF拮抗剂,例如用剂量逐渐减少的VEGF拮抗剂。最优选地,通过静脉内注射来给予剂量给药。
如果提供多次抗VEGF抗体暴露,那么每次暴露可以使用相同的或不同的施用手段来提供。在一个实施方案中,每次暴露通过静脉内(i.v.)施用。例如,抗VEGF抗体(诸如贝伐珠单抗)可以经由专用线路来输注。例如,抗VEGF抗体(诸如贝伐珠单抗)可以最初在约90分钟里静脉内施用,后续输注在约60分钟里,然后在约30分钟里。在另一个实施方案中,每次暴露通过皮下(s.c.)施用给予。在还有另一个实施方案中,所述暴露通过i.v.和s.c.施用二者给予。
除了通过上文所述传统路径将VEGF拮抗剂施用于患者,本发明还包括通过基因疗法进行的施用。参见例如WO 1996/07321,其关注使用基因疗法来产生胞内抗体。
主要有两种办法使核酸(任选包含在载体中)进入患者的细胞,即体内(in vivo)和回体(ex vivo)。对于体内投递,通常在需要拮抗剂的部位将核酸直接注射入患者。对于回体治疗,取出患者的细胞,将核酸导入这些分离的细胞,并将经过修饰的细胞直接施用于患者,或者例如封装入多孔膜再植入患者(参见例如美国专利No.4,892,538和5,283,187)。有多种技术可用于将核酸导入活细胞。这些技术根据是将核酸转移入体外培养的细胞还是目的宿主的体内细胞而有所变化。适合于在体外将核酸转移入哺乳动物细胞的技术包括使用脂质体,电穿孔,显微注射,细胞融合,DEAE-右旋糖苷,磷酸钙沉淀法等。常用于回体投递基因的一种载体是逆转录病毒。
目前优选的体内核酸转移技术包括用病毒载体(诸如腺病毒,I型单纯疱疹病毒或腺伴随病毒)和基于脂质的系统(例如,可用于脂质介导的基因转移的脂质有DOTMA,DOPE和DC-Chol)进行转染。在一些情况中,希望与对靶细胞特异性的药剂(诸如对靶细胞上的细胞表面膜蛋白特异性的抗体,针对靶细胞上受体的配体,等)一起提供核酸来源。在采用脂质体的情况中,可以使用与胞吞作用有关的细胞表面膜蛋白结合的蛋白质靶向和/或促进摄取,例如对特定细胞类型有向性的衣壳蛋白或其片段,针对在循环中经历内在化的蛋白质的抗体,和靶向胞内定位并延长胞内半衰期的蛋白质。受体介导的胞吞作用的技术记载于例如Wu et al.,J.Biol.Chem.262:4429-4432(1987);及Wagner et al.,PNAS USA 87:3410-3414(1990)。基因标记和基因疗法方案记载于例如Anderson et al.,Science 256:808-813(1992)及WO1993/25673。
2.组合疗法
在一些实施方案中,VEGF拮抗剂(例如抗VEGF抗体,例如贝伐珠单抗)可以与一种或多种别的抗癌剂或抗癌疗法组合使用。抗癌疗法的例子包括但不限于手术,放射疗法(放疗(RT)),生物疗法,免疫疗法,化疗(例如替莫唑胺(TMZ)),或者这些疗法的组合。另外,可以与抗VEGF抗体组合使用细胞毒剂,抗血管发生剂,和抗增殖剂。一种或多种别的抗癌剂或抗癌疗法优选具有与VEGF拮抗剂互补的活性,使得它们彼此没有不利影响。组合施用包括使用分开的配制剂或单一药物配制剂的共施用,和任一次序的序贯施用,其中优选有一段时间所有活性剂同时发挥它们的生物学活性。
一种或多种别的抗癌剂可以是化疗剂,细胞毒剂,细胞因子,生长抑制剂,抗激素剂,及其组合。此类分子恰当地以对于预定目的有效的量组合存在。含有VEGF拮抗剂(例如抗VEGF抗体,例如贝伐珠单抗)的药物组合物还可以包含治疗有效量的抗肿瘤剂,化疗剂,生长抑制剂,细胞毒剂,或其组合。
在一个方面,第一化合物是抗VEGF抗体且至少一种别的化合物是除抗VEGF抗体以外的治疗性抗体。在一个实施方案中,至少一种别的化合物是结合癌细胞表面标志物的抗体。在一个实施方案中,至少一种别的化合物是抗HER2抗体,曲妥珠单抗(trastuzumab)(例如Genentech,Inc.,South San Francisco,CA)。在一个实施方案中,至少一种别的化合物是抗HER2抗体,帕妥珠单抗(pertuzumab)(OmnitargTM,Genentech,Inc.,South San Francisco,CA,参见USPN 6,949,245)。在一个实施方案中,至少一种别的化合物是抗体(或是裸抗体或是ADC),且别的抗体是第二,第三,第四,第五,第六或更多抗体,使得此类第二,第三,第四,第五,第六,或更多抗体(或是裸抗体或是ADC)的组合有效治疗血管发生性病症。
依照本发明的其它治疗方案可以包括施用抗癌剂和(包括但不限于)放射疗法和/或骨髓和外周血移植,和/或细胞毒剂,化疗剂,或生长抑制剂。在一个此类实施方案中,化疗剂是一种药剂或药剂组合,诸如例如环磷酰胺,羟基柔红霉素,阿霉素,多柔吡星,长春新碱(ONCOVINTM),泼尼松龙,CHOP,CVP,或COP,或免疫治疗剂诸如抗PSCA,抗HER2(例如OMNITARGTM)。在另一个实施方案中,组合包括多西他赛,多柔吡星,和环磷酰胺。组合疗法可以作为同时或顺序方案施用。在顺序施用时,组合可以在两次或更多次施用中施用。组合施用包括使用分开的配制剂或单一药物配制剂的共施用,和任一次序的序贯施用,其中优选有一段时间所有活性剂同时发挥它们的生物学活性。
在一个实施方案中,VEGF拮抗剂(例如抗VEGF抗体)治疗牵涉本文中鉴定的抗癌剂,和一种或多种化疗剂或生长抑制剂的组合施用,包括不同化疗剂的混合物的共施用。化疗剂包括紫杉烷(诸如帕利他赛和多西他赛)和/或蒽环类抗生素。可以依照制造商的说明书或由熟练从业人员凭经验确定来使用此类化疗剂的制备和剂量给药日程表。此类化疗的制备和剂量给药日程表还记载于“Chemotherapy Service”(1992)M.C.Perry编,Williams&Wilkins,Baltimore,Md。
任何上述共施用的药剂的合适剂量就是那些当前使用的,而且可以由于VEGF拮抗剂和其它化疗剂或治疗的组合作用(协同)而降低。
组合疗法可以提供“协同作用”及证实是“协同性”的,即当一起使用活性组分时所实现的效果大于分开使用化合物时所产生的效果之和。当活性组分为如下情况时可以获得协同效应:(1)共配制和施用或在组合的单位剂量配制剂中同时投递;(2)作为分开的配制剂交替或平行投递;或(3)通过一些其它方案。当在交替疗法中投递时,在顺序施用或投递化合物时,例如通过不同注射器中的不同注射,可以获得协同效应。一般地,在交替疗法期间,顺序即连续施用有效剂量的每种活性组分,而在组合疗法中,一起施用有效剂量的两种或更多种活性组分。
一般地,对于疾病的预防或治疗,别的治疗剂的适宜剂量会取决于要治疗的疾病的类型,抗体的类型,疾病的严重程度和进程,施用VEGF拮抗剂(例如抗VEGF抗体,例如贝伐珠单抗)和别的药剂(例如TMZ)是出于预防还是治疗目的,先前的疗法,患者的临床史和对VEGF拮抗剂和别的药剂的响应,及主治医师的斟酌。以一次或在一系列治疗里将VEGF拮抗剂和别的药剂恰当地施用于患者。VEGF拮抗剂通常如上文所述施用。根据疾病的类型和严重程度,约20mg/m2至600mg/m2别的药剂是施用于患者的初始候选剂量,无论是例如通过一次或多次分开施用或是通过连续输注。根据上文所述因素,一种典型日剂量的范围可以是约20mg/m2,85mg/m2,90mg/m2,125mg/m2,200mg/m2,400mg/m2,500mg/m2或更多。对于持续数天或更久的重复施用,根据状况,持续治疗直至疾病症状发生期望的抑制。如此,可以对患者施用约20mg/m2,85mg/m2,90mg/m2,125mg/m2,200mg/m2,400mg/m2,500mg/m2,600mg/m2(或其任意组合)的一剂或多剂。此类剂量可以间歇施用,例如每周或每两,三,四,五,或六周(例如使得患者接受约2剂至约20剂,例如约6剂别的药剂)。可施用一剂较高的初始加载剂量,接着是一剂或多剂较低剂量。然而,其它剂量方案也可能是有用的。这种疗法的进展易于通过常规技术和测定法来监测。
在一个实施方案中,受试者先前从未施用任何药物来治疗成胶质细胞瘤。在另一个实施方案中,受试者或患者先前曾经施用一种或多种药物来治疗成胶质细胞瘤。在又一个实施方案中,受试者或患者对先前施用的一种或多种药物不是响应性的。受试者对其可以是非响应性的此类药物包括例如抗肿瘤剂,化疗剂,细胞毒剂,和/或生长抑制剂。更特别地,受试者对其可以是非响应性的药物包括VEGF拮抗剂,诸如抗VEGF抗体,例如贝伐珠单抗。在又一个方面,此类VEGF拮抗剂包括抗体或免疫粘附素,使得涵盖用受试者以前是非响应性的一种或多种抗体或免疫粘附素进行的复治。
B.VEGF拮抗剂
在本文所列所有方法中,VEGF拮抗剂可以是抗VEGF抗体。
在某些实施方案中,抗VEGF抗体可以是嵌合抗体。某些嵌合抗体记载于例如美国专利No.4,816,567及Morrison等,PNAS USA,81:6851-6855,1984。在一个例子中,嵌合抗体包含非人可变区(例如,自小鼠,大鼠,仓鼠,家兔,或非人灵长类,诸如猴衍生的可变区)和人恒定区。在又一个例子中,嵌合抗体是“类转换的”抗体,其中类或亚类已经自亲本抗体的类或亚类改变。嵌合抗体包括其抗原结合片段。
在某些实施方案中,抗VEGF抗体可以是人源化抗体。通常,将非人抗体人源化以降低对人的免疫原性,同时保留亲本非人抗体的特异性和亲和力。一般地,人源化抗体包含一个或多个可变域,其中HVR,例如CDR(或其部分)自非人抗体衍生,而FR(或其部分)自人抗体序列衍生。任选地,人源化抗体还会至少包含人恒定区的一部分。在一些实施方案中,将人源化抗体中的一些FR残基用来自非人抗体(例如衍生HVR残基的抗体)的相应残基替代,例如以恢复或改善抗体特异性或亲和力。人源化抗体及其生成方法综述于例如Almagro和Fransson,Front.Biosci.13:1619-1633(2008),并且进一步记载于例如Riechmann等,Nature 332:323-329(1988);Queen等,Proc.Nat’l Acad.Sci.USA 86:10029-10033(1989);美国专利No.5,821,337,7,527,791,6,982,321和7,087,409;Kashmiri等,Methods 36:25-34(2005)(描述了SDR(a-CDR)嫁接);Padlan,Mol.Immunol.28:489-498(1991)(描述了“重修表面”);Dall’Acqua等,Methods 36:43-60(2005)(描述了“FR改组”);及Osbourn等,Methods 36:61-68(2005)及Klimka等,Br.J.Cancer,83:252-260(2000)(描述了FR改组的“引导选择”办法)。
在某些实施方案中,抗VEGF抗体可以是人抗体。可以使用本领域中已知的多种技术来生成人抗体。人抗体一般性记载于van Dijk和van de Winkel,Curr.Opin.Pharmacol.5:368-74(2001)及Lonberg,Curr.Opin.Immunol.20:450-459(2008)。可以通过对转基因动物施用免疫原来制备人抗体,所述转基因动物已经修饰为响应抗原性攻击而生成完整人抗体或具有人可变区的完整抗体。此类动物通常含有整个或部分人免疫球蛋白基因座,其替换内源免疫球蛋白基因座,或者其在染色体外存在或随机整合入动物的染色体中。在此类转基因小鼠中,一般已经将内源免疫球蛋白基因座灭活。关于自转基因动物获得人抗体的方法的综述,见Lonberg,Nat.Biotech.23:1117-1125(2005)。还可见例如美国专利No.6,075,181和6,150,584,其描述了XENOMOUSETM技术;美国专利No.5,770,429,其描述了技术;美国专利No.7,041,870,其描述了技术,和美国专利申请公开文本No.US 2007/0061900,其描述了技术)。可以例如通过与不同人恒定区组合进一步修饰来自由此类动物生成的完整抗体的人可变区。也可以通过基于杂交瘤的方法生成人抗体。已经描述了用于生成人单克隆抗体的人骨髓瘤和小鼠-人异源骨髓瘤细胞系(见例如Kozbor,J.Immunol.,133:3001(1984);Brodeur等,Monoclonal Antibody Production Techniques and Applications,第51-63页(Marcel Dekker,Inc.,New York,1987);及Boerner等,J.Immunol.,147:86(1991))。经由人B细胞杂交瘤技术生成的人抗体也记载于Li等,PNAS USA,103:3557-3562(2006)。别的方法包括那些例如记载于美国专利No.7,189,826(其描述了自杂交瘤细胞系生成单克隆人IgM抗体)和Ni,Xiandai Mianyixue,26(4):265-268(2006)(其描述了人-人杂交瘤)的。人杂交瘤技术(Trioma技术)也记载于Vollmers和Brandlein,Histology and Histopathology,20(3):927-937(2005)及Vollmers和Brandlein,Methods and Findings in Experimental and Clinical Pharmacology,27(3):185-91(2005)。
在某些实施方案中,抗VEGF抗体可以是或已经是通过对组合文库筛选具有期望的一种或多种活性的抗体而分离的。例如,用于生成噬菌体展示文库并对此类文库筛选拥有期望结合特征的抗体的多种方法是本领域中已知的。此类方法综述于例如Hoogenboom等,于Methods in Molecular Biology178:1-37(O’Brien等编,Human Press,Totowa,NJ,2001),并且进一步记载于例如McCafferty等,Nature 348:552-554;Clackson等,Nature 352:624-628(1991);Marks等,J.Mol.Biol.222:581-597(1992);Marks和Bradbury,于Methods in Molecular Biology 248:161-175(Lo编,Human Press,Totowa,NJ,2003);Sidhu等,J.Mol.Biol.338(2):299-310(2004);Lee等,J.Mol.Biol.340(5):1073-1093(2004);Fellouse,PNAS USA 101(34):12467-12472(2004);及Lee等,J.Immunol.Methods 284(1-2):119-132(2004)。
在一些噬菌体展示方法中,将VH和VL基因的全集分开通过聚合酶链式反应(PCR)克隆,并在噬菌体文库中随机重组,然后可以对所述噬菌体文库筛选抗原结合噬菌体,如记载于Winter等,Ann.Rev.Immunol.,12:433-455(1994)的。噬菌体通常以单链Fv(scFv)片段或以Fab片段展示抗体片段。来自经免疫的来源的文库提供针对免疫原的高亲和力抗体,而不需要构建杂交瘤。或者,可以(例如自人)克隆未免疫全集以在没有任何免疫的情况中提供针对一大批非自身和还有自身抗原的抗体的单一来源,如由Griffiths等,EMBO J,12:725-734(1993)描述的。最后,也可以通过自干细胞克隆未重排的V基因区段,并使用含有随机序列的PCR引物编码高度可变的CDR3区并在体外实现重排来合成生成未免疫文库,如由Hoogenboom和Winter,J.Mol.Biol.,227:381-388(1992)所描述的。描述人抗体噬菌体文库的专利公开文本包括例如:美国专利No.5,750,373,和美国专利公开文本No.2005/0079574,2005/0119455,2005/0266000,2007/0117126,2007/0160598,2007/0237764,2007/0292936和2009/0002360。
在一些实施方案中,在本发明的方法中有用的抗VEGF抗体包括任何以足够亲和力和特异性结合VEGF且能降低或抑制VEGF的生物学活性的抗体或其抗原结合片段。抗VEGF抗体通常不会结合其它VEGF同源物,诸如VEGF-B或VEGF-C,也不会结合其它生长因子,诸如PlGF,PDGF,或bFGF。例如,在本发明的某些实施方案中,抗VEGF抗体包括但不限于与由杂交瘤ATCC HB 10709生成的单克隆抗VEGF抗体A4.6.1;依照Presta等(1997)Cancer Res.57:4593-4599生成的重组人源化抗VEGF单克隆抗体结合相同表位的单克隆抗体。在一个实施方案中,抗VEGF抗体是贝伐珠单抗(BV或Bev),也称作“rhuMAb VEGF”或它包含经过突变的人IgG1框架区和来自阻断人VEGF结合其受体的鼠抗hVEGF单克隆抗体A.4.6.1的抗原结合互补决定区。贝伐珠单抗大约93%的氨基酸序列(包括大部分框架区)是自人IgG1衍生,而且约7%的序列是自鼠抗体A4.6.1衍生的。贝伐珠单抗和其它人源化抗VEGF抗体记载于2005年2月26日公告的美国专利No.6,884,879。别的抗体包括G6或B20系列抗体(例如G6-31,B20-4.1),如记载于PCT公开文本No.WO2005/012359,PCT公开文本No.WO2005/044853,和美国专利申请60/991,302,通过述及明确将这些专利申请的内容收入本文。别的抗体参见美国专利No.7,060,269,6,582,959,6,703,020;6,054,297;WO98/45332;WO 96/30046;WO 94/10202;EP 0666868B1;美国专利申请公开文本No.2006009360,20050186208,20030206899,20030190317,20030203409,和20050112126;和Popkov等,Journal ofImmunological Methods288:149-164(2004)。其它抗体包括那些结合人VEGF上包含残基F17,M18,D19,Y21,Y25,Q89,I91,K101,E103,和C104或者包含残基F17,Y21,Q22,Y25,D63,I83和Q89的功能性表位的。
在一些实施方案中,在本文所述任一方法中有用的抗VEGF抗体可以具有轻链可变区和重链可变区,该轻链可变区包含下述氨基酸序列:
该重链可变区包含下述氨基酸序列:
本文中的抗VEGF抗体可以是嵌合抗体,人源化抗体,或人抗体,而且可以是例如贝伐珠单抗。
在还有其它实施方案中,抗VEGF抗体可以是未缀合的,诸如裸的抗VEGF抗体,或者可以为进一步的有效性与另一分子缀合,诸如例如为了改善半衰期。
V.药物配制剂
依照本发明使用的拮抗剂的治疗用配制剂通过将具有期望纯度的拮抗剂与任选的药学可接受载剂,赋形剂或稳定剂混合,以冻干配制剂或水溶液的形式制备供贮存。关于配制剂的一般信息参见例如Gilman et al.,(eds.)(1990),The Pharmacological Bases of Therapeutics,8th Ed.,Pergamon Press;A.Gennaro(ed.),Remington’s Pharmaceutical Sciences,18th Edition,(1990),Mack Publishing Co.,Eastori,Pennsylvania;Avis et al.,(eds.)(1993)Pharmaceutical Dosage Forms:Parenteral Medications Dekker,New York;Lieberman et al.,(eds.)(1990)Pharmaceutical Dosage Forms:Tablets Dekker,New York;Lieberman et al.,(eds.)(1990),Pharmaceutical Dosage Forms:Disperse Systems Dekker,New York;及Kenneth A.Walters(ed.)(2002)Dermatological and Transdermal Formulations(Drugs and the Pharmaceutical Sciences),Vol 119,Marcel Dekker。
可接受的载剂,赋形剂或稳定剂在所采用的剂量和浓度对接受者是无毒的,包括缓冲剂,诸如磷酸盐,柠檬酸盐和其它有机酸;抗氧化剂,包括抗坏血酸和甲硫氨酸;防腐剂(诸如氯化十八烷基二甲基苄基铵;氯化己烷双胺;苯扎氯铵,苄索氯铵;苯酚,丁醇或苯甲醇;对羟基苯甲酸烷基酯,诸如对羟基苯甲酸甲酯或丙酯;邻苯二酚;间苯二酚;环己醇;3-戊醇;和间甲酚);低分子量(少于约10个残基)多肽;蛋白质,诸如血清清蛋白,明胶或免疫球蛋白;亲水性聚合物,诸如聚乙烯吡咯烷酮;氨基酸,诸如甘氨酸,谷氨酰胺,天冬酰胺,组氨酸,精氨酸或赖氨酸;单糖,二糖和其它碳水化合物,包括葡萄糖,甘露糖或糊精;螯合剂,诸如EDTA;糖类,诸如蔗糖,甘露醇,海藻糖或山梨醇;成盐反荷离子,诸如钠;金属复合物(例如Zn-蛋白质复合物);和/或非离子表面活性剂,诸如TWEENTM,PLURONICSTM或聚乙二醇(PEG)。
例示性的抗VEGF抗体配制剂记载于美国专利No.6,884,879。在某些实施方案中,抗VEGF抗体在单次使用管形瓶中以25mg/ml配制。在某些实施方案中,在240mgα,α-海藻糖二水合物,23.2mg钠的磷酸盐(一碱基的,一水合物),4.8mg钠的磷酸盐(二碱基的,无水的),1.6mg聚山梨酯20,和注射用水(USP)中配制100mg抗VEGF抗体。在某些实施方案中,在960mgα,α-海藻糖二水合物,92.8mg钠的磷酸盐(单碱基的,一水合物),19.2mg钠的磷酸盐(二碱基的,无水的),6.4mg聚山梨酯20,和注射用水(USP)中配制400mg抗VEGF抗体。
适于皮下施用的冻干配制剂记载于例如美国专利No.6,267,958。此类冻干配制剂可以用合适的稀释剂重建至高蛋白质浓度,重建的配制剂可皮下施用于本文中要治疗的哺乳动物。
还涵盖拮抗剂的结晶形式。参见例如US 2002/0136719A1。
本文中的配制剂还可含有超过一种活性化合物(上文提到的第二药物),优选那些活性互补且彼此没有不利影响的。此类药物的类型和有效量取决于例如配制剂中存在的VEGF拮抗剂(例如抗VEGF抗体,例如贝伐珠单抗)的量和类型,以及受试者的临床参数。优选的此类第二药物如上所述。
活性组分还可包载于例如通过凝聚技术或通过界面聚合制备的微胶囊中(例如分别是羟甲基纤维素或明胶微胶囊和聚(甲基丙烯酸甲酯)微胶囊),在胶状药物投递系统中(例如脂质体,清蛋白微球体,微乳剂,纳米颗粒和纳米胶囊),或在粗滴乳状液中。此类技术公开于Remington′s Pharmaceutical Sciences,第16版,Osol,A.Ed.(1980)。
可制备持续释放制剂。持续释放制剂的合适例子包括含有所述拮抗剂的固体疏水性聚合物半透性基质,该基质是定型产品的形式,例如薄膜或微胶囊。持续释放基质的例子包括聚酯,水凝胶(例如聚(2-羟乙基-甲基丙烯酸酯)或聚(乙烯醇)),聚交酯(美国专利No.3,773,919),L-谷氨酸与L-谷氨酸γ乙酯的共聚物,不可降解的乙烯-乙酸乙烯共聚物,可降解的乳酸-乙醇酸共聚物诸如LUPRON DEPOTTM(由乳酸-乙醇酸共聚物和醋酸亮丙瑞林构成的可注射微球体)及聚-D-(-)-3-羟基丁酸。
用于体内施用的配制剂必须是无菌的。这可容易地通过使用无菌滤膜过滤来实现。
实施例
提供下述实施例以例示但非限制当前要求保护的发明。
实施例1:统计方法和微阵列分析
统计方法
统计任务一般可包含以下步骤:
1.候选生物标志物的预选择
2.有关临床功效响应预测性协变量的预选择
3.单变量水平的生物标志物预测函数的选择
4.在单变量水平包括临床协变量的生物标志物预测函数的选择
5.多变量水平的生物标志物预测函数的选择
6.在多变量水平包括临床协变量的生物标志物预测函数的选择
下文详述不同步骤:
1:候选生物标志物的预选择。
候选生物标志物的统计学预选择的方向指向与临床受益各度量的关联强度。为此目的,可以将不同临床终点变换成推导得出的替代得分,像例如关于TTP的临床受益得分程度的依次指派,避免检查观察(censored observations)。这些替代变换度量能容易地用于简单相关分析,例如通过非参数Spearman等级相关办法。一种备选方法是使用生物标志物测量作为时间对事件回归模型(像例如Cox比例危害回归)中的计量协变量。取决于生物标志物数值的统计学分布,此步骤可要求一些预加工,像例如变异稳定化变换和使用合适的标尺,或者标准化步骤诸如使用百分点代替原始测量结果。另一种办法是检查双变量散布图,例如通过在单患者基础上显示(x轴=生物标志物数值,y轴=临床受益的度量)散布。有些非参数回归线(像通过例如平滑样条而实现的)对于显现生物标志物与临床受益的关联是有用的。
这些不同办法的目的是显示与所采用的至少一项受益度量中临床受益的一些关联,同时对其它度量的结果不矛盾的生物标志物候选者的预选择。若对照组可得,则生物标志物与不同分支中临床受益的关联的差异可以是差异预测的迹象,使得该生物标志物符合进入进一步考虑的条件。
2:有关临床功效响应预测性协变量的预选择。
本文中所定义的临床协变量的统计学预选择与用于预选择生物标志物的办法平行,而且它的方向也指向与临床受益各度量的关联强度。所以,原则上,与上文第1点下考虑的方法相同的方法适用。在统计标准之外,来自临床经验和理论知识的标准可适用于预选择有关临床协变量。
临床协变量的预测值可以与生物标志物的预测值相合(interact with)。如果必要,可以考虑它们来改进预测规则。
3:单变量水平的生物标志物预测函数的选择。
术语“预测函数”会以一般意义使用,指生物标志物测量的数值函数,得出经过定标的数值,以暗示目标预测。
一个简单例子是特定截留c和生物标志物测量x的Heaviside函数选择,其中要做出二元预测,即A或B,那么,
若H(x-c)=0,则预测A。
若H(x-c)=1,则预测B。
这大概是在预测规则中使用单变量生物标志物测量的最常见方式。如上所述“预测函数”的定义包括提到现有的练习数据集,其可用于探索预测可能性。可采取不同路径自练习集获得合适的截留c。首先,可使用第1点下提到的带平滑样条的散布图来定义截留。或者,可选择一些分布百分点,例如中值或四分位。也可以通过调查所有可能截留依照它们关于临床受益度量的预测潜力而系统性提取截留。然后,可以将这些结果绘图,以容许手工选择或为实现最佳而采用一些搜索算法。这可使用Cox模型基于某些临床终点认识到,在Cox模型中,在每一个测试截留,作为二元协变量使用生物标志物。然后,可以一起考虑临床终点的结果以选择根据两终点显示预测的截留。
选择预测函数的另一种不常用的办法可基于自练习集得到的固定参数Cox回归模型,其中以生物标志物数值(可能是经过转换的)作为协变量。另一种可能性是将决策基于一些似然比(likelihood ratio)(或其单调转换(monotonic transform)),其中目标概率密度是在用于分拆预测状态的练习集中预先确定的。然后,将生物标志物塞入预测标准的一些函数中。
4:在单变量水平包括临床协变量的生物标志物预测函数的选择。
单变量指只使用一项生物标志物--就临床协变量而言,这可以是多变量模型。这种办法与没有临床协变量的搜索平行,只是此类方法应当容许掺入有关协变量信息。选择截留的散布图法只容许协变量的有限使用,例如二元协变量可以在图内用颜色编码。如果分析依赖于一些回归办法,那么通常有利于协变量的使用(也是一次多个)。基于上文第3点下描述的Cox模型的截留搜索容许容易地掺入协变量,并由此导致经过协变量调整的单变量截留搜索。通过协变量进行的调整可以像模型中的协变量那样或经由包括在分层分析中来进行。
还有,预测函数的其它选项容许掺入多项协变量。
这对于作为预测函数的Cox模型选项是直截了当的。这包括评估协变量对交互水平的影响的选项,这意味着例如,对于不同年龄组,适用不同预测标准。
对于似然比型预测函数,必须估算预测密度,包括协变量。为此目的,可使用多变量样式识别方法学,或者可通过协变量的多重回归(在密度估计之前)来调整生物标志物数值。
CART技术(分类和回归树,Breiman et al.,Wadsworth,Inc.;New York,1984)可用于此目的,采用一项生物标志物(原始测量水平)加多项临床协变量并利用临床受益度量作为响应。搜索截留,会发现决策树型的函数,其涉及预测的协变量。通过CART选择的截留和算法常常是接近最佳的,而且可以通过考虑不同临床受益度量来组合和统一。
5:多变量水平的生物标志物预测函数的选择。
若有数项生物标志物候选者在不同的单变量预测函数选项中维持它们的预测潜力,则可通过生物标志物的组合来实现进一步改进,即考虑多变量预测函数。
基于简单的Heaviside函数模型,可评估生物标志物组合,例如通过考虑生物标志物数值的双变量散布图,其中指明了最佳的截留。然后可通过逻辑“和”和“或”运算符组合不同Heaviside函数来实现生物标志物的组合,以实现改良的预测。
CART技术可用于此目的,采用多项生物标志物(原始测量水平)和临床受益度量作为响应,以获得生物标志物的截留和决策树型预测函数。通过CART选择的截留和算法常常是接近最佳的,而且可以通过考虑不同临床受益度量来组合和统一。
可以在不同水平采用Cox回归。第一种方式是以二元方式掺入多项生物标志物(即基于具有一些截留的Heaviside函数)。另一种选择是(在合适的转换后)以计量方式采用生物标志物或二元与计量办法的混和体。进化多变量预测函数属于上文第3点下描述的Cox型。
多变量似然比办法(likelihood ratio approach)难以执行,但是为多变量预测函数呈现了另一个选项。
6:在多变量水平包括临床协变量的生物标志物预测函数的选择。
若有多项有关临床协变量,则可通过组合多项生物标志物与多项临床协变量来实现进一步的改进。就包括多项临床协变量的可能性而言,评估不同的预测函数选项。
基于关于生物标志物的Heaviside函数的简单逻辑组合,可以将别的协变量包括至基于在练习集中得到的逻辑回归模型的预测函数。
可以容易地与别的协变量(可以在预测算法中包括这些)一起使用CART技术和进化决策树(evolving decision tree)。
所有基于Cox回归的预测函数可使用别的临床协变量。存在评估协变量对交互水平的影响的选择,这意味着例如,对于不同年龄组,适用不同的预测标准。
多变量似然比办法不能直接延伸至别的协变量的使用。
微阵列分析
使用开放源码编程语言R(R Core Team(2013)R:A Language and Environment for Statistical Computing.R Foundation for Statistical Computing,Vienna,Austria)实施所有分析步骤。使用RefPlus R包(Harbron et al.Bioinformatics.23(18):2493-2494,2007)将来自所有Affymetrix微阵列的原始数据针对共同参照分布标准化。
实施例2:AvaGlio研究
AvaGlio试验评估贝伐珠单抗与替莫唑胺和放疗组合用于新诊断的成胶质细胞瘤的功效和安全性。这项研究设计为一项贝伐珠单抗加化疗较之单独的化疗的前瞻性,随机化,双盲,安慰剂对照的III期评估。要成为合格,患者必须具有新诊断的成胶质细胞瘤,有手术切除或活检后建立的组织诊断。通过将贝伐珠单抗添加至化疗和放疗,AvaGlio试验的目标是改善具有有限的治疗选项且面对特别差的预后的这群患者的总体存活(OS)和无进展存活(PFS)。主要目的是比较随机化至仅替莫唑胺(TMZ)和放疗或替莫唑胺和放疗加贝伐珠单抗的患者的OS和PFS。
AvaGlio研究的概览
这项试验由三个阶段(并行,维持,和单一疗法)和两个治疗分支(TMZ和放疗(RT)(分支1),和TMZ和RT加贝伐珠单抗(分支2))组成。患者随机指派(1:1)至任一分支。
分支1(单独的化疗和放疗):合格患者接受一周5天的2Gy RT持续6周和每天的口服75mg/m2TMZ持续6周(自RT的第一天至最后一天),与每2周的i.v.10mg/kg安慰剂组合。4周治疗休息后,合格患者接受6个周期每个四周日程表的第1-5天的150-200mg/m2TMZ,与每2周的i.v.10mg/kg安慰剂组合。口服施用TMZ,始于150mg/m2剂量,可以扩大。然后继续安慰剂单一疗法(每3周15mg/kg)直至疾病进展。在疾病进展时,根据调查人员的斟酌治疗患者。
分支2(化疗和放疗加贝伐珠单抗):合格患者接受一周5天的2Gy RT持续6周和每天的口服75mg/m2TMZ持续6周(自RT的第一天至最后一天),与每2周的i.v.10mg/kg贝伐珠单抗组合。4周治疗休息后,合格患者接受6个周期每个四周日程表的第1-5天的150-200mg/m2TMZ,与每2周的i.v.10mg/kg贝伐珠单抗组合。口服施用TMZ,始于150mg/m2剂量,可以扩大。然后继续贝伐珠单抗单一疗法(每3周15mg/kg)直至疾病进展。在疾病进展时,根据调查人员的斟酌治疗患者。
初始贝伐珠单抗输注在90分钟里,后续输注在60分钟里,然后在30分钟里,视耐受情况而定。在RT和TMZ治疗的最后一天,即TMZ治疗休息开始前那天施用贝伐珠单抗。
PFS分析基于使用脑MRI的肿瘤评估MacDonald响应标准(改良WHO标准)和Macdonald et al.,J.Clin.Oncol.8:1277-80,1990)记载的神经学评估。在基线时,在4周治疗休息结束时,然后每8周实施肿瘤评估。
研究群体–纳入标准
纳入年龄≥18岁且具有新诊断的幕上成胶质细胞瘤(GBM)(具有手术切除或活检后确立的组织诊断)的患者。这包括具有较低级星形细胞瘤的在先诊断且已经升级至组织学验证的GBM的未治疗的化疗和放疗患者。患者必须具有≤2的WHO性能状态。
研究群体–排除标准
术后脑MRI上最近出血的证据排除候选患者。然而,允许具有含铁血黄素的临床无症状存在,正在解决中的涉及手术的出血变化,和肿瘤中点状出血的存在的患者进入研究。先前为登入一项临床试验针对MGMT状态的集中筛选;用于成胶质细胞瘤和低级星形细胞瘤的任何在先化疗(包括含有卡莫司汀的华夫饼或免疫疗法(包括疫苗疗法);任何在先的对脑的放疗或在先的导致照射场潜在交叠的放疗;在先的高血压危象或高血压脑病的历史;随机化之前1个月内依照NCI-CTC标准的≥2级咳血的历史;出血素质或凝血病(在治疗性抗凝缺失下)的证据;随机化之前28天内的重大手术规程,开放式活检,颅内活检,脑室腹膜分流术或显著外伤性损伤;随机化之前7天内的芯活检(排除颅内活检)或其它微小手术规程也排除患者。中央血管通路装置(CVAD)的安置,如果在贝伐珠单抗/安慰剂施用之前2天内实施的话;随机化之前6个月内腹瘘或胃肠穿孔的历史;随机化之前6个月内颅内脓肿的历史;严重非愈合伤口,活动性溃疡,或未治疗的骨折也排除患者。就妊娠或哺乳女性而言,在研究治疗开始之前7天内或在14天内(在研究治疗开始之前7天内有确认性尿妊娠试验)评估血清妊娠试验。还排除生育女性(定义为最后一次月经后<2年且未手术绝育)和不使用高度有效的激素或非激素的避孕手段(即子宫内避孕装置)的男性;具有中风的历史或随机化之前≤6个月内短暂性缺血发作(TIA),随机化之前≤6个月内的控制不当的高血压(持续的收缩>150mmHg和/或舒张>100mmHg)或重大血管病(包括需要手术修复的主动脉瘤或最近的周围动脉血栓形成)的患者。还排除具有随机化之前≤6个月内的心肌梗死或不稳定心绞痛,纽约心脏协会(NYHA)II级或更高级充血性心力衰竭(CHF),或已知的对任何研究药物或赋形剂的超敏感性的患者。
实施例3:AvaGlio数据集中具有免疫系统作用的基因的无监督分析
为了研究免疫基因表达对于原发性GBM中贝伐珠单抗治疗的潜在预测价值,通过无监督分析将AvaGlio Nanostring数据中的潜在免疫相关基因细分成关联基因簇。基因注释是自Reactome数据库(Croft et al.Nucleic Acids Res.42(D1):D472-D477,2014;Croft.Methods Mol.Biol.1021:273-283,2013;和Milacic et al.Cancers.4(4):1180-1211,2012)和基因本体论(GO)数据库(Ashburner et al.Nature Genetics.25:25-29,2000)取得的,如由reactome.db(Ligtenberg W.R package version 1.48.0)和org.Hs.eg.db(Carlson M.R package version 2.14.0)Bioconductor(Fred Hutchinson Cancer Research Center)包提供的。
取得注释为GO生物学过程免疫应答(或它的子项任一)或Reactome途径免疫系统的所有1,792种独特人基因符号。在1,792种由Reactome和GO注释的基因中,AvaGlio Nanostring代码集含有193种鉴定为免疫基因的基因。
接下来,我们在AvaGlio数据集间检查193种带注释的免疫基因的表达。对于无监督分析(聚簇),将经过标准化的AvaGlio Nanostring数据集中并在生物标志物可评估的所有339份异柠檬酸脱氢酶1(IDH1)野生型样品间定标。为了鉴定在AvaGlio数据集间展示一致关联表达的基因小组,我们使用中心点周围分割(PAM)算法(Reynolds et al.Journal of Mathematical Modeling and Algorithms.5:475-504,1992)将该数据集分割成簇,返回15个簇。使用“共有聚簇”(Monti et al.Machine Learning.52:91-118,2003)获得了强健的基因小组,由此例如聚簇重复1,000次,每一次包括80%的可得样品和80%的可得基因的另一份随机样品。无监督分析将193种基因分组成15个簇(簇1-15),其成员在AvaGlio生物标志物数据集间显示一致表达(图1)。对于显现,使用Pearson相关性作为距离度量和用于聚簇的ward.D2方法通过分级聚簇对每个PAM簇内的基因排序。
实施例4:基因簇和预先定义的GBM亚型之间的相关性
AvaGlio样品先前已经依照Phillips et al.,Cancer Cell.9(3):157-173,2006分类入GBM亚型,将每份样品与四种标签之一关联:前神经,间充质,增殖性,或未分类。将样品依照Phillips亚型重排序揭示了许多基因簇的表达与一种或多种GBM亚型有关联(图1)。例如,簇4和5中的基因典型地在间充质样品中以更高水平表达,而簇2中的基因在前神经样品中显示最高水平的表达。
为了描述每个簇的表达,我们通过计算所有所含基因间的均值,为每个基因小组提供一个连续数值表达得分来总结表达(图2)。如上文概述的,15个基因簇中的许多的平均表达得分与一种或多种GBM亚型差异有关联(图2)。例如,来自簇1和15的基因在增殖性肿瘤中最高度表达;来自簇2的基因在前神经肿瘤中最高度表达;来自簇3的基因显示前神经肿瘤中的高表达和增殖性肿瘤中的中等表达;而来自簇4,5,7和13的基因在间充质肿瘤中最高度表达。
实施例5:AvaGlio研究中免疫基因簇对于贝伐珠单抗功效的预测价值
接下来,我们检查15个基因簇任一的均值表达是否预测在生物标志物可得的AvaGlio群体中的总体存活(OS)方面的贝伐珠单抗治疗效果。对于每个簇,拟合多变量Cox比例危害(CoxPH)模型,包括已知临床预后共变量(例如年龄,皮质类固醇,切除范围,性别,Karnofsky性能得分(KPS),O-6-甲基鸟嘌呤-DNA甲基转移酶(MGMT)启动子的甲基化状态,迷你精神状态检查得分(MMSE),递归分割分析(RPA)类别,和WHO性能得分)和对指派至该簇的基因观察到的平均基因表达二者。
如图3中所示,两个簇(簇2和簇6)的平均表达与显著的基因表达和处理分支之间相互作用的p值(p<0.05)有关联,指示这两个簇对于贝伐珠单抗治疗效果的预测价值。
实施例6:簇2基因在AvaGlio中与前神经Phillips亚型有关联且是预后性的和预测性的
簇2含有下述14种基因:AKT3,CDH1,CYP27B1,DNM3,DYNLL1,ERBB3,KLRK1,MBP,MDM2,NCAM1,PDGFRA,PRKCZ,SNCA,和TNFRSF21。虽然与免疫应答间接有关联,但是大多数这些基因不是免疫细胞特有的,而是参与例如用于许多不同生物学背景的信号传导途径。在簇2基因中,NCAM1在Nanostring代码集中可得的由Phillips et al.Cancer Cell.9(3):157-173,2006定义的32种分类器基因之中且代表前神经亚型的一种标志物。簇2基因中的两种,PRKCZ和DNM3,也通过Phillips分类得到鉴定,但是没有包括在分类器的最终列表中。另外,簇2基因中的四种,ERBB3,DNM3,KLRK1,和NCAM1,包括在由TCGA联盟(Verhaak et al.Cancer Cell.17(1):98-110,2010)定义的840种GBM亚型标志物中,而且所有四种基因定义为与前神经TCGA亚型有关联。
平均而言,簇2中的基因在前神经肿瘤中最高度表达(图4)。平均而言,图4还显示簇2基因展现间充质肿瘤中的低表达水平和增殖性肿瘤中的中等表达水平。
当将CoxPH模型拟合至完全生物标志物可得AvaGlio群体的总体存活(OS)时,簇2的平均基因表达显著地既是预后性的(p=0.0204)又是预测性的(p=0.0216)(图5)。比较而言,在每种Phillips GBM亚型内分开拟合相同CoxPH模型时没有检测到簇2基因表达的预测价值(图6-8)。最后,为了排除由于样本量缩小引起效力降低导致每种亚型内的预后或预测效果丧失,我们将一种模型拟合至分类为非前神经的样品(即,增殖性,间充质,和未分类样品)的组合集。再次,当排除前神经患者时没有检测到显著的预后及预测效果(图9)。
为了展示具有簇2中基因的高/低表达的患者的OS,我们将簇2基因的表达二元化,其中AvaGlio中值以上的患者认为是“生物标志物高”而AvaGlio中值以下的患者认为是“生物标志物低”。如通过图10A-10D中的Kaplan-Meier存活曲线所示,特别是,簇2基因的高表达(“生物标志物高”组)预测受益于将VEGF拮抗剂(例如贝伐珠单抗)添加至标准护理治疗(p=0.038)。
实施例7:簇6基因在AvaGlio中与间充质Phillips亚型有弱关联且是预后性的和预测性的
簇6含有下述13种基因:AXL,BCL2L1,CD36,ETS1,ICAM2,IL17A,IRS2,PDGFRB,RPL13A,TGFB1,TNFRSF4,TNFSF4,和ZBTB16。例如,它包括编码OX40/CD134(TNFRSF4)及其结合配偶,OX40L/CD252(TNFSF4)二者的基因,它们是在活化的CD4(+)和CD8(+)T细胞上以及在多种其它淋巴样和非淋巴样细胞上表达的肿瘤坏死因子受体/肿瘤坏死因子超家族的成员。OX40已知在维持免疫应答中具有关键作用。另外,簇6包括牵涉免疫监视的别的基因,诸如AXL受体酪氨酸激酶(先天免疫应答和凋亡细胞的吞噬清除的调节物)和ICAM2(它牵涉肿瘤发生期间的免疫监视)。簇6中还包括其产物牵涉编程性细胞死亡的基因,诸如CD36(血管发生的负调节物,它还参与凋亡细胞的内在化)和BCL2L1(凋亡的调节物)。这些基因无一包括在亚型签名中,也没有包括在由Phillips等人定义的扩充标志物集中,而且簇6中只有一种基因,IRS2,是作为如由TCGA联盟(Verhaak et al.Cancer Cell.17(1):98-110,2010)定义的经典GBM亚型的标志物被包括的。
平均而言,簇6中的基因在间充质肿瘤中最高度表达(图11)。平均而言,图11还显示簇6基因展现增殖性和前神经肿瘤中的更低表达水平。
当将CoxPH模型拟合至完全生物标志物可得AvaGlio群体的总体存活(OS)时,簇6的平均基因表达显著地既是预后性的(p=1.3x10-6)又是预测性的(p=0.0038)(图12)。比较而言,在每种Phillips GBM亚型内分开拟合相同CoxPH模型时没有检测到簇6基因表达的预测价值(图13-15)。最后,为了排除由于样本量缩小引起效力降低导致每种亚型内的预后或预测效果丧失,我们将一种模型拟合至分类为非前神经的样品(即,增殖性,间充质,和未分类样品)的组合集,如上文我们对簇2基因进行的。然而,与簇2基因相反,簇6基因在非前神经组内保持显著是预后性的(p=2.9x10-6)且预测性的(p=0.0064)(图16)。
为了展示具有簇6中基因的高/低表达的患者的OS,我们将簇6基因的表达二元化,其中AvaGlio中值以上的患者认为是“生物标志物高”而AvaGlio中值以下的患者认为是“生物标志物低”。如通过图17A-17D中的Kaplan-Meier存活曲线所示,特别是,簇6基因的低表达(“生物标志物低”组)预测受益于将VEGF拮抗剂(例如贝伐珠单抗)添加至标准护理治疗(p=0.044)。
虽然为了清楚理解的目的已经通过举例说明较为详细地描述了前述发明,但是说明书和实施例不应解释为限制本发明的范围。通过述及明确完整收录本文中引用的所有专利,专利申请,科学参考文献,和Genbank登录号的公开内容用于所有目的,就像通过述及具体和个别收录每一篇专利,专利申请,科学参考文献,和Genbank登录号。
序列表
<110> 基因泰克公司(Genentech, Inc.)
豪夫迈·罗氏有限公司(F. Hoffmann-La Roche AG)
<120> 诊断方法和用于治疗成胶质细胞瘤的组合物
<130> 50474-096WO2
<150> US 62/024,244
<151> 2014-07-14
<160> 2
<170> PatentIn version 3.5
<210> 1
<211> 108
<212> PRT
<213> 人工序列
<220>
<223> 合成的构建物
<400> 1
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Ser Ala Ser Gln Asp Ile Ser Asn Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Val Leu Ile
35 40 45
Tyr Phe Thr Ser Ser Leu His Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Ser Thr Val Pro Trp
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg
100 105
<210> 2
<211> 123
<212> PRT
<213> 人工序列
<220>
<223> 合成的构建物
<400> 2
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Tyr Thr Phe Thr Asn Tyr
20 25 30
Gly Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Gly Trp Ile Asn Thr Tyr Thr Gly Glu Pro Thr Tyr Ala Ala Asp Phe
50 55 60
Lys Arg Arg Phe Thr Phe Ser Leu Asp Thr Ser Lys Ser Thr Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Tyr Pro His Tyr Tyr Gly Ser Ser His Trp Tyr Phe Asp Val
100 105 110
Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
- 还没有人留言评论。精彩留言会获得点赞!