固体生物团的空间分子分布谱生成和分布谱储存的制作方法
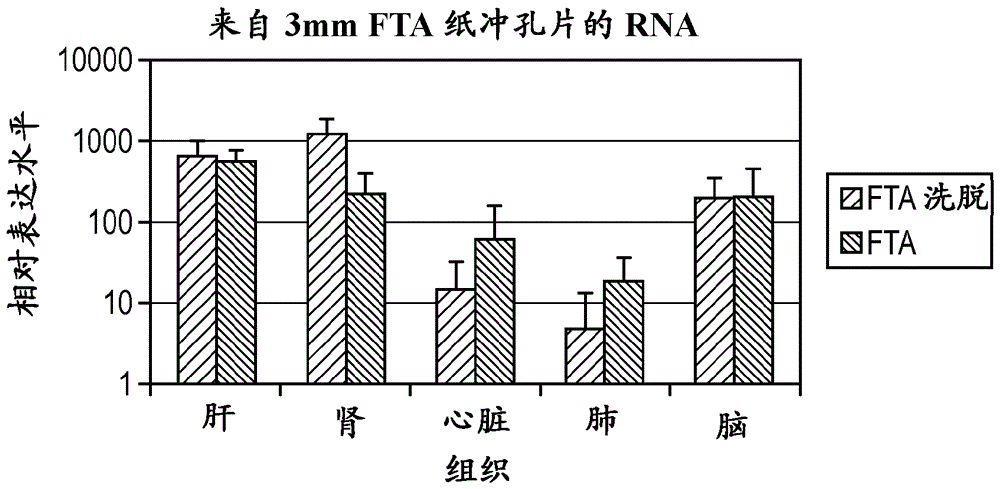
本发明涉及生物团(例如肿瘤)的离体空间分子分布谱生成和这样的分布谱的储存。发明背景本文中‘空间分子分布谱生成’指在分子或大分子水平上确定生物材料的组成。本文中大分子包括基因组、RNA表达、蛋白质组和酶信息。本发明人认为生物肿瘤以及其它生物团(例如细胞构造)的空间分子分布谱生成对于测定基因和蛋白质表达的模式是必要的,该基因和蛋白质表达模式导致表征不同的细胞类型(例如在实体肿瘤中)的生物变化,所述实体肿瘤例如但不限于乳腺癌、肺癌、前列腺癌和和结肠直肠癌。然而,由于肿瘤的固有的生物异质性,肿瘤的分子分布谱生成非常复杂。对于以‘空间-分子图’横跨肿瘤和周围的细胞外基质二者允许分析多个生物标记的技术的需求日益增加。在实施方案中,本发明将能够鉴定肿瘤区域-特异性基因表达和基因重排分布谱,和蛋白质表达分布谱,这将对肿瘤异质性提供重要的信息并且将促进治疗和临床决定,预后预测和基础肿瘤生物学研究。恶性肿瘤的分子分布谱生成对于测定适当的肿瘤-特异性治疗方案和预测预后是必要的。特别重要的是分析表征侵袭性肿瘤的分子标记物,因为非常常见的是,由癌症引起的死亡率不是由原发性肿瘤而是由在其它器官中产生的继发性肿瘤(转移)引起。这样的分子标记物包括涉及上皮至间充质过渡(EMT)的那些,其为导致非侵袭性上皮细胞获得更多间充质表型因此在其性质上变得越来越具有侵袭性的过程。目前,用于肿瘤的分子分布谱生成的方法包括由本体肿瘤样品表达大量基因的微观阵列分析,这可能昂贵并且耗时。由于肿瘤具有固有的生物异质性因此存在非常不同的基因表达分布谱(所述表达分布谱取决于取了本体样品的哪部分)的事实,分子分布谱生成进一步复杂化。当前,在临床和研究背景下,将本体肿瘤样品储存在福尔马林固定的石蜡嵌入的(FFPE)块中。该储存方法不被广泛采用,因为由这些块分离的核酸通常被降解并且比来自非固定的组织分离的核酸含有更多的PCR抑制剂。此外,储存大量样品所需的物理空间通常不可得。此外,由于二维(2D)肿瘤结构可能丧失,通常不能容易地分析横跨肿瘤的特异性基因表达模式。当试图分析侵袭的分子标记物(例如涉及EMT的那些)时,这尤其是有问题的,所述侵袭分子标志物主要仅在肿瘤的边缘或侵袭前缘差异性表达(KahlertC,LahesS等人,OverexpressionofZEB2attheinvasionfrontofcolorectalcancerisanindependentprognosticmarkerandregulatestumourinvasioninvitro(在结肠直肠癌的侵袭前缘处ZEB2的过表达为独立的预后标记物并且体外调节肿瘤侵袭)。Clin.CancerRes.2011;17,24:7654-7663.;UsamiY,SatakeS等人,Snail-associatedepithelial-mesenchymaltransitionpromotesoesophagealsquamouscellcarcinomamotilityandprogression(Snail-相关的上皮-间充质过渡促进食管鳞状细胞癌运动性和进展)。JPathol.2008;215,3,330-339.)。先前的研究检查使用以商品名FTA®销售的固体载体纸来收集和分离由结肠直肠肿瘤样品收集的DNA,用于基于实时PCR的KRAS测定(PetrasML,LeffertsJA等人,KRASdetectionincolonictumoursbyDNAextractionfromFTAPaper:Themoleculartouch-prep(通过从FTA纸提取DNA检测结肠肿瘤中的KRAS:分子接触-制备)。DiagnMolPathol.2011;20,4:189-193)。在将FTA纸直接施用于切割表面之前,通过肿瘤取切片,收集来自结肠肿瘤的DNA。对由这些样品和由匹配的FFPE块提取的DNA进行KRAS突变分析。结果证明在两种DNA收集方法之间100%关联,并且突显出使用纸载体成功地储存肿瘤样品用于将来核酸分离和下游分析的可行性。然而,仅分析了一个基因组突变,并且研究未实施二维肿瘤基因表达分布谱或考虑其它分析物,例如酶。鉴于该背景,需要高品质核酸、蛋白质和酶储存系统,其可能在‘库’等中储存一段时间后,能够询问2D肿瘤结构,从而允许进行在空间上相关的下游基因表达分析等。本发明人已认识到,需要肿瘤分子分布谱生成的方法和试剂盒,其将允许肿瘤细胞和其它生物标记物,例如mRNA和蛋白质,包括酶蛋白质从组织表面直接转移到合适的固体载体上,用于在其原始2D空间背景下储存,例如使用经清洁剂处理的纸,例如FTA,允许长期储存。当需要时,可随后从肿瘤印迹的纸载体的任何区域取样品(例如从纸打孔得到的样品),用于对于肿瘤的该区域特异的下游分子分析。本发明提供一种根据权利要求1的方法,其具有通过从属于权利要求1的权利要求所限定的优选的特征。本发明还提供通过权利要求限定的装置,其具有通过其从属的权利要求所限定的优选的特征。本发明延伸至试剂盒,所述试剂盒包括干燥的试剂组,例如呈容易可用的珠粒形式,其含有用以分析特异性基因表达信号的引物。所述方法将特别可用于鉴定与侵袭相关的基因的差异表达,其通常仅在肿瘤的侵袭性前缘处差异性表达,因此在本体肿瘤分析中鉴定不出。试剂盒可用于临床前肿瘤生物学研究和临床样品的分析二者。本发明延伸至使用未经处理的纸和基于下游蛋白质的测定的蛋白质表达分布谱生成,并且本公开先前还未在别的地方报道过。本发明将包括产品、方法和试剂盒权利要求。本发明延伸至本文公开的特征的任何组合,无论这样的组合是否在本文中明确提及了。此外,当两个或更多个特征组合提及时,在不扩展本发明的范围的情况下,意图可单独要求保护这样的特征。附图简述本发明可采用众多方式实施,下面参考附图来描述其说明性实施方案,其中:图1显示固定肿瘤横截面的托盘的平面图;图2显示包括在图1中显示的肿瘤的印迹的固体载体;图3显示在图1中显示的肿瘤的图像;图4显示扩增子的实验图像;和图5-12以图的形式显示实验数据。发明详述结合附图,通过参考以下描述,可以更好地理解本发明以及其目的和优点,其中在图中相同的参考数字识别相同的元件。参考图1,示意性显示了固定在夹具10中的癌性肿瘤的横截面T,在该实施方案中其为尺寸与以下描述的装置相容的托盘。横截面T为平躺在托盘10中的肿瘤的平行的切片。托盘10具有基底11,该基底包括直立钉12形式的固定工具,所述直立钉进而将肿瘤切片固定在适当的位置。在该说明中,在肿瘤20的外部区域(包括边缘部分22)的细胞类型用单阴影线描述,而在肿瘤的内部区域24的细胞类型表现为具有双阴影线。应认识到,肿瘤通常在具有复杂异质性的内部区域和边缘部分细胞类型之间具有限定不足或随机过渡,而不是如在图1中示意性说明的清楚的轮廓。参考图2,显示FTA®纸载体30,在其上紧贴在托盘10中安装(aFTA®papersupport30isshownontowhichfitssnuglyintothetray10)。图1的夹具10具有构造,即托盘侧面,用于引导载体30与横截面T接触。载体30可用衬里层或垫(不可见)支撑,其防止纸在使用时弯曲,但是允许纸干燥。载体具有在其上事先印刷的图案32,在此情况下呈带编号的格子的形式。载体30已装配在托盘中,并且用手在横截面10上轻压5秒或更多,以提供肿瘤10的倒转的印迹12。印迹将由在压制期间转移的少量但是可检测量的生物材料组成。在该实施方案中,FTA纸包括染料,例如酚红,当来自肿瘤的流体已润湿纸时,所述染料提供证明标记。参考图3,肿瘤横截面T已用苏木精和曙红染色,以更好地限定肿瘤的概念,随后拍照或以其他方式成像,以提供在图3中示意性显示的图像。在此情况下,在图像之上叠加格子图案32’,以提供与在载体30上印刷的格子图案32相同尺寸的图案。格子图案可简单地印在透明的纸上,并覆盖在横截面上,或者可根据已知的技术数字覆盖。为了方便,可倒转在图3中显示的图像以匹配印迹12。在使用中,实施以下步骤:1)在从患者或动物取出肿瘤后,通过干净地切割穿过肿瘤的横截面,病理学家或研究者将横切肿瘤。2)将横截面放置在托盘10中,并且将通过固定工具12固定在适当的位置。3)将载体30安装于衬里层,并且施用足够的压力,以暴露肿瘤的切割表面,确保横跨肿瘤完的充分接触达足够的时间段(至少5秒)。目视检查在纸上呈有色染料的证明标记将确保已发生充分转移。4)将允许纸干燥。5)任选,可采集横截面的图像,所述图像可能通过横截面的表面处理而增强。6)来自肿瘤印迹的DNA可随后在纸载体上以其初始空间背景储存达所需时间。7)可从肿瘤印迹的任何相关的区域取呈纸冲孔片形式的样品,特别是来自通常包括侵袭性前缘的边缘部分。样品可经历基因扩增技术,例如聚合物酶链反应(PCR)、逆转录酶PCR、实时定量PCR、等温扩增,或RNA表达测定,或基因重排测定,和/或其它测定,例如ELISA或酶测定,以鉴定某些蛋白质或酶的存在。在准备PCR时,可从冲孔片洗脱核酸,并加入到逆转录酶(RT)制剂,例如所述逆转录酶(RT)制剂以干燥的珠粒形式,与预定量的溶剂一起包含在试剂盒形式中。珠粒可含有在内含子/外显子边界处设计的PCR引物来分析在肿瘤的该区域中的基因表达。引物组包括,例如,可用在从肿瘤的边缘部分取的样品上的EMT标记物,例如E-钙粘着蛋白,Snail,Slug,Twist和ZEB-2。可从纸的任何区域取样,但是通过参考图像(图3)并且将来自图像的格子参比对照到纸上,可以更好地鉴定出边缘部分。本发明的实施方案提供:1)能保持肿瘤的二维‘空间图’的能力,使得可由充分限定的区域取样品。2)RTG珠粒,其含有适当的引物组用以分析在肿瘤的精确的区域可能存在的特异性基因信号(例如,侵袭性基因)。3)需要仅取少量的临床或研究肿瘤样品。4)易于在室温下长时间段储存核酸用于后来的下游分析。5)易于使用在以上步骤7)中提及的不同的测定。以下给出了支持性实验结果:实施例。DNA样品收集和储存将来自c57BL/6小鼠和NOS3失效小鼠(在129/B6背景中)的鼠科动物组织施用于由WhatmanInc销售的若干不同的固体载体培养基,包括FTA经典,标示和FTA洗脱微量卡。将小鼠安乐死,解剖以收集器官(血液、心脏、脑、肺、肝和肾)。将器官‘夹’在上述两层不同的FTA基质之间。经由无菌移液管施加压力以将组织埋置入各种化学涂布的纤维素基质中。对于组织匀浆,使用塑料dounce均化器,在1.5ml微量离心管中处理约5g组织,随后施用于适当的FTA基质。施用后,让所有样品空气干燥2小时,随后在具有干燥剂的密封的袋中储存。在一些情况下,在加工前将样品储存长达2个月。DNA纯化、基因型分型和定量Harris一次性微量冲孔器(直径1.2mm或3mm)用于以冲孔圆盘形式分别从FTA和FTA洗脱微量卡切下干燥的组织样品。从干燥的样品的中心切下样品圆盘,并且放置在干净的不含脱氧核糖核酸酶的1.5ml微量离心管中。为了从FTA和FTA洗脱卡提取基因组DNA,标准的纯化程序遵循制造商的使用说明。通过用内皮一氧化氮合酶(eNOS)外显子10-特异性正向引物(参见序列表1)、eNOSNeo-特异性正向引物(序列表2)和eNOS外显子12-特异性反向引物(参见序列表3)PCR扩增基因组DNA,鉴定NOS3失效或基因敲除的小鼠。使用MJResearch热循环仪器,使用初始10分钟变性步骤,接着36个循环的94℃下35秒,65℃下1分钟,和72℃下1分钟;接着72℃下5分钟的最终的延伸,扩增靶DNA。使用Experion毛细管电泳系统,使得到的PCR产物可视化。遵循制造商的使用说明,使用用于小鼠样品的引物设计基因组DNA定量试剂盒(gDNA-mo-q-DD)实现小鼠DNA定量。将单个野生类型(WT)和NOS失效组织样品单独施用于不同的FTA卡。在一些有限的情况下,产生含有KO和NOS失效肝组织样品二者的干燥的样品斑点。由该细胞混合物分离DNA,并且经历含有三种基因型分型引物(即,eNOS外显子10-特异性正向引物、eNOSNeo-特异性正向引物和eNOS外显子12-特异性反向引物)的组合的非优化的多路PCR。代表性凝胶示于图4a,其指示在单个PCR反应中同时扩增来自混合组织来源的两种产物。经由PCR分析的基因型区分为了举例说明能够由FTA基质上储存的DNA区分基因型变体,对WT和转基因(NOS3失效,基因敲除)小鼠进行区域的PCR扩增。图4b和表1(以下)显示分别由WT和NOS3失效基因敲除小鼠二者得到的DNA扩增产物。结果指示对于两种样品来源,由施用于FTA基质的所有器官/组织来源分离的DNA产生正确大小的DNA扩增子。对于FTA洗脱基质,呈现类似的结果(数据未显示)。这些数据指示1.2mmHarris微量冲孔器可从在FTA和FTA微量卡上储存的组织中切下足够的DNA,用以区分两种基因变体。在图4b中显示呈条带状的PCR扩增子,其与NOS基因座相关,使用由FTA卡的组织分离的DNA作为扩增模板。泳道1-5为从WT小鼠组织(分别为心脏、肝、脑、肺和肾)分离的DNA。泳道6-10为由NOS小鼠组织(分别为心脏、肝、脑、肺和肾)扩增的DNA。使用FTA洗脱和标示FTA(indicatingFTA)已发现相同的结果。表1在表1中,记录由在各种FTA纸上储存的组织分离的DNA的成功的扩增。由1.2mm冲孔片分离DNA。‘+’表示存在扩增子,ND代表未检测到。RNA纯化和定量如上所述将组织样品施用于FTA卡。切下FTA样品冲孔片,使用以下描述的GEHealthcareillustraRNAspin试剂盒分离RNA。利用在表2中详述的市售可得的mRNA定量试剂盒,在ABI7900实时PCR系统上实施RNA定量。使用Harris3mm一次性微量冲孔器,从干燥的样品斑点的中心切下冲孔片,并且放置在干净的不含核糖核酸酶的1.5ml微量离心管中。将illustra缓冲液RA1(350μl)与3.5μlβ-巯基乙醇混合,将溶液加入到圆盘中。使用20号针均化圆盘。将所得到的匀浆转移至RNAspinMini过滤柱用于随后去除残余的材料。将柱以11,000xg.离心1分钟,将RNAspinMini过滤器丢弃。均化的溶胞产物含有RNA,将该滤液转移至新的不含核糖核酸酶的1.5ml微量离心管中。将乙醇(70%;350μl)加入到均化的溶胞产物中,通过涡旋2x5秒脉冲而混合。对于每一个制备液,将溶胞产物用移液器上下吹吸2-3次,并且施用于放置在2ml微量离心管中的RNAMini-spin柱。将管以8000xg离心30秒,将流通液丢弃。将RNA自旋柱转移至新的收集管。加入illustraMDB缓冲液(350μl),将管以11,000xg离心1分钟。再一次将流通液丢弃,将柱放回收集管。根据制造商的使用说明制备脱氧核糖核酸酶反应混合物,并且加入到包含在RNAspin柱内的过滤器的表面。在室温下实施该脱氧核糖核酸酶孵育达15分钟。将洗涤缓冲液RA2(200μl)施用于RNAMini-spin柱,将柱以11000xg离心1分钟。再一次将流通液丢弃,将柱放回收集管。将缓冲液RA3600μl施用于RNAMini-spin柱,将柱以11000xg离心1分钟,将流通液丢弃,将柱放回收集管。再进行使用缓冲液RA3(250μl)的附加柱洗涤。为了完全使膜干燥,将柱以11000xg离心2分钟,将柱最终放置在不含核酸酶的1.5ml微量离心管中。将不含核糖核酸酶的水(40μl)施用于柱,将柱以11000xg离心1分钟。纯化的RNA立即用于下游应用或在-80℃下储存直至使用。为了测定在延长储存后来自多个组织的RNA的完整性,对由在FTA和FTA洗脱(FTAelute)上储存的小鼠组织样品分离的RNA进行实时逆转录聚合酶链反应(RT-PCR)。在干燥剂存在下,将卡储存2个月。根据制造商的使用说明,使用i)ABITaqman啮齿动物GAPDH对照试剂盒(部分#4308313),ii)用于鼠科动物HPRT、GAPDH和β-Actin基因的Invitrogen实时LUXmRNA引物组(目录号分别为105M-02、100M-02和101M-02)或iii)来自AppliedBio-systems的组织特异性基因引物组(详情参见表2),完成mRNA定量。表2.用于相对RNA定量而测试的组织特异性基因。目录号基因器官特异性Mm00475834_m1碱性磷酸酯酶肝、骨、肾Mm01266402_m1髓磷脂碱性蛋白质脑Mm01313844_mHMyh6光滑组织(心脏、肺)Mm00437306_m1VEGF肺图5显示使用ABITaqman啮齿动物GAPDH对照试剂盒,来自若干组织来源的GADPH的相对表达水平。通过与由小鼠RNA标准样品的定量滴定曲线产生的已知值比较,测定由FTA卡得到的RNA水平。由两种类型的纸分离的RNA,检测到可比的GAPDHRNA水平。这指示FTA和FTA洗脱纸基质二者为适合用于短期至中期储存来自组织的RNA的固体载体基质。从FTA和FTA洗脱的单个3mm冲孔片分离由C57Bl/6小鼠得到的组织的鼠科动物RNA。使用illustraRNAMini-spin试剂盒纯化RNA。使用适当的Invitrogen实时LUX引物组进行编码HPRT、GAPDH和β-Actin的鼠科动物mRNA的绝对定量。通过与由小鼠RNA标准样品的定量滴定曲线产生的已知值比较,测定由FTA卡得到的RNA水平。与从FTA卡的RNA分离相关的数据在图6中描述,并且证明FTA卡能支持来自众多组织类型的RNA的储存。对于在FTA洗脱上储存的RNA,类似的观察是显然的。为了研究在FTA和FTA洗脱存档的组织样品中的mRNA水平,使用实时组织特异性RT-PCR探针测定在表2中描述的mRNA的相对表达水平(参见图7)。GAPDHmRNA转录产物用于标准化在各样品中的总RNA水平。另外的对照涉及已施用于FTA卡的均化的组织和使用由illustraRNAMini-spin试剂盒得到的新分离的RNA。结果显示与其它mRNA相比升高的mRNA水平:在肾中碱性磷酸酯酶;在脑中髓磷脂碱性蛋白质;在心脏和肺中Myh6信息;和来自肺组织来源的升高的VEGFmRNA水平。该趋势是显然的,与样品类型无关,所述样品类型即,直接在FTA上储存的组织、在储存前均化的组织或新分离的RNA。这些数据与预测的表达模式和来自这些组织来源的这些mRNA的水平一致。这些数据证明FTA和FTA洗脱二者能从所有组织来源保存mRNA水平,与样品类型无关,即,基于卡的形式或新鲜形式。使用由固体载体制备的基因靶分析来自肿瘤的RNA二维(2D)肿瘤制图可用于分析肿瘤侵袭的分子标记物,例如在上皮至间充质过渡(EMT)中涉及的那些分子标记物,其主要存在于肿瘤的边缘。以下表3描述可用于测定肿瘤的侵袭的适当的基因标记物的实例。表3在上表中提供的参考:Horak,C.E.,J.H.Lee等人(2007)。"Nm23-Hlsuppressestumorcellmotilitybydown-regulatingthelysophosphatidicacidreceptorEDG2(通过下调溶血磷脂酸受体EDG2,Nm23-Hl抑制肿瘤细胞活动性)"CancerRes67(15):7238-7246。Bloomston,M.,A.Shafii等人(2002).“TIMP-1overexpressioninpancreaticcancerattenuatestumorgrowth,decreasesimplantationandmetastasis,andinhibitsangiogenesis(在胰腺癌中TIMP-1过表达减弱肿瘤生长,降低移植和转移,并抑制血管生成)”JSurgRes102(1):39-44。Zhang,L.,L.Zhao等人(2010)“Inhibitionoftumorgrowthandinductionofapoptosisinprostatecancercelllinesbyoverexpressionoftissueinhibitorofmatrixmetalloproteinase-3(通过基质金属蛋白酶-3的组织抑制物的过表达,在前列腺癌细胞系中诱导凋亡和抑制肿瘤生长)”CancerGeneTher.17(3):171-9。CanoA,Perez-MorenoMA,RodrigoI等人(2000)。“Thetranscriptionfactorsnailcontrolsepithelial-mesenchymaltransitionsbyrepressingE-cadherinexpression(通过阻遏E-钙粘着蛋白表达,转录因子snail控制上皮-间充质过渡)”NatCellBiol2:76-83。BolosV,PeinadoH,Perez-MorenoMA等人(2003).“ThetranscriptionfactorSlugrepressesE-cadherinexpressionandinducesepithelialtomesenchymaltransitions:acomparisonwithSnailandE47repressors(转录因子Slug阻遏E-钙粘着蛋白表达和诱导上皮至间充质过渡:与Snail和E47阻遏物的比较)”JCellSci116:499-511。ComijnJ,BerxG,VermassenP等人(2001)“Thetwo-handedEboxbindingzincfingerproteinSIP1downregulatesEcadherinandinducesinvasion(两手性E箱结合锌指蛋白质SIP1下调E钙粘着蛋白并诱导侵袭)”MolCell7:1267-78。EgerA,AignerK,SondereggerS等人(2005)“DEF1isatranscriptionalrepressorofE-cadherinandregulatesepithelialplasticityinbreastcancercells(DEF1为E-钙粘着蛋白的转录阻遏物并在乳腺癌细胞中调节上皮可塑性)”Oncogene24:2375-85。YangJ,ManiSA,DonaherJL等人(2004)“Twist,amasterregulatorofmorphogenesis,playsanessentialroleintumormetastasis(Twist,形态发生的主要调节物,在肿瘤转移中起到本质的作用)”Cell117:927-39。HazanRB,QiaoR,KerenR,BadanoI,SuyamaK(2004)“Cadherinswitchintumorprogression(钙粘着蛋白转换肿瘤进展)”AnnNYAcadSci1014:155-63。来自转移至固体载体的细胞或酶的酶检测根据制造商的使用说明,使用完全配置的脱氧核糖核酸酶和核糖核酸酶污染试剂盒(DNase&RNaseAlertQCSystems,目录编码AM1970&AM1966,LifeTechnologies)进行蛋白质和酶测试。在第一系列实验中,将0.125-0.5U的脱氧核糖核酸酶以10µl体积施用于由WhatmanInc销售的903商标纸和FTA纸。按以下描述测量脱氧核糖核酸酶和核糖核酸酶活性。在第二系列实验中,从106人胚胎干细胞(GEHealthcare;细胞系参考:WCB307GEHC28)中取1.2mm冲孔片,所述人胚胎干细胞按以上所述以10µl体积施用于FTA纸和903纸。按以下描述测量脱氧核糖核酸酶和核糖核酸酶活性。在第三系列实验中,从106人胚胎干细胞(GEHealthcare;细胞系参考:WCB307GEHC28)中取1.2mm冲孔片,所述人胚胎干细胞已以10µl体积施用于FTA纸和903纸,所述人胚胎干细胞含有加入到这些细胞中的0.5U的脱氧核糖核酸酶或10µU的核糖核酸酶。使用可裂解的荧光标记的脱氧核糖核酸酶底物如下进行脱氧核糖核酸酶活性检测。将各冲孔片投入96孔板的单独的孔中。将冻干的DNaseAlert底物溶解于TE缓冲液(1ml)中,并且分配(10µl)入96孔板的测试孔中。加入10×DNaseAlert缓冲液(10µl)和不含核酸酶的水(80µl),将测试溶液(100µl)在37℃下孵育60分钟。DNaseAlertQCSystem底物为当被脱氧核糖核酸酶裂解时发出粉色荧光的经修饰的DNA低聚核苷酸。对于该测定,在TecanUltra(使用中等增大率(mediumgain)的激发/发射535/595nm)上测量荧光。含有脱氧核糖核酸酶活性的溶液产生粉色荧光,而不具有脱氧核糖核酸酶活性的溶液不发荧光。因此,较高水平的脱氧核糖核酸酶相应于光输出的量的增加。负对照由代替样品的不含核酸酶的水(80µl)组成。使用903或FTA纸,以速率依赖性方式,可检测和定量脱氧核糖核酸酶活性。图8和9说明使用以上刚刚提及的方法,在FTA纸和903纸上储存的样品的相对荧光。使用可裂解的荧光标记的核糖核酸酶底物如下进行核糖核酸酶检测。将各冲孔片投入96孔板的单独的孔中。将冻干的RNaseAlert底物溶解于TE缓冲液(1ml)中,并且在96孔板的测试孔中分配(10µl)。加入10×RNaseAlert缓冲液(10µl)和不含核酸酶的水(80µl),将测试溶液(100µl)在37℃下孵育60分钟。RNaseAlertQCSystem底物为当通过核糖核酸酶裂解时发出绿色荧光的经修饰的RNA低聚核苷酸。对于该测定,在TecanUltra(使用中等增大率的激发/发射485/535nm)上测量荧光。含有核糖核酸酶的溶液产生绿色荧光,而不具有核糖核酸酶活性的溶液不发荧光。因此,较高水平的核糖核酸酶相应于光输出的量的增加。负对照由代替样品的不含核酸酶的水(80µl)组成。使用903纸或FTA纸,以速率依赖性方式,可检测和定量核糖核酸酶活性。图10和11说明使用以上刚刚提及的方法,在FTA纸和903纸上储存的样品的相对荧光。检测施用于固体载体的模型蛋白质将重组体IL-2±载体(R&DSystems;分别地目录号202-IL-CF-10µg;批号AE4309112和目录号202-IL-10µg;批号AE4309081)以50pg或100pg/µl溶解于不含钙和镁的Dulbecco’sPBS(PAA;目录号H15-002,批号H00208-0673),EDTA-抗凝固人、兔、马血(TCSBiosciences)中。将等分试样(1µl,含有0.5(B)或100(A)pg的IL-2;(参见图12))施用于以下GEHealthcare滤纸;903NeonatalSTD卡,目录号10538069,批号6833909W082;DMPK-A卡,目录号WB129241,批号FT6847509;DMPK-B卡,目录号WB129242,批号FE6847609和DMPK-C卡,目录号WB129243,批号FE6847009。让样品在环境温度和湿度下干燥过夜。使用适当尺寸的HarrisUni-core冲孔器(Sigma,目录号Z708860-25ea,批号3110),从每一种类型的纸提取冲孔片(直径3mm)。将单一冲孔放置在由HumanIL-2QuantikineELISA得到的IL-2微孔板(R&DSystems,目录号D0250,批号273275)的单个孔中。将这些板涂布上针对IL-2的小鼠单克隆抗体。使用供应有Quantikine试剂盒的测定缓冲液(100µl)从纸冲孔片洗脱IL-2蛋白质。使用“纸中”方法,根据Quantikine试剂盒供应的使用说明实施所有随后的步骤(将纸冲孔片直接放置在测定缓冲液中,并且直接原位洗脱分析物)。在完成测定后,使用ThermoElectronCorporation,MultiskanAscent,监测在450nm下微孔板的光学密度。通过将各值与已知IL-2浓度的标准曲线相比较,测定IL-2的回收。对于每一个单个实验,制备新的IL-2标准曲线。对于样品A和B的每一个,模型蛋白质(白细胞间介素2IL-2)自DMPK-C卡的回收率在图12中说明。虽然已描述和说明了一种实施方案,但是对于技术受众(skilledaddressee)来说显而易见的是,在不偏离要求保护的本发明的范围情况下,对这些实施方案添加、省略和修改是有可能的。例如,虽然在图1、2和3中显示的具体实施例被描述为采用以FTA商标销售的固体载体30,但是以上显示的实验数据说明该技术可与其它固体载体一起使用,例如以下详述的。本文中FTA(包括FTA微量卡、FTA标示和FTA经典)为使用稳定化学物质(例如弱碱、螯合剂和阴离子表面活性剂)处理的纤维素纤维纸,从而用稳定化学物质浸渍载体表面。采用这种方式,生物样品材料可在装置上储存许多个月或甚至数年,从而允许在环境温度下将装置运送(如果需要)至实验室的时间,并且随后简单地通过溶解储存的样品和试剂,足够的回收是可能的。FTA洗脱在本文中描述类似的纸,但是其涂布有离液剂例如硫氰酸胍,以允许直接测定生物材料,而无需除去FTA纸采用的化学物质。本文中903描述未经涂布的纤维素纤维纸。有可能使用其它固体载体,例如玻璃纤维/微纤维材料或多孔聚合物,例如多孔膜材料,例如聚酯、聚醚砜(PES)、聚酰胺(尼龙)、聚丙烯、聚四氟乙烯(PTFE)、聚碳酸酯、硝酸纤维素、乙酸纤维素或氧化铝.上述固体载体旨在用于通常平面构造,但是在备选中,可例如用在辊上并且卷拢于肿瘤/团表面。此外,虽然具体实例指肿瘤横截面,但是根据相同的技术可进行其它生物团的分布谱生成。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1