合成核酸的方法和设备与流程
相关申请
本申请要求2014年10月27日提交的美国临时专利申请第62/069,067号和2014年8月18日提交的美国临时专利申请第62/038,604号的优先权及权益。每一以上申请的公开内容均以其全文引用的方式并入本文中。
本发明涉及合成具有所需序列的聚核苷酸(从头)且不需要模板的方法和设备。由此,本发明能够制造具有变化序列和变化长度的聚核苷酸文库以用于研究、基因工程以及基因疗法。
背景技术:
基因工程需要确定基因材料的含量的工具以及构筑所需基因材料的工具。确定基因材料的含量的工具使得可以在低于$1,000下在约一天内对整个人类基因组测序。(参见生命技术,新闻稿:benchtopionprotontm测序仪,2012年1月10日(lifetechnologies,pressrelease:benchtopionprotontmsequencer,january10,2012))。相反,构筑所需基因材料(例如从头dna合成)的工具并未同步改进。作为参照点,在过去的25年,小核酸从头合成的成本(每个碱)下降10倍,同时核酸测序的成本(每个碱)下降10,000,000倍以上。dna合成缺乏进展目前限制了转译基因组学的步伐,即,由此确定个别序列变异的作用并且用以改进治疗性治疗。
目前,大多数新生核酸序列使用30多年前研发的固相亚磷酰胺技术合成。所述技术涉及由与天然(或非天然)核酸碱基对应的亚磷酰胺试剂构建的序列的依序去保护和合成。亚磷酰胺核酸合成长度受限,然而,这是因为长度大于200个碱基对(bp)的核酸会历经高断裂率和副反应。另外,亚磷酰胺合成会产生有毒副产物,并且这一废弃物的处置限制核酸合成器的可用性,并且增加合同寡核苷酸制造成本。(估计每年对寡核苷酸合成的需要会造成大于300,000加仑的有害化学废弃物,包括乙腈、三氯乙酸、甲苯、四氢呋喃以及吡啶。参见勒普罗斯特(leproust)等人,核酸研究,第38(8)卷,第2522-2540页,(2010)(nucleicacidsres.,vol.38(8),p.2522-2540,(2010)),其以全文引用的方式并入本文中)。因此,需要更有效并且更具成本效益的寡核苷酸合成方法。
技术实现要素:
本发明提供改进的核酸合成方法。本发明方法提供更快并且更长的聚核苷酸从头合成。由此,本发明大大降低合成常规核酸的总成本。本发明方法是针对使用核苷酸基转移酶来并入未经修饰的3'羟基通过可裂解连接子与抑制因子偶联的核苷酸类似物而不依赖模板地合成聚核苷酸。由于存在抑制因子,合成因添加每一新的碱基而停顿,因此连接子发生裂解,从而分离抑制因子并且离开聚核苷酸,这与天然产生的核苷酸本质上相同(即,通过酶识别为进一步核苷酸并入的底物)。
本发明另外包括利用本发明方法产生定制聚核苷酸的设备。本发明的设备包括提供水性条件的一个或多个生物反应器和多个核苷酸类似物来源。生物反应器可以是例如储槽、流槽或多孔板。以固体支撑物起始,通过经由核苷酸基转移酶(例如末端脱氧核苷酸转移酶(tdt)或无模板指向使dna或rna链伸长的任何其它酶)的天然活性添加连续核苷酸使聚核苷酸生长于反应器中。在连接子裂解时,天然聚核苷酸暴露于固体支撑物上。一旦序列完整,支撑物就会裂解掉,留下聚核苷酸,其实质上相当于自然界中所见的聚核苷酸。在一些实施例中,将设备设计为通过在核苷酸添加之后回收溶液并且将溶液再用于子序列核苷酸添加来回收核苷酸类似物溶液。因此,产生较少废弃物,并且,与目前先进技术方法相比每个碱基的总成本降低。在某些实施例中,生物反应器可以包括微流体装置和/或使用喷墨印刷技术。
封端基团可以包括(例如)带电部分或空间抑制因子。一般来说,防止核苷酸基转移酶达成功能构形的大分子可以用以抑制寡核苷酸合成。此类大分子可以包括聚合物、多肽、类多肽以及纳米粒子。大分子应该足够大以从物理上阻止接近核苷酸基转移酶的活性位点,但又不会大到对反应动力产生不利改变。大分子可以使用多个连接分子连接到核苷酸类似物,如下所述。
在一些实施例中,寡核苷酸合成可以包括在每一核苷酸类似物添加之后,但在封端基团裂解之前将3'核酸外切酶引入到一个或多个合成的寡核苷酸中。封端基团可以阻止3'核酸外切酶作用于已成功添加未裂解核苷酸类似物的寡核苷酸,但通过3'核酸外切酶将去除尚未成功添加抑制因子的寡核苷酸。以这种方式,本发明使得能够进行制程质量控制并且可以消除对合成后纯化的需要。
本发明的其它方面将在考虑以下图式和具体实施方式后而为所属领域的技术人员所显而易知。
附图说明
图1a展示在n-4位连接有可裂解终止子的一种脱氧胞苷三磷酸(dctp)类似物;
图1b展示来自图1a的dctp类似物的可裂解终止子的裂解,以获得“天然”dctp和环状离去分子;
图2a展示在n-6位连接有可裂解终止子的一种脱氧腺苷三磷酸(datp)类似物;
图2b展示来自图2a的datp类似物的可裂解终止子的裂解,以获得“天然”datp和环状离去分子;
图3a展示在n-2位连接有可裂解终止子的一种脱氧鸟苷三磷酸(dgtp)类似物;
图3b展示来自图3a的dgtp类似物的可裂解终止子的裂解,以获得“天然”dgtp和环状离去分子;
图4a展示在n-3位连接有可裂解终止子的一种脱氧胸苷三磷酸(dttp)类似物;
图4b展示来自图4a的dttp类似物的可裂解终止子的裂解,以获得“天然”dttp和环状离去分子;
图5a展示在n-3位连接有可裂解终止子的一种脱氧尿苷三磷酸(dutp)类似物;
图5b展示来自图5a的dutp类似物的可裂解终止子的裂解,以获得“天然”dutp和环状离去分子;
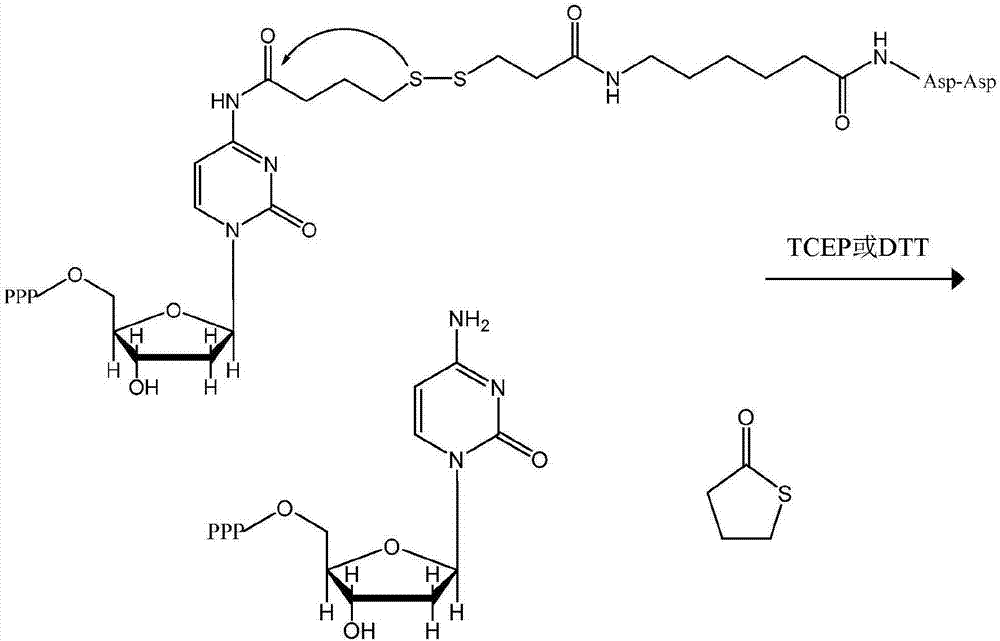
图6展示例示性脱氧胞苷三磷酸(dctp)类似物,其具有使封阻asp-asp分子连接到脱氧胞苷的n-4位的施陶丁格(staudinger)连接子并且随后在水性条件下使施陶丁格连接子裂解以获得dctp和离去基;
图7a展示在n-4位连接有可裂解终止子的一种胞嘧啶核苷三磷酸(rctp)类似物;
图7b展示来自图7a的rctp类似物的可裂解终止子裂解以获得“天然”rctp和环状离去分子;
图8a展示在n-6位连接有可裂解终止子的一种腺苷三磷酸(ratp)类似物;
图8b展示来自图8a的ratp类似物的可裂解终止子裂解以获得“天然”ratp和环状离去分子;
图9a展示在n-2位连接有可裂解终止子的一种鸟苷三磷酸(rgtp)类似物;
图9b展示来自图9a的rgtp类似物的可裂解终止子裂解以获得“天然”rgtp和环状离去分子;
图10a展示在n-3位连接有可裂解终止子的一种胸苷三磷酸(rttp)类似物;
图10b展示来自图10a的rttp类似物的可裂解终止子裂解以获得“天然”rttp和环状离去分子;
图11a展示在n-3位连接有可裂解终止子的一种尿苷三磷酸(rutp)类似物;
图11b展示来自图11a的rutp类似物的可裂解终止子裂解以获得rutp和环状离去分子;
图12展示例示性胞嘧啶核苷三磷酸(rctp)类似物,其具有使封阻asp-asp分子连接到胞嘧啶核苷的n-4位的施陶丁格连接子并且随后在水性条件下使施陶丁格连接子裂解以获得rctp和离去基;
图13展示例示性末端脱氧核苷酸转移酶(tdt)介导的聚核苷酸合成循环,其包括:(a)并入包含可裂解终止子的核苷三磷酸类似物dn*tp-oh,(b)移除封端封阻基团(由*所示),因此使得下一个dn*tp-oh并入,其中n=a、g、c或t;
图14展示具有包含可变数目的亚甲基桥的可裂解连接子的例示性核苷酸类似物;
图15展示具有包含半胱氨酸残基的可裂解连接子的例示性核苷酸类似物;
图16a展示具有包含单个磷酸基的阴离子抑制因子的例示性核苷酸类似物;
图16b展示具有包含两个磷酸酯基的阴离子抑制因子的例示性核苷酸类似物;
图16c展示具有包含三个磷酸酯基的阴离子抑制因子的例示性核苷酸类似物;
图17展示例示性微流体聚核苷酸合成装置;
图18展示适用于本发明中的例示性类多肽抑制因子;
图19展示描述3'核酸外切酶消化寡核苷酸的用途的流程图,该等寡核苷酸在寡核苷酸合成循环之间并未适当封端。
具体实施方式
本发明提供改进的使用酶和核苷酸类似物合成如dna和rna的聚核苷酸的方法。使用所公开的方法,特定聚核苷酸序列可以在水性环境中在不使用核酸模板下从头一个碱基接一个碱基地合成。另外,因为核苷酸类似物具有未经修饰的3'羟基,即如“天然”脱氧核糖和核糖分子中所见,所以该等类似物在从碱基去除抑制因子,在本文中也称为经由可裂解连接子连接的终止子或终止基团时产生“天然”核苷酸。还可以使用其它核苷酸类似物,其例如包括自消除连接子或具有经修饰磷酸基的核苷酸。在大多数情况下,封阻基团经设计不会留下大量其它分子,即经设计以留下通过酶识别为“天然”核苷酸的“无瘢痕”核苷酸。因此,在合成结束时,在去除最后一个封阻基团时,合成的聚核苷酸从化学性和结构上相当于具有相同序列的天然产生的聚核苷酸。因此,可以将合成聚核苷酸并入到生命系统中,不用担心合成的聚核苷酸会干扰生物化学途径或代谢。
本发明的方法和类似物可以用于有用寡核苷酸和寡脱氧核苷酸,尤其长寡核苷酸(<5000nt)的非模板化酶促合成。视所用起始因子而定,产物可以是单链或部分双链的。长寡核苷酸的合成需要高效并入和高效可逆终止子去除。结合于固体支撑物的起始因子由短单链dna序列组成,该短单链dna序列是一小段用户定义的序列或自其去除用户定义的单链产物的通用起始因子。
一方面,所公开的方法采用可商购的核苷酸转移酶(如末端脱氧核苷酸转移酶(tdt))以逐步方式自核苷酸类似物合成聚核苷酸。核苷酸类似物具有以下形式:
ntp-连接子-抑制因子
其中ntp是核苷三磷酸(即dntp或rntp),连接子是碱基的吡啶或嘧啶之间的可裂解连接子,并且抑制因子是阻止酶并入随后核苷酸的基团。在每一步,将新的核苷酸类似物并入到生长聚核苷酸链中,因此通过抑制因子基团阻止酶添加其它核苷酸。一旦酶停止,可以从生长链去除过量核苷酸类似物,可以从ntp裂解抑制因子,并且可以引入新的核苷酸类似物以将下一个核苷酸添加到链中。通过依序重复该等步骤,有可能快速构造所需长度和序列的核苷酸序列。聚核苷酸合成使用核苷酸转移酶的优势包括:1)在不依赖模板的聚合中使用单链(ss)引发引子的3'-延伸活性,2)能以高度有效的方式延伸引子致使添加数千个核苷酸,和3)接受多种经修饰和经取代的ntp作为有效底物。此外,本发明可以利用作为核苷酸转移酶的底物的起始因子序列。起始因子连接到固体支撑物并且充当酶的结合位点。起始因子优选地是酶的通用起始因子,如均聚物序列,并且可在固体支撑物上再循环,形成的寡核苷酸可从起始因子裂解。
本发明方法非常适合于目前使用合成核酸,例如亚磷酰胺合成的dna寡核苷酸的多种应用。举例来说,由本发明方法合成的聚核苷酸可以用作核酸扩增的引子、侦测特定标记的杂交探针并且用于并入到质粒中进行基因工程改造。然而,因为所公开的方法以更快的速率并且在水性环境中产生更长的合成核苷酸串,所以所公开的方法又适于高产量应用,如在细胞分析中针对遗传变异的表达进行筛选,以及合成生物学。此外,本发明方法将提供下一代应用所需的功能性,如使用dna作为合成读/写存储器,或产生完全(或部分)从dna合成的宏观物质。
本发明和本文所述的系统提供包括脱氧核糖核酸(dna)和核糖核酸(rna)的聚核苷酸的合成。尽管如dna和rna的“天然”核苷酸的合成途径已描述于例如腺嘌呤(a)、鸟嘌呤(g)、胞嘧啶(c)、胸腺嘧啶(t)以及尿嘧啶(u)的常见核酸碱基的情况下,但应了解本发明方法可以用于所谓的“非天然”核苷酸,包括并入有通用碱基的核苷酸,如3-硝基吡咯2'-deoxynucloside和5-硝基吲哚2'-deoxynucleoside、α硫代磷酸酯、硫代磷酸酯核苷三磷酸,或具有其它所需特性(如萤光)的嘌呤或嘧啶结合物。嘌呤和嘧啶碱基的其它实例包括吡唑并[3,4-d]嘧啶、5-甲基胞嘧啶(5-me-c)、5-羟基甲基胞嘧啶、黄嘌呤、次黄嘌呤、2-氨基腺嘌呤、腺嘌呤和鸟嘌呤的6-甲基和其它烷基衍生物、腺嘌呤和鸟嘌呤的2-丙基和其它烷基衍生物、2-硫尿嘧啶、2-thiothymine和2-thiocytosine、5-丙炔基尿嘧啶和胞嘧啶、6-偶氮基尿嘧啶、胞嘧啶和胸腺嘧啶、5-尿嘧啶(假尿嘧啶)、4-硫尿嘧啶、8-卤基(例如8-溴)、8-氨基、8-巯基、8-硫代烷基、8-羟基和其它8-取代腺嘌呤和鸟嘌呤、5-卤基、尤其5-溴、5-三氟甲基和其它5-取代的尿嘧啶和胞嘧啶;7-甲基鸟嘌呤和7-甲基腺嘌呤、8-氮杂鸟嘌呤和8-氮杂腺嘌呤、脱氮鸟嘌呤、7-脱氮鸟嘌呤、3-脱氮鸟嘌呤、脱氮腺嘌呤、7-脱氮腺嘌呤、3-脱氮腺嘌呤、吡唑并[3,4-d]嘧啶、咪唑[1,5-a]1,3,5三嗪酮、9-脱氮嘌呤、咪唑并[4,5-d]吡嗪、噻唑并[4,5-d]嘧啶、吡嗪-2-酮、1,2,4-三嗪、哒嗪;和1,3,5三嗪。在一些情况下,可以用于产生具有无反应但大致等效碱基的核苷酸序列,即碱基不与其它蛋白质(即转录酶)反应,因此使序列信息的影响与碱基的结构效果分离。
类似物
本发明提供具有式ntp-连接子-抑制因子的核苷酸类似物以在水性环境中合成聚核苷酸。关于式ntp-连接子-抑制因子的类似物,ntp可以是任何核苷三磷酸,如腺苷三磷酸(atp)、鸟苷三磷酸(gtp)、胞嘧啶核苷三磷酸(ctp)、胸苷三磷酸(ttp)、尿苷三磷酸(utp)、核苷三磷酸酯、脱氧腺苷三磷酸(datp)、脱氧鸟苷三磷酸(dgtp)、脱氧胞苷三磷酸(dctp)、脱氧胸苷三磷酸(dttp)或脱氧尿苷三磷酸(dutp)。
接子可以是使抑制因子连接到ntp的任何分子部分,并且可以发生裂解。举例来说,连接子可以通过调节周围环境的ph值来裂解。连接子还可以通过在既定温度下活化但在另一温度下失活的酶来裂解。在一些实施例中,连接子包括二硫键。
连接子可以例如包括可光裂解、亲核或亲电子裂解位点。裂解由特定波长的光激活的可光裂解连接子可以包括以安息香、硝基藜芦基、苯甲酰甲基、特戊酰基、(三甲基硅烷基)硅烷基(sisyl)、2-羟基-桂皮基、香豆素-4-基甲基或2-硝基苯甲基为主的连接子。
亲核裂解位点的实例包括氟离子可裂解硅氧键或酯,其可以在碱性溶液中发生裂解。亲电子裂解连接子可以包括酸诱发的裂解位点,其可包含三苯甲基、叔丁氧基羰基、缩醛基团以及对烷氧基苯甲基酯和酰胺。在某些方面,可裂解连接子可以包括如图15中所示的半胱氨酸残基。
连接子可以例如在下胞嘧啶的n4、胸腺嘧啶的n3或o4、鸟嘌呤的n2或n3以及腺嘌呤的n6、或尿嘧啶的n3或o4处连接,这是因为碳处的连接导致在去除聚合酶抑制基团之后存在残余瘢痕。连接子典型地是约至少约10埃长,例如至少约20埃长,例如至少约25埃长,因此使抑制因子离吡啶或嘧啶足够远以使酶将ntp经由所连接的糖主链结合到聚核苷酸链。在一些实施例中,可裂解连接子自环化,因为其形成对生长核苷酸链尤其无反应性的环分子。
在某些方面,可裂解连接子可以在二硫键的ntp或抑制因子侧包括可变数目的亚甲基桥,包含例如1、2、3或4个如图14和16a-c中所示的亚甲基桥。这些亚甲基桥可以用于增加ntp与抑制因子之间的空间。如上文所示,可以选择可裂解连接子的长度以防止抑制因子干扰ntp与合成的聚核苷酸的偶联。在本发明的一些实施例中,带电基团与ntp的距离在抑制后续核苷酸并入的效力中起重要作用。
举例来说,在一些实施例中,使用带电部分作为抑制因子,该带电部分可以与ntp相距约5到约60个键。在一些其它实施例中,抑制因子的带电部分可以与ntp相距约10到约40个键。在一些其它实施例中,抑制因子的带电部分可以与ntp相距约10到约35个键。在一些其它实施例中,抑制因子的带电部分可以与ntp相距约10到约30个键。在一些其它实施例中,抑制因子的带电部分可以与ntp相距约10到约20个键。带电部分与ntp之间的键的数目可以通过包括其它亚甲基桥来增加。
核苷酸类似物可以包括抑制通过酶使随后的核苷酸发生偶联的连接到ntp的任何部分。抑制基团可以是带电基团,如带电荷氨基酸,或抑制基团可以是视环境条件而定带电的基团。在一些实施例中,抑制因子可以包括带负电或能够带负电的部分。举例来说,抑制因子可以如图16a-c中所示包括一连串的磷酸酯基(例如1、2或3个磷酸酯),其中其它磷酸酯基会增加抑制因子的总阴离子电荷。在其它实施例中,抑制因子基团带正电或能够带正电。在一些其它实施例中,抑制因子是氨基酸或氨基酸类似物。抑制因子可以是具有2到20个氨基酸单元的肽或类似物、具有2到10个氨基酸单元的肽或类似物、具有3到7个氨基酸单元的肽或类似物、具有3到5个氨基酸单元的肽或类似物。在一些实施例中,抑制因子包括选自由以下组成的群组的基团:glu、asp、arg、his和lys以及其组合(例如arg、arg-arg、asp、asp-asp、asp、glu、glu-glu、asp-glu-asp、asp-asp-glu或aspaspaspasp等)。肽或基团可以是相同或不同氨基酸或类似物的组合。在某些实施例中,肽抑制因子可以发生乙酰化以阻止游离氨基错误键结。抑制基团还可以包括与酶活性位点中的残基反应的基团,因此干扰通过酶使随后的核苷酸发生偶联。抑制因子可以具有选自由以下组成的群的带电基团:-coo、-no2、-po4、-po3、-so2或-nr3,其中每一r可以是h或烷基。在其它实施例中,抑制因子部分并不包含-po4基团。
在某些方面,终止子或抑制因子可以包括空间抑制因子基团。此类空间抑制因子基团可以使得ntp-连接子-抑制因子(即,核苷酸类似物)并入寡核苷酸的未封端3'oh上,该并入通过核苷酸基转移酶催化。空间抑制因子基团可以从物理上阻止核苷酸或其它核苷酸类似物并入并入的核苷酸类似物的未封端3'oh上。空间抑制因子也可以阻止3'核酸内切酶作用于核苷酸类似物,并且因此,作用于并入有未裂解核苷酸类似物的寡核苷酸。
空间抑制因子可以包括例如化学聚合物、纳米粒子、经多n取代的甘氨酸(类肽)或蛋白。本发明的空间抑制因子可以是多种尺寸,包括例如大于
在某些方面,可以使用自组装类多肽序列作为空间抑制因子。类肽单体通常基于经n取代的甘氨酸主链。因为主链不含氢键供体,所以类多肽容易进行处理,同时仍能够形成二级结构,如螺旋。其还提供与肽类似的允许极性和侧链的有益特性,同时是通常化学和热稳定的。根据本发明的自组装类多肽空间抑制因子可以将单个类肽螺旋自组装以形成直径在微米范围内的微球体,包括0.3μm、0.4pm、0.5pm、0.6pm、0.7pm、0.8pm、0.9pm、1.0μm、1.5μm、2μm、2.5μm、3μm或3.5μm等等。在某些方面,空间抑制因子可以包括具有c-α-分支侧链、n-芳基侧链、n-1-萘基乙基侧链或能够形成稳定螺旋结构的其它形式的类肽。类肽空间抑制因子的实例示于图18中。图18图示分支聚-n-甲氧基乙基甘氨酸,其可以用作根据本发明的空间抑制因子。在某些实施例中,空间抑制因子可以包括容易连接到连接基团,例如如本文所述的可裂解键联基团的反应性基团。
在其它实施例中,空间抑制因子可以包含聚合物,如生物兼容性聚合物。聚合物可以包含不同聚合物的嵌段,以使得该等嵌段形成所需宏观结构,例如当暴露于水性环境时形成球体。举例来说,共聚物可以包含亲水性和疏水性嵌段的嵌段,以使得聚合物在添加到水中时自组装成胶束结构。在一些实施例中,疏水性嵌段可以选自聚己内酯(pcf)、聚二甲基硅氧烷(pdms)、聚甲基丙烯酸甲酯(pmma)或聚乳酸交酯(pfa)。亲水性嵌段可以包括聚乙二醇(peg)或其它多元醇。
在其它实施例中,抑制因子可以包含足够尺寸的纳米粒子以阻断核苷酸基转移酶的活性。此类纳米粒子可以包含例如金、银、硅、氧化铈、氧化铁、二氧化钛、氮化硅、硼化硅或二氧化硅,例如介孔性二氧化硅。在其它实施例中,纳米粒子可以包含高度有序的分子结构,如富勒烯(fullerene),例如巴克球和纳米管(包含碳),或半导体。
空间抑制因子可以不带电或可以带正电或带负电,以提供与其所连接的核苷酸和核苷酸基转移酶的兼容性,以使得抑制因子不干扰ntp类似物5'端上的并入反应。空间抑制因子可以併入多个氨基酸残基以提供所需构形、电荷或连接位点。
ntp-连接子-抑制因子型核苷酸类似物的实例示于图1a中。图1a中的类似物包括经由二硫(-s-s-)键连接到dctp的n4位同时在糖环上提供为封阻未经修饰的3'-oh的抑制性(-asp-asp-)基团。连接子经构建以使得所有连接子原子(包括第2并入抑制部分)均可以去除,由此使初生dna链恢复到天然核苷酸。如图1b中所示,还原剂水溶液,如三(2-羧乙基)膦(tcep)或二硫苏糖醇(dtt)可以用以裂解-s-s-键,从而致使抑制因子功能(解封)损失。如图1b中所示,可以并入自环化连接子,产生在核苷酸合成结束时容易从试剂溶液去除的环状氧化四氢噻吩离去基。
下文流程1a和1b中展示合成图1a的dctp类似物的例示性流程:
流程1a
流程1b
以与流程1a和1b类似的方式,ntp-连接子-抑制因子型核苷酸类似物还可以由将连接子-抑制因子部分连接到腺嘌呤的n6(图2)、鸟嘌呤的n2(图3)、胸腺嘧啶的n3(图4)或尿嘧啶的n3(图5)来形成,由此提供“天然产生的”dntp的类似物以及脱氧尿嘧啶核苷酸(dutp)。尽管不大可能广泛使用dutp,但根据化学方法合成是简单的。
本发明不限于流程1a和1b的连接化学,然而,还可以使用胺基甲酸酯、酰胺或其它自消除键联。举例来说,如流程2中所示,核苷酸还可以由施陶丁格连接子来制备。
流程2
由asp-asp封阻基团的施陶丁格连接子(流程2)产生的脱氧胞苷三磷酸(dctp)类似物示于图6中。如图6中所示,施陶丁格dctp类似物在水性条件下由添加叠氮化物和三苯基膦经历裂解。图6中所示的施陶丁格类似物还适用于如上文所述和图1-5中所例示的使用核苷酸转移酶(如tdt)进行核苷酸延伸。尽管图中未明确展示,但所属领域的技术人员可以视完整从头核苷酸合成所需用流程2以及适合的反应物产生具有施陶丁格连接子的其它核苷酸类似物。以与图6类似的方式,流程2的核苷酸类似物可以由将施陶丁格部分连接到腺嘌呤的n6、鸟嘌呤的n2、胸腺嘧啶的n3或尿嘧啶的n3来形成,由此提供“天然产生”dntp的类似物以及脱氧尿嘧啶核苷酸(dutp)。
流程1a的方法可以用以通过以适当核糖核苷酸反应物为起始物质产生例如如图7-10中所示的对应核糖核苷酸类似物。包含施陶丁格连接子的核糖核苷酸类似物还可以使用流程2产生,以形成所需核糖核苷酸类似物,包括例如如图12中所示的ctp类似物。此外,所有核糖核苷酸类似物,即c、a、t、g、u均可以使用与流程2类似的反应物形成。
酶
本发明方法采用核苷酸转移酶将核苷酸类似物组合到聚核苷酸中。核苷酸转移酶包括若干相关转移酶和聚合酶家族。一些核苷酸转移酶会使脱氧核糖核苷酸比核糖核苷酸更高效地聚合,一些核苷酸转移酶使核糖核苷酸比脱氧核糖核苷酸更高效地聚合,并且一些核苷酸基转移酶使核糖核苷酸和脱氧核糖核苷酸以大致相同的速率聚合。
本发明特别重要的是,具有聚合酶活性的转移酶,如末端脱氧核苷酸转移酶(tdt)能够催化脱氧核糖核苷酸到核苷酸链的3^端的添加,由此使dna核苷酸中的链长逐渐增加。tdt仅催化1-2个核糖核苷酸向dna链的生长端的添加,其可适用于位点特异性dna-rna嵌合聚核苷酸的构筑。具体来说,来源于经工程改造大肠杆菌的小牛胸腺tdt适合用于本发明并且购自商业来源,如赛默科技(thermoscientific)(宾夕法尼亚州匹兹堡(pittsburgh,pa))。与小牛tdt对应的氨基酸序列以seqidno.1列举于表1中。
表1.牛tdt的氨基酸序列
与小牛tdt对应的核苷酸序列以seqidno.2列举于表2中。
表2.牛tdt的核酸序列
尽管市售tdt适用于本发明方法,但本发明方法可以使用例如氨基酸序列与seqidno.1至少95%一致,例如氨基酸序列与seqidno.1至少98%一致,例如氨基酸序列与seqidno.1至少99%一致的经修饰的tdt。表达适合的核苷酸转移酶的生物体可以包含与seqidno.2至少95%一致,例如与seqidno.2至少98%一致,例如与seqidno.2至少99%一致的核酸序列。在一些情况下,经修饰的tdt将更有效地产生聚核苷酸,或更好地控制链长。tdt的其它变体可以改变酶的释放特征,由此降低对如tcep或dtt的还原剂水溶液的需要。
对于rna聚核苷酸的合成,如大肠杆菌聚(a)聚合酶的核苷酸转移酶可以用以催化核糖核苷酸向核糖核苷酸起始因子的3'端的添加。在其它实施例中,大肠杆菌聚(u)聚合酶可以更适用于本发明方法。大肠杆菌聚(a)聚合酶与大肠杆菌聚(u)聚合酶皆可购自新英格兰生物实验室(newenglandbiolabs)(马萨诸塞州伊普斯威奇(ipswich,ma))。这些酶类可与未经3'封阻的可逆终止子核糖核苷酸三磷酸酯(rntps)一起使用以合成rna。在某些实施例中,rna可以使用3'封阻、2'封阻或2'-3'封阻的rntp和聚(u)聚合酶或聚(a)聚合酶合成。下文再现大肠杆菌聚(a)聚合酶和大肠杆菌聚(u)聚合酶的氨基酸和核苷酸序列。经修饰的大肠杆菌聚(a)聚合酶大肠杆菌大肠杆菌聚(u)聚合酶可以适用于本发明方法。举例来说,氨基酸序列与seqidno.3至少95%一致,例如氨基酸序列与seqidno.3至少98%一致,例如氨基酸序列与seqidno.3至少99%一致的酶可以用于本发明方法。表达适合的酶的生物体可以包含与seqidno.4至少95%一致,例如与seqidno.4至少98%一致,例如与seqidno.4至少99%一致的核酸序列。举例来说,氨基酸序列与seqidno.5至少95%一致,例如氨基酸序列与seqidno.5至少98%一致,例如氨基酸序列与seqidno.5至少99%一致的酶可以用于本发明方法。表达适合的核苷酸转移酶的生物体可以包含与seqidno.6至少95%一致,例如与seqidno.6至少98%一致,例如与seqidno.6至少99%一致的核酸序列。
表3:大肠杆菌聚(a)聚合酶的氨基酸序列
与大肠杆菌聚(a)聚合酶对应的核苷酸序列以seqidno.4列举于表4中。
表4:大肠杆菌聚(a)聚合酶的核苷酸序列
表5:大肠杆菌聚(u)聚合酶的氨基酸序列
与大肠杆菌聚(u)聚合酶对应的核苷酸序列以seqidno.6列举于表6中。
表6:大肠杆菌聚(a)聚合酶的核苷酸序列
如上文所论述,与核苷酸类似物偶联的抑制因子将使例如tdt的转移酶不从聚核苷酸释放或防止其它类似物并入到生长链中。带电部分会产生较好的抑制作用,然而,研究表明抑制因子的特定化学性质并非尤其重要。举例来说,可以使用磷酸与酸性肽抑制酶活性。参见例如鲍尔斯等人,性质方法,第6卷,(2009)第593-95页(bowersetal,naturemethods,vol.6,(2009)p.593-95)和美国专利第8,071,755号,两文献皆以全文引用的方式并入本文中。在一些实施例中,抑制因子将包括单一胺基酸或二肽,如-(asp)2,然而部分上的尺寸和电荷可以视需要根据以实验方式确定的第一核苷酸并入和第二核苷酸并入的速率来调节。也就是说,其它实施例可以使用更多或不同的带电氨基酸或其它生物相容性带电分子。
可以使用其它核苷酸合成方法以不依赖模板的方式使用核苷酸转移酶或经修饰的核苷酸转移酶从头建构寡核苷酸。在一个实施例中,聚合酶/转移酶可以经修饰以使得其在遭遇3'-未经修饰的dntp类似物的磷酸修饰时中止核苷酸添加。这一流程需要修饰核苷酸类似物的磷酸末端的解封试剂/反应,由此空出初生链以进行随后的核苷酸并入。这一方法的优选实施例将使用仅磷酸(α、β或γ)经修饰的核苷酸类似物,但允许对核苷酸的嘌呤/嘧啶碱基进行修饰。
在一些实施例中,可能有利的是使用3'核酸外切酶以在后续核苷酸类似物添加之前去并未经抑制因子适当封端的除寡核苷酸。具体来说,核苷酸类似物的抑制因子可以经选择以抑制核苷酸基转移酶和3'核酸外切酶的活性,以使得建立仅适当终止的寡核苷酸。使用这一质量控制技术,将改进所得寡核苷酸序列的纯度。在一些实施例中,使用此类质量控制措施测量可以抵消对合成后纯化的需要。这一技术示意性地表示于图19中,其中3'核酸外切酶是在洗涤步骤之后引入以去除过量核苷酸类似物并且是在连接子裂解之前引入。如图19中所示,此类清洁步骤将降低长度和/或序列不合需要的寡核苷酸的数目。
使用不依赖模板的聚合酶/转移酶的另一实施例将使用蛋白质工程改造或蛋白质进化来修饰酶以在每一单核苷酸并入之后保持紧紧地结合于初生链且不与其反应,因此防止任何随后的并入,直到此类通过使用释放试剂/条件使聚合酶/转移酶从链释放的时间。将选择此类修饰以允许使用天然未经修饰的dntp代替可逆终止子dntp。释放试剂可为高盐缓冲剂、变性剂等。释放条件可为高温、搅拌等。举例来说,tdt的环1和sd1区的突变已展示会使活性由不依赖模板的活性显著改变为更具与模板相关的活性。所关注的特定突变包括(但不限于)δ3384/391/392、del环1(386→398)、f398a、d339a、f401a以及q402k403c404→e402r403s404。实现并入后紧密结合tdt酶的目的的其它方式可以包括引起结合起始因子链的三个磷酸(包括(但不限于)k261、r432和r454)的残基的突变。
使用不依赖模板的聚合酶/转移酶的另一实施例将为使用蛋白质工程改造或蛋白质进化来修饰酶以高效地接受3-封阻可逆终止子。大多数天然存在的聚合酶/转移酶并不并入有3'-封阻可逆终止子,这是因为酶的活性位点中的空间限制。在与上述完全类似的方法中,修饰酶活性位点中的单一或若干aa残基可以极有效地将3'-封阻可逆终止子并入到结合起始因子的支撑物中。在并入之后,用解封试剂/条件去除3'-可逆终止子,由此产生完全天然(无瘢痕)单链分子准备用于随后的受控延伸反应。有残基接近输入dntp的3'-oh,这解释了tdt并入核糖核苷三磷酸与去氧核糖核苷三磷酸酯一样容易的倾向;残基,包括(但不限于)β1与β2之间的那些残基、尤其r334,环1以及a13与a14之间的那些残基、尤其r454,很可能是突变诱发以容纳大量3'-可逆终止子基团并且允许其有效并入的标靶。在某些实施例中,可能需要其它氨基酸变化以补偿这些适应3'可逆终止子的残基改变。使用与模板有关的聚合酶的另一实施例将是使用多个引子-模板对连接到固体支撑物的经3'封阻或未经3'封阻的dntp类似物,其中该模板是支撑由使用者所指定的四个碱基中的任一者的聚合酶介导的引子延伸的核酸类似物。
使用不依赖模板的聚合酶/转移酶的另一实施例可以使用蛋白质工程改造或蛋白质进化来修饰酶以按类似特定方式优化四种不同核苷酸或甚至不同经修饰核苷酸类似物中的每一者的用途。核苷酸特异性或核苷酸类似物特异性酶变体可以经过工程改造而具有所需生物化学属性,如降低的km或提升的添加速率,由此将进一步降低合成所需聚核苷酸的成本。
固体状态合成
本发明方法可以在多种反应条件下实施,然而,在大多数情况下所需聚核苷酸的有序构建和回收需要可以生长聚核苷酸的固体支撑物。在一些实施例中,该等方法包括在固体支撑物上酶促介导地合成聚核苷酸。当与上文所论述的ntp、连接子以及抑制因子类似物结合使用时,有可能通过在水性环境中使用例如tdt或聚(a)聚合酶构筑dna以及rna的特异性多核苷酸序列。如图13中所示,tdt可以用以通过以逐步方式延伸聚核苷酸序列实现定制聚核苷酸的逐步构筑。如先前所论述,每一ntp类似物的抑制因子基团使酶因添加核苷酸而停止。在每一核苷酸延伸步骤之后,从固体支撑物洗掉反应物,之后通过使连接子裂解而去除抑制因子,并且接着添加新的反应物,从而使循环重新开始。
在某些实施例中,可并入其它质量控制,其中在核苷酸基转移酶介导的核苷酸类似物延伸步骤之后并且在抑制因子裂解之前使寡核苷酸或多核苷酸序列暴露于3'核酸外切酶。3'核酸外切酶可以降解具有未封端3'oh的寡核苷酸或聚核苷酸链。在某些方面,未裂解抑制因子(例如空间抑制因子)可以从物理上阻止3'核酸外切酶使已成功地并入有未裂解核苷酸类似物的链降解。此类质量控制步骤可以仅降解不成功地并入有所需核苷酸类似物的寡核苷酸或聚核苷酸,由此消除成品合成序列中的任何错误,从而可能去除对合成后序列校验的需要。在3'核酸外切酶暴露之后,酶可以在继续抑制因子裂解步骤之前洗掉。
3'核酸外切酶可以通过缩短或完全降解尚未成功添加所需核苷酸类似物的链来起作用。指定环处未能酶促延伸的链在连接子裂解步骤之前将不具有末端大分子-dnmp结合物。如果在这一阶段引入3'-核酸外切酶,那么可以保护全长链以免降解,“失效”链的长度将缩短或可能完全降解成单核苷酸磷酸。长(>500个碱基)合成dna的产量视每个和各个循环处出现的高度有效的反应而定;酶促延伸与解封/自消除步骤必须以接近的定量产量出现。如果延伸功效小于定量(即,存在不延伸并且因此具有天然未修饰的末端核苷酸的链),那么在酶促延伸步骤之后但在大分子终止子裂解步骤之前引入3'-核酸外切酶将对初生链纯度产生正面影响。
*相反,如果解封/消除步骤小于定量,那么3'-核酸外切酶步骤将对合成的质量无影响,因为那些链仍经大分子终止子保护并且在接下来的延伸步骤期间未能延伸。因此可以仅从实验上测定添加3'-核酸外切酶步骤下合成质量的实际改进,且接着评估是否值得额外的成本和循环时间。因为长odn的大部分成本由现有胺基磷酸酯造成,所以方法涉及合成后
在n个延伸-去除-解封-洗涤周期结束时,成品全长、单股聚核苷酸完整并且可以从固体支撑物裂解并回收,以随后用于如dna定序或pcr的应用中。或者,成品全长、单股聚核苷酸可以保持连接到固体支撑物,以随后用于如杂交分析、蛋白质或dna亲和力捕获的应用中。在其它实施例中,部分双链的dna可以作用起始因子,致使双链聚核苷酸合成。
适用于本发明方法的固体支撑物可以包括玻璃和二氧化硅支撑物,包括珠粒、载片、栓钉或孔。在一些实施例中,支撑物可以系栓到另一结构,如聚合物孔板或移液管尖端。在一些实施例中,固体支撑物可以具有额外磁特性,因此允许使用磁体操控或从某一位置去除支撑物。在其它实施例中,固体支撑物可以是涂有二氧化硅的聚合物,由此使得形成适于自动加工的多种结构形状。
合成器
为利用所公开的方法的有效性,可以构建水相dna合成器以大量产生所需聚核苷酸。在一个实施例中,合成器将包括四个孔的所述ntp类似物试剂,即dctp、datp、dgtp以及dttp,以及浓度足以实现聚核苷酸生长的tdt。可以将多个起始序列连接到固体支撑物,所述固体支撑物经设计以例如使用实验室机器人反复浸渍到四个孔中的每一者中。可对机器人另外编程以在核苷酸添加之间用洗涤缓冲剂冲洗固体支撑物,通过使支撑物暴露于解封剂而使键联基团裂解,以及第二次洗涤固体支撑物,之后将固体支撑物移到下一所需核苷酸的孔。经简单编程,有可能在大约几小时内产生有用量的所需核苷酸序列,并且充分减少有害废弃物。在小心控制的条件下进行合成将使得合成长度是数千碱基对的聚核苷酸。完成时,延伸产物从固体支撑物释放出,由此其可以用作成品核苷酸序列。
高度平行的实施例可由96或384孔格式中栓钉上的一系列起始因子-固体支撑物组成,该等栓钉可以个别回缩或降低以使得可以控制方式指引栓钉以接触孔中的液体。因此,合成器可由可随机定址的栓钉装置、四个与栓钉装置(96或384空格)相同格式的酶-dntp类似物储槽、与栓钉装置(96或384空格)相同格式的额外试剂储槽(清洗、解封等)以及以用户可编程控制但随机存取的方式将栓钉装置从一个储槽移动到另一个的输送机构(例如实验室机器人)组成。必须小心以避免四个酶-dntp储槽中的每一者受到污染,因为内含物在整个合成过程中会重复使用以降低每一次聚核苷酸合成的成本。
在替代实施例中,试剂(例如核苷酸类似物、酶、缓冲剂)将在固体支撑物之间移动,从而使得回收试剂。举例来说,具有储槽和泵的系统可以使四种不同核苷酸类似物溶液、洗涤缓冲剂和/或还原剂溶液在一个或多个将形成寡核苷酸的反应器之间移动。反应器和泵可以是常规的,或装置可以使用微流体构筑。因为该方法的非无水(水性)性质,所以所用硬件的设计中不需要特别小心地消除暴露于水。合成方法可以进行,仅采取措施以控制蒸发损失。高度平行的实施例可以由96或384孔格式中的栓钉上的单片一系列起始因子-固体支撑物组成,其可以接合相同匹配格式的一系列孔。每一孔实际上为一通过具有适当阀门的四个酶-dntp类似物储槽和额外试剂储槽(清洗、解封等)馈料的反应室。流体学逻辑将限制在每一延伸反应之后以原始方式回收酶-dntp反应物,这是因为其在整个合成过程中会重复使用以降低每一次聚核苷酸合成的成本。在其它实施例中,移液尖端的系统可以用以添加和去除试剂。
在某些方面,聚核苷酸可以使用微流体装置和/或喷墨印刷技术合成。例示性微流体聚核苷酸合成装置示于图17中以达到说明性目的并且并非按比例。包括调节器257的微流体通道255将储槽253偶联到反应腔室251,并且包括调节器257的出口通道259可以从反应腔室251中抽出废弃物。用于聚核苷酸合成的微流体装置可以包括(例如)通道255、储槽253和/或调节器257。聚核苷酸合成可以出现在微流体反应腔室251中,该微流体反应腔室可以包括多种锚定的合成核苷酸起始因子,并且可以包括锚定或结合到反应腔室的内表面并且能够可释放地结合ntp类似物或聚核苷酸起始因子的珠粒或其它底物。反应腔室251可以包括至少一个进口和一个出口通道259,以使得可以向反应腔室251中添加并且去除试剂。微流体装置可以包括用于每一相应ntp类似物的储槽253。这些ntp类似物储槽253中的每一者还可以包括适当量的tdt或无模板方指向使dna或rna链伸长的任何其它酶。其它储槽253可以含有用于连接子/抑制因子裂解和洗涤的试剂。这些储槽253可以经由独立通道255偶联到反应腔室251,并且经由每一通道255进入反应腔室251中的试剂流可以经由使用闸极、阀门、压力调节器或其它手段个别地调节。可以类似地调节经由出口通道259从反应腔室251中的流出。
在某些例子中,可以回收试剂,尤其ntp类似物酶试剂。试剂可以经由同一通道255从反应腔室251抽吸回其相应储槽253中,其通过使用闸极、阀门、压力调节器或其它手段诱导反向流而穿过该通道。或者,试剂可以经由独立回流通道从反应腔室251中返回到其相应储槽253。微流体装置可以包括能够操作上文所述的闸极、阀门、压力或其它调节器257的控制器。
例示性微流体聚核苷酸合成反应可以包括使所需酶-ntp类似物试剂流入反应腔室251中;在设定时间量之后,经由出口通道259或返回通道从反应腔室251中去除酶-ntp类似物试剂;使洗涤试剂流回反应腔室251中;经由出口通道259从反应腔室251中去除洗涤试剂;使解封或裂解试剂流入反应腔室251中;经由出口通道259或返回通道从反应腔室251中去除解封或裂解试剂;使洗涤试剂流入反应腔室251中;经由出口通道259从反应腔室251中去除洗涤试剂;使待合成的所需序列中包括下一ntp的酶-ntp类似物试剂流入反应腔室251中;并且重复直到合成所需聚核苷酸。在所需聚核苷酸已合成之后,其可以从反应腔室锚定物或底物中释放并且经由出口通道259或其它手段收集。
在某些方面,包括ntp类似物、tdt和/或其它酶类的试剂和化合物和用于连接子/抑制因子裂解和/或洗涤的试剂可以使用喷墨印刷技术或压电按需滴墨(dod)喷墨印刷技术沉积于反应腔室中。可以使用喷墨印刷技术形成小液滴,其可以经由空气沉积于反应腔室中。试剂小液滴的体积可以为皮升到纳升等级。可以使用包括1hz、10hz、100hz、1khz、2khz以及2.5khz的多个频率的喷墨印刷技术引入液滴。可以将多种试剂储存于喷墨印刷装置内的独立储槽中,并且喷墨印刷装置可以将多种试剂的小液滴递送到多个离散位置,包括例如不同反应腔室或晶片内的孔。在某些实施例中,可以将喷墨和微流体技术组合,其中某些试剂和化合物经由喷墨印刷技术递送到反应腔室中,而其他试剂和化合物经由微流体通道或管递送。喷墨印刷装置可以通过包含耦接到处理器的至少一非瞬时性实体存储器的计算装置来控制。计算装置可以经操作以接收来自包括例如触摸屏、鼠标或键盘的输入装置的输入,并且控制喷墨印刷装置沉积试剂小液滴的时间和位置、沉积的试剂和/或沉积的试剂的量。
在某些实例中,可以经由输入装置将所需多核苷酸序列输入到计算装置中,其中该计算装置经操作以进行必要反应以通过以如上文所述的适当次序相继沉积适当ntp类似物、酶、裂解试剂以及洗涤试剂产生所需多核苷酸序列。
在合成之后,释放的延伸产物可以通过高分辨率page分析以确定与对照相比起始因子是否已延伸预期碱基数。还可以对一部分回收的合成dna测序以确定合成的聚核苷酸是否具有预期序列。
因为合成器相对简单并且不需要亚磷酰胺合成所需的有毒组分,所以本发明的合成器可广泛用于研究机构、生物技术公司和医院。另外,能重复使用/回收试剂将减少废弃物产生并且有助于降低消耗品成本。本发明人预计该等方法和系统将适用于许多应用,如dna测序、pcr以及合成生物学。
以引用的方式并入
贯穿本发明已经参考且引用了其它文献,如专利、专利申请、专利公开案、期刊、书籍、论文、网络内容。所有此类文档在此以全文引用的方式并入本文中用于所有目的。
等效物
除本文展示且描述的之外,所属领域的技术人员将从本文献的完整内容对本发明的各种修改及许多其它实施例显而易见,包含对在本文中引用的科学和专利文献的参考。本文中的标的物含有重要信息、范例和指南,其可适于本发明在其各种实施例和其等效物中的实践。
- 还没有人留言评论。精彩留言会获得点赞!