细胞或组织的冷冻保存用夹具及冷冻保存方法与流程
本发明涉及冷冻保存细胞或组织等时使用的冷冻保存用夹具、以及使用了该冷冻保存用夹具的冷冻保存方法。
背景技术:
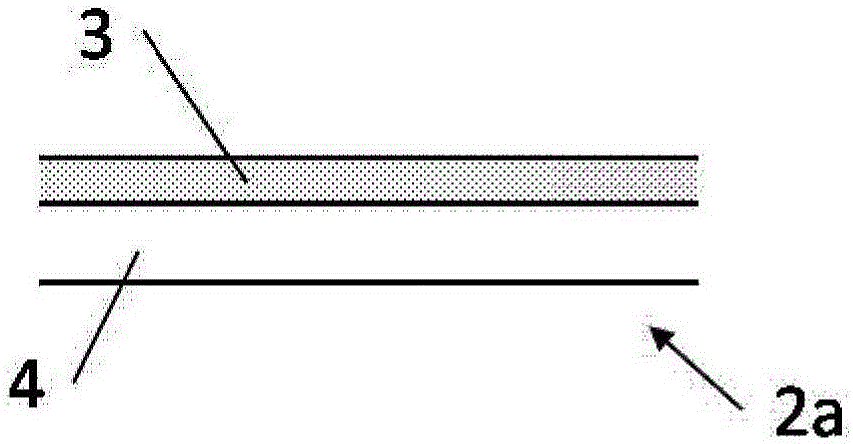
:在各种各样的产业领域中需要细胞或组织的优异的保存技术。例如在牛的胚胎移植技术中,将胚胎冷冻保存,配合受胎牛的发情周期地将胚胎融解而进行移植。另外,在人的不孕治疗中,在从母体采集卵子或卵巢后,为了配合适于移植的时机而冷冻保存,在移植时融解使用。一般而言,从活体内采集的细胞或组织即使是在培养液中,也会逐渐失去活性,因此在活体外的细胞或组织的长期培养是不可取的。为此,用于不丧失生物活性地长期保存的技术是重要的。借助优异的保存技术,可以更加准确地分析所采集的细胞或组织。另外,借助优异的保存技术,可以在保持更高的生物活性的状态下将细胞或组织用于移植,有望提高移植后的成活率。此外,也可以依次生产保存在活体外培养的培养皮肤和在活体外构筑的所谓细胞片之类的移植用的人工组织,在必要时使用,不仅是在医疗方面,在产业方面也可以期待很大的优势。作为细胞或组织的保存方法,例如已知有缓慢冷冻法。在该方法中,首先,在通过使例如磷酸缓冲生理盐水等生理溶液中含有冷冻保护剂而得的保存液中浸渍细胞或组织。作为该冷冻保护剂,使用甘油、乙二醇等化合物。将细胞或组织浸渍在该保存液中后,通过以比较慢的冷却速度(例如0.3~0.5℃/分钟的速度)冷却至-30~-35℃,而将细胞内外或组织内外的溶液充分冷却,粘度变高。在此种状态下,如果将该保存液中的细胞或组织进一步冷却至液氮的温度(-196℃),则细胞内或组织内以及其外面的周围的少许溶液均会在保持非晶的状态下发生变为固体的玻璃化。可以认为,当由于玻璃化而使细胞内外或组织内外固化时,分子的运动就会真正消失,因此通过将经过玻璃化的细胞或组织在液氮中保存,可以半永久地保存。然而,在所述缓慢冷冻法中,由于需要以比较慢的冷却速度冷却,因此在用于冷冻保存的操作中需要时间。另外,还存在有需要用于进行温度控制的装置或夹具的问题。此外,在所述缓慢冷冻法中,由于在细胞外或组织外的保存液中形成冰晶,因此细胞或组织有可能遭受该冰晶造成的物理性损害。作为用于解决所述缓慢冷冻法中的问题的方法,提出过玻璃化保存法。所谓玻璃化保存法是利用了如下原理的方法,即,由于大量含有甘油、乙二醇、DMSO(二甲亚砜)等冷冻保护剂的水溶液的凝固点降低,使得即使在冰点下也难以形成冰晶。当使该水溶液在液氮中急速冷却时,就可以在不产生冰晶的状态下直接固体化。将这样的固体化称作玻璃化冷冻。另外,将大量含有冷冻保护剂的水溶液称作玻璃化液。作为所述玻璃化法的具体操作,是在玻璃化液中浸渍细胞或组织,其后,在液氮的温度(-196℃)进行冷却。由于玻璃化法是此种简便且迅速的工序,因此具有如下的优点,即,在用于冷冻保存的操作中不需要很长时间,此外,不需要用于温度控制的装置或夹具。如果使用玻璃化保存法,则细胞内外均不产生冰晶,因此可以避免冷冻时和融解时对细胞的物理性伤害(冻害),然而玻璃化液中含有的高浓度的冷冻保护剂具有化学性毒性。因此,在细胞或组织的冷冻保存时,优选存在于细胞或组织周围的玻璃化液少,且优选细胞暴露于玻璃化液中的时间、也就是冷冻之前的时间短。此外,解冻后需要立即将玻璃化液稀释。关于使用玻璃化保存法的细胞或组织的冷冻保存,给出过利用各种方法、使用了各种细胞或组织的例子。例如,专利文献1中显示,从冷冻保存及融解后的生存率的方面考虑,玻璃化保存法在动物或人的生殖细胞或体细胞中的应用极为有用。玻璃化保存法主要是使用人的生殖细胞发展起来的技术,然而最近也广泛地研究在iPS细胞和ES细胞上的应用。另外,非专利文献1中显示,在果蝇胚胎的保存中玻璃化保存法是有效的。此外,专利文献2中显示,在植物培养细胞和组织的保存中,玻璃化保存法是有效的。如此所述,已知玻璃化保存法可以广泛地用于各种各样的细胞及组织的保存。专利文献3、专利文献4提出如下的方法,即,在人的不孕治疗领域中使用的所谓的被称作Cryotop法的方法中,使用作为卵子附着保持用带使用了长方形的挠曲性且无色透明的膜的卵子冷冻保存用具,在显微镜观察下使卵子或胚胎与极少量玻璃化液一起附着在该膜上,进行冷冻保存。专利文献5提出如下的方法,即,将卵子或胚胎与玻璃化液一起放在玻璃化保存液除去材料上,通过从下部抽吸而除去附着在卵子或胚胎的周围的多余的玻璃化液,以优异的生存率冷冻保存。而且,作为玻璃化保存液除去材料,还记载过金属丝网、由纸等天然物质或合成树脂制成的膜状物且具有贯通孔的材料。另外作为能够除去多余的玻璃化液、并且能够提高载放细胞时的操作性的冷冻保存用夹具,例如在专利文献6中记载有具备具有特定的雾度值的玻璃化液吸收体的玻璃化冷冻保存用夹具。另一方面,专利文献7中关于将细胞与培养基一起保存时所用的细胞保存容器,记载利用该容器的内面由难以附着细胞的材料形成的容器、具体而言是在容器的内面结合或覆盖有亲水性材料或疏水性材料等的容器,可以防止保存中的细胞向容器壁面上的胶粘,作为亲水性材料例示出丙烯酰胺系聚合物、聚乙烯醇等,作为疏水性材料例示出氟树脂、硅树脂。现有技术文献专利文献专利文献1:日本专利第3044323号公报专利文献2:日本特开2008-5846号公报专利文献3:日本特开2002-315573号公报专利文献4:日本特开2006-271395号公报专利文献5:国际公开第2011/070973号专利文献6:日本特开2014-183757号公报专利文献7:日本特开2004-18504号公报非专利文献非专利文献1:Steponkus等,Nature345:170-172(1990)技术实现要素:发明所要解决的问题专利文献3、专利文献4提出如下的方法,即,通过限制载放卵子或胚胎的膜的宽度,而将卵子或胚胎与少量的玻璃化液一起冷冻保存,获得优异的生存率。然而,该方法中,利用操作者的操作,将卵子或胚胎与极少量的玻璃化液一起放在膜上时,存在有操作的难度高的问题。另外,以该方法为基础的Cryotop法中,为了将卵子或胚胎与更少量的玻璃化液一起冷冻保存,有时也要进行如下的烦杂的操作,即,在先将卵子或胚胎与玻璃化液一起放在膜上后,抽吸多余的玻璃化液而将其从膜上除去。此外,在冷冻后融解卵子或胚胎时,膜上的卵子或胚胎经常会固着于膜上,因而还会有在回收它们时要求高技能的问题。专利文献5提出了通过除去附着于卵子或胚胎的周围的多余的玻璃化液而以优异的生存率冷冻保存这些生殖细胞的方法。然而,上述公报记载的方法中,在除去多余的玻璃化液时,需要从下部的抽吸操作,因此会导致烦杂的操作,不适于在短时间内进行玻璃化冷冻保存操作的情况。此外,一旦从下部的抽吸不充分,就会有残留多余的玻璃化液的问题。另外,与专利文献3、专利文献4相同,在冷冻后进行融解时,卵子或胚胎会固着于膜上,因而还有在回收时要求高技能的问题。专利文献6中,虽然操作者不需要除去附着于卵子或胚胎的周围的多余的玻璃化液,可以获得良好的操作性,然而在玻璃化液吸收体吸收玻璃化液时,卵子或胚胎尤为牢固地固着于玻璃化液吸收体上,因此存在有在回收卵子或胚胎时要求尤其高的技能的问题。本发明的主要目的在于,提供能够容易并且可靠地进行细胞或组织的冷冻保存操作的细胞或组织的冷冻保存用夹具。更具体而言,第一目的在于,提供一种冷冻保存用夹具,在将细胞或组织浸渍于玻璃化液等保存液中、将细胞或组织与保存液一起载放于该冷冻保存用夹具而进行冷冻保存后,在融解该细胞或组织时,可以容易地剥离、回收细胞或组织。另外,第二目的在于,提供一种冷冻保存用夹具,其除了可以容易地回收所述的细胞或组织以外,还具有玻璃化液等保存液的优异的吸收性。此外,目的在于,提供一种可以容易地剥离、回收冷冻保存后的细胞或组织的冷冻保存方法。用于解决问题的方法本发明人等为了解决上述问题进行了深入研究,结果发现,利用具有以下的构成的细胞或组织的冷冻保存用夹具(本说明书中,也将“细胞或组织的冷冻保存用夹具”简称为“冷冻保存用夹具”),可以解决上述问题。(1)一种细胞或组织的冷冻保存用夹具,其特征在于,在载放细胞或组织的载放部的最外表面,具有含有水溶性高分子化合物的层。(2)根据上述(1)中记载的细胞或组织的冷冻保存用夹具,其特征在于,上述水溶性高分子化合物为选自具有乙二醇基的聚乙烯醇及具有环氧乙烷基的聚乙烯醇中的至少1种。(3)根据上述(1)中记载的细胞或组织的冷冻保存用夹具,其特征在于,上述水溶性高分子化合物是皂化度为94mol%以下的聚乙烯醇。(4)根据上述(1)~(3)中任一项记载的细胞或组织的冷冻保存用夹具,其特征在于,含有上述水溶性高分子化合物的层还含有无机微粒。(5)根据上述(1)~(4)中任一项记载的细胞或组织的冷冻保存用夹具,其特征在于,上述载放部具有保存液吸收体,在该保存液吸收体上具有含有上述水溶性高分子化合物的层。(6)一种细胞或组织的冷冻保存方法,其特征在于,在上述(1)~(5)中任一项记载的细胞或组织的冷冻保存用夹具的载放部上,与保存液一起载放浸渍于保存液的细胞或组织,在将细胞或组织保持于载放部的状态下将冷冻保存用夹具浸渍于液氮中,由此将细胞或组织冷冻。(7)根据上述(6)中记载的细胞或组织的冷冻保存方法,其特征在于,上述保存液是相对于保存液的总质量包含10质量%以上的冷冻保护剂的玻璃化液。发明效果根据上述(1)的发明,可以提供一种冷冻保存用夹具,在细胞或组织的冷冻保存操作中,在将冷冻了的细胞或组织融解时,可以容易地回收细胞或组织。根据上述(2)~(4)的发明,可以提供一种冷冻保存用夹具,在将冷冻了的细胞或组织融解时,可以尤其容易地回收细胞或组织。根据上述(5)的发明,可以提供一种细胞或组织的冷冻保存用夹具,除了上述的效果以外,在将细胞或组织载放于冷冻保存用夹具的载放部时,保存液吸收体将附着于细胞或组织的外周的多余的保存液吸收,因此并不特别需要用于除去多余的保存液的其他操作(例如从保存液吸收体下部的抽吸除去操作、使用了微量移液器等的从细胞或组织周围的直接的抽吸除去操作),可以容易并且简便地进行细胞或组织的冷冻保存操作。根据上述(6)及(7)的发明,可以提供一种冷冻保存方法,能够容易地剥离、回收冷冻保存后的细胞或组织。附图说明图1是表示本发明的细胞或组织的冷冻保存用夹具的一例的整体图。图2是图1中的载放部的一例的剖面结构示意图。图3是表示图1所示的载放部具有保存液吸收体的情况下的一例的剖面结构示意图。图4是表示图1所示的载放部具有保存液吸收体的情况下的另一例的剖面结构示意图。图5是表示图1所示的载放部具有保存液吸收体的情况下的另一例的剖面结构示意图。图6是载放部的表面层含有无机微粒的情况下的剖面结构示意图的一例。图7是载放部的表面层含有无机微粒的情况下的剖面结构示意图的另一例。图8是表示载放部具有保存液吸收体、表面层含有无机微粒的情况下的一例的剖面结构示意图。图9是表示载放部具有保存液吸收体、表面层含有无机微粒的情况下的另一例的剖面结构示意图。图10是实施例24的冷冻保存用夹具的载放部表面的扫描型电子显微镜观察图像。具体实施方式本发明的冷冻保存用夹具是冷冻保存细胞或组织时所用的工具。本说明书中所谓细胞,不仅包括单一的细胞,也包括包含多个细胞的生物的细胞集团。所谓包含多个细胞的细胞集团,可以是由单一种类的细胞构成的细胞集团,也可以是由多种细胞构成的细胞集团。另外,所谓组织,可以是由单一种类的细胞构成的组织,也可以是由多种细胞构成的组织,还可以是在细胞以外还包含细胞外基质之类的非细胞性的物质的组织。本发明的冷冻保存用夹具是冷冻保存操作中所用的工具,优选为玻璃化冷冻保存操作中所用的工具。由此,本发明的冷冻保存用夹具适于作为细胞或组织的玻璃化冷冻保存用夹具使用。具体而言,本发明的冷冻保存用夹具是用于将载放有细胞或组织的冷冻保存用夹具浸渍于液氮等冷却溶媒中并使之冷冻的工具。另外,在将载放于冷冻保存用夹具上的细胞或组织融解时,将细胞或组织与冷冻保存用夹具一起从冷却介质中取出,使之浸渍于融解液中而融解。在使用本发明的冷冻保存用夹具进行冷冻保存操作的情况下,细胞或组织通常被与保存液一起载放于载放部的含有水溶性高分子化合物的层上。如果使用本发明的冷冻保存用夹具,就可以在载放细胞或组织时将其可靠地保持,另外可以在融解时容易地回收细胞或组织,因此可以容易并且可靠地进行涉及细胞或组织的冷冻保存的操作。本发明的冷冻保存用夹具可以改称为细胞或组织的冷冻保存用具、细胞或组织的保存用具、细胞或组织的冷冻保存器具、细胞或组织的保存用器具。本发明的冷冻保存用夹具在载放细胞或组织的载放部的最外表面,具有含有水溶性高分子化合物的层(以下也记作本发明的表面层或简记为表面层)。该表面层优选相对于融解液为可溶性。此处所谓可溶性是指表面层相对于25℃的融解液的溶解度为0.2质量%以上。本发明的冷冻保存用夹具如上所述,在冷冻操作时,将细胞或组织与保存液一起载放于冷冻保存用夹具的含有水溶性高分子化合物的层上后,浸渍于制冷剂(例如液氮)中,进行冷冻,在融解时,将冷冻了的细胞或组织与冷冻保存用夹具一起取出,浸渍于融解液中而融解,而在融解细胞或组织时,含有水溶性高分子化合物的层的整体或一部分溶解于融解液中,由此细胞或组织就不会固着于冷冻保存用夹具的载放部,可以容易地剥离、回收。本发明中,上述载放部优选具有保存液吸收体,优选在该保存液吸收体上具有含有上述水溶性高分子化合物的层(表面层)。在本发明的冷冻保存用夹具的载放部具有保存液吸收体、此外在该载放部的最外表面具有本发明的表面层的情况下,除了上述效果以外,该保存液吸收体还会吸收多余的保存液,因此不用特别需要用于除去多余的保存液的其他的操作,操作性大幅度提高。另外,经过如此操作的细胞或组织由极少量的保存液覆盖,在进行冷冻操作时也可以快速地制成冷冻状态。此外,在所述的玻璃化冷冻法中,保存液因含有大量的冷冻保护剂而造成的化学性毒性成为问题,然而根据载放部具有保存液吸收体的冷冻保存用夹具,因被载放的细胞或组织周边的玻璃化液是极少量,而可以期待细胞或组织的生存率的提高。在载放部具有保存液吸收体的情况下,优选在保存液吸收体与表面层之间,不具有其他的层。以下,对本发明的冷冻保存用夹具的构成进行说明。本发明的冷冻保存用夹具在载放细胞或组织的载放部的最外表面,具有含有水溶性高分子化合物的层。此处所谓载放细胞或组织的载放部的最外表面,相当于细胞或组织被与保存液一起载放的表面部分。本发明中载放部优选在各种树脂膜、金属、玻璃、橡胶等非吸收性支承体上、或保存液吸收体上具有本发明的表面层,特别是优选在保存液吸收体上具有本发明的表面层。而且,本发明中该表面层可以不是在整个载放细胞或组织的载放部中形成均匀的层,例如可以是海岛状或条纹状的层。即,重要的是本发明的表面层存在于与保存液一起载放细胞或组织的部位的最外表面,在没有载放细胞或组织的部位,可以存在有该表面层,也可以不存在该表面层。如此所述,载放部可以在其整个最外表面具有表面层,也可以在最外表面的一部分具有表面层。作为本发明中表面层所含有的水溶性高分子化合物,例如可以举出羟乙基纤维素、羧甲基纤维素等纤维素衍生物、淀粉及其衍生物、明胶、酪蛋白、海藻酸及其盐、聚乙烯醇、聚乙烯基吡咯烷酮、苯乙烯·马来酸共聚物盐、苯乙烯·丙烯酸共聚物盐等。其中,海藻酸及其盐、明胶由于可以获得相对于保存液的溶解性和适度的被膜形成作用,因此优选,聚乙烯醇是来自于非生物的材料,并且对于细胞或组织为低毒性,因此特别优选。这些水溶性高分子化合物可以单独使用,也可以并用2种以上。另外,表面层可以在相对于融解液的溶解度不低于10质量%的范围中含有交联剂。而且,本发明的所谓水溶性高分子化合物的水溶性,是指相对于25℃的水的溶解量至少为0.5质量%以上,更优选为5质量%以上。表面层所含有的水溶性高分子化合物的固体成分量优选为0.01~100g/m2,更优选为0.1~10g/m2。在水溶性高分子化合物的固体成分量大于100g/m2的情况下,水溶性高分子化合物向融解液中的溶出·混入变多,因而不够理想。另一方面,在水溶性高分子化合物的固体成分量在低于0.01g/m2的情况下,在融解时,会有无法容易地剥离细胞或组织的情况。本发明中表面层优选作为水溶性高分子化合物含有选自具有乙二醇基的聚乙烯醇及具有环氧乙烷基的聚乙烯醇中的至少1种。具有乙二醇基的聚乙烯醇及具有环氧乙烷基的聚乙烯醇可以发挥被膜的优异的亲水性、适度的强度、适度的溶解性,在融解操作时,细胞或组织不会固着于载放部,可以尤其容易地剥离·回收。具有乙二醇基的聚乙烯醇及具有环氧乙烷基的聚乙烯醇可以使用各种皂化度的该聚乙烯醇,而从获得细胞或组织的良好的剥离性的观点考虑,这些聚乙烯醇的皂化度优选为94mol%以下。另外,这些聚乙烯醇可以单独使用,也可以并用2种以上。具有乙二醇基的聚乙烯醇及具有环氧乙烷基的聚乙烯醇例如可以获取、使用由日本合成化学工业(株)销售的产品。在表面层含有选自具有乙二醇基的聚乙烯醇及具有环氧乙烷基的聚乙烯醇中的至少1种聚乙烯醇的情况下,该表面层可以含有一种或两种以上的其他的水溶性高分子化合物。作为该水溶性高分子化合物,例如可以举出羟乙基纤维素、羧甲基纤维素等纤维素衍生物、淀粉及其衍生物、明胶、酪蛋白、海藻酸及其盐、不具有乙二醇基及环氧乙烷基的聚乙烯醇、聚乙烯基吡咯烷酮、苯乙烯·马来酸共聚物盐、苯乙烯·丙烯酸共聚物盐等。其他水溶性高分子化合物的含量优选相对于选自具有乙二醇基的聚乙烯醇及具有环氧乙烷基的聚乙烯醇中的至少1种聚乙烯醇的固体成分量为50质量%以下。本发明中表面层优选作为水溶性高分子化合物含有皂化度为94mol%以下的聚乙烯醇。通过将皂化度为94mol%以下的聚乙烯醇的被膜作为表面层使用,可以获得优异的细胞或组织的剥离性,因此在融解操作时,细胞或组织不会固着于载放部,可以容易地回收。此外,通过选择皂化度为81mol%以下的聚乙烯醇,或者通过选择皂化度为94mol%以下并且聚合度为400以下的聚乙烯醇,可以获得细胞或组织的剥离性尤其优异的冷冻保存用夹具。这些聚乙烯醇可以单独使用,也可以并用2种以上。在表面层含有皂化度为94mol%以下的聚乙烯醇的情况下,该表面层可以含有一种或两种以上的其他水溶性高分子化合物。作为该水溶性高分子化合物,例如可以举出羟乙基纤维素、羧甲基纤维素等纤维素衍生物、淀粉及其衍生物、明胶、酪蛋白、海藻酸及其盐、皂化度大于94mol%的聚乙烯醇、聚乙烯基吡咯烷酮、苯乙烯·马来酸共聚物盐、苯乙烯·丙烯酸共聚物盐等。其他水溶性高分子化合物的含量优选相对于皂化度为94mol%以下的聚乙烯醇的固体成分量为50质量%以下。本发明中表面层优选除了上述的水溶性高分子化合物以外,还含有无机微粒。无机微粒不会降低表面层的亲水性,另外可以在表面层形成微细的凹凸而使载放部与细胞或组织的接触面积降低,因此细胞或组织不会固着于冷冻保存用夹具的载放部,可以更加容易地剥离·回收。作为该无机微粒,例如可以举出轻质碳酸钙、重质碳酸钙、碳酸镁、高岭土、二氧化钛、氧化锌、氢氧化锌、硅酸钙、硅酸镁、非晶质合成二氧化硅、氧化铝、氧化铝水合物、氢氧化镁等。该无机微粒的平均粒径(如果是一次粒子凝聚而形成二次凝聚体的无机微粒则为平均二次粒径,没有形成二次粒子的无机微粒中是平均一次粒径)优选为1μm以下,更优选为600nm以下。无机微粒的平均粒径的下限没有特别限定,然而优选为6nm以上。对于平均粒径,例如如果是一次粒子凝聚而形成二次凝聚体的无机微粒,则可以使用激光散射式的粒度分布计(例如堀场制作所公司制、LA910)作为个数中值直径求出。另外如果是没有形成二次粒子的无机微粒,则可以利用被分散至能够判别一次粒径的粒子的电子显微镜照片作为存在于一定面积内的100个粒子的平均粒径求出。其中,一次粒子之间没有凝聚、没有形成二次粒子的无机微粒(以下称作单一粒子分散性的无机微粒。)由于载放部的与细胞或组织的接触面积较小,因此优选。从此种观点考虑,适合为胶态二氧化硅。胶态二氧化硅例如由日产化学工业工业(株)作为Snowtex(注册商标)销售。另外,也可以优选使用由GEHealthcareJapan(株)销售的Percoll(商品名)之类的、在粒子表面覆盖了聚乙烯基吡咯烷酮的胶态二氧化硅。本发明中,在载放部具有后述的保存液吸收体的情况下,优选使无机微粒不会堵塞该保存液吸收体所具有的微孔地在载放部的最外表面设置含有水溶性高分子化合物及无机微粒的层。为此,可以使无机微粒的粒径大于保存液吸收体所具有的微孔直径,另外如果是不会明显减少保存液吸收体的吸收性的范围,也可以在保存液吸收体的微孔内部存在无机微粒。作为本发明的冷冻保存用夹具所具有的无机微粒的固体成分量,优选为0.01~100g/m2,更优选为0.1~10g/m2。在无机微粒的固体成分量大于100g/m2的情况下,无机微粒向融解液中的溶出·混入变多,因而不够理想。另一方面,在无机微粒的固体成分量低于0.01g/m2的情况下,在融解时,会有无法容易地剥离细胞或组织的情况。本发明中在表面层除了上述的水溶性高分子化合物以外还含有无机微粒的情况下,相对于水溶性高分子化合物而言的无机微粒的含有比率(无机微粒的合计质量/水溶性高分子化合物的合计质量)优选为1~100,更优选为1.67~50。通过将相对于水溶性高分子化合物而言的无机微粒的含有比率设为此种范围,载放部的表面(该表面层)可以维持适度的凹凸,在融解操作时可以容易地回收细胞或组织。另外,例如可以抑制冷冻保存用夹具使用前的无机微粒的脱落(粉粒脱落)、冷冻操作时滴加玻璃化液时的无机微粒的意愿之外的脱落。本发明中载放部在冷冻保存细胞或组织时,优选出于支承细胞或组织的目的而具有支承体,在该支承体上具有表面层。作为该支承体(非吸收性支承体),例如可以举出各种树脂膜、金属、玻璃、橡胶等。此种支承体可以由1种材料制成,也可以由2种以上的材料制成。其中,从处置的观点考虑适合使用树脂膜。作为树脂膜的具体例,可以举出由聚对苯二甲酸乙二醇酯(PET)、聚萘苯二甲酸乙二醇酯(PEN)等聚酯树脂、丙烯酸类树脂、环氧树脂、硅树脂、聚碳酸酯树脂、二乙酸酯树脂、三乙酸酯树脂、聚丙烯酸酯树脂、聚氯乙烯树脂、聚砜树脂、聚醚砜树脂、聚酰亚胺树脂、聚酰胺树脂、聚烯烃树脂、环状聚烯烃树脂等制成的树脂膜。另外如果支承体的总光线透射率为80%以上,则可以使用透射型显微镜容易地确认载放于载放部的细胞或组织,因此优选。此外,从温度传导性优异、能够实现急速的冷冻的观点考虑,也可以合适地使用金属制支承体。作为金属制支承体的具体例,可以举出铜、铜合金、铝、铝合金、金、金合金、银、银合金、铁、不锈钢等。上述的支承体的厚度优选为10μm~10mm。另外,根据目的,也可以利用电晕放电处理之类的电方法、化学方法对支承体的表面进行易胶粘处理,此外也可以使之粗面化。此外,也可以在支承体与表面层之间具有一个或多个其他的层,还可以在支承体的表面侧具有表面层,在背面侧具有一个或多个其他的层。另外,也可以将表面层设于支承体的表背面。支承体也可以是后述的保存液吸收体。下面,对本发明的冷冻保存用夹具在保存液吸收体上具有含有水溶性高分子化合物的层的情况进行说明。如前所述,在本发明的细胞或组织的载放部具有保存液吸收体的情况下,即使附着于细胞或组织上的保存液的量多,保存液吸收体也可以除去保存液,因此不需要保存液的除去操作,操作性大幅度提高。另外经过如此操作的细胞或组织由极少量的保存液覆盖,在进行冷冻操作时也可以迅速地制成冷冻状态。此外,在所述的玻璃化冷冻法中可以将包含大量甘油、乙二醇、DMSO(二甲亚砜)等冷冻保护剂的水溶液作为保存液利用,该保存液因大量的冷冻保护剂而存在化学性毒性,然而根据载放部具有保存液吸收体的冷冻保存用夹具,因被载放的细胞或组织周边的玻璃化液是极少量,而可以期待细胞或组织的生存率的提高。因而,载放部在保存液吸收体上具有含有水溶性高分子化合物的层的冷冻保存用夹具适于用作玻璃化冷冻保存用夹具。本发明中,在载放部具有保存液吸收体的情况下,优选不堵塞该保存液吸收体所具有的微孔地在载放部的最外表面设置表面层。另外,如果是保存液吸收体的吸收性不明显降低的范围,也可以在保存液吸收体的微孔内部存在表面层。本发明中,在载放部具有保存液吸收体的情况下,表面层的固体成分量越多,保存液吸收体所具有的微孔就会越小,因此保存液的吸收性有降低的趋势。另一方面,表面层的固体成分量越多,融解操作时的细胞或组织的剥离性就越优异。虽然要依据所用的保存液吸收体的厚度、微孔直径、空隙率而定,然而载放部具有保存液吸收体时的表面层的固体成分量可以考虑上述性能的平衡适当地进行调整,优选为0.1~5g/m2。作为本发明的冷冻保存用夹具所具有的保存液吸收体,可以举出由纤维制成的片、多孔性树脂片、多孔性金属片、以及多孔性金属氧化物片等各种片。本发明的所谓“多孔性”,是指上述的片在表面具有气孔(微孔)的结构体,更优选为在片表面及内部具有连续的气孔的结构体。另外,保存液吸收体(上述的各种片)的厚度优选为10μm~5mm,更优选为20μm~2.5mm。在保存液吸收体为薄片的情况下,可以作为加强构件使用所述的非吸收性支承体。本发明中,作为用作保存液吸收体的由纤维制成的片,可以例示出纸或无纺布,纸优选粘结剂等结着剂成分在纸整体中所占的比例为10质量%以下的纸,更优选比例为5质量%以下、进一步优选比例为3质量%以下的纸。由此可以获得优异的保存液的吸收性。另外,该纸中所占的制纸用药品在纸整体中所占的比例优选为1质量%以下。通常纸中所含的制纸用药品当中,例如荧光增白剂或染料、阳离子系的施胶剂等对细胞的影响有时令人担心。在由纤维制成的片为纸的情况下,优选为密度为0.1~0.6g/cm3、基重为10~130g/m2的纸。特别是密度为0.12~0.3g/cm3、基重为10~100g/m2的纸可以提供保存液的吸收性优异、而且能够使用透射型显微镜观察载放于载放部上的细胞或组织的、细胞或组织的观察性优异的冷冻保存用夹具,因此优选。在由纤维制成的片为无纺布的情况下,作为该无纺布所含有的纤维,可以举出纤维素纤维、作为包含纤维素纤维的再生纤维的人造丝纤维或铜氨纤维、以及作为来自于纤维素纤维的半合成纤维的乙酸酯纤维、聚酯纤维、尼龙纤维、丙烯酸类纤维、聚丙烯纤维、聚乙烯纤维、聚氯乙烯纤维、亚乙烯纤维、聚氨酯纤维、维尼纶纤维、玻璃纤维、丝绸纤维等,也可以使用对这些纤维进行了各种混合的无纺布。其中优选纤维素纤维、作为来自于纤维素纤维的纤维且作为纤维素再生纤维的人造丝纤维或铜氨纤维、以及作为来自于纤维素纤维的半合成纤维的乙酸酯纤维。在由纤维制成的片为无纺布的情况下,优选为密度为0.1~0.4g/cm3、基重为10~130g/m2的无纺布。特别是密度为0.12~0.3g/cm3、基重为10~100g/m2的无纺布由于能够提供保存液的吸收性优异、而且细胞或组织的观察性优异的冷冻保存用夹具,因此优选。在作为保存液吸收体使用的无纺布中也与所述的纸相同,优选粘结剂等结着剂成分在无纺布中所占的比例为10质量%以下的无纺布,更优选比例为5质量%以下、进一步优选比例为3质量%以下的无纺布。特别优选不含有结着剂的无纺布。无纺布与纸不同,有各种各样的制造方法,然而作为减少了上述的结着剂成分的无纺布,可以合适地使用利用纺粘法、熔喷法制造的无纺布、以及在利用湿式法或干式法将纤维并排排放后以水流交络法或针刺法制造的无纺布。另外,如上所述,作为本发明中无纺布所含有的优选的纤维,可以举出纤维素纤维、作为来自于纤维素纤维的纤维且作为纤维素再生纤维的人造丝纤维或铜氨纤维、以及作为来自于纤维素纤维的半合成纤维的乙酸酯纤维,在使用这些纤维制造的情况下,无论是湿式法还是干式法,都适合为利用水流交络法或针刺法的制造方法。本发明中,作为用作保存液吸收体的多孔性树脂片,例如可以举出如下的树脂片等,即,日本特公昭42-13560号公报、日本特开平08-283447号公报中记载的树脂片,即至少沿一轴方向拉伸,并加热到树脂的熔点以上而使之烧结,利用由此得到的微细纤维状结构形成多孔结构;日本特开2009-235417号公报中记载的树脂片,即将利用乳液聚合或粉碎等方法得到的热塑性树脂的固体粉末填充到模具中,并进行加热、烧结,使粉末粒子表面熔融后冷却,由此形成多孔结构。在将多孔性树脂片作为保存液吸收体使用的情况下,可以提供保存液的吸收性优异、而且细胞或组织的观察性优异的冷冻保存用夹具,因此优选。作为形成上述的多孔性树脂片的树脂,可以举出低密度聚乙烯、高密度聚乙烯、超高分子聚乙烯等各种聚乙烯或聚丙烯、聚甲基丙烯酸甲酯、聚苯乙烯、聚四氟乙烯或聚偏二氟乙烯等氟树脂、乙烯-乙酸乙烯酯共聚物、聚酰胺、苯乙烯-丙烯腈共聚物、苯乙烯-丁二烯-丙烯腈三元共聚物、聚碳酸酯、聚氯乙烯等。其中聚四氟乙烯、聚偏二氟乙烯等氟树脂在将细胞或组织与玻璃化液等保存液一起载放于载放部的情况下,该多孔性树脂片的透明性变高,透射型显微镜观察下的细胞或组织的观察性飞跃性地提高,可以提供细胞或组织的观察性尤其优异的冷冻保存用夹具,因此是合适的。另外作为多孔性树脂片,也可以使用作为物理化学实验用途或研究用途销售的、过滤用的膜滤器。本发明中,作为用作保存液吸收体的多孔性金属片,可以举出由铜、铜合金、铝、铝合金、金、金合金、银、银合金、锡、锌、铅、钛、镍、不锈钢等金属制成的多孔性金属片。另外,作为多孔性金属氧化物片,可以优选利用由二氧化硅、氧化铝、锆、石英玻璃等金属氧化物制成的多孔性金属氧化物片。另外,多孔性金属片及多孔性金属氧化物片也可以是分别含有2种以上的上述的金属及金属氧化物的多孔性片。其中,多孔性金属氧化物片可以提供细胞或组织的观察性优异的冷冻保存用夹具,因此优选。本发明中,作为用作保存液吸收体的多孔性金属片、以及多孔性金属氧化物片的制造方法,可以使用通常已知的方法。在玻璃化液吸收体为多孔性金属片的情况下,可以使用粉末冶金法、间隔物法等方法。另外,也可以优选使用组合了树脂注射成型和粉末冶金法的所谓PowderSpaceHolder法。例如,可以使用国际公开第2006/041118号、日本专利第4578062号公报中记载的方法等。更具体而言,在将金属粉末与成为间隔物的树脂混合后,施加压力而成型,然后在高温环境下烧成,由此将金属粉末烧结,使成为间隔物的树脂气化,就可以得到多孔性金属片。在使用PowderSpaceHolder法等情况下,除了金属粉末和成为间隔物的树脂以外,还可以混合树脂的粘结剂。另外,也可以使用在高温下加热金属粉末后、注入气体而制作空隙的发泡熔融法、气体膨胀法等金属多孔体的制造方法。此外,也可以使用用发泡剂来制造金属多孔体的浆料发泡法之类的制造方法。在保存液吸收体为多孔性金属氧化物片的情况下,例如可以使用日本特开2009-29692号公报或日本特开2002-160930号公报中记载的方法等。为了提高上述的多孔性树脂片、多孔性金属片、以及多孔性金属氧化物片等多孔体的表面与表面层的亲和性,也可以进行亲水化处理。作为亲水化处理的方法,可以使用接枝改性法、涂布非溶出性的亲水性物质的涂覆法、使用了电晕放电、等离子体处理、准分子激光器等各种能量的普通的表面改性方法。在保存液吸收体为上述的多孔性树脂片、多孔性金属片、以及多孔性金属氧化物片等多孔体的情况下,该多孔体的微孔直径优选为0.02~130μm,更优选为0.05~60μm。如果微孔直径是小于0.02μm的范围,则滴加保存液时会有保存液的吸收性能不够充分的情况。另外,会有多孔性片的制造困难的问题。另一方面,如果微孔直径是大于130μm的范围,则会有保存液的吸收性能不够充分的情况。而且,对于多孔体的微孔直径,在多孔性树脂片的情况下,是利用泡点试验测定的最大的微孔的直径。另外,在多孔性金属片及多孔性金属氧化物片的情况下,是根据该多孔体的表面及剖面的图像观察测定出的平均微孔直径。保存液吸收体的空隙率优选为20容量%以上,更优选为30容量%以上。另外,在保存液吸收体为上述的多孔性树脂片、多孔性金属片、以及多孔性金属氧化物片等多孔体的情况下,多孔体的内部的气孔优选为不仅在厚度方向上连续、而且在垂直于厚度方向的方向上也连续的结构。如果具有此种结构,则可以有效地使用多孔体内部的气孔,因此可以获得保存液的高吸收性能。保存液吸收体的厚度、多孔体的空隙率可以根据所用的细胞或组织的种类、与细胞或组织一起滴加的保存液的滴加量等适当地选择。上述的所谓空隙率,是由以下的式子定义。此处空隙容量V可以如下求出,即,在使用水银孔隙度仪(测定器名称AutoporeII9220制造者micromeriticsinstrumentcorporation)测定·处理了的、保存液吸收体的微孔半径3nm到400nm的累积微孔容积(ml/g)上乘以保存液吸收体的干燥固体成分量(g/平方米),由此作为每单位面积(平方米)的数值求出。另外,保存液吸收体的厚度T可以通过用电子显微镜拍摄保存液吸收体的剖面并进行测长而得到。P=(V/T)×100(%)P:空隙率(%)V:空隙容量(ml/m2)T:厚度(μm)在载放部除了保存液吸收体以外还作为加强构件具有非吸收性支承体的情况下,可以在保存液吸收体与非吸收性支承体之间设置胶粘层。作为胶粘层,可以含有以湿气固化性的胶粘物质为代表的瞬间胶粘组合物、热熔胶粘组合物、光固化性胶粘组合物等,例如可以优选利用含有聚乙烯醇、羟基纤维素、聚乙烯基吡咯烷酮、淀粉糊之类的水溶性高分子化合物、乙酸乙烯酯系树脂、丙烯酸系树脂、环氧系树脂、氨基甲酸酯系树脂、弹性体系树脂、氰基丙烯酸酯系树脂、氟系树脂、硅酮系树脂、硝基纤维素系树脂、腈橡胶系树脂、苯乙烯-丁二烯系树脂、脲系树脂、苯乙烯系树脂、酚醛系树脂、聚酰亚胺系树脂、聚酰胺系树脂、聚酯系树脂、双马来酰亚胺系树脂、烯烃系树脂、EVA系树脂等非水溶性树脂的组合物。胶粘层可以含有一种树脂,也可以含有多种树脂。胶粘层的固体成分量优选为0.01~100g/m2的范围,更优选为0.1~50g/m2的范围。本发明的冷冻保存用夹具所具有的载放部的面积只要根据与细胞或组织一起滴加的保存液的滴加量等适当地设定即可,没有特别限定,例如对于滴加的保存液1μL优选设为1mm2以上,更优选设为2~400mm2。另外,在相同的冷冻保存用夹具中,载放部是在非吸收性支承体上具有多个保存液吸收体的形态的情况下,优选连续着的1个保存液吸收体部分为所述的面积。本发明的载放部的制造方法没有特别限定,例如在支承体上或保存液吸收体上具有表面层的载放部可以通过在支承体上或保存液吸收体上形成表面层而得到。本发明的表面层的形成方法没有特别限定。例如,在将含有水溶性高分子的涂布液涂布于支承体或保存液吸收体上后,在其后进行干燥,由此可以在支承体上或保存液吸收体上形成表面层。在表面层包含无机微粒的情况下,使用含有水溶性高分子及无机微粒的涂布液形成表面层即可。涂布液也可以包含水、有机溶媒等溶剂等。涂布涂布液的方法也没有特别限定,只要适当地选择即可。以上,对本发明的冷冻保存用夹具的载放部进行了说明。本发明的冷冻保存用夹具可以与载放部一起还具有握持部。如果具有握持部,则冷冻保存操作时及融解操作时的操作性变得良好,因此优选。图1是表示本发明的细胞或组织的冷冻保存用夹具的一例的整体图。图1中冷冻保存用夹具7由握持部1和载放部2构成。握持部优选为耐液氮材料。作为此种材料,例如可以合适地使用铝、铁、铜、不锈钢合金等各种金属、ABS树脂、聚丙烯树脂、聚乙烯树脂、氟系树脂或各种工程塑料、以及玻璃等。图1中,握持部1为圆柱形,然而其形状是任意的。另外,如后所述,有时出于不使细胞或组织直接接触液氮的目的,在冷冻前在附着有细胞或组织的载放部2上盖上盖子,该情况下,也可以通过将握持部1制成从不具有载放部2的一侧朝向具有载放部2的一侧圆柱的直径连续变小的形状,而提高盖上盖子时的操作性。载放部2的形状从处置上考虑优选为条状或片状。对图1的握持部1与载放部2的连接方法进行说明。在握持部1为树脂的情况下,例如在进行成形加工时可以利用嵌件成形将载放部2与握持部1连接。此外,可以在握持部1中制作未图示的结构体插入部而利用胶粘剂连接载放部2。胶粘剂可以使用各种物质,然而可以合适地使用耐低温的硅酮系、氟系的胶粘剂。图2是图1中的载放部的一例的剖面结构示意图。图2中,载放部2a是在支承体4上具有表面层3的结构。为了获得此种结构的载放部2a,例如可以使用向支承体上以滑动料斗方式涂布含有水溶性高分子化合物的涂布液的方法、以浸涂法涂布含有水溶性高分子化合物的涂布液的方法等制造方法。图3~5是表示载放部具有保存液吸收体、且在该保存液吸收体上具有含有水溶性高分子化合物的层的冷冻保存用夹具的一例的剖面结构示意图。图3~5所示的保存液吸收体5是具有微孔9(气孔)的结构体。图3~5所示的保存液吸收体5的剖面结构是一个例子,并不限定于它们。图3是表示图1所示的载放部具有保存液吸收体的情况下的一例的剖面结构示意图。图3中,载放部2b是具有保存液吸收体5且在保存液吸收体5上具有表面层3的结构。为了获得此种结构的载放部2b,例如可以使用将所述的涂布液以滑动料斗方式涂布于保存液吸收体上的制造方法。图4是表示图1所示的载放部具有保存液吸收体的情况下的另一例的剖面结构示意图。图4中,载放部2c是在保存液吸收体5的整个多孔体具有表面层3的结构。在像这样在保存液吸收体上存在表面层的情况下,表面层不需要在保存液吸收体表面形成连续的层,也可以存在于保存液吸收体的孔表面。该结构不会堵塞多孔体的微孔,因此可以兼顾冷冻时的玻璃化液的吸收性和融解时的细胞或组织的剥离性,因而优选。该方式中,由于也是在微观上在载放部的最外表面存在本发明的表面层,因此可以说图4表示出本发明的一例。为了获得此种结构的载放部2c,例如可以使用以浸涂法涂布上述的涂布液的制造方法。图5是表示图1所示的载放部具有保存液吸收体的情况下的另一例的剖面结构示意图。图5中,载放部2d除了在保存液吸收体5的整个多孔体具有表面层3的图4的形态以外,还具有支承体4和胶粘层6。该结构的情况下,即使在例如保存液吸收体5中所用的多孔体缺乏自立性的情况下,也可以更加可靠地进行冷冻时·融解时的操作。图6是载放部的表面层含有无机微粒的情况下的剖面结构示意图的一例。图6中,载放部2e具有在支承体4上具有以层状配置的无机微粒8的结构。为了获得此种结构的载放部2e,例如可以使用向支承体上以滑动料斗方式涂布含有水溶性高分子化合物及无机微粒的涂布液的方法、以浸涂方式涂布含有水溶性高分子化合物及无机微粒的涂布液的方法等制造方法。图7是载放部的表面层含有无机微粒的情况下的剖面结构示意图的另一例。图7中,载放部2f是在支承体4上散布有无机微粒8的结构。图8是表示载放部具有保存液吸收体、且表面层含有无机微粒的情况下的一例的剖面结构示意图。图8中,载放部2g在保存液吸收体5的表面上具有无机微粒8。为了获得此种结构的载放部2g,只要利用粒径大于保存液吸收体5的微孔直径的无机微粒8,对含有该无机微粒8和水溶性高分子化合物的涂布液以上述的滑动料斗方式、浸涂方式等涂布方法进行涂布即可。图9是表示载放部具有保存液吸收体、且表面层含有无机微粒的情况下的另一例的剖面结构示意图。图9中,载放部2h在保存液吸收体5的最外表面含有无机微粒8,并且在保存液吸收体5的微孔内部也具有无机微粒8。为了获得此种结构的载放部2h,只要利用粒径小于保存液吸收体5的微孔直径的无机微粒8,对含有该无机微粒8和水溶性高分子化合物的涂布液以上述的滑动料斗方式、浸涂方式等涂布方法进行涂布即可。另外,在利用了粒径小于保存液吸收体5的微孔直径的无机微粒8的情况下,由于该无机微粒8进入微孔内部而使微孔直径变小,因此如图9所示,也有在保存液吸收体5的表面上以层状配置无机微粒的情况。图6~图9所示的载放部的剖面示意图是表示在最外表面具有含有水溶性高分子化合物及无机微粒化合物的层的载放部的一例的剖面示意图。而且,在上述的图6至图9中,省略表面层3(水溶性高分子化合物),仅记载了无机微粒8。在利用本发明的细胞或组织的冷冻保存用夹具长期冷冻保存细胞或组织的情况下,如前所述,也可以为了将细胞或组织与外界隔绝而盖上盖子,或将该冷冻保存用夹具放入任意形状的容器中并密闭。在液氮没有被灭菌、使细胞或组织直接接触液氮而使之冷冻的情况下,即使冷冻保存用夹具被灭菌也会有无法保证灭菌状态的情况。由此,有时在冷冻前在附着有细胞或组织的载放部上盖上盖子,或将冷冻保存用夹具密闭在容器中,使细胞或组织不直接接触液氮地使之冷冻。另外,在欧洲等海外发达国家如前所述地不直接接触液氮的冷冻方法是主流。从此种理由考虑,盖子及容器优选用作为具有耐液氮性的材料的各种金属、各种树脂、玻璃、陶瓷等制作。作为形状没有特别限定,例如,盖子只要是铅笔用的笔帽之类的半纺锤状或拱顶状等盖子、圆柱状的草帽等不与主体部接触、而可以将细胞或组织与外界隔绝的形状,则无论是何种形状都可以。容器只要是不与被载放的细胞或组织接触、而可以将冷冻保存用夹具外包或收纳并密闭的容器即可,其形状没有特别限定。本发明中,只要不损害本发明的效果,就可以将冷冻保存用夹具与此种能够将载放部上的细胞或组织与外界隔绝的盖子或容器组合使用。另外,与此种盖子或容器组合使用的冷冻保存用夹具也包含于本发明中。本发明的冷冻保存用夹具例如适用于Cryotop法中。另外,以往的Cryotop法通常被用于单一的细胞或少于10个的少数的细胞的保存中,而本发明的冷冻保存用夹具在更多的细胞的保存(例如10~1000000个细胞的保存)时也可以合适地使用。此外,还可以适用于包含多个细胞的片状的细胞(所谓的细胞片)的保存。如果使用本发明的冷冻保存用夹具,则可以在细胞或组织的冷冻保存操作中,在将细胞或组织冷冻后进行融解时,容易地回收细胞或组织。另外,通过使载放部具有保存液吸收体,除了上述的效果以外,在将细胞或组织冷冻时,由于会吸收附着于细胞或组织的外周的多余的玻璃化液,因此在细胞或组织的冷冻时及融解时难以受到由细胞外的玻璃化液造成的损伤,可以以优异的生存率冷冻保存细胞或组织。使用本发明的冷冻保存用夹具冷冻保存细胞或组织的方法没有特别限定,例如,首先将浸渍于保存液的细胞或组织与保存液一起向载放部上滴加,使用移液管等尽可能地除去附着于该细胞或该组织的周围的多余的保存液。此时,在该冷冻保存用夹具的载放部具有保存液吸收体的情况下,不需要上述操作,多余的保存液被自动地除去。然后,通过在将所述细胞或所述组织保持于载放部的状态下将冷冻保存用夹具浸渍于液氮等中,就可以冷冻细胞或组织。此时,也可以在载放部安装能够将所述的载放部上的细胞或组织与外界隔绝的盖子,或将冷冻保存用夹具密闭于所述的容器中,浸渍于液氮等中。如此所述,将浸渍于保存液的细胞或组织与保存液一起载放在上述细胞或组织的冷冻保存用夹具的载放部上,在将细胞或组织保持于载放部的状态下将冷冻保存用夹具浸渍于液氮中,由此将细胞或组织冷冻的冷冻保存细胞或组织的方法也是本发明之一。保存液可以使用通常为了冷冻卵子、胚胎等细胞而使用的保存液,例如,可以使用通过使上述的磷酸缓冲生理盐水等生理性溶液中含有冷冻保护剂(甘油、乙二醇等)而得的保存液、包含大量(至少相对于保存液的总质量为10质量%以上、更优选为20质量%以上)的甘油或乙二醇、DMSO(二甲亚砜)等各种冷冻保护剂的玻璃化液。其中,作为保存液,优选相对于保存液的总质量包含10质量%以上的冷冻保护剂的玻璃化液。在融解操作时,从液氮等冷却溶媒中,取出该冷冻保存用夹具,使载放有经过冷冻的细胞或组织的载放部浸渍于融解液中,其后,回收细胞或组织。作为可以使用本发明的冷冻保存用夹具冷冻保存的细胞,例如可以举出哺乳类(例如人(人类)、牛、猪、马、兔、大鼠、小鼠等)的卵子、胚胎、精子等生殖细胞;人工诱导多功能干细胞(iPS细胞)、胚胎干细胞(ES细胞)等多功能干细胞。另外,可以举出初代培养细胞、继代培养细胞、以及细胞株细胞等培养细胞。另外,在一个或多个实施方式中,作为细胞可以举出成纤维细胞、来自于胰腺癌、肝癌细胞等癌的细胞、上皮细胞、血管内皮细胞、淋巴管内皮细胞、神经细胞、软骨细胞、组织干细胞、以及免疫细胞等贴壁细胞。此外,作为可以冷冻保存的组织,可以举出由同种或异种细胞组成的组织,例如卵巢、皮肤、角膜上皮、牙周膜、心肌等组织。本发明特别适于具有片状结构的组织(例如细胞片、皮肤组织等)的冷冻保存。本发明的冷冻保存用夹具不仅可以适用于直接从活体采集的组织,也适用于例如在活体外培养增殖的培养皮肤、在活体外构筑的所谓的细胞片、日本特开2012-205516号公报中提出的具有三维结构的组织模型之类的人工组织的冷冻保存。本发明的冷冻保存用夹具可以作为如上所述的细胞或组织的冷冻保存用夹具合适地使用。[实施例]以下利用实施例更详细地明示本发明,对本发明进行具体的说明,然而本发明并不受以下的实施例限定。(实施例1)作为支承体使用经过易胶粘处理的透明PET膜(总光线透射率91%、雾度值5.5%),在该支承体上,以使干燥时的固体成分量为5g/m2的方式,利用滑动料斗方式涂布日本合成化学工业(株)制的高纯度聚乙烯醇EG-05P(皂化度86.5~89mol%)的5质量%水溶液,使之在室温下干燥,制作出图2所示的形态的载放部。将该载放部裁割为2mm×20mm的大小(40mm2),与ABS树脂制的握持部接合,以图1所示的形态制作出实施例1的冷冻保存用夹具。(比较例1)除了在实施例1的冷冻保存用夹具的制作中,直接使用透明PET膜作为载放部以外,同样地制作出比较例1的冷冻保存用夹具。<小鼠卵子的冷冻操作>将采集到的小鼠卵子在作为pH指示剂含有极低浓度的酚红的修正磷酸缓冲液(137mM的NaCl、2.7mM的KCl、0.9mM的CaCl2·2H2O、0.5mM的MgCl2·6H2O、1.5mM的KH2PO4、8mM的Na2HPO4、5.6mM的葡萄糖、0.3mM的丙酮酸Na、65μg/ml的硫酸地贝卡星、1mg/ml的聚乙烯基吡咯烷酮、14.8mM的L-proline、200mM的海藻糖)中、在15℃的环境下浸渍10分钟。其后,暂时取出小鼠卵子,然后将该小鼠卵子在温度15℃的平衡液(7容量%乙二醇、0.5容量%甘油、92.5容量%上述修正磷酸缓冲液)中浸渍5分钟。然后,将从平衡液中取出的小鼠卵子浸渍在温度4℃的玻璃化液(30容量%的乙二醇、0.5容量%的甘油、69.5%的上述修正磷酸缓冲液、0.5M的蔗糖)中。在玻璃化液中的30秒的浸渍后,将小鼠卵子载放于实施例1或比较例1的冷冻保存用夹具的载放部上,在透射型显微镜观察下,使用移液管尽可能地除去小鼠卵子周边的多余的玻璃化液。其后,浸渍于液氮中,使之玻璃化冷冻。将冷冻了的冷冻保存用夹具直至融解前都保管在液氮保存容器中。<小鼠卵子的融解操作和剥离性的评价>将载放有小鼠卵子的实施例1或比较例1的冷冻保存用夹具从液氮中取出,浸渍于温度37℃的融解液(向上述修正磷酸缓冲液中添加了1M的蔗糖的溶液)中。用透射型光学显微镜观察浸渍后的小鼠卵子的样子,依照以下的基准对融解时的小鼠卵子的剥离性进行了评价。将这些结果表示于表1的“融解时的剥离性”的项目中。依照以下的基准评价了融解时的剥离性。◎:将冷冻保存用夹具浸渍于融解液中时,能够以轻微地振动握持部的程度剥离小鼠卵子(剥离所需的时间为1分钟以内)。○:将冷冻保存用夹具浸渍于融解液中时,能够通过将握持部上下左右摇动而剥离小鼠卵子(剥离所需的时间为1分钟以内)。×:通过将握持部上下左右摇动,无法在1分钟以内剥离小鼠卵子。[表1]融解时的剥离性实施例1◎比较例1×由表1的结果判明,本发明的冷冻保存用夹具在融解时显示出优异的剥离性。(实施例2)作为支承体使用经过易胶粘处理的透明PET膜(总光线透射率91%、雾度值5.5%),在该支承体上作为胶粘层以使干燥时的固体成分量为30g/m2的方式涂布了HenkelJapan(株)制的热熔聚氨酯树脂PurmeltQR170-7141P。在胶粘层完全固化前,作为保存液吸收体,贴合AdvantechTOYO(株)制的经过亲水化处理的聚四氟乙烯多孔体(微孔直径0.2μm、空隙率71%、厚度35μm)。通过将如此得到的层叠体浸渍于日本合成化学工业公司制的高纯度聚乙烯醇EG-05P(皂化度86.5~89mol%)的2质量%水溶液中,而进行浸涂,使之在室温下干燥,制作出图5所示的形态的具有含有水溶性高分子化合物的层的载放部。而且,含有水溶性高分子化合物的层的涂布量以干燥时的固体成分量计为1.6g/m2。与实施例1相同地将该载放部裁割为2mm×20mm的大小,其后与ABS树脂制的握持部接合,以图1所示的形态制作出实施例2的冷冻保存用夹具。(实施例3)除了将聚乙烯醇EG-05P的水溶液的浓度设为1质量%以外,与实施例2相同地制作出实施例3的冷冻保存用夹具。而且,实施例3的冷冻保存用夹具所具有的含有水溶性高分子化合物的层的涂布量以干燥时的固体成分量计为0.5g/m2。(实施例4)除了将聚乙烯醇EG-05P的水溶液的浓度设为0.2质量%以外,与实施例2相同地制作出实施例4的冷冻保存用夹具。而且,实施例4的冷冻保存用夹具所具有的含有水溶性高分子化合物的层的涂布量以干燥时的固体成分量计为0.1g/m2。(实施例5)除了在作为其他的聚乙烯醇的(株)Kuraray制PVA103(皂化度98~99mol%)的1质量%水溶液中浸渍层叠体而设置含有水溶性高分子化合物的层以外,与实施例2相同地制作出实施例5的冷冻保存用夹具。而且,实施例5的冷冻保存用夹具所具有的含有水溶性高分子化合物的层的涂布量以干燥时的固体成分量计为0.5g/m2。(实施例6)除了在除聚乙烯醇以外还含有作为明胶的Jellice(株)制PN505的1质量%水溶液中浸渍层叠体而设置含有水溶性高分子化合物的层以外,与实施例2相同地制作出实施例6的冷冻保存用夹具。而且,实施例6的冷冻保存用夹具所具有的含有水溶性高分子化合物的层的涂布量以干燥时的固体成分量计为0.5g/m2。(实施例7)通过将太盛工业(株)制的经过亲水化处理的不锈钢多孔体(微孔直径1.5μm、空隙率65%、厚度1mm)作为保存液吸收体,浸渍于聚乙烯醇EG-05P的1质量%水溶液中,而进行浸涂,使之在室温下干燥,制作出图4所示的形态的具有含有水溶性高分子化合物的层的载放部。而且,实施例7的含有水溶性高分子化合物的层的涂布量以干燥时的固体成分量计为0.4g/m2。与实施例1相同,使该载放部与ABS树脂制的握持部接合,以图1所示的形态制作出实施例7的冷冻保存用夹具。(比较例2)除了在实施例2的冷冻保存用夹具的制作中,未进行向水溶液中的浸渍以外,与实施例2相同地制作出不具有含有水溶性高分子化合物的层的比较例2的冷冻保存用夹具。即,该冷冻保存用夹具是在经过易胶粘处理的透明PET膜(总光线透射率91%、雾度值5.5%)上夹隔着胶粘层(HenkelJapan(株)制的热熔聚氨酯树脂PurmeltQR170-7141P)贴合有经过亲水化处理的聚四氟乙烯多孔体(微孔直径0.2μm、空隙率71%、厚度35μm)的冷冻保存用夹具。(比较例3)除了在实施例7的冷冻保存用夹具的制作中,未进行向水溶液中的浸渍以外,与实施例7相同地制作出不具有含有水溶性高分子化合物的层的比较例3的冷冻保存用夹具。<玻璃化液的吸收性的评价>利用与前面的实施例1、比较例1中的冷冻操作相同的方法,将依次浸渍于修正磷酸缓冲液、平衡液、玻璃化液中的小鼠卵子与0.4μL的玻璃化液一起,使用ORIGIO公司制剥卵枪移液器滴加到实施例2~7、以及比较例2、比较例3的冷冻保存用夹具所具有的载放部上。对实施例2~6及比较例2,使用透射型光学显微镜进行观察,对实施例7和比较例3,使用反射型光学显微镜进行观察,同时依照以下的基准评价了滴加后的玻璃化液的吸收的样子。将这些结果表示于表2的“玻璃化液的吸收性”的项目中。依照以下的基准评价了玻璃化液的吸收性。◎:滴加玻璃化液后,在6秒以内,小鼠卵子周边的多余的玻璃化液被吸收、消失。○:滴加玻璃化液后,在6~30秒,小鼠卵子周边的多余的玻璃化液被吸收、消失。×:滴加玻璃化液后,在30秒的时刻,残留有小鼠卵子周边的多余的玻璃化液。<小鼠卵子的融解操作和剥离性的评价>对于使用了实施例2~7、以及比较例2、比较例3的冷冻保存用夹具的融解操作和剥离性的评价,利用与前面的实施例1、比较例1的各冷冻保存用夹具相同的方法进行了评价。其中,在实施例7和比较例3的评价中,除了透射型光学显微镜以外还使用了反射型光学显微镜。将其结果表示于表2的“融解时的剥离性”的项目中。[表2]玻璃化液的吸收性融解时的剥离性实施例2○◎实施例3○○实施例4◎○实施例5○○实施例6○○实施例7○○比较例2◎×比较例3◎×由表2的结果判明,利用本发明的冷冻保存用夹具,除了可以获得融解时的优异的剥离性以外,还可以获得玻璃化液的优异的吸收性。(实施例8)作为支承体使用经过易胶粘处理的透明PET膜(总光线透射率91%、雾度值5.5%),在该支承体上,以使干燥时的固体成分量为5g/m2的方式,利用滑动料斗方式涂布作为具有环氧乙烷基的聚乙烯醇的日本合成化学工业(株)制的GohsenexWO-320R(皂化度88.3mol%)的5质量%水溶液,在室温下使之干燥后,在120℃进行40小时加热处理,制作出在支承体上具有表面层的图2所示的形态的载放部。将该载放部裁割为2mm×20mm的大小(40mm2),使之与ABS树脂制的握持部接合,以图1所示的形态制作出实施例8的冷冻保存用夹具。另外,除了在上述实施例8的冷冻保存用夹具的制作中,直接使用透明PET膜作为载放部以外,同样地制作出冷冻保存用夹具。由此,该冷冻保存用夹具与前面记载的比较例1相同,因此在后述的表3中,将该冷冻保存用夹具作为比较例1记载。<小鼠胚的冷冻操作>将采集到的小鼠胚盘胞期胚胎在作为pH指示剂含有极低浓度的酚红的修正磷酸缓冲液(137mM的NaCl、2.7mM的KCl、0.9mM的CaCl2·2H2O、0.5mM的MgCl2·6H2O、1.5mM的KH2PO4、8mM的Na2HPO4、5.6mM的葡萄糖、0.3mM的丙酮酸Na、65μg/ml的硫酸地贝卡星、1mg/ml聚乙烯基吡咯烷酮、14.8mM的L-proline、200mM的海藻糖)中,在15℃的环境下浸渍10分钟。其后,暂时取出小鼠胚胎,然后将该小鼠胚胎在温度15℃的平衡液(7.5容量%DMSO(二甲亚砜)、7.5容量%乙二醇、17容量%牛胚胎血清、68容量%上述修正磷酸缓冲液)中浸渍5分钟。然后,将从平衡液中取出的小鼠胚胎浸渍在温度4℃的玻璃化液(15容量%DMSO(二甲亚砜)、15容量%乙二醇、14容量%牛胚胎血清、56容量%上述修正磷酸缓冲液、0.5M蔗糖)中。在30秒的在玻璃化液中的浸渍后,将小鼠胚胎载放于实施例8或比较例1的冷冻保存用夹具的载放部上,在透射型显微镜观察下,使用移液管尽可能地去除小鼠胚胎周边的多余的玻璃化液。其后,浸渍于液氮中,使之玻璃化冷冻。将冷冻了的冷冻保存用夹具直至融解前都保管在液氮保存容器中。<小鼠胚胎的融解操作和剥离性的评价>将载放有小鼠胚胎的实施例8或前述的比较例1的冷冻保存用夹具从液氮中取出,浸渍于温度37℃的融解液(在上述修正磷酸缓冲液中添加有1M蔗糖的溶液)中。利用透射型光学显微镜观察浸渍后的小鼠胚胎的样子,依照以下的基准对融解时的小鼠胚胎的剥离性进行了评价。将这些结果表示于表3的“细胞或组织的剥离性”的项目中。而且,表3中记载的比较例1如前所述,是直接使用经过易胶粘处理的透明PET膜作为载放部的冷冻保存用夹具。依照以下的基准评价了细胞或组织的剥离性。◎:将冷冻保存用夹具浸渍于融解液中时,可以一边摇动握持部一边剥离小鼠胚胎(剥离所需的时间少于20秒)。○:将冷冻保存用夹具浸渍于融解液中时,可以一边摇动握持部一边剥离小鼠胚胎(剥离所需的时间为20秒以上且少于40秒)。△:将冷冻保存用夹具浸渍于融解液中时,为了一边摇动握持部一边剥离小鼠胚胎,需要40~60秒。×:无法通过摇动握持部而在60秒以内剥离小鼠胚胎。[表3]细胞或组织的剥离性实施例8◎比较例1×由表3的结果判明,本发明的冷冻保存用夹具在融解时显示出优异的剥离性。(实施例9)作为支承体使用经过易胶粘处理的透明PET膜(总光线透射率91%、雾度值5.5%),在该支承体上作为胶粘层以使干燥时的固体成分量为30g/m2的方式涂布了HenkelJapan(株)制的热熔聚氨酯树脂PurmeltQR170-7141P。在胶粘层完全固化前,作为保存液吸收体,贴合AdvantechTOYO(株)制的经过亲水化处理的聚四氟乙烯多孔体(微孔直径0.2μm、空隙率71%、厚度35μm)。通过将如此得到的层叠体浸渍于作为具有乙二醇基的聚乙烯醇的日本合成化学工业(株)制的Nichigo-GpolymerAZF8035W(皂化度98.4mol%)的2质量%水溶液中,而进行了浸涂,在室温下使之干燥后,在120℃进行40小时加热处理,制作出图5所示的形态的具有表面层的载放部。而且,表面层的固体成分量为1.6g/m2。与实施例8相同,将该载放部裁割为2mm×20mm的大小,其后使之与ABS树脂制的握持部接合,以图1所示的形态制作出实施例9的冷冻保存用夹具。(实施例10)除了使用作为具有乙二醇基的聚乙烯醇的日本合成化学工业(株)制的Nichigo-GpolymerOKS-8041(皂化度88.9mol%)的2质量%水溶液进行了浸涂以外,与实施例9相同地制作出实施例10的冷冻保存用夹具。而且,实施例10的冷冻保存用夹具所具有的表面层的固体成分量为1.6g/m2。(实施例11)除了使用作为具有环氧乙烷基的聚乙烯醇的GohsenexWO-320R(皂化度88.3mol%)的2质量%水溶液进行了浸涂以外,与实施例9相同地制作出实施例11的冷冻保存用夹具。而且,实施例11的冷冻保存用夹具所具有的表面层的固体成分量为1.6g/m2。(实施例12)除了将GohsenexWO-320R的水溶液的浓度设为0.5质量%以外,与实施例11相同地制作出实施例12的冷冻保存用夹具。而且,实施例12的冷冻保存用夹具所具有的表面层的固体成分量为0.5g/m2。(实施例13)除了使用作为具有环氧乙烷基的聚乙烯醇的日本合成化学工业(株)制的GohsenexWO-320N(皂化度99mol%)的2质量%水溶液进行了浸涂以外,与实施例9相同地制作出实施例13的冷冻保存用夹具。而且,实施例13的冷冻保存用夹具所具有的表面层的固体成分量为1.6g/m2。(实施例14)除了使用作为聚乙烯醇的(株)Kuraray制的PVA103(皂化度98.5mol%)的2质量%水溶液进行了浸涂以外,与实施例9相同地制作出实施例14的冷冻保存用夹具。而且,实施例14的冷冻保存用夹具所具有的表面层的固体成分量为1.6g/m2。另外,作为比较例,除了在前述的实施例9的冷冻保存用夹具的制作中,未进行向水溶液中的浸渍以外,也与实施例9相同地制作出不具有表面层的冷冻保存用夹具。该冷冻保存用夹具是在经过易胶粘处理的透明PET膜(总光线透射率91%、雾度值5.5%)上夹隔着胶粘层(HenkelJapan(株)制的热熔聚氨酯树脂PurmeltQR170-7141P)贴合有经过亲水化处理的聚四氟乙烯多孔体(微孔直径0.2μm、空隙率71%、厚度35μm)的冷冻保存用夹具,与前述的比较例2相同。由此,在后述的表4中,将该冷冻保存用夹具作为比较例2记载。<保存液的吸收性的评价>利用与前面的实施例8、比较例1中的冷冻操作相同的方法,将依次浸渍于修正磷酸缓冲液、平衡液、玻璃化液中的小鼠胚胎与0.3μL的玻璃化液一起,使用ORIGIO公司制剥卵枪移液器滴加到实施例9~14、以及比较例2的冷冻保存用夹具所具有的载放部上。在使用反射型光学显微镜观察滴加后的玻璃化液的吸收的样子的同时,依照以下的基准进行了评价。将这些结果表示于表4的“保存液的吸收性”的项目中。依照以下的基准评价了保存液的吸收性。◎:滴加玻璃化液后,在6秒以内,小鼠胚胎周边的多余的玻璃化液被吸收、消失。○:滴加玻璃化液后,在6~30秒,小鼠胚胎周边的多余的玻璃化液被吸收、消失。×:滴加玻璃化液后,在30秒的时刻,残留有小鼠胚胎周边的多余的玻璃化液。<小鼠胚胎的融解操作和剥离性的评价>对于使用了实施例9~14、以及比较例2的冷冻保存用夹具的融解操作和剥离性的评价,利用与前面的实施例8、比较例1的各冷冻保存用夹具相同的方法进行了评价。将其结果表示于表4的“细胞或组织的剥离性”的项目中。[表4]保存液的吸收性细胞或组织的剥离性实施例9○○实施例10○◎实施例11○◎实施例12◎○实施例13○○实施例14○△比较例2◎×由表4的结果判明,利用本发明的冷冻保存用夹具,除了可以获得融解时的优异的剥离性以外,还可以获得玻璃化液的优异的吸收性。(实施例15)作为支承体使用经过易胶粘处理的透明PET膜(总光线透射率91%、雾度值5.5%),在该支承体上,以使干燥时的固体成分量为5g/m2的方式,利用滑动料斗方式涂布作为皂化度为94mol%以下的聚乙烯醇的(株)Kuraray制的PVA505(皂化度73.5mol%、聚合度500)的5质量%水溶液,在室温下使之干燥后,在120℃进行40小时加热处理,制作出在支承体上具有表面层的图2所示的形态的载放部。将该载放部裁割为2mm×20mm的大小(40mm2),使之与ABS树脂制的握持部接合,以图1所示的形态制作出实施例15的冷冻保存用夹具。另外,除了在上述实施例15的冷冻保存用夹具的制作中,直接使用透明PET膜作为载放部以外,同样地制作出冷冻保存用夹具。由此,该冷冻保存用夹具与前面记载的比较例1相同,因此后述的表5中,将该冷冻保存用夹具作为比较例1记载。<小鼠胚胎的冷冻操作>除了作为冷冻保存用夹具,分别使用了实施例15及比较例1的冷冻保存用夹具以外,利用与使用了上述的实施例8的冷冻保存用夹具的小鼠胚胎的冷冻操作相同的方法,使小鼠胚胎玻璃化冷冻。将冷冻了的冷冻保存用夹具直至融解前都保管在液氮保存容器中。<小鼠胚胎的融解操作和剥离性的评价>将载放有小鼠胚胎的实施例15或前述的比较例1的冷冻保存用夹具从液氮中取出,浸渍于温度37℃的融解液(在上述修正磷酸缓冲液中添加有1M蔗糖的溶液)中。浸渍后,在用透射型光学显微镜观察小鼠胚胎的样子的同时,进行了融解操作。在融解操作时,在使冷冻保存用夹具上的小鼠胚胎刚刚浸渍于融解液中后30秒,不进行从冷冻保存用夹具上回收小鼠胚胎的操作,使冷冻保存用夹具上的小鼠胚胎静静地浸渍于融解液中。经过30秒后,摇动冷冻保存用夹具的握持部而对载放部施加振动,或使用移液管施加抽吸压力,由此在小鼠胚胎的融解液浸渍后经过60秒之前进行回收操作。对上述融解操作时的小鼠胚胎的剥离性依照以下的基准进行了评价。将这些结果表示于表5的“细胞或组织的剥离性”的项目中。依照以下的基准评价了细胞或组织的剥离性。◎:在融解操作时,容易剥离载放部上的小鼠胚胎(仅用上下左右摇动握持部的操作就会比较良好地剥离)。○:在融解操作时,可以剥离载放部上的小鼠胚胎(仅用上下左右摇动握持部的操作就可以剥离)。△:在融解操作时,可以剥离载放部上的小鼠胚胎,然而略难剥离。×:在60秒以内无法剥离小鼠胚胎。[表5]细胞或组织的剥离性实施例15◎比较例1×由表5的结果判明,本发明的冷冻保存用夹具在融解时显示出优异的剥离性。(实施例16)作为支承体使用经过易胶粘处理的透明PET膜(总光线透射率91%、雾度值5.5%),在该支承体上作为胶粘层以使干燥时的固体成分量为30g/m2的方式涂布了HenkelJapan(株)制的热熔聚氨酯树脂PurmeltQR170-7141P。在胶粘层完全固化前,作为保存液吸收体,贴合AdvantechTOYO(株)制的经过亲水化处理的聚四氟乙烯多孔体(微孔直径0.2μm、空隙率71%、厚度35μm)。通过将如此得到的层叠体浸渍于作为皂化度为94mol%以下的聚乙烯醇的PVA505(皂化度73.5mol%、聚合度500)的2质量%水溶液中,而进行了浸涂,在室温下使之干燥后,在120℃进行40小时加热处理,制作出图5所示的形态的具有表面层的载放部。而且,表面层的固体成分量为1.6g/m2。与实施例15相同,将该载放部裁割为2mm×20mm的大小,其后使之与ABS树脂制的握持部接合,以图1所示的形态制作出实施例16的冷冻保存用夹具。(实施例17)除了使用作为皂化度为94mol%以下的聚乙烯醇的(株)Kuraray制的PVA217(皂化度88mol%、聚合度1700)的2质量%水溶液进行了浸涂以外,与实施例16相同地制作出实施例17的冷冻保存用夹具。而且,实施例17的冷冻保存用夹具所具有的表面层的固体成分量为1.6g/m2。(实施例18)除了使用作为皂化度为94mol%以下的聚乙烯醇的(株)Kuraray制的PVA205(皂化度88mol%、聚合度500)的2质量%水溶液进行了浸涂以外,与实施例16相同地制作出实施例18的冷冻保存用夹具。而且,实施例18的冷冻保存用夹具所具有的表面层的固体成分量为1.6g/m2。(实施例19)除了使用作为皂化度为94mol%以下的聚乙烯醇的日本合成化学工业(株)制的GOHSENOLEG03P(皂化度88mol%、聚合度300)的2质量%水溶液进行了浸涂以外,与实施例16相同地制作出实施例19的冷冻保存用夹具。而且,实施例19的冷冻保存用夹具所具有的表面层的固体成分量为1.6g/m2。(实施例20)除了使用作为聚乙烯醇的(株)Kuraray制的PVA105(皂化度98.5mol%、聚合度500)的2质量%水溶液进行以外,与实施例16相同地制作出实施例20的冷冻保存用夹具。而且,实施例20的冷冻保存用夹具所具有的表面层的固体成分量为1.6g/m2。另外,作为比较例,除了在前述的实施例16的冷冻保存用夹具的制作中,未进行向水溶液中的浸渍以外,也与实施例16相同地制作出不具有表面层的冷冻保存用夹具。该冷冻保存用夹具是在经过易胶粘处理的透明PET膜(总光线透射率91%、雾度值5.5%)上夹隔着胶粘层(HenkelJapan(株)制的热熔聚氨酯树脂PurmeltQR170-7141P)贴合有经过亲水化处理的聚四氟乙烯多孔体(微孔直径0.2μm、空隙率71%、厚度35μm)的冷冻保存用夹具,与前述的比较例2相同。由此,在后述的表6中,将该冷冻保存用夹具作为比较例2记载。<保存液的吸收性的评价>利用与前面的实施例15、比较例1中的冷冻操作相同的方法,将依次浸渍于修正磷酸缓冲液、平衡液、玻璃化液中的小鼠胚胎与0.4μL的玻璃化液一起,使用ORIGIO公司制剥卵枪移液器滴加到实施例16~20、以及比较例2的冷冻保存用夹具所具有的载放部上。在使用反射型光学显微镜观察滴加后的玻璃化液的吸收的样子的同时,依照以下的基准进行了评价。将这些结果表示于表6的“保存液的吸收性”的项目中。依照以下的基准评价了保存液的吸收性。○:滴加玻璃化液后,在30秒以内,小鼠胚胎周边的多余的玻璃化液被吸收。×:滴加玻璃化液后,在30秒的时刻,残留有小鼠胚胎周边的多余的玻璃化液。<小鼠胚胎的融解操作和剥离性的评价>对于使用了实施例16~20、以及比较例2的冷冻保存用夹具的融解操作和剥离性的评价,利用与前面的实施例15、比较例1的各冷冻保存用夹具相同的方法进行了评价。将其结果表示于表6的“细胞或组织的剥离性”的项目中。[表6]保存液的吸收性细胞或组织的剥离性实施例16○◎实施例17○○实施例18○○实施例19○◎实施例20○△比较例2○×由表6的结果判明,利用本发明的冷冻保存用夹具,除了可以获得融解时的优异的剥离性以外,还可以获得玻璃化液的优异的吸收性。(实施例21)作为支承体使用经过易胶粘处理的透明PET膜(总光线透射率91%、雾度值5.5%),在该支承体上作为胶粘层以使干燥时的固体成分量为30g/m2的方式涂布HenkelJapan公司制的热熔聚氨酯树脂PurmeltQR170-7141P。在胶粘层完全固化前,作为保存液吸收体,贴合AdvantechTOYO(株)制的纤维素混合酯多孔体(微孔直径0.2μm、空隙率73%、厚度133μm)。通过将如此得到的层叠体浸渍于作为二氧化硅浓度包含20质量%的日产化学工业公司制的作为胶态二氧化硅的ST-ZL(平均粒径85nm)、作为聚乙烯醇的固体成分浓度包含1质量%的日本合成化学工业公司制的高纯度聚乙烯醇EG-05P(皂化度86.5~89mol%)的水溶液(涂布液)中,而进行了浸涂,使之在室温下干燥后,再在120℃进行1天加热处理,制作出在表面具有水溶性高分子化合物和无机微粒的载放部。而且,此时的无机微粒的固体成分涂布量为3g/m2。将该载放部裁割为2mm×20mm的大小(40mm2),其后使之与ABS树脂制的握持部接合,以图1所示的形态制作出实施例21的冷冻保存用夹具。(实施例22)<气相法二氧化硅分散液的制作>水430份改性乙醇22份阳离子性聚合物3份(二甲基二烯丙基氯化铵均聚物、第一工业制药公司制、SHAROLDC902P、平均分子量9000)气相法二氧化硅100份(平均一次粒径7nm、基于BET法的比表面积300m2/g)向分散介质的水和改性乙醇中添加二甲基二烯丙基氯化铵均聚物,然后添加气相法二氧化硅,进行预分散而制作出粗分散液。然后对该粗分散液利用高压均质器进行2次处理,制作出二氧化硅浓度为20质量%的气相法二氧化硅的分散液。气相法二氧化硅的平均粒径为100nm。除了在实施例21的冷冻保存用夹具的制作中,使用了作为二氧化硅浓度包含10质量%的上述气相法二氧化硅分散液、作为聚乙烯醇的固体成分浓度包含1质量%的聚乙烯醇EG-05P的水溶液以外。与实施例21相同地制作出实施例22的冷冻保存用夹具。而且,此时的无机微粒的固体成分涂布量为3g/m2。(实施例23)除了在实施例21的冷冻保存用夹具的制作中,作为夹隔着胶粘层贴合于支承体的保存液吸收体,在纤维素混合酯多孔体以外,还使用了AdvantechTOYO(株)制的经过亲水化处理的聚四氟乙烯多孔体(微孔直径0.2μm、空隙率71%、厚度35μm)以外,与实施例21相同地制作出实施例23的冷冻保存用夹具。而且,此时的无机微粒的固体成分涂布量为3g/m2。(实施例24)除了在实施例23的冷冻保存用夹具的制作中,作为层叠体的浸涂中所用的涂布液,使用了作为二氧化硅浓度包含5质量%的日产化学工业公司制的作为胶态二氧化硅的MP-4540(平均粒径450nm)、作为聚乙烯醇的固体成分浓度包含2质量%的聚乙烯醇EG-05P的水溶液以外,与实施例23相同地制作出实施例24的冷冻保存用夹具。而且,此时的无机微粒的固体成分涂布量为1g/m2。使用扫描型电子显微镜观察了实施例24的冷冻保存用夹具的载放部的表面,其结果是,观察到如图10所示的显微镜观察像。图10中,比例尺为5μm。(实施例25)除了在实施例23的冷冻保存用夹具的制作中,作为层叠体的浸涂中所用的涂布液,使用了作为二氧化硅浓度包含20质量%的GEHealthcareJapan公司制的作为胶态二氧化硅的Percoll(平均粒径30nm)、作为聚乙烯醇的固体成分浓度包含1质量%的聚乙烯醇EG-05P的水溶液以外,与实施例23相同地制作出实施例25的冷冻保存用夹具。而且,此时的无机微粒的固体成分涂布量为1g/m2。(实施例26)除了在实施例21的冷冻保存用夹具的制作中,作为支承体使用经过易胶粘处理的透明PET膜(总光线透射率91%、雾度值5.5%),将该支承体浸渍于与实施例21相同的涂布液中,由此进行了浸涂,使之在室温下干燥以外,与实施例21相同地制作出实施例26的冷冻保存用夹具。而且,此时的无机微粒的固体成分量为3g/m2。(比较例4)除了在实施例21的冷冻保存用夹具的制作中,将作为保存液吸收体具有纤维素混合酯多孔体的层叠体不进行浸涂地直接用作载放部以外,同样地制作出比较例4的冷冻保存用夹具。除了在实施例21的冷冻保存用夹具的制作中,直接使用透明PET膜作为载放部以外,同样地制作出冷冻保存用夹具。由此,该冷冻保存用夹具与前面记载的比较例1相同,因此在后述的表7中,将该冷冻保存用夹具作为比较例1记载。此外除了在前述的实施例23的冷冻保存用夹具的制作中,将包含聚四氟乙烯多孔体的层叠体不进行浸涂地直接作为载放部使用以外,同样地制作出冷冻保存用夹具。该冷冻保存用夹具是在经过易粘附处理的透明PET膜(总光线透射率91%、雾度值5.5%)上夹隔着粘附层(HenkelJapan(株)制的热熔聚氨酯树脂PurmeltQR170-7141P)贴合有经过亲水化处理的聚四氟乙烯多孔体(微孔直径0.2μm、空隙率71%、厚度35μm)的冷冻保存用夹具,与前述的比较例2相同。由此,在后述的表7中,将该冷冻保存用夹具作为比较例2记载。<人肝细胞球状体的制作>人肝细胞球状体是使用住友BAKELITE公司制的PrimeSurface(注册商标)96U多孔板制作。在培养皿上,对用添加有10%的血清的伊格尔最小必需培养基(EMEM)增殖了的HepG2细胞利用胰蛋白酶处理从培养皿中剥离、回收后,以每1孔中50cell的细胞浓度接种到PrimeSurface96U多孔板上。在37℃、2%CO2的条件下,在多孔板上培养3天后,确认了球状体的形成。从球状体中,选择形状接近球形、并且直径接近100μm的球状体,用于以后的评价试验中。<球状体的冷冻操作>将1个球状体浸渍于玻璃化液(30容量%乙二醇、0.5容量%甘油、69.5%下述修正磷酸缓冲液、0.5M蔗糖)中后,与玻璃化液一起,载放于实施例21~26及比较例1、比较例2、比较例4的冷冻保存用夹具的载放部上。在冷冻操作时,对于实施例23~26、比较例1、比较例2,如以往的一般的操作所示,在透射型显微镜下观察的同时进行操作。在实施例21、实施例22、以及比较例4的情况下,由于载放部的透光性低,因此在使用反射型显微镜观察的同时进行操作。另外,对于具有实施例26和比较例1以外的保存液吸收体的冷冻保存用夹具,在透射型显微镜或反射型显微镜下,确认球状体周边的玻璃化液被充分地除去后,浸渍于液氮中而进行冷冻。对于实施例26和比较例1的冷冻保存用夹具,在透射型显微镜下,使用移液管,尽可能充分地除去球状体周边的玻璃化液后,浸渍于液氮中进行冷冻。<融解操作和剥离性的评价>将载放有球状体的实施例21~26及比较例1、比较例2、比较例4的冷冻保存用夹具从液氮中取出,浸渍于温度37℃的融解液(向修正磷酸缓冲液(137mM的NaCl、2.7mM的KCl、0.9mM的CaCl2·2H2O、0.5mM的MgCl2·6H2O、1.5mM的KH2PO4、8mM的Na2HPO4、5.6mM的葡萄糖、0.3mM的丙酮酸Na、65μg/ml的硫酸地贝卡星、1mg/ml的聚乙烯基吡咯烷酮、14.8mM的L-proline、200mM的海藻糖)中添加有1M蔗糖的溶液)中。在用透射型光学显微镜或反射型显微镜观察浸渍后的球状体的样子的同时,使用移液管,进行从载放部的球状体的回收操作,对融解时的球状体的剥离性依照以下的基准进行了评价。将这些结果表示于表7的“细胞或组织的剥离性”的项目中。◎:将冷冻保存用夹具浸渍于融解液中时,通过将握持部上下左右摇动或吸液,可以在30秒以内将球状体从设备中剥离。〇:将冷冻保存用夹具浸渍于融解液中时,将握持部上下左右摇动或吸液,从设备中剥离球状体需要30秒~1分钟。×:无法在1分钟以内剥离球状体。[表7]细胞或组织的剥离性实施例21◎实施例22◎实施例23◎实施例24◎实施例25◎实施例26◎比较例1×比较例2×比较例4×<保存液的吸收性>将1个球状体浸渍于玻璃化液(30容量%乙二醇、0.5容量%甘油、69.5%上述修正磷酸缓冲液、0.5M蔗糖)中后,与玻璃化液一起载放于冷冻保存用夹具的载放部上时,评价了保存液的吸收性。具有保存液吸收体的实施例21~25的冷冻保存用夹具具有良好的吸收性,不需要使用移液管等除去多余的玻璃化液的操作。尤其是实施例24显示出优异的吸收性,在10秒以内多余的玻璃化液被吸收、除去。<细胞或组织的观察性>将1个球状体浸渍于玻璃化液(30容量%乙二醇、0.5容量%甘油、69.5%上述修正磷酸缓冲液、0.5M蔗糖)中后,与玻璃化液一起载放于冷冻保存用夹具的载放部上时,作为细胞或组织的观察性评价了在透射型显微镜下观察球状体时的操作性。与实施例21、实施例22的冷冻保存用夹具相比,实施例23~26的冷冻保存用夹具能够更加清楚地观察被载放的球状体的形态。产业上的可利用性本发明除了可以用于牛等家畜、动物的胚胎移植和人工授精、对人的人工授精等以外,还可用于iPS细胞、ES细胞、一般使用的培养细胞、从活体采集的检查用或移植用的细胞或组织、在活体外培养的细胞或组织等的冷冻保存。符号的说明1握持部,2、2a~2h载放部,3表面层,4支承体,5保存液吸收体,6胶粘层,7冷冻保存用夹具,8无机微粒,9微孔(气孔)。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1