具有聚集诱导发光性质的荧光探针及其制备方法和用途与流程
本发明属于表面活性剂检测领域,特别涉及一种阴离子表面活性剂的检测方法。
背景技术:
阴离子表面活性剂,尤其是烷基磺酸盐是商品中最重要的表面活性剂并被大量生产,如:十二烷基苯磺酸钠(sdbs),月桂基硫酸钠(sls),十二烷基硫酸钠(sds)等。它们在清洁、农业、化妆品和医药工业被广泛用作洗涤剂、乳化剂、起泡剂和分散剂。由于它们的应用广泛,其在水体中的残余物对生态环境可能造成严重危害,如:抑制水生物活性,加速油质污染物的扩散。此外,阴离子表面活性剂可能对人眼和皮肤造成刺激并引起发炎。为了使阴离子表面活性剂的检测甚至在家中或者偏远地区也可实施,非常需要发展一种操作简单、成本低廉的有效的检测方法。目前,在文献中,已经报道了大量的用于检测阴离子表面活性剂的方法,如gc/lc-ms,比色法、电势测定法、免疫分析法、毛细管电泳和流动注射分析法。然而,这些方法还存在着以下缺点,如:需要大型固定仪器、操作繁琐、使用有毒的氯代溶剂和难以原位分析。
近年来,荧光法检测阴离子表面活性剂显示出了显著的优点,如:灵敏度高、操作简单成本低。然而,具有聚集诱导荧光淬灭(acq)性质的荧光材料在聚集态下,容易发生荧光的自淬灭,而且其自身在溶液态的高背景荧光也会明显降低检测过程中的信噪比。
与聚集诱导荧光淬灭(acq)相反,具有聚集诱导发光(aie)性质的荧光探针,在稀溶液中发光很弱,但在聚集态发光很强。通过形成发光聚集体,aie探针已被广泛用于检测金属离子、酶、dna等。此外,aie分子还被用于检测临界胶束浓度、监测胶束包裹的药物释放、利用荧光成像监测胶束的形态转变等过程。
技术实现要素:
:
本发明的目的是提供一种具有聚集诱导发光(aie)性质的荧光探针,其可以用于检测阴离子表面活性剂。
本发明的又一目的是提供上述荧光探针的制备方法以及其用途。
本发明目的基于如下技术方案实现:
一种式i所示的化合物:
其中:
r1,r2独立的为氢、c1-18烷基、卤素、c1-18烷基氧基、c1-18烷基硫基、芳基、杂芳基;r3,r4,r5独立的为c1-30烷基;r6为直键、c1-6亚烷基;a-为阴离子。
所述的烷基可为直链或支链烷基;例如,甲基、乙基、丙基、丁基、异丁基、叔丁基等。
所述的芳基指具有6-20个碳原子的单环或多环芳族基团,代表性的芳基包括:苯基、萘基、蒽基、芘基等。
所述的杂芳基指具有1-20个碳原子、1-4个选自n、s、o杂原子的单环或多环杂芳族基团,代表性的杂芳基包括:吡咯基、吡啶基、嘧啶基、咪唑基、噻唑基、吲哚基、氮杂萘基、氮杂蒽基、氮杂芘基等。
在一个实施方式中,r1,r2独立的为氢、c1-6烷基、卤素、c1-6烷基氧基、c1-6烷基硫基。
在另一个实施方式中,r3,r4,r5中至少一个为c8-30烷基,更优选为c10-24烷基,又优选为c12-22烷基,或c14-20烷基。
在又一个实施方式中,r3,r4,r5中的一个基团为长链烷基,而另两个基团为短链烷基,例如,r3,r4,r5中的一个基团为c8-30烷基,更优选为c10-24 烷基,又优选为c12-22烷基,或c14-20烷基;而另两个基团独立的为c1-8烷基,更优选为c1-6烷基。
在又一个实施方式中,r6为直键、-ch2-、-ch2ch2-、-ch2ch2ch2-。
优选的,所述阴离子为卤离子、高氯酸根离子、硫酸根离子、硝酸根离子、六氟磷酸根离子等。所述卤离子优选为氯离子。
优选的,所述通式i为如下通式(ia):
其中,r1、r2、r3、r4、r5、a-如上述所定义。
优选的,式ia中,r1为氢,r2为氢,r3,r4为甲基,r5为十八烷基,a-为阴离子。
更优选,式i化合物选自:
n-(3-(苯并[d]噻唑-2-基)-4-羟基苄基)-n,n-二甲基十八烷基-1-氯化铵;
本发明还提供了一种上述式i化合物的制备方法,包括将式ii化合物与式iii化合物在质子酸催化和氧化试剂的氧化下,反应得到式i化合物:
其中,r1、r2、r3、r4、r5、r6、a-如上述所定义。
优选的,所述质子酸为浓盐酸,所述氧化试剂是双氧水。
所述式ii化合物可由如下制备方法获得,包括:将式iv化合物与式v化合物反应得到式ii化合物。
其中,r2、r3、r4、r5、r6、a-如上述所定义。
本发明所述的式i化合物具有聚集诱导发光(aie)性质。所述结构中包括2-(2'-羟基苯基)苯并噻唑(hbt)分子骨架,其具有分子内六元环氢键和连接苯并噻唑单元和取代苯单元的c–n单键。由于其激发态质子分子内转移过程(esipt)性质,具有醇式和酮式发射,分别具有正常的斯托克位移和很大的斯托克位移(大于150nm)。由于分子内氢键容易受到极性溶剂的破坏,醇式和酮式的发射比例与分子所处环境的极性高度相关。在极性溶剂中,所述化合物仅表现为醇式发光。而在聚集态时,分子结构之间会紧密排列,抑制分子内c–n单键的旋转,且会保护分子内氢键免受外界环境的干扰。由于所述化合物的荧光发射对环境的极性和分子的聚集态非常敏感,因此它们特别适于作为表面活性剂的传感材料。
相对于单一的阳离子或阴离子表面活性剂体系,即使在远低于各自临界胶束浓度的情况下,具有相反电荷的表面活性剂的混合体系在溶液中亦倾向于形成阴阳离子聚集体或胶束,这是由于静电和疏水的协同作用会有效降低表面张力造成的。本发明基于aie染料在聚集态高效发光的特性,利用具有aie性质的带正电的两亲性探针分子(式i化合物),通过原位形成阴阳离子聚集体或胶束来检测阴离子表面活性剂。通过在聚集体中分子间的紧密排列,hbt骨架的分子内运动被限制且分子内氢键被保护以防止环境干扰(见图1)。
进而,本发明还提供了所述式i化合物在检测阴离子表面活性剂中的用途。
根据本发明,所述的阴离子表面活性剂可为羧酸盐、硫酸酯盐、磺酸盐和磷酸酯盐。优选的,所述的阴离子表面活性剂为连接有磺酸基团的阴离子表面活性剂,例如十二烷基苯磺酸钠(sdbs),十二烷基硫酸钠(sds)等。
本发明所述的化合物与阴离子表面活性剂形成阴阳离子聚集体。在极性溶 剂中,当本发明所述化合物与阴离子表面活性剂形成的阴阳离子胶束的浓度高于其临界胶束浓度时,本发明所述化合物与阴离子表面活性剂会形成阴阳离子胶束。使得本发明所述的化合物所处的微环境极性变小。从而保护了所述化合物分子内的氢键。所述的混合体系中阴阳离子胶束的临界浓度显著低于阴离子表面活性剂的临界胶束浓度。
本发明所述的化合物可用于监测阴阳离子胶束的形成过程,具有高效且灵敏的优点。本发明所述的化合物针对阴离子表面活性剂的检测限(3δ/s)小于0.08μm,远低于基于亚甲基蓝分光光度法的国家标准(检测限约为0.14μm)。
此外,基于激发态分子内质子转移(esipt)和分子内运动受限(rim)机制,在阴离子表面活性剂浓度较低时,式i化合物的酮式/烯醇式的发光比率与阴离子表面活性剂的浓度成线性关系,因此,可以通过式i化合物的酮式/烯醇式的发光比率来定量确定水中表面活性剂的浓度。
本发明还提供了一种检测阴离子表面活性剂的方法,包括,在阴离子表面活性剂的溶液中加入本发明所述的式i化合物,在荧光下观察或检测荧光光谱。
本发明所述的化合物在水溶液中具有微弱的荧光发射,但当其与阴离子表面活性剂结合生成聚集体后会发出很强的荧光,因此,它可以用作优异的点亮探针,实现对负电荷外膜包围的细菌的免洗荧光成像。
进一步的,本发明提供了式i化合物在细菌免洗荧光染色的用途。
根据本发明,所述的细菌为具有负电荷外膜包围的细菌,例如大肠杆菌、枯草杆菌、金黄色葡萄球菌等。
本发明所述的式i化合物可被用于直接染色细菌而无需进一步洗涤步骤。并且表现出非常低的针对细菌的毒性,有利于其针对细菌的荧光染色实验。
由于细菌的外膜是由带负电荷的两亲性分子组成的,而本发明所述的式i化合物是带有正电荷的两亲性分子,因此其可以通过静电及疏水作用与细菌外膜形成强的亲和力;与之结合后,所述化合物的转动等分子内运动会受到限制,根据聚集诱导发光的机制,分子内运动受限后,其发光会明显增强。而溶解在溶液中的未与细菌结合的所述化合物,由于分子内运动,导致发光很弱。可见,本发明所述的化合物与细菌结合后发强荧光,而在溶液中发光微弱,在该高对比度下,仅观察到细菌上的荧光信号。而传统的荧光材料,在稀溶液中发光很 强,因此需要离心洗涤,除去稀溶液中的荧光分子,才可以用于观察细菌上的荧光信号。
本发明还提供一种细菌免洗荧光染色的方法,包括,将本发明所述的式i化合物与细菌共培养,无需分离直接观察其荧光,例如使用激光扫描共焦显微镜进行观察。
本发明至少具有以下有益效果:
1、本发明所述的化合物针对阴离子表面活性剂的检测限(3δ/s)小于0.8μm,远低于基于亚甲基蓝分光光度法的国家标准,且不需要氯仿等有毒试剂的萃取、浓缩,可以直接原位进行检测,操作十分方便。
2、本发明所述的化合物可以用作优异的点亮探针,能够对细菌进行免洗荧光成像,无需分离。
3、本发明所述化合物制备简单。
附图说明
图1为加入sdbs之前和之后的hbt-c18的假设的堆积模型。具有aie性质的荧光探针hbt-c18通过形成胶束点亮检测阴离子表面活性剂。
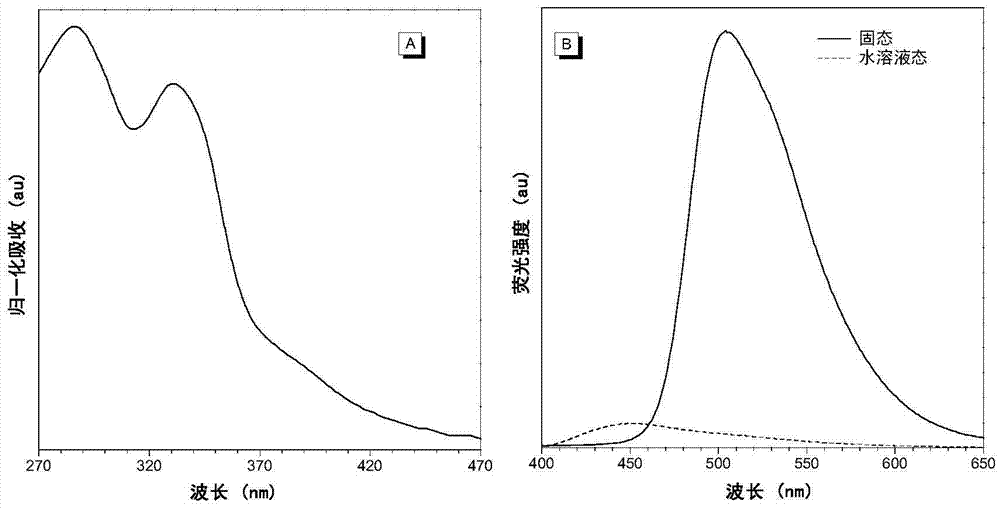
图2(a)为hbt-c18在h2o/dmso(99:1,v/v)的溶液中的归一化的紫外吸收光谱;(b)为hbt-c18在h2o/dmso(99:1,v/v)的溶液中及固态下的荧光发射光谱。[hbt-c18]=5μm;λex=334nm。
图3(a)为随着sdbs浓度的增加hbt-c18(5μm)在h2o/dmso(99:1,v/v)的溶液中的荧光发射谱图;(b)为随着sdbs浓度的增加,hbt-c18在510nm和450nm处的荧光发射强度变化;(c)为随着sdbs浓度的增加,hbt-c18在510nm和450nm处的荧光发射强度的比例(i510/i450)变化。λex=334nm.
图4为hbt-c18(5μm)在h2o/dmso(99:1,v/v)中随sdbs浓度变化的荧光量子产率。
图5为hbt-c18在不同sdbs浓度下(0,2.0,8.0μm)的(a)归一化紫外吸收和(b)荧光发射光谱图。[hbt-c18]=5μm;λex=334nm.
图6为hbt-c18在510nm和450nm处的荧光发射强度的比例(i510/i450)随sdbs浓度的变化。λex=334nm.内部为线性回归方程。
图7(a)为hbt-c18在510nm和450nm处的(i510/i450)荧光发射强度的比例对sdbs浓度的对数作图;(b)为通过动态光散射测得的胶束粒径,pdi=0.434;(c)、(d)为hbt-c18(5μm)/sdbs(8μm)在h2o/dmso(99:1,v/v)溶液中形成的胶束的(c)sem和(d)tem图。
图8为在不同表面活性剂及离子的存在下,hbt-c18在510nm和450nm处的荧光发射强度的比例(i510/i450)变化。
图9为明场和荧光下的大肠杆菌的染色照片。(hbt-c18=10μm).比例尺=10μm.
图10为e.coli细菌在不同浓度hbt-c18(0,10,20,40,60,80和100μm)下的存活率图。
具体实施方式
下面结合具体实施例和说明书附图,对本发明作进一步阐述。
实施例1
按照如下合成路线,具体合成以下化合物:
(1)n-(3-甲酰基-4-羟基苄基)-n,n-二甲基十八烷基-1-氯化铵(化合物3)的合成
在回流条件下将5-(氯甲基)-2-羟基水杨醛(340mg,2mmol)和n,n-二甲基十八烷-1-胺(594mg,2mmol)的混合物搅拌5小时。在反应完成后,过滤出沉淀并用乙醚洗涤(10ml×2),在真空下干燥得到白色固体产物化合物3,产率为90%(841mg).
1hnmr(cdcl3,500mhz):δ11.26(brs,1h),8.16(d,j=3.5hz,1h),7.80(d,j=8.5hz,1h),7.09(d,j=8.5hz,1h),5.21(d,j=8.5hz,2h),3.47(t,j=8.5hz,2h),3.27(s,6h),1.26–1.25(m,32h),0.88(t,j=7.0hz,3h);13cnmr(d6-dmso,125mhz):190.0,162.3,140.1,132.9,122.5,118.8,118.0,65.3,63.1, 48.7,31.3,29.0,29.0,28.9,28.76,28.66,28.5,25.8,22.1,21.7,13.9;hrms(esi):m/z[m-cl]+计算值为c28h50no2:432.3836;实际测量值为:432.3845.
(2)n-(3-(苯并[d]噻唑-2-基)-4-羟基苄基)-n,n-二甲基十八烷基-1-氯化铵(hbt-c18)的合成
在n-(3-甲酰基-4-羟基苄基)-n,n-二甲基十八烷基-1-氯化铵(467mg,1.0mmol)和2-氨基苯硫酚(150mg,1.2mmol)的甲醇溶液中加入浓hcl(37wt.%,100mg,1.0mmol),所得混合液在室温下搅拌10分钟。随后在混合液中加入h2o2(30wt.%,113mg,1.0mmol),并进一步在室温下搅拌2小时。在反应完成后,蒸发掉溶剂,所得剩余物用二氯甲烷/正己烷重结晶,得到白色固体产物n-(3-(苯并[d]噻唑-2-基)-4-羟基苄基)-n,n-二甲基十八烷基-1-氯化铵(hbt-c18)(120mg,产率21%)
1hnmr(cdcl3,500mhz):δ12.87(brs,1h),8.28(s,1h),7.97(d,j=8.0hz,1h),7.85(d,j=7.5hz,1h),7.63(d,j=8.0hz,1h),7.49(t,j=8.0hz,1h),7.40(t,j=8.0hz,1h),7.15(d,j=7.0hz,1h),5.17(s,2h),3.47(t,j=7.5hz,2h),3.31(s,6h),1.26–1.23(m,32h),0.88(t,j=7.0hz,3h);
13cnmr(cdcl3,125mhz):168.2,159.7,136.8,133.7,132.7,126.9,126.0,122.1,121.8,118.8,118.2,117.3,67.0,63.8,49.6,31.9,29.69,29.65,29.6,29.4,29.4,29.3,26.4,22.9,22.7,14.1;hrms(esi):m/z[m-cl]+计算值为c34h53n2os:537.3873;实际测量值为:537.3880.
图2(a)为hbt-c18在h2o/dmso(99:1,v/v)的溶液中的归一化的紫外吸收光谱;图2(b)为hbt-c18在h2o/dmso(99:1,v/v)的溶液中及固态下的荧光发射光谱。[hbt-c18]=5μm;λex=334nm.由图中可以看出,在溶液态,仅观察到在约450nm处的醇式发光。这是由于在水溶液中的环境干扰造成的。固态粉末时,在510nm观测到具有大的stokes位移(176nm)的强发光,源于激发态分子内质子转移(esipt)过程,而且由于分子内氢键被保护且其自由运动受到抑制,因此它可以发射强的酮式发光。大的stokes位移(176nm)是激发态分子内质子转移(esipt)过程的典型特征。hbt-c18在h2o/dmso(体积比99:1)溶液中和固态下的量子产率分别为0.2%和50.5%,清楚地证实了其aie性质。
实施例2:阴离子表面活性剂的检测
将15μl实施例1制备的hbt-c18的dmso(1.0mm)母液加入2.985ml含有不同含量阴离子表面活性剂十二烷基苯磺酸钠(sdbs)的纯水中,漩涡震荡10s,用荧光分光计测定荧光(激发波长334nm)。
图3(a)为随着sdbs浓度的增加hbt-c18(5μm)在h2o/dmso(99:1,v/v)的溶液中的荧光发射谱图;(b)为随着sdbs浓度的增加,hbt-c18在510nm和450nm处的荧光发射强度变化;(c)为随着sdbs浓度的增加,hbt-c18在510nm和450nm处的荧光发射强度的比例(i510/i450)变化。λex=334nm.
图4为hbt-c18(5μm)在h2o/dmso(99:1,v/v)中随sdbs浓度变化的荧光量子产率。由图中可以看出,hbt-c18的荧光量子产率从0.2%增加至8.5%。这是由于形成了阴阳离子聚集体,而且分子内氢键被保护。
图5为hbt-c18在不同sdbs浓度下(0,2.0,8.0μm)的(a)归一化紫外吸收和(b)荧光发射光谱图。[hbt-c18]=5μm;λex=334nm.由图中可以看出,在加入sdbs后,在370nm~420nm的拖尾峰的吸收光谱消失,分子内氢键得到保护,发出强烈的酮式荧光。
图6为hbt-c18在510nm和450nm处的荧光发射强度的比例(i510/i450)随sdbs浓度的变化。由图中可以看出在450nm和510nm检测到的发光比值(i510/i450)与sdbs增加的量相比逐渐增加。λex=334nm.内部为线性回归方程。基于信噪比的计算方法,针对sdbs的检测限(3δ/s)为0.05μm,远低于基于亚甲基蓝分光光度法的国家标准(检测限约为0.14μm)。
图7(a)为hbt-c18在510nm和450nm处的(i510/i450)荧光发射强度的比例对sdbs浓度的对数作图;如图所示,在hbt-c18/sdbs混合体系中的阴阳离子胶束的临界浓度为2.39μm,显著低于sdbs的临界胶束浓度(1.2mm)。
图7(b)为通过动态光散射(dls)测得的胶束粒径,pdi=0.434。由图所示,胶束的直径平均为223.8nm。
图7(c)、(d)为hbt-c18(5μm)/sdbs(8μm)在h2o/dmso(99:1,v/v)溶液中形成的胶束的扫描电镜(sem)和透射电镜(tem)图。图中显示胶束为 球形结构,其半径为90~200nm,相对于dls的结果,测得的胶束直径略小,这是由于在样品制备过程中,由溶液态转变为干燥的状态,溶液挥发会导致胶束的收缩造成的。
实施例3:
不同表面活性剂及离子的检测
将15μl实施例1制备的hbt-c18的dmso(1.0mm)母液加入2.985ml含有不同表面活性剂及离子(十二烷基苯磺酸钠(sdbs),十二烷基硫酸钠(sds)、曲通x-100、溴化十六烷基三甲基铵(ctab)和简单的离子(如:na+,k+,mg2+,ca2+,zn2+no3–,hco3–,hco32–,po43–,so42–))的纯水中,漩涡震荡10s,用荧光分光计测定荧光(激发波长334nm)。结果如图8所示。
图8为在不同表面活性剂及离子的存在下,hbt-c18在510nm和450nm处的荧光发射强度的比例(i510/i450)变化。该探针对连有磺酸基的阴离子表面活性剂有很高的灵敏性,包括:十二烷基苯磺酸钠(sdbs)、十二烷基硫酸钠(sds),而对中性的表面活性剂曲通x-100和阳离子表面活性剂溴化十六烷基三甲基铵(ctab),以及多种简单的阳离子(如:na+,k+,mg2+,ca2+,zn2+)、阴离子(如:no3–,hco3–,hco32–,po43–,so42–)则响应很弱。
实施例4:细菌荧光染色
(1)细菌培养
大肠杆菌(e.coli,strainatcc15224)购买自vwrinternational,llc。将该细菌的单菌落接种在5ml的lb基质中,在37℃下震动(150rpm)。之后,将1ml细菌悬浊液接种到50ml的新鲜基质中,在37℃震动下培养5h,以实现对数中期生长。
(2)e.coli的荧光染色
在37℃下将e.coli培养12小时,通过pbs将细菌的浓度稀释至107cfu/ml,随后用10μm实施例1制备的hbt-c18在37℃下培养0.5小时。用激光扫描共焦显微镜技术进行荧光成像实验(leicatcs-sp8,germany),在405nm激发并用508–558nm的滤光片。结果如图9所示。
图9为明场和荧光下的大肠杆菌的染色照片。(hbt-c18=10μm).比例尺=10μm.由图中可以看出,在激光扫描共聚焦显微镜下,所示大肠杆菌的荧光图 像清晰可见,背景噪音的影响可以忽略。因此hbt-c18探针可被用于直接染色细菌无需进一步分离、洗涤步骤。
(3)抗菌实验
将不同浓度的实施例1制备的hbt-c18探针加入1ml细菌浓度为107cfu/ml的lb介质中,测定hbt-c18的抗菌活性。在37℃下震荡(150rpm)培养2h,所得溶液用9mlpbs稀释。用移液器粗略地混合后,将溶液转移至15ml的试管中,进一步涡流振荡混合细菌3min。随后,该细菌溶液被稀释100,101和102倍,随后取10μl稀释的细菌悬浊液,用琼脂板评估细菌的活性。
图10为e.coli细菌在不同浓度hbt-c18(0,10,20,40,60,80和100μm)下的存活率图。从图中可以看出,hbt-c18探针表现出非常低的针对细菌的毒性,有利于其针对细菌的荧光染色实验。
尽管结合优选实施例对本发明进行了说明,但本发明并不局限于上述实施例,应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。此外应理解,在阅读了本发明讲授的内容之后,本领域的技术人员可以对本发明作各种不背离本发明宗旨的改动或修改,这些等价形式同样落于本申请所附权利要求书所限定的范围。
- 还没有人留言评论。精彩留言会获得点赞!