OsZFP基因及其蛋白在调控水稻侧根生长发育中的应用的制作方法
本发明涉及分子生物学领域,尤其涉及OsZFP基因及其蛋白在调控水稻侧根生长发育中的应用。
背景技术:
细胞亲环素(cyclophilin,Cyp)蛋白家族普遍存在于植物体中(Marivet,J.,Frendo,P and Burkard,G..Effects of abiotic stresses on cyclophilin gene expression in maize and bean and sequence analysis of bean cyclophilin cDNA.Plant Sci,1992,84:171-178;Hayman,G.T.and Miernyk,J.A.The nucleotide and deduced amino acid sequences of a peptidyl-prolyl cis-trans isomerase from Arabidopsis thaliana.Biochimica et Biophysica Acta-Gene Structure and expression,1994,1219:536-538;Godoy,A.V.,Lazzaro,A.S.,Casalongue,C.A.and Segundo,B.S.Expression of a Solanum tuberosum cyclophilin gene is regulated by fungal infection and abiotic stress conditions.Plant Sci,2000,152:123-134;Lee,J.R.,Park,S.C.,Kim,J.Y.,Lee,S.S.,Park,Y.,Cheong,G.W.,Hahm,K.S.and Lee,S.Y.Molecular and functional characterization of a cyclophilin with antifungal activity from Chinese cabbage.Biochem and Bioph Res Co,2007,353:672-678),具有肽脯胺酰顺反异构酶(peptidyl-proly cis-trans-isomerase,PPIase)活性,能够催化脯氨酸肽键(Xaa-Pro)的顺反异构化。植物细胞亲环素作为分子伴侣诱导富含脯氨酸蛋白质的折叠、翻译后修饰及蛋白质再分配,从而调控植物的生长发育过程。
已有研究表明,肽脯胺酰顺反异构酶可能参与生长素响应基因信号和介导转运抑制响应基因来调节植物的生长发育(Dharmasiri,N.,Dharmasiri,S.,Jones,A.M.and Estelle,M.Auxin action in a cell-free system.Curr Biol,2003,13:1418-1422;Dharmasiri,N.and Estelle,M.Auxin signaling and regulated protein degradation.Trens in Plant Sci,2004,9:302-308)。拟南芥CyP71突变体表现出顶端分生组织活性减弱,侧生器官发生缓慢且畸形以及根生长停止等症状(Li,H.,He,Z.,Lu,G..,Lee,S.C.,Alonso,J.,Ecker,J.R.and Luan,S.A WD40domain cyclophilin interacts with histone H3and functions in gene repression and organogenesis in Arabidopsis.Plant Cell,2007,19:2403-2416)。番茄中一个编码CYP的Dgt基因突变后出现生长素响应相关的多效性表型,如向重力性反应迟缓、侧根缺失、降低顶端优势和影响结实率等。亲环素抑制剂环孢素A在抑制生长素诱导的不定根发生上部分模拟了dgt突变的作用,并下调了相关生长素响应基因LeIAA10和LeIAA11的表达。水稻CYP2突变体表现出侧根缺失和花粉发育受阻等表型,进一步的结果显示CYP2和SGT1一起通过调控AUX/IAA蛋白的降解参与水稻生长素信号调节水稻侧根发生和花粉发育的过程(Kang,B.,Zhang,Z.,Wang,L.,Zheng,L.,Mao,W.,Li,M.,Wu,Y.,Wu,P.,and Mo,X..OsCYP2,a chaperone involved in degradation of auxin-responsive proteins,plays crucial roles in rice lateral root initiation.Plant J,2013,74:86-97),但在翻译过程中调控因子的发掘和功能研究还未见报道。
上述研究结果表明,植物CYPs基因的PPIase活性在植物生长发育方面起着重要的调节作用,其相关的作用机制和信号转导途径可能受植物激素的调控(Oh,K.,Ivanchenko,M.G.,White,T.J.and Lomax,T.L.The diageotropica gene of tomato encodes a cyclophilin:A novel player in auxin signaling.Planta,2006,224:133-144)。为了进一步研究水稻细胞亲环素基因在调控生长发育方面的作用,需要对相关信号转导途径的调控网络进行功能基因的发掘和验证工作。
目前,酵母双杂交技术已成为筛选蛋白互作的一个重要工具,对于发现基因调控网络中新的蛋白质和蛋白质的新功能有着广泛的应用及较大优势(Fields,S.and Song,O.A novel genetic system to detect protein-protein interactions.Nature,1989,340:245-247;Chien,C.T.,Bartel,P.L.,Sternglanz,R.and Fields,S.The two-hybrid system:A method to identify and clone genes for proteins that interact with a protein of interest.PANS,1991,88:9578-9582;Luban,J.and Goff,S.P.The yeast two-hybrid system for studying protein-protein interactions.Curr Opin in Biotech,1995,6:59-64);同时,酵母双杂交也存在一定的假阳性问题,由于某些外源蛋白对酵母产生毒性,不适合于酵母双杂交筛选系统;或外源蛋白具有激活转录功能,在酵母中表达时发挥转录激活作用,使DNA结合结构域杂交蛋白在无特异激活结构域的情况下可激活转录,因此,需要对钓饵蛋白进行酵母毒性试验和自激活试验,并经体外蛋白互作(in vitro pull-down)和western bolt验证。
基于以上研究背景,我们通过酵母双杂交和GST pull-down技术筛选及验证与调控水稻侧根生长发育重要功能蛋白OsCYP2互作的靶蛋白,并验证编码该靶蛋白的基因参与调控水稻侧根的生长发育,为水稻侧根生长发育基因功能研究提供新的思路。
技术实现要素:
本发明提供了一种OsZFP基因及其蛋白在调控水稻侧根生长发育中的应用,该OsZFP基因能够直接调控水稻侧根的生长发育,蛋白OsZFP能够与功能蛋白OsCYP2互作,并参与调控水稻侧根的生长发育。
本发明发现了OsZFP基因在调控水稻侧根生长发育中的应用,所述OsZFP基因为Os01g0252900。
具体地,包括:选取OsZFP基因的靶向干扰片段,将所述靶向干扰片段的正向和反向连接至干扰表达载体上,经遗传转化筛选和PCR验证,获得干扰表达载体阳性的转化植株。
进一步地,所述的靶向干扰片段如SEQ ID NO.7~10所示。
进一步地,所述的干扰表达载体为pCAMBIA1300-RNAi。
本发明还发现了与水稻亲环素蛋白CYP2互作的蛋白OsZFP在调控水稻侧根生长发育中的应用,其中,所述蛋白OsZFP的编码基因为Os01g0252900,所述亲环素蛋白CYP2的编码基因为Os02g0121300。
本发明将水稻亲环素基因OsCYP2连接至酵母表达载体pGBKT7,转化酵母菌株Y2H,在SD/-Trp培养基中筛选获得含有重组载体的阳性酵母菌株Y2H(pGBKT7+OsCYP2),在SD/-Trp、SD/-Trp/X-α-gal和SD/-Trp/X-α-gal/AbA培养基中验证OsCYP2基因对酵母菌株Y2H无毒性和自激活现象。
然后,构建水稻cDNA文库,连接至酵母表达载体pGADT7,文库初始库容达到1.7x106cfu;转化酵母菌株Y187,在SD/-Leu的培养基中筛选获得含有水稻cDNA文库重组载体的阳性酵母菌株Y187;将Y2H(pGBKT7+OsCYP2)和酵母菌株Y187(pGBKT7+cDNA library)进行共培养,在SD/-Trp/-Leu/X-α-gal/AbA和SD/-Trp/-Leu/-Ade/-His/X-α-gal/AbA培养基筛选水稻cDNA文库中与OsCYP2蛋白互作的靶蛋白。
再对共培养酵母细胞中互作靶蛋白进行分离,提取SD/-Trp/-Leu/-Ade/-His/X-α-gal/AbA培养基中显蓝色的酵母细胞的表达载体,转化大肠杆菌DH5α,利用pGADT7载体的氨苄青霉素抗性标记在LB+Amp的培养基中分离互作表达载体,送生物公司测序,再进行序列比对,鉴定为CCHC型锌指结构蛋白(OsZFP)。
接着,将鉴定的表达载体pGADT7-OsZFP与pGBKT7和pGBKT7-OsCYP2分别共转化酵母菌株Y2H,在SD/-Trp/-Leu/X-α-gal和SD/-Trp/-Leu/-Ade/-His/X-α-gal/AbA培养基中回复验证OsCYP2蛋白与OsZFP蛋白互作。
进一步通过体外pull-down和western blot检测,验证OsCYP2和OsZFP存在真实互作,将OsCYP2和OsZFP分别克隆至原核表达载体pGEX-4T-1和pET28a,形成两个融合表达载体(pGEX-4T-1中GST蛋白与OsCYP2蛋白融合表达,pET28a中His蛋白与OsZFP蛋白融合表达),经GST和His纯化磁珠提取GST-OsCYP2融合蛋白和His-OsZFP融合蛋白,利用MagneGST Pull-Down System和His标签偶联HRP进行蛋白互作试验,经化学发光底物检测验证GST-OsCYP2融合蛋白与His-OsZFP融合蛋白互作。
最后,验证OsZFP基因调控水稻侧根生长发育。选取OsZFP基因靶向干扰序列,将该片段正向和反向连接至植物干扰表达载体pCAMBIA1300-RNAi,通过水稻遗传转化筛选和PCR验证,获得该基因干扰表达载体阳性转化植株。以野生型植株和转化植株进行侧根生长发育比较,野生型植株幼苗侧根能正常生长发育,而OsZFP基因干扰转化植株的侧根生长发育则明显受到抑制,验证了该基因能直接调控水稻侧根的生长发育。
本发明通过酵母双杂交系统(in vivo)和GST pull-down(in vitro)技术筛选并验证了与调控水稻侧根生长发育重要功能蛋白OsCYP2互作的下游靶蛋白OsZFP,旨在探索新的调控水稻根系生长发育基因,丰富水稻侧根生长发育的基因调控网络及相关信号转导途径,为水稻侧根发育基因功能研究提供新的思路;与此同时,对揭示水稻根系生长发育机制和提高水稻生产力有重要的意义。
附图说明
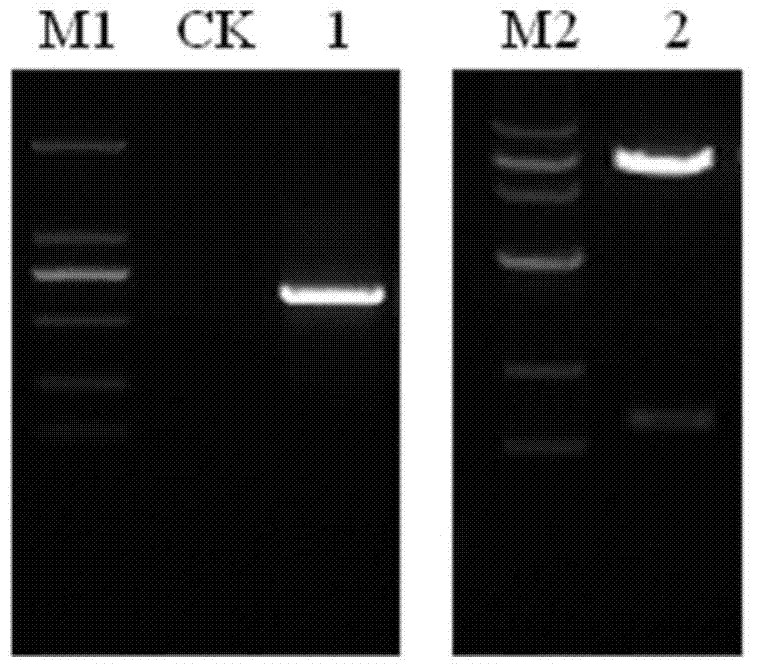
图1OsCYP2基因PCR扩增及重组酵母表达载体pGBKT7+OsCYP2酶切验证;
CK:阴性对照;1:OsCYP2目的片段;2:pGBKT7+OsCYP2重组表达载体酶切验证;
M1:DL2000;M2:Wide Range 500-15000。
图2OsCYP2基因对酵母菌株Y2H的毒性及自激活验证;
SDO:SD/-Trp;SDO/X:SD/-Trp/X-α-gal;SDO/X/A:SD/-Trp/X-α-gal/AbA
BD:pGBKT7;BD-OsCYP2:pGBKT7+OsCYP2。
图3水稻cDNA文库构建;
1:总RNA;2:纯化mRNA,3:双链cDNA;4:去除小片段的cDNA
M1:250bp DNA Ladder marker;M2:λ-EcoT14I digest。
图4OsCYP2蛋白与OsZFP蛋白一对一互作验证;
DDO/X:SD/-Trp-Leu/X-α-gal;QDO/X/A:SD/-Trp-Leu-Ade-His/X-α-gal/AbA
AD-OsZFP:pGADT7+OsZFP;BD:pGBKT7;BD-OsCYP2:pGBKT7+OsCYP2。
图5GST与OsCYP2及His与OsZFP融合蛋白表达载体酶切验证;
1:pGEX-4T-1+OsCYP2重组表达载体酶切验证;2:pET28a+OsZFP重组表达载体酶切验证;M1:DL2000;M2:1kb DNA Ladder。
图6 GST(Glutathione-S-transferase)pull-down;
GST:pGEX-4T-1;GST-OsCYP2:pGEX-4T-1+OsCYP2;His-ZFP:pET28a+OsZFP。
图7 OSZFP基因干扰载体构建示意图;
图8 OSZFP基因RNAi干扰载体双酶切验证(BamHI和SacI);
1:pCAMBIA1300-RNAi+OsZFP;M:DNA Marker F。
图9 T0代转基因干扰植株PCR检测;
M:DNA Marker F;P:pCAMBIA1300-RNAi;WT:野生型植株;1-6:T0代转基因植株
图10不同RNAi转化株系的表型分析结果;
RNAi:T0代干扰载体转化植株;WT:野生型植株。
具体实施方式
下面结合具体实施例对本发明进行详细阐述。
其中,下列实施例中的水稻品种‘爱知旭’由杭州市农业科学研究院提供。
实施例1
一、OsCYP2基因的PCR扩增
根据酵母表达载体pGBKT7多克隆位点(EcoRI和SalI)及OsCYP2基因序列(519bp)设计PCR扩增引物BD-OsCYP2-F和BD-OsCYP2-R,具体如下(下划线为酶切位点):
BD-OsCYP2-F:CGGGAATTCTCTGTGAAATTCGCAAAACCC(SEQ ID NO.1)
BD-OsCYP2-R:ACGCGTCGACACACCACCACCACCTCCTCCT(SEQ ID NO.2)
以水稻品种‘爱知旭’第一链cDNA为模板进行PCR扩增OsCYP2基因,反应程序如下:
PCR扩增产物经琼脂糖凝胶电泳检测在BIO-RAD凝胶成像仪中拍照(如图1所示)。将目的片段和酵母表达载体pGBKT7分别进行双酶切(EcoRI和SalI),回收目的片段和载体骨架,用T4DNA连接酶16℃过夜连接,连接产物转化至大肠杆菌DH5α,经LB固体培养基(含50mg/L kanamycin)37℃过夜培养,挑取单克隆摇菌培养,小量法提取质粒进行双酶切验证(如图1所示),经酶切验证正确的阳性单克隆送生物公司进行测序。
二、酵母感受态细胞的制备和转化
采用小量法转化表达载体pGBKT7和pGBKT7+OsCYP2至酵母菌株Y2H,酵母感受态细胞制备及转化;
具体步骤如下:
1)吸取1μl酵母菌株Y2H菌液涂布于YPDA培养基,30℃培养3-5天;
2)挑取2-3mm单克隆接种于3ml YPDA液体培养基中,30℃,250rpm培养8-12hr;
3)取5μl转接至50ml YPDA液体培养基中,30℃,250rpm培养至OD600达到0.15-0.3;
4)700g室温离心5min,弃上清,重悬于100ml YPDA液体培养基中,30℃,250rpm培养至OD600达到0.4-0.5;
5)700g室温离心5min,弃上清,重悬于30ml灭菌ddH2O;
6)700g室温离心5min,弃上清,重悬于1.5ml 1.1×TE/LiAc;
7)菌液转移至1.5ml离心管中,10000rpm离心15s,弃上清,重悬于600μl 1.1×TE/LiAc至冰上备用;
8)在预冷的1.5ml灭菌离心管中加入50μl酵母感受态细胞,100ng表达载体以及5μl Yeastmaker Carrier DNA(98℃变性5min);
9)加入500μl PEG/LiAc,混匀后30℃孵育30min,每隔10min摇匀混合一次;
10)加入20μl DMSO混匀,42℃水浴15min,每隔5min摇匀混合一次;
11)10000rpm离心15s,弃上清,重悬于1ml YPDA Plus Medium,30℃,150rpm培养1hr;
12)10000rpm离心15s,弃上清,重悬于1ml 0.9%的氯化钠溶液中;
13)用0.9%的氯化钠溶液稀释酵母菌液备用。
取100μl转化菌液分别涂布于SD/-Trp,SD/-Trp/X-α-Gal,SD/-Trp/X-α-Gal/AbA固体培养基,30℃培养3-5天,在SD/-Trp培养基中,含有pGBKT7和pGBKT7+OsCYP2的酵母菌株Y2H生长情况一致,在SD/-Trp/X-α-Gal培养基中,含有pGBKT7+OsCYP2的酵母菌株Y2H为白色菌落,且在SD/-Trp/X-α-Gal/AbA培养中不能生长(如图2所示),该试验结果表明OsCYP2基因对酵母菌株Y2H没有毒性且无自激活现象。
三、cDNA文库的构建,酵母菌株Y187感受态的制备和转化
对水稻组织地上部和地下部等比例取样提取总RNA,进行mRNA纯化,反转录合成双链cDNA,经末端平滑化、Adaptor连接、酶切、去除短片段后得到cDNA文库(如图3所示);通过酶切位点EcoRI和XhoI连接到酵母表达载体pGADT7,滴度检测表明该cDNA文库库容达到1.7x106cfu;将构建好的cDNA文库酵母表达载体转化至酵母菌株Y187。
酵母菌株Y187感受态的制备和转化方法与步骤二相同。
四、酵母双杂交筛选与OsCYP2蛋白互作的靶蛋白
酵母双杂交筛选与OsCYP2蛋白互作的靶蛋白,具体步骤如下:
1)室温溶解1ml水稻cDNA文库酵母菌液,计算文库滴度;
2)挑取2-3mm单克隆Y2H(含pGBKT7+OsCYP2)接种于50ml SD/-Trp液体培养基,30℃,250rpm振荡培养至OD600达到0.8;
3)1000g离心5min,弃上清;
4)用4-5ml SD/-Trp液体培养基重悬,使酵母菌液浓度大于1×108;
5)将1ml cDNA文库酵母菌液与钓饵载体菌液混合,加入45ml 2×YPDA液体培养基(含50μg/ml Kanamycin),30℃,30-50rpm振荡培养20-24hr;
6)待培养20hr后用显微镜观察出现酵母合子细胞后,将菌液转移至50ml离心管,1000g离心10min,弃上清;
7)用50ml 0.5×YPDA液体培养基(含50μg/ml Kanamycin)重悬酵母菌液,1000g离心10min,弃上清,重复一次;
8)用10ml 0.5×YPDA液体培养基(含50μg/ml Kanamycin)重悬酵母菌液;
10)将菌液按200μl/皿涂布于SD/-Trp/-Leu/X-α-Gal/AbA固体培养基,30℃培养3-5天;
11)挑取蓝色单克隆接种于SD/-Ade/-His/-Trp/-Leu/X-α-Gal/AbA固体培养基,30℃培养3-5天。
五、分离及鉴定阳性互作靶蛋白(体内)
挑取SD/-Ade/-His/-Trp/-Leu/X-α-Gal/AbA固体培养基中蓝色单克隆,划线接种至SD/-Trp/-Leu/X-α-Gal固体培养基,重复2-3次,分离蓝色酵母单克隆,提取蓝色酵母单克隆的质粒,转化大肠杆菌DH5α,涂布与含有氨苄青霉素的LB固体培养基,利用pGADT7载体的氨苄青霉素抗性标记筛选互作表达载体,送生物公司测序。
利用NCBI数据库进行序列同源性比对,鉴定上述序列编码的蛋白为CCHC型锌指结构蛋白(OsZFP)。
将分离的pGADT7+OsZFP质粒,与pGBKT7和pGBKT7+OsCYP2分别共转化酵母菌株Y2H,酵母感受态制备及质粒转化同步骤二。
取100μl转化菌液涂布于SD/-Trp/-Leu/X-α-gal和SD/-Trp/-Leu/-Ade/-His/X-α-gal/AbA培养基中,结果显示pGBKT与pGADT7+OsZFP质粒共转化酵母菌株只能在SD/-Trp/-Leu/X-α-gal培养基中生长且无蓝色信号,pGBKT7+OsCYP2与pGADT7+OsZFP质粒共转化酵母菌株在SD/-Trp/-Leu/X-α-gal培养基和SD/-Trp/-Leu/-Ade/-His/X-α-gal/AbA培养基中均能生长且呈蓝色菌落(图4),表明OsCYP2蛋白与OsZFP蛋白存在互作。
六、OsCYP2基因和OsZFP基因的PCR扩增
根据原核表达载体pGEX-4T-1多克隆位点和OsCYP2基因序列(519bp)设计PCR扩增引物GST-OsCYP2-F和GST-OsCYP2-R;同时,根据原核表达载体pET28a多克隆位点和OsZFP基因序列(827bp)设计PCR扩增引物His-OsZFP-F和His-OsZFP-R,具体如下(下划线为酶切位点):
GST-OsCYP2-F:CGGAATTCATGTCGAACACGAGGGTGTT(SEQ ID NO.3)
GST-OsCYP2-R:CCGCTCGAGCTAGGAGAGCTGGCCGCAGT(SEQ ID NO.4)
His-OsZFP-F:CGGAATTCATGGCAAGGGAACCAAGTCC(SEQ ID NO.5)
His-OsZFP-R:CCGCTCGAGCTAAAATGCCTGGCTCCTAA(SEQ ID NO.6)。
OsCYP2基因PCR扩增程序同步骤一,OsZFP基因PCR扩增反应程序如下:
PCR扩增产物经琼脂糖凝胶电泳检测。将目的片段(OsCYP2基因和OsZFP基因)和原核表达载体(pGEX-4T-1和pET28a)分别进行双酶切(EcoRI和XhoI),回收目的片段和载体骨架,将OsCYP2基因与pGEX-4T-1、OsZFP基因与pET28a用T4DNA连接酶16℃过夜连接,连接产物转化至大肠杆菌BL21,经LB固体培养基(含50mg/L kanamycin或100mg/L ampicillin)37℃过夜培养,挑取单克隆摇菌培养,小量法提取质粒进行双酶切验证(如图5所示),经酶切验证正确的阳性单克隆送生物公司进行测序。
七、体外检测互作蛋白
利用Promega公司的GST和His纯化磁珠提取GST-OsCYP2融合蛋白和His-OsZFP融合蛋白,经SDS-PAGE凝胶电泳检测;利用Promega公司的MagneGST Pull-Down System和Genescript公司的His标签偶联HRP抗体进行蛋白互作和免疫反应,经化学发光底物检测验证GST-OsCYP2融合蛋白与His-OsZFP融合蛋白互作(如图6所示)。
实施例2
一、OsZFP基因干扰表达载体构建
根据干扰表达载体pCAMBIA1300-RNAi多克隆位点和OsZFP基因靶点序列(264bp)设计正向插入片段PCR扩增引物RNAi1-F和RNAi1-R,以及反向插入片段PCR扩增引物RNAi3-F和RNAi3-R,干扰表达载体构建示意图如图7所示,相关引物序列如下(下划线为酶切位点):
RNAi1-F:CGCGGATCCTGTAAAATATGTGGAGAATCAGGTC(SEQ ID NO.7)
RNAi1-R:GGACTAGTCTCCTGAATGATTTTATGAACAGCA(SEQ ID NO.8)
RNAi3-F:CGAGCTCTGTAAAATATGTGGAGAATCAGGTC(SEQ ID NO.9)
RNAi3-R:CGGGGTACCCTCCTGAATGATTTTATGAACAGCA(SEQ ID NO.10)。
OsZFP基因靶点序列PCR扩增反应程序如下:
PCR扩增产物经琼脂糖凝胶电泳检测。利用酶切位点BamHI和SpeI先将正向片段连接到干扰表达载体pCAMBIA1300-RNAi,再利用酶切位点KpnI和SacI将反向片段连接至已插入正向片段的干扰表达载体。两次连接及转化试验同上述方法,经LB固体培养基(含50mg/L kanamycin)37℃过夜培养,挑取单克隆摇菌培养,小量法提取质粒进行双酶切验证(如图8所示),经酶切验证正确的阳性单克隆送生物公司进行测序。
二、干扰表达载体转基因水稻侧根表型分析
为了验证OsZFP基因能调控水稻侧根生长发育,将该基因的干扰表达载体通过水稻遗传转化,经潮霉素筛选获得T0代干扰转基因植株,对部分转化植株Hyg筛选标记基因(250bp)进行PCR检测验证,所用引物如下:
Hyg-FP:CGCAAGGAATCGGTCAATAC(SEQ ID NO.11)
Hyg-RP:ATCGCCTCGCTCCAGTCAAT(SEQ ID NO.12)
Hyg筛选标记基因扩增反应程序如下;
PCR扩增产物经琼脂糖凝胶电泳检测(图9),表明已成功获得OsZFP基因干扰表达载体阳性转化植株。
以水稻野生型植株和阳性转化干扰植株为试验材料,发芽10天后,观察侧根生长发育情况。结果显示,野生型植株侧根能正常生长发育,而OsZFP基因干扰表达载体转化植株明显无侧根分化(图10),表明OsZFP基因对水稻侧根生长发育起着直接的调控作用。
- 还没有人留言评论。精彩留言会获得点赞!