抗乙型肝炎病毒的免疫反应性细胞的制作方法
本发明涉及一种特异性地识别感染了乙型肝炎病毒的细胞的嵌合抗原受体(chimericantigenreceptor,car),表达其的免疫反应性细胞及利用其来调节或治疗源自乙型肝炎病毒的肝疾病的方法。
背景技术:
乙型肝炎是全世界范围内主要的问题性疾病。据世界卫生组织(who,worldhealthorganization)的统计结果表明,约有20亿人感染有乙型肝炎,其中,推定约有2亿4千万人患有慢性肝炎。肝细胞癌在世界范围的癌症死亡原因中排第三位,每年有600,000名以上的患者因源自乙型肝炎病毒的慢性肝疾病(肝硬化或肝癌)而死亡。
基础的慢性乙型肝炎病毒(hbv)感染会诱发肝硬化或肝细胞癌(hcc,hepatocellularcarcinoma)。与其它癌症相比,肝细胞癌的预后差,其原因在于,肝癌细胞在早期通过血管大范围地扩散,并具有可加快生长速度的肿瘤生物学特性。另外,由于大部分肝细胞癌会伴有慢性肝炎或肝硬化,因此成为积极治疗癌症方面的阻碍。
在乙型肝炎患者居多的亚洲或非洲,肝癌患者中有约70~80%的乙型肝炎病毒携带者。据台湾的一个报道,乙型肝炎病毒携带者发生肝细胞癌的风险度与非携带者相比,约高出200倍。尤其是在病毒增殖速度快的情况下,即血清hbve抗原或hbv-dna为阳性时,他们中年龄较高或患有肝硬化的人更易患上肝癌。
用于治疗源自hbv的慢性肝疾病的药物有干扰素-α(interferon-α;ifn-α)、聚乙二醇干扰素(peg-ifn)、核苷类似物(拉米夫定、恩替卡韦及替比夫定)及核苷酸类似物(阿德福韦及替诺福韦)等。优选的药物为,能够完全去除乙型肝炎病毒,并能够实现从乙型肝炎病毒表面抗原(hbsag)阳性到抗表面抗原阳性的血清转化(seroconversion)的 药物,然而,上述药物没有显示出这种效果。
ifn-α为长期使用的抗hbv药物,但已知其具有严重的副作用,并且在治疗效果方面有限。对乙型肝炎病毒表面抗原的去除率约在8%以下。核苷类似物及核苷酸类似物等药物虽然能够抑制病毒的逆转录酶(viralreversetranscriptase),但不能去除乙型肝炎病毒共价闭合环状dna(hbvcccdna)。这些药物虽然能抑制hbv的复制,但由于hbvcccdna一直存在于宿主细胞的核中,且hbvdna会插入到宿主细胞的染色体内,因此无法实现患者对hbv免疫环境的调节或去除病毒。而且,在患者中断治疗的情况下,hbv的复制会退回到治疗前的状态,从而使肝炎症状大大恶化。虽然需要使用这种药物持续进行治疗,但是难以期待大的效果,而且患者可能需要面对这种持续治疗所带来的变异病毒所导致的耐药性等严重的副作用。
由于肝细胞癌在早期没有症状,因此,大部分患者为在进展到一定程度后才被发现,在这种情况下,目前还没有有效的治疗方法,对于早期诊断的肝细胞癌,首选的治疗方法为肝移植或肝切除术,但在患者中能够进行肝切除术的比例仅为30-40%。作为其它治疗方法,虽然可以使用肝移植、全身性化疗、放射治疗、射频消蚀治疗方法等,但是复发率高,且在移植后排斥反应等副作用较严重。目前为止,作为酪氨酸激酶抑制剂的索拉非尼是能够治疗已进行的肝细胞癌的唯一药物,但是生存延长期仅为3个月左右。更主要的问题是在实施了现有的治疗术之后会引起肝细胞癌的复发或向肝细胞以外的器官转移。上述问题是由插入有未完全被去除的hbv的肝细胞所导致的。因此,需要开发出一种用于治疗源自hbv的肝细胞癌的新型治疗方法。
免疫治疗方法可以增强存在于体内的现有的免疫反应,或对新型病毒或癌细胞诱导特异性免疫反应,从而能够有效且选择性地对病毒感染细胞或肝细胞癌进行标记。即,可以通过非特异性宿主的免疫反应或hbv特异性辅助性t细胞(t-helper)或细胞毒性t淋巴细胞(cytotoxictlimphocytes,ctl)的活性化来去除病毒或肝细胞癌。
目前最受瞩目的治疗途径为,将经过基因操作(geneticallymodified)的hbv特异性t细胞进行过继转移(adoptivetransfer)的方法。t细胞的过继转移是通过对新型病毒或癌细胞诱导特异性免疫反应,从而可以恢复丧失的抗hbv的免疫功能。
在初期,为了标记癌细胞而使用的过继转移t细胞为在体外增殖的自体来源的肿瘤浸润性淋巴细胞(til,tumorinfiltratinglymphocytes)或肿瘤特异性t细胞克隆(tumor-specifictcellclones)。然而,不能在所有患者或所有癌症的外周血单核细胞中分离出til细胞或癌特异性t细胞克隆。
为了克服这种限制,已研究出通过基因操作来将肿瘤特异性t细胞受体(tcr,tcellreceptor)导入到t细胞中的方法。该方法是将病毒或肿瘤特异性受体导入到自体来源t细胞(autologoustcells)中,并在体外增殖后再注入患者的方法。表达对t细胞受体具有高的结合活性的α和β链的情况下,能够重构(redirect)t细胞的抗原特异性。导入了新型tcrs的t细胞在体内遇到抗原,则会起到诱导免疫反应的作用。但导入了tcrs的t细胞仅限制于人白细胞抗原(hla)形态。即,仅适用于与插入了tcrs的hla形态相同的患者。
为了克服导入了tcr基因的t细胞受hla形态的限制的问题,被导入的为嵌合抗原受体。car是由能够附着在癌或病毒抗原上的单链抗体区域和根据抗原刺激而活化t细胞并能够使t细胞增殖的细胞质区域构成。car基本上是通过抗原-抗体反应来实现的,因此对hla的形态没有限制,从而具有可以适用于所有患者的优点。
导入了附着在乙型肝炎抗原上的抗原和tcr的细胞质区域的cart细胞能够识别hbsag阳性肝细胞,分泌作为增强免疫细胞因子的ifn-γ和il-2,并能够杀灭感染hbv的肝细胞等,从而显示出能够有效治疗慢性乙型肝炎或源自hbv的肝癌的治疗可能性。
技术实现要素:
要解决的技术问题
本发明的目的在于,提供一种特异性地识别感染了乙型肝炎病毒的细胞的嵌合抗原受体。
本发明的另一目的在于,提供一种表达上述嵌合抗原受体的免疫反应性细胞。
本发明的又一目的在于,提供一种用于调节或治疗源自乙型肝炎的肝疾病的所述免疫反应性细胞的应用。
技术方案
根据上述目的,本发明提供一种嵌合抗原受体,所述嵌合抗原受体在n-末端至c-末端的方向上包含(1)乙型肝炎病毒表面抗原(hbsag)结合区域、(2)跨膜区域、(3)共刺激性信号传递区域及(4)cd3ζ信号传递区域。
根据上述的另一目的,本发明提供一种编码所述嵌合抗原受体的核酸序列及包含其的载体。
根据上述又一目的,本发明提供一种导入有所述载体的免疫反应性细胞和所述的免疫反应性细胞在制备用于治疗源自hbv的肝疾病的药物中的应用,以及为了治疗源自乙型肝炎的肝细胞癌或慢性乙型肝炎而利用这些免疫反应性细胞的方法。
附图说明
图1为hbvcar表达用慢病毒载体(ppvl01/hbvcar)的模拟图;
图2为利用人宫颈癌细胞系(hela)对hbvcar慢病毒进行效价分析的结果;
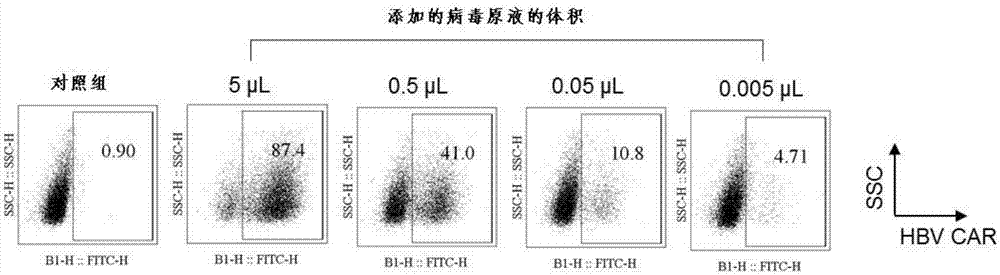
图3为采用流式细胞术对通过hbvcar慢病毒转导的t细胞表面进行分析的结果;
图4为转导有hbvcar基因的t细胞对靶细胞的杀伤效果的分析结果。
发明的详细说明
定义
在未进行其它定义的情况下,本说明书中所使用的所有技术性及科 学性术语具有本发明所属技术领域的技术人员通常所理解的含义。
本说明书中所使用的术语“抗原识别受体”是指在进行抗原结合的反应时,能够活化免疫细胞(例如,t细胞)的受体。作为抗原识别受体的例子,可以使用自然型或内因性t细胞受体,或者可以使用肿瘤抗原-结合区域融合在能够活化免疫细胞(例如,t细胞)的细胞内信号化区域上的嵌合抗原受体(car)。
本说明书中所使用的术语“抗体”不仅是指完整的抗体分子,还表示维持免疫原(immunogen)-结合能力的抗体分子的片段。这些片段在本领域中已被熟知,经常被导入到试管内或生物体内。因此,本说明书中所使用的术语“抗体”不仅是指完整的免疫球蛋白分子,还表示已被熟知的活性片段f(ab')2及fab。完整抗体的无fc片段的f(ab')2及fab片段通过循环而被更加迅速地去除,并且可以具有很少的完整抗体的非-特异性组织结合(wahletal.,j.nucl.med.24:316-325(1983))。本发明的抗体包括完整的自然型抗体、双特异性抗体、嵌合抗体、fab、fab'、单链v区域片段(scfv)、融合多肽及非传统型抗体。
本说明书中所使用的术语“单-链可变片段”或“scfv”是免疫球蛋白的重链(vh)及轻链(vl)的可变区域通过共价键而连接,从而形成vh::vl异质二聚体的融合蛋白质。所述重链(vh)及轻链(vl)是直接连接,或者是通过连接vh的n-末端与vl的c-末端,或连接vh的c-末端与vl的n-末端的肽-编码连接体(例如,10、15、20、25个氨基酸)来进行连接。通常,所述连接体为了维持柔韧性而富含甘氨酸,并且为了具有优异的溶解度而富含丝氨酸或苏氨酸。即使被去除了恒定区域并导入了连接体,scfv蛋白质也能够维持原来的免疫球蛋白的特异性。
本说明书中所使用的“亲和力”是指测定的结合强度。
本说明书中所使用的术语“嵌合抗原受体”或“car”是表示融合在能够活化或刺激免疫细胞的细胞内信号化区域上的抗原-结合区域。通常,所述car的细胞外结合区域由通过融合鼠科(murine)或人性化单克隆抗体的可变重链及轻链区域而形成的单链可变片段(scfv)构成。在多 个具体例中,所述scfv融合到跨膜区域上之后,再与细胞内信号化区域融合。“1代”car包括抗原结合时只提供cd3ζ信号的car,“2代”car包括同时提供共刺激(例如,cd28或cd137)及活性化(cd3ζ)的car。“3代”car包括提供多个共刺激(例如,cd28及cd137)及活性化(cd3ζ)的car。在多个具体例中,选择与抗原的亲和力或结合度高的car。
本说明书中所使用的术语“免疫刺激活性”是指,在细胞(例如,活化的免疫反应性细胞)内诱导信号传递,或使蛋白质表达发生变化,从而增强免疫反应。免疫刺激活性可以包含前-炎性活性。已知是通过其结合来刺激或增加免疫反应的多肽包括cd28、cd137、b7-1、b7-2及cd137l和对应其的配体。这种多肽存在于肿瘤微环境中,并且活化新生物细胞的免疫反应。在多个具体例中,促进、刺激或增强前-炎性多肽和/或其配体,则能够提高免疫反应性细胞的免疫反应。
本说明书中所使用的“cd28多肽”是指ncbi参考编号为np_006130或者是与其片段至少具有85、90、95、96、97、98、99或100%的同源性的、具有刺激活性的蛋白质。示例性的cd28细胞内信号化区域的氨基酸序列提供为下述seqidno:7。
本发明中所使用的“cd137多肽”是指起到肿瘤坏死因子(tumornecrosisfactor,tnf)配体的作用的ncbi参考编号为p41273或np_001552,或与其片段至少具有85、90、95、96、97、98、99或100%的同源性的蛋白质。示例性的cd137细胞内信号化区域的氨基酸序列提供为下述seqidno:8。
本发明中所使用的“cd3ζ多肽”是指ncbi参考编号为np_932170或与其片段具有85、90、95、96、97、98、99或100%的同源性的、具有活化或刺激活性的蛋白质。示例性的cd3ζ细胞内信号化区域的氨基酸序列提供为下述seqidno:9。
本说明书中所使用的“有效量”是指,对于具有治疗效果来说充分的量。在一具体例中,“有效量”是指,对于使新生物的持续性增殖、生长或转移(例如,侵入或移动)停止、改善或抑制来说充分的量。
本说明书中所使用的“免疫反应性细胞”表示在免疫反应中起作用的细胞或其的祖细胞(progenitor)或后代细胞(progeny)。
本发明中所使用的“肝炎”是由肝的炎症而定义的医学上的状态。
本说明书中所使用的“人白细胞抗原(hla,humanleukocyteantigen)”是人i类或ii类主要组织相容性复合体(mhc,majorhistocompatibilitycomplex)蛋白质。
嵌合抗原受体(car)
本发明提供一种嵌合抗原受体(car),所述嵌合抗原受体包含细胞外区域、跨膜区域及细胞内区域。所述细胞外区域包含作为抗原结合的一部分的抗原特异性结合元件。所述细胞内区域包含共刺激性信号传递区域及ζ链的一部分。所述共刺激性信号传递区域是指,包含淋巴细胞的有效反应所必需的细胞表面共刺激性分子的细胞内区域的、car的一部分。
在所述细胞外区域与跨膜区域之间或所述跨膜区域与所述细胞内区域之间可以增加有间隔区域。本文中所使用的“间隔区域”是指,具有能够将跨膜区域连接到细胞外区域及细胞内区域中的一个区域上的功能的任一低聚糖或多肽。间隔区域最多可包含300个氨基酸。
具体而言,本发明提供一种嵌合抗原受体,所述嵌合抗原受体在n-末端至c-末端的方向上包含(1)hbsag结合区域、(2)跨膜区域、(3)共刺激性信号传递区域及(4)cd3ζ信号传递区域。
本发明的一具体例中,所述car在n-末端至c-末端方向上具有以下结构。即,由鼠(murine)免疫球蛋白的前导序列(leadersequence)、抗-hbv表面抗原抗体的scfv部分、连接体a、人免疫球蛋白的恒定区域(constantregion)、连接体b、人cd28跨膜(transmembrane)区域、人cd28细胞内信号化区域、人cd137细胞内信号化区域及人cd3ζ细胞内信号化区域依次连接而成。
编码目标区域的核酸序列可以通过重组的方法来获得,例如可以通过以下方式获得,即可以通过利用标准技术方法来从表达所述区域的细 胞中筛选文库的方式,或从公知的载体中诱导基因,以使其包含上述区域的基因的方法,或从包含所述区域的基因的细胞及组织中直接分离的方式来获得。作为替代方案,还可以通过非克隆的合成方式来生成上述目标区域的基因。
载体
本发明还提供一种插入有本发明的dna的载体。编码car的核酸的表达可以通过以下典型的方式来实现。将编码car多肽或其一部分的核酸可操作地连接到启动子上,并将所述结构体导入到表达载体中而实现。所述载体适合用于复制及结合真核生物。典型的克隆载体包括对转录及转译终止因子、起始序列及目标核酸序列的表达的调节有帮助的启动子。
所述核酸可以克隆到诸如质粒、噬菌粒、动物病毒及粘粒等多种类型的载体中。尤其是作为有用的载体,可以例举如表达载体、复制载体、探针生成载体及测序载体。所述表达载体可以以病毒性载体的形态提供到细胞中,本发明的一具体例中使用慢病毒载体。
免疫反应性细胞
本发明提供一种通过导入包含所述抗原识别受体的载体来对结合到hbv表面抗原的单链可变片段(scfv,singlechainvariablefragment)进行表达,从而降低或去除所述抗原活性的免疫反应性细胞。所述免疫反应性细胞可以为t细胞、自然杀伤细胞(nk,naturalkiller)或细胞毒性t淋巴细胞(ctl,cytotoxictlymphocyte)。更具体地,所述免疫反应性细胞可以为t细胞。
源自乙型肝炎的疾病的治疗
本发明的另一方面,提供一种本发明的免疫反应性细胞在用于治疗源自乙型肝炎的疾病方面的应用。
所述源自乙型肝炎的疾病可以例举如肝细胞癌或慢性乙型肝炎。
一方面,本发明提供一种在个体(subject)中治疗或预防源自乙型肝炎的肝细胞癌或慢性乙型肝炎的方法,所述方法包括以下步骤。即,将有效量的免疫反应性细胞施用于需要治疗或预防源自乙型肝炎的肝细胞 癌或慢性乙型肝炎的个体。
另一方面,本发明提供一种在个体中减少肿瘤负荷的方法,该方法包括以下步骤。即,将有效量的免疫反应性细胞施用于需要减少肿瘤负荷的个体中,从而在所述个体中诱导肿瘤细胞或病毒感染细胞的死亡。
另一方面,本发明提供一种使具有源自乙型肝炎的肝细胞癌或慢性乙型肝炎的个体的生存时间得到延长的方法,所述方法包括以下步骤。即,通过将有效量的免疫反应性细胞施用于所述个体中,从而延长所述个体的生存时间。
具体实施方式
在没有另外特殊定义的情况下,在实施本发明时,引入本技术领域范围内的分子生物学、微生物学、细胞生物学、生物化学及免疫学等现有技术。
下述实施例是为了向本领域的技术人员说明本发明的方法而提供的,本发明的范围并不限定于这些实施例。
实施例1.对hbv具有特异性的car基因的设计
设计一种具有以下结构的car。所述car在n-末端至c-末端的方向上具有以下结构。即,由鼠免疫球蛋白的前导序列、抗-hbv表面抗原抗体的scfv部分(kuerschner,t.(2000),constructionandscreeningofantibodylibrariesagainstsurfaceantigens(针对表面抗原构建和筛选抗体文库).phdthesis(博士论文),ruprecht-karls-
[表1.对hbv具有特异性的car氨基酸序列]
实施例2.载体的制备
在实施例1中制备的car基因的n-末端上导入ecorv限制性内切 酶碱基序列,在c-末端上导入ecori限制性内切酶碱基序列。通过genscript公司的「全基因合成服务(genesynthesisservices)」来进行基因合成。用ecorv/ecori限制性内切酶来处理合成的基因片段后,将其克隆到事先用相同的限制性内切酶切断的、用于表达慢病毒的psmpuw-ires-puro(cellbiolab)载体上,并将该表达载体命名为ppvl01/hbvcar(图1)。
实施例3.慢病毒载体的生成
通过将嵌入有hbvcar基因的载体和慢病毒性包装质粒导入到细胞内来生产慢病毒载体。为了产生这种慢病毒载体,从atcc中获得了作为宿主细胞的293t细胞(
实施例4.慢病毒载体的效价(titer)的确定
用0.05%的胰蛋白酶edta溶液(gibco,25200-072)对培养中的293t细胞或hela细胞(
tu/ml={(表达hbvcar的细胞的%/100)×感染时的细胞总数}/添加的病毒原液(virusstock)的体积(ml)。
实施例5.向细胞的转导
通过利用聚蔗糖密度梯度离心法,从外周血液中分离出外周血单核细胞(pmbc)。为了分离及刺激t细胞,可以在分离获得pbmc后立即使用,或者可以在冷冻保藏后解冻使用。可以通过与
实施例6.hbvcart细胞的靶细胞的杀伤效果
为了评价对所述hbvcar进行表达的t细胞对靶细胞的选择性去 除能力,准备了作为hbv-阳性及hbv-阴性细胞系的hepg2细胞(
如上所述的结果表明,超表达hbvcar的t细胞能够选择性地仅识别出hbv-阳性细胞,并将其去除。该结果表明,可以将该t细胞有效地用于源自hbv的肝细胞癌或源自hbv的慢性肝炎中。
通过以上部分,主要对本发明的优选实施例进行了说明。本发明所属领域的技术人员应当理解,在不脱离本发明的本质特性的情况下,可以实现多种变形例。因此,应从说明的角度来考虑上述实施例,而非限定的角度。本发明的范围显示在本发明的权利要求书中,而非上述说明中,在与其等同范围内的所有不同点均应解释为包含在本发明的范围内。
- 还没有人留言评论。精彩留言会获得点赞!