来源于共生发酵生成物的基质金属蛋白酶抑制剂及其应用的制作方法
本发明涉及一种基质金属蛋白酶抑制剂,特别是涉及一种来源于共生发酵生成物的基质金属蛋白酶抑制剂及其于口服组合物、皮肤外用组合物以及医药组合物的应用。
背景技术:
基质金属蛋白酶是一群基质金属蛋白酶(matrixmetallopoateinase;mmp)的总称,其具有裂解胶原和细胞外基质(extracelluarmatrix;ecm)的能力。目前已发现至少28个不同种类的基质金属蛋白酶,每种基质金属蛋白酶可分解不同的细胞外基质。
mmps除对细胞外基质(ecm)和基底膜的降解外,它们在调控细胞因子、生长因子、激素和细胞黏附分子受体等的合成和分泌中发挥重要作用,进而参与发育、进化、形态发生、组织重塑、血管新生、关节炎、心血管疾病、中风、多发性硬化症、神经退行性疾病、过敏以及癌症等一系列生理和病理过程。在上述mmp中,第2型mmp(mmp-2)属于明胶酵素,第9型mmp(mmp-9)与肿瘤转移及血管新生特别相关,mmp-2与mmp-9可透过促进微血管新生与分解组织,帮助肿瘤细胞向外扩散、移行与浸润。
过去研究显示,基质金属蛋白酶的活性可以被内源性抑制因子,例如基质金属蛋白酶抑制因子(timps)、α2巨球蛋白肝素以及reck蛋白所调控,藉此调控基质金属蛋白酶的分泌量。然而,内源性抑制因子的生物功能的多样性以及系统蛋白给药技术上的困难,使得内源性抑制因子在临床应用中受到较大的阻碍,因此研发人员尝试由天然来源产物中,试图筛选出基质金属蛋白酶抑制剂。
目前已知天然来源产物中,黄芩、肉桂、卫矛、厚朴、华钩藤、海绵等提取物,具有抑制基质金属蛋白酶活性的活性。然而,上述具有抑制基质金属蛋白酶的天然来源产物对于mmps的选择性不高,口服利用度低、代谢不稳定、生物毒性大、临床实验的副作用较大甚至无法达成预期的功效。
有鉴于此,亟需开发一种天然来源产物,以提供具有抑制基质金属蛋白酶活性的产品。
技术实现要素:
本发明的一方面是在提供一种来源于共生发酵生成物的基质金属蛋白酶抑制剂,其包含共生发酵生成物,且此共生发酵生成物为于植物性培养基中以多种发酵菌株经共生发酵步骤以及固液分离步骤而得。
本发明的另一方面是提供一种皮肤外用组合物,包含上述基质金属蛋白酶抑制剂作为有效成分。
本发明的又一方面是提供一种基质金属蛋白酶抑制剂用于制备抑制基质金属蛋白酶的口服组合物,其是以上述基质金属蛋白酶抑制剂作为有效成分。
本发明的再一方面是提供一种基质金属蛋白酶抑制剂用于制备抑制基质金属蛋白酶的医药组合物,其是以上述基质金属蛋白酶抑制剂作为有效成分,且共生发酵生成物具有抑制基质金属蛋白酶的活性。
根据本发明的上述方面,提出一种来源于共生发酵生成物的基质金属蛋白酶抑制剂,其是于植物性培养基中以多种发酵菌株经共生发酵步骤以及固液分离步骤而得,其中前述共生发酵步骤是于37℃下进行70小时至100小时,且前述发酵菌株选自于由多种乳酸菌菌株以及至少一非乳杆菌属菌株所组成的族群中的至少8者。
依据本发明一实施例,上述乳酸菌菌株包括多种双歧杆菌属(bifidobacteriumspp.)菌株和/或乳杆菌属(lactobacillusspp.)菌株。
依据本发明一实施例,上述双歧杆菌属选自于由青春双歧杆菌(b.adolescentis;bcrc14606、bcrc14607、bcrc14608、bcrc14658和/或bcrc80247)、两叉双歧杆菌(b.bifidum;bcrc11844、bcrc11845、bcrc14613、bcrc14614、bcrc14615、bcrc14630和/或bcrc14670)、短双歧杆菌(b.breve;bcrc11846、bcrc12584、bcrc14601和/或bcrc14612)、长双歧杆菌(b.longum;bcrc11847、bcrc12585、bcrc14602、bcrc14634和/或bcrc14664)及上述的任意组合所组成的族群。
依据本发明一实施例,上述乳杆菌属菌株选自于由德氏乳杆菌保加利亚亚种(l.delbrueckiisubsp.bulgaricus;bcrc10696、bcrc12297、bcrc14007、bcrc14008、bcrc14010、bcrc14069和/或bcrc14071)、瑞士乳杆菌(l.helveticus;bcrc11052、bcrc12258、bcrc12259、bcrc12296、bcrc12936、bcrc14021、bcrc14026)、鼠李糖乳杆菌(l.rhamnosus;bcrc10940、bcrc11673、bcrc12249、bcrc14027、bcrc14029、bcrc14068、bcrc14600和/或bcrc16095)、乳杆菌副干酪亚种(l.paracaseisubsp.paracasei;bcrc12188、bcrc12193、bcrc12248、bcrc14001、bcrc14023、bcrc16100、bcrc17002、bcrc17005和/或bcrc17475)、短乳杆菌(l.brevis;bcrc10361、bcrc11196、bcrc12187、bcrc12310和/或bcrc14060)、干酪乳杆菌(l.casei;bcrc10358、bcrc10697、bcrc11197、bcrc12272和/或bcrc14025)、乳杆菌属(lactobacillussp.;bcrc12945、bcrc14018、bcrc14031、bcrc14040、bcrc14044、bcrc14045、bcrc14061和/或bcrc17003)及上述的任意组合所组成的族群。
依据本发明一实施例,上述至少一非乳杆菌属菌株包括链球菌属(streptococcusspp.)菌株和/或酵母菌属(saccharomycesspp.)菌株。
依据本发明一实施例,上述链球菌属菌株包括嗜热链球菌(streptococcussalivariussubsp.thermophilus;bcrc12257、bcrc12268、bcrc12307、bcrc13869、bcrc14017、bcrc14308和/或bcrc14085)。
依据本发明一实施例,上述酵母菌属菌株包括啤酒酵母菌(saccharomycescerevisiae;bcrc20262、bcrc20263、bcrc20270、bcrc20271、bcrc20405、bcrc20496、bcrc20497、bcrc20498和/或bcrc21680)。
依据本发明一实施例,上述发酵菌株于植物性培养基的接种量可例如为3重量百分比至5重量百分比。
依据本发明一实施例,上述植物性培养基包含大豆、芝麻、薏苡、蔗糖、氯化钠及水。
依据本发明一实施例,上述植物性培养基包含1.0至10.0重量百分比的大豆、1.0至5.0重量百分比的芝麻、1.0至5.0重量百分比的薏苡、1.0至5.0重量百分比的蔗糖以及0.1至2.0重量百分比的氯化钠。
依据本发明一实施例,上述植物性培养基包含1.0至6.0重量百分比的大豆、1.0至3.0重量百分比的芝麻、1.0至3.0重量百分比的薏苡、2至5重量百分比的蔗糖以及0.2至1.0重量百分比的氯化钠。
根据本发明的另一方面,提出一种基质金属蛋白酶抑制剂用于制备具有抑制基质金属蛋白酶的口服组合物,其是以上述基质金属蛋白酶抑制剂为有效成分。
依据本发明一实施例,上述基质金属蛋白酶抑制剂具有抑制第2型基质金属蛋白酶和/或第9型基质金属蛋白酶的活性。
根据本发明的又一方面,提出一种皮肤外用组合物,其包含上述基质金属蛋白酶抑制剂,其中基质金属蛋白酶抑制剂为有效成分。
依据本发明一实施例,上述基质金属蛋白酶抑制剂具有抑制第2型基质金属蛋白酶和/或第9型基质金属蛋白酶的活性。
根据本发明的再一方面,提出一种基质金属蛋白酶抑制剂用于制备具有抑制基质金属蛋白酶的医药组合物,其是以上述基质金属蛋白酶抑制剂为有效成分。
依据本发明一实施例,上述基质金属蛋白酶抑制剂具有抑制第2型基质金属蛋白酶和/或第9型基质金属蛋白酶的活性。
应用本发明的基质金属蛋白酶抑制剂,其包含来源于共生发酵生成物,且此来源于共生发酵生成物为于植物性培养基利用多种发酵菌株经共生发酵步骤以及固液分离步骤而得,所得的基质金属蛋白酶抑制剂具有抑制基质金属蛋白酶的活性,可作为有效成分并应用于皮肤外用组合物、制备具有抑制基质金属蛋白酶的口服组合物或医药组合物。
附图说明
为使本发明的上述和其他目的、特征、优点与实施例能更明显易懂,提供附图,其中附图的详细说明如下:
图1绘示根据本发明实施例1的实验例、比较例1及比较例2所得的共生发酵生成物的hplc图谱。
图2a至图2c示出根据本发明浓度1.0~10%的实施例1的实验例(图2a)、比较例1(图2b)及比较例2(图2c)的共生发酵生成物与3t3纤维母细胞共培养后,基质金属蛋白酶(mmp-2与mmp-9)的明胶酶谱胶体照片。
具体实施方式
承前所述,本发明提供一种来源于共生发酵生成物的基质金属蛋白酶抑制剂,其包含来源于共生发酵生成物,且此共生发酵生成物为于植物性培养基利用多种发酵菌株经共生发酵步骤以及固液分离步骤而得。
展开讲,本发明此处所称的「共生发酵生成物」是指在体外将各种不同菌株,培养于发酵基质中进行共生发酵,再经固液分离等处理所得的生成物,其中包含菌体残留成分、代谢物质等。
在一实施例中,前述共生发酵生成物可例如于植物性培养基,以多种发酵菌株接种后,经共生发酵步骤以及固液分离步骤而得。在此说明的是,并非共生发酵生成物当然就具有抑制基质金属蛋白酶活性,需经实验证实才能确认。以乳酸菌发酵生成物为例,有研究显示,乳酸菌发酵生成物在体外无法抑制细胞培养液所含的第2型基质金属蛋白酶和/或第9型基质金属蛋白酶的活性。
在一实施例中,上述植物性培养基可包含例如大豆、芝麻、薏苡、蔗糖、氯化钠及水。在一例示中,上述植物性培养基可包含1.0至10.0重量百分比的大豆、1.0至5.0重量百分比的芝麻、1.0至5.0重量百分比的薏苡、1.0至5.0重量百分比的蔗糖以及0.1至2.0重量百分比的氯化钠,其余量为水。在另一例示中,上述植物性培养基可包含1.0至6.0重量百分比的大豆、1.0至3.0重量百分比的芝麻、1.0至3.0重量百分比的薏苡、2至5重量百分比的蔗糖以及0.2至1.0重量百分比的氯化钠,其余量为水。
在此说明的是,倘若植物性培养基的各成分的使用量在上述范围之外,则未经实验证实,无法预期能获得具有抑制基质金属蛋白酶活性的共生发酵生成物。
在一实施例中,上述发酵菌株选自于由多种乳酸菌菌株以及至少一非乳杆菌属菌株所组成的族群中的至少8者。在一例示中,上述发酵菌株于植物性培养基的接种量可例如为3重量百分比至5重量百分比。
依据本发明一实施例,上述乳酸菌菌株可包括但不限于多种双歧杆菌属(bifidobacteriumspp.)菌株和/或乳杆菌属(lactobacillusspp.)菌株。
在上述实施例中,双歧杆菌属可例如选自于由青春双歧杆菌(b.adolescentis;bcrc14606、bcrc14607、bcrc14608、bcrc14658和/或bcrc80247)、两叉双歧杆菌(b.bifidum;bcrc11844、bcrc11845、bcrc14613、bcrc14614、bcrc14615、bcrc14630和/或bcrc14670)、短双歧杆菌(b.breve;bcrc11846、bcrc12584、bcrc14601和/或bcrc14612)、长双歧杆菌(b.longum;bcrc11847、bcrc12585、bcrc14602、bcrc14634和/或bcrc14664)及上述的任意组合所组成的族群。
在上述实施例中,乳杆菌属菌株可例如选自于由德氏乳杆菌保加利亚亚种(l.delbrueckiisubsp.bulgaricus;bcrc10696、bcrc12297、bcrc14007、bcrc14008、bcrc14010、bcrc14069和/或bcrc14071)、瑞士乳杆菌(l.helveticus;bcrc11052、bcrc12258、bcrc12259、bcrc12296、bcrc12936、bcrc14021、bcrc14026)、鼠李糖乳杆菌(l.rhamnosus;bcrc10940、bcrc11673、bcrc12249、bcrc14027、bcrc14029、bcrc14068、bcrc14600和/或bcrc16095)、乳杆菌副干酪亚种(l.paracaseisubsp.paracasei;bcrc12188、bcrc12193、bcrc12248、bcrc14001、bcrc14023、bcrc16100、bcrc17002、bcrc17005和/或bcrc17475)、短乳杆菌(l.brevis;bcrc10361、bcrc11196、bcrc12187、bcrc12310和/或bcrc14060)、干酪乳杆菌(l.casei;bcrc10358、bcrc10697、bcrc11197、bcrc12272和/或bcrc14025)、乳杆菌属(lactobacillussp.;bcrc12945、bcrc14018、bcrc14031、bcrc14040、bcrc14044、bcrc14045、bcrc14061和/或bcrc17003)及上述的任意组合所组成的族群。
在上述实施例中,至少一非乳杆菌属菌株可包括例如链球菌属(streptococcusspp.)菌株和/或酵母菌属(saccharomycesspp.)菌株。
在上述实施例中,链球菌属菌株包括嗜热链球菌(streptococcussalivariussubsp.thermophilus;bcrc12257、bcrc12268、bcrc12307、bcrc13869、bcrc14017、bcrc14308和/或bcrc14085)。
在上述实施例中,酵母菌属菌株包括啤酒酵母菌(saccharomycescerevisiae;bcrc20262、bcrc20263、bcrc20270、bcrc20271、bcrc20405、bcrc20496、bcrc20497、bcrc20498和/或bcrc21680)。
在一实施例中,前述共生发酵步骤可例如于37℃下进行70小时至100小时,然以于37℃下进行72小时至96小时为较佳,以获得发酵产物。在另一例示中,固液分离步骤可例如过滤步骤或离心步骤,除去发酵产物的固形物,以获得共生发酵生成物。
在其他实施例中,上述共生发酵步骤以及固液分离步骤之间,更可选择性进行终止发酵步骤。在一例示中,前述终止发酵步骤可例如在90℃下进行15分钟。
在一实施例中,上述所得的共生发酵生成物可选择性进行公知的后处理步骤,例如浓缩步骤、脱色步骤和/或微生物检测步骤,端视实际需求而定。
上述所得的共生发酵生成物经体外活性试验评估后,证实具有抑制基质金属蛋白酶活性,故可进一步应用于各种剂型的组合物。适合的组合物可包括但不限于口服组合物、皮肤外用组合物和/或医药组合物。在一实施例中,上述的共生发酵生成物的口服组合物、皮肤外用组合物和/或医药组合物是以共生发酵生成物为有效成分,使上述剂型的组合物具有抑制基质金属蛋白酶的活性。在此说明的是,一般而言,目前已知天然来源产物中具有抑制基质金属蛋白酶活性者,其抑制活性的程度都有剂量及时间依存(dose-andtime-dependent)相关性。然而,本发明上述所得的共生发酵生成物在作为基质金属蛋白酶抑制剂时,具有良好的水溶性,不具有剂量依存相关的细胞毒性,更可于无剂量及时间依存表现下完全抑制基质金属蛋白酶活性,因此可提供生物安全性高、稳定、生体吸收性佳且有效的基质金属蛋白酶抑制剂。
以下利用数个实施例以说明本发明的应用,然其并非用以限定本发明,本发明技术领域中普通技术人员,在不脱离本发明的精神和范围内,可作各种修改与改变。
实施例1:制备共生发酵生成物
1.配制植物性培养基
首先,根据表1配制实施例、比较例1至2的植物性培养基。
表1
在进行发酵前,表1所列的植物性培养基可先利用公知的高压蒸气灭菌法进行灭菌,其灭菌的工艺条件可例如在121℃下进行40分钟。然后,将至少8种不同的发酵菌株分别接种至于表1的植物性培养基中,其中发酵菌株于植物性培养基的总接种量可为3%(w/v)至5%(w/v)。
在此实施例中,前述发酵菌株包括青春双歧杆菌(b.adolescentis;bcrc14606和/或bcrc14658)、两叉双歧杆菌(b.bifidum;bcrc11845和/或bcrc14615)、短双歧杆菌(b.breve;bcrc11846和/或bcrc14612)、长双歧杆菌(b.longum;bcrc12585和/或bcrc14602)、德氏乳杆菌保加利亚亚种(l.delbrueckiisubsp.bulgaricus;bcrc10696和/或bcrc14008)、瑞士乳杆菌(l.helveticus;bcrc12936和/或bcrc14026)、鼠李糖乳杆菌(l.rhamnosus;bcrc14068和/或bcrc14600)、乳杆菌副干酪亚种(l.paracaseisubsp.paracasei;bcrc14023和/或bcrc17475)、短乳杆菌(l.brevis;bcrc11196和/或bcrc12187)、干酪乳杆菌(l.casei;bcrc10697和/或bcrc11197)、乳杆菌属(lactobacillussp.;bcrc14061和/或bcrc17003)、嗜热链球菌(streptococcussalivariussubsp.thermophilus;bcrc12257和/或bcrc13869)以及啤酒酵母菌(saccharomycescerevisiae;bcrc20262和/或bcrc21680)。上述同种但不同保藏编号的菌株,各选择一种菌株与其他不同种的菌株混合使用。
接下来,上述接种后的植物性培养基进行共生发酵步骤,其是于37℃下进行72小时至96小时。所得的共生发酵生成物在终止发酵步骤以及固液分离步骤后,即获得所得的共生发酵生成物并进行后续评估。
实施例2:利用高效液相层析评估共生发酵生成物
1.共生发酵生成物的分析产物萃取
实施例1的实验例、比较例1及比较例2所得的共生发酵生成物先分别以50%乙酸乙酯萃取,再以多层(例如6层)纱布过滤后的滤液,于45℃下烘干6小时,以获得共生发酵生成物测试样品的萃取产物,取1mg样品,以2mldmso回溶,以进行高效液相层析(hplc)分析。
2.共生发酵生成物测试样品萃取产物的分析方法
hplc分析条件如下,其结果如图1所示:
(i)分析管柱:cosmosilc18;
(ii)uv-vis检测器:hitachil-7420;
(iii)检测波长:243nm;
(iv)移动相:洗提液a:甲醇/醋酸(100/0.5);
(v)洗提液b:甲醇/水/醋酸(80/20/0.5);
(vi)梯度洗提的条件:甲醇浓度在0至15分钟内从80%线性递增至84%,在15至30分钟内再递增至86%,在30至40分钟内再递增至88%,在0至50分钟内再递增至94%,在50至70分钟内再递增至100%;
(vii)流速:0.7ml/min。
参阅图1,其绘示实施例1的实验例、比较例1及比较例2所得的共生发酵生成物的hplc图谱。由图1的结果可知,不同的植物性培养基经共生发酵等步骤处理后,其峰值分布(peakpattern)亦有所不同。实验组1的共生发酵生成物出现的峰值分布(peakpattern)可作为参考,并作为未来生产共生发酵生成物的品管标准。
实施例3:评估共生发酵生成物抑制基质金属蛋白酶的活性
1.细胞培养
首先,将老鼠3t3纤维母细胞(mouse3t3fibroblasts;bcrc60071)培养于含10%胎牛血清(fetalcalfserum,hyclone)及2.5%小牛血清(bovinecalfserum,hyclone)的dulbecco’smodifiedeagle’smedium(dmem)培养基并加入3.7%(w/v)的碳酸氢钠,0.03%(w/v)的谷氨酸(l-glutamine),每毫升含100单位的青霉素(penicillin)及100毫克的链霉素(streptomycin)等抗生素,在37℃、10%co2培养箱培养,一般以1×106个细胞的细胞密度接种于75cm2的培养皿,每三至四天进行继代培养并换以新鲜培养基。之后,取约第十代的3t3细胞,进行不同浓度的共生发酵生成物的细胞实验。
2.基质金属蛋白酶活性抑制分析方法(明胶酶谱分析;gelatin-basedzymography)
将3t3老鼠纤维母细胞(mouse3t3fibroblasts;bcrc60071)与实施例1的实验例、比较例1至2的共生发酵生成物共培养,或不与前述共生发酵生成物(对照组)共培养。培养1或2天(24或48小时)后,取各组的细胞培养液,利用市售浓缩离心管,例如centricon10(millipore),浓缩成原始浓度的约100倍后,其蛋白质浓度以bio-radproteindeterminationassaykit测量,取约相同量(10g)的蛋白质,于10%的三羟甲基胺基甲烷-甘氨酸(tris-glycine)胶体(含0.1%的胶原蛋白)进行非变性的蛋白质电泳分析。待电泳完成后,于室温、缓和摇摆振荡的情形下,电泳胶片以2.5%的tritonx-100处理30分钟以恢复蛋白质的活性,电泳胶片再与developingbuffer(bio-rad)于室温下先反应30分钟,然后于37℃下再反应至少24小时。
反应完成后,电泳胶片以0.1%的考马斯蓝(coomassieblue;溶于9.2%的醋酸及45.4%的甲醇中)于室温下染色20分钟,然后以9.2%的醋酸与45.4%的甲醇清洗10分钟,重复2次。之后,以10%的醋酸与10%的甲醇清洗至代表基质金属蛋白酶活性强弱的白色条带出现为止,即完成共生发酵生成物测试样品萃取产物对于基质金属蛋白酶活性影响的分析步骤,其结果如图2a至图2c。
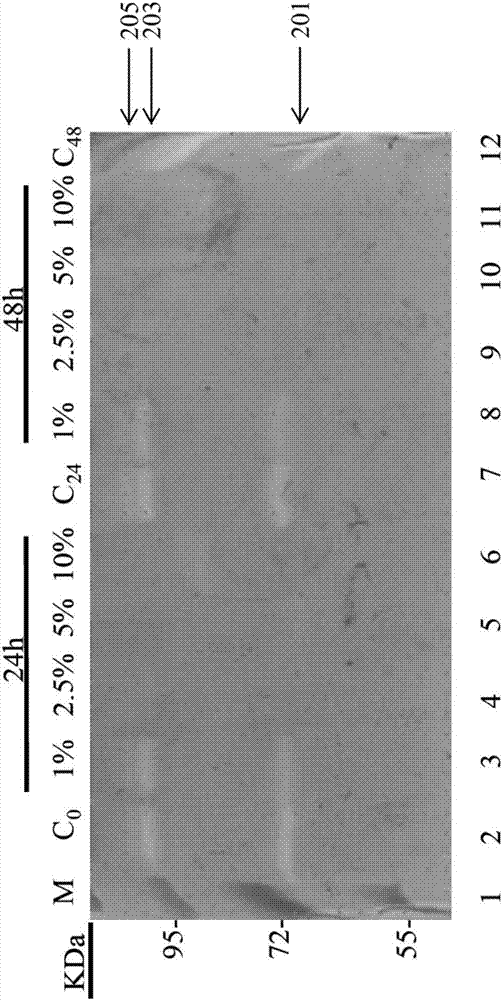
参阅图2a至2c,其示出根据本发明浓度1.0~10%的实施例1的实验例(图2a)、比较例1(图2b)及比较例2(图2c)的共生发酵生成物与3t3纤维母细胞共培养后,基质金属蛋白酶(mmp-2与mmp-9)的明胶酶谱胶体照片。在图2a至2c中,第m道代表蛋白质标记,第c0、c24、c48道分别显示未经处理的3t3老鼠纤维母细胞经0、24、48小时培养后的mmp活性。
由图2a至图2c的结果可知,本发明实施例1的实验例(图2a)的共生发酵生成物在2.5~10%的浓度(处理24、48小时)对于基质金属蛋白酶的酵素(mmp-2与mmp-9)活性均具有明显的抑制作用,甚至几乎完全抑制其活性。在此说明的是,图2a不仅显示实施例1的实验例的共生发酵生成物在体外以低剂量(2.5%)的实验例(图2a)的共生发酵生成物,于24小时内可完全抑制mmp-2与mmp-9活性,在2.5~10%的浓度皆可明显抑制对mmp-2与mmp-9活性,且其抑制作用在2.5~10%的浓度之间不具有剂量相关性。相较于其他已知具有剂量及时间相关性的天然来源产物的基质金属蛋白酶抑制剂,本发明实验例的共生发酵生成物对mmp-2与mmp-9的抑制作用显然是更加有效的。至于比较例1(图2b)的共生发酵生成物在10%的浓度(处理24、48小时)对于基质金属蛋白酶的酵素(mmp-2与mmp-9)活性才有抑制作用,比较例2(图2c)的共生发酵生成物在2.5~10%的浓度(处理24、48小时)对于基质金属蛋白酶的酵素(mmp-2与mmp-9)活性有抑制作用,但抑制效果远不及实验例(图2a)。
由于实施例1的实验例的共生发酵生成物可明显抑制mmp-2与mmp-9活性,具有保护胶原蛋白的较佳作用,也就是具有推迟胶原蛋白因老化因素而被基质金属蛋白酶破坏的抗老化能力,可作为有效成分并应用于皮肤外用组合物,例如化妆品组合物。
其次,实施例1的实验例的共生发酵生成物根据中国台湾公告的健康食品安全性评估方法,以低剂量(3.5g/kg体重/天)、中剂量(7g/kg体重/天)及高剂量(11.67g/kg体重/天)的剂量,利用胃管经口给予试验动物(雄、雌大鼠,至少为三重复的数据),进行28天亚慢性毒性试验,并未造成死亡现象以及不良临床征兆。每日体重增加量及饮水、饲料消耗量、形态、行为活动力及器官组织重量未产生与剂量相关的显著变化。血液分析及生化指针检测的结果显示喂食实施例1的实验例的共生发酵生成物与比较例或对照组间无明显差异,证实无明显亚慢性毒性,符合食品安全性的标准(图未绘示),并推估实施例1的实验例的共生发酵生成物的未观察到不良影响反应剂量(no-observed-adverse-effect-level;noael)为11.67g/kg/天。
既然实施例1的实验例的共生发酵生成物能明显抑制mmp-2与mmp-9活性,又符合食品安全性的标准,可作为有效成分,并应用于制备具有抑制基质金属蛋白酶活性的口服组合物和/或的医药组合物,甚至应用于抑制肿瘤细胞向外扩散、移行与浸润等用途。
综言之,由上述数个实施例证实,本发明来源于共生发酵生成物的基质金属蛋白酶抑制剂,成功利用多种发酵菌株经共生发酵步骤以及固液分离步骤制得,且所得的共生发酵生成物确实具有抑制基质金属蛋白酶等活性,亦可进一步抑制肿瘤细胞向外扩散、移行与浸润,可应用于皮肤外用组合物、制备具有抑制基质金属蛋白酶的口服组合物或医药组合物。
需补充的是,本发明虽以特定的工艺、特定的分析方法或特定仪器作为例示,说明本发明的具有抑制基质金属蛋白酶活性的共生发酵生成物及其应用,惟本发明所属技术领域中任何普通技术人员可知,本发明并不限于此,在不脱离本发明的精神和范围内,本发明的具有抑制基质金属蛋白酶活性的共生发酵生成物亦可使用其他工艺、其他的分析方法或其他仪器进行。
由上述实施例可知,本发明的来源于共生发酵生成物的基质金属蛋白酶抑制剂及其应用,其优点在于基质金属蛋白酶抑制剂是利用多种发酵菌株经共生发酵步骤以及固液分离步骤而得,所得的共生发酵生成物具有抑制基质金属蛋白酶的活性,可应用于皮肤外用组合物、制备具有抑制基质金属蛋白酶的口服组合物或医药组合物。
虽然本发明已以数个实施例揭露如上,然其并非用以限定本发明,在本发明所属技术领域中任何具有通常知识者,在不脱离本发明的精神和范围内,可作各种修改与改变,因此本发明的保护范围视所附权利要求书中所界定为准。
- 还没有人留言评论。精彩留言会获得点赞!
- 一种制备自噬小体型瘤苗的培养基添加剂及其制备方法与制造工艺
- N-萘烷基取代的含氮杂环衍生物、制备方法及其抗肿瘤用途与制造工艺
- 作为BET蛋白抑制剂的1H‑吡咯并[2,3‑c]吡啶‑7(6H)‑酮和吡唑并[3,4‑c]吡啶‑7(6H)‑酮的制造方法与工艺
- 一种人肿瘤抑制蛋白变体及其应用的制造方法与工艺
- 一种人肿瘤抑制蛋白变体及其应用的制造方法与工艺
- G蛋白信号调节因子6及其抑制剂在治疗脂肪肝和Ⅱ型糖尿病中的功能和应用的制造方法与工艺
- 蛋白酶体抑制剂在制备降低动物脂含量或脂储积能力产品中的应用的制造方法与工艺
- GINS2基因或蛋白的抑制剂在制备抗肿瘤药物中的应用的制造方法与工艺
- ZNF383蛋白在制备抑制p53蛋白活性的产品中的应用的制造方法与工艺
- 蛋白酶体抑制剂MLN9708的合成方法与制造工艺