一种新城疫病毒拯救方法及其应用与流程
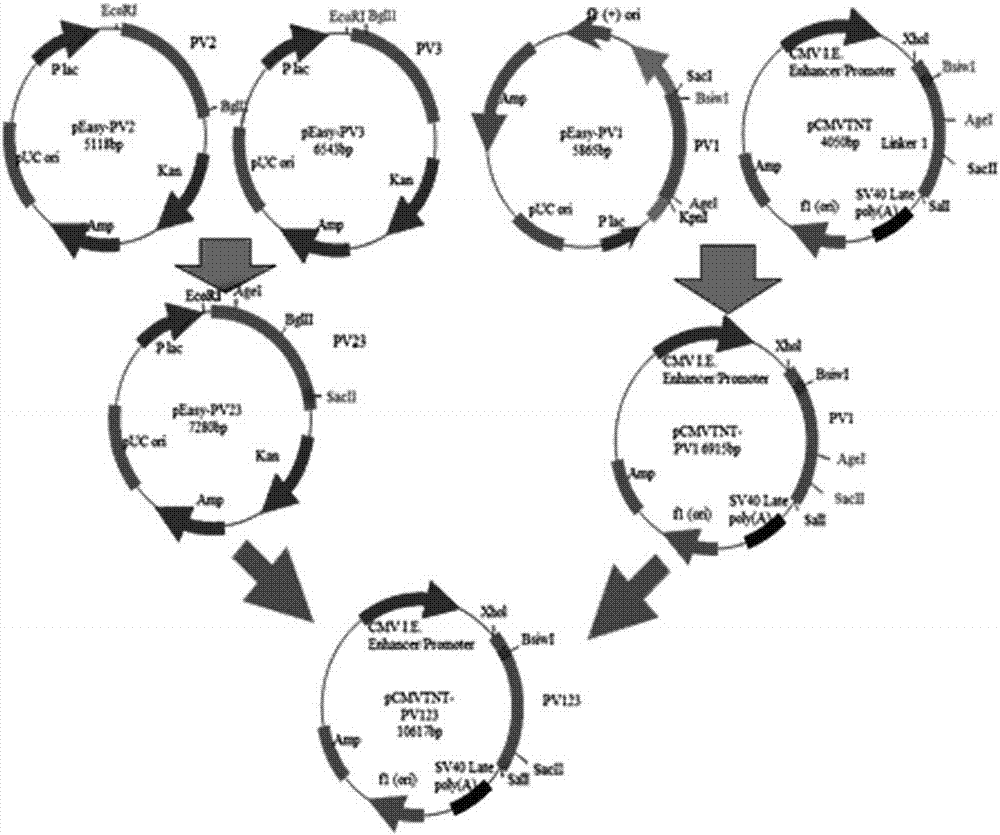
本发明涉及应用反向遗传操作技术,产生一种新城疫病毒拯救方法、使用该方法制备的新城疫病毒致弱株,以及该致弱株制备的疫苗组合物,属于生物
技术领域:
。
背景技术:
:新城疫(newcastledisease,nd)是禽副黏病毒9种血清型中的血清ⅰ型禽副黏病毒(即新城疫病毒,ndv)引起的鸡和火鸡等多种禽类急性高度接触性传染病,常呈败血症症状。新城疫是一个严重的高度传染性病毒性疾病,由于其在全球许多国家分布广泛并可能造成重大的经济损失,是家禽行业的一个主要威胁。近年来,新城疫疫苗在世界范围内得到了广泛使用,但免疫鸡群中新城疫强毒感染仍然常见,同时,临床上新城疫病毒与其它呼吸道病原体协同致病的现象也较为常见,因此,新城疫仍然是当前困扰广大养殖户的重要疫病之一。从近十年来新城疫的流行特点来看,临床上所分离到的新城疫强毒大多数属于基因ⅶ型,而常规的新城疫疫苗株的基因型主要为基因ⅱ型(如lasota、clone30、v4等),新城疫流行株与常规疫苗株在遗传距离上相差较远,因此,常规疫苗对当前新城疫病毒强毒株的攻击并不能提供全面的免疫保护效力。在制备新的新城疫疫苗过程中,常使用新城疫病毒拯救方法对新城疫病毒株进行致弱,因此,新城疫病毒拯救方法的效率是毒株致弱成功的关键。因此,如果能使用高效率的新城疫病毒拯救方法对新的流行株进行致弱,开发出与临床流行毒株相匹配的、免疫原性良好的疫苗组合物,可以有效防止我国新城疫的流行。技术实现要素:本发明涉及一种新城疫病毒拯救方法,其中,所述方法包括:步骤(1),反转录所述新城疫病毒基因组rna,制备所述新城疫病毒基因组的cdna;步骤(2),使用所述步骤(1)中获得的所述新城疫病毒基因组的cdna,构建覆盖整个基因组的七个cdna克隆片段,利用各片段间重叠部分的酶切位点,在转录载体pcmvtnt质粒连接组装获得了完整cdna克隆,在全长cdna片段的5’端引入锤头状核酶dna序列,3’端引入丁肝核酶dna序列,得到pcmv-fl质粒;步骤(3),分别构建三个克隆np、p、l蛋白的辅助质粒;以及步骤(4),将所述步骤(2)中构建的cdna全长转录载体质粒和所述步骤(3)中获得的三个辅助质粒共转染bhk-21细胞,拯救出新城疫病毒株。本发明还涉及一种新城疫病毒的致弱方法,在所述拯救方法中将所述新城疫病毒的f基因裂解位点突变为弱毒株特征112g-r-q-g-r-l117。本发明还涉及一种基因vii型新城疫病毒弱毒株,所述基因vii新城疫病毒弱毒株为新城疫病毒(基因vii型),n7a株(newcastlediseasevirus(genotypeⅶ),strainn7a),保藏于中国典型培养物保藏中心,保藏地址为中国武汉·武汉大学,保藏编号:cctccno:v201545,保藏时间为2015年10月19日。所述基因vii新城疫病毒弱毒株制备的疫苗组合物可以对流行基因ⅶ型新城疫野毒株提供有效的免疫保护,显示出良好的免疫原性。本发明还涉及一种疫苗组合物,其中,所述疫苗组合物含有免疫量的所述的基因vii型新城疫病毒弱毒株n7a或其培养物的抗原以及药学上的载体。本发明具有如下积极效果:本发明使用的反向遗传技术在新城疫病毒cdna的5’端引入锤头状核酶dna序列,该序列使得转录出的rna具有准确的5’端,且促进了转录。同时该序列并未降低病毒在细胞上的复制增殖能力,保证了高的拯救效率。本发明方法在巨细胞病毒启动子(cmvpromoter)控制下, 依赖rna聚合酶ii,以自身带有cmv启动子的真核表达载体pcmvtnt作为骨架进行全长构建,在rna聚合酶ii的驱动下,负链病毒全长crna能够稳定表达,病毒拯救效率有效提高。本发明利用反向遗传技术成功拯救出了基因vii新城疫病毒弱毒株。该毒株在鸡胚上具有高滴度、遗传性能稳定,适合于疫苗的大规模生产,可用于制造疫苗。该毒株与我国新城疫病毒的优势流行株的基因型相一致,在控制当前新城疫的发病和流行方面显示了广阔的应用前景。附图说明图1为包含全长cdna的质粒pcmv-fl的构建示意图,图1a为包含新城疫病毒cdna的1、2、3片段的表达质粒的构建示意图,图1b为包含新城疫病毒cdna的4、5、6、7片段的表达质粒的构建示意图,图1c为包含新城疫病毒全长cdna的的表达质粒的构建示意图;图2为f基因裂解位点突变示意图;图3为全长cdna的质粒pcmv-fl-n7a的酶切鉴定图,泳道1为xhoi酶切后的电泳图,泳道2为bglii酶切后的电泳图,泳道m为markerdl15000;图4为基因vii新城疫病毒致弱株n7a的rt-pcr鉴定结果图。具体实施方式以下,对本发明的实施方式进行说明。本发明涉及一种新城疫病毒拯救方法,其中,所述方法包括:步骤(1),反转录所述新城疫病毒基因组rna,制备所述新城疫病毒基因组的cdna;步骤(2),使用所述步骤(1)中获得的所述新城疫病毒基因组的cdna,构建覆盖整个基因组的七个cdna克隆片段,利用各片段间重叠部分的酶切位点,在转录载体pcmvtnt质粒连接组装获得了完整cdna克隆,在全长cdna片段的5’端引入锤头状核酶dna序列,3’端引入丁肝核酶dna序列,得到pcmv-fl质粒;步骤(3), 分别构建三个克隆np、p、l蛋白的辅助质粒;以及步骤(4),将所述步骤(2)中构建的cdna全长转录载体质粒和所述步骤(3)中获得的三个辅助质粒共转染bhk-21细胞,拯救出新城疫病毒株。作为本发明的一种实施方式,所述拯救方法步骤(1)中所述新城疫病毒为基因vii新城疫病毒株;所述拯救方法步骤(3)中所述辅助质粒为pci-neo质粒。作为本发明的一种实施方式,所述步骤(2)中包括:根据病毒基因组测序结果和转录载体pcmvtnt中酶切位点的分析,将基因组分成7个片段,扩增病毒基因组全长,引物序列如下:pv1-f:5’-ccggagctcaatcgaatcgtacgggtag-3’pv1-r:5’-cggatcaattcagaagggtgct-3’pv2-f:5’-ccggagctcatctccttacgtgacaca-3’pv2-r:5’-cggggtaccgtgtagttgcacttctt-3’pv3-f:5’-ccggagctcaatgctctgcttaggagtg-3’pv3-r:5’-cggagatcacagtcgatat-3’pv4-f:5’-ccggagctcatggtaatgatctact-3’pv4-r:5’-cggggtaccactctatcatccttga-3’pv5-f:5’-tgcgagctcattgtcttagtatcca-3’pv5-r:5’-cggggtacctcattagagttcaaat-3’pv6-f:5’-tgctcttgaatgcatccacttagca-3’pv6-r:5’-cggggtaccaagcagatcgtactt-3’pv7-f:5’-ccggagctcatagacttctcgaggt-3’pv7-r:5’-tgcaattggcgtacgattgcct-3’,通过将扩增的7个cdna片段在转录载体pcmvtnt质粒连接组装获得了包含完整cdna克隆的pcmv-fl质粒;所述步骤(3)中包括:根据对真核表达载体pci-neo及np、p和l基因的酶切位点分析,设计五对引物扩增三个基因,l基因分成三个片段扩增,其中将gccacc的kozak序列添加至每个上游引物酶切位点后。引物序列如下:np-f:5’-tattgaattcgccaccatgtcgtctgttttcgacgaat-3’np-r:5’-tatagtcgactcagtacccccagtcagtgtcgtt-3’p-f:5’-tattgaattcgccaccatggctacttttacagatgcgga-3’p-r:5’-tatagtcgactcaaccattcagcgcaaggcgt-3’l1-f:5’-tattgctagcgccaccatggcgggctccggtcc-3’l1-r:5’-tatagtcgaccaggattggttggaatctgactg-3’l2-f:5’-agatggaacaatactcagtcaggtc-3’l2-r:5’-tatagtcgactcttctcactcaggtta-3’l3-f:5’-tcattcactcaaggttgaatgcagt-3’l3-r:5’-tatagtcgacttaagagtcattattactg-3’,通过将扩增的np、p和l基因cdna克隆至pci-neo质粒获得了pci-np、pci-p、pci-l质粒。作为本发明的一种实施方式,在所述步骤(2)中,利用overlappcr方法,将所述新城疫病毒的f基因裂解位点突变为弱毒株特征112g-r-q-g-r-l117,突变引物序列如下:pv2-f:5’-ccggagctcatctccttacgtgacaca-3’p1:5’-aaggcgtccttgtctccctcctccggacgtggacaca-3’p2:5’-gagggagacaaggacgccttataggtgctgttatt-3’pv3-r:5’-cggggtaccagatcacagtcgatat-3’,并通过将所述扩增的6个cdna片段以及所述包含突变f基因裂解位点的片段在转录载体pcmvtnt质粒连接组装获得了包含完整cdna克隆的pcmv-fl-n7a质粒;所述步骤(4)中,将质粒pcmv-fl-n7a与三个辅助质粒pci-np、pci-p、pci-l共转染bhk-21细胞,转染后6小时加入终浓度为1μg/ml的tpck-trypsin,3~4日后收获培养液及细胞,反复冻融3次后离心, 上清接种10日龄spf鸡胚,获得基因vii新城疫病毒致弱株n7a。作为本发明的一种实施方式,本发明的基因vii新城疫病毒致弱株制备方法包括以下具体步骤:1、新城疫病毒plk-n-06株全基因组的测序:参照genbank中已提交的ndv序列(jn631747.1),设计14对引物,扩增片段之间部分相互重叠,连接起来可以覆盖全基因组,引物序列如下:p1-1:5’-accaaacagagaatccgt-3’p1-2:5’-ccgttgggcagcagctgcca-3’p2-1:5’-agctcatgcgtttatatcggat-3’p2-2:5’-ttagcattggacgatttatt-3’p3-1:5’-agaccagtgggactgtcatt-3’p3-2:5’-gcactttgattctacccgtat-3’p4-1:5’-attgaagagatcaggaagat-3’p4-2:5’-caggctgtcccactgctagag-3’p5-1:5’-aatcttgcgctcaatgtcact-3’p5-2:5’-cctctaatggggctttcgc-3’p6-1:5’-aattgtagtaacaggaga-3’p6-2:5’-tgagaatctagtattgag-3’p7-1:5’-gaagctgtatccctgatag-3’p7-2:5’-tggtgtctaagtccttctcat-3’p8-1:5’-tcacagggactgaagagga-3’p8-2:5’-tcatcaggaagcggtagccca-3’p9-1:5’-tgacatgattattctgagt-3’p9-2:5’-acatctcagctgcttgatt-3’p10-1:5’-tcaggtacatttgcagga-3’p10-2:5’-agcaagttggattgcagca-3’p11-1:5’-tgtcttaactggagatatca-3’p11-2:5’-ttgcttggaagatggaacca-3’p12-1:5’-agtctcttctaatatgtgtt-3’p12-2:5’-tctcttgttgtagcaaaga-3’p13-1:5’-acggatcacaccaacttgca-3’p13-2:5’-gtgcactgtttaagtgatgt-3’p14-1:5’-gagtgttacctggtatttgt-3’p14-2:5’-ccaaacaaagatttggtgaa-3’2、新城疫病毒plk-n-06株全长感染性克隆pcmv-fl的构建:根据病毒基因组测序结果和转录载体pcmvtnt中酶切位点的分析,将基因组分成7个片段,扩增病毒基因组全长,引物序列如下:pv1-f:5’-ccggagctcaatcgaatcgtacgggtag-3’pv1-r:5’-cggatcaattcagaagggtgct-3’pv2-f:5’-ccggagctcatctccttacgtgacaca-3’pv2-r:5’-cggggtaccgtgtagttgcacttctt-3’pv3-f:5’-ccggagctcaatgctctgcttaggagtg-3’pv3-r:5’-cggagatcacagtcgatat-3’pv4-f:5’-ccggagctcatggtaatgatctact-3’pv4-r:5’-cggggtaccactctatcatccttga-3’pv5-f:5’-tgcgagctcattgtcttagtatcca-3’pv5-r:5’-cggggtacctcattagagttcaaat-3’pv6-f:5’-tgctcttgaatgcatccacttagca-3’pv6-r:5’-cggggtaccaagcagatcgtactt-3’pv7-f:5’-ccggagctcatagacttctcgaggt-3’pv7-r:5’-tgcaattggcgtacgattgcct-3’3、新城疫病毒plk-n-06株三个辅助质粒的构建根据对真核表达载体pci-neo及np、p和l基因的酶切位点分析,设计五对引物扩增三个基因,l基因分成三个片段扩增,其中将kozak序列(gccacc)添加至每个上游引物酶切位点后。引物序列如下:np-f:5’-tattgaattcgccaccatgtcgtctgttttcgacgaat-3’np-r:5’-tatagtcgactcagtacccccagtcagtgtcgtt-3’p-f:5’-tattgaattcgccaccatggctacttttacagatgcgga-3’p-r:5’-tatagtcgactcaaccattcagcgcaaggcgt-3’l1-f:5’-tattgctagcgccaccatggcgggctccggtcc-3’l1-r:5’-tatagtcgaccaggattggttggaatctgactg-3’l2-f:5’-agatggaacaatactcagtcaggtc-3’l2-r:5’-tatagtcgactcttctcactcaggtta-3’l3-f:5’-tcattcactcaaggttgaatgcagt-3’l3-r:5’-tatagtcgacttaagagtcattattactg-3’4、新城疫病毒致弱株n7a的拯救利用overlappcr方法,将新城疫病毒plk-n-06的f基因裂解位点突变为弱毒株特征112g-r-q-g-r-l117,突变引物序列如下:pv2-f:5’-ccggagctcatctccttacgtgacaca-3’p1:5’-aaggcgtccttgtctccctcctccggacgtggacaca-3’p2:5’-gagggagacaaggacgccttataggtgctgttatt-3’pv3-r:5’-cggggtaccagatcacagtcgatat-3’将质粒pcmv-fl-n7a与三个辅助质粒pci-np、pci-p、pci-l共转染bhk-21细胞,转染后6小时加入终浓度为1μg/ml的tpck-trypsin,3~4日后收获培养液及细胞,反复冻融3次后离心,上清接种10日龄spf鸡胚,即获得基因vii新城疫病毒致弱株n7a。本发明涉及一种新城疫病毒弱毒株,所述新城疫病毒弱毒株为所述拯救方法制备得到的基因vii型新城疫病毒弱毒株,所述基因vii新城疫病毒弱毒株为新城疫病毒(基因vii型),n7a株(newcastlediseasevirus(genotypeⅶ),strainn7a),保藏于中国典型培养物保藏中心,保藏地址为中国武汉·武汉大学,保藏编号:cctccno.v201545,保藏时间为2015年10月19日。本发明利用反向遗传操作技术对普莱柯生物工程股份有限公司分离、鉴定、保存的基因vii新城疫病毒plk-n-06株 的f基因进行致弱突变后拯救出致弱的基因vii新城疫病毒株n7a。该毒株在鸡胚上具有高滴度、遗传性能稳定,适合于疫苗的大规模生产,可用于制造疫苗。本发明涉及一种疫苗组合物,其中,所述疫苗组合物含有免疫量的所述的基因vii型新城疫病毒弱毒株n7a或其培养物的抗原以及药学上的载体。“培养物”是病毒的不同代次传代培养物,本领域技术人员知晓不同代次之间其基因序列仅可能会发生微小的变异。作为本发明的一种实施方式,所述基因vii型新城疫病毒弱毒株n7a或其培养物的抗原为灭活全病毒抗原、亚单位抗原、或裂解病毒的抗原。本发明所用术语“疫苗组合物”指含有基因ⅶ型新城疫病毒免疫原性的药物组合物,该药物组合物可诱发、刺激或增强鸡只针对基因ⅶ型新城疫病毒的免疫反应。所述疫苗组合物包括免疫量的基因ⅶ型新城疫病毒株的减毒活疫苗、灭活疫苗、亚单位疫苗或合成肽疫苗。优选地,所述疫苗组合物包括免疫量的基因ⅶ型新城疫弱毒疫苗株n7a株或其培养物的灭活疫苗。本发明所用的术语“灭活疫苗”,也称作失活疫苗,指的是用作抗原以产生免疫力的灭活病毒的混悬液。灭活疫苗的例子包括全病毒疫苗和裂解型疫苗。使用已知方法可以很容易地产生灭活疫苗。例如,通过用甲醛溶液处理病毒可获得全病毒灭活疫苗。裂解型疫苗可在用醚处理后由病毒包膜制备得到。例如用本发明的弱毒疫苗株n7a株可以通过灭活的方法制备成灭活疫苗。优选地,所述疫苗组合物中基因ⅶ型新城疫病毒抗原为灭活的所述基因ⅶ型新城疫病毒n7a株全病毒抗原;所述疫苗组合物进一步包含佐剂。作为本发明的一种实施方式,所述基因vii型新城疫病毒弱毒株n7a的培养物为1~50代的培养物;优选地,所述基因vii型新城疫病毒弱毒株n7a的培养物为1~40代的培养物;更优选地,所述基因vii 型新城疫病毒弱毒株n7a的培养物为1~35代的培养物;进一步优选地,所述基因vii型新城疫病毒弱毒株n7a的培养物为1~30代的培养物;进一步优选地,所述基因vii型新城疫病毒弱毒株n7a的培养物为1~25代的培养物;进一步优选地,所述基因vii型新城疫病毒弱毒株n7a的培养物为1~20代的培养物;最优选地,所述基因vii型新城疫病毒弱毒株n7a的培养物为1~16代的培养物。本发明的组合物的成分或组分的量优选地是治疗有效量。所述治疗有效量是指在组合物施用的宿主中发挥它们的免疫学作用而不导致过度副作用所必需量。所用的成分和待施用的组合物的精确的量将根据因素如治疗的疾病的类型,待治疗的动物的类型和年龄,施用的方式,以及组合物中的其它成分而变化。作为本发明的一种实施方式,所述基因ⅶ型新城疫病毒弱毒株的灭活全病毒抗原含量为灭活前≥108.0eid50/0.1ml。当基因ⅶ型新城疫病毒以灭活前少于108.0eid50/0.1ml的量使用时,疫苗不能有效刺激抗体产生。另一方面,超过的量可能是不经济的。作为本发明的一种优选实施方式,所述基因ⅶ型新城疫病毒弱毒株的灭活全病毒抗原含量为灭活前108.0eid50/0.1ml~109.0eid50/0.1ml。作为本发明的一种实施方式,所述药学上可接受的载体包括佐剂,所述佐剂包括(1)氢氧化铝、皂苷、阿夫立定、dda,(2)丙烯酸或甲基丙烯酸的聚合物、顺丁烯二酸酐和链烯基衍生物的聚合物,或(3)水包油乳剂、油包水乳剂或水包油包水乳剂,所述佐剂的浓度范围是从10%到70%v/v,优选从30%到60%v/v,更优选60%v/v。作为本发明的一种优选实施方式,所述佐剂包括(1)皂苷quila;(2)丙烯酸或甲基丙烯酸聚合物与糖或多元醇的聚链烯基醚交联产物卡波姆;或(3)所述佐剂包括基于轻液体石蜡油、类异戊二烯油的乳剂,例如角鲨烷或角鲨烯;烯烃,特别是异丁烯或癸烯低聚化产生的油,带直链烷基的酸或醇形成的酯,更特别是植物油,油酸乙基酯,丙二醇二(辛酸酯/癸酸酯),甘油三(辛酸酯/癸酸酯),丙二醇二油酸酯;分支脂肪酸酯或醇的酯,特别是异硬脂酸酯、油与乳化剂一起使用形成乳剂,乳化剂优选非离子表面活性剂;特别是聚氧乙烯化脂肪酸(例如 油酸),脱水山梨糖醇、甘露醇(例如脱水甘露醇油酸酯)、甘油、聚甘油、丙二醇和可选地乙氧基化的油酸、异硬脂酸、蓖麻油酸、羟基硬脂酸形成的酯,脂肪醇和多元醇(例如油醇)的醚,聚氧丙稀-聚氧乙烯嵌段共聚物,特别是pluronicr,尤其是l121。术语“佐剂”指加入到本发明的组合物中以增加组合物的免疫原性的物质。已知的佐剂包括,但不限于:(1)氢氧化铝、皂苷(saponine)(例如quila)、阿夫立定、dda,(2)丙烯酸或甲基丙烯酸的聚合物、顺丁烯二酸酐和链烯基衍生物的聚合物,或(3)疫苗可以以水包油、油包水或水包油包水乳剂形式制成。尤其是,乳剂可以基于轻液体石蜡油、类异戊二烯油,例如角鲨烷或角鲨烯;烯烃,特别是异丁烯或癸烯低聚化产生的油,带直链烷基的酸或醇形成的酯,更特别是植物油,油酸乙基酯,丙二醇二(辛酸酯/癸酸酯),甘油三(辛酸酯/癸酸酯),丙二醇二油酸酯;分支脂肪酸酯或醇的酯,特别是异硬脂酸酯。油与乳化剂一起使用形成乳剂。乳化剂优选非离子表面活性剂,特别是聚氧乙烯化脂肪酸(例如油酸),脱水山梨糖醇、甘露醇(例如脱水甘露醇油酸酯)、甘油、聚甘油、丙二醇和可选地乙氧基化的油酸、异硬脂酸、蓖麻油酸、羟基硬脂酸形成的酯,脂肪醇和多元醇(例如油醇)的醚,聚氧丙稀-聚氧乙烯嵌段共聚物,特别是pluronicr,尤其是l121(参照hunter等,1995,“thetheoryandpracticalapplicationofadjuvants”(steward-tull,d.e.s主编)johnwileyandsons,ny,51-94;todd等,vaccine,1997,15,564-570)。特别地,丙烯酸或甲基丙烯酸聚合物通过糖或多元醇的聚链烯基醚交联。这些化合物被称作卡波姆。优选地,本发明选用佐剂为白油佐剂,制备油包水乳剂。在最终疫苗组合物中,佐剂的浓度范围是从10%到70%v/v,优选从30%到60%v/v,更优选60%v/v。本发明疫苗组合物还可以进一步将其他的试剂加入到本发明的组合物。例如,本发明的组合物还可以包含试剂,如:药物,免疫刺激剂(如:α-干扰素、β-干扰素、γ-干扰素、粒细胞巨噬细胞集落刺激因子 (gm-csf)、巨噬细胞集落刺激因子(m-csf)和白介素2(il2))、抗氧化剂、表面活性剂、着色剂、挥发性油、缓冲剂、分散剂、推进剂和防腐剂。为了制备这样的组合物,可以使用本领域公知的方法。本发明涉及所述的疫苗组合物在制备预防和治疗新城疫相关疾病的药物中的应用。术语“预防”指通过其与基因ⅶ型新城疫病毒相关的感染或疾病的症状被阻断或延迟;术语“治疗”指通过与基因ⅶ型新城疫病毒相关的感染或疾病的症状被缓和或完全消除的过程。本发明具有以下突出的优点:本发明使用pcmvtnt质粒克隆新城疫基因组全长cdna,并在5’端添加锤头状核酶dna序列,成功地在bhk-21细胞中拯救出新城疫病毒。ndv虽然只有一个血清型,但是疫苗株和流行株在基因型和抗原位点上都差异较大;国内外研究表明,当疫苗株与流行株的基因型一致时,其不仅能提供理想的临床保护,而且能显著降低免疫鸡的强毒感染率和排毒量,在临床上可有效控制免疫鸡群中非典型新城疫的发生;本发明提供的基因ⅶ型新城疫弱毒疫苗株,免疫效果良好,有利地预防新城疫病毒的感染。下面结合具体实施实例对本发明做进一步的描述。实施例1:新城疫病毒plk-n-06株全基因组的测序:参照rna提取试剂盒的说明书,提取ndvplk-n-06株病毒液的总rna,分别使用p1~p14的下游引物进行反转录反应,制备病毒的cdna,以得到的cdna为模板,使用设计的14对引物扩增病毒全基因组。pcr产物经1%琼脂糖凝胶电泳鉴定条带大小与预期相符后,将pcr产物按照胶回收试剂盒说明书进行回收纯化。将回收后的dna片段克隆至peasy-blunt载体,转化进e.colidh5α感受态细胞中,筛选阳性克隆,并进行测序分析。实施例2:新城疫病毒plk-n-06株全长感染性克隆pcmv-fl的构建:根据对新城疫病毒plk-n-06株基因组序列和转录载体pcmvtnt中酶切位点的分析,将基因组分成7个片段,经rt-pcr从plk-n-06株感染的尿囊液中扩增得到目的片段,分别连入到克隆载体peasy-blunt中。首先在全长cdna片段的5’端引入锤头状核酶(hamrz),3’端引入丁肝核酶序列(hdvrz),将基因组3’和5’端序列,连入转录载体中,再通过酶切、连接将七个片段依次连入转录载体中,最后得到含有病毒全长cdna的转录载体pcmv-fl。图1a展示了新城疫病毒plk-n-06株基因组cdna片段1、2、3连接到转录载体pcmvtnt的过程,制备的质粒为pcmvtnt-pv123,图1b展示了新城疫病毒plk-n-06株基因组cdna片段4、5、6、7连接到转录载体pcmvtnt的过程,制备的质粒为pcmvtnt-pv4567,图1c展示了由质粒pcmvtnt-pv123和质粒pcmvtnt-pv4567制备含有新城疫病毒基因组全长cdna的表达载体的过程,制备的质粒为pcmvtnt-fl。使用引物其序列如下:pv1-f:5’-ccggagctcaatcgaatcgtacgggtag-3’pv1-r:5’-cggatcaattcagaagggtgct-3’pv2-f:5’-ccggagctcatctccttacgtgacaca-3’pv2-r:5’-cggggtaccgtgtagttgcacttctt-3’pv3-f:5’-ccggagctcaatgctctgcttaggagtg-3’pv3-r:5’-cggagatcacagtcgatat-3’pv4-f:5’-ccggagctcatggtaatgatctact-3’pv4-r:5’-cggggtaccactctatcatccttga-3’pv5-f:5’-tgcgagctcattgtcttagtatcca-3’pv5-r:5’-cggggtacctcattagagttcaaat-3’pv6-f:5’-tgctcttgaatgcatccacttagca-3’pv6-r:5’-cggggtaccaagcagatcgtactt-3’pv7-f:5’-ccggagctcatagacttctcgaggt-3’pv7-r:5’-tgcaattggcgtacgattgcct-3’。实施例3:新城疫病毒plk-n-06株三个辅助质粒的构建:以新城疫病毒plk-n-06的cdna为模板,使用设计的np、p基因的两对引物扩增病毒np、p基因。pcr产物经1%琼脂糖凝胶电泳鉴定条带大小与预期相符后,将pcr产物按照胶回收试剂盒说明书进行回收纯化。将回收后的dna片段克隆至pci-neo载体,转化进大肠杆菌dh5α感受态细胞中,筛选阳性克隆,酶切鉴定正确的质粒命名为pci-np、pci-p,并进行测序分析。以新城疫病毒plk-n-06的cdna为模板,使用设计的l基因的三对引物扩增病毒l1、l2、l3片段。pcr产物经1%琼脂糖凝胶电泳鉴定条带大小与预期相符后,将pcr产物按照胶回收试剂盒说明书进行回收纯化。将回收后的l1片段用nhei和sali双酶切后,回收l1片段与经过同样双酶切的pci-neo载体进行连接、转化,得到质粒pci-l1。将回收后的l2片段用bsu36i和sali双酶切后,回收l2片段与经过同样双酶切的pci-l1载体进行连接、转化,得到质粒pci-l12。将回收后的l3片段用mlui和sali双酶切后,回收l3片段与经过同样双酶切的pci-l12载体进行连接、转化,最终得到质粒pci-l123,即pci-l,并进行测序分析。使用引物其序列如下:np-f:5’-tattgaattcgccaccatgtcgtctgttttcgacgaat-3’np-r:5’-tatagtcgactcagtacccccagtcagtgtcgtt-3’p-f:5’-tattgaattcgccaccatggctacttttacagatgcgga-3’p-r:5’-tatagtcgactcaaccattcagcgcaaggcgt-3’l1-f:5’-tattgctagcgccaccatggcgggctccggtcc-3’l1-r:5’-tatagtcgaccaggattggttggaatctgactg-3’l2-f:5’-agatggaacaatactcagtcaggtc-3’l2-r:5’-tatagtcgactcttctcactcaggtta-3’l3-f:5’-tcattcactcaaggttgaatgcagt-3’l3-r:5’-tatagtcgacttaagagtcattattactg-3’。实施例4:新城疫病毒致弱株n7a的拯救:利用pv2-f、p1和p2、pv3-r两对引物,通过overlappcr方法,将新城疫病毒plk-n-06的f基因裂解位点突变为弱毒株特征112g-r-q-g-r-l117。图2展示了将f基因裂解位点突变前后的核苷酸序列变化以及对应的氨基酸序列变化。突变引物序列如下:pv2-f:5’-ccggagctcatctccttacgtgacaca-3’p1:5’-aaggcgtccttgtctccctcctccggacgtggacaca-3’p2:5’-gagggagacaaggacgccttataggtgctgttatt-3’pv3-r:5’-cggggtaccagatcacagtcgatat-3’。将含有突变后的新城疫病毒plk-n-06全长cdna的表达载体pcmv-fl-n7a用限制性内切酶进行酶切鉴定,酶切后产物的电泳图见图3,其中,泳道1为使用xhoi酶切后产物,泳道m为分子marker,泳道2为bglii酶切后产物。将bhk-21细胞铺于六孔板中生长至80%~90%单层,转染前用pbs轻轻洗涤细胞3次,将dmem培养基换为opti-mem培养基,将总共6μg的全长质粒、pci-np、pci-p和pci-l用转染试剂2000按照2∶2∶1∶1的比例共转染bhk-21细胞,6小时后用pbs轻轻洗涤3次后换液,opti-mem培养基中加入tpck-trypsin(1μg/ml),混合均匀继续孵育3~4日。收获培养液及细胞,反复冻融3次后离心,上清接种10日龄spf鸡胚,每胚0.2ml。置37℃继续孵育,每日照蛋检查1~2次,选接种后72~120小时死亡与120小时存活的鸡胚,收获鸡胚液,命名为n7a株。实施例5:新城疫病毒致弱株n7a的rt-pcr鉴定:提取新城疫病毒致弱株n7a株病毒液的rna,反转录后用全长感染性克隆pcmv-fl的构建中的pv3-f和pv3-r进行扩增并测序,其包含f基因的全长,扩增片段的测序结果显示f基因的裂解位点已突变成功,测序结果见图4。用于扩增新城疫病毒致弱株n7a株中f基因的引物序列为:pv2-f:5’-ccggagctcatctccttacgtgacaca-3’pv3-r:5’-cggggtaccagatcacagtcgatat-3’实施例6:新城疫病毒致弱株n7a红细胞凝集价和病毒含量的测定按现行《中国兽药典》附录进行,测定n7a株毒种的ha效价。将n7a株毒种用灭菌生理盐水作10倍系列稀释,取10-7、10-8、10-9及10-104个稀释度,各经尿囊腔接种10日龄spf鸡胚5枚,每胚0.1ml,置36~37℃继续孵育,48小时前死亡的鸡胚弃去不计,在48~120小时死亡的鸡胚随时取出置2~8℃,至120小时,取出所有活胚,48~120小时死亡与120小时存活的鸡胚,逐胚测定红细胞凝集价,凝集价不低于1∶128(微量法)者判为感染,计算eid50。结果见表1。表1鸡新城疫病毒n7a株毒种的ha效价及病毒含量测定结果病毒株ha效价病毒含量(lgeid50/0.1ml)n7a株1∶5129.5结果显示,n7a株新城疫病毒弱毒疫苗株生长滴度高,具有良好的生物学特性。实施例7:新城疫病毒致弱株n7a对鸡脑内致病指数(icpi)和对鸡胚最小致死量的平均死亡时间(mdt/mld)的测定:按《兽用生物制品规程》(二〇〇〇年版)附录进行,分别测定n7a株毒种的icpi。对鸡胚最小致死量的平均死亡时间(mdt/mld)按《中华人民共和国兽用生物制品规程》(二〇〇〇年版)附录进行,分别测定n7a株毒种的mdt/mld。结果显示新城疫病毒致弱株n7a株毒种的icpi值为0.25,mdt/mld分别为112,符合弱毒株的特征。实施例8:新城疫病毒致弱株n7a的特异性:(1)hi试验将n7a株毒种根据ha效价分别配制4单位抗原,用ndv阳性血清、edsv阳性血清、aiv(h9亚型)阳性血清、aiv(h7亚型)阳性血清和aiv(h5亚型)阳性血清分别按现行《中国兽药典》附录进行hi试验,测定各血清的hi效价。经hi试验测定,n7a株毒种的血凝活性仅可被鸡新城疫病毒阳性血清所抑制,表明,拯救的n7a株为鸡新城疫病毒,无其它血凝性病毒存在。结果见表2。表2重组鸡新城疫病毒n7a株毒种的hi试验结果(2)鸡胚中和试验将n7a株毒种用无菌生理盐水稀释至105.0eid50/0.1ml,分别与等量抗鸡新城疫病毒阳性血清混合,室温中和1小时后,各经尿囊腔接种10日龄spf鸡胚10枚,每胚0.2ml,接种后置37℃孵育120小时,观察并记录结果。将重组鸡新城疫病毒n7a株毒种分别与抗鸡新城疫病毒阳性血清进行中和,接种鸡胚后120小时,鸡胚均10/10存活,且鸡胚液均无血凝性。表明毒种可被鸡新城疫阳性血清完全中和。结果见表3。表3鸡胚中和试验检测重组鸡新城疫病毒n7a株毒种的特异性结果试验项目n7a株鸡胚存活比例10/10鸡胚液血凝性10/10(-)实施例9n7a株新城疫病毒灭活疫苗的制备ndvn7a株毒种用灭菌生理盐水稀释10,000倍,接种10日龄spf鸡胚20枚,每胚接种0.1ml,置37℃继续孵育。将接种后24h内死胚弃去,24h~120h死胚及时放4℃,120h收混合样,测定制苗毒的ha和eid50分别为9.6和109.5eid50/0.1ml。将测定好效价的新城疫病毒液导入灭活罐内,计量加入10%甲醛溶液,开启搅拌机搅拌,使其充分混合,甲醛的最终浓度为0.1%,37℃灭活16小时。按照表4组分配比,将灭活完全的病毒液徐徐加入到白油佐剂中,同时开动电机,以4000r/min搅拌30~40分钟,在终止搅拌前加入1%硫柳汞溶液,使其最终浓度为0.01%。表4n7a株新城疫病毒灭活疫苗配比组分疫苗1疫苗2n7a株抗原(eid50/0.1ml)108.0109.0白油佐剂(v/v)60%60%实施例10n7a株新城疫病毒灭活疫苗效力试验取30日龄的spf鸡50只,分成5组,每组10只,第1组和第2组分别胸部肌肉注射免疫实施例9制备的疫苗1,第3组和第4组分别胸部肌肉注射免疫实施例9制备的疫苗2,免疫剂量为20μl,第5组不免疫作为对照。所有试验鸡均隔离饲养,免疫21日后,连同对照组采血分离血清,测定hi抗体效价,同时第1组、第3组和第5组用hn1101株105eid50/只的剂量肌肉注射攻击,第2组、第4组和第6组plk-n-06株105eid50/只的剂量肌肉注射攻击,观察14日,记录发病、死亡及保护数。结果见表5。表5n7a株新城疫病毒灭活疫苗效力试验结果注:hi抗体测定为免疫鸡抗体的几何平均数,标示为x±sd,x代表平均数,sd代表标准差。结果显示,疫苗1和疫苗2组在免疫后21天均能产生较高的抗体,而且两组和对照相比,可以完全保护强毒的攻击。证明了疫苗1和疫苗2均能保护致死剂量的强毒攻击,疫苗含量不小于108.0eid50/0.1ml即可提供对鸡群的完全保护。实施例11lasota株新城疫病毒灭活疫苗的制备取lasota株毒种按照实施例9的制备方法制备lasota株新城疫病毒灭活疫苗,疫苗组分含量见表6。表6lasota株新城疫灭活疫苗配比组分疫苗3lasota(eid50/0.1ml)108.0白油佐剂(v/v)60%实施例12n7a株新城疫病毒灭活疫苗免疫原性对比试验取实施9制备的疫苗1及实施例11制备的疫苗3分别免疫21~28日龄spf鸡,疫苗1免疫20只鸡,疫苗3免疫20只鸡,20μl/只,共40只,对照组10只鸡,胸部肌肉注射,免前、免后21日和28日对全部鸡只采血分离血清,进行hi抗体效价测定(自身抗原)。免后28日,用hn1101株和f48e9攻毒,攻毒剂量105eld50,滴鼻点眼进行攻毒,攻毒后每天观察,观察14日,记录免疫组和攻毒对照组鸡只食欲、粪便、发病症状及有无死亡,在攻毒后第5天分别采集免疫组每只鸡的喉头和泄殖腔拭子,将所有的喉头和泄殖腔拭子分别接胚,每个拭子接胚3枚进行病毒分离,鸡胚液ha>1:16即判为病毒分离阳性。阴性样本需盲 传一代后再进行判定。试验分组情况见表7。表7n7a株新城疫病毒灭活疫苗免疫原性对比试验分组疫苗1免疫组免疫后21日至28日hi抗体平均值达到了1∶64以上,且对照组鸡均不高于1∶4。说明疫苗的血清学方法检验结果均达到了同类疫苗的质量标准,而且在免疫后28天疫苗1对自身抗原产生的hi抗体较疫苗3高。具体结果见表8。表8对比试验免疫后7天、14天、21天和28天hi抗体检测情况各免疫组攻毒后观察14天,各免疫组均未见发病或死亡,均达到了现在ndv疫苗的质量标准。攻毒后第5天采集喉头和泄殖腔棉拭子,分别进行病毒分离检测排毒,阴性样品盲传一代。结果n7a株各免疫组均未见排毒。对照组存活鸡两种拭子样品均为排毒阳性。具体结果见表9、10。表9对比试验攻毒保护结果表10对比试验攻毒第5天喉头和泄殖腔的排毒情况注:“/”表示此项无内容;“+a”表示喉头和泄殖腔排毒均为阳性;“—”表示喉头和泄殖腔排毒均为阴性。结论:免疫后第7天可以检测到抗体,免疫21天后抗体滴度较高,而且ndvn7a较经典疫苗株lasota抗体高,ndvn7a免疫后可以完全保护基因ⅶ型野毒和标准强毒f48e9的攻击,本发明的疫苗组合物不仅能够预防基因ⅶ型ndv的感染且对经典ndv也能有效免疫,并较lasota免疫组保护率更高,与lasota免疫组攻毒后相比,能够保证检测不到排毒,对于预防非典型性新城疫的爆发有着重要的作用。说明本发明疫苗组合物能对鸡群更全面的保护,更有利于生物安全。以上所述仅是本发明的优选实施例而已,并非对本发明做任何形式上的限制,虽然本发明已以优选实施例揭露如上,然而并非用以限 定本发明,任何熟悉本专业的技术人员,在不脱离本发明技术方案的范围内,当可利用上述揭示的技术内容作出些许更动或修饰为等同变化的等效实施例,但凡是未脱离本发明技术方案的内容,依据本发明的技术实质对以上实施例所作的任何简单修改、等同变化与修饰,均仍属于本发明技术方案的范围内。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1