一种CAR‑T细胞的制备方法与流程
本发明涉及生物工程技术领域,更具体地说,涉及一种car-t细胞的制备方法。
背景技术:
car-t(chimericantigenreceptort-cellimmunotherapy,嵌合抗原受体t细胞免疫疗法)是通过基因修饰获得携带识别肿瘤抗原特异性受体t淋巴细胞的个性化治疗方法。
目前,car-t细胞(即嵌合抗原受体t细胞)的培养采用培养瓶或培养皿于洁净的实验室内进行,培养过程过无规范流程,难以实现car-t细胞的大规模培养。
综上所述,如何提供一种适用于car-t细胞的制备方法,以便于实现car-t细胞的大规模生产,是本领域技术人员亟待解决的技术问题。
技术实现要素:
有鉴于此,本发明提供一种car-t细胞的制备方法,其利用分离培养罐制备car-t细胞,步骤规范,便于实现car-t细胞的大规模生产。
为实现上述目的,本发明提供如下技术方案:
一种car-t细胞的制备方法,用于全封闭的car-t细胞制备设备,包括:
1)将血液样本和等体积的淋巴细胞分离液加入分离培养罐中进行离心分离以获得单个核细胞;
2)对所述单个核细胞进行分选以获得t细胞;
3)在所述分离培养罐中对所述t细胞进行诱导培养;
4)将带有目的基因的载体和经过诱导培养的t细胞按照预设比例混合后进行基因转导;
5)于所述分离培养罐内对经基因转导的细胞进行扩增培养;
6)获得car-t细胞终产品,进行包装。
优选的,上述car-t细胞的制备方法中,所述步骤1)中分离培养罐以800g离心力转动15min-30min。
优选的,上述car-t细胞的制备方法中,所述步骤2)包括:
21)对离心分离获得的单个核细胞进行洗涤;
22)加入带有t细胞对应标志物抗体的磁珠以对所述分离培养罐中的单个核细胞进行孵育;
23)使所述磁珠排出所述分离培养罐再进行磁分选以获得t细胞。
优选的,上述car-t细胞的制备方法中,所述步骤3)为:向所述分离培养罐中加入所述t细胞所需的诱导培养基和细胞因子。
优选的,上述car-t细胞的制备方法中,进行所述步骤3)时需维持所述分离培养罐中温度为37℃,co2浓度为5%。
优选的,上述car-t细胞的制备方法中,所述步骤5)为:向所述分离培养罐中加入培养基和细胞因子,排出所述分离培养罐中的废液。
优选的,上述car-t细胞的制备方法中,进行所述步骤5)时需每间隔预设时间采集所述分离培养罐内的细胞进行样品进行计数和质量监测。
优选的,上述car-t细胞的制备方法中,所述步骤6)包括:
61)提取分离培养罐中的细胞样品进行计数和质量监测,并在监测结果为合格时进入步骤62);
62)将所述分离培养罐中的培养基排出;
63)向所述分离培养罐内加入生理盐水进行细胞洗涤,将形成的上清液排出;
64)收集car-t细胞终产品,进行包装。
本发明提供一种car-t细胞的制备方法,用于全封闭的car-t细胞制备设备,其包括:1)将血液样本和等体积的淋巴细胞分离液加入分离培养罐中进行离心分离以获得单个核细胞;2)对上述单个核细胞进行分选以获得t细胞;3)在分离培养罐中对t细胞进行诱导培养;4)将带有目的基因的载体和经过诱导培养的t细胞按照预设比例混合后进行基因转导;5)于分离培养罐内对经基因转导的细胞进行扩增培养;6)获得car-t细胞终产品,进行包装。
上述car-t细胞的制备方法中,利用分离培养罐制备car-t细胞,相比于现有技术中利用培养皿体外培养car-t细胞的方式,其步骤规范,更便于实现car-t细胞的大规模生产。
附图说明
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
图1为本发明实施例提供的car-t细胞的制备方法的流程图;
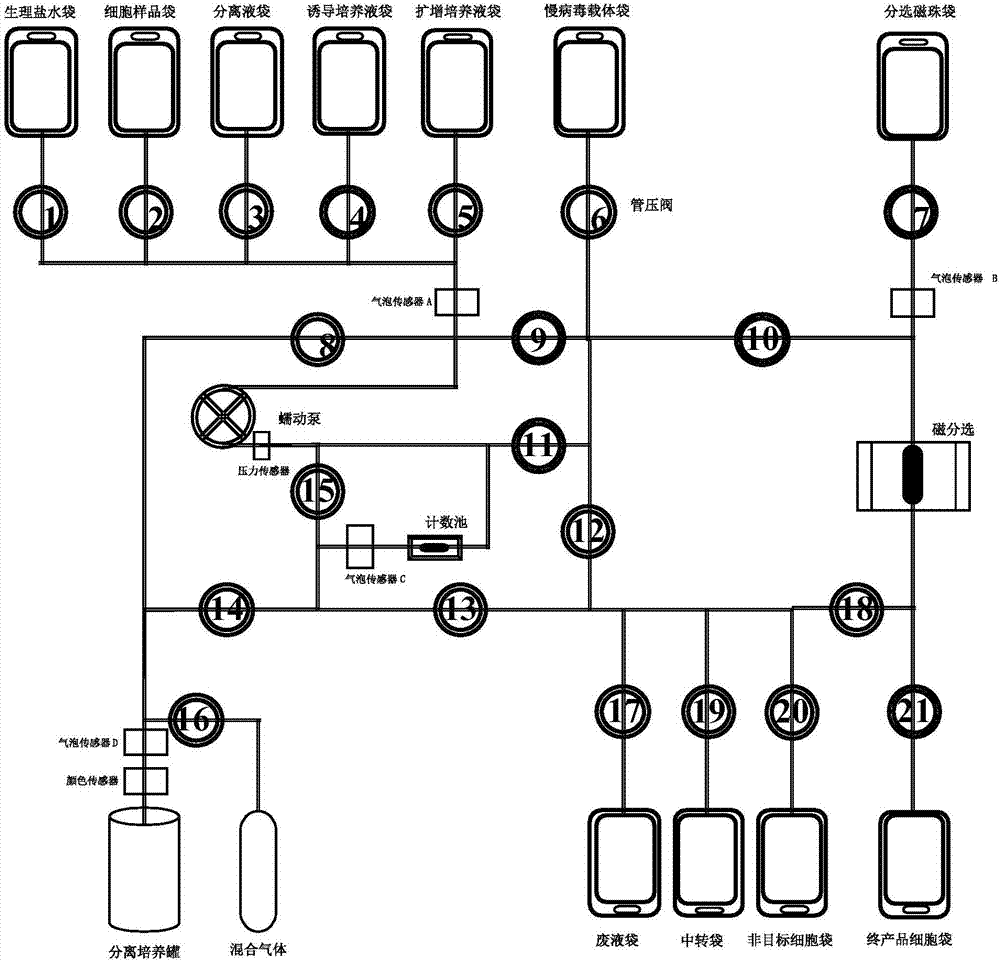
图2为本发明实施例提供的car-t细胞的制备设备的结构示意图;
图3为本发明实施例提供的car-t细胞的制备设备的另一结构示意图。
具体实施方式
本发明实施例公开了一种car-t细胞的制备方法,其利用分离培养罐制备car-t细胞,步骤规范,便于实现car-t细胞的大规模生产。
下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
请参阅图1-图2,本发明实施例提供一种car-t细胞的制备方法,用于全封闭的car-t细胞制备设备,其包括:
1、将血液样本和等体积的淋巴细胞分离液加入分离培养罐中进行离心分离以获得单个核细胞。
该步骤中分离培养罐以800g离心力转动15min-30min进行物理学密度梯度离心分离。分离结束后需将废液袋转移至废液袋。
2、对上述单个核细胞进行分选以获得t细胞。该步骤包括:
21)对离心分离获得的单个核细胞进行洗涤;
洗涤是向分离培养罐中加入生理盐水,然后使分离培养罐以预设离心力转动预设时间,结束后将上清液抽至废液袋中;具体操作时该洗涤步骤需进行1-2次;
进行如上洗涤过程时可采集样品进入计数池支路进行计数和形态观察等质量监测。
22)加入带有t细胞对应标志物抗体的磁珠以对分离培养罐中的单个核细胞进行孵育;孵育需进行10min-20min,孵育结束后需向分离培养罐中加入生理盐水进行洗涤以去除未结合的抗体磁珠,洗涤时分离培养罐以500g离心力转动5min-10min;
23)使磁珠(指已结合的磁珠)排出分离培养罐再进行磁分选以获得t细胞;
上述磁分选于带有分选柱的磁分选部件处进行,上述已结合的磁珠缓慢通过磁分选部件,并且结合有t细胞的磁珠停留于分选柱,未结合t细胞的磁珠排至非目的细胞袋内。
以上步骤23)之后还包括:24)移去磁分选部件处的磁场以获得高纯度的t细胞,将t细胞转移至分离培养罐中,并在转移完成后采集分离培养罐中t细胞样品进行计数和质量监测。
3、在分离培养罐中对t细胞进行诱导培养。
该步骤具体为向分离培养罐中加入t细胞所需的诱导培养基和细胞因子,并维持分离培养罐中环境温度为37℃,co2浓度为5%。
4、将带有目的基因的载体和经过诱导培养的t细胞按照预设比例混合后进行基因转导;
该步骤中基因转导可设置为电转导,相应的,该电转导由car-t细胞的制备设备中的电转化模块完成,如图3所示;基因转导还可设置为慢病毒转导,相应的操作时需将预先准备的慢病毒载体加入t细胞中混合培养6-10小时,实施该基因转导方案的car-t细胞的制备设备如图2所示。
上述全封闭的car-t细胞制备设备可根据生产需要求来采用电转导或基因转导,通过应用该全封闭的car-t细胞制备中不同的管路装置,最终都能够达到car-t细胞基因转导的目的。
5、于分离培养罐内对经过基因转导细胞进行扩增培养。
该步骤为向分离培养罐中加入培养基,排出分离培养罐中的废液。具体操作时,需每间隔预设时间(24小时)采集上述经过基因转导的细胞样品进行计数和质量监测,并根据监测结果进行相应操作,如:若监测结果为细胞生长过慢,则先使分离培养罐以500g离心力离心5min-10min后抽取分离培养罐中的培养基至废液袋,再向分离培养罐中加入新鲜的培养基和细胞因子;若监测结果为细胞生长较快,则向分离培养罐中加入新鲜的培养基和细胞因子。
具体进行步骤5的过程中需使分离培养罐维持温度为37℃,co2浓度为5%。
6、获car-t细胞终产品,进行包装。该步骤包括:
61)提取分离培养罐中的car-t细胞样品进行计数和质量监测,并在监测结果为合格时进入步骤62);
62)将分离培养罐中的培养基排出;
具体先使分离培养罐以500g离心力转动5min-10min,然后排尽培养基至废液袋中;
63)向分离培养罐内加入生理盐水对car-t细胞进行洗涤,再将形成的上清液排出;
洗涤时分离培养罐以500g离心力离心5min-10min,且洗涤需进行1-2次;
64)收集car-t细胞终产品,进行包装。包装具体指对用于盛装car-t细胞终产品的包装袋采用热合封管机封管。
如上car-t细胞的制备方法由专门的car-t细胞生产设备自动实施,该car-t细胞生产设备包括生理盐水袋、废液袋和分离培养罐,以及用于连接个各部件的管路等,管路上设有管压阀1-21,car-t细胞制备过程中通过控制各个管压阀的开闭即可实现液体于不同的部件之间流转,避免人为因素的干扰,大大降低细胞的污染风险,能够确保car-t细胞的质量,且无需提供gmp(生产质量管理规范)环境,减小环境投入,利于降低成本。由于采用car-t细胞制备设备实施上述制备方法,故步骤1之前还包括步骤0:对car-t细胞制备设备的管路进行预冲洗。
另外,上述细胞制备方法中,细胞的质量监测由car-t细胞制备设备的中央数据处理器自动完成,其上述中央数据处理器预置专家数据库系统,质量检测时拍摄细胞的图片并针对每一次采集到的图像进行比对和判断。
显然,本发明实施例提供的car-t细胞制备方法利用分离培养罐制备car-t细胞,相比于现有技术中人工利用培养皿体外培养car-t细胞的方式,其步骤规范,更便于实现car-t细胞的大规模生产。
并且,上述细胞制备方法中具有多个对细胞进行质量监测的步骤,能够在各个环节保证细胞质量,利于提高car-t细胞终产品的合格率;再者上述质量检测的步骤以过程检验的方式实现car-t细胞制备质量的各个环节监控,分环节获取细胞制备流程中的细胞图像信息(包括细胞形态、灰度、密度、荧光染色情况等),既可用于各类外源因子的检测、细胞形态学的检查,也可用于细胞数量、细胞活性等质量数据的分析,以联机方式实现细胞制备质量检测的数据共享,远程高效完成car-t细胞制备过程的质量监控。
上述car-t细胞制备方法中所有操作由car-t细胞制备设备的中央数据处理器精确控制,该设备的六个内部控制分系统协助完成,提升了制备的自动智能化的同时,大大降低了人工干预操作,实现细胞制备过程的自动标准化操作,消除了人工因素的干扰,能够提高car-t细胞终产品的质量,提高生产效率。
如上制备方法用于全封闭的car-t细胞制备设备,大大减少了培养瓶的使用数量,也降低了被微生物污染的风险。进一步的,上述制备方法具体应用于全封闭且全自动处理的car-t细胞制备设备,该具有全自动处理功能的car-t细胞制备设备将复杂的细胞制备实验室工作整合到一个平台中,采用六工位方式独立同时进行细胞制备培养,集合细胞分离,细胞分选,细胞诱导培养,细胞基因转导,细胞扩增培养,细胞质量检测,细胞洗涤收集包装等多功能于一体,所有操作全部由中央数据处理器精确控制,六个内部控制分系统协助完成,针对car-t细胞的体外大规模制备,共享某些重要功能部件如细胞质量检测功能部件、气体供应功能部件等,确保每一批细胞都是在同等标准条件下制备,相对于现有的细胞制备自动化设备而言,提升了数倍细胞制备效率,实现car-t细胞的体外大规模制备。
本说明书中各个实施例采用递进的方式描述,每个实施例重点说明的都是与其他实施例的不同之处,各个实施例之间相同相似部分互相参见即可。
对所公开的实施例的上述说明,使本领域专业技术人员能够实现或使用本发明。对这些实施例的多种修改对本领域的专业技术人员来说将是显而易见的,本文中所定义的一般原理可以在不脱离本发明的精神或范围的情况下,在其它实施例中实现。因此,本发明将不会被限制于本文所示的这些实施例,而是要符合与本文所公开的原理和新颖特点相一致的最宽的范围。
- 还没有人留言评论。精彩留言会获得点赞!