可分泌鼠抗A群轮状病毒单克隆抗体的杂交瘤细胞及其分泌的单克隆抗体的制作方法
本发明涉及鼠抗a群轮状病毒单克隆抗体、其用途以及分泌所述单克隆抗体的杂交瘤细胞。
背景技术:
a群轮状病毒(grouparotavirus,rv)是引发全球儿童严重腹泻的单一主因,并且可引发人类和动物急性胃肠道疾病。该病毒首先感染小肠上皮细胞,进而造成细胞毁伤,引发腹泻,情况严重时将会危及生命。全球几近每一个约5岁的孩子都曾感染过rv至少一次。与其他引发肠胃炎的病原体比拟,rv引发的如高烧、呕吐、伴随腹泻的呕吐等严重症状的频率更高。据调查表现,全世界每一年平均有60万儿童死于rv感染,占全球5岁以下儿童总死亡人数的5%,有超过85%的死亡是发生在非洲及亚洲等发展中国家。在美国,因得胃肠炎而住院的患病儿童中30%-70%是因为rv感染,而在我国,该病毒感染所致的急性胃肠炎占30%-40%,每一年因此死亡的5岁以下儿童约有3万。rv感染不但严重危及了婴幼儿的健康及生存质量,并且给家庭及社会带来庞大的经济负担,rv感染已成为一项亟待解决的重要公共卫生问题。截止到目前,市面上尚没有能够有效治疗rv感染的特效药,因此研究快速并准确的rv早期检测方法对于该病毒的防治具有深远的意义。
目前在轮状病毒的检测技术中,可靠性和实用性符合要求的依然是世界卫生组织who推荐的免疫学技术,如elisa双抗体夹心法。大部分免疫学技术的检测对象是病人粪便等标本中的rv抗原,依赖于rv抗原与单克隆抗体的结合。另外,样品中难以避免的血红蛋白、胆红素、乳糜等成分,往往也会干扰单克隆抗体与抗原的结合,从而对实验室或临床样品的检测造成不良的影响。因此,检测中使用的单克隆抗体的效价等特性,会对检测的特异性与灵敏度造成很大的影响。
基于单克隆抗体的检测试纸条对保存条件、操作条件要求较高。在实验室或临床实际操作中,特别是在实验/医疗条件较差的偏远地区等,保存条件以及操作人员的业务水平有时往往无法达到标准要求。例如,试剂可能会因停电或操作不当而被反复冻融,或冻存时间过长。在炎热的落后地区(如非洲),试剂可能会被误置于高温热加速的环境中。在这种情况下,常规试纸条往往会发生性状变化,导致检测结果不够稳定可靠,这也是人们长期以来期待解决的问题。
技术实现要素:
本发明制备的杂交瘤细胞能够分泌出高效价的鼠抗a群轮状病毒单克隆抗体。本发明的单克隆抗体应用于快速检验样品中rv的试纸条如胶体金平台时,特异性强、灵敏度高、稳定性好。
本发明采用经典的杂交瘤单克隆抗体技术。以rv抗原(杭州启泰生物技术有限公司)免疫2只balb/c小鼠,血清筛选后选取抗体效价较好的小鼠取脾用于细胞融合,融合后经有限稀释法克隆、筛选出2株能稳定分泌鼠抗a群轮状病毒单克隆抗体的杂交瘤细胞株,继而通过制备小鼠腹水,经纯化后得到鼠抗a群轮状病毒单克隆抗体,并制备成检测试剂盒检测临床样品。我们制备的可分泌鼠抗a群轮状病毒单克隆抗体的杂交瘤细胞株所分泌的单克隆抗体能与目的抗原发生高效价的特异性结合。在胶体金平台上使用双抗体夹心法快速定性检测粪便中rv时,特异性强、灵敏度高、稳定性好。
附图说明
图1展示了本发明的鼠抗a群轮状病毒单克隆抗体1和鼠抗a群轮状病毒单克隆抗体2与两种商业化的鼠抗a群轮状病毒单克隆抗体3和鼠抗a群轮状病毒单克隆抗体4的抗体效价检测的结果。以log(稀释度)作为横坐标,抗体od值作为纵坐标。
图2展示了使用本发明的鼠抗a群轮状病毒的单克隆抗体的胶体金检测试纸的示意图。1-pvc底板,2-样品垫,3-胶体金垫,4-包被膜,5-标记物包被区(t线),6-质控物包被区(c线),7-吸水垫。
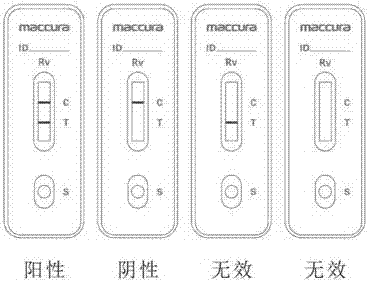
图3展示了本发明检测试纸条用于检测时的阳性、阴性、无效结果解释示意图。
实施方式
本文包括以下的实施例,用于以例证的方式更清楚、明确地阐述本发明的技术方案。本领域技术人员根据本文的公开应当理解,可以在所公开的特定的实施方式中进行许多改变但是仍然获得相似或类似的结果,而不偏离本发明的思想和范围。本发明的具体实施方式仅用于解释本发明,而非意图通过任何方式限制本发明。
实施例1
杂交瘤细胞株的制备与筛选
(1)rv抗原免疫小鼠
将rv抗原(购自杭州启泰生物技术有限公司)用生理盐水稀释至2.0mg/ml,与弗氏完全佐剂(购自sigma公司,货号slbf-9338v)等体积混合,用1ml注射器乳化为油状乳液,直至滴入水中的油状乳液不分散方可停止乳化。将该乳液以100μl/只的剂量四肢腋窝皮下施给balb/c小鼠(购自成都达硕实验动物中心,6周龄雌性,2只)。第一次免疫14天后增强免疫,取抗原与弗氏不完全佐剂(购自sigma公司,货号slbm9367v)等体积混合后乳化,免疫剂量为50μl/只。以后每隔一周增强免疫一次,每次免疫之前采尾血,分离血清,用间接elisa法测定效价。免疫5次后,2只小鼠血清效价均大于1:106,即可用于融合。融合前3天,取rv抗原用生理盐水稀释至2.0mg/ml,再与生理盐水等体积混合尾静脉追加免疫,剂量为50μl/只。
(2)杂交瘤细胞系的制备
①饲养细胞的制备
以正常的10周龄balb/c鼠腹腔巨噬细胞作饲养细胞。在融合前1天,balb/c取眼血拉颈处死,0.1%新洁尔灭浸泡1分钟,转入75%酒精浸泡1分钟。超净台内无菌操作下用剪刀剪开腹部皮肤,暴露腹膜,用注射器腹腔注入rpmi1640基础培养液3ml,后以滴管取出,再加入rpmi1640基础培养液7ml反复冲洗。回收冲洗液,1000rpm离心5分钟留沉淀,用已加入20%新生牛血清的rpmi1640培养液重悬,调整细胞浓度为3-5×105个/ml,加入96孔板,100μl/孔,37℃、5%co2培养。
②免疫脾细胞的制备
小鼠追加免疫三天后,在无菌条件下取出脾脏,置于平皿中,rpmi1640基础培养液冲洗一次,剪碎、研磨、过滤后得到分散的脾细胞,1000rpm离心5分钟留沉淀,rpmi1640基础培养液重悬,3%乙酸稀释计数。
③骨髓瘤细胞的制备
小鼠骨髓瘤细胞sp2/0(购自中国科学院细胞库)经8-氮鸟嘌呤筛选后,培养至对数生长期,取6大瓶(75cm2)制成细胞悬液,1000rpm离心5分钟留沉淀,用rpmi1640基础培养液重悬、计数,按0.5-2×105个/ml的细胞浓度进行分瓶培养(一般情况每1-2天更换一次15-30ml完全1640培养基)。
④细胞融合及hat选择培养杂交瘤
将骨髓瘤细胞与免疫脾细胞按1:8的比例混合,在50ml锥形离心管内用rpmi1640基础培养液洗1次,1000rpm离心5分钟留沉淀。将细胞混匀,缓慢加入1.2ml50%的peg4000融合,融合1分钟后加入30ml的rpmi1640基础培养液终止细胞融合。700rpm/min离心5分钟后重悬于含有1%hat与20%新生牛血清的1640培养基中,平均滴入30套96孔细胞培养板。37℃,5%co2培养,次日补加含有1%hat与20%新生牛血清的1640培养基至孔满。5天后半换培养基,7天后再次半换培养基。
⑤阳性细胞株的筛选
用0.06mph9.6碳酸缓冲溶液稀释rv抗原(杭州启泰生物技术有限公司)至5μg/ml,96孔酶标板中每孔包被100μl,用于检测细胞培养上清。放置于冰箱中2-8℃过夜,第二天抛弃孔中液体,elisa洗液洗板三次,拍干,用含10%小牛血清的0.01mph7.2的pbs150μl/孔,37℃封闭2小时,拍干,真空封装待用。脾细胞融合后第九天,取细胞上清100μl于上述96孔检测板中,37℃孵育40分钟,elisa洗板机洗五次后加入5000倍稀释的辣根过氧化酶标记的羊抗鼠igg(北京中杉金桥生物技术有限公司)100μl,37℃孵育30分钟同上洗板后,每孔加入100μl显色液(含0.1%(m/v)邻苯二胺,0.1%(v/v)双氧水,ph5.0柠檬酸磷酸缓冲液),37℃孵育10分钟,每孔加入50μl2m硫酸溶液终止反应,测450nm吸收值。以融合时小鼠血清稀释至100倍为阳性对照,rpmi1640完全培养液作为阴性对照,阴性对照od值<0.2,阳性对照od值>1.8为检测系统有效,样品od值≥2×阴性对照od值时,为阳性,反之为阴性。分泌抗体阳性细胞孔以1个细胞/孔在96孔培养板上用有限稀释法克隆,筛选阳性孔依上法连续克隆四次,使其达到100%单克隆,转入24孔继续培养,待细胞长满80%时转入细胞瓶扩大培养,待细胞长满细胞瓶80%时分瓶传代,传代的细胞生长至对数期时,用适量无血清rpmi-1640培养基分散细胞瓶内细胞,收集细胞悬液于锥形离心管中,记录细胞悬液体积v,取适量细胞悬液进行细胞计数,得到细胞悬液密度(个/ml),其余1000rpm离心5min后弃上清液,根据细胞密度和离心前体积算出沉淀的细胞数,向细胞沉淀中加入适量冻存液调整细胞密度至4-8×106个/ml,然后分装于无菌冻存管中,每只冻存管加细胞液0.5ml。细胞融合共获得2株能稳定分泌鼠抗a群轮状病毒单克隆抗体的杂交瘤细胞株rvab-1与杂交瘤细胞株rvab-2,且分别分泌的抗体以双抗体夹心法检测rv抗原可配对,并于2017年3月30日保藏在中国典型培养物保藏中心(中国,武汉,武汉大学),保藏号分别为cctccno:c201743、cctccno:c201744。
实施例2
单克隆抗体的制备
选取6-8周健康的balb/c小鼠,每只小鼠腹腔注射0.5ml液体石蜡(天津科密欧化学试剂有限公司),7天后每只小鼠腹腔注射0.5~1×106个杂交瘤细胞株rvab-1或杂交瘤细胞株rvab-2。接种细胞7-10天后产生腹水,密切观察小鼠的健康状况与腹水征象,待腹水尽可能多,而小鼠濒死之前,处死小鼠,用滴管将腹水吸入试管中,两株细胞分别收集8ml与10ml腹水。收集的腹水4000rpm离心10min后取上清,分别取小样放于-20℃冰箱保存。腹水用硫酸氨饱和沉淀后,再用蛋白a亲合层析柱纯化,sds-page检测得到的两株单克隆抗体纯度均大于90%。
实施例3
效价检测
(1)杂交瘤细胞培养上清效价检测
用0.06mph9.6碳酸缓冲溶液稀释rv抗原(杭州启泰生物技术有限公司)至5μg/ml,96孔酶标板中每孔包被100μl。放置于冰箱中2-8℃过夜,第二天抛弃孔中液体,elisa洗板机洗三次,拍干,用含10%小牛血清的0.01mph7.2的pbs,150μl/孔,37℃封闭2小时弃液体,拍干,用于检测杂交瘤细胞培养上清效价、腹水效价、纯化后的抗体效价。杂交瘤细胞培养上清效价检测第一孔为原倍上清培养液,从第二孔至第四孔以0.01mph7.2的pbs缓冲液10倍逐级稀释,第五孔至第十孔以2倍逐级稀释。第十一孔以融合时小鼠血清稀释至100倍作阳性对照,第十二孔以rpmi1640完全培养液作阴性对照,每孔样品体积为100μl。37℃孵育40分钟,elisa洗板机洗五次后加入5000倍稀释的辣根过氧化酶标记的羊抗鼠igg(北京中杉金桥生物技术有限公司)100μl,37℃孵育30分钟同上洗后,每孔加入100μl含0.1%(m/v)邻苯二胺,0.1%(v/v)双氧水,ph5.0柠檬酸磷酸缓冲液,37℃孵育10分钟,每孔加入50μl2m硫酸溶液终止反应,测450nm吸收值。阴性对照od值<0.2,阳性对照od值>1.8为检测系统有效,当od值≥2×阴性对照od值时,为阳性,反之为阴性。检测值最低阳性孔所对应的稀释比例即为杂交瘤细胞培养上清效价,杂交瘤细胞株rvab-1培养上清效价大于1:1024,杂交瘤细胞株rvab-2培养上清效价大于1:512。
(2)腹水效价检测
elisa检测方法同上文第(1)部分中所述。稀释方法不同,具体为:第一孔为原倍腹水,以0.01mph7.2的pbs缓冲液从第二孔至第七孔10倍逐级稀释,从第八孔至第十一孔以2倍逐级稀释。检测值最低阳性孔所对应的稀释比例即为腹水效价,杂交瘤细胞株rvab-1与杂交瘤细胞株rvab-2所制备的腹水效价均大于1:5×105。
(3)抗体效价检测
先将本发明的两株鼠抗a群轮状病毒单克隆抗体(四川迈克生物新材料技术有限公司)以0.01mph7.2的pbs缓冲液统一稀释为1mg/ml,后再稀释100倍作为初始第一孔,从第二孔开始至第十一孔作3倍逐级稀释,每孔加样体积为100μl。37℃孵育50分钟,elisa洗板机洗五次后加入12000倍稀释的辣根过氧化酶标记的羊抗鼠igg(四川迈克生物新材料技术有限公司)100μl,37℃孵育1h同上洗后,每孔加入100μl含0.1%(m/v)邻苯二胺,0.1%(v/v)双氧水,ph5.0柠檬酸磷酸缓冲液,37℃孵育15分钟,每孔加入50μl2m硫酸溶液终止反应,检测450nm吸收值。阴性对照od值<0.2,阳性对照od值>1.8为检测系统有效。抗体效价判定标准:以log(稀释度)为横坐标,以抗体od值为纵坐标作曲线,曲线方程为y=min+(max-min)/(1+10^((logec50-x)×hillslope)),通过sigmaplot数据处理软件拟合曲线,取中值效价=10logec50。结果显示本发明的两株鼠抗a群轮状病毒单克隆抗体的中值效价均大于6×104。以同样方法对照检测已商业化的杭州启泰生物技术有限公司的可双抗体夹心法检测rv抗原的配对鼠抗a群轮状病毒单克隆抗体,通过拟合,中值效价为6-8×103,均显著均低于本发明杂交瘤细胞获得的两株配对抗体。表1与图1列出了效价测定结果。
表1抗体效价检测
实施例4
检测试纸条的制备及使用
(1)检测试纸条的制备
本发明的杂交瘤细胞株rvab-1与杂交瘤细胞株rvab-2分别分泌的鼠抗a群轮状病毒单克隆抗体1与鼠抗a群轮状病毒单克隆抗体2能应于胶体金平台快速定性检测粪便中的rv。该检测试纸条由包含在pvc底板上顺次固定且端部互相连接的样品垫、胶体金垫、包被膜、吸水垫组成,所述胶体金垫包被有鼠抗a群轮状病毒抗原单克隆抗体2的胶体金复合物,所述包被膜上沿着从样品垫到吸水垫的方向在膜本体上顺次分布有互相间隔开的包被有鼠抗a群轮状病毒抗原单克隆抗体1的标记物包被区(t线),以及质控物包被区(c线)。标记浓度、包被浓度、划膜间距优选方案见下表2、3、4。本发明的试纸条中,质控包被物选自抗鼠igg、抗兔igg、兔igg、生物素、亲和素、或结合有生物素或亲和素的蛋白等,优选抗鼠igg。图2为该试纸条的示意图,1-底板,2-样品垫,3-胶体金垫,4-包被膜,包被有鼠抗a群轮状病毒抗原单克隆抗体2(rvab-2分泌)的胶体金复合物,5-标记物包被区(t线),包被有鼠抗a群轮状病毒抗原单克隆抗体1(rvab-1分泌),6-质控物包被区(c线),7-吸水垫。图3为本发明的阴性、阳性、无效结果解释示意图。
表2标记浓度
表3包被浓度
表4划膜间距
替代方案:抗鼠igg可被抗兔igg、兔igg、生物素、亲和素以及结合有生物素或亲和素的蛋白替代。
(2)检测本发明检测试纸条的抗干扰能力
将阴性与阳性参考品中分别加入血红蛋白、胆红素、乳糜,然后按上述方案制备本发明的检测试纸条并检验以上经处理的参考品,各重复10次检测,其结果显色一致。结果表明血红蛋白、胆红素、乳糜对本发明的检测试纸条无影响。以同样条件利用杭州启泰生物技术有限公司的可双抗体夹心法检测rv抗原的鼠抗a群轮状病毒配对抗体制备检测试纸条,其检测结果判定正确,但存在显色不一致的现象,表明血红蛋白、胆红素、乳糜对杭州启泰生物技术有限公司的可双抗体夹心法检测rv抗原的鼠抗a群轮状病毒配对抗体制备的试纸条有一定影响,在下表5中列出了检测结果。
表5抗干扰能力检测
(3)灵敏度检测
采用上述方案制备的检测试纸条分别检验100例阳性样品与100例阴性样品。表6列出了本发明的单克隆抗体制备的检测试纸条与商业化试纸条(北京万泰生物药业股份有限公司)的比较实验,检验结果表明本发明的鼠抗a群轮状病毒单克隆抗体1与鼠抗a群轮状病毒单克隆抗体2制备的检测试纸条其灵敏度及特异性均高于商业化试纸条,在表6中列出了检测结果。
表6阳性与阴性样品检验
(4)稳定性检测
将本发明的鼠抗a群轮状病毒单克隆抗体1与鼠抗a群轮状病毒单克隆抗体2在以下条件下处理:a-20℃反复冻融3次;b-20℃反复冻融4次;c-20℃反复冻融5次;d-20℃保存12个月;e37℃热加速7天;f37℃热加速20天,其他条件不变,按上述方法制备成检测试纸条分别检验10份阳性参考品与10份阴性参考品,符合率均为100%。表明本发明的两株抗体稳定性良好,且利用本发明抗体制备的检测试纸条稳定性、精密性良好。在同样条件下处理商业化的b厂家(杭州启泰生物技术有限公司)的可双抗体夹心法检测rv抗原的抗a群轮状病毒配对抗体,并制备检测试纸条,分别检测此10份阳性参考品与10份阴性参考品。结果显示其反复冻融4至5次或-20℃保存12个月或热加速7天后已部分开始降解,检验结果与参考品不完全符合。在表7中列出了检测结果。
表7稳定性检验
由此可见,本发明制得的单克隆抗体在多变、严苛的条件下仍然保持了很高的稳定性。这一特性保证了制成用于检测样品中的rv的检测试纸条时,制得的检测试纸条可以适用于多种实验室和临床条件,并且在低温保存、反复冻融、热加速之后仍然保持其稳定的可靠性。
- 还没有人留言评论。精彩留言会获得点赞!